Prosiding Kimia FMIPA
SK-091304
Sintesis Dan Karakterisasi Oksida Perovskit La1-xSrxCo1-yFeyO3-δ (0,0≤x,y≤0,5) Dengan Metode Solid-State
Ninik Maulidah*, Hamzah Fansuri, M.Si., Ph.D 1)
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Abstrak
Oksida-oksida perovskit (ABO3) telah lama dikenal sebagai bahan yang dapat disubstitusi isomorfis pada unsur
A-nya maupun pada unsur B-A-nya. Mobilitas oksigen kisi pada oksida perovskit bergantung pada struktur kisiA-nya yang dapat dimodifikasi dengan melakukan substitusi isomorfis, baik pada posisi kisi yang ditempati oleh ion A-nya maupun B-nya dengan ion-ion sejenis.Pada penelitian ini ion La3+ pada oksida perovskit akan disubstitusi dengan Sr2+ dan ion Co3+ akan disubstitusi dengan Fe3+ sehingga dihasilkan oksida perovskit dengan komposisi La1-xSrxCo1-yFeyO3-δ, dimana x,y =
0,0≤x,y≤0,5. Oksida perovskit La1-xSrxCo1-yFeyO3- δ disintesis dengan metode solid-state menggunakan metanol sebagai zat
pendispersi. Substitusi Sr2+ dan Fe3+ akan mempengaruhi intensitas puncak perovskit pada difraktogram.
Kata Kunci : perovskit, solid-state, La1-xSrxCo1-yFeyO3- δ
Abstract
Perovskite oxides (ABO3) have been known as material which may be isomorphically substituted for either the A
element or the B element. Oxygent Mobility of perovskite oxides depend on its lattice structure which may be modified by isomorphic substitution on either the A ions or B ions position with ions of a kind. In this research La3+ and Co3+ on perovskite oxide substituted by Sr2+ and Fe3+ with result La1-xSrxCo1-yFeyO3- δ, which x,y = 0,0≤x,y≤0,5. Perovskite oxides
LaCo1-xCuxO3- δ could be synthesized by Solid-state method with methanol as Dispersing agent. Sr
2+
and Fe3+ substitution influence on peak intensity XRD pattern of perovskite.
Keyword: Perovskite, Sol-Gel, La1-xSrxCo1-yFeyO3
1. Pendahuluan
Oksida perovskit (ABO3) merupakan suatu
bentuk campuran oksida logam, dimana A adalah kation yang berukuran lebih besar daripada B. Ion A umumnya adalah kation dari logam alkali, logam alkali tanah atau logam tanah jarang, B adalah kation yang lebih kecil dan umumnya adalah kation dari logam transisi (Waterrud, 2005). Total muatan ion dari kedua logam tersebut haruslah 6 agar terjadi keseimbangan muatan dengan muatan negatif 6 yang dibawa oleh tiga ion oksigen.
Oksida logam dengan struktur perovskit ini, banyak digunakan sebagai katalis untuk mengoksidasi hidrokarbon secara sempurna. Salah satu contohnya adalah perovskit La1-xSrxMO3
(M=Mn, Ni) yang dapat digunakan sebagai katalis pada reaksi oksidasi parsial metana menjadi syngas (Wei dkk., 2008). Contoh lain adalah oksida perovskit LaCo1-xCuxO3-δ yang digunakan pada
reaksi oksidasi gas alam menjadi alkohol yang beratom karbon rendah (Tien-Thao dkk., 2007).
Oksida perovskit berbasis LaCoO3
terbukti mempunyai sifat reduksi dan oksidasi yang baik serta, memiliki aktivitas dan selektivitas yang baik jika diaplikasikan menjadi katalis, serta dapat menghantarkan ion oksigen dengan fluks oksigen yang tinggi (Yang dkk., 2005; Wang dkk., 2003)
sehingga bisa diaplikasikan dalam membran Penghantar Ion Oksigen. Selain itu oksida perovskit dapat mempertahankan strukturnya karena setelah mengalami reduksi dapat direoksidasi.
Oksida-oksida perovskit juga dapat menyerahkan ion-ion oksigen yang menyusun strukturnya (oksigen kisi) tanpa mengalami perubahan struktur yang berarti. Penyerahan ion-ion oksigen ini menyebabkan kekosongan oksigen sehingga terjadi ketidakseimbangan muatan (muatan oksida perovskit menjadi lebih positif). Namun, keberadaan kation-kation B, yang memiliki kemampuan untuk berada pada keadaan oksidasi yang berbeda, dapat menyeimbangkan muatan tersebut dengan cara menurunkan bilangan oksidasinya walaupun pada akhirnya kekosongan ion oksigen tersebut harus diisi kembali melalui reaksi oksidasi. Karena sifat tersebut maka oksida perovskit dapat mempertahankan strukturnya sehingga pelepasan oksigen dari kerangka struktur oksida perovskit bersifat reversible. Dengan sifat seperti itu, oksida perovskit dapat berperan sebagai oksidator sekaligus juga sebagai reduktor.
Kemampuan oksida perovskit untuk melepaskan oksigen kisinya secara reversible merupakan salah satu alasan bagi penggunaan oksida perovskit sebagai membran penghantar ion oksigen. Penghantaran oksigen terjadi melalui reaksi oksidasi- reduksi internal di dalam struktur oksida perovskit yang efeknya terlihat sebagai Prosiding Skripsi Semester Gasal 2010/2011
* Corresponding author Phone : +628563364399, e-mail:niek06@chem.its.ac.id
1 Alamat sekarang : Jurusan Kimia, Fakultas MIPA,
Institut Teknologi Sepuluh Nopember, Surabaya. e-mail: h.fansuri@chem.its.ac.id
Prosiding Kimia FMIPA
difusi ion oksigen di dalam kisi. Karena sumber oksigen adalah dari kisi, maka hantaran ion oksigen tersebut sangat selektif sehingga tidak ada peluang bagi gas atau molekul lain yang dapat melalui membran oksida perovskit ini. Oleh karena itu, membran oksida perovskit ini digunakan secara luas dalam proses-proses produksi gas oksigen.
Membran penghantar ion oksigen haruslah berupa bahan yang rapat (dense) sehingga tidak ada peluang bagi perpindahan massa melalui celah-celah pori dan retakan pada bahan membran. Keretakkan sekecil apapun tidak diperkenankan terjadi pada membran penghantar ion oksigen karena hal ini dapat menyebabkan perpindahan massa yang tidak melalui reaksi oksdasi-reduksi internal. Perpindahan seperti ini menyebabkan penurunan selektivitas perpindahan ion oksigen.
Oksida perovskit LaCoO3 yang digunakan
sebagai membran penghantar ion oksigen harus berupa bahan yang rapat, tidak berpori dan tidak ada celah bagi terjadinya difusi gas melalui retakan- retakan pada membrannya. Namun berbagai penelitian melaporkan bahwa membran penghantar ion oksigen berbahan oksida perovskit mudah pecah atau retak jika terpapar oleh perubahan suhu dan tekanan yang mendadak (Tong dkk., 2002; Wang dkk., 2003; Hamakawa dkk., 2005).
Selain mudah pecah, fluks oksigen pada membran oksida perovskit masih relatif rendah. Oleh karena itu, penggunaan membran penghantar ion oksigen masih terbatas pada proses pemurnian gas hidrogen. Jika fluks oksigen dapat ditingkatkan maka oksida perovskit akan memiliki potensi yang sangat besar untuk digunakan sebagai katalis pada proses-proses konversi hidrokarbon yang memerlukan kontrol oksigen yang ketat. Contoh dari reaksi tersebut adalah konversi gas metana menjadi syn gas ataupun metanol. Pada reaksi tersebut, konsentrasi oksigen yang terlibat dalam reaksi harus dikontrol dengan ketat. Oleh karena itu membran penghantar ion oksigen masih sangat jarang digunakan sebagai katalis membran dalam proses konversi bahan kimia yang memerlukan kontrol oksigen yang ketat seperti konversi gas alam menjadi metanol.
Untuk mengatasi beberapa masalah di atas maka perlu dilakukan upaya-upaya untuk meningkatkan fluks oksigen sekaligus kekuatan mekanik dari bahan membran. Fluks oksigen sangat dipengaruhi oleh mobilitas oksigen kisi. Sebagaimana telah disebutkan sebelumnya, mobilitas oksigen kisi tersebut dapat berubah jika ion A atau ion B disubstitusi dengan ion lain yang sejenis. Substitusi terhadap ion A menggunakan ion sejenis yang berukuran lebih besar dapat melemahkan kuat ion logam dengan oksigen sehingga oksigen tersebut lebih mudah terlepas dari ikatan. Substitusi terhadap ion B dengan ion logam transisi yang berukuran lebih kecil juga dapat meningkatkan aktivitas oksidatif oksida perovskit. Oksigen- oksigen kisi pada oksida perovskit menjadi lebih mudah bergerak dan digunakan untuk reaksi . Hal ini menyebabkan oksida perovskit mudah direduksi dan dioksidasi kembali.
Metode solid-state dapat digunakan dalam substitusi stoikiometri logam Sr2+ dan Fe3+ terhadap oksida LaCoO3. Metode solid-state
dilakukan dengan teknik penggerusan yang menggunakan metanol sebagai zat pendispersinya. Pada metode solid-state ini, oksida perovskit La 1-xSrxCo1-yFeyO3- disiapkan dari oksida logam
penyusunnya. Menurut hipotesis, metode solid-state akan menghasilkan produk yang lebih banyak dan paling mendekati komposisi yang diinginkan. Komposisi material yang dicampurkan pada awal sintesis akan sama dengan komposisi perovskit yang terbentuk, karena pada dasarnya tidak ada sejumlah komposisi dari material pembentuk perovskit yang hilang ataupun berkurang dalam proses sintesisnya yang disebabkan oleh beberapa hal seperti penguapan atau belum terendapkan.
2. Metode Penelitian 2.1 Peralatan dan Bahan 2.1.1 Peralatan
Alat yang digunakan dalam penelitian ini adalah alat-alat gelas seperti gelas beaker, Erlenmeyer dan sebagainya, alat-alat porselen untuk proses pemanasan, furnace, mortar dan alu batu agat,oven dan neraca analitik.
2.1.2 Bahan
Bahan yang digunakan dalam penelitian ini adalah Oksida Lantanum(III) (La2O3) p.a 99,5%
(Merck), Oksida Kobalt (Co3O4) p.a 99,5%
(Aldrich), Oksida Stronsium (SrO) p.a 99,0% (Merck), Oksida Besi (Fe2O3) p.a 97% (Merck)
dan Metanol p.a 99,8% (Mallinckrodt Chemicals).
2.2 Prosedur Kerja
Penelitian ini dilakukan dalam dua tahapan, yaitu síntesis oksida perovskit dan pengujian sifat hantaran oksigen serta muai panasnya. Tahapan síntesis meliputi proses síntesis beserta karakterisasinya.
2.2.1 Sintesis Oksida Perovskit La1-xSrxCo 1-yFeyO3-δ dan Karakterisasinya
Target síntesis oksida perovskit adalah La 1-xSrxCo1-yFeyO3-δ dengan nilai x dan y antara 0,0
sampai 0,5 dengan interval 0,1. Oksida perovskit tersebut dibuat dengan metode solid state. Metode solid-state dilakukan dengan teknik penggerusan yang menggunakan metanol sebagai zat pendispersinya. Pada metode solid-state ini, oksida perovskit La1-xSrxCo1-yFeyO3-δ disiapkan dari
oksida logam penyusunnya, yakni Oksida Lantanum (III) (La2O3) yang berupa bubuk halus
berwarna putih, Oksida Stronsium (SrO) yang berupa serbuk berwarna putih, Oksida Kobalt (Co3O4) berupa bubuk hitam dan Oksida Besi
(Fe2O3) yang berupa serbuk berwarna merah bata.
Oksida stronsium disiapkan dari bahan stronsium nitrat anhidrat Sr(NO3)2 yang dibakar
pada suhu 200 oC selama 1 jam, kemudian dipanaskan dalam furnace vakum pada suhu 400 oC selama 1 jam. Stronsium nitrat yang semula berupa butiran kristal halus berwarna putih yang ditunjukkan pada Gambar 2.1 (a), setelah dipanaskan tidak berubah bentuk dan warnanya, hal ini ditunjukkan pada Gambar 2.1 (b). Suhu 400
Prosiding Kimia FMIPA
o
C diperoleh dari data dekomposisi garam-garam nitrat menjadi oksida, dimana pada suhu 400 oC garam-garam nitrat sudah terdekomposisi menjadi oksida. Misalnya kalium nitrat (KNO3) yang
terdekomposisi pada suhu 400 oC.
a
b
Gambar 2.1 (a) Stronsium Nitrat Anhidrat (Sr(NO3)2, (b) Oksida Stronsium SrO.
Sintesis kerangka oksida perovskit LaCoO3
diawali dengan mempersiapkan La2O3 dan Co3O4
sesuai hasil perhitungan stoikiometri dari komposisi yang diharapkan. Selanjutnya bahan-bahan tersebut di campur dan digerus dengan mortar dan alu batu agat dimana sebelumnya telah ditambahkan beberapa tetes metanol 75 tetes ke dalam campuran. Metanol ini berfungsi sebagai zat pendispersi agar semua bahan mudah tercampur, karena reaksi padat–padat ini umumnya akan berjalan lebih lambat jika dibandingkan dengan reaksi fasa cair. Metanol disini dipilih sebagai zat pendispersi karena metanol merupakan bahan organik yang bersifat volatil dan polar sehigga metanol tidak akan merubah struktur perovskit tersebut, jadi dengan penambahan metanol nantinya akan memudahkan untuk pemurnian produk yang hendak disintesis.
Oksida perovskit LaCoO3 yang tersubstitutsi
oleh Sr2+ dan Fe3+ disiapkan dengan cara yang sama dengan LaCoO3. Selain La2O3 dan Co3O4
juga ditambahkan SrO dan Fe2O3 dengan jumlah
tertentu sesuai dengan komposisi yang dikehendaki.
Campuran tersebut digerus terus menerus kurang lebih selama 1-2 jam dan hasilnya ditunjukkan pada Gambar 2.2, lalu diangin- anginkan agar metanol yang ditambahkan sebelumnya menguap, baru setelah itu dilakukan kalsinasi. Setelah itu campuran dikeluarkan dari furnace, didinginkan kemudian digerus ulang menggunakan mortar dan alu batu agat. Kemudian campuran tersebut dimasukkan kembali ke dalam furnace untuk melanjutkan kalsinasi.
Gambar 2.2 Campuran La2O3, SrO, Co3O4, Fe2O3
dan metanol yang terbentuk setelah digerus selama 2 jam.
Karakterisasi dilakukan baik terhadap prekursor maupun terhadap oksida perovskit yang dihasilkan. Karakterisasi yang dilakukan meliputi karakterisasi termal menggunakan metode analisis DTA/TGA. Karakterisasi utama yang dilakukan pada padatan hasil sintesis adalah karakterisasi strukturnya. Karakterisasi ini dilakukan dengan metode difraksi sinar-X menggunakan
difraktometer Philipps X’pert PN-1830 X-ray. Difraksi dilakukan pada sudut 2θ antara 20 o
dan 60o agar diperoleh jumlah puncak yang memadai bagi analisis fasa kristalin yang ada. Analisis fasa dilakukan dengan bantuan software Phillips X’pert Graphics & Identity menggunakan database JCPDS PDF no. 25-1060 tahun 2002. Sementara itu komposisi oksida perovskit yang terbentuk dianalisis menggunakan spektrometer pendarfluor sinar-X (X-Ray fluoroscence /XRF) untuk mengetahui komposisi unsur-unsur kimia dari oksida perovskit.
2.2.2 Analisis DTA/TGA
Analisis DTA/TGA dilakukan untuk menentukan suhu, waktu dan metode kalsinasi dalam mengubah prekursor menjadi oksida perovskit. Prekursor yang digunakan berbentuk serbuk. Analisis dilakukan di Balai Besar Keramik Bandung, menggunakan instrumen Setaram Setsys-1750. Analisis DTA/TGA dilakukan dengan kenaikan suhu 10 o/menit dalam atmosfir udara dan rentang suhu mulai dari suhu kamar hingga 1000
o
C.
2.2.3 Penentuan Fasa Oksida Perovskit Menggunakan XRD
Analisis menggunakan difraksi sinar-X dilakukan untuk menentukan fasa oksida perovskit yang terbentuk dari proses sintesis. analisis XRD dilakukan di Riset Center ITS menggunakan difraktometer Philipps X’pert PN-1830 X-ray. Analisis dilakukan pada sudut 2θ antara 20 o dan 60o. Sumber sinar-X yang digunakan adalah Cu
dengan radiasi Kα1 yang dihasilkan dari sumber Cu
dengan panjang gelombang (λ) 1,54056 Å. Prekursor yang digunakan berbentuk serbuk halus. Serbuk ditempatkan di dalam sampel holder berbentuk bulat dengan volume 20mm3. Ukuran partikel sangat mempengaruhi kualitas hasil analisa difraksi sinar-X, Sebaiknya sampel dihaluskan terlebih dahulu sebelum dimasukkan ke dalam sampel holder.
2.2.4 Komposisi Oksida Perovskit
Analisis X-Ray fluoroscence (XRF) dilakukan untuk mengetahui komposisi unsur-unsur kimia dari oksida perovskit. instrument XRF yang digunakan adalah XRF merk PANalytical tipe Minipal 4, PW4030/45b. Analisa XRF dilakukan di laboratorium Studi Energi dan Rekayasa LPPM ITS Surabaya. Cuplikan yang digunakan untuk analisa berupa serbuk setelah dikalsinasi.
3.Hasil dan Diskusi
Penelitian ini dilakukan untuk mengetahui sejauh mana substitusi oleh Sr2+ dan Fe3+ dapat dilakukan tanpa menyebabkan terbentuknya fasa- fasa non perovskit pada sintesis oksida perovskit LaCoO3 (La1-xSrxCo1-yFeyO3-). Nilai x dan y
berkisar antara 0,0 sampai 0,5 dengan interval 0,1. Selain itu, penelitian ini juga bertujuan untuk mendapatkan informasi mengenai bagaimana substitusi tersebut dapat mempengaruhi sifat hantaran oksigen (fluks oksigen) serta kekuatan mekaniknya, yang diukur sesuai sifat muai panasnya. Untuk menjawab permasalahan yang
Prosiding Kimia FMIPA
ada dan mencapai tujuan tersebut maka dilakukan pembuatan oksida perovskit La1-xSrxCo1-yFeyO
3-dengan metode solid-state.
Metode solid-state telah banyak dilakukan oleh -peneliti sebelumnya. Diantaranya Mundscau (2008) yang mensintesis La0,5Sr0,5CoO3 serta Tien
Thao dkk. (2007) dan Royer dkk. (2005) yang membuat katalis perovskit LaCo1-xCuxO3- untuk
mensintesis alkohol tingkat tinggi (higher alcohols). Begitu juga yang dilakukan oleh Juste dkk. (2008) yang meneliti tentang permeasi oksigen dan ekspansi secara kimia pada membran perovskit La(1-x)SrxFe(1-y)GayO3-.
Metode solid-state akan menghasilkan produk yang lebih banyak dan paling mendekati komposisi yang diinginkan. Komposisi material yang dicampurkan pada awal sintesis akan sama dengan komposisi perovskit yang terbentuk, karena pada dasarnya tidak ada sejumlah komposisi dari material pembentuk perovskit yang hilang ataupun berkurang dalam proses sintesisnya yang disebabkan oleh beberapa hal seperti penguapan atau belum terendapkan.
Bab ini membahas hasil-hasil penelitian yang telah dilakukan. pembahasannya diuraikan secara kronologis, sesuai dengan urut-urutan pelaksanaan penelitian. Bagian pertama dimulai dengan uraian mengenai proses pembuatan oksida perovskit diikuti dengan karakterisasi hasil- hasilnya.
3.1 Sintesis Oksida Perovskit La1-xSrxCo 1-yFeyO
3-Penelitian ini dimulai dengan preparasi oksida perovskit La1-xSrxCo1-yFeyO3- dari bahan- bahan
murni. Bubuk perovskit yang dihasilkan dari hasil preparasi dikarakterisasi dengan XRD dan dianalisa juga dengan DTA/TGA, analisis ini sangat penting untuk mengetahui suhu kalsinasi (Kasmayadi, 2007). Selain itu, untuk mendukung analisa XRD dilakukan juga analisa XRF.
Sintesis oksida perovskit La1-xSrxCo1-yFeyO
3-ini dilakukan dengan metode solid-state. Penghomogenan campuran yang merupakan langkah paling menetukan dalam metode solid-state dilakukan dengan penggerusan yang menggunakan metanol sebagai zat pendispersinya. Pada metode solid-state ini, oksida perovskit La 1-xSrxCo1-yFeyO3- disiapkan dari oksida logam
diantaranya Oksida Lantanum (III) (La2O3) yang
berupa bubuk halus berwarna putih, Oksida Stronsium (SrO) yang berupa serbuk berwarna putih, Oksida Kobalt (Co3O4) berupa bubuk hitam
dan Oksida Besi (Fe2O3) yang berupa serbuk
berwarna merah bata.
Oksida stronsium disiapkan dari bahan stronsium nitrat anhidrat Sr(NO3)2 yang dibakar
pada suhu 200 oC selama 1 jam, kemudian dipanaskan dalam furnace vakum pada suhu 400 oC selama 1 jam. Stronsium nitrat yang semula berupa butiran kristal halus berwarna putih, setelah dipanaskan tidak berubah bentuk dan warnanya. Suhu 400 oC diperoleh dari data dekomposisi garam-garam nitrat menjadi oksida, dimana pada suhu 400 oC garam-garam nitrat sudah terdekomposisi menjadi oksida. Misalnya kalium
nitrat (KNO3) yang terdekomposisi pada suhu 400 o
C.
Setiap komposisi oksida logam yang hendak diperoleh, dibuat sebanyak 10 gram. Hal ini didapatkan dengan mencampurkan oksida-oksida logam prekursornya secara stoikiometris yang kemudian dihaluskan dengan ball-milling dengan kecepatan 400 rpm selama 4 jam, sesuai dengan metode yang dilaporkan oleh Mundscau dkk (2008). Proses ball miling dilakukan dengan menggunakan metanol sebagai zat pendispersi.
Campuran oksida prekursor pasca ball milling selanjutnya diangin- anginkan. Selanjutnya padatan kering yang dihasilkan dianalisis dengan DTA/TGA untuk menentukan suhu, waktu dan metode kalsinasi yang tepat agar dihasilkan oksida perovskit dengan kesempurnaan reaksi yang tinggi. Analisis DTA/TGA adalah salah satu cara yang dapat digunakan untuk mendapatkan suhu kalsinasi yang tepat. DTA akan mendeteksi setiap perubahan termal yang terkait dengan peristiwa atau reaksi kimia, baik yang berjalan secara eksotermik maupun endotermik. Sementara itu, TGA mendeteksi setiap perubahan massa yang terjadi pada cuplikan sebagai akibat dari kenaikan suhu, baik yang diikuti oleh perubahan fasa Kristal maupun tidak.
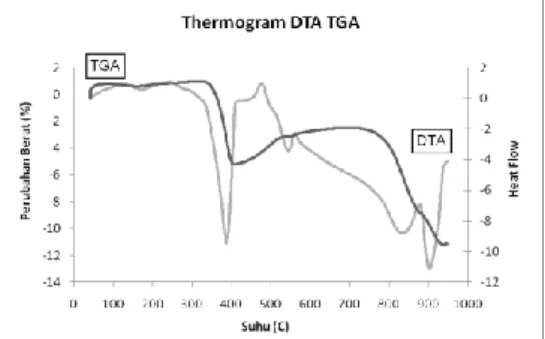
Analisa DTA/TGA pada penelitian ini dilakukan dalam atmosfir udara dengan laju kenaikan suhu 10 oC.men-1 dengan rentang suhu pengukuran 0 sampai 1000oC. Hasil pengukuran ditunjukkan oleh Gambar 3.1
Gambar 3.1 Termogram DTA dan TGA cuplikan prekursor LaCoO3
Termogram DTA-TGA pada Gambar 4.2 menunjukkan adanya lembah-lembah endotermis pada suhu sekitar 371oC, 540°C, 830°C dan 900°C serta puncak eksotermis pada 480˚C, 545°C dan 880°C. Lembah endotermis pada 371˚C yang diikuti dengan penurunan berat, Δw1 sebesar 6%
diperkirakan sebagai proses terdekomposisinya LaFeO(OH)4. Reaksi yang terjadi adalah sebagai
berikut:
LaFeO(OH)4 → LaFeO2(OH)2+H2O
Lembah endotermis lain pada suhu 540˚C menunjukkan adanya proses dekomposisi karbonat dan oksikarbonat untuk menghasilkan fasa oksida, pada suhu 830˚C menunjukkan proses terdekomposisinya oksida yang disertai dengan penurunan berat Δw2 sebesar 7%, sedangkan
lembah endotermis pada suhu sekitar 900˚C yang diikuti penurunan berat Δw3 sebesar 2%
Prosiding Kimia FMIPA
Peristiwa eksotermis terjadi pada suhu 480˚C, 545˚C, serta 880˚C. Reaksi eksotermis yang terjadi pada suhu 480˚C sampai 545˚C diperkirakan sebagai reaksi dekomposisi karbonat dan oksikarbonat untuk menghasilkan fasa oksida.
Perubahan campuran oksida logam menjadi oksida perovskit merupakan suatu reaksi yang bersifat eksotermis. Oleh karena itu, pembentukan fasa perovskit diperkirakan terjadi pada suhu sekitar 880oC yang ditandai oleh munculnya puncak kecil eksotermis pada suhu tersebut. Oleh karena itu, pada penelitian ini padatan oksida perovskit La1-xSrxCo1-yFeyO3- dikalsinasi pada
suhu 900 C, 1000 C dan 1100 C selama 2 jam. Suhu kalsinasi yang tepat untuk mengubah prekursor menjadi oksida perovskit tidak sama antara satu oksida perovskit dengan oksida perovskit lainnya. Pada umunya oksida perovskit yang disintesis dengan metode solid-state memerlukan suhu kalsinasi yang tinggi yaitu diatas 1000°C, sebagai contoh oksida perovskit La0,2Sr0,8Co0,8Fe0,2O3-δ dikalsinasi pada suhu
1000-1150°C selama 10-15 jam (Hu dkk., 2006). Perovskit La0,6Sr0,4Co0,2Fe0,8O3 dikalsinasi pada
suhu 1000°C selama 5 jam (Lee dkk., 2003), serta perovskit La0,6Sr0,4Fe0,9 Ga 0,1O3−δ yang disintesis
pada suhu kalsinasi 1100°C selam 10 jam (Etchegoyen dkk., 2006).
Penggunaan suhu kalsinasi yang tepat akan sangat berpengaruh pada sifat akhir dari oksida perovskit yang dihasilkan. Sebagai contoh, jika suhu kalsinasi yang digunakan terlalu tinggi, maka akan dihasilkan oksida perovskit dengan kerapatan yang tinggi dan luas permukaan rendah. Sifat seperti ini tidak cocok jika oksida perovskit yang dihasilkan hendak digunakan sebagai katalis. Sebaliknya, jika suhu kalsinasinya terlalu rendah maka dimungkinkan masih adanya fasa-fasa oksida non perovskit yang tidak menjadi oksida perovskit. Keberadaan fasa-fasa tersebut menyebabkan sifat-sifat oksida perovskit hasilnya tidak sesuai dengan oksida perovskit murni, karena ada bahan-bahan lain yang mengotorinya.
Proses kalsinasi ini bertujuan untuk menghilangkan pengotor dari padatan oksida perovskit La1-xSrxCo1-yFeyO3-. Setelah itu padatan
hasil kalsinasi dikeluarkan dari furnace untuk digerus dan selanjutnya akan dikarakterisasi dengan XRF untuk menentukan komposisi kimia dan XRD untuk menentukan fasa kristal. Selanjutnya serbuk tersebut digerus ulang dan ditambahkan metanol 75 tetes, kemudian serbuk dibagi menjadi dua bagian, bagian pertama dikalsinasi pada suhu 1000 oC selama 2 jam dan bagian kedua dikalsinasi pada suhu 1100 oC selama 2 jam.
Pada saat pembakaran atau kalsinasi pertama terjadi perubahan warna cuplikan yaitu dari warna merah kecoklatan menjadi abu-abu kehitaman yang ditampilkan pada Gambar 4.3, setelah itu dilanjutkan dengan kalsinasi yang kedua. Setelah kalsinasi yang kedua akan diperoleh serbuk hitam. Gambar 4.4 menunujukkan oksida perovskit setelah kalsinasi yang kedua pada suhu 1000 oC. Gambar 4.5 menunujukkan oksida perovskit setelah kalsinasi yang kedua pada suhu 1100 oC,
(a) (b) (c)
(d) (e) (f)
Gambar 4.4 Oksida perovskit hasil kalsinasi pada 900°C selama ± 2 jam (a) LaCoO3, (b)
La0,9Sr0,1Co0,9Fe0,1O3-, (c) La0,8Sr0,2Co0,8Fe0,2O3-,
(d)La0,7Sr0,3Co0,7Fe0,3O3-,(e) La0,6Sr0,4Co0,6Fe0,4O
3-, (f) La0,5Sr0,5Co0,5Fe0,5O3-.
(a) (b) (c)
(d) (e) (f)
Gambar 4.5 Oksida perovskit hasil kalsinasi kedua pada 1000°C selama 2 jam (a) LaCoO3, (b)
La0,9Sr0,1Co0,9Fe0,1O3- , (c) La0,8Sr0,2Co0,8Fe0,2O3- ,
(d)La0,7Sr0,3Co0,7Fe0,3O3- ,(e) La0,6Sr0,4Co0,6Fe0,4O 3-, (f) La0,5Sr0,5Co0,5Fe0,5O3-.
(a) (b) (c)
(d) (e) (f)
Gambar 4.5 Oksida perovskit hasil kalsinasi kedua pada 1100°C selama 2 jam (a) LaCoO3, (b)
La0,9Sr0,1Co0,9Fe0,1O3- , (c) La0,8Sr0,2Co0,8Fe0,2O3- ,
(d)La0,7Sr0,3Co0,7Fe0,3O3- ,(e) La0,6Sr0,4Co0,6Fe0,4O 3-, (f) La0,5Sr0,5Co0,5Fe0,5O3-.
3.2. Karakterisasi Oksida Perovskit
Karakterisasi terhadap oksida perovskit La 1-xSrxCo1-yFeyO3- yang dihasilkan meliputi
penentuan komponen fasa dengan X-Ray Diffraction (XRD) serta penentuan kandungan kimia dengan XRF.
Prosiding Kimia FMIPA 3.2.1 Difraksi Sinar-X (XRD)
Analisis difraksi sinar-X dilakukan pada rentang sudut 2 antara 20 dan 60o. Pada rentang sudut tersebut, puncak-puncak khas oksida perovskit LaCoO3 sudah tampak dengan jelas. Pada
metode solid-state, reaksi pembentukan perovskit sangat dipengaruhi oleh suhu kalsinasi.
Gambar 4.7 Difraktogram sinar-X oksida perovskit LaCoO3 hasil search n match JCPDS no.25-1060
dan JCPDS no.06-0491.
Gambar 4.7 menunjukkan Difraktogram sinar-X oksida perovskit LaCoO3 hasil search n match
JCPDS no.25-1060 dan JCPDS no.06-0491. Pada gambar tersebut tidak terlihat fasa-fasa selain oksida perovskit, hal ini dikarenakan oksida perovskit tersebut telah dikalsinasi pada suhu yang sesuai, yaitu dikalsinasi pada suhu 1000 oC maka oksida perovskit tersebut telah murni. Garis warna biru dan merah sama-sama menunjukkan keberadaan puncak oksida perovskit LaCoO3.
Gambar 4.8 Difraktogram sinar-X oksida perovskit La0,8Sr0,2Co0,8Fe0,2O3- hasil search n match
JCPDS no.05-0602, JCPDS no.09-0358, JCPDS no.36-1394 dan JCPDS no.36-1481.
Gambar 4.8 menunjukkan Difraktogram sinar-X oksida perovskit La0,8Sr0,2Co0,8Fe0,2O3- hasil
search n match JCPDS no.05-0602, JCPDS no.09-0358, JCPDS no.36-1394 dan JCPDS no.36-1481. Pada gambar tersebut masih terdapat fasa-fasa selain oksida perovskit. Garis warna merah menunjukkan puncak oksida lanthanum (La2O3)
JCPDS no.05-0602 , garis warna biru menunjukkan puncak oksida perovskit LaCoO3 JCPDS
no.09-0358, garis warna hijau muda menunjukkan puncak oksida perovskit La0,5Sr0,5CoO3- JCPDS
no.36-1394 dan garis warna hijau tosca menunjukkan puncak lanthanum hidroksida (La(OH)3) JCPDS
no.36-1481.
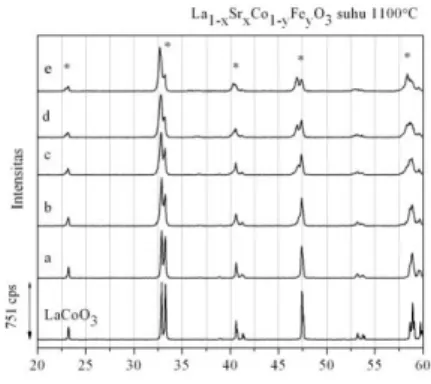
Gambar 4.9 Difraktogram sinar-X oksida perovskit La1-xSrxCo1-yFeyO3- pada suhu 900°C (* =
perovskit, # = La2O3, ♦ = Co3O4). (a)
La0,9Sr0,1Co0,9Fe0,1O3- (b) La0,8Sr0,2Co0,8Fe0,2O
3-(c)La0,7Sr0,3Co0,7Fe0,3O3- (d) La0,6Sr0,4Co0,6Fe0,4O
(e) La0,5Sr0,5Co0,5Fe0,5O
3-Gambar 4.9 menunjukkan difraktogram sinar-X oksida perovskit La1-xSrxCo1-yFeyO3- yang
disintesis pada suhu 900°C. Pada difraktogram tersebut terlihat puncak- puncak difraksi khas oksida perovskit. Puncak- puncak khas oksida perovskit muncul di daerah sekitar 2θ= 23°, 32°, 33°, 40°, 41°, 47°, 58° dan 59° sesuai dengan data PDF nomor 25-1060. Akan tetapi ada pula puncak- puncak non perovskit yang muncul di daerah sekitar 2θ= 26°, 27°, 29°, 36° dan 39° sesuai dengan JCPDS no.05-0602 . Hal ini ditunjukkan pada Tabel 4.1.
Kemunculan fasa selain oksida perovskit antara lain Co3O4 dan La2O3 terbentuk karena ada ion
Co3+ dan La3+ yang tidak bereaksi dengan ion O2-. Sebaliknya, ion-ion tersebut bereaksi sendiri-sendiri dengan ion O2- membentuk oksida logam masing-masing. Hal ini dapat terjadi karena prekursor yang dihasilkan memiliki homogenitas yang tidak sempurna, sehingga ion-ion logam yang ada tidak berada cukup berdekatan untuk bereaksi membentuk oksida perovskit. Proses penggerusan dan kalsinasi berulang (lebih dari dua kali) dapat membuat prekursor lebih homogen sehingga dapat mengurangi terbentuknya oksida- oksida logam secara individu.
Gambar 4.10 Difraktogram sinar-X oksida perovskit La1-xSrxCo1-yFeyO3- pada suhu 1000°C
(* = perovskit). (a) La0,9Sr0,1Co0,9Fe0,1O3- (b)
La0,8Sr0,2Co0,8Fe0,2O3- (c) La0,7Sr0,3Co0,7Fe0,3O
Prosiding Kimia FMIPA
Gambar 4.11 Difraktogram sinar-X oksida perovskit La1-xSrxCo1-yFeyO3- pada suhu 1100°C
(* = perovskit). (a) La0,9Sr0,1Co0,9Fe0,1O3- (b)
La0,8Sr0,2Co0,8Fe0,2O3- (c) La0,7Sr0,3Co0,7Fe0,3O
3-(d)La0,6Sr0,4Co0,6Fe0,4O3- (e) La0,5Sr0,5Co0,5Fe0,5O3-
Pada Gambar 4.10 dan Gambar 4.11 menunujukkan adanya puncak- puncak perovskit yang tajam dan sudah tidak ada puncak- puncak selain oksida perovskit. Hal ini terjadi karena cuplikan mengalami proses penggerusan dan kalsinasi berulang, maka dari itu cuplikan menjadi lebih homogen. Hal ini juga bisa dikarenakan oleh suhu kalsinasi yang sesuai.
Pengamatan lebih teliti terhadap difraktogram yang ada menunjukkan adanya pergeseran posisi puncak-puncak difraksi oksida perovskit (*) setelah disubstitusi oleh ion-ion Sr2+ dan Fe3+, hal ini dapat dijelaskan karena adanya perbedaan kecil jari-jari antara atom La3+ (1,36Å) dan Sr2+ (1,44 Å) yang menghasilkan perubahan kecil pada unit sel kisi kristal perovskit (Tien-Thao dkk., 2006), sehingga terjadi pergeseran sudut puncak 2 perovskit seperti yang ditunjukkan dalam Tabel 4.1.Difraksi sinar-X menunjukkan puncak kembar pada 2 32,88° dan 33,30° untuk LaCoO3 dan bergeser ke
sudut difraksi yang lebih kecil yaitu 32,87° dan 33,26° untuk La0,8Sr0,2Co0,8Fe0,2O3- dan untuk
La0,5Sr0,5Co0,5Fe0,5O3- bergeser ke sudut difraksi
yang lebih kecil yaitu 32,68° dan 33,25° pada suhu 1100°C. Hal ini ditunjukkan oleh Gambar 4.12.
Gambar 4.12 Difraktogram sinar-X oksida perovskit La1-xSrxCo1-yFeyO3- pada suhu 1100°C
(zoom).
Pada Gambar 4.10 dan Gambar 4.11 terlihat bahwa perubahan intensitas puncak dipengaruhi oleh suhu kalsinasi. Semakin tinggi suhu kalsinasi, maka intensitas puncak perovskit semakin
menurun. Berdasarkan Gambar 4.9, Gambar 4.10 dan Gambar 4.11, Nampak bahwa perubahan intensitas perovskit dipengaruhi oleh jumlah subtituen x dan y (Sr2+ dan Fe3+) (0≤x,y≤0,5), dimana semakin banyak substitusi x dan y maka intensitas oksida perovskit semakin menurun.
pada kalsinasi suhu 900°C intensitas tertinggi dimiliki oleh oksida perovskit LaCoO3 tanpa
adanya substitusi, sedangkan untuk oksida perovskit dengan subtitusi Sr2+ dan Fe3+ intensitas tertinggi dimiliki oleh La0,9Sr0,1Co0,9Fe0,1O3-. Pada
suhu kalsinasi 1000°C intensitas tertinggi dimiliki oleh oksida perovskit LaCoO3 tanpa adanya
substitusi, sedangkan untuk oksida perovskit dengan subtitusi Sr2+ dan Fe3+ intensitas tertinggi
dimiliki oleh La0,9Sr0,1Co0,9Fe0,1O3-. Pada suhu
kalsinasi 1100°C intensitas tertinggi dimiliki oleh oksida perovskit LaCoO3 tanpa adanya substitusi,
sedangkan untuk oksida perovskit dengan subtitusi Sr2+ dan Fe3+ intensitas tertinggi dimiliki oleh La0,8Sr0,2Co0,8Fe0,2O3-.
Difraktogram sinar-X oksida perovskit La 1-xSrxCo1-yFeyO3- dengan interval 0≤x,y≤0,5 yang
dihasilkan pada suhu 900°C, 1000°C dan 1100°C disajikan pada gambar dibawah ini.
Gambar 4.13 Difraktogram sinar-X oksida perovskit LaCoO3 pada suhu 900°C, 1000°C dan
1100°C.
Gambar 4.14 Difraktogram sinar-X oksida perovskit La0,8Sr0,2Co0,8Fe0,2O3- pada suhu 900°C,
1000°C dan 1100°C.
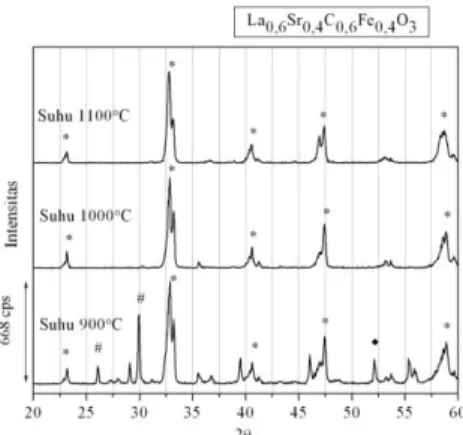
puncak kembar oksida perovskit La0,5Sr0,5Co0,5Fe0,5O3-pada 32,68° dan
33,25°
puncak kembar oksida perovskit La0,8Sr0,2Co0,8Fe0,2O3-pada 32,87° dan
33,26°
puncak kembar oksida perovskit LaCoO3 pada 32,88° dan 33,30°
Prosiding Kimia FMIPA
Gambar 4.15 Difraktogram sinar-X oksida perovskit La0,6Sr0,4Co0,6Fe0,4O3- pada suhu 900°C,
1000°C dan 1100°C.
Berdasarkan ketiga gambar pola difraksi sinar-X nampak bahwa ketika suhu kalsinasi 900°C, pada difraktogram sinar-X masih banyak puncak- puncak selain oksida perovskit. Sedangkan pada suhu kalsinasi 1000°C dan 1100° sudah tidak ada puncak- puncak selain oksida perovskit. Hal ini terjadi karena cuplikan mengalami proses penggerusan dan kalsinasi berulang, maka dari itu cuplikan menjadi lebih homogen. Hal ini juga bisa dikarenakan oleh suhu kalsinasi yang sesuai.
Berdasarkan Gambar 4.13, Gambar 4.14 dan Gambar 4.15 pola difraksi tersebut terlihat jelas bahwa pada metode solid-state, reaksi pembentukan perovskit sangat dipengaruhi oleh suhu kalsinasi yang tinggi, yaitu 1000°C sampai lebih dari 1000°C. Semakin tinggi suhu kalsinasi, maka intensitas puncak perovskit semakin menurun. Berdasarkan ketiga gambar pola difraksi sinar-X, Nampak bahwa perubahan intensitas perovskit dipengaruhi oleh jumlah subtituen x dan y (Sr2+ dan Fe3+) (0≤x,y≤0,5), dimana semakin banyak substitusi x dan y maka intensitas oksida perovskit semakin menurun.
3.2.2 Komposisi Kimia Oksida perovskit Komposisi kimia dari cuplikan perovskit dianalisis menggunakan Pendar fluor sinar-X (XRF) merk PANalytical tipe Minipal 4, PW4030/45b. Analisa XRF dilakukan di laboratorium Studi Energi dan Rekayasa LPPM ITS Surabaya. Hasil yang diperoleh dari analisis XRF dapat dilihat pada Tabel 4.5.
Tabel 4.3 Komposisi ion- ion La3+, Sr2+, Co3+ dan Fe3+ pada cuplikan analat oksida perovskit hasil
sintesis berdasarkan hasil analisis XRF.
Cuplikan %(b/b) La Sr Co Fe LaCoO3 74,3 - 25,7 - La0,9Sr0,1Co0,9Fe0,1O3- 69,5 2 25,2 3,1 La0,8Sr0,2Co0,8Fe0,2O3- 67,6 3 22,8 6,4 La0,7Sr0,3Co0,7Fe0,3O3- 64,3 4,4 20,8 10,5 La0,6Sr0,4Co0,6Fe0,4O3- 57,5 6,5 19,3 16,7 La0,5Sr0,5Co0,5Fe0,5O3- 50,3 9,5 17,5 22,6
Table 4.4 Perbandingan mol komposisi ion- ion La3+, Sr2+, Co3+ dan Fe3+ pada cuplikan analat
oksida perovskit hasil sintesis berdasarkan hasil analisis XRF.
Cuplikan Kandungan Logam (mol)
La Sr Co Fe LaCoO3 0,029 - 0,024 - La0,9Sr0,1Co0,9Fe0,1O3- 0,96 0.04 0,82 0,1 La0,8Sr0,2Co0,8Fe0,2O3- 0,89 0,06 0,71 0,21 La0,7Sr0,3Co0,7Fe0,3O3- 0,81 0,09 0,62 0,33 La0,6Sr0,4Co0,6Fe0,4O3- 0,68 0,12 0,54 0,49 La0,5Sr0,5Co0,5Fe0,5O3- 0,57 0,17 0,46 0,63
Hasil analisis XRF menunujukkan bahwa fraksi mol ion- ion logam pada oksida perovskit tidak sesuai dengan fraksi mol dari oksida perovskit yang hendak dibuat. Sebagai contoh pada La0,5Sr0,5Co0,5Fe0,5O3- seharusnya memiliki fraksi
mol ion La3+, Sr2+, Co3+ dan Fe3+ berturut-turut adalah 0,5, 0,5, 0,5 dan 0,5. Akan tetapi, hasil analisis XRF menunjukkan bahwa fraksi mol oksida perovskit tersebut adalah 0,574, 0,232, 0,398 dan 0,588.
Satu-satunya oksida perovskit yang memiliki komposisi kimia yang sama antara rumus yang disiapkan dengan hasil analisis XRF ditunjukkan oleh cuplikan LaCoO3. Selain memiliki komposisi
yang konsisten, data difraksi sinar-X pada Gambar 4.6, Gambar 4.7 dan Gambar 4.8 juga menunjukkan tidak adanya fasa-fasa lain selain oksida perovskit yang terdeteksi.
4. Kesimpulan
Oksida perovskit LaCoO3 dengan substitusi
Sr2+ terhadap La3+ dan Fe3+ terhadap Co3+ dengan nilai x dan y antara 0,0 sampai 0,5 dengan interval 0,1 dapat disintesis menggunakan metode solid- state dengan methanol sebagai zat pendispersi. Sintesis oksida perovskit La1-xSrxCo1-yFeyO3-
dapat dilakukan pada suhu 1000°C dan 1100°C, sedangkan pada suhu 900°C masih terdapat fasa non perovskit.
Pada metode solid-state, reaksi pembentukan perovskit sangat dipengaruhi oleh suhu kalsinasi yang tinggi, yaitu 1000°C sampai lebih dari 1000°C. Semakin tinggi suhu kalsinasi, maka intensitas puncak perovskit semakin menurun. Perubahan intensitas perovskit dipengaruhi oleh jumlah subtituen x dan y (Sr2+ dan Fe3+) (0≤x,y≤0,5), dimana semakin banyak substitusi x dan y maka intensitas oksida perovskit semakin menurun. Komposisi oksida perovskit berdasarkan hasil analisis XRF, oksida perovskit yang mendekati komposisi sebenarnya adalah LaCoO3
dimana diperoleh perbandingan mol La : Co sebesar 0,029 : 0,024, La0,9Sr0,1Co0,9Fe0,1O
3-La0,8Sr0,2Co0,8Fe0,2O3-dan La0,7Sr0,3Co0,7Fe0,3O3-.
Ucapan terimakasih
1. Hamzah Fansuri, M.Si., Ph.D atas dukungan, bimbingan dan motivasi yang diberikan
2. Ibu, ayah, adikku dan mas arfan atas dukungan dan doanya
3. teman-teman satu tim, serta teman-teman 2006
4. Semua pihak yang mendukung yang tidak dapat saya sebutkan satu persatu hingga terselesainya penelitian ini
Prosiding Kimia FMIPA Daftar Pustaka
Etchegoyen, G., Chartier, T. & Julian, A. (2006), Microstructure and oxygen permeability of a La0.6Sr0.4Fe0.9Ga0.1O3−δ membrane containing
magnesia as dispersed second phase particles, Journal Of Membrane Science, 268, 86-95
Hamakawa, S., Hayakawa, T. & Mizukami, F. (2005) Research on a Ceramics Membrane Reactor for Natural Gas Conversion. Catalysis Surveys from Asia, 9, 95-101
Hu, J., Hao, H., & Chen, C., (2006), Thermogravimetric study on perovskite-like oxygen permeation ceramic membranes, Journal Of Membrane Science, 280, 809-814
Juste, E., A. Julian, G. Etchegoyen, P. M. Geffroy, T. Chartier, N. Richet, P.Del Gallo, (2008), Oxygen Permeation, Thermal and Chemical Expansion of (La-Sr)(Fe-Ga)O3− Perovskite Membranes, Journal of Membrane Science. 319, 185-191 Lee, S., Lee, K. S., & Woo, S. K., (2003),
Oxygen-permeating property of LaSrBFeO3 (B=Co, Ga)
perovskite membrane surface-modified by LaSrCoO3, Solid State Ionics, 158, 287-296
Mundscau, M.V.,Cristtopher G.B., David A.G.Jr.,(2008), Diesel Fuel Reforming Using Catalytic Membran Reaktor , Catalysis Today, 136 (2008) 190 – 205 Tien-Thao N., H. Alamdari, M.H. Zahedi-Niaki, S.
Kaliaguine, (2007), Conversion of Syngas to Higher Alcohols over Nanosized LaCo0.7Cu0.3O3 Perovskite Precursors, Appl.Catal. A 311 vol 204–212
Tong, J., Yang, W., Cai, R., Zhu, B. & Lin, L. (2002), Novel and Ideal Zirconium-based Dense Membrane Reactors for Partial Oxidation of Methane to Syngas. Catalysis Letters, 78, 129-137 Wang, H., Cong, Y., Zhu, X. & Yang, W. (2003),
Oxidative Dehydrogenation of Propane in a Dense Tubular Membrane Reactor. React. Kinet. Catal. Lett., 79, 351-356
Waterrud, G., (2005), Determination of Oxygen Transport Coefficient in Perovskites and Perovskit Related Material With Mixed Conductivity, Department of Materials Science and Engineering, Norwegian University of Science and Technology
Wei, H.J., Y. Cao, W.J. Ji & C.T. Au, (2008), Lattice oxygen of La1-xSrxMO3 (M=Mn, Ni) and
LaMnO3-δFβ perovskite oxides for the partial
oxidation of methane to synthesis gas, Catalysis Communications, vol. 9, pp. 2509–2514
Yang, W., Wang, H., Zhu, X. & Lin, L. (2005), Development and Application of Oxygen Permeable Membrane in Selective Oxidation of Light Alkanes. Topics in Catalysis, 3, 155-167