KEMAMPUAN ANTI-β-LAKTAMASE Streptomyces lavendulae IVNF1-1
SEBAGAI SENYAWA PENDUKUNG β-LAKTAM PENGHAMBAT
SINTESIS DINDING SEL EPEC K1-1
HARYO TEJO PRAKOSO
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
ABSTRAK
HARYO TEJO PRAKOSO. Kemampuan Anti-β-Laktamase Streptomyces lavendulae IVNF1-1 Sebagai Senyawa Pendukung β-Laktam Penghambat Sintesis Dinding Sel EPEC K1-1. Dibimbing oleh YULIN LESTARI dan SRI BUDIARTI.
Enteropathogenic Escherichia coli (EPEC) merupakan bakteri yang dapat menyebabkan
diare karena mampu menempel pada membran plasma apikal sel usus dan merusak keseimbangan cairan elektrolit di dalamnya. Penggunaan antibiotik β-laktam secara luas untuk menanggulangi pertumbuhan bakteri ini telah menimbulkan resistensi terhadap antibiotik tersebut melalui pembentukan enzim β-laktamase. Streptomyces lavendulae IVNF1-1 diketahui memiliki senyawa anti-β-laktamase yang terdiri dari β-lactamase Inhibitory Protein (βLIP) dan asam klavulanat sehingga diduga dapat digunakan sebagai senyawa pendukung kerja antibiotik β-laktam dalam mengendalikan pertumbuhan EPEC yang resisten β-laktam. Penelitian ini bertujuan mengkaji kemampuan senyawa anti-β-laktamase yang dihasilkan oleh S. lavendulae IVNF1-1 dalam membantu kerja antibiotik β-laktam penghambat sintesis dinding sel EPEC K1-1. Asam klavulanat maupun βLIP mampu menghambat pertumbuhan EPEC K1-1. Penambahan βLIP dan asam klavulanat ke dalam 5 ml media NB berisi 100 µg/ml ampisilin dan biakan EPEC umur 12 jam yang diinkubasi pada suhu 37° C dapat menurunkan lebih banyak jumlah sel EPEC K1-1 yang mengindikasikan kombinasi kedua senyawa anti-β-laktamase tersebut kerjanya menjadi lebih efektif. Efek sinergisme terjadi pada kombinasi βLIP dengan konsentrasi 4.7% (b/v) dan asam klavulanat dengan konsentrasi 2% (v/v). Penambahan kedua senyawa anti-β-laktamase tersebut, secara terpisah ataupun kombinasi, menyebabkan morfologi sel EPEC K1-1 menjadi memanjang dan beberapa selnya nampak rusak. Dinding sel EPEC K1-1 ada yang robek yang mengakibatkan sel menjadi lisis. Senyawa anti-β-laktamase S. lavendulae IVNF1-1 terbukti mampu mendukung kerja ampisilin dalam menghambat pertumbuhan sel EPEC K1-1.
ABSTRACT
HARYO TEJO PRAKOSO. Ability of Anti-β-Lactamase Streptomyces lavendulae IVNF1-1 As a Supporting Compound For β-lactam to Inhibit EPEC K1-1 Cell Wall Synthesis. Supervised by YULIN LESTARI and SRI BUDIARTI.
Enteropathogenic Escherichia coli (EPEC) is a causing agent of diarrhea because it can
adhere to apical plasma membrane of enterocyte cell and disrupt the electrolyte balance inside it. Widely used of lactam antibiotics against EPEC has stimulated resistance of it through β-lactamase formation. It has been known that Streptomyces lavendulae IVNF1-1 has anti-β-lactamases comprise of β-Lactamase Inhibitory Protein (βLIP) and clavulanic acid. The anti-b-lactamase compounds probably can be used as a supporting compounds for β-lactam antibiotics to control the growth of β-lactam-resistant-EPEC. The aim of this study was to examine the ability of anti-β-lactamase produced by S. lavendulae IVNF1-1 in supporting the function of β-lactam antibiotic in inhibiting EPEC cell wall synthesis. Clavulanic acid as well as βLIP inhibited the growth of EPEC K1-1. Adding of βLIP and clavulanic acid to 5 ml NB media which contain 100 µg/ml ampicilin and EPEC with 12 hour incubation in 37° C lowered the cell number of EPEC K1-1, indicating that combining the two anti-β-lactamase compounds increased their effectiveness. Synergism effect occured when both βLIP and clavulanic acid were combined at 4.7% (b/v) and 2% (v/v), respectively. Addition of two anti-β-lactamase compounds either separately or mixedly, has made the cell morphology of EPEC K1-1 longer in shape and broken in its cell appearance. Its cell wall has lysed. Anti-β-lactamase compounds of S. lavendulae IVNF1-1 are proven to be supporting compounds for ampicillin during inhibition of EPEC K1-1 cell.
KEMAMPUAN ANTI-β-LAKTAMASE Streptomyces lavendulae IVNF1-1
SEBAGAI SENYAWA PENDUKUNG β-LAKTAM PENGHAMBAT
SINTESIS DINDING SEL EPEC K1-1
HARYO TEJO PRAKOSO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Fakultas Matematika dan
Ilmu Pengetahuan Alam
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul Skripsi : Kemampuan Anti-β-Laktamase Streptomyces lavendulae IVNF1-1
sebagai Senyawa Pendukung β-Laktam Penghambat Sintesis
Dinding Sel EPEC K1-1.
Nama
: Haryo Tejo Prakoso
NIM :
G34104033
Menyetujui :
Pembimbing I, Pembimbing II,
Dr. Ir. Yulin Lestari
Dr. dr. Sri Budiarti
NIP 131 779 515 NIP 132 047 666
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131 578 806
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Kemampuan Anti-β-Laktamase Streptomyces lavendulae IVNF1-1 sebagai Senyawa Pendukung β-Laktam Penghambat Sintesis Dinding Sel EPEC K1-1”. Penelitian yang dilaporkan dalam karya ilmiah ini dilakukan mulai Februari 2008 sampai dengan November 2008 bertempat di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong.
Penulis mengucapkan terima kasih kepada berbagai pihak yang telah membantu selama berlangsungnya kegiatan penelitian ini. Ucapan terima kasih penulis sampaikan kepada Dr. Ir. Yulin Lestari selaku dosen pembimbing pertama dan Dr. dr. Sri Budiarti selaku dosen pembimbing kedua atas segala bimbingan, saran, dan masukan selama berlangsungnya kegiatan penelitian dan selama penyusunan karya ilmiah ini serta kepada Dr. Ir. Tatik Chikmawati, Msi selaku dosen penguji. Ucapan terima kasih juga penulis sampaikan kepada orang tua tercinta atas segala dukungan dan doa yang telah diberikan, kepada adik-adik praktikan yang telah penulis bimbing, kepada teman-teman Biologi khususnya angkatan 41 yang telah penulis anggap sebagai keluarga, dan kepada teman-teman seperjuangan di Laboratorium Mikrobiologi tempat penulis berbagi kesenangan dan suka-duka selama penelitian ini berlangsung. Tak lupa penulis sampaikan terima kasih kepada Andini Purnama Sari yang tak pernah lelah memberikan semangat, dukungan, dan motivasi kepada penulis dalam melakukan penelitian dan penyusunan karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis merupakan anak tunggal yang dilahirkan di Jakarta pada tanggal 1 Agustus 1986 dari pasangan Drs. Hartono, DIPL.SI. dan Ir. Ashraf Badrulhidur. Tahun 2004 penulis lulus dari SMU Labschool Rawamangun dan pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Biologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum untuk mata kuliah Biologi Dasar sejak tahun 2007 hingga 2008, untuk mata kuliah Ilmu Lingkungan pada tahun 2006, dan untuk mata kuliah Mikrobiologi Dasar pada tahun 2008. Pada periode 2005-2006, penulis pernah menjabat sebagai staf bidang Informasi dan Komunikasi (Infokom) Perhimpunan Mahasiswa Biologi (Himabio) dan pada periode berikutnya, yaitu periode 2006-2007, penulis menjabat menjadi ketua pada bidang yang sama. Penulis pernah menjadi ketua panitia pada acara “Talk Show Lapangan Kerja” yang diselenggarakan oleh Infokom Himabio pada tahun 2007. Penulis pernah tergabung ke dalam tim Program Kreativitas Mahasiswa Penelitian (PKMP) yang diketuai Irni Mahagiani dengan judul penelitian “Bakteri Asal Tanaman Cabai Pendegradasi Kutu Kebul” dan berhasil mendapatkan penghargaan sebagai “penyaji terbaik 2” dan “penyaji poster terbaik 3” dalam Pekan Ilmiah Nasional (PIMNAS) XX pada tanggal 17-22 Juli 2007 bertempat di Universitas Lampung. Pada tahun 2008, penulis menjadi ketua tim dan mengikutsertakan penelitian ini pada PKMP 2008 dan lolos seleksi untuk penelitian yang didanai DIKTI.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN...viii
PENDAHULUAN...1
Latar Belakang ...1
Tujuan Penelitian...1
Waktu dan Tempat ...1
BAHAN DAN METODE ...1
Bahan dan Alat ...1
Metode...2
HASIL...3
Peremajaan Isolat ...3
Uji Antagonis Senyawa Anti-β-Laktamase dalam Filtrat Isolat IVNF1-1 Terhadap Pertumbuhan EPEC K1-1...4
Pengamatan Morfologi Sel EPEC K1-1. ...4
PEMBAHASAN ...4
SIMPULAN ...7
SARAN ...7
DAFTAR PUSTAKA ...8
DAFTAR GAMBAR
Halaman
1 Koloni IVNF1-1 pada media YMA umur 10 hari pada suhu ruang. ...3
2 EPEC K1-1 di media NA + 100µg/ml ampisilin...3
3 Grafik yang menunjukkan hubungan antara log jumlah sel dengan konsentrasi asam klavulanat dalam media NB (%v/v). ...5
4 Grafik yang menunjukkan hubungan antara log jumlah sel dengan konsentrasi βLIP dalam media NB (% b/v)...5
5 Grafik yang menunjukkan hubungan antara log jumlah sel dengan konsentrasi campuran antara βLIP (% b/v) dan asam klavulanat (% v/v) dalam media NB ...5
6 Sel EPEC K1-1 (perbesaran 10000 x) yang diberikan perlakuan. (a) Kontrol, (b) ditambahkan dengan 2 µl βLIP, (c) ditambahkan dengan 25 µl asam klavulanat, dan (d) ditambahkan dengan 2 µl βLIP dan 25 µl asam klavulanat. ls = lisis. ...6
DAFTAR LAMPIRAN
Halaman 1 Komposisi media yang digunakan (per 1 liter) ...102 Diameter zona bening pada pengujian aktivitas anti-β-laktamase ...10
3 Kurva standar protein (Bovin Serum Albumin) ...10
PENDAHULUAN
Latar Belakang
Diare merupakan penyakit yang sering menyebabkan Kondisi Luar Biasa (KLB) dengan tingkat kematian yang tinggi di beberapa negara berkembang, termasuk Indonesia (PPM & PLP Depkes RI 2004). Infeksi mikroba merupakan salah satu penyebab timbulnya diare. Enteropathogenic
Escherichia coli (EPEC) merupakan Escherichia coli patogen penyebab dominan
diare pada bayi dan balita (Nataro & Kaper 1998). Antibiotik β-laktam dapat digunakan untuk menghambat pertumbuhan EPEC. Antibiotik tersebut bekerja dengan cara menghambat sintesis dinding sel dari bakteri target dan karenanya aman untuk dipakai, kecuali untuk orang yang memiliki reaksi hipersensitivitas terhadap antibiotik tersebut. Harga yang ekonomis, selektivitas yang tinggi, spektrum yang luas, dan toksisitas terhadap inang yang rendah mendorong penggunaan β-laktam secara luas dalam dunia medis (Doran et al. 1990).
Penggunaan β-laktam secara kontinu memiliki efek samping berupa resistensi terhadap antibiotik tersebut (Kang et al. 2000). Mekanisme yang umum terjadi ialah melalui pembentukan enzim β-laktamase yang menginaktifkan antibiotik β-laktam sehingga sel bakteri target tetap hidup. Kode genetik yang menyimpan informasi enzim tersebut diperoleh melalui perpindahan gen yang cepat dan luas dari satu bakteri ke bakteri lain sejak antibiotik β-laktam mulai digunakan. EPEC K1-1 yang diisolasi dari feses anak-anak penderita diare (Budiarti et al. 1998) diketahui memiliki resistensi terhadap ampisilin dengan menghasilkan enzim β-laktamase (Wahyuni 2006). Salah satu cara untuk mengatasi resistensi terhadap β-laktam adalah dengan mengisolasi senyawa anti-β-laktamase dari bakteri (Kang et al. 2000). Senyawa tersebut adalah β-lactamase inhibitory protein (βLIP) yang berhasil diisolasi dari Streptomyces
clavuligerus (Doran et al. 1990) dan asam
klavulanat sebagai senyawaan nonprotein yang diisolasi dari spesies yang sama (Reading & Cole 1977).
Streptomyces isolat lokal memiliki potensi
untuk dikembangkan lebih lanjut.
Streptomyces isolat IVNF1-1 yang didapatkan
oleh Desriani (2004) berpotensi menghasilkan senyawa anti-β-laktamase karena memiliki
aktivitas penghambatan β-laktamase tertinggi yaitu 1.946 x 10-4 U/ml sebesar 84.12% (Elsie
2006). Senyawa tersebut diidentifikasi dan diketahui mengandung asam klavulanat dan protein penghambat β-laktamase (βLIP) (Wahyuni 2006). Optimasi produksi yang telah dilakukan dapat meningkatkan aktivitas penghambatan senyawa anti-β-laktamase terhadap EPEC K1-1 hingga tiga kali lipat (Fadhilah 2007). Isolat IVNF1-1 dianalisis sekuen genomnya dan diketahui memiliki persamaan dengan Streptomyces lavendulae (Lestari 2006). Tindak lanjut dari hasil penelitian ini yakni pengkajian sinergisme antara protein βLIP dengan asam klavulanat dalam menghambat EPEC K1-1 perlu dilakukan. Kemampuan senyawa anti-β-laktamase Streptomyces lavendulae IVNF1-1 dalam membantu kerja antibiotik β-laktam juga belum dikaji.
Tujuan Penelitian
Penelitian ini bertujuan mengkaji kemampuan senyawa anti-β-laktamase yang dihasilkan dari Streptomyces lavendulae IVNF1-1 dalam membantu kerja antibiotik β-laktam penghambat sintesis dinding sel EPEC K1-1 penyebab diare.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari 2008 - November 2008, bertempat di Laboratorium Mikrobiologi Departemen Biologi, Fakultas MIPA, Institut Pertanian Bogor dan LIPI Cibinong.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan ialah isolat
Streptomyces IVNF1-1 koleksi Dr. Ir. Yulin
Lestari, isolat EPEC K1-1 koleksi Dr. dr. Sri Budiarti, media International Streptomyces
Project (ISP) 4, media Yeast Malt Agar
(YMA), media Yeast Malt Broth (YMB) (Lampiran 1), media Nutrient Agar (NA), dan media Nutrient Broth (NB). Bahan lain yang digunakan adalah ampisilin, griseovulvin, asam nalidiksat, n-butanol, norit GSX karbon, H2SO4, NaOH, aseton 70%, larutan dapar
fosfat pH 7, Coomasie Brilliant Blue G 250, asam fosfor 85%, dan etanol 95%.
Alat-alat yang digunakan ialah sentrifuse, inkubator bergoyang, autoklaf, laminar,
2
membran milipore, kertas saring, sedotan berdiameter 6 mm, spektrofotometer, cakram kertas berdiameter 8 mm, mikroskop elektron payaran model JSM-5310LV, dan peralatan lain yang biasa digunakan dalam laboratorium mikrobiologi.
Metode
Peremajaan Isolat Streptomyces
lavendulae IVNF1-1. Isolat IVNF1-1
diremajakan pada media YMB yang diberi 12.5 mg/ml griseovulvin (antifungi) dan 40 mg asam nalidiksat (antibakteri gram negatif) dalam 2 ml 0.4% NaOH dan 6 ml aquades steril. Isolat tersebut diletakkan di inkubator bergoyang 100 rpm pada suhu ruang (24°C– 36°C) dan diinkubasi selama 7–10 hari atau hingga terbentuk miselia, kemudian isolat digores pada media YMA.
Peremajaan Isolat EPEC K1-1. Isolat
EPEC K1-1 diremajakan pada media NA yang ditambahkan 100 µg/ml ampisilin selama 24 jam pada suhu 37ºC. Koloni tunggal EPEC K1-1 dari media NA diinokulasikan ke dalam media NB yang ditambahkan 100 µg/ml ampisilin. Biakan ditumbuhkan pada suhu 37ºC dengan kecepatan pengocokan 100 rpm selama kurang lebih 2 jam untuk mendapatkan jumlah sel 108 sel/ml (OD=0.161).
Produksi Senyawa Anti-β-Laktamase. Isolat IVNF1-1 yang telah diremajakan pada media YMA diambil dengan menggunakan sedotan steril berdiameter 6 mm kemudian diinokulasikan ke dalam media cair ISP 4. Inkubasi dilakukan pada suhu ruang (24°C– 36°C) dengan kecepatan pengocokan 100 rpm selama lima hari. Sebanyak 10 ml isolat diambil dari media ISP 4 kemudian disentrifugasi pada kecepatan 20000 x g pada suhu 4°C selama 10 menit. Supernatan yang dihasilkan mengandung senyawa anti-β-laktamase.
Pemurnian βLIP. Aseton 70%
dimasukkan ke filtrat isolat IVNF1-1 sambil diaduk perlahan-lahan dalam kondisi dingin selama 10–15 menit. Setelah itu, campuran tersebut disentrifugasi pada kecepatan 20000 x g selama 10 menit pada suhu 4°C. Supernatan yang dihasilkan dibuang dan pelet diresuspensikan kembali dengan larutan dapar fosfat pH 7.
Pemurnian Asam Klavulanat. Asam
klavulanat diekstraksi dari filtrat isolat IVNF1-1 dalam bentuk garam karboksilat dengan metode United States Patent 4140764 (Howarth 1979). Sebanyak satu liter filtrat kultur bakteri IVNF1-1 didinginkan hingga 5°C. Filtrat dingin tersebut kemudian ditambahkan 0.33 liter n-butanol sambil diaduk selama 15 menit kemudian ditambahkan H2SO4 25% hingga pH 2 dan
diaduk kembali selama 15 menit. Hasil yang diperoleh berupa fase n-butanol dan fase air. Fase air dibuang dan fase n-butanol ditambahkan 0,5 % norit GSX karbon diaduk selama 15 menit kemudian disaring dengan kertas saring hingga dihasilkan fraksi n-butanol. Fraksi n-butanol tersebut ditambahkan 250 ml air deion dan NaOH 20% hingga pH 7 sambil terus diaduk. Suspensi tersebut disentrifugasi dengan kecepatan 10000 x g hingga didapatkan dua fase, yakni fase n-butanol yang dibuang dan fase air yang mengandung asam klavulanat kemudian disimpan pada suhu 4°C.
Pengujian Aktivitas Senyawa Anti-β-Laktamase. Pengujian dilakukan dengan
menggunakan metode difusi cakram melalui cawan overlay. Media NA semisolid berisi 100 μl biakan EPEC K1-1 (konsentrasi minimal 106 sel/ml) yang ditambahkan 100 μg/ml ampisilin dituang ke atas cawan berisi media NA yang telah memadat. Setelah media memadat, cakram kertas berdiameter 8 mm diletakkan ke atas media. Senyawa anti-β-laktamase (βLIP dan asam klavulanat) diteteskan sebanyak 15 µl ke cakram kertas tersebut. Inkubasi dilakukan selama 24 jam pada suhu 37°C. Zona bening yang terbentuk kemudian diukur (Lampiran 2).
Pengukuran Konsentrasi βLIP. Konsentrasi protein diukur dengan menggunakan metode Bradford (Bradford 1976). Sebanyak 400 µl larutan βLIP dicampurkan dengan 4 ml reagen Bradford kemudian divorteks sampai homogen. Absorbansi diukur pada panjang gelombang 595 nm setelah diinkubasi terlebih dahulu selama 15 menit. Bovin Serum Albumin dengan kisaran konsentrasi 1–10 ppm dipakai sebagai standar protein (Lampiran 3).
Uji Antagonis Senyawa Anti-β-Laktamase dalam Filtrat Isolat IVNF1-1 Terhadap Pertumbuhan EPEC K1-1.
Pengujian dilakukan terhadap konsentrasi efektif dari βLIP, asam klavulanat, dan
3
gabungan keduanya. Volume βLIP yang diujikan adalah 2, 4, 6, 8, dan 10 µl yang konsentrasinya dalam media NB secara berurutan adalah 4.7%, 9.4%, 14.1%, 18.8%, dan 23.5% (b/v) sedangkan volume asam klavulanat yang diujikan adalah 25, 50, 75, 100 µl yang konsentrasinya dalam media NB secara berurutan adalah 0.5%, 1%, 1.5%, dan 2% (v/v). Campuran antara βLIP dan asam klavulanat yang diujikan menggunakan kombinasi dari volume uji setiap faktor. Volume yang diujikan ditambahkan ke dalam 5 ml media NB yang sudah ditambahkan 100 µg/ml ampisilin dengan jumlah awal sel EPEC K1-1 sekitar 106 sel/ml kemudian
diinkubasi selama 12 jam pada suhu 37°C. Absorbansi dibaca pada panjang gelombang 620 nm.
Pengamatan Morfologi Sel EPEC K1-1.
Konsentrasi efektif yang didapat dari hasil uji antagonis dicobakan terhadap EPEC K1-1 untuk dilihat morfologi selnya. Pengamatan morfologi sel menggunakan mikroskop elektron payaran bervakum rendah model JSM-5310LV. Sampel bakteri EPEC dalam tabung reaksi disentrifugasi hingga sel-selnya mengendap. Supernatan dibuang kemudian ditambahkan glutaraldehida 2% dan direndam selama dua jam. Glutaraldehida dipisahkan dengan cara disentrifugasi kemudian dibuang dan selanjutnya larutan dapar caccodylate ditambahkan ke dalam sampel. Setelah direndam selama 10 menit, larutan dapar dibuang dengan cara disentrifugasi dan dilakukan perendaman dengan osmium tetra oksida 1% selama satu jam. Sampel disentrifugasi lagi untuk membuang larutannya dan kemudian direndam dengan alkohol 50% selama 10 menit. Kemudian secara berurut ditambahkan alkohol 70%, 80%, 95%, dan 99% dengan perendaman masing-masing penambahan selama 10 menit. Larutan alkohol kemudian dibuang dengan cara disentrifugasi dan t-butanol ditambahkan ke dalam sampel. Cover slip (cover glass yang dipotong dengan ukuran 0.25 cm2) dicuci
dengan alkohol absolut dan suspensi bakteri dioleskan di atasnya setelah cover slip kering. Selanjutnya sampel dikeringbekukan dan dilapisi ion Au. Semua tahapan sentrifugasi dilakukan pada kecepatan 4000 x g selama 5 menit
HASIL
Peremajaan Isolat
Isolat IVNF1-1 mampu tumbuh pada media YMA setelah terlebih dahulu ditumbuhkan pada media YMB. Pada umumnya koloni yang muncul memiliki morfologi dengan warna putih di permukaan atas media dan berwarna coklat gelap di permukaan yang menghadap media. Apabila koloni telah dewasa, akan terbentuk warna merah muda menggantikan warna putih pada permukaan atas koloni. Warna merah muda disebabkan oleh pigmen yang dihasilkan S.
lavendulae IVNF1-1 (Gambar 1).
Gambar 1 Koloni IVNF1-1 pada media YMA umur 10 hari pada suhu ruang. Pertumbuhan EPEC K1-1 pada media NA yang ditambahkan 100µg/ml ampisilin sangat cepat. Fase eksponensial dapat dicapai dalam waktu empat jam (Fadhilah 2007). Morfologi koloni tunggal EPEC K1-1 berbentuk bulat, permukaan licin, dan warnanya putih susu (Gambar 2). EPEC K1-1 dapat tumbuh pada media NA yang telah diberi antibiotik 100 µg/ml ampisilin karena EPEC K1-1 menghasilkan enzim β-laktamase yang dapat menginaktifkan cincin β-laktam ampisilin (Wahyuni 2006).
Gambar 2 EPEC K1-1 di media NA + 100µg/ml ampisilin.
4
Uji Antagonis Senyawa Anti-β-Laktamase
dalam Filtrat Isolat IVNF1-1 Terhadap Pertumbuhan EPEC K1-1
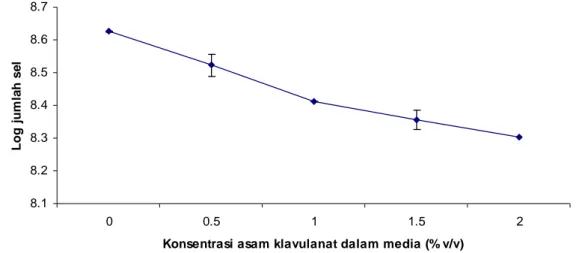
Asam klavulanat mampu menghambat pertumbuhan sel EPEC K1-1. Hal ini ditunjukkan dengan menurunnya log jumlah sel EPEC K1-1 pada saat diinkubasi 12 jam pada suhu 37°C dalam media NB yang ditambahkan dengan 100 µg/ml ampisilin (Gambar 3). Penurunan log jumlah sel EPEC K1-1 tersebut semakin kuat dengan naiknya konsentrasi asam klavulanat. Log jumlah sel EPEC K1-1 pada konsentrasi asam klavulanat 0.5% (v/v) sebesar 8.523 dan menurun menjadi 8.304 pada konsentrasi asam klavulanat 2% (v/v). Biakan EPEC K1-1 dengan kondisi yang sama tetapi tidak ditambahkan asam klavulanat dan digunakan sebagai kontrol menunjukkan log jumlah sel yang lebih tinggi yaitu 8.625
Protein inhibitor βLIP yang dihasilkan oleh S. lavendulae IVNF1-1 ternyata mampu menghambat kuat pertumbuhan EPEC K1-1. Penurunan log jumlah sel EPEC K1-1 semakin kuat dengan naiknya konsentrasi βLIP (Gambar 4). Log jumlah sel EPEC K1-1 pada konsentrasi βLIP 4.7% (b/v) adalah sekitar 8.366 sedangkan pada konsentrasi βLIP 9.4% (b/v) penghambatannya menjadi sangat kuat sehingga jumlah sel EPEC K1-1 yang terukur menjadi sangat sedikit. Konsentrasi βLIP ditentukan dengan menggunakan kurva standar protein (Lampiran 3). Kurva standar EPEC K1-1 dapat dilihat di Lampiran 4.
Kemampuan penghambatan kombinasi antara asam klavulanat dan βLIP dapat dilihat pada Gambar 5. Dibandingkan dengan kemampuan masing-masing senyawa inhibitor tersebut, penambahan βLIP dan asam klavulanat secara bersama-sama (campuran) memiliki efek sinergisme. Konsentrasi asam klavulanat 2% (v/v) saja hanya menurunkan log jumlah sel menjadi 8.304 (Gambar 3), dan konsentrasi βLIP 4.7% (b/v) saja hanya menurunkan log jumlah sel menjadi 8.367 (Gambar 4). Akan tetapi, campuran asam klavulanat 2% (v/v) dengan βLIP 4.7% (b/v) memberikan hambatan yang lebih kuat dibandingkan hambatan dari masing-masing senyawa inhibitor tersebut. Pada konsentrasi tersebut, kedua campuran senyawa inhibitor dapat menurunkan log jumlah sel dari 8.625 (kontrol) menjadi 7.297. (Gambar 5)
Pengamatan Morfologi Sel EPEC K1-1.
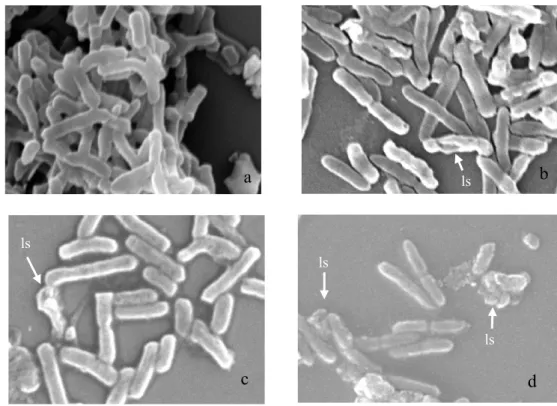
Sel EPEC K1-1 berbentuk batang pendek seperti E. coli pada umumnya (Gambar 6a). Akan tetapi, bentuk batang tersebut menjadi bergelombang pada permukaan tepinya dan terdapat sel dengan dinding sel yang berlubang sehingga lisis pada konsentrasi βLIP 4.7% (b/v) (Gambar 6b). Pada konsentrasi 0.5% (v/v) asam klavulanat, juga terlihat sel yang lisis (Gambar 6c). Sel yang lisis semakin banyak teramati pada kombinasi konsentrasi βLIP 4.7% (b/v) dan asam klavulanat 0.5% (v/v) (Gambar 6d).
PEMBAHASAN
Streptomyces merupakan bakteri gram
positif dari kelas Aktinomiset yang bersifat aerob obligat. Bakteri ini tumbuh optimal pada suhu ruang karena sebagian besar merupakan organisme mesofilik. Pertumbuhan terjadi melalui fragmentasi ujung filamen membentuk matriks tenunan kompleks miselia aerial (sporosphore). Pada media YMA, ujung sporosphore membentuk spora yang dikenal sebagai konidia. Setelah dewasa konidia dan sporosphore mengalami pigmentasi sehingga memberikan karakteristik warna terhadap koloni dewasa Streptomyces. Isolat IVNF1-1 mula-mula tumbuh membentuk miselia berwarna putih, namun akan menjadi sedikit merah muda setelah koloni berusia dewasa (Gambar 1). Warna merah muda ini karena pigmen yang dihasilkan.
EPEC merupakan Escherichia coli patogen yang menjadi penyebab utama diare di negara-negara berkembang (Nataro & Kaper 1998). Seperti E. coli lainnya, EPEC merupakan bakteri gram negatif dengan habitat alami di dalam saluran pencernaan manusia dan hewan berdarah panas (Donnenberg & Whittam 2001). Virulensi EPEC yang dijelaskan oleh Clarke et al. (2003) terjadi karena pembentukan lesi ultrastruktural pada saat bakteri EPEC bersentuhan dan mengadakan kontak dengan membran plasma apikal sel inang. Kemampuan EPEC untuk menempel pada membran sel inang dibantu oleh beberapa struktur khusus yaitu bundle-forming pili, intimin, dan filamen EspA. Fosforilasi tirosin dan transduksi sinyal terjadi di dalam sel inang pada situs pembentukan lesi sehingga kapasitas absorsi cairan dari mukosa intestinal turun. Hal tersebut menyebabkan keseimbangan elektrolit terganggu dan pada akhirnya menyebabkan diare.
8.1 8.2 8.3 8.4 8.5 8.6 0 0.5 1 1.5 2
Konsentrasi asam klav 8.7
anat dalam media (% v/v)
Lo g j um la h s e l ul
Gambar 3 Grafik yang menunjukkan hubungan antara log jumlah sel dengan konsentrasi asam klavulanat dalam media NB (%v/v).
0.0 1.0 2.0 3.0 4.0 5.0 6.0 7.0 8.0 9.0 10.0 0 4.7 9.4 14.1 18.8 23.5
Konsentrasi βLIP dalam media (% b/v)
s e l la h um Lo g j 6.5 7.0 7.5 8.0 8.5 9.0 0 4.7 ; 0.5 4.7 ; 1 4.7 ; 1.5 4.7 ; 2
βLIP (% b/v) ; asam klav (% v/v)
Log j um la h s e l
Gambar 4 Grafik yang menunjukkan hubungan antara log jumlah sel dengan konsentrasi βLIP dalam media NB (% b/v).
Gambar 5 Grafik yang menunjukkan hubungan antara log jumlah sel dengan konsentrasi campuran antara βLIP (% b/v) dan asam klavulanat (% v/v) dalam media NB
6
a
lsb
c
ls ls lsd
Gambar 6 Sel EPEC K1-1 (perbesaran 10000 x) yang diberikan perlakuan. (a) Kontrol, (b) ditambahkan dengan 2 µl βLIP, (c) ditambahkan dengan 25 µl asam klavulanat,
dan (d) ditambahkan dengan 2 µl βLIP dan 25 µl asam klavulanat. ls = lisis.
Penambahan asam klavulanat pada berbagai konsentrasi uji ke dalam masing-masing 5 ml NB dan 100 µg/ml ampisilin dengan umur biakan EPEC 12 jam yang diinkubasi pada suhu 37°C dapat menghambat pertumbuhan EPEC K1-1. Asam klavulanat merupakan senyawa non-protein yang memiliki cincin β-laktam tetapi tidak mempunyai inti penisilin maupun cephalosporin (Finlay et al. 2003). Charnas et
al (1978) menyatakan bahwa β-laktamase dari
E. coli RTEM menjadi inaktif setelah
diinkubasi dengan asam klavulanat. Mekanisme inaktivasi β-laktamase oleh asam klavulanat adalah melalui inhibitor tidak dapat balik (Finlay et al. 2003). Umumnya, asam klavulanat digunakan bersama-sama dengan antibiotik β-laktam lainnya. Kombinasi antara asam klavulanat dengan penisilin diketahui dapat menurunkan konsentrasi penghambatan minimum pada Streptococcus pneumoniae (Severin et al. 1997).
Senyawa βLIP mampu menghambat pertumbuhan EPEC K1-1 pada berbagai konsentrasi yang diujikan. βLIP merupakan senyawa protein yang terdiri dari 165 asam amino (Huang et al. 2000). Struktur co-kristal dari kompleks βLIP dan TEM-1 β-laktamase
memperlihatkan asam aspartat pada posisi ke-49 yang terintegrasikan ke dalam situs aktif untuk membentuk ikatan hidrogen dengan empat residu katalitik β-laktamase dan fenilalanin pada posisi ke-142 yang menempati situs aktif tempat menempelnya gugus benzil dari antibiotik β-laktam penisilin G pada saat pelekatan substrat dan katalisisnya (Rudgers & Palzkill 1999). βLIP yang diperoleh dari isolat IVNF1-1 diketahui memiliki asam aspartat dan fenilalanin sebagai asam amino dominan (Wahyuni 2006). Log jumlah sel EPEC K1-1 pada konsentrasi βLIP 4.7% (b/v) adalah sekitar 8.366 sedangkan pada konsentrasi βLIP 9.4% (b/v) penghambatannya menjadi sangat kuat sehingga jumlah sel EPEC K1-1 yang terukur menjadi sangat sedikit. Konsentrasi penghambatan minimum dari βLIP asal isolat IVNF1-1 kemungkinan terletak pada rentang 4.7% sampai 9.4% (b/v).
Asam klavulanat lebih lemah kemampuannya dalam menurunkan log jumlah sel EPEC K1-1 apabila dibandingkan dengan penambahan βLIP pada beberapa konsentrasi yang diujikan. Hal ini menguatkan hasil penelitian Fadillah (2007) yang menguji aktivitas penghambatan βLIP dan asam
7
klavulanat terhadap enzim β-laktamase melalui uji zona bening dan diketahui diameter zona bening asam klavulanat lebih kecil dibandingkan βLIP hasil ekstraksi langsung. Namun demikian, dalam penelitian ini konsentrasi asam klavulanat dinyatakan dalam % (v/v) dan βLIP dinyatakan dalam % (b/v). Oleh karena itu untuk membandingkan kekuatan penghambatan keduanya perlu dilakukan uji lanjut pada konsentrasi yang sama.
Efek sinergisme antara βLIP dan asam klavulanat terjadi pada saat pencampuran keduanya ke dalam media NB yang ditambah 100 µg/ml ampisilin berisi biakan EPEC umur 12 jam yang diinkubasi pada suhu 37° C pada berbagai konsentrasi campuran yang diujikan. Efek sinergisme tersebut beragam tergantung konsentrasi. Sinergisme yang kuat ditunjukkan oleh perlakuan campuran konsentrasi βLIP 4.7% (b/v) dan asam klavulanat 2% (v/v). Hal ini mengindikasikan bahwa kombinasi kedua senyawa anti-β-laktamase tersebut kerjanya menjadi lebih efektif. βLIP dan asam klavulanat yang dihasilkan dari isolat Streptomyces lavendulae IVNF1-1 masing-masing mampu menghambat enzim β-laktamase yang diproduksi secara ekstraseluler dari EPEC K1-1 (Wahyuni 2006). Sinergisme βLIP dan asam klavulanat dalam menurunkan jumlah sel EPEC K1-1 diduga terjadi karena semakin banyak enzim β-laktamase yang dihambat oleh kedua senyawa tersebut sehingga semakin banyak pula jumlah ampisilin yang tidak terdegradasi yang pada akhirnya menghambat pertumbuhan sel EPEC K1-1.
Pengamatan morfologi sel bakteri EPEC K1-1 (Gambar 6) memberikan gambaran bahwa antibiotik β-laktam dapat menghambat sintesis dinding sel setelah diberikan perlakuan senyawa anti-β-laktamase. Hal ini menguatkan hasil penelitian Wahyuni (2006) yang mereaksikan enzim β-laktamase ekstraseluler dari EPEC K1-1 dengan ekstrak kasar yang mengandung senyawa anti-β-laktamase dari isolat IVNF1-1 dan diketahui memiliki nilai penghambatan yang tinggi. Enzim β-laktamase yang dihambat oleh senyawa anti-β-laktamase menyebabkan antibiotik β-laktam dapat bekerja menghambat sintesis dinding sel. Pengamatan dengan menggunakan mikroskop elektron payaran menunjukkan bahwa sel EPEC K1-1 terlihat ada yang lisis pada konsentrasi βLIP 4.7 % (b/v) dan asam klavulanat 0.5% (v/v).
Sel yang lisis dapat disebabkan oleh aktivitas enzim autolisis. Enzim autolisis diketahui memiliki beberapa peran penting seperti perakitan dinding sel, perluasan dinding sel, dan pembelahan sel (Daneo-Moore & Shockman 1977 dalam Ogawara 1981). Perluasan dinding sel bakteri terjadi melalui proses yang seimbang antara degradasi dengan sintesis dinding sel (Ogawara 1981). Apabila proses sintesis dinding sel dihambat misalnya oleh antibiotik β-laktam, maka degradasi dinding sel oleh enzim autolisis akan tetap bekerja dan dapat menyebabkan sel lisis. Fenomena ini mengindikasikan bahwa antibiotik β-laktam (misalnya ampisilin) dapat tetap bekerja menghambat sintesis dinding sel bakteri dan tidak didegradasi oleh β-laktamase karena enzim β-laktamase terebut diinaktivasi oleh senyawa anti-β-laktamase.
SIMPULAN
Senyawa anti-β-laktamase yaitu βLIP dan asam klavulanat yang dihasilkan oleh
Streptomyces lavendulae IVNF1-1 dapat
menurunkan populasi EPEC K1-1 dan kemampuan penghambatannya semakin kuat seiring dengan meningkatnya konsentrasi. Log jumlah sel EPEC K1-1 yang diberi perlakuan asam klavulanat menurun dari 8.523 pada konsentrasi 0.5% menjadi 8.304 pada konsentrasi 2% (v/v). Log jumlah sel EPEC K1-1 yang diberi perlakuan βLIP menurun dari 8.367 pada konsentrasi 4.7% (b/v) menjadi mendekati nol pada konsentrasi 23.5% (b/v). Campuran kedua senyawa inhibitor tersebut memiliki efek sinergisme. Sinergisme nyata pada kombinasi βLIP 4.7% (b/v) dan asam klavulanat 2% (v/v) yang menurunkan log jumlah sel EPEC dari 8.625 (kontrol) menjadi 7.297.
Perlakuan βLIP dan/atau asam klavulanat merusak morfologi sel EPEC. Pengamatan dengan mikroskop elektron menunjukkan bahwa sel EPEC K1-1 nampak rusak dan berlubang (lisis).
SARAN
Penentuan konsentrasi penghambatan minimum βLIP dan asam klavulanat dari
Streptomyces lavendulae IVNF1-1, serta efek
sinergisme kedua senyawa inhibitor tersebut perlu dikaji lebih lanjut.
8
DAFTAR PUSTAKA
Bradford MM. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein dye binding. Anal
Biochem 72: 248-254.
Budiarti S, Wahyudi AT, Rachmania N. 1998. Telaah faktor adhesifitas E. coli enteropathogenik dalam penanggulangan Diare di Indonesia. [laporan akhir hibah bersaing III]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Charnas RL, Fisher J, Knowles JR. 1978. Chemical studies on the inactivation of
Escherichia coli RTEM β-lactamase by clavulanic acid. Biochemistry 17:2185-2189.
Clarke SC, Haigh RD, Freestone PPE, Williams PH. 2003. Virulence of
Enteropathogenic Esherichia coli, a global
pathogen. Clinical Microbiol Rev 16(3): 365-378.
Daneo-Moore L, Shockman GD. 1977. The bacterial cell surface in growth and division. Di dalam: Ogawara H. 1981. Antibiotic resistance in pathogenic and producing bacteria, with special reference to b-lactam antibiotics. Microbiol Rev 45: 591-619..
Desriani. 2004. Penapisan isolat Streptomyces spp. penghasil protein penghambat β-laktamase. Hayati. 11(3): 88-92.
Donnenberg MS, Whittam TS. 2001. Pathogenesis and evolution of virulence in enteropathogenic and enterohemorrhagic
Escherichia coli. The J Clinical Investig
107: 539-548.
Doran et al. 1990. Isolation and
characterization of a β-lactamase-inhibitory protein from Streptomyces
clavuligerus and cloning and analysis of
the corresponding gene. J Bacteriol 172(9): 4909-4918.
Elsie. 2006. Aktivitas protein penghambat β-laktamase dari Streptomyces sp. IVNF1-1 terhadap Enteropathogenic Escherichia
coli (EPEC) K1-1. [tesis]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Fadhilah AM. 2007. Optimasi produksi senyawa anti-β-laktamase dari
Streptomyces sp. IVNF1-1 penghambat
pertumbuhan bakteri penyebab diare EPEC K1-1. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Finlay J, Miller L, Puopard JA. 2003. A review of the antimicrobial activity of clavulanate. J Antimicrob Chemother 52:18-23.
Howarth TT, penemu; United States Patent. 20 Feb 1979. β-lactamase inhibitors and process for their preparation. US 4140764. Huang W, Zhang Z, Palzkill T. 2000. Design
of potent β-lactamase inhibitors by phage display of β-lactamase inhibitory protein. J
Biol Chem 275 (20): 14964-14968
Kang SG, Park HU, Lee HS, Kim HT, Lee KJ. 2000. New β-lactamase inhibitory protein (BLIP-1) from Streptomyces
exfoliatus SMF 19 and its roles on the
morphological differentiation. J Biol Chem 275(22): 16851-16856.
Lestari Y. 2006. Identification of indigenous
Streptomyces spp. producing antibacterial
compounds. J Mikrobiol Indones 11(2): 99-101
Nataro JP, Kaper JB. 1998. Diarheagenic
Escherichia coli. Clinical Microbiol Rev
11(1): 142-201.
Ogawara H. 1981. Antibiotic resistance in pathogenic and producing bacteria, with special reference to b-lactam antibiotics.
Microbiol Rev 45: 591-619.
[PPM & PLP] Pemberantasan Penyakit Menular Departemen Kesehatan RI. 2004. Diare [terhubung berkala]. www. dep. kesri.com [12 Oktober 2008]
Reading C, Cole M. 1977. Clavulanic acid: a β-lactamase-inhibiting β-lactam from
Streptomyces clavuligerus. Antimicr Agent Chem 11(5): 852-857.
Rudgers G, Palzkill T. 1999. Identification of residues in β-lactamase critical for binding β-lactamase inhibitory protein. J Biol
Chem 274 (11): 6963-6971
Severin A, Severina E, Tomasz A. 1997. Abnormal physiological properties and altered cell wall composition in
Streptococcus pneumoniae grown in the
presence of clavulanate. Antimicrob Agent
Chemother 41:504-510
Wahyuni WT. 2006. Isolasi, pemurnian, dan identifikasi senyawa anti-β-laktamase dari
Streptomyces sp. IVNF1-1 (Penghambat
pertumbuhan bakteri penyebab diare, EPEC K1-1). [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
10
Lampiran 1 Komposisi media yang digunakan (per 1 liter) Media peremajaan IVNF1-1 (YMA)
Bahan yang digunakan Komposisi (dalam gram) Yeast Extract 4
Malt Extract 10
Glukosa 4 Agar 15 Media produksi anti-β-laktamase dari IVNF1-1 (ISP 4)
Bahan yang digunakan Komposisi (dalam gram)
Soluble Starch 10 CaCO3 2 (NH4)2SO4 2 K2HPO4 1 MgSO4.7H2O 1 NaCl 1 FeSO4.7H2O 0.001 MnCl2.7H2O 0.001 ZnSO4.7H2O 0.001
Lampiran 2 Diameter zona bening pada pengujian aktivitas anti-β-laktamase Ulangan* (mm) Bahan yang diujikan (15µl) 1 2 3 4 Rata-rata Ekstrak kasar 4 3.67 3.67 3.33 3.67 Asam klavulanat 9 11 10 10 10 βLIP 14 14 14 14 14
*Keterangan: sudah dikurangi diameter kertas cakram (8 mm).
Lampiran 3 Kurva standar protein (Bovin Serum Albumin)
R2 = 0.984 y = 0.0017x + 0.003 0 0.005 0.01 0.015 0.02 0.025 0 2 4 6 8 10 1 mg/L (ppm) A b so rb an 2
Konsentrasi BSA (mg/L) Absorban
Blanko 0.0295 1 0.0040 2 0.0070 3 0.0085 4 0.0090 5 0.0115 6 0.0135 7 0.0140 8 0.0165 9 0.0190 10 0.0190 Sampel (pengenceran 10x) 0.0230 Konsentrasi βLIP: Y = 0.0017X + 0.003 0.023 = 0.0017X + 0.003 X = 11.76 x 10 (faktor pengenceran) X = 117.6 mg/L
11
Lampiran 4 Kurva standar bakteri EPEC K1-1
x=114 x=57 x=28.5 x=14.25 x=7.125 R2 = 0.9889 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0 20 40 60 80 100 120 Jumlah sel (106) A b s o rb an si y = 3x10-9 X + 0.0244