SKRIPSI
PENGARUH PENYIMPANAN PAKAN UDANG KOMERSIAL DENGAN PENAMBAHAN VOLUME AIR BERBEDATERHADAP
PERTUMBUHAN JAMUR DAN KANDUNGAN PROTEIN KASAR
Oleh :
ARIF SYAIFURRISAL
SIDOARJO – JAWA TIMUR
FAKULTAS PERIKANAN DAN KELAUTAN UNIVERSITAS AIRLANGGA
SURABAYA 2014
SKRIPSI
PENGARUH PENYIMPANAN PAKAN UDANG KOMERSIAL DENGAN PENAMBAHAN VOLUME AIR BERBEDA TERHADAP PERTUMBUHAN
JAMUR DAN KANDUNGAN PROTEIN KASAR
Skripsi sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Perikanan pada Fakultas Perikanan dan Kelautan Universitas Airlangga
Oleh :
ARIF SYAIFURRISAL NIM : 140911137
Menyetujui,
Komisi Pembimbing
Pembimbing Utama Pembimbing Serta
Rahayu Kusdarwati, Ir., M.Kes Agustono, Ir., M.Kes.
SKRIPSI
PENGARUH PENYIMPANAN PAKAN UDANG KOMERSIAL DENGAN PENAMBAHAN VOLUME AIR BERBEDA TERHADAP PERTUMBUHAN
JAMUR DAN KANDUNGAN PROTEIN KASAR
Oleh :
ARIF SYAIFURRISAL NIM : 140911137
Telah diujikan pada Tanggal : 21 Juli 2014
KOMISI PENGUJI SKRIPSI
Ketua : Sudarno, Ir., M.Kes.
Anggota : Dr. M. Anam Al Arif, Drh., M.P Prayogo, SPi., MP.
Rahayu Kusdarwati, Ir., M.Kes. Agustono, Ir., M.Kes.
Surabaya,
Fakultas Perikanan dan Kelautan Universitas Airlangga
Dekan,
Prof. Dr. Hj.Sri Subekti, drh., DEA NIP. 19520517 197803 2 001
RINGKASAN
ARIF SYAIFURRISAL. Pengaruh Penyimpanan Pakan Udang Komersial Dengan Penambahan Volume Air Berbeda Terhadap Pertumbuhan Jamur Dan Kandungan Protein Kasar. Dosen Pembimbing I Rahayu Kusdarwati, Ir., M.Kes dan Dosen Pembimbing II Agustono, Ir., M.Kes.
Pakan berperan sangat penting pada usaha budidaya perikanan karena bermanfaat untuk memenuhi kebutuhan zat-zat makanan yang diperlukan bagi pertumbuhan, perkembangan dan reproduksi (Suprijatna dkk., 2005). Salah satu kendala penyediaan bahan pakan dalam kegiatan budidaya adalah kerusakan bahan pakanselama penyimpanan (Suparjo, 2010). Salah satu organisme yang menyebabkan kerusakan bahan pakan adalah jamur. Laju reproduksi dan pertumbuhan organisme ini dipengaruhi oleh kadar air, temperatur dan lama penyimpanan bahan. Tingkat kontaminasi oleh jamur sebagian besar ditentukan oleh suhu penyimpanan dan ketersediaan air dan oksigen (Suparjo, 2010).
Tujuan dari penelitian ini adalah untuk mengidentifikasi jamur dan mengalanisa perubahan Protein Kasar (PK) akibat pengaruh penyimpanan pakan dengan penambahan volume air yang berbeda. Penelitian dilakukan di Laboratorium Fakultas Perikanan dan Kelautan dan Laboratorium Pakan Ternak Fakultas Kedokteran Hewan Universitas Airlangga Surabaya. Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) dilanjutkan dengan Uji Jarak Berganda Duncan.
Bahan yang digunakan dalam penelitian ini adalah media SDA (Sabouraud Dextrose Agar), air steril, akuades steril dan kloramfenikol 50 µg/ml, aquades, NaOH 4% dan 40%, tablet Kjeldahl, H2SO4, asam borat, indikator Metil-merah, Brom cresol
green, silika gel dan HCl.
Hasil identifikasi jamur menunjukkan adanya lima spesies jamur yang tumbuh pada penyimpanan pakan dengan penambahan volume air berbeda, lima spesies jamur tersebut antara lain Aspergillus niger, Aspergillus flavus, Aspergillus fumigatus, Aspergillus candidus dan Rhizopus oryzae. Hasil analisis varian (ANAVA) yang dilakukan menunjukkan bahwa setiap perlakuan memberikan pengaruh terhadap perubahan kadar protein kasar (p<0,05). Rata-rata perubahan kadar protein kasar tertinggi terjadi pada perlakuan P3 (113,54%) dan terendah pada P2 (90.27%). Pada perlakuan P3 ditemukan empat spesies jamur antara lain Aspergillus niger, Aspergillus flavus, Aspergillus fumigatus dan Rhizopus oryzae, sedangkan pada perlakuan P2 ditemukan dua spesies jamur Aspergillus niger dan Aspergillus flavus.
SUMMARY
ARIF SYAIFURRISAL. The Effect of Storage Commercial Shrimp Feed With Addition of Different Water Volume to Growth of Fungi and Crude Protein Content. Academic Advisor I Rahayu Kusdarwati, Ir., M.Kes dan Academic Advisor II Agustono, Ir., M.Kes.
Feed very important role in aquaculture because it is useful to meet the needs of nutrients necessary for growth, development and reproduction (Suprijatna et al., 2005). One of the constraints in the supply of aquaculture feed is the feed material damage during storage (Suparjo, 2010). One of the organisms that cause damage to the feed material is mildew. The rate of reproduction and growth of this organism is affected by water content, temperature and duration of storage of materials. The level of contamination by fungi are largely determined by the temperature of storage and the availability of water and oxygen (Suparjo, 2010).
The purpose of this study is to identify and analyze changes in fungal Crude Protein (CP) due to the influence of feed storage with the addition of different volumes of water. The study was conducted at the Laboratory of The Faculty of Fisheries and Marine and Forage Laboratory Faculty of Veterinary Medicine, Universitas Airlangga, Surabaya. The study design used was Completely Randomized Design (CRD) followed by Duncan's Multiple Range Test.
Materials used in this study is a medium SDA (Sabouraud Dextrose Agar), sterile water, sterile distilled water and chloramphenicol 50 ug / ml, distilled water, NaOH 4% and 40%, Kjeldahl tablets, H2SO4, boric acid, methyl-red indicator, Brom cresol green,
silica gel and HCl.
Fungi identification results show the presence of five species of fungus that grows on food storage with the addition of different volumes of water, five species of fungi include Aspergillus niger, Aspergillus flavus, Aspergillus fumigatus, Aspergillus candidus and Rhizopus oryzae. Results of Analysis of Variance (ANOVA) were conducted showed that each treatment is to give effect to changes in crude protein levels (p <0.05). Average changes in the levels of crude protein was highest in treatment P3 (113.54%) and lowest in P2 (90.27%). At P3 treatment found four species of fungi include Aspergillus niger, Aspergillus flavus, Aspergillus fumigatus and Rhizopus oryzae, whereas the P2 treatment found two species of the fungus Aspergillus niger and Aspergillus flavus.
KATA PENGANTAR
Segala puji dan syukur penulis ucapkan atas kehadirat Allah SWT yang telah memberikan limpahan rahmat dan hidayahnya, sehingga penelitian ini dapat terselesaikan. Penelitian ini dibuat untuk mengetahui pengaruh penyimpanan pakan udang komersial dengan penambahan volume air berbeda terhadap pertumbuhan jamur dan perubahan protein kasar. Penelitian ini diharapkan dapat bermanfaat bagi peningkatan produktifitas perikanan di Indonesia. Pada kesempatan ini tidak lupa penulis mengucapkan terimakasih yang sebesar–besarnya kepada semua pihak yang telah memberikan ijin dan bantuan fasilitas dalam penyelesaian penelitan ini.
Penulis menyadari bahwa Skripsi ini masih belum sempurna, sehingga kritik dan saran yang membangun sangat penulis harapkan demi perbaikan dan kesempurnaan Skripsi ini lebih lanjut. Akhirnya penulis berharap semoga Karya Ilmiah ini dapat bermanfaat untuk memberikan informasi serta perkembangan ilmu dan teknologi di bidang perikanan Indonesia.
Surabaya, Juli 2014
UCAPAN TERIMA KASIH
Ucapan terima kasih penulis sampaikan kepada :
1. Ibu Prof. Dr. drh. Hj. Sri Subekti B.S., DEA selaku Dekan Fakultas Perikanan dan Kelautan Universitas Airlangga Surabaya.
2. Ibu Rahayu Kusdarwati, Ir., M.Kes. dan Bapak Agustono, Ir., M.Kes.
selaku dosen pembimbing pertama dan selaku dosen pembimbing kedua yang selama ini telah memberikan arahan serta bimbingan selama penyusunan skripsi. 3. Bapak Sudarno, Ir., M.Kes., Bapak Dr. M. Anam Al Arif, Drh., M.P dan Bapak
Prayogo, SPi., MP. selaku penguji yang telah bersedia meluangkan waktu untuk menguji serta memberikan masukan dan saran atas perbaikan laporan skripsi ini. 4. Bapak Moch. Amin Alamsjah, Ir., M.Si., Ph.D selaku dosen wali yang telah
memberikan bimbingan dan motivasi bagi saya selama menempuh kuliah.
5. Bapak/Ibu dosen dan staf pendidikan di Fakultas Perikanan dan Kelautan Universitas Airlangga.
6. Ayah dan ibuku yang selalu mendukung segala keputusanku. 7. Rekan-rekan SKI FPK UNAIR
8. Rekan-rekan mahasiswa angkatan 2009.
9. Semua pihak yang membantu dalam penyelesaian skripsi.
10. Dan seluruh rakyat Indonesia yang telah mensubsidi biaya pendidikanku melalui 20% dana APBN untuk pendidikan.
DAFTAR ISI
Halaman
RINGKASAN ... iv
SUMMARY ... v
KATA PENGANTAR ... vi
UCAPAN TERIMA KASIH ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
I PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 3 1.3 Tujuan ... 3 1.4 Manfaat ... 3 II TINJAUAN PUSTAKA ... 4 2.1 Pakan Udang ... 4
2.1.1 Protein Kasar (PK) Pakan ... 5
2.1.3 Penyimpanan Pakan 6
2.2 Jamur ... 7
2.2.1 Jamur pada Pakan Udang ... III KERANGKA KONSEPTUAL DAN HIPOTESIS ... 14
3.1 Kerangka Konseptual Penelitian ... 14
3.2 Hipotesis Penelitian ... 16
IV METODOLOGI PENELITIAN ... 17
4.1 Waktu dan Tempat ... 17
4.2 Materi Penelitian ... 17
4.3 Metode Penelitian ... 18
4.3.1 Rancangan Penelitian ... 18
4.3.2 Prosedur Kerja ... 20
A. Penyimpanan Pakan ... 20
B. Isolasi dan Identifikasi Jamur ... 21
C. Analisis Proksimat ... 22
4.3.3 Parameter Pengamatan ... 23
A. Parameter Utama ... 23
4.3.4 Analisis Data ... 23
V HASIL DAN PEMBAHASAN ... 24
5.1 Hasil ... 24
5.1.1 Identifikasi ... 24
5.2 Pembahasan ... 38
VI SIMPULAN DAN SARAN ... 42
5.1 Simpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Tabel Halaman
1. Kadar Air dan Kerusakan Pakan 7
2. Hasil Identifikasi Jamur pada Penyimpanan Pakan
Komersial dengan Penambahan Volume Air Berbeda 25 3. Rata-rata kandungan berat kering pakan komersial dengan
penambahan volume air berbeda 35
4. . Rata-rata nilai perubahan kandungan protein kasar pakan
DAFTAR GAMBAR
Gambar Halaman
1. Aspergillus sp ... 7
2. Fusarium sp. ... 11
3. Penicillium sp. ... 13
4 Kerangka Konseptual Penelitian ... 15
5. Denah penempatan perlakuan pada (RAL) ... 20
6. Diagram alir penelitian ... 23
7. Koloni Aspergillus flavus ... 27
8. Bagain-bagian Aspergillus flavus secara mikroskopis. ... 28
9. Koloni Aspergillus niger ... 29
10 Bagian-bagian Aspergillus niger secara mikroskopis. ... 30
11. Koloni Aspergillus fumigatus ... 31
12. Bagian-bagian Aspergillus fumigatus secara mikroskopis... 31
13. Koloni Aspergillus candidus ... 32
14. Bagian-bagian Aspergillus candidus secara mikroskopis.. ... 33
15. Koloni Rhizopus oryzae ... 34
16. Bagian-bagian Rhizopus oryzae secara mikroskopis.. ... 34
17. Grafik Rata-Rata Nilai Perubahan Protein Kasar pada Masing-Masing Perlakuan Pakan ... 37
DAFTAR LAMPIRAN
Lampiran Halaman
1. Prosedur Analisis Proksimat ... 50
2. Hasil Uji Proksimat Bahan Kering (BK) dan Protein Kasar (PK) Pakan yang diberi Volume Air yang Berbeda Sebelum Perlakuan Penyimpanan ... 51
3. Perhitungan Perubahan Protein Kasar (PK). ... 54
4. Data glukosa darah selama penelitian ... 56
I PENDAHULUAN
1.1 Latar belakang
Pakan berperan sangat penting pada usaha budidaya perikanan karena bermanfaat untuk memenuhi kebutuhan zat-zat makanan yang diperlukan bagi pertumbuhan, perkembangan dan reproduksi (Suprijatna dkk., 2005). Kebutuhan pakan pada usaha budidaya perikanan dapat mencapai 60-70% dari biaya produksi (Anggraeni dkk., 2010).
Salah satu kendala penyediaan bahan pakan dalam kegiatan budidaya adalah kerusakan bahan pakanselama penyimpanan. Kerusakan bahan pakan selama penyimpanan dipengaruhi oleh interaksi kondisi bahan pakan, kondisi lingkungan dan organisme (mikroorganisme, serangga dan rodenta) perusak kualitas bahan pakan. Kerugian yang ditimbulkan selama penyimpanan akibat interaksi tadi berupa kehilangan berat, penurunan kualitas, peningkatan resiko terhadap kesehatan dan kerugian ekonomis (Suparjo, 2010).
Penanganan pakan dan bahan baku pakan sangat penting bagi ketersediaan nutrisi pakan, sehingga penyimpanan yang tidak baik berujung pada rusaknya kandungan nutrisi. (Sihombing, 2013). Penyimpanan pakan yang baik akan memperpanjang waktu penyimpanan. (Afrianto dan Liviawaty, 2005 dalam Purbaya, 2011). Menurut (Toto dalam Sihombing, 2013) parameter gudang penyimpanan pakan yang baik adalah terhindar dari sinar matahari langsung, terhindar dari hujan dan bocor, temperatur 300C – 340C, kelembaban tidak lebih dari 70%, bebas dari hama kutu dan tikus serta tidak bercampur dengan bahan
kimia seperti pupuk, pestisida atau racun tikus. Pengaturan gudang penyimpanan yang baik adalah harus memiliki catatan stok yang rapi, memiliki jarak antara dinding terhadap tumpukan atau antar tumpukan dan cukup luas untuk mengatur FIFO (First In First Out).
Pada daerah dengan iklim tropis, kecepatan penurunan kualitas pakan berlangsung 10 kali lipat lebih cepat, hal ini disebabkan oleh tingginya curah hujan, serta kelembaban yang tinggi yang mengakibatkan terjadinya peningkatan aktivitas air yang terkandung dalam pakan (Sihombing, 2013).
Berbagai kerusakan bahan pakan yang terjadi selama penyimpanan secara umum disebabkan oleh jamur, serangga dan tikus. Salah satu organisme yang menyebabkan kerusakan bahan pakan adalah jamur. Laju reproduksi dan pertumbuhan organisme ini dipengaruhi oleh kadar air, temperatur dan lama penyimpanan bahan. Tingkat kontaminasi oleh jamur sebagian besar ditentukan oleh suhu penyimpanan dan ketersediaan air dan oksigen. Jamur dapat tumbuh pada kisaran suhu yang luas, tetapi pertumbuhan jamur akan mengalami penurunan seiring dengan penurunan suhu dan ketersediaan air. Interaksi antara suhu dan kandungan air bahan baku juga mempengaruhi tingkat kolonisasi jamur. Perubahan air bahan menjadi fase uap didorong oleh peningkatan suhu (Suparjo, 2010).
Berdasarkan latar belakang permasalahan seperti yang dijelaskan tersebut, maka dilakukan suatu penelitian untuk mengidentifikasi jamur dan analisa protein kasar (PK) akibat pengaruh penyimpanan pakan dengan penambahan volume air yang berbeda.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan diatas maka dapat dirumuskan permasalahan sebagai berikut:
1. Jenis jamur apa saja yang tumbuh pada pakan selama penyimpanan dengan penambahan volume air berbeda?
2. Berapa kandungan protein kasar pada pakan yang ditumbuhi jamur selama penyimpanan dengan kadar air berbeda?
1.3 Tujuan
Tujuan dilaksanakannya penelitian ini yaitu:
1. Mengetahui Jenis jamur yang tumbuh pada penyimpanan pakan dengan penambahan volume air berbeda.
2. Mengetahui kandungan protein kasar pada pakan yang ditumbuhi jamur pada penyimpanan dengan penambahan volume air berbeda.
1.4 Manfaat
Manfaat yang diharapkan dari hasil penelitian ini yaitu dapat dijadikan data untuk melakukan pencegahan penyebaran jamur yang tumbuh pada pakan selama penyimpanan di gudang budidaya. Dapat dijadikan pertimbangan untuk metode penyimpanan pakan agar tidak mengalami kerugian yang besar akibat jamur tersebut.
II TINJAUAN PUSTAKA
2.1 Pakan Udang
Pakan berperan sangat penting pada usaha budidaya perikanan karena bermanfaat untuk memenuhi kebutuhan zat-zat makanan yang diperlukan bagi pertumbuhan, perkembangan dan reproduksi (Suprijatna dkk., 2005). Menurut Tangendjaja dan Wina (2008), pada budidaya perikanan secara intensif peranan pakan sangat penting karena sebagian besar biaya operasional digunakan untuk pembelian pakan, dan sebagai pengganti pakan alami, pakan buatan harus memiliki kandungan gizi lengkap yaitu sumber kalori, protein, vitamin dan mineral yang sesuai dengan jenis ikan yang dibudidayakan.
Pakan dapat digolongkan menjadi dua macam, yaitu pakan alami dan pakan buatan. Pakan alami merupakan makanan yang tumbuh di alam tanpa campur tangan manusia secara langsung, misalnya plankton dan tumbuhan air. Sedangkan pakan buatan merupakan makanan yang dibuat dari campuran bahan-bahan alami atau bahan-bahan olahan yang selanjutnya dilakukan proses pengolahan serta dibuat dalam bentuk tertentu (Djarijah, 1995). Asal bahan pakan buatan terdiri dari bahan organik dan anorganik. Bahan organik yang terkandung dalam bahan pakan antara lain, protein, lemak, serat kasar, bahan ekstrak tanpa nitrogen, sedang bahan anorganik yang dimaksud seperti kalsium, phospor, magnesium, kalium, natrium dan lain sebagainya (Kartasudjana, 2001). Dalam budidaya udang dibutuhkan pakan buatan dengan kadar protein tinggi. Menurut Balai Budidaya
Air Payau Situbondo (2006) menyatakan bahwa, kebutuhan protein pada udang vannamei sebesar 32-38%.
2.1.1 Protein Kasar (PK) Pakan
Protein adalah senyawa organik kompleks dan merupakan protoplasma aktif dalam semua sel hidup baik hewan maupun tumbuhan. Protein adalah sumber asam-asam amino yang mengandung unsur C, H, O dan N yang tidak dimiliki oleh lemak atau karbohidrat (Budianto, 2009). Protein pada pakan berasal dari hewani (tepung ikan, tepung daging, tepung darah dan tepung tulang), kacang-kacangan atau leguminosa (kacang tanah, kedelai, turi, gamal dan lamtoro), bungkil (bungkil dari kelapa, kelapa sawit, kedelai, kacang, kapok, kapas dan jagung) (Hartadi dkk., 1997).
Protein kasar adalah nilai hasil bagi dari total nitrogen ammonia dengan faktor 16% (16/100) atau hasil kali dari total nitrogen ammonia dengan faktor 6,25 (100/16). Faktor 16% berasal dari asumsi bahwa protein mengandung nitrogen 16%. Kenyataannya nitrogen yang terdapat di dalam pakan tidak hanya berasal dari protein saja tetapi ada juga nitrogen yang berasal dari senyawa bukan protein atau nitrogen nonprotein (non–protein nitrogen / NPN). Nilai yang diperoleh dari perhitungan tersebut merupakan nilai dari apa yang disebut protein kasar (Kamal, 1994).
2.1.2 Bahan Kering (BK) Pakan
Bahan kering adalah bahan yang tersisa setelah bahan pakan dipanaskan 105°C selama beberapa waktu sehingga kadar airnya menguap, setelah pemanasan tersebut sampel makanan disebut sampel bahan kering dan pengurangannya
disebut persen air atau kadar air. Bahan kering dibagi menjadi dua bagian yaitu bahan kering sebagian (Partial Dry Matter) dan bahan kering bebas air (Dry Matter). Prinsip dari bahan kering sebagian yaitu sebagian air diuapkan sampai kadar air bahan maksimal mencapai 14%, sedangkan bahan kering bebas air yaitu semua air diuapkan sampai kadar bahan air 0%. Bahan kering bebas air digunakan sebagai bahan analisis proksimat lebih lanjut, untuk perhitungan pembandingan nilai nutrisi antar pakan, dan kepadatan suatu pakan. Sampel bahan pakan yang sudah dipanaskan disebut sampel bahan kering dan penguapannya dengan sampel bahan pakan tersebut disebut persen air atau kadar air (Tillman dkk, 1998).
Interaksi suhu dan kadar air yang meningkat memacu perkembangan dan pertumbuhan kapang. Pengaruh terhadap bahan pakan adalah penurunan kualitas akibat perubahan komposisi dan serangan kapang yang makin meningkat (Suparjo, 2010).
Tabel 1. Kadar Air dan Kerusakan Pakan Kadar Air (%) Jenis Kerusakan
<8 Kerusakan oleh serangan tikus
8-14 Kerusakan oleh serangan serangga dan tikus
14-28 Kerusakan oleh serangan serangga, jamur dan tikus 20-25 Kerusakan oleh serangan serangga, jamur, bakteri, tikus Sumber: (Suparjo, 2010)
2.1.3 Penyimpanan Pakan
. Penyimpanan pakan yang baik akan memperpanjang waktu penyimpanan. Pakan yang terkena air akan menyebabkan kandungan nutrisinya berkurang, aroma berubah, dan berjamur. Pakan yang terlalu lama terkena sinar
matahari juga tidak baik karena kandungan vitamin C-nya akan rusak (Afrianto dan Liviawaty, 2005 dalam Purbaya, 2011).
Menurut Toto (2008) dalam Sihombing (2013), parameter gudang penyimpanan pakan yang baik adalah terhindar dari sinar matahari langsung, terhindar dari hujan dan bocor, temperatur 30– 34 oC, kelembaban tidak lebih dari 70%, bebas dari hama kutu dan tikus serta tidak bercampur dengan bahan kimia seperti pupuk, pestisida atau racun tikus. Untuk layout atau desain gudang penyimpanan, yang baik adalah cukup luas untuk mengatur FIFO (First In First Out). Gudang penyimpanan harus memiliki catatan stok yang rapi dan cukup jarak antara dinding terhadap tumpukan atau antar tumpukan.
2.2 Jamur
Berdasarkan struktur tubuhnya, jamur digolongkan ke dalam tumbuhan tingkat rendah (Thallophyta), tetapi jika dilihat dari ada tidaknya klorofil maka jamur dikelompokkan tersendiri, tidak dijadikan satu kelompok dengan tumbuhan yang lain (Budhisma, 2013).
Jamur memerlukan oksigen untuk hidupnya (bersifat aerobik). Habitat (tempat hidup) jamur terdapat pada air dan tanah. Cara hidupnya bebas atau bersimbiosis, tumbuh sebagai saprofit atau parasit pada tanaman, hewan dan manusia (Sumarsih, 2003).
Jamur mendapatkan makanan secara heterotrof dengan mengambil makanan dari bahan organik. Bahan organik disekitar tempat tumbuhnya diubah menjadi molekul sederhana dan diserap langsung oleh hifa, oleh karena itu jamur
tidak seperti organisme heterotrof lainnya yang menelan makanan kemudian mencernanya sebelum diserap (Iswanto, 2009).
Setiap jamur memerlukan tingkat kadar air dan temperatur yang spesifik untuk perkecambahan dan perkembangan. Untuk berkembang jamur akan menghancurkan nutrien dengan bantuan aktivitas enzimnya dan menghasilkan air yang memungkinkan peningkatan kolonisasi (Suparjo, 2010).
2.2.1. Jamur Pada Pakan Udang
Tingkat kontaminasi pakan oleh jamur sebagian besar ditentukan oleh suhu penyimpanan dan ketersediaan air dan oksigen. Jamur dapat tumbuh pada kisaran suhu yang luas, tetapi pertumbuhan jamur akan mengalami penurunan seiring dengan penurunan suhu dan ketersediaan air. Interaksi antara suhu dan kandungan air bahan baku juga mempengaruhi tingkat kolonisasi jamur. Perubahan air bahan menjadi fase uap didorong oleh peningkatan suhu. Akibatnya, kandungan air dan pertumbuhan jamur akan meningkat dengan meningkatnya suhu penyimpanan (Suparjo, 2010). Kontaminasi jamur yang paling banyak ditemukan pada pakan ternak di daerah tropis adalah adalah Aspergillus (Dhand, Joshi dan Jand, 1998). Menurut Suparjo (2010), kapang dari genus Aspergillus, Fusarium dan Penicillium merupakan kontaminan utama dalam pakan yang disimpan.
A. Aspergillus sp.
Menurut Fardiaz (1992), klasifikasi dari Aspergillus sp adalah sebagai berikut : Kingdom : Fungi Divisi : Amastigomycota Kelas : Deutromycetes Ordo : Moniliales Famili : Moniliaceae Genus : Aspergillus Spesies : Aspergillus sp.
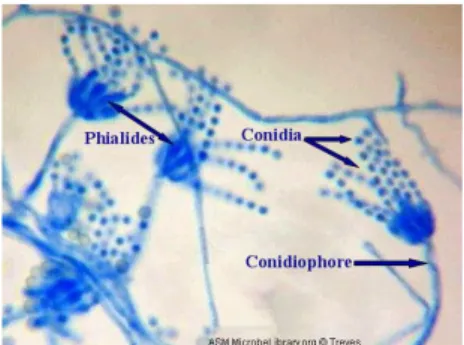
Menurut Sukma dkk. (2010), miselia kapang Aspergillus sp. mulai tumbuh pada hari ke dua inkubasi berupa koloni-koloni kecil yang menyebar pada permukaan media berwarna putih kekuningan. Miselia membentuk koloni lebih luas dan kompak serta berwarna cokelat krem pada hari ke enam. Sumanti dkk. (2003) menyatakan spora Aspergillus sp. berukuran kecil dan ringan, tahan terhadap keadaan kering, memiliki sel kaki yang tidak begitu jelas terlihat, memiliki konidia spora non septa dan membesar menjadi vesikel pada ujungnya dan membentuk sterigmata tempat tumbuhnya konidia.
Konidia dari Aspergillus sp. memiliki ukuran diameter 1,5 – 2,4 µm, berdinding halus, berbentuk panjang hingga elips dan striate. Secara mikrokopis, konidiofor biasanya panjang, kolumnar, tidak berwarna (hialin) dan halus sehingga menimbulkan vesikel bulat biseriate (Balajee, 2009).
Aspergillus sp. memiliki kemampuan untuk memproduksi aksesoris konidia (aleuroconidia) yang tumbuh tunggal dari hifa. Permukaan aleuroconidia mulus tanpa struktur yang berbentuk batang atau tonjolan yang jelas. Percobaan in vitro yang telah dilakukan menunjukkan bahwa aleuroconidia dapat dengan mudah
terlepas dari hifa. Kemampuan aleuroconidia untuk berkecambah dengan cepat ke dalam jaringan hifa invasif dapat menjadi faktor yang mematikan Aspergillus sp, selain dari konidia istirahat dan perkecambahan yang selanjutnya sangat penting untuk pembentukan infeksi (Deak et al., 2009).
Gambar 1. Aspergillus sp. (Tehnologijahrane, 2014) B. Fusarium sp.
Menurut Alexopoulus dan Mims (1979), Fusarium sp. diklasifikasikan sebagai berikut Kingdom : Mycetaceae Divisi : Amastigomycota Kelas : Deuteromycetes Ordo : Famili : Moniales Genus : Fusarium Spesies : Fusarium sp.
Fusarium sp mempunyai 3 alat reproduksi, yaitu mikrokonidia (terdiri dari 1-2 sel), makrokonidia (3-5 septa), dan klamidospora (pembengkakan pada hifa). Makrokonidia berbentuk melengkung, panjang dengan ujung yang mengecil dan mempunyai satu atau tiga buah sekat. Mikrokonidia merupakan konidia bersel 1 atau 2, dan paling banyak dihasilkan di setiap lingkungan bahkan pada saat
patogen berada dalam pembuluh inangnya. Makrokonidia mempunyai bentuk yang khas, melengkung seperti bulan sabit, terdiri dari 3-5 septa, dan biasanya dihasilkan pada permukaan tanaman yang terserang lanjut. Klamidospora memiliki dinding tebal, dihasilkan pada ujung miselium yang sudah tua atau didalam makrokonidia, terdiri dari 1-2 septa dan merupakan fase atau spora bertahan pada lingkungan yang kurang baik (Alexopoulus dan Mims, 1979).
Jamur ini tumbuh dari spora dengan struktur yang menyerupai benang, ada yang mempunyai dinding pemisah dan ada yang tidak. Benang secara individu disebut hifa, dan massa benang yang luas disebut miselium. Miselium adalah struktur yang berpengaruh dalam absorbsi nutrisi secara terus-menerus sehingga cendawan dapat tumbuh dan pada akhirnya menghasilkan hifa yang khusus menghasilkan spora reproduktif (Saragih, 2009).
Jamur Fusarium sp dapat tumbuh dengan baik pada bermacam-macam media agar terutama media yang mengandung ekstrak sayuran. Tahap pertumbuhan awal miselium tidak berwarna, semakin tua warnanya akan semakin krem, hingga koloni tampak mempunyai benang. Pada miselium yang lebih tua terbentuk klamidospora yang berdinding tebal. Jamur membentuk banyak mikrokonidium bersel satu, tidak berwarna, lonjong atau bulat telur, 6-15 x 2,5-4 µm, makrokonidium lebih jarang, berbentuk kumparan, tidak berwarna, kebanyakan bersekat dua atau tiga, berukuran 25-33 x 3,5-5,5 µm (Semangun, 2001).
Gambar 2. Fusarium sp. (Benadof, 2010)
C. Penicillium sp.
Menurut Astriana (2010) Penicillium sp. diklasifikasikan sebagai berikut. Kingdom : Fungi Divisi : Ascomycota Kelas : Eurotiomycetes Ordo : Eorotiales Famili : Trichocomaceae Genus : Penicillium Spesies : Penicillium sp.
Ciri morfologi Penicillium yaitu memiliki hifa bersepta, konidia, sterigma, dan konidiospora (Kurasein, 2009). Kapang Penicillium sp. mempunyai hifa bersepta, miselium bercabang, konidiospora yang muncul di atas permukaan, spora dengan sterigma yang berkelompok, dan konidia membentuk rantai (Fardiaz, 1989). Penicillium sp. pada beberapa spesies, miselium berkembang menjadi sklerotium (Pelczar, 2005).
Kapang Penicillium sp. mempunyai hifa vegetative yang disebut dengan hifa udara (aerial hyphae). Penicillium sp. berkembang biak secara aseksual
disebut askospora dan secara aseksual dengan membentuk konidiospora, yaitu spora yang dihasilkan secara berantai pada ujung suatu hifa (Pohan, 2009). Bentuk sel konidiospora pada kapang Penicillium sp. adalah seperti botol dengan leher panjang atau pendek, jamur ini berwarna hijau kebiruan. Penicillium sp. termasuk jamur yang tidak bersifat patogen kecuali Penicillium marneffei (Gandjar et. al., 2006).
Ada dua macam bentuk Penicillium sp. yang dapat diamati secara makroskopis dan mikrokopis. Secara makroskopis, ciri-ciri yang dapat dilihat adalah koloni tumbuh sekitar 4 hari pada suhu 25oC pada medium saboroud dextrose agar dan koloni mula-mula berwarna putih kemudian akan berwarna kehijauan, sedang secara mikroskopis dengan ciri-ciri yang sapat dilihat adalah hifa bersepta dan konidiofor mempunyai cabang yang disebut dengan metula, di atas metula terdapat fialid (Pohan, 2009).
Pertumbuhan kapang Penicillium sp. dipengaruhi oleh faktor-faktor yang penting, yaitu : substrat, kelmbaban, suhu, dan pH. Penicillium sp. dapat hidup pada kelembaban yang rendah yaitu 80%. Suhu yang optimum untuk pertumbuhannya adalah 25oC (Gandjar e.t al., 2006). Menurut penelitian Indahwati (2009), pH optimum yang dihasilan oleh 25oC berkisar 3,15-4,34.
III KONSEPTUAL PENELITIAN DAN HIPOTESIS
3.1 Kerangka Konseptual
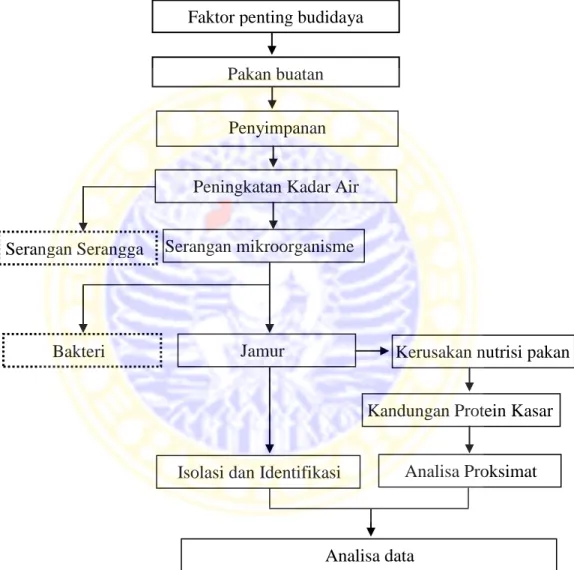
Pakan merupakan salah satu aspek penting dalam setiap aktivitas budidaya akuatik. Pakan menjadi faktor produksi terbesar dan mencapai 50% atau lebih dari total biaya operasional, sehingga perlu dikelola dengan baik agar dapat digunakan secara efisien bagi kultivan. Salah aspek penting dalam pengolaan pakan adalah aspek penyimpanan (Nur, 2011). Peningkatan kadar air dalam proses penyimpanan pakan dapat menyebabkan munculnya faktor-faktor yang dapat menurunkan kualitas pakan. Menurut Suparjo (2010), kadar air pakan diatas 8-14% dapat memicu kerusakan pakan oleh serangga dan tikus. Kadar air pakan diatas 14-28% dapat memicu kerusakan pakan oleh sarangga, jamur dan tikus. Kadar air pakan diatas 20-25% dapat memicu kerusakan pakan oleh serangga, jamur, tikus, dan bakteri. Sedangkan kadar air pakan diatas 25% dapat memicu kerusakan pakan oleh bakteri, tikus, dan tumbuhnya biji.
Tiga hal yang perlu diperhatikan dalam proses penyimpaman, yakni serangga, organisme mikroskopis (bakteri dan jamur) dan perubahan deteriratif, yang akan menyebabkan kehilangan bobot, kualitas, resiko kesehatan dan ekonomis (Sutikno, 2011). Menurut Nur (2011), pakan termasuk produk yang mudah rusak, sehingga perlu disimpan dan ditangani dengan baik untuk menghindari terjadinya hilangnya nutrien tertentu, terjadinya bau tengik, dan tumbuhnya jamur atau kapang. Dampak yang ditimbulkan serangan jamur pada pakan adalah produksi racun mikotoksin oleh jamur, timbulnya panas, naiknya kelembaban (Sutikno, 2011).
Berdasarkan hal tersebut dilakukan penelitian untuk mengidentifikasi jamur dan analisa PK akibat pengaruh penyimpanan dengan kadar air yang berbeda. Berikut kerangka konseptual penelitiannya.
Gambar 4. Kerangka Konseptual Penelitian Keterangan:
:
Faktor penting budidaya
Pakan buatan
Aspek yang diteliti : Aspek yang tidak diteliti
Penyimpanan
Peningkatan Kadar Air
Serangan Serangga alami Serangan mikroorganisme alami Bakteri alami Jamur alami
Kerusakan nutrisi pakan
Kandungan Protein Kasar
Analisa Proksimat Isolasi dan Identifikasi
3.2 Hipotesis
Hipotesis yang diharapkan dari penelitian ini adalah :
H1 : Ditemukan spesies jamur pada penyimpanan pakan dengan kadar air yang berbeda.
H2 : Terdapat perbedaan kandungan protein kasar pada penyimpanan pakan dengan kadar air yang berbeda.
IV METODOLOGI
4.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kering Fakultas Perikanan dan Kelautan, Universitas Airlangga, Surabaya dan analisis proksimat di ujikan di Laboratorium Makan Ternak Fakultas Kedokteran Hewan, Universitas Airlangga, Surabaya. Waktu penelitian dilaksanakan pada April sampai Mei 2013.
4.2 Materi Penelitian 4.2.1 Peralatan Penelitian
Peralatan yang digunakan untuk penyimpanan sampel yaitu plastik untuk kemasan pakan, ember, plastic sealer, sarung tangan karet dan penyemprot air. Peralatan yang digunakan untuk proses identifikasi jamur yaitu mikroskop cahaya, pinset, bunsen, selotip, cawan petri, gunting bedah, pisau bedah, pinset, ose, gelas ukur, object glass, dan autoklaf. Peralatan untuk analisa proksimat meliputi, cawan porselin, cruss tang, eksikator, oven, neraca analitik, labu Kjeldhal, Erlenmeyer, alat destilasi uap, alat titrasi, pemanas labu Kjeldahl, lemari asam, spatula, seperangkat alat marcam steel.
4.2.2 Bahan Penelitian
Bahan yang diperlukan untuk proses identifikasi jamur adalah pakan komersial yang sering digunakan pembudidaya udang vannamei, media SDA (Sabouraud Dextrose Agar), air steril, akuades steril dan kloramfenikol 50 µg/ml.
Bahan yang diperlukan untuk analisa proksimat adalah antara lain aquades, NaOH 4% dan 40%, tablet Kjeldahl, H2SO4, asam borat, indikator Metil-merah, Brom cresol green, silika gel dan HCl.
4.3 Metode Penelitian
4.3.1 Rancangan Penelitian
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL). Kusriningrum (2008) menyatakan bahwa rancangan acak lengkap disebut pula Completely Randomized Design atau Fully Randomized Design dipergunakan apabila media, alat dan bahan percobaan seragam atau dapat dianggap seragam. Rancangan Acak Lengkap hanya terdiri dari satu sumber keragaman, sehingga hasil perbedaan antar perlakuan hanya disebabkan oleh pengaruh perlakuan. Model matematika untuk Rancangan Acak Lengkap adalah sebagai berikut :
Yij = µ + τi + εij Keterangan :
i = 1,2,3,…..t j = 1,2,3,…..n
Yij = nilai pengamatan pada perlakuan ke-i ulangan ke-j µ = nilai tengah umum
τi = pengaruh perlakuan ke-i
εij = pengaruh galat atau acak percobaan (kesalahan percobaan) pada (t = banyaknya perlakuan, n = banyaknya ulangan)
Kusriningrum (2008) menyatakan bahwa ulangan adalah banyaknya kali atau frekuensi suatu macam perlakuan yang dicobakan dalam suatu percobaan. Federer (1974) dalam Kusriningrum (2008) menyatakan hubungan antara perlakuan dan ulangan adalah :
t (n-1) ≥ 15
Keterangan : t = banyaknya perlakuan; n = banyaknya ulangan
Rancangan percobaan ini terdiri atas lima perlakuan yaitu P0, P1, P2, P3, dan P4 yang diulang sebanyak empat kali sehingga terdapat 20 satuan percobaan, yaitu:
P0.1, P0.2, P0.3, P0.4, P1.1, P1.2, P1.3, P1.4, P2.1, P2.2, P2.3, P2.4, P3.1, P3.2, P3.3, P3.4, P4.1, P4.2, P4.3 dan P4.4.
Berdasarkan hasil penelitian pendahuluan yang menunjukkan bahwa BK pakan 90,95%. Untuk meningkatkan kadar air pakan sampai pada kondisi kadar air yang yang cocok untuk pertumbuhan jamur, dalam penelitian ini dilakukan perlakuan sebagai berikut:
P0 : Campuran 100 gr Pakan + 0 ml air P1 : Campuran 100 gr Pakan + 5 ml air. P2 : Campuran 100 gr Pakan + 10 ml air. P3 : Campuran 100 gr Pakan + 15 ml air. P4 : Campuran 100 gr Pakan + 20ml air.
Penempatan perlakuan-perlakuan ke dalam tempat percobaan setelah dilakukan pengacakan sebagaimana tergambar pada denah berikut (Gambar 4).
Gambar 5. Denah penempatan perlakuan pada (RAL) Keterangan: P1.1 artinya perlakuan P1 ulangan 1 dst.
4.3.2 Prosedur Kerja
Penelitian ini dilakukan dalam 3 tahap yaitu a) penyimpanan pakan dengan penambahan air berbeda b.) isolasi dan identifikasi jamur pada pakan c.) analisis proksimat kandungan PK pakan. Langkah-langkah penelitian ini sebagai berikut: A. Penyimpanan Pakan
Tiap sampel pakan terlebih dahulu dipastikan dalam kondisi fisik yang baik dan steril, kemudian setiap sampel perlakuan diisi pakan udang seberat 100gr. Pakan ditingkatkan kuantitas airnya dengan lima dosis yang berbeda dengan empat kali pengulangan, suhu ruangan diatur pada suhu 25oC, kemudian disimpan dalam kemasan plastik selama 4 hari. Hasil penelitian pendahuluan menunjukkan bahwa pakan yang disimpan dengan kadar air yang telah dinaikkan diatas 10% akan ditumbuhi jamur pada hari ke 4.
P2.1 P4.2 P0.1 P1.4 P3.1
P1.3 P4.4 P2.2 P0.3 P3.3
P0.2 P1.2 P4.3 P3.2 P2.3
B. Isolasi dan Identifikasi Jamur
Media SDA (Sabouraud Dextrose Agar) merupakan media yang digunakan utuk mengisolasi jamur. Tahap awal dari persiapan media ini adalah sterilisasi peralatan yang akan digunakan. Sterilisasi merupakan suatu proses untuk mematikan atau menghilangkan semua jasad renik yang ada, sehingga jika ditumbuhkan di dalam suatu medium tidak ada lagi jasad renik yang dapat berkembang biak (Idafi, 2009).
Sebelum dilakukan proses isolasi jamur, pakan yang telah ditumbuhi jamur terlebih dahulu di homogenkan dengan dilakukan pengadukan sampai merata dan penggerusan. Menurut Marlia (2014), bagian batch yang diambil sampelnya untuk pengujian harus mewakili batch tersebut.
Jamur diisolasi menggunakan pinset dan kemudian ditanam pada media SDA (Saboraud Dextrose Agar) kemudian diinkubasi pada suhu 25oC selama 2-7 hari dan selanjutnya diidentifikasi di laboratorium (Gandjar dkk, 2006). Sampel yang diinokulasi pada media SDA (Saboraud Dextrose Agar) merupakan campuran dari berbagai macam isolat jamur dan tidak jarang terkontaminasi oleh bakteri. Oleh karena itu untuk mempermudah identifikasi maka isolat tersebut dimurnikan. Proses pemurnian dimulai dengan mengambil satu jenis koloni menggunakan ose pada media SDA lama yang memiliki warna dan tekstur sejenis kemudian diisolasi pada media SDA baru dan diinkubasi pada suhu 25oC selama 2-7 hari untuk mendapatkan isolat murni.
Jamur yang sudah dimurnikan siap untuk dilakukan identifikasi. Pengamatan isolat jamur dimulai dengan menyiapkan object glass kemudian
ditetesi dengan larutan lactophenol blue sebanyak satu tetes. Kemudian dengan selotip secukupnya lalu ditempelkan pada jamur yang tumbuh pada media. Selotip yang tertempel jamur tersebut, ditempelkan pada object glass yang sudah ditetesi dengan lactophenol blue lalu diamati di bawah mikroskop dengan pembesaran 100 dan 400X dan jamur yang terlihat dapat diidentifikasi (Balai Karantina Ikan, 2011).
Identifikasi jamur menggunakan teknik identifikasi secara konvensional yang meliputi dua tahap yaitu pengamatan fungi secara makroskopis dan mikroskopis. Pengamatan secara makroskopis meliputi bentuk koloni dan warna koloni sedangkan pengamatan secara mikroskopos meliputi bentuk hifa, bentuk spora, letak spora dan identifikasi dilakukan menurut prosedur identifikasi Post (1987) dan Murray et al. (2007).
C. Analisis Proksimat
Analisa Proksimat yang dilakukan adalah analisa bahan kering (BK) dan protein kasar (PK) pakan saat sebelum perlakuan penyimpanan dan sesudah perlakuan penyimpanan. Hal ini berguna untuk mengetahui %pengurangan kadar BK dan PK sebelum penyimpanan (sebelum tumbuh jamur) dan sesudah perlakuan penyimpanan (sudah tumbuh jamur).
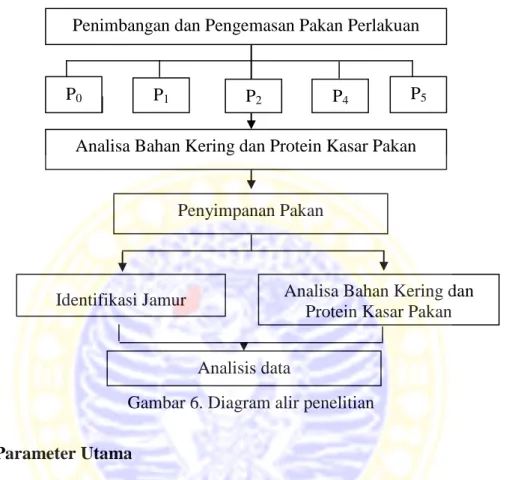
Penelitian ini dapat disajikan dalam diagram alur penelitian seperti pada Gambar 6 berikut.
Gambar 6. Diagram alir penelitian
4.3.4 Parameter Utama
Parameter yang diamati dalam penelitian ini adalah jenis jamur yang tumbuh pada penyimpanan pakan dengan penambahan volume air berbeda dan perubahan nilai protein kasar pada pakan.
4.3.5 Analisis Data
Hasil identifikasi jamur dianalisis menggunakan metode deskriptif. Metode analisis yang menggambarkan fakta-fakta sebagaimana adanya (Sangadji, 2010). Data persentase perubahan protein kasar pakan dianalisis dengan analisis varian (Anova) untuk kemudian dilajutkan dengan uji jarak berganda Duncan bila data yang didapat menunjukkan perbedaan nyata.
Penimbangan dan Pengemasan Pakan Perlakuan
Analisa Bahan Kering dan Protein Kasar Pakan
P0 P1 P2 P4 P5
Penyimpanan Pakan
Identifikasi Jamur Analisa Bahan Kering dan Protein Kasar Pakan
BAB V HASIL DAN PEMBAHASAN
5.1 Hasil
5.1.1 Identifikasi
Identifikasi bertujuan untuk mengetahui jenis jamur yang tumbuh pada pakan udang yang disimpan dalam berbagai tingkat penambahan volume air. Identifikasi pada fungi dilakukan dengan pemeriksaan secara makroskopis dan mikroskopis (Ronald and Richard, 2000). Pengamatan secara makroskopis pada penelitian ini diawali dengan menanam sampel pakan yang telah disimpan dengan peningkatan kadar air berbeda pada media SDA yang telah disterilisasi dengan pemberian antibiotik penicillin dan streptomycin. Menurut Idafi (2009), Sterilisasi merupakan suatu proses untuk mematikan atau menghilangkan semua jasad renik yang ada, sehingga jika ditumbuhkan di dalam suatu medium tidak ada lagi jasad renik yang dapat berkembang biak.
Hasil pengamatan secara makroskopis dan mikroskopis pada penelitian ini mendapatkan lima macam isolat murni koloni fungi yang disajikan pada tabel 4. Isolat murni pertama berwarna hijau tua dengan bentuk koloni granular dan kompak, isolat murni yang ke dua berwarna hitam dengan dengan bentuk koloni granular dan kompak, isolat murni yang ke tiga berwarna hijau muda dengan bentuk koloni granular dan kompak, isolat murni yang ke empat berwarna putih dengan dengan bentuk koloni granular dan kompak, sedangkan isolat murni yang ke lima berwarna putih-abu-abu dengan dengan bentuk koloni seperti kapas.
Pengamatan mikroskopis dalam penelitian ini dilakukan dengan metode selotip untuk mendapatkan sampel struktur jamur yang baik dan dapat diamati. Pengamatan menggunakan mikroskop dengan perbesaran 400 untuk dapat mengamati struktur hifa serta organ reproduksi jamur secara jelas (Balai Karantina Ikan, 2011).
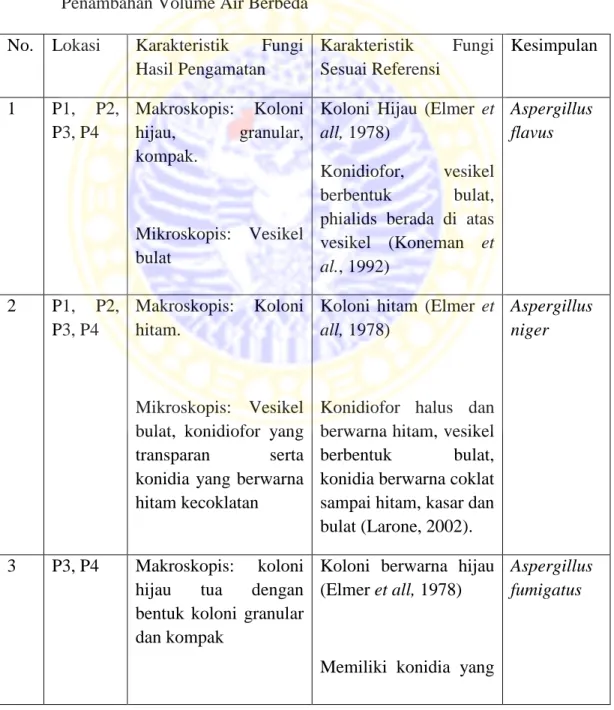
Tabel 2. Hasil Identifikasi Jamur pada Penyimpanan Pakan Komersial dengan Penambahan Volume Air Berbeda
No. Lokasi Karakteristik Fungi Hasil Pengamatan Karakteristik Fungi Sesuai Referensi Kesimpulan 1 P1, P2, P3, P4 Makroskopis: Koloni hijau, granular, kompak. Mikroskopis: Vesikel bulat
Koloni Hijau (Elmer et all, 1978)
Konidiofor, vesikel berbentuk bulat, phialids berada di atas vesikel (Koneman et al., 1992) Aspergillus flavus 2 P1, P2, P3, P4 Makroskopis: Koloni hitam. Mikroskopis: Vesikel bulat, konidiofor yang transparan serta konidia yang berwarna hitam kecoklatan
Koloni hitam (Elmer et all, 1978)
Konidiofor halus dan berwarna hitam, vesikel berbentuk bulat, konidia berwarna coklat sampai hitam, kasar dan bulat (Larone, 2002).
Aspergillus niger
3 P3, P4 Makroskopis: koloni hijau tua dengan bentuk koloni granular dan kompak
Koloni berwarna hijau (Elmer et all, 1978)
Memiliki konidia yang
Aspergillus fumigatus
Mikroskopis:
Vesikel, dan konidia.
melekat pada vesikel.
(Elmer et all, 1978)
4 P1, P4 Makroskopis: Koloni putih
Mikroskopis:
Hifa tidak bersepta dan vesikel yang bulat.
Koloni yang berwarna putih sampai krem (Murray et al., 1995). Konidiofor tidak berwarna, memiliki vesikel yang berbentuk bulat, memiliki konidia bulat dan halus (Murray et al., 1995). Aspergillus candidus 5 P3 Makroskopis: Koloni abu-abu, seperti kapas, memenuhi cawan petri
Mikroskopis:
Sporangium berbentuk bulat
Koloni mengisi seluruh cawan petri dengan miselium berwarna abu-abu dan sporangium kecil berwarna abu-abu (Indonesian mycology, 2014) Sporangium membulat yang pada awalnya berwarna putih kemudian menjadi hitam agak kelabu pada
waktu matang
(Indonesian mycology, 2014)
Rhizopus oryzae
1. Aspergillus flavus
Menurut Samson and Pitt (2000), klasifikasi Aspergillus flavus adalah sebagai berikut: Phylum : Ascomycota Class : Eurotiomycetes Ordo : Eurotiales Family : Trichocomaceae Genus: Aspergillus
Spesies : Aspergillus flavus
Hasil pengamatan secara makroskopis menunjukkan bahwa Aspergillus flavus memiliki ciri-ciri yaitu, koloni berwarna hijau muda dengan dengan bentuk koloni granular dan kompak. Hal ini sesuai dengan Elmer et all (1978) yang mengatakan, pada isolate murni dalam media SDA Aspergillus flavus memiliki koloni berwarna hijau kekuningan atau kuning kecoklatan, Koloni Aspergillus flavus dapat dilihat pada gambar 7.
Gambar 7. Koloni Aspergillus flavus
Secara mikroskopis Aspergillus flavus memiliki ciri-ciri yaitu, memiliki vesikel yang berbentuk bulat. Hal ini sesuai dengan Koneman et al. (1992) yang menyatakan bahwa Aspergillus flavus memiliki konidiofor, vesikel berbentuk bulat, phialids berada di atas vesikel dan memiliki konidia yang bulat, halus atau
kasar. Bagian-bagian Aspergillus flavus secara mikroskopis dapat dilihat pada gambar 8.
Gambar 8. Bagain-bagian Aspergillus flavus secara mikroskopis. Keterangan: (a). Vesikel; (b). Konidia
2. Aspergillus niger
Menurut Zhao et al. (2009), klasifikasi Aspergillus niger adalah sebagai berikut: Phylum : Ascomycota Class : Eurotiomycetes Ordo : Eurotiales Family : Trichomaceae Genus : Aspergillus Spesies : Aspergillus niger
Hasil pengamatan secara makroskopis menunjukkan bahwa Aspergillus niger memiliki ciri-ciri yaitu, memiliki koloni yang berwana hitam. Hal ini sesuai dengan Elmer et all (1978) yang mengatakan, pada isolat murni dalam media SDA Aspergillus flavus memiliki koloni berwarna hitam. Koloni dari Aspergillus niger dapat dilihat pada gambar 9.
a
Gambar 9. Koloni Aspergillus niger
Secara mikroskopis Aspergillus niger memiliki ciri-ciri yaitu, memiliki vesikel yang berbentuk bulat, konidiofor yang transparan serta konidia yang berwarna hitam kecoklatan. Hal ini sesuai dengan Larone (2002) yang menyatakan bahwa Aspergillus niger memiliki konidiofor halus dan berwarna hitam, memiliki vesikel yang berbentuk bulat, memiliki konidia yang berwarna coklat sampai hitam, kasar dan bulat. Bagian-bagian Aspergillus niger secara mikroskopis dapat dilihat pada gambar 10.
c
Gambar 10. Bagian-bagian Aspergillus niger secara mikroskopis. Keterangan: (a). Konidia; (b). Vesikel
3. Aspergillus fumigatus
Menurut Bennett dan Klich (1992)., klasifikasi Aspergillus fumigatus adalah sebagai berikut:
Kingdom : Fungi Phylum :Ascomycota Class :Ascomycetes Order :Eurotiales Family :Trichocomaceae Genus : Aspergillus
Species : Aspergillus fumigatus
Hasil pengamatan secara makroskopis menunjukkan bahwa Aspergillus fumigatus memiliki ciri-ciri yaitu, memiliki koloni yang berwarna hijau tua dengan bentuk koloni granular dan kompak. Hal ini sesuai dengan Elmer et all (1978) yang mengatakan, pada isolat murni dalam media SDA Aspergillus fumigatus memiliki koloni berwarna hijau. Koloni dari Aspergillus niger dapat dilihat pada gambar 11.
b
a
Gambar 11. Koloni Aspergillus fumigatus
Hasil pengamatan mikroskopis menunjukkan terdapat ciri-ciri berupa vesikel, dan konidia. Hal ini sesuai dengan pendapat Elmer et all (1978), Aspergillus memiliki karakteristik dengan memiliki rantai oval kecil konidia yang melekat pada ujung satu atau dua baris sterigmata yang teratur melingkar pada permukaan ujung conidiophore yang disebut vesikel.
Gambar 12. Bagian-bagian Aspergillus fumigatus secara mikroskopis. Keterangan: (a). Konidia; (b). Vesikel
4. Aspergillus candidus
Menurut Samson and Pitt (2000), klasifikasi Aspergillus candidus adalah sebagai berikut: Phylum : Ascomycota Class : Eurotiomycetes Ordo : Eurotiales Family : Trichocomaceae Genus : Aspergillus
Spesies : Aspergillus candidus
Hasil identifikasi yang telah dilakukan Aspergillus candidus secara makroskopis memiliki ciri-ciri yaitu, memiliki koloni yang berwarna putih dengan bentuk koloni granular dan kompak. Hal ini sesuai dengan Murray et al. (1995) yang menyaatakan bahwa Aspergillus candidus merupakan jamur yang memiliki ciri koloni yang berwarna putih sampai krem. Koloni dari Aspergillus candidus dapat dilihat pada gambar 13.
Gambar 13. Koloni Aspergillus candidus
Secara mikroskopis Aspergillus candidus memiliki ciri yaitu memiliki hifa tidak bersepta dan vesikel yang bulat. Hal ini sesuai dengan Murray et al. (2007) yang menyatakan bahwa Aspergillus candidus secara mikroskopis memiliki ciri yaitu, memiliki konidiofor tidak berwarna, memiliki vesikel yang berbentuk bulat,
memiliki konidia bulat dan halus. Bagian-bagian Aspergillus candidus secara mikroskopis dapat dilihat pada gambar 14.
Gambar 14. Bagian-bagian Aspergillus candidus secara mikroskopis. Keterangan: (a). Konidia; (b). Vesikel
5. Rhizopus oryzae
Menurut Plantamor (2012), klasifikasi Rhizopus oryzae adalah sebagai berikut:
Kingdom :Fungi
Order : Mucorales
Family :Mucoraceae
Genus : Rhizopus
Spesies : Rhizopus oryzae
Hasil identifikasi yang telah dilakukan Rhizopus oryzae secara makroskopis memiliki ciri-ciri yaitu, memiliki koloni berwarna putih-abu-abu dengan dengan bentuk koloni seperti kapas yang memenuhi cawan petri.. Hal ini sesuai dengan Indonesian mycology (2014), Rhizopus oryzae memiliki koloni yang mengisi seluruh cawan petri dengan miselium berwarna abu-abu dan
b
a
sporangium kecil berwarna abu-abu. Koloni dari Aspergillus candidus dapat dilihat pada gambar 15.
Gambar 15. Koloni Rhizopus oryzae
Sedangkan pengamatan secara mikroskopis menunjukkan ciri-ciri berupa adanya sporangium yang berbentuk bulat. Hal ini sesuai dengan pendapat Indonesian mycologi (2014), Rhizopus oryzae memiliki sporangium membulat yang pada awalnya berwarna putih kemudian menjadi hitam agak kelabu pada waktu matang.
Gambar 16. Bagian-bagian Rhizopus oryzae secara mikroskopis.
b
5.1.2 Analisis Proksimat
Hasil analisis proksimat kandungan berat kering pakan komersial yang telah ditambahkan air dengan volume berbeda dapat dilihat pada Lampiran 2. rata-rata kandungan berat kering pakan dapat dilihat pada Tabel 3.
Tabel 3. Rata-rata kandungan berat kering pakan komersial dengan penambahan volume air berbeda.
Sampel BK Rata-rata (%) Kadar Air Rata-rata (%)
P0 90,1693 9.8307
P1 86.2811 13.7189
P2 84.0379 15.9621
P3 79.8478 20.1522
P4 76.8667 23.1333
Hasil rata-rata kandungan berat kering dari ke lima perlakuan diketahui P0 sebagai control memiliki rata-rata BK 90,1693% sehingga kadar air rata-rata P0 mencapai 9,8307%. P1 menunjukkan rata-rata BK 86.2811% sehingga kadar air rata-rata P1 mencapai 13, 718%, P2 menunjukkan rata-rata BK 84.0379% sehingga kadar air rata-rata P2 mencapai 15.9621%, P3 menunjukkan rata-rata BK 79.8478% sehingga kadar air rata-rata P3 mencapai 20.1522%, dan P4 menunjukkan rata-rata BK 76.8667% sehingga kadar air rata-rata P4 mencapai 23.1333%.
Hasil analisis statistik perubahan nilai bahan kering pada pakan yang diberi perlakuan kadar air yang berbeda dan disimpan selama enam hari, dapat dilihat pada Lampiran 4. Rata-rata perubahan nilai bahan kering menunjukkan
bahwa penambahan volume air yang berbeda memberikan perbedaan yang nyata terhadap perubahan bahan kering pada pakan (p<0.05). Perlakuan tersebut selanjutnya dilakukan Uji Jarak Berganda Dunchan (Duncan’s Multiple Range Test) .
Tabel 4. Rata-rata nilai perubahan kandungan protein kasar pakan komersial dengan penambahan volume air berbeda.
Perlakuan Rata-rata (X) ± SD P0 108.98±0.66b P1 109.85± 2.33b P2 90.27± 1.05c P3 113.54± 2.10a P4 109.18± 2.21b Keterangan : SD= Standar Deviasi Notasi Garis P3 P4 P1 P0 P2 a
Hasil perubahan kandungan protein kasar tertinggi terjadi pada perlakuan P3 sedangkan perubahan kandungan protein kasar terendah terjadi pada perlakuan P2. Dengan demikian perubahan kandungan protein kasar pada perlakuan P2 berbeda nyata terhadap perlakuan P3, P0, P1 dan P4. Perubahan protein kasar
b
b
b
pada perlakuan P3 juga berbeda nyata terhadap perlakuan P1, P4 dan P0. Namun perubahan protein kasar pada perlakuan P1, P4 dan P0 tidak menunjukkan perbedaan yang signifikan antar perlakuan.
108.89 109.85 90.27 113.54 109.18 0 10 20 30 40 50 60 70 80 90 100 110 120 P0 P1 P2 P3 P4 persentase Perubahan Protein Kasar
Gambar 17. Grafik Rata-Rata Nilai Perubahan Protein Kasar pada Masing-Masing Perlakuan Pakan.
Grafik di atas menunjukkan rata-rata nilai perubahan protein kasar pakan yang diberi perlakuan penambahan air yang berbeda dan disimpan selama enam hari. Grafik tersebut menunjukkan perbedaan nilai perubahan protein kasar pakan pada setiap perlakuan.
5.2 Pembahasan
5.2.1 Pengaruh Penyimpanan Pakan Udang dengan Penambahan Volume Air Berbeda Terhadap Pertumbuhan Jamur
Dalam penelitian ini telah terindentifikasi empat spesies Aspergillus (A. niger, A. flavus, A. fumigatus, dan A. candidus) dan satu Spesies Rhizopus oryzae yang menginfeksi pakan komersial yang disimpan dengan perlakuan penambahan volume air yang berbeda. Munculnya spesies Aspergillus pada penyimpanan pakan perlu diwaspadai karena menurut Elmer et all (1978), A. fumigatus, A. Niger, dan A. flavus adalah tiga spesies Aspergillus yang merupakan penghasil toxic dan sering muncul dalam spesimen klinis.
Menurut RHM Technology, 2003 dalam Noor (2006), aflatoksin dihasilkan oleh A. flavus dan beberapa jamur lain, cyclopiazonic acid dapat dihasilkan oleh A. flavus . Aflatoksin yang terdapat pada ikan dapat menyebabkan pertumbuhan ikan menjadi terganggu (Effiong And Alatise, 2009). Gejala klinis ikan yang terinfeksi antara lain, insang pucat, sistem peredaran darah terganggu, sistem kekebalan menurun, anemia, pertumbuhan terganggu dan kurangnya berat badan dan efek jangka panjang menyebabkan tumor dan gangguan pada hati yang berakibat tingginya mortalitas ikan (Russo and Yanong, 2010).
Menurut RHM Technology, 2003 dalam Noor (2006) disebutkan bahwa ochratoksin dapat dihasilkan oleh A. niger, Selain berpotensi menghasilkan toksin, jamur dalam bahan makanan menghasilkan berbagai enzim yang dapat merombak senyawa-senyawa yang terkandung dalam bahan makanan tersebut, sehingga
mempengaruhi kualitasnya terutama apabila disimpan terlalu lama. A. niger dapat menghasilkan enzim amilase, selulase, oksidase, oksidase glukosa, lipase dan pektinase (Frazier dan Westhoff, 1988 dalam Noor, 2006).
Sedangkan A.fumigatus adalah jenis jamur yang dapat menghasilkan gliotoxin yang menyebabkan penyakit aspergillosis (NCBI, 2006). A. flavus dapat menyebabkan alergi pada paru-paru dan menyebarkan aspergillosis (Elmer et all, 1978).
5.2.1 Pengaruh Penyimpanan Pakan Komersial dengan Penambahan Volume Air Berbeda Terhadap Perubahan Kadar Protein Kasar
Perlakuan P0 dengan rata-rata BK 90,1693% dan rata-rata kadar air 9,8307% tidak ditemukan pertumbuhan jamur pada pakan. Hal ini menunjukkan pakan yang memiliki nilai kadar air dibawah 14% bukan merupakan lingkungan yang baik untuk pertumbuhan jamur. Sedangkan perlakuan P1 dengan rata-rata BK 86.2811% dan rata-rata kadar air 13, 718%, perlakuan P2 dengan rata-rata BK 84.0379% dan rata-rata kadar air 15.9621%, perlakuan P3 dengan rata-rata BK 79.8478% dan rata-rata kadar air 20.1522%, dan perlakuan P4 dengan rata-rata BK 76.8667% dan rata-rata kadar air 23.1333% ditemukan pertumbuhan jamur pada pakan. Hal ini sesuai dengan Suparjo (2010) yang mengatakan, munculnya jamur pada pakan mulai terjadi pada pakan dengan kadar air 14%.
Berdasarkan pada Lampiran 4 dapat kita ketahui bahwa penambahan volume air pada pakan komersial dapat mengakibatkan penurunan kadar protein kasar pada sampel yang belum disimpan, sedangkan sampel yang sudah disimpan menunjukan nilai protein kasar yang meningkat. Hal ini menunjukkan bahwa keberadaan jamur pada pakan dapat meningkatkan kandungan protein pada pakan. Hal ini sesuai dengan FAO (1992), dalam Susi (2011), jamur memiliki kandungan protein yang cukup tinggi mencapai 13,8%. Sehingga kandungan protein jamur dapat meningkatkan kadar protein pakan. Selain itu menurut Purwadaria (1998) dalam Haryati (2006), jamur Aspergillus dapat menghasilkan enzim hidrolitik mananase dan selulase yang dapat menurunkan serat kasar dan meningkatkan protein kasar. Menurut LIM et al. (2001) dalam Simon (2006) menyatakan fermentasi bahan pakan dengan menggunakan A. flavus dapat meningkatkan kadar protein kasar. Menurut Lina (2012) R. oryzae mampu meningkatkan kadar protein dan menurunkan kadar HCN dari tepung mocaf. Menurut Sugiyono (2008) dalam Ria (2012), fermentasi A.niger pada ampas sagu dapat meningkatkan kadar protein sebesar 1,9% dalam waktu 12 hari. A. niger secara kultur tunggal sering digunakan dalam pengolahan pakan karena kemampuannya dalam degradasi selulosa maupun pati dan meningkatkan kadar protein.
Berdasarkan hasil uji proksimat protein kasar pada penelitian penyimpanan pakan komersial dengan penambahan volume air berbeda selama 6 hari yang disajikan pada lampiran 4 dan hasil Analisis Varian dan Duncan pada tabel 5 menunjukkan bahwa perbedaan nilai perubahan (penurunan) kadar protein kering pada penelitian ini signifikan. Dengan perlakuan P3 dengan perubahan
kadar protein tertinggi sedangkan P2 dengan perubahan kadar protein terendah. Pada perlakuan P3 teridentifikasi empat spesies jamur yaitu A. niger, A. flavus, A fumigatus, dan R. oryzae. Sedangkan pada perlakuan P2 hanya teridentifikasi dua spesies jamur yaitu A. niger dan A. flavus.
VI KESIMPULAN DAN SARAN
6.1. Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa:
a. Jamur yang tumbuh pada pakan komersial yang disimpan dengan perlakuan penambahan volume air berbeda adalah Aspergillus flavus, Aspergillus niger, Aspergillus fumigatus, Aspergillus candidus dan Rhizopus oryzae.
b. Perubahan kandungan protein kasar pada penyimpanan pakan komersial dengan perlakuan penambahan volume air berbeda menunjukkan perbedaan yang sangat signifikan. Perlakuan P3 menunjukkan perubahan kandungan PK tertinggi, sedangkan perlakuan P2 menunjukkan perubahan kandungan PK terrendah.
6.2 Saran
Saran yang dapat diberikan penulis yaitu perlu dilakukan penelitian mengenai tingkat kandungan nutrisi serta patogenitas dari masing-masing spesies sehingga diperoleh data yang dapat digunakan untuk meningkatkan nutrisi pakan tanpa terkendala masalah toksik pada jamur.
DAFTAR PUSTAKA
Anggraeni, H. S., R. R. P. Fasa dan U. K. Alma’rufah. 2010. Inovasi Pengolahan Limbah Tepung (ampas ketela) menjadi Pelet sebagai Makanan Alternatif pada Ikan. http://community.um.ac.id. Diakses 17 Desember 2013. 10 hal. Alexopoulos, C. J. and C. W. Mims. 1979. Introductory Mycology. Third Edition.
John Wiley and Sons. New York.
Ana, A. 2009. Biosolubilisasi Batubara Hasil Iradiasi Gamma. dalam Berbagai Dosis oleh Kapang Penicillium sp. Program studi Biologi. Fakultas Sains dan Teknologi. Universitas Negeri Jakarta.
Balai Budidaya Air Payau (BBAP) Situbondo. 2006. Pembenihan Udang Vannamei. Departemen Kelautan Perikanan. Situbondo. 67 hal.
Balai Karantina Ikan. 2011. Teknik Identifikasi Jamur Metode Selotip. Balai Karantina Ikan Kelas II. Tanjung Emas. Semarang.
Balajee, M.S. 2009. Aspergillus terreus complex. Medical Mycology. 47: S42 – S46.
Benadof, D. F. 2010. Fusarium especie. Revista Chilena Infectologiaa 27 (4): 327-328
Bennett, J.W. and M.A. Klich. 1992. Aspergillus fumigatus. University of Wisconsin.http://bioweb.uwlax.edu/bio203/s2008/miller_melo/Classificati on.htm. Diakses 20 Juni 2014
Budianto, A.K. 2009. Dasar-Dasar Ilmu Gizi. Cetakan keempat. Malang : Penerbit Universitas Muhammadiyah Malang Press.
Deak, E., Wilson S.D, White E, Carr J.H., and Balajee S.A. 2009. Aspergillus terreus accessory conidia are unique in surface architecture, cell wall composition and germination kinetics. Plos One 4: e7673.
Dhand, N.K., D.V. Joshi, and S.K. Jand. 1998. Fungal contaminants of dairy feed and their toxigenicity. Indian Journal of Animal Sciences 68: 1095-1096. Djarijah, A. S. 1995. Pakan Ikan Alami. Kanisius. Yogyakarta.
Elmer, W.K., Glenn, D.R., and Sara, E.W. 1978. Practical Laboratory Mycologi 2nd Edition. The Williams and wilkins co. United States of Amerika. 7-96p Effiong, B. N., and S. P. Alatise. 2009. Effect Of Mold Infested Feeds On The
Growth And Survival Of Heterobranchus longifilis Fingerlings. Report and Opinion 1(3):9-14.
Erna J. dan Iis A. 2013. Optimasi Penambahan Nutrient terhadap Kadar Protein pada Fermentasi Padat Kulit Umbi Ubi Kayu Menggunakan Response
Survace Method. Jurusan Teknik Kimia. Fakultas Teknik. Universitas Diponegoro. Semarang.
Fardiaz, S. 1992. Mikrobiologi Pangan 1. PT Gramedia Pustaka Umum.Jakarta. hal 35-37.
Gandjar, I. 2008. Subbituminous Coal. http://www.rzfarland.com. 25 Februari 2014. hal 1
Gandjar, K., W. Sjamsurizal dan A. Oetari. 2006. Mikologi Dasar dan terapan. Yayasan Obor Indonesia. Jakarta. 237 Hal
Hartadi, H., S. Reksohadiprodjo, dan A.D. Tillman. 1997. Komposisi Pakan Untuk Indonesia. Gadjah mada University Press. Yogyakarta.
Haryati, T., Togatorop, M.H., Sinurat, A.P., Purwadaria, T. Dan Murtiyeni. 2006. Pemanfaatan Bungkil Kelapa Fermentasi dengan Aspergillus niger dalam Ransum Ayam Pedaging. Balai Penelitian Ternak. Bogor.
Idafi, M. 2009. Sterilisasi dan Pembuatan Medium Mikroba. Program Studi Teknik Lingkungan. Fakultas Teknik. Universitas Lambung Mangkurat. Banjarbaru. http:// www.scribd.com/doc/24542047/Sterilisasi-Dan-Pembuatan-Medium-Mikro bia-Dafi017. Diakses pada tanggal 21 Desember 2011.
Indahwati, E. 2009. Degradasi Batubara Subbituminus Asal Kalimantan Timur Menggunakan Fungi Aspergilus sp. dan Penicillium sp. Skripsi Sarjana Biologi. Universitas Islam Negeri Syahid. Jakarta.
Indonesian Mycology. 2014. Rhizopus oryzae. pp1. http://203.130.231.174:1107/GST/src/Html/Indonesian/I_Mycology/I_RH IZOPUS.HTM. Diakses 20 Juni 2014.
Iswanto, A. H. 2009. Identifikasi Jamur Perusak Kayu. Karya Tulis. Depertemen Kehutanan. Fakultas Pertanian. Universitas Sumatra Utara. 13 Hal
Kamal, M. 1994. Nutrisi Ternak I. Laboratorium Makanan Ternak. Jurusan Nutrisi dan Makanan Ternak. Fakultas Peternakan. Universitas Gadjah Mada. Yogyakarta.
Kartasudjana, R. 2001. Proses Pemotongan Ternak di RPH. http://125.160.17.21/speedyorari/view.php?file=pendidikan/materi_kejuruan /pertanian/budi_daya_ternak_ruminansia/proses_pemotongan_ternak_di_rph .pdf. 12 November 2012.
Koneman, E. M., S. D. Allen., W. M. Janda., P. C. Schreckenberger., and W. C. Winn. 1992. Color Atlas and Text of Diagnostic Mikrobiology. 4th Edition. United States of America. J.B. Lippincott Company. pp 804
Kuraesin, T., I. Sugoro, M.R. Pikoli, S. Hermanto dan P. Aditiawati. 2009. Isolasi dan Seleksi Fungi Pelaku Solubilisasi Batubara Subbituminus. Jurnal Biologi Lingkungan 3 (2) : 75-87.
Kusriningrum. 2008. Perancangan Percobaan. Airlangga University Press. Surabaya.
Larone, D. H. 2002. Medically Important Fungi. 4th ed. ASM Press. Washington, D.C. pp. 175-266.
Lina I. K., Nur A., Setiyo G., dan Tri W. 2012. Pembuatan Mocaf (Modified Cassava Flour) Dengan Proses Fermentasi Menggunakan Lactobacillus Plantarum, Saccharomyces Cereviseae, Dan Rhizopus Oryzae. Jurusan Teknik Kimia. Fakultas Teknologi Industri. Institut Teknologi Sepuluh Nopember (ITS). Surabaya.
Marlia, S.W. 2014. Prinsip dan Pelaksanaan Pengambilan Sampel. School of Pharmacy. Institut Teknologi Bandung.
Martens, C. and Treves, D. 2005. Penicillium spp. Department of Biology. Indiana University. Southeast New Albany
Medion. 2011. Persoalan Jamur dan Mikotoksin pada Ransum. http://info.medion.co.id/index.php/artikel/broiler/tata-laksana/persoalan-jamur-dan-mitotoksin-pada-ransum. 16 Juli 2013
Murray, P. R., E. J. Baron., J. H. Jorgensen., M. L. Landry., and M. A. Pfaller. 2007. Manual of Clinical Mikrobiology. 9th Edition. ASM Press. Washington, D.C. pp. 1726
NCBI (US National Library of MedicineNational Institutes of Health). 2006. Disruption of a nonribosomal peptide synthetase in Aspergillus fumigatus
eliminates gliotoxin production. pp1.
http://www.ncbi.nlm.nih.gov/pubmed/16757745. Diakses 20 Juni 2014. Noor, S.H. dan Ratna, S. 2006. Identifikasi Jamur dan Deteksi Aflatoxin B1 pada
Petis Udang Komersial. Jurusan Biologi FMIPA Universitas Sebelas Maret. Surakarta. 3 hal
Nur, A. 2011. Manajemen Pemeliharaan Udang Vannamei. Direktorat jenderal perikanan budidaya Balai besar pengembangan budidaya air payau. Jepara Pelczar, M. dan E. C. S. Chan. 1986. Dasar-dasar mikrobiologi. Unversitas
Indonesia. Jakarta. 443 hal.
Pelczar, M.J. dan E.C.S. Chan. 2005. Dasar-Dasar Mikrobiologi. Indonesia University Press. Jakarta.
Plantamor. 2012. Rhizopus oryzae. Article Electronic. pp1. http://plantamor.com/index.php?plant=1621. Diakses 20 Juni 2014.
Pohan, A. 2009. Kapang Penicillium. www.arthur@fk.unair.ac.id. 25 Februari 2014. hal 1