| 647
Kajian Aplikasi Bakteri Endofit Indigenos dalam Meningkatkan
Pertumbuhan dan Mengendalikan
Ralstonia Solanacearum
pada Kentang
Yulmira Yanti
1*, Warnita
2, Reflin
1, Zelly Noffianti
3, Chainur Rahman Nasution
3 1Program Studi Proteksi Tanaman Fakultas Pertanian Universitas Andalas, Padang, 251632Program studi Agroekoteknologi Fakultas pertanian Universitas Andalas Padang, 25163 3Mahasiswa Program Pasca sarjana Universitas Andalas Padang 25163
*Email: yy.anthie79@gmail.com
ABSTRAK
Bakteri endofit merupakan bakteri yang hidup dalam jaringan tanaman tanpa menimbulkan gejala penyakit. Bakteri endofit berpotensi sebagai salah satu teknik pengendalian penyakit layu vaskuler seperti penyakit layu bakteri (Ralstonia solanacearum) karena kemampuannya untuk hidup dan mengkolonisasi jaringan internal tanaman. Penelitian ini bertujuan untuk mengetahui kemampuan bakteri endofit indigenos dalam meningkatkan pertumbuhan dan mengendalikan R. solanacearum pada tanaman kentang. Pengkajian kemampuan isolat dilakukan dengan teknik in planta. Penelitian ini dilakukan dengan rancangan acak lengkap dengan 8 perlakuan (7 isolat bakteri endofit + kontrol) dengan 5 ulangan. Hasil penelitian menunjukkan seluruh isolat mampu meningkatkan ketahanan tanaman terhadap R. solanacearum dibanding kontrol dengan 3 isolat yaitu EKN.2.1.1, EKB1.2.1 dan EKB1.2.2 tidak menunjukkan gejala sampai akhir pengamatan. Isolat EKN2.1.1 merupakan isolat terbaik dalam meningkatkan pertumbuhan dengan efektivitas pertambahan hasil 22,5% dan mampu menghasilkan IAA tertinggi (22,73 ppm).
Kata Kunci: Bakteri Endofit, Indigenos, IAA, teknik in planta.
1. Pendahuluan
Kentang merupakan salah satu tanaman penting di Indonesia (Purwanti 2002). Peningkatan produktivitas kentang menghadapi berbagai kendala, salah satunya adalah serangan hama dan patogen tanaman. Penyakit layu bakteri yang disebabkan oleh Ralstonia solanacearum banyak ditemukan di daerah sentra produksi kentang. Penyakit ini dapat menimbulkan kerugian besar, karena mengurangi kualitas dan kuantitas umbi kentang antara 43 sampai 78% bahkan mencapai 100% (Nurbaya et al. 2011).
Beberapa metode pengendalian telah dilakukan terhadap penyakit layu bakteri ini antara lain dengan penggunaan varietas tahan, pergiliran tanaman dan penggunaan bakterisida sintetik (Mahmud et al. 1996). Penggunaan bakterisidasintetik pada budidaya tanaman sayuran tergolong tinggi terutama pada budidaya kentang secara konvensional. Beberapa laporan menyebutkan bahwa residu kimiawi sintetik mencapai ambang yang mengkhawatirkan, oleh karena itu perlu dicari alternatif lain untuk mengendalikan layu bakteri pada tanaman kentang tanpa memperparah pencemaran lingkungan (Hanudin et al. 2012)
Pengendalian menggunakanagens hayati merupakan pilihan yang perludikembangkan, karena relatif murah dan mudah dilakukan serta bersifat ramah lingkungan (Soesanto et al. 2010). Sudah banyak dilaporkan adanya stimulasi pertumbuhan tanaman dan hasil oleh mikroorganisme tanah yang bermanfaat (Adesemoye et al. 2008; Adesemoye et al. 2009; Adesemoye & Kloepper 2009; Berg 2009). Mikroorganisme yang hidup di dalam tanah mampu berasosiasi secara simbiotik dan non simbiotik dengan tanaman inangnya (Gray & Smith 2005). Mikroba ini memikiki peranan penting dalam tanah termasuk mengendalikan penurunan pertumbuhan tanaman akibat adanya patogen, Menghilangkan efek negatif dari cekaman stress terhadap pertumbuhan tanaman dan hasil, biofertilisasi, meningkatkan pertumbuhan akar, dan remediasi akar (Emmerling et al. 2002; Bohme & Bohme 2006; Lugtenberg & Kamilova 2009; Arzanesh et al. 2011). Plant Growth-promoting Rhizobacteria (PGPR) merupakan mikroorganisme tanah yang paling efektif dan paling banyak dipelajari kemampuannya dalam memicu pertumbuhan tanaman. (Gray & Smith 2005).
PGPR dikarakterisasikan berdasarkan kemampuannya, termasuk kemampuan dalam mengkolonisasi permukaan akar tanaman dan meningkatkan kelarutan mineral nutrient dan
648 |
pengikatan nitrogen (Khan 2005; Abou-Shanab et al. 2003), memicu pertumbuhan tanaman dan hasil, serta menekan serangan patogen penyebab penyakit tanaman dengan produksi Hidrogen Sianida (HCN), siderofor, antibiotic dan atau kompetisi terhadap nutrisi (Kamnev & Lelie 2000; Abou-Shanab et al. 2003; Idris et al. 2004) serta dapat meningkatkan toleransi tanaman terhadap stress kekeringan, salinitas, keracunan terhadap logam dan produksi fitohormon seperti Indole-3-acetic acid (IAA) (Khan et al. 2009; Verma et al. 2010; Figuiredo et al. 2010). Bakteri endofit merupakan bakteri yang hidup didalam jaringan tanaman tanpa menyebabkan kerusakan pada tanaman inang (Sandhya & Ali 2016). Bakteri endofit diketahui dapat meningkatkan pertumbuhan tanaman inang serta ketahanan melalui mekanisme PGPR (Vessey 2003).
Bakteri endofit merupakan bakteri yang berada dalam jaringan tanaman dan tidak menimbulkan gejala penyakit pada tanaman (Bandara et al. 2006). Di dalam jaringan tanaman bakteri berada di ruang antar sel, atau dalam jaringan pembuluh (Zinniel et al. 2002). Bakteri endofit sebagai agen biokontrol dan pemicu pertumbuhan memiliki kelebihan dibandingkan agen biokontrol lainnya karena keberadaannya dalam jaringan tanaman, sehingga mampu bertahan terhadap tekanan biotik dan abiotic (Hallman et al. 1997). Penelitian ini bertujuan untuk mendapatkan isolat bakteri endofit indigenos yang memiliki kemampuan terbaik dalam memicu pertumbuhan bibit tanaman tomat.
Penelitian ini bertujuan untuk mengetahui kemampuan bakteri endofit indigenos dalam meningkatkan pertumbuhan dan mengendalikan R. solanacearum pada tanaman kentang.
2. Bahan dan Metode
Penelitian dilaksanakan dari bulan Januari sampai Juni 2017 di Laboratorium Mikrobiologi Pertanian, Program Studi Proteksi Tanaman Fakultas Pertanian Universitas Andalas dan Balai Pengkajian Teknologi Pertanian Sukarami Kab. Solok
2.1. Penyiapan isolat bakteri endofit dan patogen
Isolat bakteri endofit dan patogen R. Solancearum diperoleh dari koleksi penelitian sebelumnya. Isolat bakteri endofit yang digunakan adalah EKN.2.1.1, EKB1.2.1, EKB1.2.2, KB.2.1.1, EKB.2.2.1, EKB.3.1.2 dan EKM.1.1.5. Koleksi issolat dari microtube ditumbuhkan pada media Nutrient Agar (NA) dan diinkubasi selama 3 hari. Koloni tunggal dari biakan kemudian ditumbuhkan pada medium nutrient broth (NB) sebanyak 10 mL dan diinkubasi pada shaker selama 110 rpm selama 24 jam. Hasil biakan dalam medium NB kemudian dibandingkan tingkat kekeruhannya dengan larutan McFarland skala 8 untuk memperoleh populasi bakteri sebanyak 108 CFU/mL.
Isolat patogen R. solanacearum dari koleksi ditumbuhkan kembali pada medium Triphenyl tetrazolium agar (TZC). Koloni virulen bakteri yang tumbuh diseleksi berdasarkan karakterisasi Kelman (1954). Koloni virulen kemudian diperbanyak dengan cara ditumbuhkan pada media TZC agar dan diinkubasi selama 2 hari. R. solanacearum kemudian disuspensi dengan air steril sampai mencapai populasi 108 CFU/mL dengan membandingkan dengan larutan McFarland skala 8.
2.2. Uji In Planta
Percobaan dilakukan untuk seleksi isolat bakteri endofit indigenos yang mempunyai kemampuan dalam mengendalikan layu bakteri pada tanaman tomat. Media tanam yang digunakan adalah campuran tanah dan pupuk kandang (2:1 v/v) yang disterilisasikan terlebih dahulu menggunakan metoda Tyndalisasi. Selanjutnya media tanam dimasukkan dalam polybag. Bibit yang digunakan adalah varietas granola. Sebelum ditanam bibit direndam dalam suspensi bakteri endofit dengan kepadatan inokulum 108 sel/ml selama 15 menit, selanjutnya dikering anginkan, dan
ditanam. Rancangan percobaan dilakukan dengan rancangan acak lengkap dengan 8 perlakuan (7 isolat bakteri endofit + kontrol) dengan 5 ulangan.
2.3. Inokulasi R. solanacearum
Suspensi R. solanacearum diinokulasi pada tanaman kentang umur 21 hst (sebelumnya benih sudah diaplikasi dengan rizobakteri), dengan cara menyuntik pangkal batang dengan suspensi bakteriR. solanacearum (106/ml) sebanyak 1 ml. Untuk menjaga kelembaban tetap optimal, tanaman
yang sudah diinokulasi disungkup dengan kantung plastik transparan.Tanaman diinkubasi selama ± 7 hari dalam kantong plastik dandiamati setiap hari gejala yang muncul.
| 649
2.4. Parameter Pengamatan.
Parameter pertumbuhan tanaman yang diamati yaitu morfologi koloni bakteri endofit tinggi tanaman, jumlah daun, jumlah cabang dan bobot umbi. Parameter perkembangan penyakit yang diamati yaitu masa inkubasi tingkat keparahan dan tingkat serangan.
2.5. Produksi IAA
Indole acetic acid (IAA) dari isolat rhizobakteria terpilih dideterminasi dengan metoda kalorimeter Bric et al (1991). Bakteri dikulturkan dalam medium cair Kings B dan diinkubasi pada shaker dengan kecepatan 200 rpm selama 2 x 24 jam. Kultur disentrifus pada 7000 g selama 15 menit. Supernatan dipisahkan dari pelletnya, 2 ml supernatan ditambahkan dalam 4 ml reagent sowlkesky (1 ml FeCl3 dalam 49 ml perchloric acid 35 %) dikocok, inkubasi selama 20-25 menit panjang
gelombang 530 nm. Jumlah IAA yang dihasilkan dikalibrasikan menggunakan kurva IAA standar (10-100µg/ml)
3. Hasil
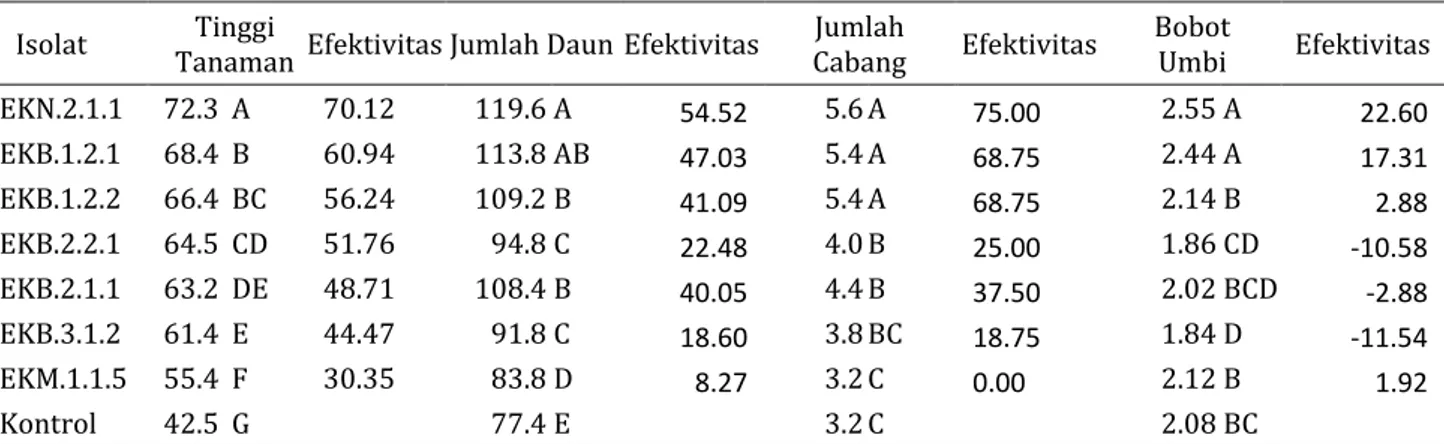
Tanaman kentang yang diintroduksi dengan isolat bakteri endofit indigenos menunjukkan pertumbuhan tanaman yang berbeda nyata dibanding kontrol. Seluruh isolat menunjukkan adanya peningkatan tinggi tanaman dan jumlah daun yang lebih baik dibanding kontrol dengan peningkatan efektivitas tinggi tanaman antara 30.35-70.12% dan jumlah daun meningkat sampai 1119.6% dibanding kontrol (Tabel 1).
Tabel 1. Pertumbuhan dan hasil tanaman kentang yang diintroduksi dengan isolat bakteri endofit
Isolat Tanaman Tinggi Efektivitas Jumlah Daun Efektivitas Cabang Jumlah Efektivitas Bobot Umbi Efektivitas
EKN.2.1.1 72.3 A 70.12 119.6 A 54.52 5.6 A 75.00 2.55 A 22.60 EKB.1.2.1 68.4 B 60.94 113.8 AB 47.03 5.4 A 68.75 2.44 A 17.31 EKB.1.2.2 66.4 BC 56.24 109.2 B 41.09 5.4 A 68.75 2.14 B 2.88 EKB.2.2.1 64.5 CD 51.76 94.8 C 22.48 4.0 B 25.00 1.86 CD -10.58 EKB.2.1.1 63.2 DE 48.71 108.4 B 40.05 4.4 B 37.50 2.02 BCD -2.88 EKB.3.1.2 61.4 E 44.47 91.8 C 18.60 3.8 BC 18.75 1.84 D -11.54 EKM.1.1.5 55.4 F 30.35 83.8 D 8.27 3.2 C 0.00 2.12 B 1.92 Kontrol 42.5 G 77.4 E 3.2 C 2.08 BC
Aplikasi bakteri endofit indigenos juga menunjukkan peningkatan jumlah cabang dan bobot buah (Tabel 1). Hampir semua isolat menunjukkan peningkatan jumlah cabang dibanding kontrol. Namun, tidak semua isolat menunjukkan kemampuan untuk meningkatkan hasil dibanding kontrol. Hanya isolat EKN.2.1.1, EKB.1.2.1, EKB.1.2.2 dan EKM.1.1.5 yang mampu menunjukkan peningkatan bobot umbi kentang dibanding kontrol. Isolat EKN.2.1.1 merupakan isolat yang menunjukkan peningkatan jumlah bobot umbi kentang terbaik dengan bobot 2.55 kg dengan efektivitas peningkatan 22.60% dibanding kontrol.
Tanaman kentang yang diintroduksi dengan isolat bakteri endofit indigenos dan diinokulasi dengan R. solanacearum menunjukkan adanya peningkatan ketahanan tanaman kentang terhadap serangan patogen tersebut. Seluruh isolat menunjukkan penekanan masa inkubasi penyakit dibanding kontrol (Tabel 2).
Isolat EKB1.2.2 dan EKB2.1.1 menunjukkan penurunan kejadian penyakit menjadi 40% dan 80 % dibanding kontrol. Isolat EKB.1.2.1 dan EKN.2.1.1 merupakan isolat terbaik yang tidak menunjukkan munculnya penyakit sampai akhir pengamatan.
Hasil uji produksi IAA pada bakteri endofit indigenos menunjukkan produksi IAA yang bervariasi(Tabel 3). Seluruh isolat mampu menghasilkan IAA dengan konsentrasi yang beragam. Isolat EKN.2.1.1. menunjukkan produksi IAA tertinggi dengan konsentrasi 22.73 ppm(Tabel 3). Produksi ini juga berbanding lurus dengan pertumbuhan tanaman kentang, dimana isolat EKN.2.1.1. juga merupakan isolat dengan pertumbuhan tinggi tanaman paling baik dibanding isolat lain.
650 |
Tabel 2. Perkembangan penyakit layu bakteri pada tanaman kentang yang diintroduksi dengan isolat bakteri endofit indigenos
Isolat Masa Inkubasi (his) Kejadian Penyakit (%)
EKB.1.2.1 62.00* A 0 EKN.2.1.1 62.00* A 0 EKB.1.2.2 48.80 B 40 EKB.2.1.1 37.40 C 80 EKB.2.2.1 24.40 D 100 EKB.3.1.2 19.60 D 100 EKM.1.1.5 18.40 D 100 Kontrol 14.40 D 100
Tabel 3. Produksi IAA isolat bakteri endofit indigenos
Isolat Produksi IAA (ppm)
EKB.1.2.1 20.10 EKN.2.1.1 22.73 EKB.1.2.2 19.23 EKB.2.1.1 17.50 EKB.2.2.1 18.50 EKB.3.1.2 12.55 EKM.1.1.5 18.20 4. Pembahasan
Perlakuan bakteri endofit pada benih jagung, mampu menginduksi ketahanan sistemik tanaman jagung dengan menekan keparahan penyakit layu steward (Pantoea stewartii subsp. Stewartii) berkisar 48,95-55,60% (Rahma 2013). Kombinasi beberapa isolat bakteri antagonis Clostridium spp, memiliki kemampuan menekan layu bakteri R. solanacearum pada tanaman kentang hingga 85% (Syaifuddin 2013). Empat isolat (NS01, NG02, G06 dan SO6) mampu menghambat pertumbuhan R. solanacearum secara in-vitro (Ariyanti et al. 2009). Pada uji skala rumah kaca keempat isolat tersebut mampu menekan perkembangan penyakit layu hingga 85% dan mendorong produksi umbi pada sistem aeroponik (Nurbaya et al. 2011). Isolat bakteri endofit (BD4.2E1) mampu menekan serangan penyakit Hawar Daun Bakteri dan meningkatkan hasil bawang merah dengan efektifitas penekanan persentase penyakit 60,06% dibanding kontrol (Resti et al. 2013).
Menurut Resti et al. (2013) sebagian besar isolat bakteri endofit indigenus yang diintroduksi pada bawang merah (77 isolat) dapat meningkatkan ketahanan terhadap hawar daun bakteri (HDB) dengan reaksi agak rentan (kontrol) menjadi agak tahan (70 isolat) sampai tahan (9 isolat). Penelitian Munif et al. (2012) 12 isolat bakteri endofit asal padi gogo dapat memacu pertumbuhan akar dan tajuk tanaman padi. Penelitian Susanto et al, (2013) aplikasi formula cair Pseudomonas fluorescen P60 sebanyak 5 kali pada pertanaman cabai mampu meningkatkan tinggi tanaman sebesar 23,7%.
Penelitian ini sejalan dengan penelitian Oswald & Calvo. (2009) berhasil membuktikan bahwa pemberian PGPR seperti Azospirillum, Azotobacter, Bacillus dan Streptomyces, meningkatkan produksi tanaman kentang hingga 40 % dilapangan, 60% di Green House dan 125% pada sistem budidaya aeroponik. Pseudomonas fluorescens P8 merupakan bakteri antagonis yang terbaik meningkatkan pertumbuhan tanaman tomat dengan meningkatkan bobot segar tanaman 52,80%, bobot akar tanaman 47,48% dan jumlah buah 58,86% (Mugiastuti et al. 2012).
5. Kesimpulan
Hasil penelitian ini menunjukkan bahwa hampir semua isolat mampu meningkatkan pertumbuhan dan hasil tanaman kentang. Isolat EKB.1.2.1, EKN.2.1.1 dan EKB.1.2.2 merupakan isolat terbaik yang mampu meningkatkan pertumbuhan tanaman dan hasil tanaman kentang. Isolat
| 651 EKB.1.2.1 dan EKN.2.1.1 selain mampu meningkatkan pertumbuhan dan hasil juga mampu mengendalikan R. solanacaerum tanpa menunjukkan adanya gejala sampai akhir pengamatan. 6. Ucapan Terimakasih
Peneliti mengucapkan terimakasih kepadaKemenristekdikti yang telah mendanai penelitian ini melalui hibah Penelitian Unggulan Perguruan Tingi (PUPT) dengan nomor kontrak 059/SP2H/LT/DRPM/IV/2017 Tanggal 3 april 2017.
7. Daftar Pustaka
Abou-Shanab RI, Angle JS, Delorme TA, Chaney RL, vanBerkum P, Moawad H, Ghanem K, Ghozlan HA. 2003. Rhizobacterial effects onnickel extraction from soil and uptake by Alyssum murale. New Phytologist. 158: 219-224.
Adesemoye AO, Kloepper J. 2009. Plant–microbes interactions in enhancedfertilizer-use efficiency. Appl Microbiol Biot 85:1–12.
Adesemoye AO, Torbert HA, Kloepper JW. 2008. Enhanced plant nutrient useefficiency with PGPR and AMF in an integrated nutrient managementsystem. Can J Microbiol 54:876–886.
Adesemoye AO, Torbert HA, Kloepper JW. 2009. Plant growth promoting rhizobacteria allow reduced application rates of chemical fertilizers. Microb Ecol 58:921–929.
Arzanesh MH, Alikhani HA, Khavazi K, Rahimian HA, Miransari M. 2011. Wheat (Triticum aestivum L.) growth enhancement by Azospirillum spp. Underdrought stress. World J Microbiol Biot 27:197–205
Ariyanti EL. 2009. Isolasi dan Karakterisasi Mikroba Antagonis dari Rizosfer Tanaman Kentang Sistem Aeroponik yang Berpotensi Sebagai Pengendali Penyakit Layu (Ralstonia solanacearum) [Tesis]. Makassar: Fakultas Pasca Sarjana Universitas Hasanuddin.
Bandara WMMS, Seneviratne G, Kulasooriya SA. 2006. Interaction among endophytic bacteria and fungi; effects and potentials. J. Biosci 31(5):645-650
Berg G. 2009. Plant–microbe interactions promoting plant growth and health:perspectives for controlled use of microorganisms in agriculture. Appl Microbiol Biot 84:11–18.
Böhme L, Böhme F, 2006. Soil microbiological and biochemical properties affected by plant growth and different long-term fertilization. Eur J Soil Biol 42:1–12.
Bric JM, Bostock RM, Silverstone SE. 1991. Rapid in situ assay for indoleacetic acid production by bacteria immobilized on a nitrocellulose membrane. Applied and environmental microbiology 57: 535-538.
Emmerling C, Schloter M, Hartmann A, Kandeler E. 2002. Functional diversity ofsoils organisms: a review of recent research activities in Germany. J Plant Nutr Soil Sci 165:408–420.
Figueiredo MVB, Seldin L, Araujo FF, Mariano RLM. 2010. Plant growth promoting rhizobacteria: Fundamentals and applications. Plant growth and health promoting bacteria. DOI 10.1007/978-3-642-13612-2-2.
Gray EJ, Smith DL: Intracellular and extracellular PGPR. 2005. commonalitiesand distinctions in the plant–bacterium signalling processes. Soil BiolBiochem 37:395–412.
Hallman J, Quadt-Hallmann QA, Mahaffee WF, Kloepper JW. 1997. Bacterial endophytes in agricultural crops. Can J. Microbiol. 43:895-914.
Hanudin, Marwoto B, Hersanti, Muharam A. 2012. Kompatibilitas Bacillus subtilis, Pseudomonas fluorescens dan Trichoderma harzianum untuk mengendalikan Ralstonia solanacearum pada Tanaman Kentang. J. Hort. 22(2): 173-180.
Idris R, Trifonova R, Puschenreiter M, Wenzel WW, Sessitsch A. 2004. Bacterial communities associated with flowering plants on the Ni hyper accumulator Thlaspi goesingense. Appl. Environ.Microbiol.70:2667-2677.
Kamnev AA, Lelie D. 2000. Chemical and biological parameters astools to evaluate and improve heavy metal phytoremediation. Biosci. Rep. 20:239-258.
Kelman, A. 1954. The bacterial wilt caused by P. solanacearum. A literature review and bibliography. North Carolina Agric. Expt. Sta. Tech. Bull. 99.
Khan MS, Zaidi A, Wani PA, Oves M. 2009. Role of plant growthpromoting rhizobacteria in the remediation of metal contaminatedsoils. Environ. Chem. Lett. 7:1-19.
652 |
Khan AG. 2005. Role of soil microbes in the rhizosphere of plants growing on trace metal contaminated soils in phytoremediation. J.Trace Elem. Med. Biol. 18:355-364.
Lugtenberg B, Kamilova F. 2009. Plant growth-promoting rhizobacteria. Annu Rev Microbiol 63:541– 556.
Machmud M. 1986. Bacterial wilt in Indonesia. Hal: 30-34. Di dalam: Persley GJ, editor. Bacterial wilt disease in Asia and the South Pacific. Proceedings of an International Workshop held at PCARRD, Los Banos, Philippines 8 - 10 October 1985. ACIAR Proceedings No. 13, Canberra, Australia.
Mugiastuti E, Rahayuniati RF, Sulistyanto P. 2012. Pemanfaatan Bacillus sp dan Pseudomonas fluorescens untuk mengendalikan penyakit layu tomat akibat sinergi R. solanacearum dan Meloidogyne sp. Prosiding seminar Nasional Pengembangan Sumber Daya Pedesaan dan Kearifan Lokal berkelanjutan II. Purwokerto. 27-28 November.
Munif A, Wiyono S, Suwarno. 2014. Isolasi Bakteri endofit asal padi gogo dan potensinya sebagai agens biokontrol dan pemacu pertumbuhan. J Fitopatologi Indonesia 8(3):57-64.
Nurbaya, Zulfikar A, Kusinanti T, Baharuddin, Lologau B A. 2011. Kemampuan Mikroba Antagonis dalam Mengendalikan Ralstoniasolanacearum pada Sistem Budidaya Aeroponik Tanaman Kentang. J Fitomedika 7(3): 155–158.
Oswald A, Calvo P. 2009. Using Rhizobacteria to Improve Productivity of Potato. Disajikan pada; Symposium of The International Society for Tropical Root Crop. Integrated Crop Management Division, CIP, Lima, Peru.
Purwanti H. 2002. Penyakit Hawar Daun (hytophthora infestans (Mont.) de Bary) pada Kentang dan Tomat:Identifikasi Permasalahan diIndonesia. Bulletin Agrobio 5(2): 67-72.
Rahma H. 2013. Induksi ketahanan tanaman jagung terhadap penyakit layu Stewart (Pantoea stewartii Subsp. Stewartii) menggunakan bakteri endofit. Pross. Seminar dan Kongres Nasional ke XXII Perhimpunan Fitopatologi Indonesia. Padang. 7–10 Oktober.
Resti Z, Habazar T, Putra DP, Nasrun. 2013. Skrining dan Identifikasi Isolat Bakteri Endofit untuk Mengendalikan Penyakit Hawar Daun Bakteri pada Bawang Merah. J. HPT Tropika 13(2): 167-178. Sandhya V, Ali Sk.Z, 2016. Endophytic Bacteria as Plant Growth Promoters. Dalam: Sayyed RZ, Reddy MS, Al-Turki AI, (Ed). Recent Trends in PGPR Research for Sustainable Crop Productivity. India: Scientific Publishers
Soesanto L, Mugiastuti E, Rahayuniati RF. 2010. Kajian mekanisme antagonis Pseudomonas Fluorescens P60 terhadap Fusarium oxysporum F.Sp. lycopersici pada tanaman tomat in vivo. J Hama dan Penyakit Tumbuhan Tropika 10(2):108-115.
Soesanto L, Mugiastuti E, Rahayuniati RT. 2013. Kajian Aplikasi Formula Pseudomonas fluorescen P60 untuk Menekan Penyakit karena Virus serta Pengaruhnya pada Pertumbuhan dan Hasil Cabai. Pross. Seminar dan Kongres Nasional ke XXII PFI. Padang. 7-10 Oktober.
Syaifuddin A. 2013. Uji viabilitas beberapa kombinasi isolat bakteri antagonis (Clostridium spp) pada budidaya aeroponik tanaman kentang (Solanum tuberosum). Pross. Seminar dan Kongres Nasional ke XXII Perhimpunan Fitopatologi Indonesia. Padang 7 – 10 Oktober.
Verma JP, Yadav J, Tiwari KN, Lavakush, Singh V. 2010. Impact of plant growth promoting rhizobacteria on crop production. Intl. J. Agric.Res. 5 (11): 954-983.
Vessey JK. 2003. Plant growth promoting rhizobacteria as biofertilizers. Plant Soil 255:571-586. Zinniel DK, Pat Lambrecht B, Harris Z, Feng D, Kuczmarski P, Higley CA, Ishimaru A, Arunakumari RG,
Barletta and Cidaver AK. 2002. Isolation and Characterization of Endophytic Colonizing Bacteria From Agronomic Crops and Prairie Plants. Applied and Environmental Mycrobiol P 2198-2208.