i
PENGARUH EKSTRAK KACANG KEDELAI HITAM (Glycine soja) TERHADAP JUMLAH KELENJAR DAN KETEBALAN LAPISAN
ENDOMETRIUM TIKUS PUTIH (Rattus norvegicus, L.)
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta untuk Memenuhi Sebagian Persyaratan
guna Memperoleh Gelar Sarjana Sains
Disusun oleh: Yuniar Ajeng Pratiwi
NIM 13308141018
PROGRAM STUDI BIOLOGI JURUSAN PENDIDIKAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
iii
HALAMAN PERNYATAAN
Yang bertanda tangan di bawah ini:
Nama Mahasiswa : Yuniar Ajeng Pratiwi
NIM : 13308141018
Jurusan/Prodi : Pendidikan Biologi/Biologi
Fakultas : MIPA
Judul TAS : PENGARUH EKSTRAK KACANG KEDELAI HITAM (Glycine soja) TERHADAP JUMLAH KELENJAR DAN KETEBALAN LAPISAN ENDOMETRIUM TIKUS PUTIH (Rattus norvegicus, L.)
Dengan ini menyatakan bahwa skripsi ini benar-benar karya saya sendiri. Sepanjang pengetahuan saya tidak terdapat karya atau pendapat yang ditulis atau diterbitkan orang lain kecuali sebagai acuan atau kutipan dengan mengikuti tata penulisan ilmiah yang telah lazim.
Yogyakarta, 3 Februari 2017
Yang menyatakan,
Yuniar Ajeng Pratiwi
v “MOTTO”
“A mind is like a parachute. It doesn’t work if it is not open.”
-Frank Zappa-
“Kegagalan hanya terjadi bila kita menyerah.”
-Lessing-
“Manusia tidak merancang untuk gagal, mereka gagal untuk merancang.”
vi
PERSEMBAHAN
Alhamdulillah puji syukur kehadirat Allah SWT yang telah memberikan rahmat, kesehatan, kemudahan, kelancaran dan kesabaran sehingga mampu menyelesaikan
tugas akhir skripsi ini.
Hadiah kecil ini ku persembahkan untuk Ayah dan Ibu tercinta untuk segala doa, keikhlasan, pengorbanan, kasih sayang, perjuangan dan kesabaran yang telah
diberikan untukku.
Untuk teman seperjuanganku Kharirotul Munawiroh, Ismiyati Marfuah dan Rahayu Tri Rejeki yang saling membantu dalam melaksanakan penelitian tugas
akhir skripsi ini.
Untuk Dinda Mardiani Lubis, Astrid Umaya Arum Sari, Mery Nur Fitriani, Dita dan Ika terimakasih atas bantuan, dorongan dan semangatnya.
Terimakasih juga untuk NS yang tidak pernah lelah membantu, mendoakan dan memberi semangat dalam mengerjakan tugas akhir skripsi ini.
vii
PENGARUH EKSTRAK KACANG KEDELAI HITAM (Glycine soja) TERHADAP JUMLAH KELENJAR DAN KETEBALAN LAPISAN
ENDOMETRIUM TIKUS PUTIH (Rattus norvegicus, L.)
Oleh
Yuniar Ajeng Pratiwi NIM 13308141018
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh ekstrak kacang kedelai hitam (Glycine soja) dan mengetahui dosis optimal terhadap jumlah kelenjar dan ketebalan lapisan endometrium tikus putih (Rattus norvegicus, L.).
Jenis penelitian ini adalah eksperimen yang menggunakan pola acak lengkap. Objek yang digunakan dalam penelitian ini adalah 16 ekor tikus putih betina yang berumur 2 bulan, memiliki berat 200 gram dan belum pernah bunting. Tikus tersebut dibagi menjadi 4 kelompok, yaitu kontrol (tanpa pemberian ekstrak kacang kedelai hitam) dan 3 kelompok perlakuan, yaitu P1 (50 mg/200 g/hari), P2 (100mg/200 g/hari) dan P3 (150 mg/ 200 g/hari). Variabel tergayut dalam penelitian ini adalah jumlah kelenjar dan ketebalan lapisan endometrium uterus tikus putih betina. Perlakuan dilakukan selama 21 hari. Data ketebalan endometrium dianalisis dengan analisis statistik One Way Anova untuk mengetahui ada tidaknya perbedaan pengaruh antara kelompok kontrol dan perlakuan. Uji Duncan’s Multiple Range Test (DMRT) dilakukan jika terdapat pengaruh nyata untuk membedakan antara kelompok perlakuan dan antar perlakuan. Uji Kruskal-Wallis digunakan untuk menganalisis pengaruh perlakuan terhadap jumlah kelenjar endometrium dilakukan.
Hasil penelitian menunjukkan bahwa pemberian ekstrak kacang kedelai hitam memberikan pengaruh nyata (p<0,05) meningkatkan jumlah kelenjar endometrium dan ketebalan lapisan endometrium tikus putih. Dosis optimal dalam meningkatkan jumlah kelenjar dan ketebalan endometrium berdasarkan hasil penelitian terdapat pada pemberian dosis 100mg/ekor/hari.
viii
The Influence of Black Soybean Extract Supplies(Glycine soja) towards the Amount of Gland and the Thickness of Endometrium Layer in Female White
Mice (Rattus norvegicus, L.)
By
Yuniar Ajeng Pratiwi NIM 13308141018
ABSTRACT
The research aims to find out both influence of black soybean extract (Glycine soja) and to find out optimum dose of extract towards the amount of gland and the thickness of endometrium layer in female white mice womb (Rattus norvegicus, L.).
Type of this research is experiment using completely randomized design. The object of the research are 2 months old female white mice which never impregnated. Those mice are divided into 4 treatment group, those are controling (without black soybean extract), P1 (50 mg/mice each day), P2 (100 mg/mice each day) and P3 (150 mg/mice each day). Uncertain variable in this research is the amount of glands and the thickness of endometrium layer in female white mice womb. Treatment have been don for 21 days. Analysis one way annova is used in order to analyze the influence of the thickness of endometrium layer treatment, then if give constanly effect continued by Duncan’s Multiple Range Test (DMRT) to analyzw the diference between treatment group and inter-treatment group, whereas kruskal wallis test is used in order to analyze the influence of the amount of endometrium glands.
ix
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas kesehatan, rahmat
dan ridho-Nya sehingga penulis dapat menyelesaikan penyusunan Tugas Akhir Skripsi dengan judul “Pengaruh Ekstra Kacang Kedelai Hitam (Glycine soja) Terhadap Jumlah Kelenjar dan Ketebalan Lapisan Endometrium Tikus Putih
(Rattus norvegicus, L.)” dengan baik dan lancar.
Dalam pelaksanaan dan penyusunan tugas akhir skripsi ini penulis
menyadari tidak lepas dari bantuan, bimbingan serta dukungan dari berbagai
pihak. Oleh karena itu, penulis menyampaikan ucapan terima kasih kepada:
1. Bapak Dr. Hartono, selaku Dekan FMIPA UNY yang telah membantu
proses terselesaikannya Tugas Akhir Skripsi ini.
2. Bapak Slamet Suyanto, M.Ed., selaku Wakil dekan I yang telah membantu
dalam proses pembuatan SK pembimbing dan penguji Tugas Akhir Skripsi
ini.
3. Bapak Dr. Paidi, M.Si., selaku Ketua Jurusan Pendidikan Biologi FMIPA
UNY yang telah memberikan izin penelitian di Laboratorium Jurusan
Biologi FMIPA UNY.
4. Ibu Dr. Tien Aminatun, M.Si., selaku Kaprodi Biologi Fmipa UNY yang
telah memberikan persetujuan dalam menetapkan Dosen Pembimbing
x
5. Bapak Tri Harjana, M.P., selaku pembimbing I yang selalu memberikan
bimbingan, masukan, saran, nasihat dan waktunya selama penelitian dan
penulisan Tugas Akhir Skripsi.
6. Bapak Suhandoyo, M.S., selaku pembimbing II yang telah memberikan
waktu, saran dan masukkan dalam menyelesaikan Tugas Akhir Skripsi.
7. Ayah dan Ibu selaku orang tua dan panutan hidup yang selalu memberikan
dukungan serta doanya selama ini.
8. Bapak Hidayat selaku Laboran Jurdik Biologi FMIPA UNY atas bantuan
dan kerjasamanya selama penelitian.
Penulis menyadari bahwa penyusunan Tugas Akhir Skripsi ini masih banyak
terdapat kekurangan dan kesalahan. Kritik dan saran yang membangun sangat
berguna bagi penulis demi perbaikan dan kesempurnaan selanjutnya. Akhirnya,
harapan penulis semoga skripsi ini dapat bermanfaat bagi penulis dan pembaca.
Amiin.
Yogyakarta, 3 Februari 2017
xi DAFTAR ISI
Halaman
HALAMAN JUDUL ...i
HALAMAN PERSETUJUAN ...ii
HALAMAN PERNYATAAN ...iii
HALAMAN PENGESAHAN ...iv
MOTTO ...v
PERSEMBAHAN ...vi
ABSTRAK ...vii
ABSTRACT ...viii
KATA PENGANTAR ...ix
DAFTAR ISI ...xi
DAFTAR TABEL ...xiv
DAFTAR GAMBAR ...xv
DAFTAR LAMPIRAN...xvi
BAB I. PENDAHULUAN A. Latar Belakang ...1
B. Identifikasi Masalah ...3
C. Batasan Masalah ...3
xii
E. Tujuan Penelitian ...4
F. Manfaat Penelitian ...4
G. Batasan Operasional...5
BAB II. TINJAUAN PUSTAKA A.Dasar Teori ...6
1. Kacang Kedelai Hitam...6
a. Tanaman Kedelai Hitam ...6
b. Taksonomi Kacang Kedelai Hitam ...8
c. Kandungan Kacang Kedelai Hitam ...8
2. Fitoestrogen ...10
3. Tikus Putih ...12
a. Klasifikasi Tikus Putih ...14
b. Tikus Putih Sebagai Hewan Uji ...14
c. Siklus Estrus ...15
4. Uterus ...18
a. Anatomi ...18
b. Struktur Histologik ...18
c. Fungsi Uterus ...20
d. Pengaruh Hormon pada Endometrium ...20
e. Siklus Endometrium ...24
B.Kerangka Berpikir ...25
C.Hipotesis ...27
xiii
B.Rancangan Penelitian ...28
C.Waktu dan Tempat Penelitian ...29
D.Populasi dan Sampel ...29
E. Variabel Penelitian ...29
F. Alat dan Bahan Penelitian ...30
G.Langkah Penelitian ...31
H.Teknik Sampling ...41
I. Teknik Pengumpulan Data ...42
J. Analisis data ...43
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN A. Hasil Penelitian ...44
1. Pengaruh Pemberian Ekstrak Kacang Kedelai Hitam terhadap Jumlah Kelenjar Endometrium ...44
2. Pengaruh Pemberian Ekstrak Kacang Kedelai Hitam terhadap Ketebalan Lapisan Endometrium ...48
B. Pembahasan ...53
BAB V. SIMPULAN DAN SARAN A. Simpulan ...58
B. Saran ...58
DAFTAR PUSTAKA ...59
xiv
DAFTAR TABEL
Halaman
Tabel 1. Data Fisiologi Tikus Putih ...13
Tabel 2. Rata-rata Jumlah Endometrium Uji Pendahuluan ...33
Tabel 3. Rata-rata Ketebalan Lapisan Endometrium (µm) Uji Pendahuluan ...33
Tabel 4. Data Pengacakan Tikus Putih pada Masing-masing Kandang...42
Tabel 5. Data Jumlah Kelenjar Endometrium Uterus Tikus Putih Setelah Pemberian Ekstrak Kacang Kedelai Hitam ...45
Tabel 6. Descriptive Statistics ...47
Tabel 7. Data Ketebalan Lapisan Endometrium Uterus Tikus Putih (µm) setelah Pemberian Ekstrak Kacang Kedelai Hitam ...49
Tabel 8. Anova ...51
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Biji kacang kedelai hitam ...6
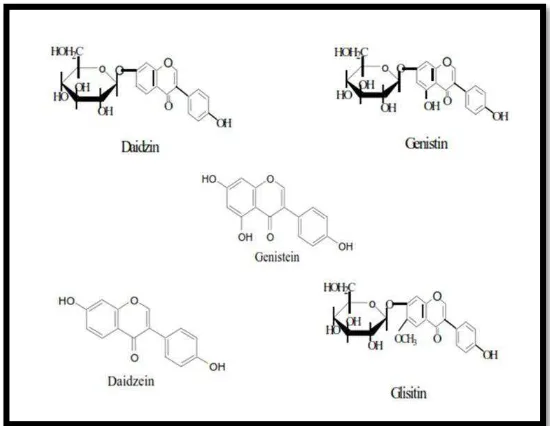
Gambar 2. Struktur kimia daidzin, daidzein, genistin, genistein dan glysitin ....11
Gambar 3. Rattus norvegicus, L. ...12
Gambar 4. Mikrograf epitel vagina tikus putih fase estrus perbesaran 40X ...17
Gambar 5. Uterus tikus putih ...18
Gambar 6. Struktur kimia estrogen ...22
Gambar 7. Bagan kerangka berpikir pengaruh fitoestrogen terhadap uterus ...26
Gambar 8. Mikrograf endometrium tikus putih setelah mendapat perlakuan pemberian ekstrak kacang kedelai hitam (HE, 4X) ...44
Gambar 9. Diagram jumlah kelenjar endometrium uterus tikus putih sesudah pemberian ekstrak kacang kedelai hitam ...46
Gambar 10. Mikrograf uterus tikus putih setelah pemberian perlakuan ekstrak kacang kedelai hitam (HE, 4X) ...49
xvi
DAFTAR LAMPIRAN
Halaman
LAMPIRAN 1. Dokumentasi Penelitian ...61
LAMPIRAN 2. Rekap Data Rata-rata Jumlah Kelenjar dan
Ketebalan Endometrium...64
BABBI
PENDAHULUAN
A. LatarBBelakang
Makanan di era modern ini semakin beragam bahan yang digunakan, tidak terkecuali bahan yang digunakan adalah biji-bijian. Salah satu jenis biji yang sering digunakan adalah kacang kedelai hitam karena mudah didapatkan dipasar tradisional maupun pasar modern. Kacang kedelai hitam juga memiliki kandungan karbohidrat, protein nabati dan serat.
Hormon estrogen berpengaruh pada organ reproduksi betina, salah satunya adalah uterus karena memiliki reseptor estrogen yang dapat berikatan dengan estrogen maupun senyawa yang memiliki struktur mirip estrogen seperti fitoestrogen. Estrogen berperan dalam sekresi mukus pada endometrium. Salah satu komponen dari lapisan endometrium yang dipengaruhi oleh estrogen adalah kelenjar endometrium yang memiliki peran dalam menentukan ketebalan lapisan endometrium. Sekresi hormon estrogen apabila terganggu akan mempengaruhi organ reproduksi pada hewan betina, termasuk uterus yang berakibat pada kelenjar dan proses penebalan lapisan endometrium. Aksi dari hormon estrogen sepanjang fase folikular menyebabkan proliferasi lapisan endometrium, termasuk pada kelenjar endometrium. Estrogen memiliki peningkatan kandungan yang dapat merangsang pertumbuhan dan percabangan kelenjar endometrium yang berpengaruh terhadap ketebalan endometrium, tetapi uliran dan sekresi kelenjar tidak dapat terjadi sebelum adanya rangsangan dari hormon progesteron (Dellmann dan Brown, 1992:514).Salah satu organ reproduksi betina yang sangat berpengaruh terhadap uterus adalah lapisan endometrium. Lapisan endometrium yang berpengaruh adalah ketebalan lapisan endometrium dan akan diikuti juga pengaruh terhadap jumlah kelenjarnya.
siklus estrus berkisar 4-5 hari dan memiliki lama masa kebuntingan antara 21-22 hari. Selain itu juga karena anatomi dan fisiologi dari organ-organ tikus putih yang sistematis kerjanya, hampir sama dengan fungsional anatomi organ manusia.
Berdasarkan latar belakang tersebut maka dilakukan penelitian untuk mengetahui pengaruh pemberian ekstrak kacang kedelai hitam secara oral terhadap jumlah kelenjar dan ketebalan lapisan endometrium pada tikus putih betina yang belum pernah mengalami kebuntingan.
B. IdentifikasiBMasalah
1. Apa pengaruh fitoestrogen dari estrak kacang kedelai hitam terhadap ketebalan endometrium tikus putih?
2. Apa pengaruh fitoestrogen dari kacang kedelai hitamyang masuk ke dalam tubuh terhadap jumlah kelenjar endometrium tikus putih?
3. Apakah kekurangan dan kelebihan pemberian fitoestrogen yang berasal dari ekstrak kacang kedelai hitam terhadap jumlah kelenjar dan ketebalan endometrium tikus putih belum?
C. BatasanBMasalah
hitam terhadap jumlah kelenjar dan ketebalan lapisan endometrium tikus putih (Rattus norvegicus, L.).
D. RumusanBMasalah
1. Apa pengaruh ekstrak kacang kedelai hitam terhadap jumlah kelenjar endometrium tikus putih (Rattus norvegicus, L.)?
2. Apa pengaruh ekstrak kacang kedelai hitam terhadap ketebalan lapisan endometrium tikus putih (Rattus norvegicus, L.)?
E.BTujuanBPenelitian
1. Mengetahui pengaruh ekstrak kacang kedelai hitam terhadap jumlah kelenjar endometrium tikus putih (Rattus norvegicus, L.).
2. Mengetahui pengaruh ekstrak kacang kedelai hitam terhadap ketebalan lapisan endometrium tikus putih (Rattus norvegicus, L.).
F.BManfaatBPenelitian
1. Bagi Peneliti
Penelitian ini diharapkan dapat digunakan sebagai sarana informasi mengenai pengaruh ekstrak kacang kedelai hitam terhadap jumlah kelenjar dan ketebalan lapisan endometrium tikus putih (Rattus norvegicus, L.). Penelitian ini juga diharapkan dapat digunakan sebagai salah satu bahan acuan dalam melakukan penelitian lanjutan.
Hasil penelitian ini diharapkan dapat memberikan informasi kepada masyarakat mengenai pengaruh ekstrak kacang kedelai hitam terhadap jumlah kelenjar dan ketebalan lapisan endometrium tikus putih (Rattus norvegicus, L.)
.
G.BBatasanBOperasiaonal
1. Kacang kedelai hitam yang digunakan adalah kacang kedelai hitam yang didapatkan di pasar Demangan Yogyakarta.
2. Ekstrak kacang kedelai hitam dibuat dengan teknik ekstraksi maserasi.
3. Tikus putih betina (Rattus norvegicus, L.) yang digunakan dengan galur wistar.
4. Jumlah kelenjar endometrium yang diamati adalah kelenjar yang terdapat dalam preparat dan dihitung dengan cara sampling, yaitu kelenjar dihitung pada seluruh bidang pandang dengan perbesaran mikroskop 100X.
1 BAB II
TINJAUAN PUSTAKA
A. Dasar Teori
1. Kedelai Hitam
a. Tanaman Kedelai Hitam
Gambar 1. Biji Kacang Kedelai Hitam (Dokumen Penelitian, 2016)
Kedelai adalah salah satu tanaman polong-polongan yang menjadi
bahan dasar banyak makanan dari Asia Timur seperti kecap, tahu, dan
tempe. Berdasarkan peninggalan arkeologi, tanaman ini telah dibudidayakan
sejak 3500 tahun yang lalu di Asia Timur. Kedelai putih diperkenalkan di
Indonesia oleh pendatang dengan Cina sejak maraknya perdagangan dengan
Tiongkok, sementara kedelai hitam sudah dikenal lama orang penduduk
setempat. Kedelai merupakan sumber utama protein nabati dan minyak
2
meskipun kedelai praktis baru dibudidayakan masyarakat di luar Asia
setelah 1910 (Amrin, 2007:1-5).
Kedelai yang dibudidayakan terdiri dua spesies: Glycin max (disebut
kedelai putih, yang bijinya bisa berwarna kuning, agak putih, atau hijau) dan
Glycine soja (kedelai hitam, berbiji hitam). G. max merupakan tanaman asli daerah Asia subtropik seperti RRC dan Jepang Selatan, sementara G. soja merupakan tanaman asli Asia tropis di Asia Tenggara. Tanaman ini telah
menyebar ke Jepang, Korea, Asia Tenggara, dan Indonesia (Amrin,
2007:1-5).
Tanaman kedelai hitam termasuk famili Magnoliophyta, subfamili
Faboideae. Kedelai hitam berasal dari China, kemudian dikembangkan di
berbagai negara di amerika Latin, juga Amerika Serikat dan negara-negara
di Asia. Di Indonesia, penanaman kedelai hitam berpusat di Jawa,
Lampung, Nusa Tenggara Barat, dan Bali (Amrin, 2007:1-5).
Kedelai hitam dapat tumbuh sampai ketinggian 1500 m diatas
permukaan laut, tetapi ketinggian idealnya adalah 650 m diatas permukaan
laut. Untuk pertumbuhan, kedelaiperlu suhu optimal 29,4ºC, pH tanah
6,0-6,8. Kedelai hitam dapat ditanam secara monokultur maupun tumpang sari,
di lahan kering (tegalan) maupun dilahan bekas padi di lahan sawah
3 b. Taksonomi Kacang Kedelai Hitam
Klasifikasi menurut USDA (2016): Kingdom : Plantae
Divisio : Magnoliophyta Kelas : Magnoliopsida Sub Kelas : Rosidae Ordo : Fabales
Famili : Fabaceae (Leguminosae) Sub famili : Faboideae
Genus : Glycine (L.) Merr. Spesies : Glycine soja
c. Kandungan dan Manfaat Kacang Kedelai Hitam
Kedelai mengandung karbohidrat kompleks, protein nabati, serat,
oligosakarida, isoflavon dan mineral kompleks. Kandungan serat
berkontribusi terhadap indeks glisemik yang rendah yang menguntungkan
bagi penderita diabetes untuk mengurangi risiko diabetes. Komposisi nutrisi
kedelai hitam kering adalah protein 420 mg/g, lemak 224 mg/g, karbohidrat
340 mg/g, kalsium 6 mg/g, fosfor 5 mg/g, dan besi 0,1 mg/g. Kandungan
senyawa bioaktif dalam kedelai hitam adalah sebagai berikut:
1)Oligosakarida
Kedelai hitam mengandung rafinosa dan stakiosa yang merupakan
komponen gula yang tidak dapat dicerna sehingga dapat menyebabkan
4
penelitian yang menunjukan bahwa oligosakarida dapat berperan sebagai
prebiotik. Kandungan stakiosa pada kacang kedelai hitam yaitu 37,2 mg/mL
dan kandungan Rafinosa yaitu 8,7 mg/mL (Potter, et al., 1993).
2)Isoflavon
Kedelai hitam terdapat lima jenis isoflavon, yaitu Daidzin (25
mg/100 g), Daidzein (92 mg/100gr), Genistin (22 mg/100 g), Genistein (51
mg/100 g), dan Glysitin (16 mg/100 g) (Hagiwara, 2010).
3)Antosianin
Dalam kacang kedelai hitam terdapat tiga macam Anthosianin yaitu
Delphinidin-3 Glukosida 0–3,71 mg/mL, Cyanidin-3-Glukosida 0,94 –15,98
mg/mL, dan Petunidin-3-Glukosida 0–1,41 mg/mL. Total kandungan
anthosianin dalam kacang kedelai hitam l1,58–20,18 (Potter, et al., 1993).
4)Saponin
Kandungan saponin kedelai hitam sebesar 310 mg/100 g. Menurut
Potter, et al, 1993, saponin menghambat pencer naan protein dikarenakan
adanya susunan saponin protein kompleks.
5)Serat Pangan Kandungan
Serat dalam kedelai hitam juga sangat tinggi. Serat kasarnya
sekitar 4% dan bermanfaat untuk membantu sistem pencernaan tubuh,
sehingga dapat mengurangi waktu transit zat-zat racun yang tidak
dibutuhkan tubuh. Di dalam kedelai hitam terdapat serat yang larut,dimana
serat yang larut itu akan menyerap air membentuk sebuah gel yang akan
5
mengandung serat tidak larut yang berguna untuk mengontrol kepadatan
feses dan mencegah sembelit (Potter, et al., 1993).
2. Fitoestrogen
Fitoestrogen merupakan zat yang terdapat pada tumbuhan dan
biji-bijian dengan struktur mirip estrogen, memiliki efek estrogenik lemah dan
dapat bekerja pada reseptor estrogen. Fitoestrogen berasal dari kata “fito”
yang berarti tanaman dan “estrogen” dikarenakan memiliki aktivitas
biologik dan struktur yang menyerupai estrogen endogen (Eddy Suparman,
2006:3).
Fitoestrogen mampu diserap oleh tubuh dan mengalami berbagai
perubahan melalui cara disekresikan ataupun dipecah menjadi
komponen-komponen lain dalam tubuh yang masih memiliki khasiat sama seperti
estrogen endogen. Aktivitas dan khasiat menyerupai estrogen ini tidak
berlangsung lama, dan pada umumnya tidak dapat lama disimpan oleh
jaringan tubuh (Biben, 2012:2).
Fitoestrogen memiliki struktur kimia yang serupa dengan 2
penilnaptalen yang rumus bangunnya sama dengan rumus bangun estrogen
endogen. Terdapat gugus OH pada Fitoestrogen, estradiol, dan
dietilstilbesrol merupakan salah satu dari persyaratan untuk aktivitas
estrogenik terjadi (Biben, 2012:2).
Jenis dari fitoestrogen yang sering terdapat pada tanaman antara lain:
6
Enterodiol dan Enterolactone, coumestans mengandung Coumestrol, dan
yang terakhir Tripterpene Glycosides (Eddy Suparman, 2006:3-5).
Satu jenis tanaman dapat mengandung lebih dari satu gugus aktif
fitoestrogen yaitu Isoflavon, Lignan atau Coumestans (Biben, 2012:2).
Menurut Hagiwara, 2010 Kacang kedelai hitam (Glycine soja) mentah
mengandung fitoestrogen jenis Isoflavon yang terdiri dari Daidzin,
Daidzein, Genistin, Genistein, dan Glysitin, dengan rincian sebagai berikut
Daidzin sebanyak 25 mg/100g, Daidzein sebanyak 92 mg/100g, Genistin
sebanyak 22 mg/100g, Genistein sebnayak 51 mg/100g, dan Glysitin
sebanyak 16 mg/100g.
7 3. Tikus Putih (Rattus norvegicus, L.)
Gambar 3. Rattus norvegicus, L. (Dokumentasi Penelitian 2016)
Di Indonesia, binatang percobaan ini sering dinamakan tikus besar,
akan tetapi jika lebih kecil lagi dinamakan mencit sehingga akan
membingungkan jika semuanya dinamakan tikus (Smith &
Mangkoewidjojo,1991: 36). Dibandingkan dengan tikus liar, tikus percobaan
lebih cepat dewasa yang tidak ditunjukkan oleh musim kawin dan seringnya
berbiak. Tikus liar dapat hidup sampai 4-5 tahun, sedangkan tikus percobaan
jarang yang lebih dari 3 tahun. Dua karakteristik yang membedakan tikus
putih dengan binatang percobaan yang lain adalah tikus tidak dapat
memuntahkan makanan karena susunan anatomi esophagus yang menyatu di
perut, serta tikus tidak mempunyai kantung empedu (John Smith, 1987:
36-37). Kelebihan dari tikus putih sebagai binatang percobaan antara lain bersifat
8
manusia dan kebutuhan gizinya juga hampir sama dengan manusia. Selain itu
dari segi ekonomi harganya murah, ukurannya kecil dan perkembangannya
cepat.
Tikus percobaan strain Wistar yang dikembangkan secara luas sangat
mudah menyesuaikan diri dengan lingkungannya. Makanan tikus juga
mempunyai variasi dalam susunannya, sebagai contoh komposisinya meliputi:
protein 20-25 %, karbohidrat 45-50%, serat 5%. Juga harus mengandung
vitamin A, vitamin D, Alfa tokoferol, Asam linoleat, Thiamin, Riboflavin, Panthothenat, biotin, serta mineral, Phospor, Magnesium, Potasium, tembaga, Iodin, besi dan timah. Setiap hari seekor tikus dewasa membutuhkan makanan
antara 12-20 gr, serta minum air antara 20-45 ml, serta mineral, besi sebesar
35 mg/kg ( Smith, 1987:41).
Data tentang fisiologi tikus putih (Rattus norvegicus, L.) menurut John
Smith (1987: 37) antara lain:
Tabel 1. Data Fisiologi Tikus Putih
Jangka hidup 2-3 tahun, ada yang dapat hidup selama 4 tahun
Produksi ekonomi 1 tahun
Kehamilan 20-22 hari
Umur saat disapih 21 hari
9
Berat lahir 5-6 gram
Volume darah 57-70 ml/gr
Sel darah merah 7,2 - 9,6x106/nm3
Sel darah putih 5,0 – 13,0x106/nm3
Trombosit 150 – 460x103/nm3
Tikus putih jenis (Rattus norvegicus, L.) sejak dulu sudah sering
digunakan sebagai hewan uji laboratorium karena anatomi fisiologi dari
organ-organ hewan tersebut sistematis kerjanya hampir sama dengan fungsi
anatomi organ manusia(John Smith, 1987:43).
a. Klasifikasi Tikus Putih (Rattus norvegicus, L.)
Klasifikasi tikus putih (Rattus norvegicus, L.) menurut Priyambodo,
1995:
Kingdom : Animalia
Filum : Chordata
Kelas : Mamalia
Famili : Muridae
Genus : Rattus
Spesies : Rattus norvegicus, L. (Priyambodo, 1995:55).
10
Tikus putih (Rattus norvegicus, L.) sering digunakan sebagai hewan
uji laboratorium karena anatomi dari organ-organ tikus putih bekerja
sistematis hampir sama dengan fungsional anatomi organ manusia. Oleh
karena itu, tikus putih banyak digunakan dalam uji praklinis yang selanjutnya
hasil ujinya dapat diaplikasikan dalam kehidupan manusia untuk
kesejahteraan khususnya di bidang medis atau kesehatan (Smith &
mangkoewidjojo, 1998 dalam Amri, 2012:16).
c. Siklus Estrus pada Tikus Putih
Tikus putih betina siap untuk bereproduksi saat telah berumur 50-60
hari. Vagina tikus putih mulai terbuka pada umur 35-90 hari dan testis tikus
jantan turun pada umur 20-50 hari. Siklus estrus pada tikus putih berlangsung
sekitar 4-5 hari dengan lama waktu selama 12 jam setiap siklus, estrus dimulai
pada malam hari (Malole & Pramono, 1989 dalam Amri, 2012:16).
Estrus adalah suatu periode dimana secara psikologis dan fisiologis
bersedia menerima pejantan untuk melakukan perkawinan. Sedangkan, siklus
estrus adalah suatu periode birahi ke permulaan periode berikutnya sampai
akhir periode (Nalbandov, 1990:140).
Vaginal smears, cervix smear dan endometrium smears, dapat menunjukan waktu ovulasi secara persis dan daur estrus. Ciri-ciri daur estrus
dapat diketahui sebagai berikut :
a) Proestrus : terdapat sel epitel biasa
11
c) Metestrus : terdapat banyak sel epitel menanduk, sel epitel biasa dan
leukosit
d) Diestrus : terdapat sel epitel biasa dan banyak leukosit
(Yatim, 1982:103).
Proestrus merupakan fase menjelang estrus dimana gejala birahi mulai
muncul akan tetapi hewan betina belum siap menerima pejantan untuk
melakukan kawin. Fase ini folikel de Graff tumbuh dibawah pengaruh FSH
dan menghasilkan estrogen dalam jumlah banyak. Pada fase ini, estradiol
menyebabkan betina mulai siap di dekat pejantan untuk melakukan kawin.
Pada tikus fase ini berlangsung selama kira-kira 12 jam (Smith dan
Mangkoewidjojo, 1988 dalam Daud, 2012:9).
Fase proestrus akan dilanjutkan ke fase estrus yang ditandai dengan
keinginan kelamin dan penerimaan jantan oleh hewan betina untuk kopulasi.
Fase estrus terjadi selama 12 jam. Fase ini estradiol yang berasal dari folikel
de Graff yang matang akan menyebabkan perubahan-perubahan pada saluran
reproduksi betina. Saat estrus konsentrasi estrogen meningkat sesuai dengan
pertumbuhan folikel de Graff , dan selanjutnya dibawah pengaruh LH yang
disekresikan dari hipofisis anterior terjadilah ovulasi dan pembentukan corpus
luteum. Ovulasi terjadi pada akhir estrus dalam waktu yang sangat singkat dan
akan terjadi fase metestrus dan diestrus. Saat corpus luteum telah mencapai
ukuran maksimal dan fungsional akan terjadi peningkatan konsentrasi
12
Gambar 4. Mikrograf Epitel Vagina Tikus Putih Fase Estrus Perbesaran 40X (Dokumentasi Penelitian, 2016)
Metestrus merupakan periode kelanjutan dari fase estrus yang
berlangsung selama 15 jam. Pada periode ini biasanya tidak terjadi
perkawinan, yang ditandai dengan bertumbuhnya corpus luteum dan sel-sel
granulosa folikel dengan cepat yang dipengaruhi oleh LH. Selama metestrus,
uterus menjadi agak lunak karena terjadi pengendoran otot serta melakukan
persiapan untuk menerima embrio (Daud, 2012:10).
Diestrus merupakan fase setelah metestrus. Fase ini merupakan fase
perpanjangan diantara fase-fase siklus estrus lainnya. Fase diestrus
berlangsung selama 60-70 jam. Pada fase ini kontraksi uterus menurun,
endometrium menebal, mukosa vagina menipis, warna lebih pucat dan
leukosit yang bermigrasi semakin banyak (Turner dan Bagnara, 1988 dala
13
Manifestasi birahi ditimbulkan oleh hormon estrogen yang dihasilkan
oleh folikel ovarium. Tikus yang sedang mengalami masa estrus cenderung
lebih sering bergerak aktif secara spontan dibandingkan saat mengalami masa
diestrus (Nalbandov, 1990:141).
4. Uterus
Uterus merupakan tempat implantasi konseptus atau zigot yang telah
berkembang menjadi embrio. Uterus mengalami serangkaian perubahan selama
birahi (estrus) dan daur reproduksi (Dellmann dan Brown, 1992:512).
[image:34.612.204.456.333.523.2]a. Anatomi
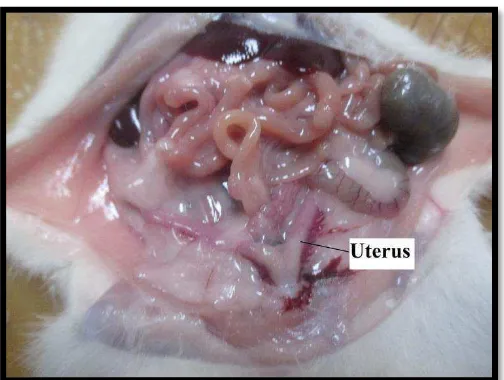
Gambar 5. Uterus Tikus Putih (Dokumentasi Penelitian, 2016)
Tikus memiliki uterus dupleks, dengan dua serviks, tanpa tubuh uterus,
dan tanduk terpisah secara sempurna. Seluruh organ tersebut melekat pada
14
lebar melalui ligamen inilah uterus menerima suplai darah dan saraf
(Nalbandov, 1990:33-34).
b. Struktur Histologik
Dinding uterus terdiri dari tiga lapis, yaitu: mukosa-submukosa atau
endometrium, tunika muskularis atau miometrium, dan tunika serosa atau
perimetrium.
1) Endometrium
Endometrium terdiri dari dua daerah yang berbeda dalam bangun serta
fungsinya. Lapis superfisial disebut zona fungsional, dapat mengalami
degenerasi sebagian atau seluruhnya selama masa reproduksi, estrus, dan daur
haid dan dapat hilang pada beberapa spesies. Suatu lapis dalam tipis, disebut
zona basalis, tetap bertahan sepanjang daur. Bila zona fungsional hilang, dapat
diganti oleh lapisan tersebut (Dellmann dan Brown, 1992:512-514).
2) Miometrium
Miometrium terdiri dari lapis otot dalam tebal yang umumnya tersusun
melingkar, dan lapis luar memanjang terdiri dari sel-sel otot polos yang
mampu meningkatkan jumlah serta ukurannya selama kebuntingan
berlangsung. Di antara kedua lapis tersebut, atau bagian dalam dari lapis
dalam, terdapat lapis vaskular yang mengandung arteria besar, vena serta
pembuluh limfe. Pembuluh darah tersebut memberikan darah pada
endometrium, lazimnya besar di daerah karunkula ruminansia (Dellmann dan
15 3) Perimetrium
Perimetrium atau tunika serosa, terdiri dari jaringan ikat longgar yang
dibalut oleh mesotel atau peritoneum. Sel-sel otot polos terdapat dalam
perimetrium. Banyak pembuluh darah, pembuluh limfe,dan saraf terdapat
pada lapis ini. Perimetrium, lapis memanjang dan miometrium, dan lapis
vaskular dari miometrium, seluruhnya berlanjut dengan bangun ligamentum
uterus (Dellmann dan Brown, 1992:515).
c. Fungsi Uterus
Fungsi uterus adalah:
a) Sewaktu perkawinan, kontraksi uterus mempermudah pengangkutan
spermatozoa ke tuba fallopi.
b) Sebelum implantasi, cairan uterus menjadi medium blastosit.
c) Sesudah implantasi, uterus menjadi tempat pembentukan plasenta dan
perkembangan fetus.
d) Waktu partus, kontraksi uterus berperan besar.
(Suhandoyo dan Ciptono, 2008:28).
d. Pengaruh Hormon pada Endometrium
Perubahan siklik pada endometrium diatur oleh aksi hormon-hormon
hipotalamus-hipofisis-gonad. Aktivitas hipotalamus dipicu oleh rangsangan
lingkungan luar dan kadar hormon estrogen di dalam sirkulasi darah.
Produsen utama dari hormon betina adalah ovarium dan hormon yang
16
bekerja untuk merangsang pertumbuhan dari endometrium dan miometrium.
Peningkatan dalam sintesis reseptor progesteron di dalam endometrium
dipengaruhi hormon estrogen yang mengakibatkan progesteron dapat
merangsang endometrium, tetapi setelah endometrium tersebut dirangsang
oleh estrogen terlebih dahulu. Terdapat rangsangan dari hormon yang
disekresikan oleh hipotalamus dalam proses produksi hormon-hormon
tersebut, antara lain FSH-RH dan LH-RF, FSH-RH (Follicle Stimulating
Hormon-Releasing Hormon) bertugas untuk merangsang agar FSH untuk disekresikan. FSH berfungsi untuk merangsang pembentukan folikel sampai
folikel tersebut masak tetapi tidak menyebabkan sel telur untuk ovulasi.
Folikel tersebut mensintesis dan mensekresi pembentukan estrogen, saat fase
folikel ini bertepatan dengan fase proliferasi pada uterus, peningkatan kadar
estrogen merangsang endometrium untuk menebal dan memiliki banyak
pembuluh darah sedangkan, LH-RF (Luteinizing Hormone-Releasing Factor)
berguna untuk merangsang sekresi dari LH. (Yatim, 1982:106-108).
Kerja dari semua hormon uterus yang paling mengalami perubahan
struktural secara teratur. Hormon estrogen akan mempengaruhi endometrium
dan miometrium yang merupakan lapisan penyusun dari uterus (Sugiyanto,
1996:20-30).Salah satu yang paling terlihat akibat pengaruh hormon estrogen
pada endometrium adalah perubahan ketebalan lapisan dari endometrium
tersebut. Perubahan ketebalan lapisan endometrium yang terjadi, maka jumlah
17
pada endometrium adalah meningkatkan jumlah kelenjar dan ketebalan
lapisannya.
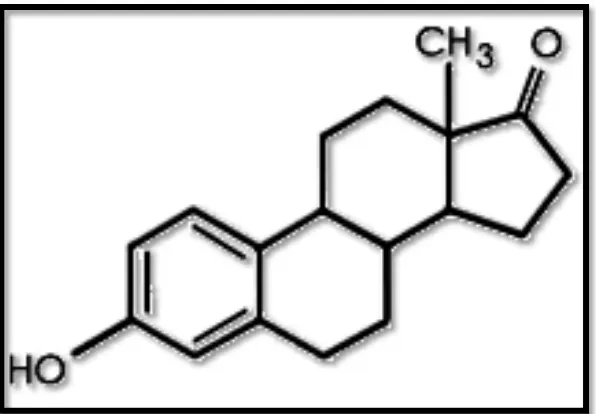
Dellmann dan Brown (1992) menyatakan estrogen adalah salah satu
dari hormon reproduksi betina yang disekresikan oleh sel-sel granulosa folikel
ovarium dengan struktur yang tersusun atas 18 atom C, gugus –OH fenolik
pada atam C-3, cincin A yang bersifat aromatik dan tidak memiliki gugus
metil pada atom C-10. Bentuk dari hormon estrogen yang terdapat tubuh
hewan betina berupa estradiol 17-β, estron dan estriol, tetapi hormon estrogen
yang lazim di jumpai dalam jumlah yang cukup tinggi dan sesuai dalam tubuh
[image:38.612.171.469.362.569.2]adalah estradiol 17-β.
Gambar 6. Struktur Kimia Estrogen (Suherman, 1995:11)
Hormon estrogen yang berasal dari sel-sel techa interna dapat memberikan efek berupa umpan balik positif maupun negatif. Apabila kadar
18
menghambat sintesis dari LH, inilah yang disebut dengan umpan balik positif.
Sedangkan, umpan balik negatif terjadi apabila kadar hormon estrogen tinggi
maka akan menghambat dan menghentikan sintesis dari FSH dan merangsang
sintesis dari LH (Partodiharjo, 1982:135-136).
Estrogen merangsang pertumbuhan miometrium dan endometrium.
Hormon ini juga meningkatkan sintesis reseptor progesteron di endometrium
sehingga progesteron mampu mempengaruhi endometrim hanya setelah
endometrium di rangsang oleh progesteron. Progesteron bekerja pada
endometrium yang telah dipersiapkan estrogen untuk mengubahnya menjadi
lapisan yang ramah dan mengandung banyak nutrisi bagi ovum yang sudah
dibuahi. Di bawah pengaruh progesteron, jaringan ikat endometrium menjadi
longgar dan endematosa akibat penimbunan elektrolit dan air, yang
mempermudah implantasi ovum yang dibuahi. Progesteron juga
mempersiapkan endometrium untuk menampung embrio yang baru
berkembang dengan merangsang kelenjar-kelenjar endometrium agar
mengeluarkan dan menyimpan glikogen dalam jumlah besar dan dengan
menyebabkan pertumbuhan pembuluh darah endometrium. Progesteron juga
menurunkan kontraktilitas uterus agar lingkungan di uterus tenang dan
kondusif untuk implantasi dan pertumbuhan embrio (Sherwood,
2001:713-714).
Estrogen berfungsi untuk manifestasi fisiologik dari uterus,
19
secara histologis pada ephitelium vagina selama siklus estrus, mengontrol
sekresi hormon pituitary (FSH dan LH) dan berpengaruh pada pertumbuhan kelenjar mamae pada manusia (Suhandoyo, dkk, 2009:34).
e. Siklus Endometrium
Endometrium mempunyai dua daerah berbeda baik bentuk maupun
fungsinya. Daerah yang pertama merupakan lapis superficial disebut zona
fungsional, yang mengalami perusakan sebagian atau seluruhnya selama masa
estrus, fase reproduksi atau daur haid dan dapat hilang pada beberapa spesies.
Daerah kedua merupakan suatu lapisan dalam tipis atau sebagai zona basalis,
yang akan tetap bertahan sepanjang daur. Zona basalis sendiri berguna untuk
menggantikan zona fungsional ketika zona fungsional hilang. Bagian
superficial yang terdiri dari jaringan ikat longgar yang mengandung banyak
pembuluh darah dan sel-sel jaringan ikat seperti makrofag, fibroblast dan sel
mast terdeapat di bawah epitel zona fungsional. Sedangkan, jaringan ikat
longgar yang mengandung sedikit sel dibandingkan lapis superficial terdapat
pada bagian dalam zona fungsional (Dellmann dan Brown, 1992:512-514).
Terdapat tiga fase yang terjadi pada endometrium, yaitu fase
proliferasi, fase sekresi atau fase luteal dan fase menstruasi. Fase proliferasi
terjadi bersamaan dengan perkembangan folikel dan pembentukan estrogen
20
mitosis pada sel epitel dan sel kelenjar. Kelenjar nampak lurus dan lumen
uterus sempit pada akhir masa proliferasi. Dilanjutkan dengan fase sekresi
yang diawali setelah ovulasi, pada fase ini hormon yang berpengaruh adalah
hormon progesteron yang disekresikan oleh korpus luteum. Progesteron
berfungsi untuk merangsang sel kelenjar untuk mengeluarkan sekret. Di akhir
fase sekresi, terjadi kematian endometrium akibat dari dinding arteria spiralis
yang mengalami kontraksi, menutup aliran darah dan akhirnya menimbulkan
iskemia.
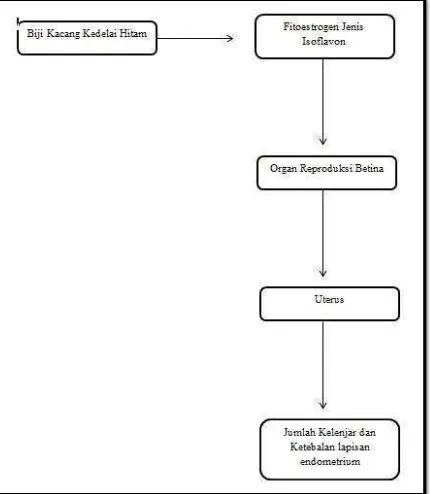
B. Kerangka Berpikir Penelitian
Tanaman yang masuk ke dalm kelompok leguminosae dan fabaceae
mengandung fitoestrogen dalam jumlah yang banyak dibandingkan dengan
kelompok tumbuhan yang lainnya. Salah satu tanaman dari kelompok fabaceae
adalah kacang kedelai hitam. Kacang kedelai hitam mengandung fitoestrogen jenis
isoflavon. Fitoestrogen merupakan senyawa yang berasal dari tanaman yang
memiliki struktur mirip dengan estrogen endogen dan memiliki pengaruh terhadap
aktivitas estrogenik dalam tubuh. Pengaruh tersebut dapat terjadi dikarenakan
fitoestrogen dapat berikatan dengan reseptor estrogen endogen dalam tubuh
walaupun pengaruhnya lebih rendah dari estrogen endogen.
Pemberian fitoestrogen yang terdapat pada ekstrak kacang kedelai hitam
diharapkan mampu memberikan efek estrogenik terhadap lapisan endometrium
tikus putih dilihat dari jumlah kelenjar dan ketebalan lapisan endometrium.
21
dari struktur kelenjar endometrium merupakan kelenjar tubular sederhana. Aksi
dari hormon estrogen sepanjang fase folikular menyebabkan proliferasi lapisan
endometrium, termasuk pada kelenjar endometrium. Adanya peningkatan
kandungan estrogen dapat merangsang pertumbuhan dan percabangan kelenjar
endometrium yang berpengaruh terhadap ketebalan endometrium, tetapi uliran dan
sekresi kelenjar tidak dapat terjadi sebelum adanya rangsangan dari hormon
22
23 C. Hipotesis
1. Pemberian ekstrak kacang kedelai hitam dapat mempengaruhi jumlah kelenjar
endometrium tikus putih (Rattus norvegicus, L.).
2. Pemberian ekstrak kacang kedelai hitam dapat mempengaruhi ketebalan lapisan
BABBIII
METODEBPENELITIAN
A. JenisBPenelitian
Jenis penelitian adalah eksperimen satu faktor dengan menggunakan
rancangan pola acak lengkap.
B. RancanganBPenelitian
Penelitian yang dilaksanakan merupakan penelitian eksperimen,
rancangan penelitian yang digunakan adalah rancangan acak lengkap (RAL)
dengan empat kelompok, yaitu : 1 kelompok kontrol dan 3 kelompok perlakuan
dengan masing-masing kelompok 4 ekor tikus putih sebagai ulangan.
Pemberian ekstrak kacang kedelai hitam dengan volume 2 ml perhari sesuai
dengan dosis masing-masing perlakuan selama 21 hari secara oral yang
didasarkan pada hasil uji pendahuluan, yaitu sebagai berikut:
1. Kontrol = kelompok tanpa perlakuan ekstrak kacang kedelai
hitam (Glycine soja) 0 mg/200 g/hari dan diberi
perlakuan aquadesh 2 ml/200 g/hari.
2. Perlakuan 1 = kelompok dengan perlakuan ekstrak kacang
kedelai hitam (Glycine soja) 50 mg/200 g/hari.
3. Perlakuan 2 = kelompok dengan perlakuan ekstrak kacang
kedelai hitam (Glycine soja) 100 mg/200 g/hari.
4. Perlakuan 3 = kelompok dengan perlakuan ekstrak kacang
kacang kedelai hitam (Glycine soja) 150 mg/200
g/hari.
C. WaktuBdanBTempatBPenelitian
1. Waktu
Penelitian ini dilaksanakan pada 12Oktober –30November2016.
2. Tempat Penelitian
a. Pembuatan ekstrak kacang kedelai hitam dilakukan di Unit II Fakultas
Farmasi UGM dengan teknik ekstraksi maserasi.
b. Pemeliharaan tikus dilakukan di Unit Pengelolaan Hewan Laboratorium
Biologi FMIPA UNY.
c. Pembuatan preparat histologik organ dilakukan di Laboratorium
Biologi FMIPA UNY dan di Laboratorium Patologi Anatomi Fakultas
Kedokteran Hewan UGM.
d. Pengamatan preparat histologik endometrium dilakukan di laboratorium
Mikroskopi dan Zoologi Jurdik Biologi FMIPA UNY.
D. PopulasiBdanBSampel
1. Populasi
Tikus putih.
2. Sampel
16 ekor tikus putih betinaumur ± 2 bulan dan memiliki berat 200 gram yang
diberi perlakuan ekstrak kacang kedelai hitam.
E. VariabelBPenelitian
1. Variabel Bebas
Ekstrak kacang kedelai hitam dengan dosis perlakuan :
P0 : 0 mg (kontrol)
P1 : 50 mg/200 g/hari.
P2 : 100 mg/200 g/hari.
P3 : 150 mg/200 g/hari.
2. Variabel Tergayut
a. Jumlah kelenjar endometrium
b. Ketebalan lapisan endometrium tikus putih.
3. Variabel Kontrol
Dosis ekstrak masing-masing dengan volume 2 ml, tikus putih betina strain
wistar, waktu pemberian ekstrak kacang kedelai hitam.
F. AlatBdanBBahanBPenelitian
1. Alat
a. Kandang tikus
b. Tempat pakan dan minum
c. Alat suntik 5 ml
d. Botol jam
e. Botol flakon
f. Sarung tangan
g. Sonde oral
h. Cotton buds
i. Kertas label
j. Mikroskop
k. Bak parafin
l. Alat bedah
m.Gelas preparat
n. Mikrometer objektif
o. Mikrometer okuler
p. Alat ekstraksi maserasi
q. Alat tulis
r. Mikrotom
s. Nampan
2. Bahan
a. Tikus putih betina umur 2
bulan.
b. Alkohol 70%, 80%, 96%,
absolut
c. Pakan tikus
d. Formalin10%
e. Chloroform
f. Aquadesh
g. Pewarna Eosin
h. Parafin
i. Pewarna Giemsa
j. NaCl
k. Serbuk gergaji
l. Kacang kedelai hitam
m.Xylol
n. Toluol
o. Haematoxylin
p. Glyserin
q. Etanol 96%
r. Canada balsam
G. LangkahBPenelitian
1. Tahap persiapan
a. Menyiapkan 16 tikus putih betina dengan umur ± 2 bulan dengan berat 200
gram.
b. Menyiapkan kandang tikus sebanyak 4 buah.
c. Menyiapkan kacang kedelai hitam yang sudah dikeringkan.
d. Melakukan ekstraksi kacang kedelai hitam dengan teknik ekstraksi maserasi
di Laboratorium Penelitian dan Pengujian Terpadu (LPPT) UGM.
H.
I.
2. Tahap pembuatan ekstrak kacang kedelai hitam dengan teknik ekstraksi
maserasi
a. Biji kering kacang kedelai hitam dihancurkan menjadi bentuk serbuk,
kemudian massa yang telah halus dimasukkan ke dalam maserator dan
dituangi dengan etanol 96% .
b. Proses maserasi yang dilakukan dengan cara perendaman dibiarkan selama
c. Cairan hasil ekstraksi ditampung dan sisa ampas direndam kembali dengan
etanol 96% dan dibiarkan selama 24 jam.
d. Cairan hasil maserasi ditampung kembali dan dilakukan kembali maserasi
pada sisa serbuk kacang kedelai hitam hingga didapat tiga cairan hasil
maserasi.
e. Seluruh hasil maserasi tersebut dievaporasi menggunakan alat evaporator
sehingga diperoleh ekstrak kental yang terpisah dari pelarut etanolnya.
3. Aklimatisasi
a. Menyiapkan 16 ekor tikus putih betina (Rattus norvegicus, L.) berumur 2
bulan.
b. Menyiapkan 4 buah kandang dan memasukkan tikus putih secara acak
sebanyak 4 ekor tikus kedalam masing-masing kandang.
c. Memberikan pakan dan minum tikus setiap hari.
d. Membersihkan kandang 2 kali seminggu dengan mengganti alas berupa
serbuk gergaji.
e. Tahap aklimatisasi berlangsung selama 7 hari.
4. Perhitungan dosis
J. Penentuan dosis perlakuan pada penelitian didasarkan pada hasil uji
pendahuluan, dimana pada uji pendahuluan terdiri dari 4 kelompok perlakuan.
Satu kelompok kontrol (0 mg ekstrak kacang kedelai hitam) dan tiga kelompok
perlakuan, masing-masing 50 mg, 100 mg, 150 mg ekstrak kacang kedelai
hitam. Berikut hasil dari uji pendahuluan:
K. Tabel 2. Rata-rata Jumlah Kelenjar Endometrium (unit) Uji Pendahuluan
L. Jumlah
Kelenjar Endometrium
M. Perlakuan
O. Kontrol P. P1
(50mg)
Q. P2 (100mg)
R. P3 (150mg)
T. 6,590 U. 11,675 V. 9,985 W. 8,335
X.
Y. Tabel 3. Rata-rata Ketebalan Lapisan Endometrium (µm) Uji Pendahuluan
Z. Ketebala
n Lapisan Endometrium
AA. Perlakuan
AC. Kontrol AD. P1
(50mg)
AE. P2 (100mg)
AF. P3 (150mg)
AH. 359,068 AI. 370,280 AJ. 433,110 AK. 316,682
AL.
AM. Hasil uji pendahuluan diatas, dosis yang berpengaruh menaikkan
jumlah kelenjar dan ketebalan lapisan endometrium adalah pada dosis
perlakuan P1 (50mg) dan P2 (100mg). Berdasarkan besar dosis tersebut, pada
penelitian ini ditentukan 4 kelompok perlakuan, yaitu 1 kelompok kontrol (0mg
ekstrak kacang kedelai hitam) dan 3 kelompok perlakuan P1 (50mg), P2
(100mg) dan P3 (150mg) ekstrak kacang kedelai hitam, dengan selisih dari
b. Kandungan isoflavon pada setiap dosis perlakuan.
AN. Kacang kedelai hitam mengandung fitoestrogen jenis isoflavon, dalam
100 gram kacang kedelai hitam mengandung isoflavon sebanyak 206 mg.
Sehingga kandungan isoflavon dalam setiap dosis perlakuan adalah sebagai
beriku:
d.1) Dosis 50 mg
AO. 100 gram = 100.000 mg
AP. 100.000 mg mengandung 206 mg isoflavon
AQ. Maka, dalam 50 mg mengandung isoflavon sebanyak:
AR. 100.000 X = 206 x 50 mg
AS. X = 10.300 : 100.000
AT. X = 0,103 mg isoflavon.
d.2) Dosis 100 mg
AU. 100 gram = 100.000 mg
AV. 100.000 mg mengandung 206 mg isoflavon
AX. 100.000 X = 206 x100 mg
AY. X = 20.600 : 100.000
AZ. X = 0,206 mg isoflavon.
d.3) Dosis 150 mg
BA. 100 gram = 100.000 mg
BB. 100.000 mg mengandung 206 mg isoflavon
BC. Maka, dalam 150 mg mengandung isoflavon sebanyak:
BD. 100.000 X = 206 x150 mg
BE. X = 30.900 : 100.000
BF. X = 0,309 mg isoflavon.
5. Tahap pelaksanaan
a. Pemberian ekstrak kacang kedelai hitam.
BG. Ekstrak kacang kedelai hitam diberikan secara oral pada tikus putih
sesuai dosisnya masing-masing, setiap 1 kali sehari selama 21 hari pada pukul
b. Pemeliharaan tikus putih dengan pemberian pakan secara rutin dan teratur
setiap hari.
c. Pengambilan apus vagina.
BH. Pengambilan apus vagina dilakukan untuk mengetahui
siklus estrus pada tikus putih. Siklus estrus perlu diketahui karena perlakuan
dimulai dan diakhiri saat tikus putih sedang mengalami fase estrus. Prosedur
pembuatan apus vagina adalah gelas benda dibersihkan dengan alkohol 70%.
Cotton bud dicelupkan ke dalam NaCl fisiologis, kemudian dimasukkan ke
dalam vagina tikus sedalam 1 cm kemudian diputar secara perlahan dan merata
sehingga diperoleh jaringan mukosa vagina selanjutnya dioleskan di atas gelas
objek sambil diputar sehingga diperoleh olesan yang merata. Gelas objek
kemudian dikeringanginkan dan difiksasi dengan methanol 70% selama 15
menit dan diwarnai menggunakan pewarna giemsa selama 20 menit. Setelah
itu, sediaan tersebut dicuci menggunakan air mengalir dan dikeringkan pada
suhu kamar. Preparat apus vagina kemudian diamati dibawah mikroskop
cahaya.
d. Pembuatan preparat histologik
BI. Eutanasi dilakukan terhadap tikus setelah perlakuan selama 21
hari. Eutanasi dilakukan saat tikus sedang dalam fase estrus, sehingga eutanasi
tikus mana yang sedang mengalami siklus estrus terlebih dahulu. Pembuatan
preparat dilakukan di Laboratorium Pathologi Kedokteran Hewan UGM dengan
prosedur sebagai berikut:
1) Melakukan pembiusan terhadap tikus dengan menggunakan kloroform.
2) Section (pembedahan)
BJ. Pembedahan bertujuan untuk mengambil organ uterus tikus
putih yang akan dibuat preparat dan diamati jumlah kelenjar dan ketebalan
lapisan endometriumnya.
3) Labelling (pemberian label)
BK. Uterus dimasukkan kedalam botol flakon dan ditempeli label.
4) Fixation
BL. Uterus yang telah diberi label segera dimasukkan dalam larutan
fiksatif supaya tidak terjadi autolisis post mortal. Fiksatif yang digunakan
adalah formalin 10%.
BM.
BN.
BP.
5) Dehydration
BQ. Dehidrasi merupakan penggantian molekul air dengan molekul
alkohol bertingkat mulai konsentrasi rendah hingga absolut dalam waktu
yang telah ditentukan:
a) Alkohol 70%, 3x @ 30 menit
b) Alkohol 80%, 3x @ 30 menit
c) Alkohol 90%, 3x @ 30 menit
d) Alkohol 96%, 2x @ 30 menit
e) Alkohol absolute, 1x @ 30 menit
6) Clearing (penjernihan)
BR. Pada proses clearing bertujuan untuk membersihkan cairan
dehidran dari dalam jaringan. Reagen penjernihan yang dipakai dalam
pembuatan preparat uterus adalah toluol, reagen pembersih ini akan diganti
dengan paraffin dengan cara penetrasi ke dalam jaringan.
BS. Proses infiltrasi dilakukan dengan oven pada temperatur
70-80ºC, suhu tersebut bertujuan supaya temperaturnya sesuai untuk penetrasi
parrafin selama proses berlangsung agar jaringan tgidak rusak. Parrafin
yang dipilih untuk membuat preparat adalah parrafin dengan titik leleh yang
tidak merubah keadaan sitologik dan sitokimia organ. Proses ini dilakukan
dengan memakai parrafin bertingkat, yaitu parrafin: toluol perbandingan
1:1, parafin murni 1, 2 dan 3 masing-masing selama 30 menit. Penetrasi
parrafin tergantung dari tebal tipisnya pemotongan preparat yang dipakai.
Parrafin kemudian dibiarkan memadat dan diberi petunjuk arah pemotongan
dan nama dari jaringan tersebut.
8) Sectioning (pemotongan dengan mikrotom)
a) Blok parrafin berisi jaringan diiris menggunakan scalpel, sehinggga
bagian yang akan diiris menggunakan mikrotom berbentuk segi empat.
Pengirisan menggunakan scalpel ini bertujuan supaya organ yang akan
dibuat menjadi preparat terletak pada tengah coupes (irisan tengah pita
preparat), kira-kira 3-5 mm dari tepi.
b) Meletakkan blok parrafin di holder kayu dengan mencairkan sedikit
parrafin pada kayu yang digunakkan.
c) Memasang holder dengan blok parrafin pada rotary mikrotom yang
d) Setelah terpasang, kemudian menyiapkan tempat pita preparat dan kuas
kecil untuk digunakan mengambil coupes dari pisau mikrotom.
e) Memasang pisau mikrotom pada tempatnya dan mengatur tebal tipisnya
coupes dengan pengaturan mikrotom.
f) Segera setelah diiris, pita preparat langsung dimasukkan dalam tempat
yang telah berisi air hangat, ini bertujuan agar coupes dapat terlentang
dan tidak terlipat.
9) Affixing
a) Meletakkan sejumlah coupes pada gelas benda yang telah diberi perekat
Gliserin albumin.
b) Memindahkan gelas benda yang berisi coupes di atas hotplate yang
bersuhu (40-45ºC), mengatur letak coupes dan merentangkannya,
menghisap kelebihan air dengan menggunakan kertas saring dan
membiarkan gelas benda di atas hotplate sampai kering selama 24 jam.
10)Staining (pewarnaan)
BT. Langkah pertama adalah melakukan deparafinnasi dengan
mencelupkan kaca benda yang telah ditempeli coupes ke dalam Xylol
selama 30 menit. Hematoxylyn-Eosin digunakan pada proses pewarnaan
a) Proses penghilangan parrafin selesai dilakukan, coupes dikeringkan dari
xylol mengguanakan kertas filter maupun tissue, selanjutnya melakukan
rehidrasi berturut-turut dengan mencelupkan ke dalam alkohol absolute,
alkohol 96%, 90%, 80%, 70% kemudian memasukkan dalam Eosin
selama 2 menit, mencelupkan ke dalam alkohol 60%, 50%, 40%, 30%,
20% kemudian dicelupkan ke dalam Hematoxylyn selama 10 menit dan
mencucinya menggunakan air mengalir.
b) Melakukan rehidrasi dengan mencelupkan berurutan mulai alkohol
20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 96% dan alkohol absolute
beberapa kali celupan kemudian mengeringkannya dengan kertas filter
atau tissue.
c) Menetesi slide dengan Canada Balsam.
BU.
11)Penutup
BV. Setelah ditetesi mengguanakan Canada Balsam kemudian
objek gelas ditutup dengan gelas penutup dan diusahakan tidak muncul
gelembung, karena adanya gelembung akan mengganggu pengamatan.
BW. Preparat histologik uterus yang telah dibuat diamati
menggunakan mikroskop dengan perbesaran 100X. Preparat diamati secara
sampling dan diamati seluruh bidang pandangnya, kemudian
membandingkan hasil yang diperoleh antara kelompok perlakuan dengan
kelompok kontrol.
a) Cara menghitung jumlah kelenjar endometrium adalah dengan
menghitung seluruh kelenjar yang tampak melalui cara sampling, yaitu
kelenjar dihitung per satuan lapang pandang dengan perbesaran 100X.
Cara menentukan satuan lapang pandang adalah dengan menghitung
luas area pandang menggunakan rumus r2, yang sebelumnya telah
dilakukan kalibrasi antara mikrometer okuler dan obyektif.
BX. Hasil kalibrasi tersebut adalah sebagai berikut:
BY. Skala objektif (ob) = 1 µm
BZ. Skala okuler = 10 µm
CA. Perbesaran = 100X
CB. Rumus: skala okuler = skala objektif X perbesaran
CC. Sehingga, 10 ok = 1 ob X 100
CE. ok = 10, jadi 1 skala okuler = 10 µm
CF. Satuan lapang pandang = , dimana r = 108 µm
CG. r = 108 X 10 = 1080 µm
CH. Satuan lapang pandang =
CI. = 3,14 X 10802
CJ. = 3,66 X106 µm2.
b) Cara mengukur ketebalan lapisan endometrium diukur mulai lapisan
yang berbatasan langsung dengan lumen uterus sampai batas antara
lapisan endometrium dengan lapisan miometrium menggunakan
bantuan mikrometer okuler yang telah dikalibrasi dengan mikrometer
obyektif melalui rumus kalibrasi di atas. Ketebalan diukur
menggunakan skala pada mikrometer okuler, kemudian hasil yang
diperoleh dikaliakan dengan nilai kalibrasi 10, sehingga diperoleh nilai
ketebalan lapisan. Ketebalan lapisan endometrium diperoleh dari rerata
empat kali pengukuran sampling yaitu bagian atas, bawah, kanan dan
kiri endometrium.
CL. Sampel yang digunakan adalah 16 ekor tikus putih berumur ± 2 bulan
yang sudah dibagi menjadi 4 kandang dengan 1 kandang merupakan kelompok
kontrol dan 3 kandang merupakan kelompok perlakuan .
CM. Pemilihan sampel dilakukan secara acak dengan pemberian tanda
berupa angka 1 sampai 16 di kepala tikus putih. Kemudian membuat potongan
kertas yang diberi tulisan angka 1 sampai 16. Kertas dilipat kemudian dimasukkan
ke dalam toples kecil. Kertas dipilih dan diambil dengan mata terpejam secara
acak. Kertas yang terpilih disesuaikan dengan tikus putih yang dengan nomor
dikepalanya. Kemudian dimasukkan ke dalam masing-masing kandang sebanyak 4
ekor sampai ke empat kandang terisi rata.Berikut adalah tabel data pengacakan
tikus putih:
CN. Tabel 4. Data Pengacakan Tikus Putih pada Masing-masing Kandang
CO. CP. Kandang
1 CQ. Kandang 2 CR. Kandang 3 CS. Kandang 4 CT. Angk a di kepal a tikus putih
CU.5 CV. 1 CW.7 CX.8
CZ. 12 DA.4 DB.16 DC.13
DE.15 DF. 10 DG.2 DH.9
DJ. 3 DK.6 DL. 14 DM.
11
DN.
DO. TeknikBPengumpulanBdata
DP. Penelitian diakhiri pada hari ke-21 dan tikus di eutanasi untuk diambil
uterus dengan pengecatan HE. Pengumpulan data melalui pengamatan pada
preparat uterus yang telah dibuat dan diambil dokumentasinya kemudiann dihitung
jumlah kelenjar endometrium dan diukur ketebalan lapisan endometrium pada
kelompok kontrol dan kelompok perlakuan ekstrak kacang kedelai hitam,
keseluruhan hasil pengamatan kemudian dianalisis.
DQ.
DR.
DS.
DT.AnalisisBData
DU. Data jumlah kelenjar endometrium dianalisis menggunakan analisis
nonparametrik kruskal-wallis untuk mengetahui ada tidaknya pengaruh pemberian
ekstrak kacang kedelai hitam terhadap jumlah kelenjar endometrium.
DV. Data ketebalan endometrium dianalisis dengan analisis statistik One
Way Anova untuk mengetahui apakah terdapat perbedaan pengaruh dosis ekstrak
kacang kedelai hitam terhadap ketebalan endometrium tikus putih kelompok
kontrol dan kelompok perlakuan, selanjutnya apabila terdapat pengaruh nyata,
maka dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) untuk
mengetahui perbedaan dari masing-masing kelompok perlakuan.
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Hasil Penelitian
Hasil penelitian mengenai pengaruh pemberian ekstrak kacang kedelai
hitam (Glycine soja) terhadap jumlah kelenjar dan ketebalan lapisan endometrium
tikus putih (Rattus norvegicus, L.) adalah sebagai berikut:
1. Pengaruh Pemberian Ekstrak Kacang Kedelai Hitam terhadap Jumlah Kelenjar Endometrium
Data hasil penelitian mengenai jumlah kelenjar endometrium diamati
di Laboratorium Mikroskopi, dengan cara mengamati preparat uterus di
bawah mikroskop, kemudian menghitung jumlah keseluruhan kelenjar
endometrium melalui cara sampling, yaitu kelenjar dihitung per satuan lapang
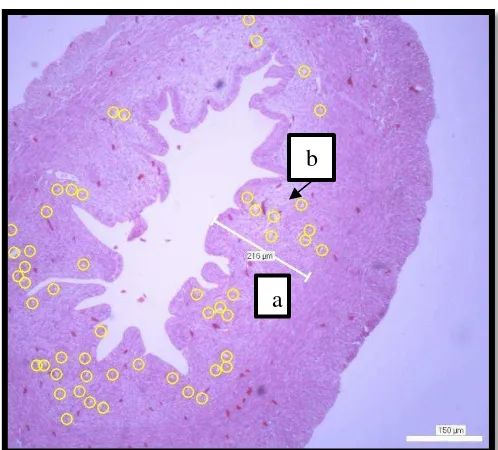
Gambar 8. Mikrograf Endometrium Tikus Putih Setelah Mendapat Perlakuan Pemberian Ekstrak Kacang Kedelai Hitam (HE, Perbesaran Lensa Objektif 4X).
Keterangan: (a) lapisan endometrium tikus putih betina (b) kelenjar endometrium tikus putih betina
Penyusun lapisan endometrium terdiri dari jaringan ikat longgar,
kelenjar endometrium dan sel epitel kolumner. Jaringan ikat longgar adalah
jaringan yang paling dominan dalam menyusun lapisan endometrium.
Kelenjar endometrium merupakan kelenjar yang mengalami perubahan
sepanjang siklus estrus berlangsung. Kelenjar ini memiliki fungsi untuk
memberikan nutrisi yang diperlukan oleh embrio yang telah mengalami
implantasi. Epitel kolumner pada lapisan endometrium terdapat pada bagian
paling luar dan mengelilingi bagian permukaan luar dari lapisan endometrium. a
Perhitungan jumlah kelenjar endometrium dilakukan dengan
menggunakan alat bantu hitung atau counter. Hasil dari perhitungan jumlah kelenjar endometrium dapat dilihat pada tabel 5 sebagai berikut:
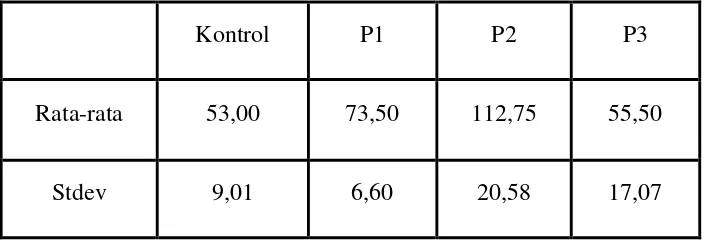
Tabel 5. Data Jumlah Kelenjar Endometrium Uterus Tikus Putih Setelah Pemberian Ekstrak Kacang Kedelai Hitam
Kontrol P1 P2 P3
Rata-rata 53,00 73,50 112,75 55,50
Stdev 9,01 6,60 20,58 17,07
Data jumlah kelenjar endometrium pada tabel 4 tersebut
menunjukkan bahwa kelompok kontrol memiliki rata-rata jumlah sebesar
53,00. Pada kelompok perlakuan 1 mengalami kenaikan rata-rata jumlah
menjadi 73,50. Terjadi kenaikan rata-rata jumlah kelenjar endometrium pada
kelompok perlakuan 2 menjadi 112,75 dan pada kelompok perlakuan 3 terjadi
penurunan rata-rata jumlah kelenjar endometrium menjadi 55,50. Jumlah
kelenjar endometrium terbesar terdapat pada kelompok perlakuan 2 dengan
dosis ekstrak 100 mg/ekor/hari dibandingkan dengan kelompok perlakuan 1, 3
[image:67.612.145.500.209.331.2]Gambar 9. Diagram Jumlah Kelenjar Endometrium Uterus Tikus Putih Sesudah Pemberian Ekstrak Kacang Kedelai Hitam
Diagram tersebut menunjukkan bahwa jumlah kelenjar endometrium
uterus tikus putih mengalami peningkatanpada kelompok perlakuan 1,
selanjutnya mengalami peningkatan jumlah kembali pada kelompok perlakuan
2, kemudian terjadi penurunan pada kelompok perlakuan 3. Peningkatan
jumlah kelenjar endometrium terbesar terdapat pada kelompok perlakuan 2
dengan dosis 100 mg/ekor/hari.
Data yang diperoleh dari pemberian perlakuan ekstrak kacang kedelai
hitam terhadap jumlah kelenjar endometrium tersebut merupakan data yang
diperoleh melalui perhitungan jumlah, sehimgga analisis data yang cocok
digunakan adalah uji non-parametrik Kruskal Wallis karena dengan uji
53 73.5 112.75 55.5 0 20 40 60 80 100 120
0 mg 50 mg 100 mg 150 mg
[image:68.612.147.525.86.355.2]tersebut data yang dianalisis tidak memerlukan distribusi normal maupun
[image:69.612.145.325.197.277.2]homogen. Hasil dari uji Kruskal Wallis dapat dilihat pada tabel 6 sebagai berikut:
Tabel 6. Uji Kruskal Wallis Jumlah Kelenjar Endometrium Tikus Putih Jumlah
Chi-Square 11.605
Df 3
Asymp. Sig. .009
Berdasarkan hasil uji non-parametrik Kruskal Wallis pada tabel 6 tersebut diperoleh hasil bahwa nilai signifikasinya adalah sebesar 0.009. Dari
data tersebut menunjukkan bahwa nilai signifikansi 0,05 (p<0,05),
menunjukkan bahwa terdapat perbedaan pengaruh yang sangat nyata antar
kelompok kontrol dengan kelompok perlakuan, sehingga menunjukkan bahwa
perlakuan pemberian ekstrak kacang kedelai hitam memberikan pengaruh
nyata terhadap jumlah kelenjar endometrium uterus tikus putih.
2. Pengaruh Pemberian Ekstrak Kacang Kedelai Hitam terhadap Ketebalan Lapisan Endometrium
Data hasil penelitian mengenai ketebalan lapisan endometrium
menggunakan bantuan mikrometer objektif dan okuler yang dipasang pada
mikroskop. Pengambilan data terlebih dahulu dilakukan kalibrasi antara skala
mikrometer objektif dan okuler untuk menentukan ukuran satuan dari
mikrometer okuler.
Gambar 10 di bawah, terlihat bahwa uterus terdiri dari tiga lapisan
penyusun, yaitu endometrium, miometrium dan perimetrium. Jika dilihat dari
lumen uterus lapisan paling luar adalah endometrium, lapisan tengah adalah
miometrium dan lapisan paling dalam adalah perimetrium. Ketebalan lapisan
pada endometrium tidak sama disetiap sisinya,dikarenakan sisi dari
endometrium tidak rata tetapi berlekuk-lekuk. Terdapat kelenjar endometrium
juga berpengaruh pada ketebalan endometrium.
Ketebalan lapisan endometrium diukur mulai lapisan yang berbatasan
langsung dengan lumen uterus sampai batas antara lapisan endometrium
Gambar 10. Mikrograf Uterus Tikus Putih Setelah Pemberian Perlakuan Ekstrak Kacang Kedelai Hitam (HE, Perbesaran Lensa Objektif 4X)
Keterangan: (a) endometrium
(b) miometrium
(c) perimetrium
Data rata-rata ketebalan lapisan endometrium yang diperoleh adalah
sebagai berikut:
Tabel 7. Data Ketebalan Lapisan Endometrium (µm) Uterus Tikus Putih setelah Pemberian Ekstrak Kacang Kedelai Hitam (40X)
Kontrol P1 P2 P3
Rata-rata 351,66 585,20 650,62 365,60
Stdev 179,12 88,42 104,15 29,91
Data tabel 7 menunjukkan bahwa ketebalan endometrium uterus tikus
putih memiliki nilai rata-rata tertinggi pada kelompok perlakuan 2 dengan c
[image:71.612.176.490.84.307.2]rata-rata ketebalan lapisan endometrium 650,62 µm, dibandingkan dengan
kelompok kontrol yang memiliki ketebalan lapisan endometrium 351,66 µm,
kelompok per