FORMULASI DAN EVALUASI PEMBERSIH TANGAN MENGANDUNG EKSTRAK KULIT BUAH LABU KUNING (Cucurbita moschata) SEBAGAI
ANTIBAKTERI
SKRIPSI
OLEH:
MELLITA KOSASIH NIM 171501101
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
FORMULASI DAN EVALUASI PEMBERSIH TANGAN MENGANDUNG EKSTRAK KULIT BUAH LABU KUNING (Cucurbita moschata) SEBAGAI
ANTIBAKTERI
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH:
MELLITA KOSASIH NIM 171501101
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
iii
PENGESAHAN SKRIPSI
FORMULASI DAN EVALUASI PEMBERSIH TANGAN MENGANDUNG EKSTRAK KULIT BUAH LABU KUNING (Cucurbita moschata) SEBAGAI
ANTIBAKTERI
OLEH:
MELLITA KOSASIH NIM 171501101
Dipertahankan di Hadapan Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara pada Tanggal:
Disetujui oleh:
Pembimbing I,
Dra. Nazliniwaty, M.Si., Apt.
NIP 196005111989022001
Panitia Penguji:
Popi Patilaya, S.Si., M.Sc., Apt.
NIP 197812052010121004
Imam Bagus Sumantri, S.Farm., M.Si.,Apt.
NIP 198212242014041001
Dra. Nazliniwaty, M.Si., Apt.
NIP 196005111989022001
Ketua Program Studi Sarjana Farmasi,
Dr. Sumaiyah, M.Si., Apt.
NIP 197712262008122002
Imam Bagus Sumantri, S.Farm., M.Si.,Apt.
NIP 198212242014041001
Mariadi, S.Farm., M.Si., Apt.
NIP 198403052017041001 Medan, September 2021
Disahkan Oleh:
Dekan,
Khairunnisa, S.Si., M.Pharm, Ph.D, Apt.
NIP 197802152008122001
iv
KATA PENGANTAR
Puji syukur ke hadirat Tuhan Yang Maha Esa atas berkat dan kasih-Nya kepada penulis sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Formulasi dan Evaluasi Pembersih Tangan Mengandung Ekstrak Kulit Buah Labu Kuning (Cucurbita Moschata) sebagai Antibakteri”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Kulit buah labu kuning (Cucurbita moschata) mengandung senyawa- senyawa antibiotik dan dapat digunakan sebagai sumber antibiotik yang baru.
Selama ini kulit labu kuning dianggap hanya sebagai sampah tidak terpakai.
Penelitian-penelitian terhadap pemanfaatan kulit buah labu kuning juga sangat jarang dilakukan, padahal kulit buah labu kuning sangat banyak manfaatnya.
Penelitian ini bertujuan untuk memformulasikan sediaan pembersih tangan menggunakan ekstrak kulit buah labu kuning (Cucurbita moschata). Dari hasil penelitian menunjukan bahwa ekstrak kulit buah labu kuning (Cucurbita moschata) dapat digunakan sebagai bahan aktif pembersih tangan yang dapat menghambat pertumbuhan bakteri, stabil dalam suhu kamar dan tidak mengiritasi kulit. Harapan penulis semoga penelitian ini dapat bermanfaat bagi masyarakat dan menambah ilmu pengetahuan tentang kegunaan kulit buah labu kuning.
Pada kesempatan ini dengan segala kerendahan hati penulis ingin menyampaikan ucapan terimakasih yang sebesar-besarnya kepada Ibu Dra.
Nazliniwaty, M.Si., Apt., selaku dosen pembimbing I dan Bapak Imam Bagus Sumantri, S.Farm., M.Si., Apt selaku dosen pembimbing II yang telah banyak memberikan bimbingan dan motivasi dengan tulus, ikhlas, dan penuh kesabaran selama penelitian dan penulisan. Ucapan terima kasih juga penulis sampaikan
v
kepada Bapak Popi Patilaya, S.Si., M.Sc., Apt, selaku ketua penguji dan Bapak Mariadi, S,Farm., M.Si., Apt selaku anggota penguji yang telah memberikan saran, kritik, serta arahan kepada penulis dalam menyelesaikan skripsi ini. Penulis juga menyampaikan rasa hormat dan terimakasih kepada Dekan Fakultas Farmasi Universitas Sumatera Utara, Ibu Khairunnisa, S.Si., M.Pharm., Ph.D., Apt., yang telah memberikan bantuan dan fasilitas selama masa pendidikan. Kepada Bapak dan Ibu staf pengajar Fakultas Farmasi USU serta kepada Ibu Poppy Anjelisa Zaitun Hasibuan Dr., M.Si., Apt., selaku dosen penasihat akademik yang telah memberikan nasihat dan bimbingan selama masa perkuliahan.
Penulis mengucapkan terima kasih dan penghargaan yang tulus kepada kedua orangtua, Ayah Asan Kosasih dan Ibu Eng Hong, adik Evelyn Kosasih, yang telah memberikan doa, dukungan moril hingga materiil serta kasih sayang yang tanpa henti dan tak terhingga kepada penulis sampai saat ini.
Pada kesempatan ini, penulis juga ingin menyampaikan rasa terimakasih kepada sahabat dan teman-teman stambuk 2017 Fakultas Farmasi USU yang telah mendengarkan dan memberikan motivasi beserta doa yang tulus sehingga skripsi ini dapat diselesaikan.
Skripsi ini jauh dari kata sempurna, oleh karena itu penulis meminta maaf apabila ada kesalahan dan kehilafan dalam penulisan skripsi. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahun khususnya dalam bidang Farmasi.
Medan, Penulis
Mellita Kosasih 171501101
vi
SURAT PERNYATAAN ORISINILITAS Saya yang bertanda tangan di bawah ini:
Nama : Mellita Kosasih
Nomor Induk Mahasiswa : 171501101 Program Studi : Sarjana Farmasi
Judul Skripsi : Formulasi dan Evaluasi Pembersih Tangan Mengandung Ekstrak Kulit Buah Labu Kuning (Cucurbita Moschata) sebagai Antibakteri
Dengan ini menyatakan bahwa skripsi yang saya buat adalah asli karya sendiri dan bukan plagiat. Apabila dikemudian hari diketahui bahwa skripsi saya tersebut terbukti plagiat karena kesalahan sendiri, maka saya bersedia diberi sanksi apapun oleh Program Studi Sarjana Farmasi Fakultas Farmasi Universitas Sumatera Utara.
Saya tidak akan menuntut pihak manapun atas perbuatan saya tersebut.
Demikian surat pernyataan ini saya perbuat dengan sebenarnya dan dalam keadaan sehat.
Medan, 1 September 2021
Mellita Kosasih NIM 171501101
vii
FORMULASI DAN EVALUASI PEMBERSIH TANGAN MENGANDUNG EKSTRAK KULIT BUAH LABU KUNING (Cucurbita moschata) SEBAGAI
ANTIBAKTERI
ABSTRAK
Latar Belakang: Kebersihan tangan sangat penting dalam pencegahan penyakit yang disebabkan oleh infeksi mikroorganisme. Pembersih tangan lebih efektif dan efisien dibandingkan dengan sabun sehingga masyarakat tertarik menggunakannya.
Kulit buah labu kuning (Cucurbita moschata) mengandung saponin dan flavonoid yang berperan sebagai antibakteri. Oleh karena itu kulit buah labu kuning dapat dimanfaatkan sebagai bahan dasar pembuatan pembersih tangan.
Tujuan: Memformulasikan ekstrak etanol kulit buah labu kuning dalam sediaan pembersih tangan serta uji aktivitas antibakeri ekstrak etanol kulit buah labu kuning dan sediaan pembersih tangan terhadap bakteri Escherichia coli dan Staphylococcus aureus.
Metode: Kulit buah labu kuning dibuat menjadi simplisia, kemudian diekstraksi secara perkolasi dengan etanol 96%. Dilakukan skrining fitokimia dan karaktetisasi simplisia dan ekstrak, dan uji aktivitas antibakteri ekstrak menggunakan metode difusi agar. Ekstrak kulit labu kuning diformulasikan dalam sediaan pembersih tangan dengan konsentrasi 2,5, 5, dan 7,5%. Dilakukan evaluasi sediaan meliputi uji organoleptik, homogenitas, pH, stabilitas selama 12 minggu, iritasi dan aktivitas antibakteri pembersih tangan dengan metode AOAC 960,09 terhadap bakteri Eschericia coli dan Staphylococcus aureus.
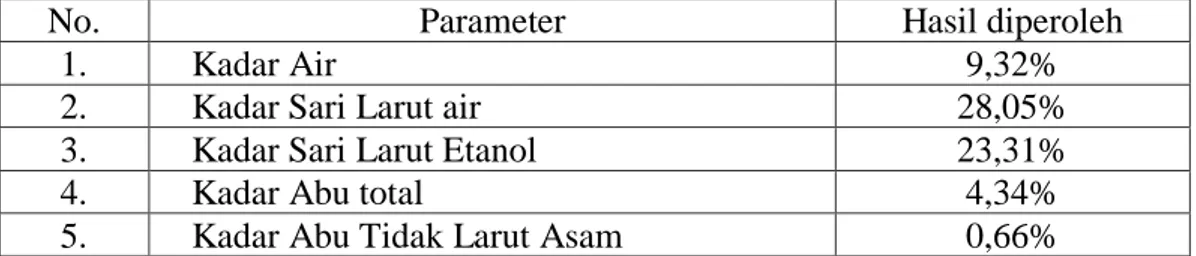
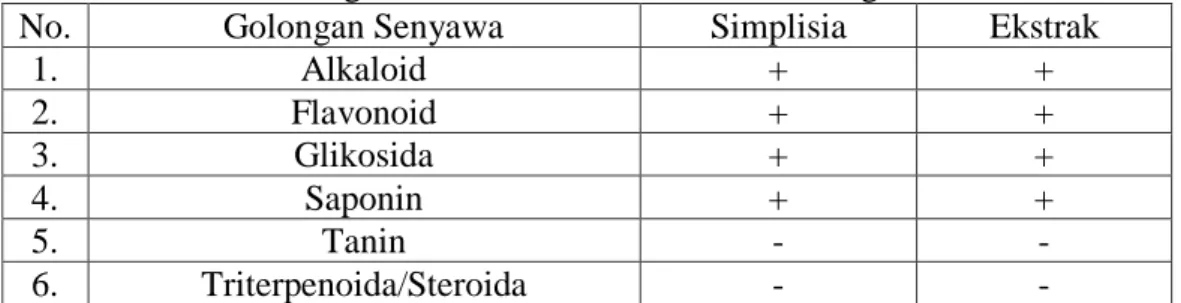
Hasil: Simplisia dan ekstrak kulit buah labu kuning mengandung senyawa alkaloid, flavonoid, glikosida dan saponin. Karakterisasi simplisia kulit labu buah kuning menunjukkan kadar air 9,32%; kadar sari larut air 28,05%; kadar sari larut etanol 23,13% ; kadar abu total 4,34% dan kadar abu tidak larut asam 0,66%. Karakterisasi ekstrak kulit labu buah kuning menunjukkan kadar air 6,65%; kadar abu total 1,48%
dan kadar abu tidak larut asam 0,26%. Ekstrak kulit buah labu kuning mulai memiliki aktivitas antibakteri pada konsentrasi 2,5%. Hasil evaluasi sediaan yaitu sediaan gel homogen, tidak mengiritasi, pH 5,8-6,3, stabil selama penyimpanan 12 minggu. Uji aktivitas antibakteri pembersih tangan ekstrak kulit buah labu kuning dengan konsenstrasi 7,5% mempunyai potensi yang paling baik diantara formula lainnya dalam menghambat pertumbuhan bakteri Eschericia coli sebesar 99,645%
dan Staphylococcus aureus sebesar 99,821% pada pada waktu kontak 90 detik.
Kesimpulan: Ekstrak kulit buah labu kuning dapat diformulasikan dalam sediaan pembersih tangan dan memiliki aktivitas antibakteri yang dapat menghambat pertumbuhan bakteri paling baik pada konsentrasi 7,5% diantara semua formula yang dibuat.
Kata Kunci: Kulit buah labu kuning, pembersih tangan, AOAC 960,09, Staphylococcus aureus, Eschericia coli.
viii
FORMULATION AND EVALUATION OF HAND SANITIZER CONTAINS THE EXTRACT OF PUMPKIN (Cucurbita moschata) RIND AS
ANTIBACTERIA ABSTACT
Background: Hand hygiene is very important in the prevention of diseases caused by infectious microorganisms. Hand sanitizer is more effective and efficient than soap, so people are interested in using it. Pumpkin rind (Cucurbita moschata) contains saponins and flavonoids that act as antibacterial. Therefore, pumpkin rind can be used as a basic ingredient for making antiseptic hand sanitizer.
Purposes: To formulate the extract of pumpkin rind into hand sanitizer as well as testing the antibacterial activity of the ethanolic extract of pumpkin rind and hand sanitizer against Escherichia coli and Staphylococcus aureus bacteria.
Methods: Pumpkin rind was made into dried powder, then extracted by percolation using 96% ethanol. Phytochemical screening and characterization of dried powder and extract were carried out, and the antibacterial activity of the extract was tested using the agar diffusion method. The extract of pumpkin rind was formulated into hand sanitizer with concentrations of 2.5, 5, and 7.5%. Evaluation included organoleptic tests, homogeneity, pH, stability for 12 weeks, irritation and antibacterial activity of hand sanitizers using the AOAC 960.09 method against Eschericia coli and Staphylococcus aureus bacteria.
Results: Dried powder and pumpkin rind extract contain alkaloids, flavonoids, glycosides and saponins. The simplicia characterization of pumpkin rind showed a moisture content of 9.32%; water soluble content 28.05%; ethanol soluble content 23.13% ; total ash content 4.34% and acid insoluble ash content 0.66%.
Characterization of pumpkin rind extract showed a water content of 6.65%; total ash 1.48% and acid insoluble ash 0.26%. Pumpkin rind extract started to have antibacterial activity at concentration of 2.5%. The results of the evaluation were homogeneous gel, non-irritating, pH 5.8-6.3, stable for 12 weeks of storage.
Antibacterial activity test of the extract of pumpkin rind hand sanitizer with a concentration of 7.5% has the best potential among other formulas in inhibiting the growth of Eschericia coli bacteria by 99.645% and Staphylococcus aureus by 99.821% at a contact time of 90 seconds.
Conclusion: : Extract of pumpkin peel can be formulated into hand sanitizer and has antibacterial activity that can inhibit bacterial growth the best at a concentration of 7.5% among all formulas made.
Keywords: Pumpkin skin, hand sanitizer, AOAC 960,09, Staphylococcus aureus, Eschericia coli.
ix DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERNYATAAN ORISINALITAS ... vi
ABSTRAK ... vii
ABSTACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
1.6 Kerangka Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Labu Kuning ... 5
2.1.1 Morfologi Labu Kuning ... 5
2.1.2 Sistematika Labu Kuning ... 6
2.1.3 Kandungan Labu Kuning ... 7
2.2 Simplisia ... 7
2.3 Ekstraksi ... 8
2.3.1 Ekstraksi Cara Dingin ... 8
2.3.1.1 Maserasi ... 8
2.3.1.2 Perkolasi ... 8
2.3.2 Ekstraksi Cara Panas ... 9
2.3.2.1 Infudasi ... 9
2.3.2.2 Digesti ... 9
2.3.2.3 Sokhletasi ... 10
2.3.2.4 Dekoktasi... 10
2.3.2.5 Refluks ... 10
2.4 Kulit... 10
2.5 Pembersih Tangan (Hand Sanitizer)….. ... 12
2.6 Gel ….. ... 12
2.7 Bakteri ... 14
2.7.1 Ukuran Bakteri ... 16
2.7.2 Bentuk Bakteri ... 16
2.7.2.1 Bentuk Basil ... 16
2.7.2.2 Bentuk Kokus ... 17
2.7.2.2 Bentuk Spiral ... 17
2.7.3 Metode Uji Antibakteri ... 18
2.7.4 AOAC 960.09 ... 20
2.8Uraian Bakteri Escherichia coli dan Staphylococcus aueus ... 20
2.8.1 Escherichia coli….. ... 20
x
2.8.2Staphylococcus aureus ... 21
2.9Bahan yang Digunakan dalam Gel Pembersih Tangan ... 22
BAB III METODE PENELITIAN... 24
3.1 Jenis Penelitian ... 24
3.2 Alat dan Bahan ... 24
3.2.1 Alat ... 24
3.2.2 Bahan... 25
3.3Pengambilan dan Pengolahan Sampel ... 25
3.3.1 Pengambilan Sampel ... 25
3.3.2 Identifikasi Tanaman ... 25
3.3.3 Pembuatan Simplisia ... 25
3.4Karakterisasi Simplisia ... 26
3.4.1Pemeriksaan Makroskopik ... 26
3.4.2Pemeriksaaan Mikroskopik ... 26
3.4.3 Penetapan Kadar Air ... 26
3.4.4Penetapan Kadar Sari Larut Air ... 27
3.4.5Penetapan Kadar Sari Yang Larut Etanol ... 27
3.4.6Penetapan Kadar Abu Total ... 27
3.4.7Penetapan Kadar Abu Tidak Larut Asam ... 28
3.5Skrining Fitokimia Serbuk Simplisia ... 28
3.5.1 Pemeriksaan Alkaloid ... 28
3.5.2Pemeriksaan Glikosida ... 29
3.5.3 Pemeriksaan Saponin ... 29
3.5.4Pemeriksaan Flavonoid ... 29
3.5.5 Pemeriksaan Tanin ... 30
3.5.6Pemeriksaan Steroid/Triterpenoid... 30
3.6 Pembuatan Ekstrak ... 30
3.7 Skrinning Fitokimia Ekstrak ... 31
3.8 Pembuatan Media ... 31
3.8.1Pembuatan Media Nutrient Agar (NA) ... 31
3.8.2Pembuatan Media Nutrient Broth (NB) ... 32
3.8.3Pembuatan Media Muller Hinton Agar (MHA) ... 32
3.8.4Pembuatan Media Plate Count Agar (PCA) ... 33
3.9 Penyiapan Stok Kultur Bakteri Escherichia coli danStaphylococcus aureus . 33 3.10Penyiapan Inokulum Bakteri Escherichia coli dan Staphylococcus aureus... 33
3.11Sterilisasi Alat dan Bahan ... 34
3.12 Pembuatan Larutan Uji Ekstrak Kulit Buah Labu Kuning dari Berbagaikk …Konsentrtasi ... 34
3.13Pengujian Aktivitas Antibakteri Ekstrak Kulit Buah Labu Kuning terhadap… Bakteri Escherichia coli danStaphylococcus aureus ... 34
3.14Formulasi Sediaan Pembersih Tangan ... 35
3.14.1 Formula Dasar Gel ... 35
3.14.2 Formulasi Sediaan Gel Pembersih Tangan ... 35
3.15 Evaluasi Sediaan Gel Pembersih Tangan ... 36
3.15.1 Uji Organoleptik... 36
3.15.2 Uji Homogenitas ... 37
3.15.3 Uji pH ... 37
3.15.4 Uji Viskositas ... 37
3.15.5 Uji Stabilitas ... 37
xi
3.15.6 Uji Iritasi ... 38
3.16 Uji Aktivitas Antibakteri terhadap Sediaan Pembersih Tangan Ekstrak Kulit… Buah Labu Kuning ... 38
BAB IV HASIL DAN PEMBAHASAN ... 40
4.1Hasil Identifikasi Tumbuhan ... 40
4.2Hasil Karakterisasi Simplisia ... 40
4.3 Hasil Ekstraksi ... 42
4.4 Hasil Skrinning Fitokimia ... 43
4.5 Hasil Uji Antibakteri Ekstrak Kulit Buah Labu Kuning ... 44
4.6 Hasil Evaluasi Sediaan Pembersih Tangan ... 45
4.6.1 Hasil Evaluasi Formula ... 45
4.6.2 Hasil Uji Homogenitas ... 46
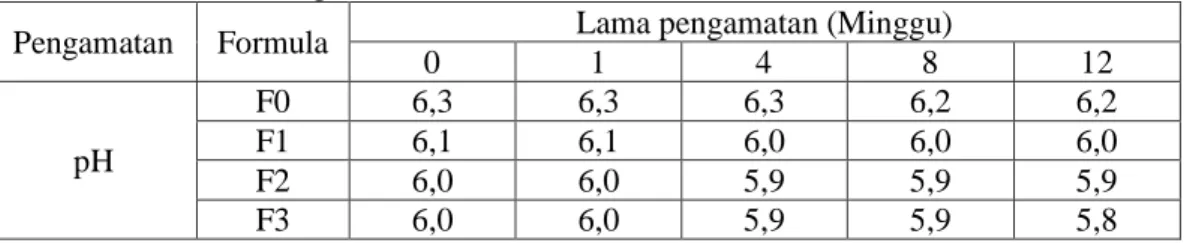
4.6.3 Hasil Uji pH ... 46
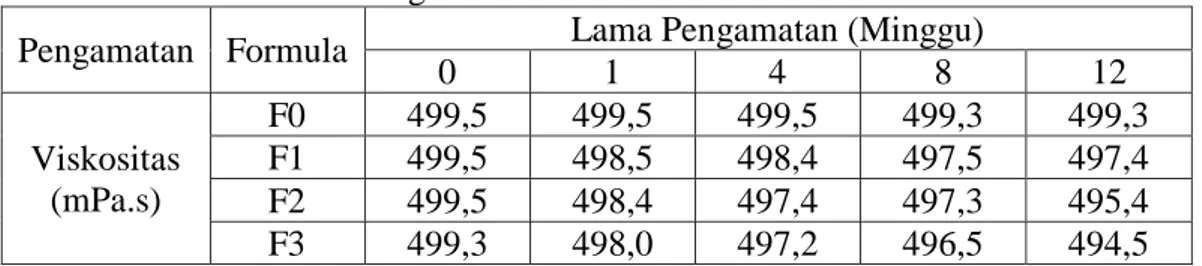
4.6.4 Hasi Uji Viskositas ... 47
4.6.5 Hasil Uji Stabilitas ... 48
4.6.6 Hasil Uji Iritasi ... 49
4.7 Hasil Uji Aktivitas Antibakteri Sediaan Pembersih Tangan Ekstrak Kulit… Buah Labu Kuning ... 49
BAB V KESIMPULAN DAN SARAN ... 53
5.1 Kesimpulan ... 53
5.2 Saran ... 53
DAFTAR PUSTAKA ... 54 LAMPIRAN ...
xii
DAFTAR TABEL
3.1 Rancangan Formula Gel Pembersih Tangan Ekstrak Kulit Buah Labu Kuning…
(Cucurbita moschata) ... 35
4.1 Hasil Pemeriksaan Karakterisasi Serbuk Simplisai Kulit Buah Labu Kuning . 41 4.2 Hasil Pemeriksaan Karakterisasi Ekstrak Kulit Buah Labu Kuning ... 42
4.3 Hasil Skrinning Fitokimia Kulit Buah Labu Kuning ... 43
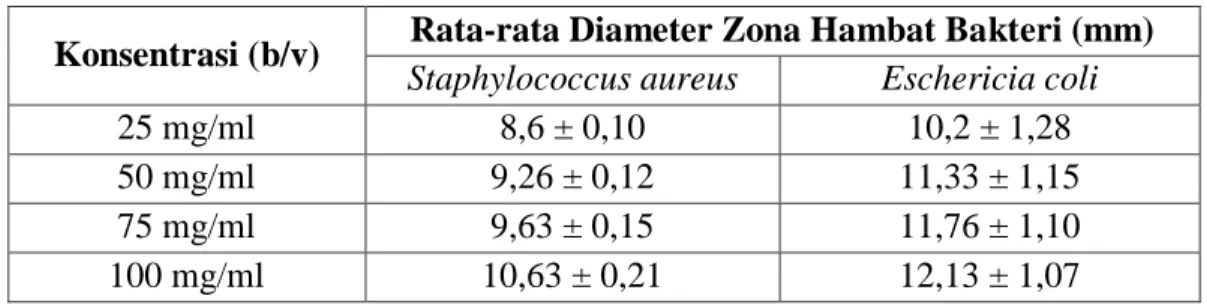
4.4 Hasil Uji Aktivitas Antibakteri Ekstrak Kulit Buah Labu Kuning terhadap… ..Bakteri Staphylococcus aureus ATCC 6523 dan Escherichia coli ATCC… ..25922 ... 44
4.5 Hasil Pengamatan Homogenitas Sediaan ... 46
4.6 Hasil Pengukuran pH Sediaan ... 46
4.7 Hasil Pengukuran Viskositas Sediaan ... 47
4.8 Hasil Pengamatan Stabilitas Sediaan Pembersih Tangan pada Suhu Kamar ... 48
4.9 Data Hasil Uji Iritasi Pembersih Tangan Ekstrak Kulit Buah Labu Kuning 49 4.10 Hasil Uji AOAC 960,09 Sediaan Pembersih Tangan terhadap Bakteri…. Staphylococcus aureus dan Escherichia coli ... 50
xiii
DAFTAR GAMBAR
1.1 Kerangka Pikiran Penelitian...4
2.1 Struktur Anatomi Kulit ... 11
4.1 Buah dan Simplisia Kulit Buah Labu Kuning ... 40
4.1 Pemeriksaan Mikroskopik Serbuk Simplisia Kulit Buah Labu Kuning ... 41
4.1 Persen Reduksi Bakteri Staphylococcus aureus dan Escherichia coli dalam… Blanko, Sediaan Pembersih Tangan Ekstrak Kulit Buah Labu Kuning dan… Sediaan Pembanding ... 51
xiv
DAFTAR LAMPIRAN
1. Hasil Identifikasi Sampel ... 58
2. Bagan Kerja Penelitian ... 59
3. Gambar Alat ... 64
4. Gambar Ekstrak Kulit Buah Labu Kuning ... 67
5. Hasil Skrinning Fitokimia ... 68
6. Perhitungan Rendemen Ekstrak Kulit Buah Labu Kuning... 69
7. Perhitungan Karakterisasi Serbuk Simplisia Kulit Buah Labu Kuning ... 70
8. Perhitungan Karakterisasi Ekstrak Kulit Buah Labu Kuning ... 73
9. Gambar Pemeiksaan Karakterisasi Kulit Buah Labu Kuning ... 75
10. Gambar Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Kulit Buah Labu…. Kuning ... 77
11. Data Diameter dan Daya Hambat Antibakteri Ekstrak Kulit Buah Labu…. Kuning Terhadap Bakteri Staphylococcus aureus dan Escherichia coli ... 78
12. Gambar Sediaan Pembersih Tangan Ekstrak Etanol Kulit Buah Labu… Kuning ... 79
13. Gambar Hasil Uji Homogenitas Sediaan Pembersih Tangan Ekstrak Kulit… Buah Labu Kuning ... 80
14. Contoh Surat Pernyataan Sukarelawan... 81
15. Hasil Uji Iritasi terhadap Sukarelawan ... 82
16. Surat Persetujuan Komite Etik ... 83
17. Gambar Hasil Uji Aktivitas Antibakteri Sediaan Pembersih Tangan Ekstrak… Kulit Buah Labu Kuning terhadap Bakteri Escherichia coli ... 84
18. Gambar Hasil Uji Aktivitas Antibakteri Sediaan Pembersih Tangan Ekstrak… KulitlBuah Labu Kuning terhadap Bakteri Staphylococcus aureus ... 96
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Kesehatan merupakan aspek yang sangat penting bagi kehidupan, salah satu cara untuk menjaganya yaitu dengan memelihara kebersihan tangan.
Kebersihan tangan yang terjaga adalah salah satu hal penting dalam langkah pencegahan penyakit yang disebabkan oleh infeksi mikroorganisme dan penyakit menular lainnya (Jusnita, 2018).
Cuci tangan menggunakan sabun dan air merupakan cara yang paling umum dilakukan untuk menjaga kebersihan tangan. Saat ini banyak ditawarkan pembersih tangan berupa hand sanitizer karena penggunaannya lebih praktis (Jusnita, 2018).
Pembersih Tangan mudah di bawa dan bisa cepat di gunakan tanpa perlu menggunakan air. Pembersih tangan sering digunakan ketika pada saat darurat di mana saat kita tidak bisa menemukan air. Di negara maju penggunaan pembersih tangan telah berjalan sangat pesat. Beberapa sediaan pembersih tangan dapat di jumpai di pasaran, dapat berupa gel atau spray. Sediaan gel dapat memberikan rasa dingin di kulit, dapat melembabkan karena adanya humektan yang mampu memperlambat penguapan air dari kulit.
Bahan aktif pembersih tangan termasuk isopropanol, etanol, n-propanol atau povidone-iodine sedangkan bahan tidak aktif biasanya termasuk humektan (seperti gliserin atau propilen glikol) dan minyak esensial tanaman. Cairan pembersih tangan berbasis alkohol telah terbukti efektif terhadap berbagai macam bakteri Gram-positif dan Gram-negatif, patogen multi-resistant, jamur dan virus (Oke et al, 2013).
2
Kulit labu kuning hanya dianggap sebagai sampah yang tidak terpakai.
Penelitian terhadap kulit buah labu kuning juga sangat jarang dilakukan, padahal kulit buah labu kuning sangat banyak manfaatnya. Menurut Kamarudin (2014) ekstrak kulit buah labu kuning memiliki aktivitas antibakteri terhadap bakteri gram positif: Bacillus cereus, Enterococcus faecalis dan Staphylococcus aureus dan bakteri gram negatif: Burkholderia cepacia, Pseudomonas aeruginosa, Vibrio alginolyticus, Vibrio parahaemolyticus dan Escherichia coli. Menurut Indriyanti, 2018 kulit buah labu kuning mengandung komponen bioaktif seperti flavonoid, tanin, saponin dan terpenoid. Pada penelitian Jayasundara et al, 2018 bahwa bagian kulit buah, biji dan daun labu kuning (Cucurbita moschata) memiliki aktivitas antibakteri terhadap Baccilus suptilis, Staphylococcus aureus dan Escherichia coli.
Berdasarkan latar belakang diatas, maka penulis tertarik untuk memformulasikan sediaan pembersih tangan yang mengandung ekstrak kulit buah labu kuning (Cucurbita moschata) sebagai antibakteri.
1.2 Perumusan Masalah
Berdasarkan uraian di atas, maka perumusan masalah dalam penelitian ini adalah:
a. Apakah ekstrak kulit buah labu kuning (Cucurbita moschata) mempunyai aktivitas antibakteri terhadap bakteri Escherichia coli dan Staphylococcus aureus?
b. Apakah ekstrak kulit buah labu kuning (Cucurbita moschata) dapat diformulasikan dalam sediaan pembersih tangan?
3
c. Apakah pembersih tangan ekstrak kulit buah labu kuning (Cucurbita moschata) mempunyai aktivitas antibakteri tehadap bakteri Escherichia coli dan Staphylococcus aureus?
1.3 Hipotesis Penelitian
Berdasarkan uraian di atas, maka hipotresis dalam penelitian ini adalah:
a. Ekstrak kulit buah labu kuning (Cucurbita moschata) mempunyai aktivitas antibakteri terhadap bakteri Escherichia coli dan Staphylococcus aureus.
b. Ekstrak kulit buah labu kuning (Cucurbita moschata) dapat diformulasikan dalam sediaan pembersih tangan.
c. Pembersih tangan ekstrak kulit buah labu kuning mempunyai aktivitas antibakteri tehadap bakteri Escherichia coli dan Staphylococcus aureus.
1.4 Tujuan Penelitian
Berdasarkan uraian diatas, maka tujuan dalam penelitian ini adalah:
a. Menguji aktivitas antibakteri dari ekstrak kulit labu kuning (Cucurbita moschata) terhadap bakteri Escherichia coli dan Staphylococcus aureus.
b. Memformulasikan sediaan pembersih tangan yang mengandung ekstrak kulit buah labu kuning (Cucurbita moschata).
c. Menguji aktivitas antibakteri sediaan pembersih tangan ekstrak kulit buah labu kuning (Cucurbita moschata) tehadap bakteri Escherichia coli dan Staphylococcus aureus.
4 1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk memberikan informasi mengenai kulit buah labu kuning (Curbita moschata) dapat berguna sebagai antibakteri yang bias diformulasikan dalam sediaan pembersih tangan.
1.6 Kerangka Pikir Penelitian
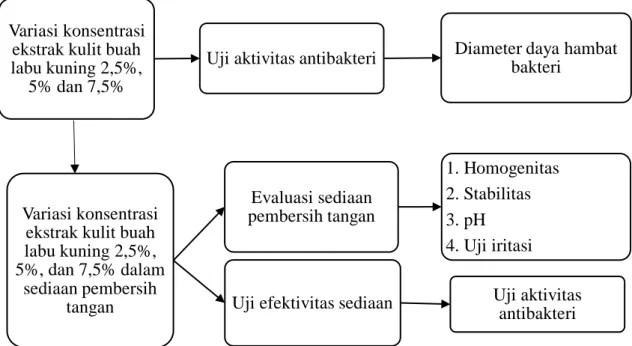
Variabel bebas Variabel terikat Parameter
Gambar 1.1 Kerangka Pikir Penelitian Variasi konsentrasi
ekstrak kulit buah labu kuning 2,5%,
5% dan 7,5%
Uji aktivitas antibakteri Diameter daya hambat bakteri
Variasi konsentrasi ekstrak kulit buah labu kuning 2,5%, 5%, dan 7,5% dalam
sediaan pembersih tangan
Evaluasi sediaan pembersih tangan
1. Homogenitas 2. Stabilitas 3. pH 4. Uji iritasi
Uji efektivitas sediaan Uji aktivitas antibakteri
5 BAB II
TINJAUAN PUSTAKA
2.1 Uraian Labu Kuning
Labu Kuning (Cucurbita moschata) adalah salah satu yang penting di antara tanaman sayuran yang asli dari Meksiko dan banyak dibudidayakan di India, Afrika, Amerika Latin, Asia Selatan dan Amerika Serikat (Ahmad dan Khan, 2019).
Dalam masyarakat Indonesia, buah labu kuning umumnya dimanfaatkan sebagai bahan makanan untuk pembuatan kolak atau hanya sebagai sayuran. Kandungan senyawa kimia yang terdapat dalam buah labu kuning segar (matang) tiap 100 gram antara lain: protein, lemak, karbohidrat, kalsium, fosfor, zat besi, vitamin A, vitamin B, vitamin C, dan air (Departemen Kesehatan RI, 1996).
Labu kuning (Cucurbita moschata) merupakan salah satu tumbuhan sumber pangan yang memiliki kandungan gizi yang tinggi dan berserat halus sehingga mudah dicerna. Memiliki daya adaptasi yang tinggi, maka dapat tumbuh di mana saja baik di dataran rendah maupun tinggi. Jenis tumbuhan ini dapat tumbuh dengan baik pada daerah yang kering dengan curah hujan sedang, dan pada ketinggian 1000-3000 meter diatas permukaan laut (Zufahmi, 2015).
2.1.1 Morfologi Labu Kuning
Labu kuning (Cucurbita moschata Duch.) termasuk dalam famili Cucurbitaceae. Labu kuning memiliki karakteristik pertumbuhan batang yang bercabang dan menjalar. Hampir seluruh tubuhnya dilingkupi oleh bulu halus yang tajam. Labu kuning memiliki sistem perakaran tunggang. Daun labu kuning berlobus lima dengan variasi ornamen warna permukaan hijau polos hingga hijau bertrotol putih, bunga monoceous uniseksual berwarna kuning (Furqan, 2018).
6
Tanaman Cucurbita moschata merupakan jenis tanaman semak dan merambat yang mudah ditanam yaitu suatu kondisi yang tidak memerlukan perawatan intensif. Tanaman ini sangat mudah/banyak dijumpai di Indonesia.
Tanaman Cucurbita moschata memiliki batang berkayu, lunak, berbentuk segi empat, berambut, berbuku-buku, memiliki panjang batang kurang lebih 25 m dan berwarna hijau muda (Puspita, 2012).
Tanaman Cucurbita moschata memiliki daun tunggal, bentuk daunnya bulat, tepi daun berombak sedangkan pangkal daunnya membulat dan berbulu.
Panjang daunnya 7-35 cm dengan lebar 6-30 cm, tanaman ini memiliki pertulangan daun menyirip dan berwana hijau. Bunga Cucurbita moschata berwarna kuning, berbentuk corong sedangkan kelopaknya berbentuk lonceng. Buah Cucurbita moschata berbentuk bulat, berdaging yang berwarna kuning muda, dan bijinya berbentuk pipih, keras, memiliki panjang kurang lebih 1,5 cm dengan lebar kurang lebih 0,5 cm dan berwarna putih susu (Puspita, 2012).
Buah labu kuning mempunyai kulit yang sangat tebal dan keras, sehingga dapat bertindak sebagai penghalang laju respirasi, keluarnya air melalui proses penguapan, maupun masuknya udara penyebab proses oksidasi. Hal tersebut menyebabkan labu kuning relatif awet dibanding buah-buah lainnya (Indriyanti, 2018).
2.1.2 Sistematika Labu Kuning
Sistematika tumbuhan buah labu kuning menurut Medanese Herbarium (2020) diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledonae
7 Ordo : Cucurbitales
Famili : Cucurbitaceae Genus : Cucubita
Spesies : Cucubita moschata (Duchesne.) Duchesne ex Poir.
Nama Lokal : Labu Kuning
2.1.3 Kandungan Labu Kuning (Cucurbita moschata)
Labu adalah bahan makanan penting sebagai bagian dari diet dan sebagai terapi obat. Dipercayai bahwa labu adalah sayuran yang sehat dan fungsional karena kaya akan fenolat, flavonoid, vitamin (termasuk β-karoten, vitamin A, vitamin B2, α-tokoferol, vitamin C, vitamin E), asam amino, karbohidrat dan mineral (terutama kalium) dan memiliki kandungan energi yang rendah dan sejumlah besar serat. Labu terbukti merupakan sumber provitamin a karotenoid yang sangat baik untuk pencegahan defisiensi vitamin A (Dar, dkk., 2017).
Pada kulit buah labu kuning mengandung karbohidrat, protein, lemak, serat, abu, β-karoten, α-tokoferol, β-kriptoxantin asam amino seperti: alanin, arginin, asam aspartat, asam glutamat, glisin, histidin, isoleusin, leusin, lisin, metionin, fenilalanin, prolin, serin, teorin, tirosin dan valine (Kim, 2012).
2.2 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dikatakan lain, berupa bahan yang telah dikeringkan. Simplisia dibedakan simplisia nabati, simplisia hewani dan simplisia pelikan (mineral). Simplisia nabati adalah simplisia yang berupa tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan. Eksudat tumbuhan ialah isi sel yang secara spontan keluar dari tumbuhan atau isi sel yang dengan cara tertentu dikeluarkan dari selnya, atau senyawa nabati lainnya yang
8
dengan cara tertentu dipisahkan dari tumbuhannya dan belum berupa senyawa kimia murni (Ditjen POM, 2000).
2.3 Ekstraksi
2.3.1 Ekstraksi Cara Dingin 2.3.1.1 Maserasi
Maserasi dilakukan dengan melakukan perendaman bagian tanaman secara utuh atau yang sudah digiling kasar dengan pelarut dalam bejana tertutup pada suhu kamar selama sekurang-kurangnya 3 hari dengan pengadukan berkali-kali sampai semua bagian tanaman yang dapat larut melarut dalam cairan pelarut. Pelarut yang digunakan adalah alkohol atau kadang-kadang juga air. Campuran ini kemudian disaring dan ampas yang diperoleh dipress untuk memperoleh bagian cairnya saja.
Cairan yang diperoleh kemudian dijernihkan dengan penyaringan atau dekantasi setelah dibiarkan selama waktu tertentu. Keuntungan proses maserasi diantaranya adalah bahwa bagian tanaman yang akan diekstraksi tidak harus dalam wujud serbuk yang halus, tidak diperlukan keahlian khusus dan lebih sedikit kehilangan alkohol sebagai pelarut seperti pada proses perkolasi atau sokhletasi. Sedangkan kerugian proses maserasi adalah perlunya dilakukan penggojogan/pengadukan, pengepresan dan penyaringan, terjadinya residu pelarut di dalam ampas, serta mutu produk akhir yang tidak konsisten (Endarini, 2016).
2.3.1.2 Perkolasi
Perkolasi merupakan teknik yang paling sering digunakan untuk mengekstrak bahan aktif dari bagian tanaman dalam penyediaan tinktur dan ekstrak cair. Sebuah perkolator, biasanya berupa silinder yang sempit dan panjang dengan kedua ujungnya berbentuk kerucut yang terbuka. Bagian tanaman yang akan diekstrak dibasahi dengan sejumlah pelarut yang sesuai dan dibiarkan selama
9
kurang lebih 4 jam dalam tangki tertutup. Selanjutnya, bagian tanaman ini dimasukkan ke dalam perkolator dan bagian atas perkolator ditutup. Sejumlah pelarut biasanya ditambahkan hingga membentuk lapisan tipis di bagian tanaman yang akan dieskstrak. Bagian tanaman ini dibiarkan mengalami maserasi selama 24 jam dalam perkolator tertutup. Setelah itu, cairan hasil perkolasi dibiarkan keluar dari perkolator dengan membuka bagian pengeluaran (tutup bawah) perkolator.
Sejumlah pelarut ditambahkan lagi (seperti membilas) sesuai dengan kebutuhan hingga cairan ekstrak yang diperoleh menjadi kurang lebih tiga per empat dari volume yang diinginkan dalam produk akhir. Ampas ditekan/dipress, dan cairan yang diperoleh ditambahkan ke dalam caira ekstrak. Selanjutnya, sejumlah pelarut ditambahkan lagi ke dalam cairan ekstrak untuk memeperoleh ekstrak dengan volume yang diinginkan. Campuran ekstrak yang diperoleh dijernihkan dengan penyaringan atau sedimentasi dengan dilanjutkan dengan dekantasi (Endarini, 2016).
2.3.2 Ekstraksi Cara Panas 2.3.2.1 Infudasi
Ekstraksi dengan pelarut air pada temperatur penangas (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-98 °C) selama waktu tertentu (15-20 menit) (Depkes, 2010).
2.3.2.2 Digesti
Maserasi kinetik yaitu maserasi dingin yang dilakukan dengan cara pengadukan kontinu (terus-menerus) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40- 50°C (Depkes, 2010).
10 2.3.2.3 Sokhletasi
Ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat soxhlet sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Depkes, 2010).
2.3.2.4 Dekoktasi
Infudasi pada waktu yang lebih lama (≥ 30 menit) dan temperatur sampai titik didih air (Depkes, 2010).
Pada proses dekoksi, bagian tanaman yang berupa batang, kulit kayu, cabang, ranting, rimpang atau akar direbus dalam air mendidih dengan volume dan selama waktu tertentu kemudian didinginkan dan ditekan atau disaring untuk memisahkan cairan ekstrak dari ampasnya. Proses ini sesuai untuk mengekstrak bahan bioaktif yang dapat larut dalam air dan tahan terhadap panas (Endarini, 2016).
2.3.2.5 Refluks
Ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna (Depkes, 2010).
2.4 Kulit
Kulit adalah lapisan jaringan yang terdapat yang terdapat pada bagian luar yang menutupi dan melindungi permukaan tubuh. Kulit disebut juga integumen atau kutis, tumbuh dari dua macam jaringan yaitu jaringan epitel yang menumbuhkan lapisan epidermis dan jaringan pengikat (penunjang) yang menumbuhkan lapisan dermis (kulit dalam). Kulit merupakan organ yang paling
11
luas sebagai pelindung tubuh terhadap bahaya bahan kimia, cahaya matahari, mikroorganisme dan menjaga keseimbangan tubuh dengan lingkungan (Syaifuddin, 2012). Kulit merupakan organ yang esensial dan vital serta merupakan cermin kesehatan dan kehidupan. Kulit juga sangat kompleks, elastis dan sensitif, serta bervariasi pada keadaan iklim, umur, jenis kelamin, ras, dan lokasi tubuh (Wasitaatmadja,1997).
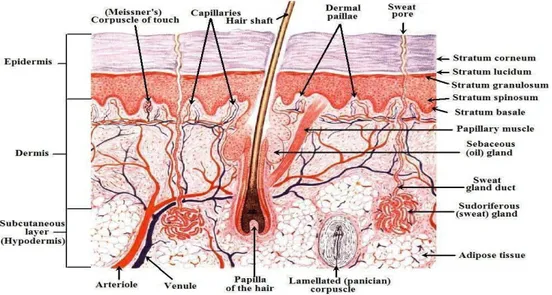
Gambar 2.1 Struktur anatomi kulit (Saurabh, dkk., 2014)
Kulit berfungsi sebagai pembatas terhadap serangan fisika-kimia. Kulit berfungsi sebagai thermostat dalam mempertahankan suhu tubuh, melindungi tubuh dari serangan mikroorganisme, sianr ultraviolet, dan berperan pula dalam mengatur tekanan darah (Lachman, 2007). Kulit melindungi tubuh dari trauma dan merupakan benteng pertahanan terhadap infeksi bakteri, virus dan jamur (Price dan Wilson, 2005).
Kulit berperan sebagai lapisan pelindung tubuh terhadap pengaruh luar, baik pengaruh fisik Maupun kimia. Kulit juga merupakan sawar (barrier) fisiologik yang penting karena mampu menahan penembusan bahan gas, cair, maupun padat, baik yang berasal dari lingkungan dari lingkungan luar tubuh maupun komponen
12
yang dihasilkan oleh mikroorganisme. Struktur senyawa penyusun sel-sel kulit sangat penting dalam mempertimbangkan absorpsi perkutan dari senyawa yang terkandung dalam sediaan yang diaplikasikan pada permukaan kulit (Ismail, 2013).
2.5 Pembersih Tangan (Hand Sanitizer)
Sanitizer adalah disenfektan khusus yang mengurangi jumlah kuman- kuman kontaminasi sampai tingkat yang aman bagi kesehatan masyarakat.
Pembersih tangan adalah gel dengan berbagai kandungan yang membunuh mikroorganisme yang ada di kulit tangan. Kelebihan pembersih tangandi utarakan menurut US FDA (Food and Drug Administration) dapat membunuh kuman dalam waktu relatif cepat (Verica, 2014).
Pembersih tangan mengandung bahan antiseptik seperti alkohol atau isopropanol, serta pelembab untuk meminimalisir terjadinya iritasi pada kulkit.
Pembersih Tangan digunakan untuk membersihkan tangan pada keadaan yang tidak memungkinkan untuk mencuci tangan (Simonne, 2005). Pembersih tangan memiliki banyak keunggulan yang disukai seperti waktu aplikasi yang singkat, kerja yang efektif, nyaman, dan meningkatnya kepatuhan pengguna. Sediaan pembersih tangan dapat diformulasikan dalam bentuk cairan maupun gel (Traore et al., 2007)
2.6 Gel
Gel didefenisikan sebagai suatu sistem setengah padat yang terdiri dari suatu dispersi yang tersusun baik dari partikel anorganik yang kecil atau molekul organik yang besar dan saling diresapi cairan. Polimer-polimer yang biasa digunakan untuk membuat gel- gel farmasetik meliputi gom alam tragakan, pektin, karagenan, agar,
13
asam alginat, serta bahan-bahan sintetis dan semi sintetis seperti metil selulosa, hidroksi etil selulosa, karboksi metil selulosa, dan karbopol yang merupakan polimer vinil sintetis dengan gugus karboksil yang terionisasi. Gel dibuat dengan proses peleburan, atau diperlukan suatu prosedur khusus berkenaan dengan sifat mengembang dari gel (Lachman, 2007).
Makromolekul pada sediaan gel disebarkan keseluruh cairan sampai tidak terlihat ada batas diantaranya, cairan ini disebut gel satu fase. Jika massa gel terdiri dari kelompok partikel kecil yang berbeda, maka gel ini dikelompokkan sebagai sistem dua fase dan sering pula disebut magma atau susu. Gel dianggap sebagai dispersi koloid karena masing-masing mengandung partikel-partikel dengan ukuran koloid (Ansel, 1989).
Dasar gel yang umum digunakan adalah gel hidrofobik dan gel hidrofilik.
1. Dasar gel hidrofobik
Dasar gel hidrofobik umumnya terdiri dari partikel-partikel anorganik, bila ditambahkan ke dalam fase pendispersi, hanya sedikit sekali interaksi antara kedua fase. Berbeda dengan bahan hidrofilik, bahan hidrofobik tidak secara spontan menyebar, tetapi harus dirangsang dengan prosedur yang khusus (Ansel, 1989).
2. Dasar gel hidrofilik
Dasar gel hidrofilik umumnya terdiri dari molekul-molekul organik yang besar dan dapat dilarutkan atau disatukan dengan molekul dari fase pendispersi.
Istilah hidrofilik berarti suka pada pelarut. Umumnya daya tarik menarik pada pelarut dari bahan-bahan hidrofilik kebalikan dari tidak adanya daya tarik menarik dari bahan hidrofobik. Sistem koloid hidrofilik biasanya lebih mudah untuk dibuat dan memiliki stabilitas yang lebih besar (Ansel, 1989). Gel hidrofilik umummnya
14
mengandung komponen bahan pengembang, air, humektan dan bahan pengawet (Voigt, 1994).
Beberapa keuntungan sediaan gel (Voigt, 1994) adalah sebagai berikut:
1. Memiliki kemampuan penyebarannya baik pada kulit
2. Memberikan efek dingin, yang dijelaskan melalui penguapan lambat dari kulit 3. Kemudahan pencuciannya dengan air yang baik
4. Jumlah air yang banyak dalam gel akan menghidrasi stratum corneum sehingga terjadi perubahan permeabilitas stratum corneum menjadi lebih permeabel terhadap zat aktif yang dapat meningkatkan berpenetrasi zat aktif.
2.7 Bakteri
Nama bakteri berasal dari bahasa Yunani “bacterion” yang berarti tongkat atau batang. Sekarang nama itu dipakai untuk menyebut sekelompok mikroorganisme yang bersel satu, berkembang biak dengan pembelahan diri serta demikian kecilnya sehingga hanya tampak atau dapat diamati dengan mikroskop.
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh:
1. Zat makanan (nutrisi)
Sumber zat makanan bagi bakteri diperoleh dari senyawa karbon, nitrogen, sulfur, fosfor, unsur logam, vitamin dan air untuk fungsi metabolik dan pertumbuhannya
2. Temperatur
Proses pertumbuhan bakteri tergantung pada reaksi kimiawi dan laju reaksi kimia yang dipengaruhi oleh temperatur. Berdasarkan hal tersebut maka bakteri dapat diklasifikasikan sebagai berikut:
15
a. Bakteri psikofil, yaitu bakteri yang dapat hidup pada temperatur 0-30ºC, dengan temperatur optimum adalah 10-20ºC.
b. Bakteri mesofil, yaitu bakteri yang dapat hidup pada temperatur 5-60ºC, dengan temperatur optimum adalah 25-40º.
c. Bakteri termofil, yaitu bakteri yang dapat hidup pada temperatur optimum yaitu 55-65 °C
3. Keasaman dan kebasaan (pH)
Kebanyakan bakteri patogen mempunyai pH optimum pertumbuhan antara 7,2-7,6.
4. Oksigen
Oksigen dapat mempengaruhi pertumbuhan mikroorganisme, berdasarkan kebutuhan oksigen, bakteri dapat dibedakan menjadi 5 kelompok antara lain:
a. Aerob mutlak yaitu bakteri yang membutuhkan oksigen dalam pertumbuhannya.
b. Anaerob fakultatif yaitu bakteri yang dapat tumbuh dengan atau tanpa adanya oksigen.
c. Anaerob mutlak yaitu bakteri yang hidup bila tidak ada oksigen.
d. Aetoleran yaitu bakteri yang tidak mati dengan adanya oksigen.
e. Mikroaerofilik yaitu bakteri yang dapat tumbuh baik dengan adanya sedikit oksigen
5. Tekanan osmosa
Dalam larutan hipotonik air akan masuk ke dalam sel mikroorganisme, sedangkan pada larutan hipertonik air akan keluar dari sel mikroorganisme sehingga membrane plasma mengkerut dan lepas dari dinding sel
16
(plasmolysis), serta menyebabkan sel secara metabolic menjadi tidak aktif (Pratiwi, 2008).
2.7.1 Ukuran bakteri
Pada umumnya bentuk tubuh bakteri baru dilihat menggunakan mikroskop dengan pembesaran 1000 kali atau lebih. Satuan ukuran tubuh bakteri adalah mikrometer atau micron (Waluyo, 2007).
Bakteri berbentuk kokus ada yang berdiameter 0,5 μ sampai 2,5 μ.
Sedangkan bakteri berbentuk basil ada yang lebarnya 0,2 μ sampai 2 μ. Oleh karena itu, pengukuran besar kecilnya bakteri perlu didasarkan pada standard yang sama.
Pada umumnya bakteri yang berumur 2 sampai 6 jam lebih besar dari bakteri yang umurnya lebih dari 24 jam. Lebar tubuh umumnya 1- 2 mikron, sedangkan panjangnya 2-5 mikron (Waluyo, 2007).
2.7.2 Bentuk Bakteri 2.7.2.1 Bentuk Basil
Bakteri yang sebagian besar tampak sebagai bentuk batang tunggal atau silinder dan membelah hanya melalui sumbu pendeknya (dalam satu bidang).
Bentuk basil dapat dibedakan atas:
a. Monobasil yaitu basil yang terlepas satu sama lain dengan kedua ujung tumpul.
Contoh: Eschericia coli.
b. Diplobasil yaitu basil yang bergandeng dua dan kedua ujungnya tumpul.
Contoh: Salmonella typhimurium.
c. Streptobasil yaitu basil yang bergandengan panjang dengan kedua ujung tajam.
Contoh: Bacillus anthracis (Pratiwi, 2008).
17 2.7.2.2 Bentuk Kokus
Kokus adalah bakteri yang bentuknya umumnya bukat atau oval. Bila membelah diri, sel-sel dapat tetap melekat satu sama lain Bentuk kokus dapat dibedakan atas:
a. Diplokokus yaitu kokus yang bergandeng dua.
Contoh: Streptococcus pneumoniae.
b. Stafilokokus yaitu kokus yang mengelompok dan membentuk anggur. Contoh:
Staphylococus aureus.
c. Tetrakokus yaitu kokus yang mengelompok empat.
Contoh: Pediococcus cerevisiae.
d. Stafilokokus yaitu kokus yang mengelompok dan membentuk anggur. Contoh:
Staphylococus aureus.
e. Streptokokus yaitu kokus yang bergandengan panjang menyerupai rantai.
Contoh: Streptococcus pyogenes.
d. Sarsina yaitu kokus yang mengelompok seperti kubus.
Contoh: Sarcina ventriculi (Pratiwi, 2008).
2.7.2.3 Bentuk Spiral
Bentuk spiral dapat dibedakan atas:
a. Spiral yaitu menyerupai spiral atau lilitan.
b. Vibrio yaitu bentuk batang yang melengkung berupa koma.
c. Spirochaeta yaitu menyerupai bentuk spiral, bedanya dengan spiral dalam kemampuannya melenturkan dan melengkukkan tubuhnya sambil bergerak (Pratiwi, 2008).
18 2.7.3 Metode Uji Antibakteri
Uji antibakteri dapat dilakukan dengan 2 macam metode diantaranya sebagai berikut:
1. Metode Difusi
Metode difusi adalah metode yang sering digunakan untuk analisis aktivitas antibakteri. Terdapat 5 cara dari metode difusi yang dapat dilakukan yaitu sebagai berikut:
a. Metode Cakram (Tes Kirby & Bauer)
Metode cakram (metode disc diffusion) digunakan untuk menentukan aktivitas agen antimikroba. Piringan agen antimikroba diletakkan pada media agar yang telah ditanami mikroorganisme yang akan berdifusi pada media agar tersebut.
Area yang jernih menandakan adanya hambatan pertumbuhan mikroorganisme oleh agen antimikroba pada permukaan media agar.
b. Metode E-Test
Metode ini digunakan untuk mengestimasi MIC (mininmum inhibitory concentration) atau KHM (kadar hambat minum), yaitu konsentrasi minimal suatu agen anti mikroba untuk dapat menghambat pertumbuhan mikroorganisme. . Metode ini menggunakan strip plastik yang telah berisi agen antimikroba dari kadar terendah hingga tertinggi dan diletakkan pada media agar yang telah ditanami mikroorganisme.
c. Metode Sumuran (Cup Plate Technique)
Metode sumuran hampir sama dengan metode cakram dimana dibuat suatu sumur pada media Agar yang telah ditanami dengan mikroorganisme dan pada sumur tersebut dan diteteskan larutan antimikroba yang akan diuji.
19 d. Ditch plate technique
Sampel uji pada metode ini berupa agen antimikroba yang diletakkan pada parit yang dibuat dengan cara memotong media agar dalam cawan petri pada bagian tengah secara membujur dan bakteri uji digoreskan ke arah parit.
e. Gradient plate technique
Metode ini menggunkan konsentrasi agen antimikroba pada media agar dari 0 hingga maksimal. Media agar dicairkan dan ditambahkan larutan uji kemudian campuran tersebut dituangkan ke dalam cawan petri dan diletakkan dalam posisi miring. Nutrisi kedua selanjutnya dituang diatasnya.
2. Metode Dilusi a. Dilusi Cair
Metode dilusi cair digunakan untuk menentukan MIC (Minimum Inhibitory Concentration) atau KHM (Kadar Hambat Minimum) dan MBC (Minimum Bacterial Concentration) atau KBM (Kadar Bunuh Minimum). Cara yang dilakukan adalah dengan membuat seri pengenceran agen antimikroba pada agen medium cair yang ditambahkan dengan agen mikroba uji. Larutan uji agen antimikroba terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba disebut sebagai KHM. Larutan tersebut selanjutnya dikultur ulang pada media cair tanpa penambahan mikroba maupun agen antimikroba, dan diinkubasi selama 18- 24 jam. Media yang tetap terlihat cair disebut sebagai KBM.
b. Dilusi Padat
Metode Dilusi Padat serupa dengan metode dilusi cair namun menggunakan media padat (solid). Keuntungan dari metode ini adalah satu konsentrasi agen antimikroba yang diuji dapat digunakan untuk menguji beberapa mikroba uji (Pratiwi, 2008).
20 2.7.4 AOAC 960.09
Uji AOAC adalah uji yang menentukan adanya pengurangan atau penurunan jumlah bakteri setelah dikontakkan dengan waktu yang telah ditentukan (Widyastuti, 2016).
Dalam metode ini, produk diinokulasi dengan organisme uji. Setelah pemaparan singkat, sampel dinetralkan, cawan diinkubasi, dan jumlah organisme yang masih hidup ditetapkan. Menurut AOAC (2013) agar memenuhi syarat sebagai pembersih yang efektif, produk harus menunjukkan pengurangan 99,9%.
Organisme uji yang tipikal termasuk Staphylococcus aureus dan Escherichia coli.
2.8 Uraian Bakteri Escherichia Coli dan Staphylococcus aureus 2.8.1 Escherichia coli
Escherichia coli merupakan bakteri Gram negative, berbentuk batang, merupakan bakteri aerobik atau anaerobik fakultatif yang habitat alaminya adalah usus besar manusia dan hewan (Jawetz, et al., 2013).
Bakteri Escherichia coli dalam jumlah yang berlebihan dapat mengakibatkan diare, dan bila bakteri ini menjalar ke sistem/organ tubuh yang lain, maka akan dapat menyebabkan infeksi. Jika bakteri Escherichia coli sampai masuk ke saluran kencing maka dapat mengakibatkan infeksi pada saluran kemih/kencing (ISK). Bakteri Escherichia coli ditemukan pada tahun 1885 oleh Theodor Escherich dan diberi nama sesuai dengan nama penemunya. Escherichia coli merupakan bakteri berbentuk batang dengan panjang sekitar 2 micrometer dan diamater 0.5 micrometer. Volume sel E. coli berkisar 0.6-0.7 m³. Bakteri ini dapat hidup pada rentang suhu 20-40°C dengan suhu optimumnya pada 37°C dan tergolong bakteri gram negatif.
21
Sistematika Escherichia coli adalah sebagai berikut : Domain : Bacteria
Kingdom : Eubacteria Filum : Proteobacteria
Kelas : Gammaproteobacteria Ordo : Eubacteriales
Famili : Enterobacteriaceae Genus : Escherichia
Spesies : Escherichia coli (Sutiknowati, 2016).
2.8.2 Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif, berbentuk bulat (kokus) dengan diameter sekitar 1 μm, terdapat tunggal dan berpasangan, secara khas membelah diri pada lebih dari satu bidang sehingga membentuk gerombolan yang tidak teratur dan menyerupai buah anggur. Staphylococcus aureus termasukbakteri mesofil dimana hidup dalam saluran pengeluaran lendir dari tubuh manusia dan hewan seperti hidung, mulut, dan tenggorokan (Supardi dan Sukamto, 1999). Sistematika Staphylococcus aureus adalah:
Kingdom : Bakteri Filum : Firmicutes Kelas : Bacilli Ordo : Bacillales
Famili : Staphylococcaceae Genus : Staphylococcus
Spesies : Staphylococcus aureus (Gajdacs, 2020).
22
Staphylococcus aureus dapat menyebabkan intoksikasi, bakteri ini juga dapat menyebabkan berbagai macam infeksi seperti jerawat, bisul, meningitis, osteomielitis, pneumonia dan mastitis pada manusia dan hewan (Supardi dan Sukamto, 1999).
2.9 Bahan yang Digunakan dalam Gel Pembersih Tangan a. Etanol
Larutan etanol banyak digunakan dalam formulasi farmasi dan kosmetik terutama digunakan sebagai pelarut ekstrak (hingga 85%). Selain itu dapat juga digunakan sebagai desinfektan (60-90%) dan dalam larutan sebagai pengawet antimikroba (≥10%). Etanol digunakan dalam pengembangan sistem pengiriman obat transdermal sebagai peningkat penetrasi (Rowe, dkk., 2009).
b. Karbopol 940
Karbopol 940 digunakan sebagai pengubah reologi dalam formulasi farmasi cair atau semipadat contohnya krim, gel, lotion dan salep. Karbopol telah diteliti sebagai bantuan peningkat viskositas dalam pembuatan beberapa emulsi mikrosfer. Karbopol 940 dapat digunakan sebagai agen pengemulsi (0,1-0,5%), agen pembuat gel (0,5-2,0%), agen suspensi (0,5-1,0%), tablet binder (0,75-3,0%), dan agen lepas terkendali (5,0-30,0%) (Rowe, dkk., 2009).
c. Gliserin
Pemeriannya yaitu cairan jernih seperti sirup, tidak berwarna, rasa manis, berbau khas lemah. Kelarutannya yaitu dapat bercampur dengan air dan etanol, praktis tidak larut dalam kloroform, eter, dan minyak lemak (Depkes RI, 1995). Gliserin digunakan secara luas pada formulasi farmasetikal meliputi sediaan oral, telinga,
23
mata, topikal dan parenteral. Pada sediaan topikal dan kosmetik, gliserin digunakan sebagai humektan dan emolien (Rowe dkk., 2009).
d. Metil Paraben (Nipagin)
Metil paraben dapat digunakan sendiri atau dikombinasikan dengan paraben lain atau dengan agen antimikroba dalam kosmetik, produk makanan, dan formulasi farmasi. Metil paraben dapat digunakan sebagai pengawet sediaan topical (0,02-0,3%), pada sediaan larutan oral dan suspense (0,015-0,2%), sediaan rektal (0,1-0,18) dan lain-lain (Rowe, dkk., 2009).
e. Trietanolamine
Trietanolamina adalah cairan kental, berwarna bening hingga kuning pucat, memiliki bau lebah mirip amoniak, dan bersifat higroskopis. Kelarutan trietanolamina adalah mudah larut dalam air, ethanol 95% P, dan dalam kloroform.
Trietanolamina dapat digunakan sebagai alkalizing agent yang digunakan diperlukan untuk menemukan sifat fisik dan stabilitas sediaan gel yang paling optimum (Rowe, dkk., 2009).
24 BAB III
METODE PENELITIAN 3.1 Jenis Penelitian
Penelitian ini dilakukan dengan metode eksperimental yang meliputi tahapan pengumpulan sampel dan pengolahan simplisia, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak etanol 96%, pembuatan sediaan gel.
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Fakultas Farmasi Universitas Sumatera Utara, Laboratorium Fitokimia Fakultas Farmasi Universitas Sumatera Utara, Laboratorium Farmasetika Dasar Fakultas Farmasi Universitas Sumatera Utara dan Laboratorium Farmasi Fisik Fakultas Farmasi Universitas Sumatera Utara.
3.2. Alat dan Bahan 3.2.1 Alat
Alat yang digunakan dalam penelitian ini adalah aluminium foil (Klinpack), autoklaf (Express Equipment), batang pengaduk, beaker glass (Pyrex), benang wol, bunsen, cawan petri, cawan penguap, erlenmeyer (Pyrex), gelas ukur (Pyrex), inkubator bakteri (Memmert), jangka sorong, jarum ose, kain kassa, kapas, kertas perkamen, kertas saring, kompor gas (Rinnai), kurs porselen, laminar airflow cabinet (Astec HLF 1200 L), lumpang dan alu porselen, lemari pendingin, lemari pengering, mikro pipet (Eppendorf), mikroskop (Boeco-Germany), neraca analitik, oven, object glass, penangas air, pencadang kertas, penangas air, pH meter (Hana Insrtrument), pinset, pipet tetes, rotary evaporator (Heidolph), spatula, tanur (Nabertherm) dan vial.
25 3.2.2 Bahan
Bahan yang digunakan dalam penelitian ini adalah akuades, alkohol 70%
(Brataco), buah labu kuning, carbopol 940 (Rinci), ekstrak kulit buah labu kuning, etanol 96%, gliserin (OST), metil paraben (Clariant), muller hinton agar (HImedia), nutrient agar (Oxoid), nutrient broth (Oxoid), parfum, plate count agar (Himedia ) dan TEA (Merck).
3.3 Pengambilan dan Pengolahan Sampel 3.3.1 Pengambilan sampel
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa membandingkan tumbuhan yang sama pada daerah lain. Bahan tumbuhan yang digunakan adalah kulit labu kuning diambil dari Pasaraya MMTC, Jl. Pancing Medan, Kenanga Baru, Kecamatan Percut Sei Tuan, Kabupaten Deli Serdang, Provinsi Sumatera Utara.
3.3.2 Identifikasi tanaman
Identifikasi tanaman dilakukan di “Herbarium Medanense“ (MEDA) Universitas Sumatera Utara
3.3.3 Pembuatan simplisia
Kulit buah labu kuning (Cucurbita moschata) dicuci dengan menggunakan air mengalir hingga bersih dan tiriskan. Lalu, timbang dan hitung berat basah.
Selanjutanya, dikeringkan kulit buah labu kuning dalam lemari pengering sampai kering. Simplisia kulit buah labu kuning yang sudah kering dilakukan pengecilan ukuran partikel dengan menggunakan blender, kemudian diayak dengan ayakan nomor 30/40 mesh. Kemudian dimasukkan kedalam wadah dan diberikan silica gel.
26 3.4 Karakterisasi Simplisia
Karakterisasi simplisia meliputi pemeriksaan makroskopik, pemeriksaan mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut asam (Kemenkes RI, 2017).
3.4.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan cara mengamati bentuk, ukuran, warna, bau dan rasa kulit buah labu kuning.
3.4.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik serbuk simplisia dilakukan untuk mengetahui fragmen dari simplisia dengan cara serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesi larutan kloralhidrat dan ditutup dengan kaca penutup kemudian diamati di mikroskop.
3.4.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Alat meliputi labu alas 500 mL, tabung penerima 5 mL berskala 0,05 mL, pendingin, tabung penyambung, pemanas listrik.
Cara kerja:
Toluen 200 mL dan air suling 2 mL dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Toluen didinginkan selama 30 menit dan volume air pada tabung penerima dibaca. Serbuk simplisia sebanyak 5 g yang telah ditimbang seksama dimasukkan ke dalam labu tersebut, lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mulai mendidih, kecepatan tetesan diatur kurang lebih 2 tetes tiap detik, hingga sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam
27
pendingin dibilas dengan toluen yang telah dijenuhkan. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Setelah air dan toluen memisah sempurna, dibaca volume air.
3.4.4 Penetapan Kadar Sari Larut Air
Timbang saksama lebih kurang 5 g serbuk yang telah dikeringkan di udara.
Masukkan ke dalam labu bersumbat, tambahkan 100 ml air jenuh kloroform, kocok berkali-kali selama 6 jam pertama, biarkan selama 18 jam. Saring, uapkan 20.0 mL filtrat hingga kering dalam cawan dangkal beralas datar yang telah dipanaskan 105°C dan ditara, panaskan sisa pada suhu 105°C hingga bobot tetap. Hitung kadar dalam % sari larut air (Kemenkes RI, 2017).
3.4.5 Penetapan Kadar Sari Larut Etanol
Timbang saksama lebih kurang 5 g serbuk yang telah dikeringkan di udara.
Masukkan ke dalam labu bersumbat, tambahkan 100 mL etanol P, kocok berkali- kali selama 6 jam pertama, biarkan selama 18 jam. Saring cepat untuk menghindarkan penguapan etanol, uapkan 20.0 mL filtrat hingga kering dalam cawan dangkal beralas datar yang telah dipanaskan 105°C dan ditara, panaskan sisa pada suhu 155°C hingga bobot tetap. Hitung kadar dalam % sari larut etanol (Kemenkes RI, 2017).
3.4.6 Penetapan Kadar Abu Total
Timbang saksama 2 sampai 3 g bahan uji yang telah dihaluskan dan masukkan ke dalam krus silikat yang telah dipijar dan ditara, pijarkan perlahan- lahan hingga arang habis, dinginkan dan timbang. Jika dengan cara ini arang tidak dapat dihilangkan, tambahkan air panas, aduk, saring melalui kertas saring bebas abu. Pijarkan kertas saring beserta sisa penyaringan dalam krus yang sama.
Masukkan filtrat ke dalam krus, uapkan dan piljarkan hingga bobot tetap pada suhu
28
800±25°C. Kadar abu total dihitung terhadap berat bahan uji, dinyatakan dalam % b/b (Kemenkes RI, 2017).
3.4.7 Penetapan Kadar Abu Tidak Larut Asam
Didihkan abu yang diperoleh pada Penetapan Kadar Abu Total dengan 25 mL asam klorida encer LP selama 5 menit. Kumpulkan bagian yang tidak larut dalam asam, saring melalui kertas saring bebas abu, cuci dengan air panas, pijarkan dalam krus hingga bobot tetap pada suhu 800±125º. Kadar abu yang tidak larut dalam asam dihitung terhadap berat bahan uji, dinyatakan dalam % b/b (Kemenkes RI, 2017).
3.5 Skrining Fitokimia Serbuk Simplisia
Skrining fitokimia serbuk simplisia kulit buah labu kuning meliputi pemeriksaan senyawa alkaloid, glikosida, saponin, flavonoid, tanin dan steroid/triterpenoid.
3.5.1 Pemeriksaan alkaloid
Bahan tanaman segar sebanyak 5-10 gram diekstraksi dengan kloroform beramonia lalu disaring. Selanjutnya ke dalam filtrat ditambahkan 0,5-1 ml asam sulfat 2N dan dikocok sampai terbentuk dua lapisan. Lapisan asam (atas) dipipet dan dimasukkan ke dalam tiga buah tabung reaksi. Ke dalam tabung reaksi yang pertama ditambahkan dua tetes pereaksi Mayer. Ke dalam tabung reaksi kedua ditambahkan dua tetes pereaksi Dragendorf dan ke dalam tabung reaksi yang ketiga dimasukkan dua tetes pereaksi Wagener. Adanya senyawa alkaloid ditandai dengan terbentuknya endapan putih pada tabung reaksi yang pertama dan timbulnya endapan berwarna coklat kemerahan pada tabung reaksi kedua dan ketiga (Endarini, 2016).
29 3.5.2 Pemeriksaan Glikosida
Sebanyak 3 gram serbuk simplisia disari dengan 30 ml campuran dari 7 bagian etanol 96% dan 3 bagian air suling, ditambahkan dengan asam klorida 2 N hingga pH larutan adalah 2, direfluks selama 10 menit, didinginkan dan disaring.
Sebanyak 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok dan didiamkan selama 5 menit, lalu disaring. Sebanyak 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dan dikocok lalu didiamkan selama 5 menit, disaring. Filtrat diekstraksi dengan 20 ml campuran 3 bagian kloroform dan 2 bgian isopropanol, ini dilakukan sebanyak 3 kali.
Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC sisanya dilarutkan dalam 2 ml metanol. Larutan ini digunakan untuk percobaan berikut:
larutan sisa dimasukkan ke dalam tabung reaksi, diuapkan d atas penangas air, sisanya ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, bila terbentuk cincin ungu pada batas kedua cairan menunjukkan adanya gula (Depkes RI, 1995).
3.5.3 Pemeriksaan Saponin
Sebanyak 0,5 gram serbuk simplisia dimasukkan dalam tabung reaksi lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, jika terbentuk buih yang stabil slama tidak kurang dari 10 menit setinggi 1- 10 cm dan dengan penambahan 1 tetes asam klorida 2 N buih tidak hilang maka menunjukkan adanya saponin (Depkes RI, 1995).
3.5.4 Pemeriksaan Flavonoid
Sebanyak 10 gram serbuk simplisia ditambahkan 100 ml air panas, didihkan selama 5 menit dan disaring dalam keadaan panas, filtrat yang diperoleh kemudian diambil 5 ml lalu ditambahkan 0,1 gram serbuk Mg dan 1 ml asam klorida pekat
30
dan 2 ml amil alkohol, lalu dikocok, dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol (Endarini, 2016).
3.5.5 Pemeriksaan Tanin
Sebanyak 0,5 gram serbuk simplisia ditimbang, dimasukkan dalam tabung reaksi, lalu disari dengan 10 ml air suling, disaring lalu filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida, bila terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Endarini, 2016).
3.5.6 Pemeriksaan Steroid/Triterpenoid
Bahan sampel tanaman sebanyak 5 gram diekstraksi dengan pelarut n- heksana atau petroleum eter sebanyak 10 ml kemudian disaring. Ekstrak yang diperoleh diambil sedikit dan dikeringkan di atas papan spot test, ditambahkan tiga tetes anhidrida asetat dan kemudian satu tetes asam sulfat pekat. Adanya senyawa golongan terpenoid akan ditandai dengan timbulnya warna merah sedangkan adanya senyawa golongan steroid ditandai dengan munculnya warna biru (Endarini, 2016).
3.6 Pembuatan Ekstrak
Sebanyak 500 g serbuk simplisia dimasukkan ke dalam bejana bertutup, kemudian direndam dengan cairan penyari etanol selama 3 jam. Kemudian massa dimasukkan ke dalam perkolator, cairan penyari etanol dituang secukupnya sampai terdapat selapis cairan penyari di atas serbuk simplisia, kemudian mulut perkolator ditutup dengan aluminium foil dan dibiarkan selama 24 jam. Kemudian, cairan perkolat dibiarkan menetes dengan kecepatan 1 tetes per detik lalu tambahkan berulang-ulang etanol sehingga selalu terdapat selapis cairan penyari diatas
31
simplisia dan ditampung ke dalam botol berwarna bening. Perkolasi dihentikan apabila cairan perkolat terakhir diuapkan diatas penangas air tidak meninggalkan sisa. Penambahan pelarut dilakukan sampai perkolat sudah tidak mengandung senyawa aktif lagi. Hal ini dapat dilakukan dengan pengamatan secara visual dengan cara melihat secara fisik pada tetesan perkolat. Apabila tetesan sudah tidak berwarna, maka penambahan pelarut sudah dapat dihentikan. Sisa pelarut yang masih ada di dalam perkolator dihabiskan dan dikumpulkan dengan perkolat sebelumnya (Marjoni, 2016). Perkolat dipekatkan dengan bantuan alat penguap rotary evaporator pada suhu tidak lebih dari 40°C, lalu diuapkan sisa pelarut dengan bantuan oven sampai diperoleh ekstrak kental kemudian disimpan di lemari pendingin.
3.7 Skrining Fitokimia Ekstrak
Skrining fitokimia ekstrak daun bangun-bangun meliputi: pemeriksaan senyawa alkaloid, glikosida, saponin, flavonoid, tanin dan steroid/triterpenoid.
Skrining fitokimia ekstrak kulit labu kuning dilakukan seperti skrining fitokimia serbuk simplisia.
3.8 Pembuatan Media
3.8.1 Pembuatan Media Nutrien Agar (NA) Komposisi: Lab-Lamco powder 1,0 g
Yeast extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g
Agar 15,0 g
32 Air suling ad 1 liter Cara pembuatan:
Sebanyak 28 g nutrient agar dilarutkan dalam air suling steril ad 1000 ml kemudian dipanaskan hingga semua larut, dalam keadaan panas larutan tersebut kemudian dimasukkan dalam erlenmeyer. Disterilkan di autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1982).
3.8.2 Pembuatan Media Nutrient Broth (NB) Komposisi: Lab-Lamco powder 1,0 g
Yeast extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g Air suling ad 1 liter Cara pembuatan:
Sebanyak 13 g nutrient broth dilarutkan dalam air suling steril ad 1000 ml kemudian dipanaskan hingga semua larut, dalam keadaan panas larutan tersebut kemudian dimasukkan dalam erlenmeyer. Disterilkan di autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1982).
3.8.3 Pembuatan Media Muller Hinton Agar (MHA) Komposisi : Casein acid hydrolisate 17,50 g
Starch 1,50 g
Agar 17,00 g
Air suling ad 1 liter