METODE DPPH
TUGAS AKHIR
Diajukan untuk memenuhi salah satu persyaratan Memperoleh gelar Ahli Madya D3 Farmasi
Oleh: SARI ASTUTI NIM. M3511050
PROGRAM STUDI DIPLOMA 3 FARMASI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN UNIVERSITAS SEBELAS MARET
iv Sari Astuti
Program Studi Diploma 3, Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Sebelas Maret
INTISARI
Antioksidan merupakan senyawa yang mampu menghambat proses oksidasi, memberikan elektron, mengikat dan mengakhiri reaksi berantai radikal bebas. Tomat (Solanum lycopersicum L.), cabai merah (Capsicum annum L.) dan ciplukan (Physalis angulata L.) berpotensi memiliki aktivitas antioksidan. Namun, penelitian aktivitas antioksidan pada bagian daun tanaman tersebut belum diketahui. Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan ekstrak kloroform daun tomat (Solanum lycopersicum L. ), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.) dengan melihat nilai IC50.
Penelitian ini merupakan penelitian eksperimental. Daun tomat (Solanum lycopersicum L.), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.) diekstraksi secara perkolasi dengan pelarut kloroform. Pengujian aktivitas antioksidan digunakan metode DPPH (1,1-difenil-2 pikrilhidrazil). Identifikasi kandungan fitokimia dengan KLT (Kromatografi Lapis Tipis) dan uji aktivitas antioksidan dengan spektrofotometri UV-Vis pada panjang gelombang 514,5 nm dengan pembanding vitamin C.
Hasil pengujian ekstrak daun tomat dan daun ciplukan mengandung senyawa saponin dan flavonoid. Sedangkan daun cabai merah hanya mengandung flavonoid. Nilai IC50 daun tomat sebesar 88,94 ppm ± 0,22 ; daun cabai merah sebesar 76,57 ppm ± 0,13 ; dan daun ciplukan sebesar 82,07 ppm ± 0,19. Aktivitas antioksidan pada ekstrak kloroform daun tomat, daun cabai merah, dan daun ciplukan termasuk antioksidan kuat (50-100 ppm).
v Sari Astuti
Diploma 3 of Pharmacy, Faculty of Mathematic and Sciences Sebelas Maret University
ABSTRACT
Antoxidant is a compound that can inhibit oxidation process, give electron, binding and terminated chain reactions of free radicals. Tomato (Solanum lycopersicum L.), red-chili (Capsicum annum L.), and ciplukan (Physalis angulata L.) are potential as antioxidant activity. But, the antioxidant activity in that leaves arestill unknown. The aim of this study is to determinate the antioxidant activity of chloroform extract of tomato’s leaves (Solanum lycopersicum L.), red-chili’s leaves (Capsicum annum L.), and ciplukan’s leaves (Physalis angulata L.) by measured IC50 value.
Extraction process using percolation method with chloroform as solvent. Antioxidant activity test using DPPH (1,1-Diphenyl-2-picrylhidrazyl) method. Identification of phytochemical contents by Thin Layer Chromatography (TLC). The quantitative antioxidant activity test using Ultraviolet visible spectrofotometric at maximum wavelenght of 514,5 nm with vitamin C injection as comparator.
The result showed that chloroform extract of tomato’s leaves (Solanum lycopersicum L.) and ciplukan,s leaves (Physalis angulata L.) are contained of saponin and flavonoid. Chloroform extract of red-chili leaves (Capsicum annum L.) only contained of flavonoid. IC50 value of tomato’s leaves, red-chili’s leaves, and cipukan’s leaves are 88,94 ppm ± 0,22 ; 76,57 ppm ± 0,13 ; 82,07 ppm ± 0,19 respectively. Antioxidant activity of their leaves included strength category of antioxidant.
vi
Tanpa terus-menerus tumbuh dan berkembang, kata-kata seperti kemajuan,
prestasi, dan sukses tak punya arti apa-apa
(Benjamin Franklin)
Waktu itu gratis, tapi sangat berharga.Kamu tidak akan dapat memiliki, tapi
dapat memanfaatkannya. Kamu tidak dapat menyimpan, tapi dapat
menghabiskannya. Sekali kehilangan, kamu tidakakan bias mendapatkannya
kembali
(Harvey MacKay)
Kepuasan itu terletak pada usaha, bukan pada pencapaian hasil. Berusaha
kerasa dalah kemenangan besar
vii
Tugas akhir ini aku persembahkan untuk…..
Bapak dan Ibu yang selalu memberikan doa, semangat dan kasih sayang
Kakakku tersayang yang selalu memberi semangat dan motivasi
Ibu Anif Nur Artanti, M.Sc.,Apt yang telah memberikan, ilmu, bimbingan, motvasi, dan pengalaman
viii
melimpahkan rahmat dan karunia-Nya sehingga saya dapat menyelesaikan Tugas Akhir berjudul “Uji Aktivitas Antioksidan Ekstrak Kloroform Daun Tomat
(Solanum lycopersicum L.), Daun Cabai Merah (Capsicum annum L.) dan Daun Ciplukan (Physalis angulata L.) Dengan Metode DPPH (1,1-difenil-2-pikrilhidrazil)” dengan baik dan lancar. Tugas Akhir ini disusun guna melengkapi salah satu persyaratan untuk dapat memperoleh gelar Ahli Madya Farmasi di Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret, Surakarta. Dalam penulisan Tugas Akhir ini penulis telah berusaha semaksimal mungkin untuk memberikan hasil yang terbaik. Pelaksanaann Tugas Akhir ini tidak mungkin dapat terselesaikan jika tanpa adanya bimbingan, dorongan, semangat, harapan, dan motivasi serta bantuan baik doa, moril, maupun materil dari berbagai pihak. Penulis pada kesempatan ini mengucapkan terimakasih kepada :
1. Prof. Ir. Ari Handono Ramelan, M.Sc. (Hons), Ph.D, selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta. 2. Ibu Estu Retnaningtyas N., S.TP.,M.Si, selaku Kepala Program Studi D3 Farmasi
Universitas Sebelas Maret Surakarta.
ix
6. Kakakku Bangun Arizona yang selalu memberikan dukungan dan semangat. 7. Teman-teman sepenelitianku Renita, Dias, Maryani, serta teman-teman D3
Farmasi 2013 khususnya Desi, Niky, Mey, Azizah yang telah berbagi suka dan duka serta pengalaman selama kuliah dan penelitian Tugas Akhir.
8. Sahabat-sahabat dari SMA Atika, Ukhfiya, Nurul, serta teman-teman kos Kusuma yang selalu mendukung dan memberi semangat.
9. Semua pihak yang tidak dapat disebutkan satu persatu, yang telah membantu pelaksanaan dan penyusunan Tugas Akhir.
Penulis menyadari masih banyak kekurangan dalam penulisan Tugas Akhir ini. Untuk itu penulis mengharapkan adanya kritik dan saran yang membangun dari semua pihak untuk perbaikan sehingga akan menjadi bahan pertimbangan dan masukan untuk penyusunan tugas-tugas selanjutnya. Penulis berharap semoga Tugas Akhir ini dapat bermanfaat bagi pembaca pada umumnya dan dapat menjadi bekal bagi penulis dalam pengabdian Ahli Madya Farmasi di masyarakat pada khususnya.
Surakarta, Juli 2016
x
COVER.……….. i
HALAMAN PENGESAHAN..……….. ii
HALAMAN PERNYATAAN.………... iii
INTISARI... iv
ABSTRACT……….. v
MOTTO……….. vi
PERSEMBAHAN…..……….. vii
KATA PENGANTAR……….. viii
DAFTAR ISI….……….. . x
DAFTAR TABEL.………... xiii
DAFTAR GAMBAR.……….. xiv
DAFTAR LAMPIRAN……… xv
DAFTAR SINGKATAN.……… xvi
BAB I. PENDAHULUAN... 1
A. LATAR BELAKANG MASALAH... 1
B.RUMUSAN MASALAH... 4
C.TUJUAN PENELITIAN ... 4
D. MANFAAT PENELITIAN... 4
BAB II. LANDASAN TEORI... 5
A. TINJAUAN PUSTAKA... 5
1. Tanaman Tomat (Solanum lycopersicum L.)... 5
2. Tanaman Cabai Merah (Capsicum annum L.)…... 6
3. Tanaman Ciplukan (Physalis angulata L.)... 7
4. Ekstraksi dan Ekstrak………... 8
5. Kromatografi………... 10
6. Radikal Bebas………. 12
7. Antioksidan………. 14
xi
8.3. Metode FRAP……….. 18
8.4. Metode Tiosianat……….. 18
8.5. Aktivitas Penghambatan Radikal Superoksida…..…………. 19
9. Spektrofotometri UV-VIS………... 19
B. KERANGKA PEMIKIRAN……….. 21
C. HIPOTESIS……….... 22
BAB III. METODOLOGI PENELITIAN………. 23
A. JENIS PENELITIAN……….. . 23
B.WAKTU DAN TEMPAT PENELITIAN……….. 24
C.ALAT DAN BAHAN………... 24
D. PROSEDUR PENELITIAN………. 25
1. Determinasi Tanaman……….. 25
2. Pengumpulan dan Pengolahan Sampel……… 25
3. Pembuatan Serbuk Simplisia……… 25
4. Ekstraksi………... 25
5. Kontrol Kualitas Ekstrak……….. 26
6. Skrining Fitokimia dengan KLT………... 26
6.1. Uji Flavonoid………... 26
6.2. Uji Tanin………... 27
6.3. Uji Saponin………... 28
6.4. Uji Polifenol………. 28
7. Uji Aktivitas Antioksidan……… 29
7.1. Pembuatan Larutan DPPH 0,004%………... 29
7.2. Penentuan Panjang Gelombang Maksimum Pengukuran………... 29
7.3. Penyiapan Larutan Kontrol Positif (Vit. C)………. 30
7.4. Penyiapan Larutan Sampel………... 30
7.5. Pengukuran Absorbansi Ekstrak dan Vitamin C…...31
xii
A. DETERMINASI TANAMAN………...33
B. PEMBUATAN EKSTRAK………...33
C. SKRINING FITOKIMIA………..36
D. UJI KUANTITATIF ANTIOKSIDAN DENGAN METODE DPPH…...39
1. Penentuan Panjang Gelombang Maksimal………...40
2. Analisa Kuantitatif Sampel dan Vitamin C………...40
BAB V. PENUTUP………...47
A. KESIMPULAN………...47
B. SARAN………..47
DAFTAR PUSTAKA………...48
xiii
Tabel II. Data Hasil Skrining Fitokimia Estrak Daun Tomat, Ekstrak Daun Cabai
Merah, dan Ekstrak Daun Cipukan………. 39
Tabel III.Data Absorbansi Sampel Ekstrak dan Vitamin C………. 41
Tabel IV.Data (%) Aktivitas Antioksidan Sampel……… 42
xiv
Gambar 2. Tanaman Cabai Merah……… 6
Gambar 3. Tanaman Ciplukan………... 7
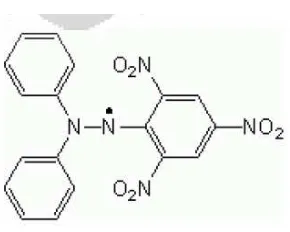
Gambar 4. Struktur DPPH………. 16
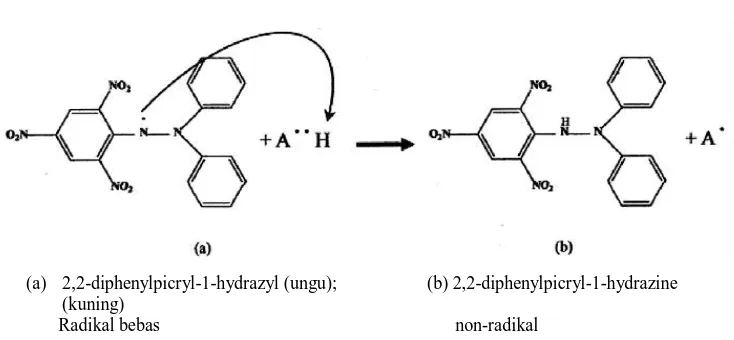
Gambar 5. Reaksi Reduksi DPPH………. 17
Gambar 7. Hasil KLT……….. 37
7.A. Hasil KLT Ekstrak Daun Tomat……… 37
7.B. Hasil KLT Ekstrak Daun Cabai Merah………. 37
7.C. Hasil KLT Ekstrak Daun Ciplukan……… 38
Gambar 8. Grafik Regresi Linear Ekstrak Daun Tomat……….. 43
Gambar 9. Grafik Regresi Linear Ekstrak Daun Cabai Merah………... 43
Gambar 10.Grafik Regresi Linear Ekstrak Daun Ciplukan……… 43
xv
Lampiran I. Hasil Determinasi Daun Tomat………. 53
Lampiran II. Hasil Determinasi Daun Cabai Merah………. 54
Lampiran III. Hasil Determinasi Daun Ciplukan……….. 55
Lampiran IV. Hasil Ekstraksi Sampel……….. 56
Lampiran V. Penentuan Panjang Gelombang Maksimal……….. 57
Lampiran VI. Diagram Alir Cara Kerja Pembuatan Ekstrak……… 58
Lampiran VII. Cara Kerja Skrining Fitokimia dengan KLT………. 59
Lampiran VIII. Cara Kerja Uji Aktivitas Antioksidan……….. 59
Lampiran IX. Perhitungan Rf hasil KLT……….. 61
Lampiran X. Data Absorbansi, Perhitungan % Aktivitas Antioksidan dan IC50 dengan menggunakan regresi linear..……….. 62
Lampiran XI. Hasil Perhitungan dengan SPSS Probit………. 66
xvi KLT = Kromatografi Lapis Tipis
IC50 = Inhibitory Concenteration BHT = Butylated hydroxyltoluen BHA = Butylated hydroxylanisole TBHQ = Tersierbutylhydroquinone
FRAP = Ferric Reducing Ability of Plasma
AAPH = 2,2’-Azobis(2-aminidopropana) hidroksiklorida nm = nanometer
p.a. = pro analisis PPM = parts per million UV = Ultraviolet Vis = Visible
1
PENDAHULUAN
A. LATAR BELAKANG
Radikal bebas adalah atom atau gugus atom yang memiliki satu atau lebih elektron tidak berpasangan. Radikal bebas merupakan molekul yang sangat reaktif karena memiliki elektron yang tidak berpasangan dalam orbital luarnya sehingga dapat bereaksi dengan molekul sel tubuh dengan cara mengikat elektron sel tersebut (Fessenden, 1997).Radikal bebas memiliki sifat yang sangat reaktif serta mampu bereaksi dengan DNA, RNA, protein, dan lipid. Efek oksidatif radikal bebas dapat menyebabkan peradangan, penuaan dini dan memacu zat karsinogenik penyebab penyakit kanker. Tubuh yang normal memiliki sistem alami yang dapat menetralisir radikal bebas agar tidak berkembang menjadi berbahaya. Faktor eksogen yang dapat memicu antara lain radiasi ultraviolet, polusi, asap rokok, dan pestisida dapat membuat sistem pertahanan tubuh tidak mampu menghadapi radikal bebas dalam jumlah besar (Mahmoud et al., 2010).
butylatedhydroxyltoluen (BHT) dan butylated hydroxylanisole (BHA), propil gallat dan etoksiquin (Cahyadi, 2006).
Indonesia merupakan negara megabiodiversitas yang terdiri dari banyak hutan yang memiliki berbagai jenis tumbuhan dengan jumlah yang luar biasa besar. Kebanyakan dari tumbuhan tersebut belum dieksplorasi dan memiliki potensi sebagai sumber obat (Wahyuningsih et al., 2008). Dengan melihat kenyataan tersebut maka beberapa usaha untuk menggali informasi kandungan senyawa kimia dan bioaktivitas tumbuhan obat melalui penelitian ilmiah menjadi sangat penting.
Mu’nisa, A (2012) mengenai analisa kadar likopen dan uji aktivitas
antioksidan pada tomat (Solanum lycopersicum L.), diketahui bahwa nilai IC50dari ekstrak metanol buah tomat yaitu sebesar 2,31 ppm. Menurut (Sugianto, 2015) dalam penelitiannya terhadap daun ciplukan diketahui bahwa mengandung senyawa flavonoid dan memiliki aktivitas antioksidan. Dalam penelitian Nuranda, dkk (2016) terhadap tumbuhan ciplukan (Physalis angulata L.) diketahui bahwa nilai IC50dari ekstrak metanol buah ciplukan yaitu sebesar 63,46 ppm.
B. RUMUSAN MASALAH
1. Apakah terdapat aktivitas antioksidan dan berapa nilai IC50 dari ekstrak kloroform daun tomat (Solanum lycopersicum L.)?
2. Apakah terdapat aktivitas antioksidan dan berapa nilai IC50 dari ekstrak kloroform daun cabai merah (Capsicum annum L.)?
3. Apakah terdapat aktivitas antioksidan dan berapa nilai IC50 dari daun ciplukan (Physalis angulata L.)?
C. TUJUAN
1. Mengetahui nilai IC50 dan aktivitas antioksidan apa yang terkandung dalam ekstrak kloroform daun tomat (Solanum lycopersicum L.).
2. Mengethuin nilai IC50 dan aktivitas antioksidan apa yang terkandung dalam ekstrak kloroform daun cabai merah (Capsicum annum L.).
3. Mengetahui nilai IC50 dan aktivitas antioksidan apa yang terkandung daun ciplukan (Physalis angulata L.).
D. MANFAAT PENELITIAN
1. Memberikan informasi kepada masyarakat dan instansi terkait kemungkinan adanya potensi aktivitas antioksidan pada bagian tanaman yang belum pernah dilakukan penelitian seperti pada bagian daun.
2. Memberikan informasi terkait metode dan prosedur pengujian senyawa antioksidan dengan 1,1-difenil-2-pikrilhidrazil ( DPPH ).
BAB II
LANDASAN TEORI
A. TINJAUAN PUSTAKA
1. Tanaman Tomat (Solanum lycopersicum L.) Klasifikasi Tanaman :
Dalam klasifikasi tumbuhan, tanaman tomat termasuk kelas Dicotyledonae (berkeping dua). Secara lengkap ahli botani mengklasifikasikan tanaman tomat secara sistematik. Tanaman tomat dapat diklasifikasikan sebagai berikut :
1. Divisi : Spermatophyta 2. Anak Divisi : Angiospermae 3. Kelas : Dicotyledonae 4. Sub-kelas : Metachlamidae 5. Ordo : Solanales 6. Famili : Solanaceae
7. Genus : Lycopersicon (Lycopersicum)
8. Spesies :Solanum lycopersicum L. (H Tugiyono 1999).
Morfologi daun pada tumbuhan tomat yaitu daunnya berbentuk oval, bagian tepi daun bergigi dan membentuk celah-celah yang menyirip serta agak melengkung ke dalam. Daun berwarna hijau merupakan daun majemuk ganjil, antara 5-7 helai, di sela-sela daun terdapat 1-2 pasang daun kecil yang berbentuk delta (Rukmana, 2000).
Gambar 1. Tanaman Tomat (Solanum lycopersicum L.)
(H Tugiyono, 1999)
2. Tanaman Cabai Merah (Capsicum annum L.) Klasifikasi Tanaman:
Menurut klasifikasi dalam tata nama (sistem tumbuhan) tanaman cabai termasuk kedalam :
1. Divisi : Spermatophyta 2. Sub divisi : Angiospermae 3. Kelas : Dicotyledoneae 4. Ordo : Solanales 5. Famili : Solanaceae 6. Genus : Capsicum
7. Spesies : Capsicum annum L.(Prajnanta, 2007)
Morfologi daun cabai menurut (Darmawan, 2010) berbentuk hati, lonjong, atau agak bulat telur dengan posisi berselang-seling. Bagian permukaan daun bagian atas berwarna hijau tua, sedangkan bagian permukaan bawah berwarna hijau muda atau hijau terang. Panjang daun berkisar 9 -15 cm dengan lebar 3,5-5 cm. selain itu daun cabai merupakan daun tunggal, bertangkai, letak tersebar.
Cabai atau Lombok termasuk dalam suku terong -terongan (Solanaceae) dan merupakan tanaman yang mudah ditanam di dataran rendah ataupun di dataran tinggi. Tanaman cabai banyak mengandung vitamin A dan vitamin C serta mengandung minyak atsiri capsaicin, yang menyebabkan rasa pedas dan memberikan kehangatan panas bila digunakan
Gambar 2. Tanaman Cabai Merah (Capsicum annum L.)
untuk rempah-rempah (bumbu dapur). Cabai dapat ditanam dengan mudah sehingga dapat dipakai untuk kebutuhan sehari-hari (Harpenas, 2010).
Daun cabai memiliki beberapa manfaat yaitu mengobati jerawat dengan cara mengoleskan tumbukan daun cabai pada bagian yang berjerawat, mengobati bisul, mengobati masuk angin, meredakan demam, sebagai bahan lulur pada kulit tubuh, bahan masker untuk mengatasi masalah kerutan, kantung mata dan flek hitam pada wajah, mengobati kejang perut, serta menghilangkan rasa gatal dari gigitan serangga (Anonim, 2015).
3. Tanaman Ciplukan (Physalis angulata L.) Klasifikasi Tanaman
1. Kingdom : Plantae
2. Divisi : Spermatophyta 3. Subdivisi : Angiospermae 4. Kelas : Dicotyledonnae 5. Ordo : Solanales 6. Famili : Solanaceae 7. Marga : Physalis
8. Spesies : Physalis angulata L. ( Latifah N., dkk, 2016).
Physalis angulata L. adalah tumbuhan herba annual (tahunan) dengan tinggi 0,1-1 m. Batang pokoknya tidak jelas, percabangan menggarpu bersegi tajam, berusuk, berongga, bagian yang hijau berambut pendek atau boleh dikatakan gundul. Daunnya tunggal bertangkai, bagian bawah
Gambar 3. Tanaman Ciplukan
(Physalis angulata L.)
tersebar, di atas berpasangan, helaian berbentuk bulat telur-bulat memanjang-lanset dengan ujung runcing ujung tidak sama (runcing-tumpul-membulat-meruncing), bertepi rata atau bergelombang-bergigi, 5-15 x 25-10,5 cm (Latifah, N., dkk , 2016).
Tanaman Ciplukan (Physalis angulata L.) merupakan tumbuhan dari family Solana ceae yang lebih dikenal di Indonesia dengan ceplukan atau ciplukan. Physalis angulata L. terbukti sebagai tanaman yang memiliki daya antihiperglikemi, antibakteri, antivirus, imunostimulan dan imunosupresan, antiinflamasi, antioksidan, dan analgesik (Salgado dkk., 2013). Tanaman ciplukan merupakan salah satu tumbuhan yang kaya akan senyawa- senyawa aktif. Pada daun ciplukan terdapat senyawa flavonoid, polifenol, physalin, chlorogenik acid, sedangkan pada bagian buah terdapat Withangulatin A, tannin, kriptoxantin, vitamin C dan gula (Osho et al., 2010).
Daun ciplukan (Physalis angulata L.) bermanfaat sebagai obat penyembuhan patah tulang, bisul, borok, penguat jantung, keseleo, nyeri perut, dan kencing nanah. Sedangkan buah ciplukan sendiri sering dimakan langsung untuk mengobati epilepsi, sulit buang air kecil, dan penyakit kuning. Akar tumbuhan ciplukan pada umumnya digunakan sebagai obat cacing dan penurun demam (Pinto, N.B., 2010)
4. Ekstraksi dan Ekstrak
menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut pada ekstrak kental diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang ditetapkan. Ekstraksi adalah proses penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Ekstraksi dibagi dalam dua metode yaitu ekstraksi menggunakan pelarut dengan metode cara dingin dan cara panas. Ekstraksi cara dingin ada dua macam metode yaitu maserasi dan perkolasi. Sedangkan cara panas yaitu refluks, sokletasi, digesti, infus dan dekok (DepKes RI , 2000).
Metode ekstraksi cara dingin antara lain : 1. Ekstraksi Metode Maserasi
Maserasi adalah proses ekstraksi simplisia menggunakan pelarut dengan beberapa kali penggocokan atau pengadukan pada temperatur ruangan (suhu kamar). Dilakukan dengan cara merendam bahan simplisia yang telah dihaluskan dengan derajat kehalusan yang sesuai. Selanjutnya dimasukkan bejana tertutup dengan cairan penyari, kemudian disimpan di tempat yang terlindungi dari cahaya lansung selama 3-5 hari dengan sesekali diaduk (Voight, 1995).
2. Ekstraksi Metode Perkolasi
perkolasi sebenarnya (penetesan/penampungan ekstrak), terus menerus hingga dihasilkan ekstrak (perkolat). Ekstraksi dengan metode perkolasi membutuhkan pelarut banyak (DepKes RI, 2000).
5. Kromatografi
Kromatografi adalah cara pemisahan fisik dengan unsur-unsur yang akan dipisahkan terdistribusi antara dua fasa, salah satu dari fasa-fasa tersebut membentuk suatu lapisan stasioner dengan luas permukaan yang besar dan yang lain merupakan cairan yang merembes melalui lapisan yang stasioner (Day & Underwood, 2002).
5.1.Kromatografi Lapis Tipis (KLT)
Terjadinya pemisahan komponen-komponen pada KLT dengan dihasilkannya Rf tertentu maka dapat dijadikan sebagai panduan untuk memisahkan komponen kimia tersebut . Nilai Rf dapat ditentukan dengan rumus :
Rf = (Gandjar & Rohman, 2007).
(1). Fase Diam
Fase diam merupakan lapisan penjerap tipis atau media yang digunakan sebagai media pembawa. Penjerap tersebut dilekatkan pada suatu penyangga yang digunakan sebagai pelapis untuk mendapatkan lapisan yang stabil dengan ukuran yang sesuai. Untuk bahan penyangga yang sering digunakan yaitu alumunium dan plastik, sedangkan pada penjerat dapat digunakan silika gel, alumina, dan selulosa (Touchstone & Dobbins, 1983).
Ukuran standar untuk lempeng KLT adalah 20 x 20 cm. ukuran lainnya dari lempeng antara lain 5 x 20 cm, 10 x 20 cm dan 20 x 40 cm (Gritter, Bobbit dan Schwarting, 1991).
(2). Fase Gerak
Fase gerak ditentukan oleh jenis zat yang dipisahkan dan jenis penjerap yang digunakan untuk pemisah. Komposisi fase gerak dapat berupa pelarut yang murni atau campuran kompleks dari beberapa pelarut (Touchstone & Dobbins, 1983).
pelarutan sampel, ekstraksi, kromatografi kolom, sentrifugasi dan penguapan. Sampel dilarutkan pada pelarut yang sesuai. Larutan sampel yang ditotolkan paling sedikit 0,5 µL, jika volume sampel yang ditotolkan lebih besar dari 2-10 µL, maka penotolan harus dilakukan secara bertahap dengan dilakukan pengeringan antar totolan. Penotolan dilakukan pada garis awal berupa titik atau pita. Penotolan berupa titik sebaiknya mempunyai diameter antara 2 mm dan paling besar 5 mm ( Stahl, 1969).
Bejana kromatografi harus tertutup rapat dan sedapatnya mungkin volume fase gerak sedikit mungkin (akan tetapi harus mampu mengelusi lempeng sampai mencapai ketinggian lempeng yang telah ditentukan).
Dengan adanya gaya kapiler tersebut akan menyebabkan fase gerak bergerak melewati media dalam proses yang disebut pengembangan. Setelah fase gerak telah hampir mencapai ujung lainnya (batas akhir penotolan) dari lempeng, maka lempeng dipindahkan dan dikeringkan sebelum dilakukan pendeteksian (Touchstone dan Dobbins, 1983).
6. Radikal Bebas
Radikal bebas adalah atom atau gugus atom yang memiliki satu atau lebih elektron tidak berpasangan. Radikal bebas merupakan molekul yang sangat reaktif karena memiliki elekron yang tidak berpasangan dalam orbital luarnya sehingga dapat bereaksi dengan molekul sel tubuh dengan cara mengikat elektron sel tersebut (Fessenden, 1997).
lemak pada mitokondria, proses inflamasi atau peradangan, reaksi antara logam transisi dalam tubuh. Untuk radikal bebas yang berasal dari luar tubuh (eksogen) yaitu dari asap rokok, polusi lingkungan, radiasi, obat-obatan, pestisida, anestetik, limbah industri, ozon, serta sinar ultraviolet (Langseth, 1995).
Mekanisme terbentuknya radikal bebas dimulai dari berbagai hal, baik yang bersifat endogen maupun eksogen. Terjadi reaksi peroksidasi lipid membran dan sitosol yang mengakibatkan terjadinya serangkaian reduksi asam lemak sehingga terjadi kerusakan membran dan organel sel (Kusumadewi, 2002). Peroksidasi (otooksidasi) lipid tidak hanya menyebabkan kerusakan makanan, tetapi juga kerusakan pada jaringan in-vivo yang dapat menyebabkan kanker, penyakit inflamasi, dan penuaan. Efek tersebut berakibat pada produksi radikal bebas (ROO-, RO-, OH+) pada proses pembentukan peroksida dari asam lemak.
Menurut (Langseth, 1995), reaksi pembentukan radikal bebas melalui tiga tahapan reaksi :
1. Tahapan inisiasi, merupakan tahapan awal yang menyebabkan terbentuknya radikal bebas.
2. Tahapan propagasi, merupakan tahapan pemanjangan rantai radikal bebas yang membuat radikal bebas cenderung bertambah banyak melalui reaksi rantai dengan molekul lain.
radikal. Reaksi ini dapat mengubah radikal bebas menjadi radikal bebas stabil dan tidak reaktif yang menyebabkan propagasinya rendah sehingga tidak ada radikal bebas baru yang terbentuk dalam tahapan ini dan rantai menjadi putus.
7. Antioksidan
Antioksidan merupakan senyawa yang menghambat proses oksidasi. Antioksidan memiliki kemampuan dalam memberikan elektron, mengikat dan mengakhiri reaksi berantai radikal bebas. Antioksidan dibagi dalam dua kelompok yaitu antioksidan alami dan antioksidan sintetik (Rohdianan, 2002).
Antioksidan alami dapat diperoleh dari hasil ekstraksi bahan alam yang diisolasi dari suatu tumbuhan. Antioksidan alami banyak tersebar pada bagian kayu, kulit kayu, akar, daun, buah, biji, dan serbuk sari. Antioksidan alami umumnya merupakan dalam senyawa fenolik/polifenolik yang dapat berupa golongan flavonoid, dan yang dapat memberikan efek antioksidan meliputi flavones, flavonol, flavonon, isoflavon, katekin, dan kalkon (Droge, 2002).
sepenuhnya diuji reaksi toksisitasnya tetapi beberapa diantaranya menjadi toksik setelah penggunaan dalam waktu lama (Takashi dan Takayuni, 1997). Berdasarkan mekanisme kerjanya, antioksidan dibagi menjadi 3 jenis yaitu :
1. Antioksidan Primer
Antioksidan primer merupakan antioksidan yang bekerja dengan cara mencegah terbentuknya radikal bebas yang baru dan mengubah radikal bebas menjadi molekul yang tidak merugikan. Sebagai contoh yaitu Butil Hidroksi Toluen (BHT), Tersier Butyl Hidro Quinon (TBHQ), propel galat, tokoferol alami maupun sintetik dan alkil galat (Kumalaningsih, 2008).
2. Antioksidan Sekunder
Mekanisme kerja dari antioksidan ini yaitu memotong reaksi oksidasi berantai dari radikal bebas sehingga tidak bisa bereaksi dengan komponen seluler (Winarsi, 2007). Contoh antioksidan jenis ini yaitu vitamin E, vitamin C, flavonoid, dan betakaroten yang banyak diperoleh dari buah-buahan (Soewoto, 2011).
3. Antioksidan Tersier
8. Metode Pengujian Antioksidan
8.1. Metode Perendaman Radikal DPPH (1,1-difenil-2-pikrilhidrazil)
Metode ini dilakukan dengan cara direndam ke dalam larutan DPPH dalam keadaan gelap, kemudian di ukur absorbansi dengan spektrofotometer. Selanjutnya ditentukan harga IC50, yakni konsentrasi larutan uji yang memberikan perendaman DPPH sebesar 50%. Harga IC50 umum digunakan untuk menyatakan aktivitas antioksidan suatu bahan uji dengan metode perendaman radikal bebas DPPH (Molyneux, 2004).
Radikal bebas yang umumnya digunakan sebagai model dalam penelitian antioksidan atau perendam radikal bebas adalah 1,1-difenil -2-pikrihidrazil (DPPH). Metode dengan DPPH merupakan metode yang sederhana, cepat, dan mudah untuk penapisan aktivitas penangkapan radikal beberapa senyawa. Selain itu metode ini terbukti akurat, dapat diandalkan dan praktis (Molyneux, 2004).
DPPH merupakan radikal bebas yang stabil pada suhu kamar dan digunakan untuk mengevaluasi aktivitas antioksidan atau ekstrak bahan alam. Interaksi antioksidan dengan DPPH baik secara transfer elektron atau
radikal hidrogen pada DPPH yaitu menetralkan radikal bebas dari DPPH dan membentuk DPPH tereduksi. Jika semua elektron pada radikal bebas DPPH menjadi berpasangan, maka warna larutan berubah dari ungu tua menjadi kuning terang. Perubahan ini dapat diukur sesuai dengan jumlah elektron atau atom hidrogen yang ditangkap oleh molekul DPPH akibat adanya reduktor (Molyneux, 2004).
(a) 2,2-diphenylpicryl-1-hydrazyl (ungu); (b) 2,2-diphenylpicryl-1-hydrazine (kuning)
Radikal bebas non-radikal
Gambar 5. Reaksi reduksi DPPH oleh donor atom hidrogen seperti senyawa fenolik
(Molyneux, 2004)
8.2.Metode Reducing Power
campuran reaksi menunjukkan kekuatan mereduksi dari antioksidan (Joseph, G.S,.Jayaprakasha, Selvi A.T., Jena B.S., Sakariah K.K, 2005).
8.3.Metode FRAP
FRAP (Ferric Reducing Ability of Plasma) adalah salah satu tes yang paling cepat dan sangat berguna untuk analisis rutin (Shivaprasad, Mohan, Kharya, 2005). Uji FRAP didasarkan pada kemampuan antioksidan untuk mereduksi Fe3+ menjadi Fe2+ dengan adanya 2,4,6-tri(2-piridil)-s triazine (TPTZ), membentuk biru intensif dari kompleks Fe2+, TPTZ yang diukur pada absorbansi maksimum 593 nm. Reaksi ini tergantung pH (pH optimum 3,6). Penurunan absorbansi sebanding dengan kandungan antioksidan (Chanda, S., Dave, R, 2009).
8.4.Metode Tiosianat
Aktivitas antioksidan sampel dengan metode tiosianat ditunjukkan dengan kekuatan sampel dalam menghambat peroksidasi asam linoleat. Jumlah peroksida yang terbentuk diukur secara tidak lansung dengan pembentukan kompleks ferritiosianat yang berwarna merah. Senyawa AAPH (2,2’-Azobis(2-aminidopropana) hidroksiklorida) pada pemanasan
akan menginduksi pembentukan radikal dan menyebabkan terjadinya peroksidasi asam linoleat. Peroksida yang terbentuk akan mengoksidasi ion ferro menjadi ferri. Antioksidan kuat akan menunjukkan grafik antara serapan dan waktu inkubasi yang landai (Mun’im, Azizahwati dan
8.5.Aktivitas Penghambatan Radikal Superoksida
Metode ini didasarkan pada pembangkitan radikal superoksida oleh autooksidasi dari riboflavin dengan adanya cahaya. Radikal superoksida mereduksi NBT (Nitro bitu tetra zolium) menjadi formazon yang berwarna biru yang dapat diukur pada panjang gelombang 560 nm (Shivaprasad, 2005).
9. Spektrofotometri UV-VIS
Spektrofotometri merupakan pengukuran suatu interaksi antara radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia (DepKes RI, 1995). Prinsip kerja dari spektrofotometer UV-Vis yaitu sinar dari sumber sinar adalah sinar polikromatis, dilewatkan melalui monokromator, kemudian sinar monokromatis dilewatkan melalui kuvet yang berisi sampel maka akan menghasilkan sinar yang ditransmisikan dan diterima oleh detektor untuk diubah menjadi energi listrik yang kekuatannya dapat diamati oleh alat pembaca (satuan yang dihasilkan adalah absorban atau transmitan).
maksimum ataupun yang sudah tercantum dalam monografi (DepKes RI, 1979).
Hal – hal yang perlu diperhatikan pada saat analisa dengan menggunakan spektrofotometer UV-Vis:
1. Pembentukan molekul yang dapat menyerap sinar UV-Vis
Hal ini perlu dilakukan jika senyawa yang dianalisis tidak menyerap sinar pada daerah tersebut. Cara yang digunakan adalah dengan merubah menjadi senyawa lain atau direaksikan dengan pereaksi tertentu.
2. Waktu operasional (operating time)
Tujuannya adalah untuk mengetahui waktu pengukuran yang stabil. Waktu operasional ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan.
3. Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang maksimal. Panjang gelombang maksimal diketahui dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu.
4. Pembuatan kurva baku
5. Pembacaan absorbansi sampel atau cuplikan
Rentang absorbansi spektofotometri 0,2 sampai 0,8 atau 15% sampai 70% jika dibaca sebagai transmitan. Hal ini berdasarkan anggapan bahwa kesalahan pada pembacaan adalah 0,005 atau 0,5% (Gandjar
&Rohman,2007).
B. KERANGKA PEMIKIRAN
kloroform untuk melihat potensi aktivitas antioksidan dari metabolit sekunder yang bersifat nonpolar.
C. HIPOTESIS
1. Ekstrak kloroform daun tomat (Solanum lycopersicum L. ) memiliki aktivitas antioksidan.
2. Ekstrak kloroform daun cabai merah (Capsicum annum L.) memiliki aktivitas antioksidan.
BAB III
METODOLOGI PENELITIAN
A. JENIS PENELITIAN
Penelitian ini menggunakan metode eksperimental laboratorium. Metode yang digunakan untuk mengekstraksi kandungan kimia dalam daun tomat (Solanum lycopersicum L. ), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.)adalah metode perkolasi dengan menggunakan pelarut klorofom teknis. Ekstrak kloroform daun tomat, daun cabai merah, dan daun ciplukan yang diperoleh dilakukan pengujian aktivitas antioksidan. Dalam penelitian ini digunakan 3 macam variabel, yaitu :
1. Variabel bebas : Variabel yang tercakup dalam hipotesis penelitian danberpengaruh atau mempengaruhi variabel tergantung. Pada penelitian inivariabel bebasnya adalah konsentrasi ekstrak daun tomat (Solanum lycopersicum L. ), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.)
2. Variabel tergantung : Variabel yang tercakup dalam hipotesis penelitian dan keragamannya dipengaruhi oleh variabel lain. Variabel tergantung dalam penelitian ini adalah persen (%)aktivitas antioksidan dan nilai IC50. 3. Variabel kontrol (terkendali) yaitu metode ekstraksi, suhu, metode uji
DPPH, spektrofotometer UV-Vis (panjang gelombang).
B. WAKTU DAN TEMPAT PENELITIAN
Penelitian ini dilaksanakan di Laboratorium Teknologi Farmasi FMIPA UNS, Laboratorium Farmasetika FMIPA UNS, dan Laboratorium Pusat MIPA Sublab Kimia Universitas Sebelas Maret Surakarta bulan Oktober 2015 – April 2016.
C. ALAT DAN BAHAN
1. Alat Yang Digunakan
Alat-alat yang digunakan dalam penelitian ini adalah rotar y evaporator, seperangkat alat spektrofotometer UV-Visibel (Shimadzu®) 2.0 (Lambda 25), timbangan digital (Mettler teledo®),blender (Miyako®), lampu UV 254 nm dan 366 nm, pipa kapiler, cawan porselin, alat-alat gelas berupa labu ukur 250 mL (Pyrex®), labu ukur 100 mL (Pyrex®), labu ukur 25 mL (Pyrex®), labu ukur 5 mL (Pyrex®), erlenmeyer 250 mL (Pyrex), gelas ukur 50 mL (Pyrex®), gelas ukur 10 mL (Pyrex®), gelas beker 250 mL (Pyrex®), tabung reaksi (Pyrex®), pipet tetes, corong,kaca arloji, mikro pipet 25-100µL, mikro pipet (Masterpette®)100-1000µL, blue tip,chamber, sendok besi, penjepit, penggaris, dan pensil.
2. Bahan Yang Digunakan
asam formiat p.a (Merck®), etil asetatp.a (Merck®), kloroform p.a (Merck®), metanol p.a (Merck®), tisu, dan alumunium foil.
D. POSEDUR PENELITIAN
1. Determinasi Tanaman
Daun yang digunakan dalam penelitian ini yaitu daun tomat (Solanum lycopersicum L.), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.) dilakukan identifikasi di Laboratorium Biologi FMIPA Universitas Sebelas Maret Surakarta.
2. Pengumpulan dan Pengolahan Sampel
Daun tomat (Solanum lycopersicum L.), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.) diambil dari bagian daun yang masih muda yang di kumpulkan dari daerah Karanganyar dan Boyolali. Daun yang diperoleh, dicuci bersih dan dikeringanginkan selama 7 hari hingga dihasilkan simplisia kering.
3. Pembuatan Serbuk Simplisia
Bahan uji daun tomat (Solanum lycopersicum L. ), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.) setelah kering dilakukan penghalusan dengan derajat halus tertentu.
4. Ekstraksi
kloroform kemudian cairan penyari akan menetes. Kemudian , ujung perkolator ditutup menggunakan alumunium foil. Cairan penyari dituang perlahan-lahan hingga di atas massa. Cairan penyari harus selalu ditambahkan sehingga terjaga agar tetap selapis diatas serbuk sampai tetesan dari proses ekstraksi berwarna putih bening.. Setelah didapat perkolat, kemudian disaring dan diuapkan dengan menggunakan rota ry evaporator dengan suhu 400C dan putaran 6 rpm hingga didapatkan ekstrak kental. 5. Kontrol Kualitas Ekstrak
a. Perhitungan Rendemen Ekstrak
Rendemen ekstrak dapat dihitung dengan cara jumlah bobot ekstrak yang diperoleh (gram) terhadap jumlah bobot simplisia awal (gram), yang hasilnya dinyatakan dalam persen (Anonim, 2000).
b. Pemeriksaan Organoleptis
Pemeriksaan dilakukan dengan mengamati konsistensi, warna dan bau dari ekstrak daun tomat (Solanum lycopersicum L.), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.).
6. Skrining Fitokimia Dengan KLT 6.1. Uji Flavonoid
fase diam yang kemudian dimasukkan kedalam chamber berisi fase gerak yang sudah dijenuhkan. Lempeng KLT didiamkan hingga senyawa dalam ekstrak terelusi sampai batas atas plat KLT, dikeringkan dan selanjutnya dideteksi dengan UV 254 dan UV 366. Pada penelitian terhadap kandungan flavonoid yang terkandung dalam ekstrak daun jambu biji fraksi etil asetat dan fraksi n-heksana, diketahui bahwa hasil positif menunjukkan adanya bercak dengan nilai Rf yaitu 0,8 (warna coklat) dan 0,813 (warna hijau). Sebagai pembanding digunakan kuersetin dengan nilai Rf yaitu 0,8 ( Fajar dkk, 2011).
6.2. Uji Tanin
Identifikasi tanin dilakukan dengan Kromatografi Lapis Tipis (KLT) yang menggunakan fasa gerak berupa kloroform : etil asetat : asam formiat (0,5:9,0:0,5) dan fasa diam silika gel GF254. Ekstrak daun tomat (Solanum
6.3. Uji Saponin
Identifikasi senyawa saponin dilakukan dengan Kromatografi Lapis Tipis (KLT) yang menggunakan fasa gerak berupa kloroform : metanol (95 : 5) dan fasa diam berupa plat silika gel GF254. Ekstrak daun tomat (Solanum
lycopersicum L.), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.) masing-masing ditotolkan pada plat silika gel GF254 dan kemudian dimasukkan ke dalam chamber berisi fasa gerak yang sudah dijenuhkan. Lempeng KLT didiamkan hingga senyawa dalam ekstrak terelusi hingga batas atas plat, dikeringkan, dan selanjutnya dideteksi dengan UV 254 dan UV 366. Menurut penelitian tentang identifikasi kandungan kimia terhadap ekstrak etanol daun sirih merah, hasil positif terhadap kandungan saponin ditunjukkan dengan adanya bercak pada sampel dengan nilai Rf sebesar 0,65. Sedangkan pada senyawa pembanding berupa saponin dari quillaja bark, menghasilkan bercak dengan nilai Rf sebesar 0,48; 0,61; 0,83 (Ninik, Y.W., dkk, 2011).
6.4. Uji Polifenol
batas atas plat, dikeringkan, dan dideteksi dengan penampak bercak yaitu UV 254 dan UV 366. Pada penelitian kandungan polifenol pada ekstrak etil asetat daun binahong, kandungan polifenol ditunjukkan adanya bercak dengan nilai Rf sebesar 0,21 (Sulistyani dkk, 2012).
7. Uji Aktivitas Antioksidan
Pada masing- masing ekstrak dari daun tomat (Solanum lycopersicum L.), daun cabai merah (Capsicum annum L.), dan daun ciplukan (Physalis angulata L.) diuji aktivitas antioksidan dengan metode DPPH. Nilai IC50 dihitung dengan menggunakan rumus persamaan regresi.
7.1. Pembuatan Larutan DPPH 0,004%
Sejumlah 10 mg DPPH ditimbang dan dilarutkan dalam 250 ml metanol p.a dan didapatkan konsentrasi DPPH 40 ppm atau 0,004% (Limbono, 2013).
7.2. Penentuan Panjang Gelombang Maksimal Pengukuran
7.3. Penyiapan Larutan Kontrol Positif (Vitamin C) a. Larutan Induk
Vitamin C injeksi (Extrace®) dengan konsentrasi 100 mg/mL (100.000 ppm) diencerkan menjadi 100 ppm dalam 25 mL dengan rumus :
V1×M1 = V2×M2
Dari perhitungan, diambil vitamin C injeksi sebanyak 25 µL yang diencerkan dengan metanol p.a sampai 25 mL. Larutan vitamin C 100 ppm diencerkan lagi menjadi 10 ppm. Dari perhitungan, diambil vitamin C 100 ppm sebanyak 5 mL yang diencerkan menjadi 50 mL.
b. Larutan Seri (2,4,6,8,10 ppm)
10 ppm : digunakan larutan induk 10 ppm
8 ppm : diambil 8 mL larutan induk ditambahkan metanol p.a
sampai volumenya 10 mL
6 ppm : diambil 6 mL larutan induk ditambahkan metanol p.a
sampai volumenya 10 mL.
4 ppm : diambil 4 mL larutan induk ditambahkan metanol p.a
sampai volumenya 10 mL.
2 ppm : diambil 2 mL larutan induk ditambahkan metanol p.a
sampai volumenya 10 mL. 7.4. Penyiapan Larutan Sampel a. Larutan Induk
ekstrak kloroform daun ciplukan masing-masing dilarutkan 25 mL metanol p.a.
b. Larutan Seri (10,30,60,90,120 ppm)
120 ppm : digunakan larutan induk 120 ppm
90 ppm : diambil 3,75 mL larutan induk ditambahkan metanol p.a
sampai volumenya 5 mL.
60 ppm : diambil 2,5 mL larutan induk ditambahkan metanol p.a
sampai volumenya 5 mL
30 ppm : diambil 1,25 mL larutan induk ditambahkan metanol p.a
sampai volumenya 5 mL.
10 ppm : diambil 0,416 mL larutan induk ditambahkan metanol p.a
sampai volumenya 5 mL.
7.5. Pengukuran Absorbansi Terhadap Ekstrak dan Vitamin C Masing-masing larutan uji dipipet 4 mL dimasukkan ke dalam tabung reaksi, ditambahkan 2 mL DPPH 0,004 % dikocok dengan vortex dan dibiarkan di suhu kamar selama 30 menit dan diukur serapannya pada panjang gelombang yang dihasilkan (514,5 nm).
7.6. Analisis Data Aktivitas Antioksidan
Daya antioksidan atau kapasitas anti radikal bebas DPPH diukur berdasarkan presentase aktivitas antioksidan terhadap radikal DPPH dari masing – masing konsentrasi larutan sampel dengan rumus :
Keterangan :
Abs DPPH kontrol = Abs DPPH sebelum direaksikan dengan sampel Abs DPPH sampel =Abs DPPH setelah direaksikan dengan sampel
Setelah didapatkan presentasi aktivitas antioksidan dari masing-masing konsentrasi, kemudian ditentukan persamaan y = bx + a dengan perhitungan secara regresi linear dengan x adalah konsentrasi (μg/mL) dan y
adalah presentase aktivitas antioksidan (%). Aktivitas antioksidan dinyatakan dengan Inhibition Concentration 50% (IC50) yaitu konsentrasi sampel yang dapat meredam radikal DPPH sebanyak 50%. Nilai IC50 didapatkan dari nilai x setelah mengganti y = 50 (Subiyandono, 2009).
7.7. Analisa Data Dengan SPSS
BAB IV
HASIL DAN PEMBAHASAN
A. DETERMINASI TANAMAN
Determinasi pada suatu tanaman bertujuan untuk mengetahui kebenaran identitas dari tanaman yang kita gunakan dalam uji tersebut, apakah tanaman tersebut sesuai dengan tanaman yang akan kita gunakan. Dengan dilakukannya determinasi ini maka dapat mengantisipasi adanya kesalahan dalam pengumpulan tanaman guna untuk penelitian. daun tomat (Solanum lycopersicum L.), daun cabai merah (Capsicum annum L.), dan daun ciplukan (Physalis angulata L.) yang digunakan dalam penelitian ini dideterminasi di Laboratorium Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sebelas Maret (UNS) Surakarta menurut buku C.A. Backer & R.C. Bakhuizen van den Brink, Jr. (1963;1965) dan buku C.G.G.J. van Steenis (1978). Dari hasil determinasi diketahui bahwa tanaman yang digunakan dalam penelitian sudah sesuai dengan tanaman tanaman yang diinginkan (Lampiran I, II, III).
B. PEMBUATAN EKSTRAK
Daun tomat (Solanum lycopersicum L.), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.) yang sudah dikumpulkan dan dilakukan pencucian, sebelum dilakukan pengeringan, terlebih dahulu dilakukan penyortiran. Sortasi dilakukan agar bahan-bahan yang digunakan memiliki kondisi yang baik. Selanjutnya, bahan-bahan dilakukan pengeringan dengan cara kering angin, yaitu bahan-bahan
dikeringkan di dalam ruangan yang pengeringannya dengan bantuan udara. Pengeringan dilakukan selama 7 hari hingga dihasilkan bahan yang benar-benar kering dan mudah di remah atau dihancurkan. Proses pengeringan ini bertujuan agar mengurangi kadar air dalam bahan sehingga menghindari tumbuhnya jamur (fungi) pada bahan selama penyimpanan.
Bahan yang dalam kondisi kering, kemudian diperkecil ukurannya dengan cara diserbuk menggunakan blender. Untuk mendapatkan derajat kehalusan tertentu, serbuk diayak dengan ayakan no. 4/18. Hal ini artinya serbuk simplisia lolos pada ayakan no.4 dan tidak lebih dari 40% lolos pada ayakan no.18. Penghalusan simplisia dilakukan dengan tujuan untuk meningkatkan luas permukaan sehingga kontak antara sampel dengan pelarut menjadi semakin luas (Cannel, 1998).
Proses penyarian dilakukan dengan metode perkolasi, dimana metode ini memiliki keuntungan yaitu tidak terjadinya kejenuhan dan dapat meningkatkan difusi karena dengan terus dialiri cairan penyari secara kontinu dapat menyebabkan zat terdorong untuk keluar dari sel. Selain memiliki keuntungan, penyarian menggunakan metode perkolasi juga memilki kerugian yaitu cairan penyari yang digunakan relatif banyak dan adanya resiko cemaran mikroba karena proses dilakukan secara terbuka (DepKes RI, 1986).
Pemilihan pelarut kloroform karena memiliki sifat non polar, dimana penelitian ini bertujuan untuk melihat kemungkinan adanya aktivitas antioksidan dari metabolit sekunder yang bersifat non polar. Setelah dihasilkan ekstrak cair dari proses perkolasi, kemudian dipekatkan dengan rotary evaporatordengan suhu 400C hingga dihasilkan ekstrak kental.
Dari hasil ekstraksi diperoleh ekstrak kentaldaun tomat sebanyak 1,07 gram, ekstrak kental daun cabai merah sebanyak 0,55 gram dan ekstrak daun ciplukan sebanyak 0,52 gram. Selanjutnya untuk rendemen yang dihasilkan dari ekstrak daun tomat, ekstrak daun cabai merah, dan ekstrak daun ciplukan masing-masing adalah 4,51% ; 1,93% ; 2,11%. Perhitungan dari rendemen ekstrak dapat dilihat pada lampiran IV.
Ekstrak kental yang didapat, selain dihitung rendemennya selanjutnya dilakukan uji organoleptis untuk mengetahui karakteristik dari ekstrak yang dihasilkan. Uji organoleptis yang dilakukan mencakup dari bentuk, warna, dan aroma dari masing-masinng ekstrak.Ekstrak kental dari daun tomat (Solanum lycopersicum L.) (Gambar 6.A), daun cabai merah (Capsicum annum L.) (Gambar 6.B), dan daun ciplukan (Physalis angulata L.) (Gambar 6.C).
Gambar 6.Hasil Ekstraksi Sampel. A. Ekstrak Kloroform Daun Tomat (Solanum lycopersicum L.); B. Ekstrak Kloroform Daun Cabai Merah (Capsicum annum L.); C. Ekstrak Kloroform Daun Ciplukan (Physalis angulata L.)
Tabel I. Data Hasil Uji Organoleptis
Ekstrak Organoleptis
Bentuk Warna Aroma
Ekstrak Daun Tomat
Ekstrak Daun Cabai
Merah
Ekstrak Daun Ciplukan
Ekstrak kental
Ekstrak kental
Ekstrak kental
sedikit kering
Hijau kehitaman
Hijau kehitaman
Hijau kehitaman
Beraroma khas
menyengat pahit
keasaman
Beraroma khas
sedikit asam
Beraroma khas
daun sedikit asam
C. SKRINING FITOKIMIA
Skrining fitokimia dilakukan untuk mengetahui golongan senyawa yang terkandung dalam suatu bahan dan untuk mengetahui apakah suatu tumbuhan berpotensi untuk dapat dimanfaatkan (Harborne, 1987).
A. Polifenol
Cahaya UV 254 UV 366 Tampak
B. Saponin
Cahaya UV 254 UV 366 Tampak
C.Tanin
Cahaya UV 254 UV 366 Tampak
D.Flavonoid
CahayaUV 254 UV 366 Tampak
Gambar 7.A. Hasil KLT Ekstrak Daun Tomat ( Solanum lycopersicum L.)
A.Polifenol
Cahaya UV 254 UV 366 Tampak
B. Saponin
C. Tanin
Cahaya UV 254 UV 366 Tampak
D. Flavonoid
Cahaya UV 254 UV 366 Tampak
Gambar 7.B. Hasil KLT EKstrak Daun Cabai Merah (Capsicum annum L.)
A. Polifenol
Cahaya UV 254 UV 366 Tampak
B. Saponin
Cahaya UV 254 UV 366 Tampak
C. Tanin
Cahaya UV 254 UV 366 Tampak
D. Flavonoid
Cahaya UV 254 UV 366 Tampak
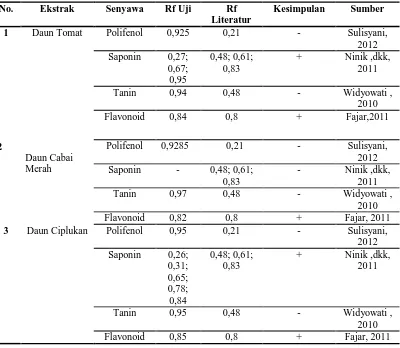
Tabel II. Data Hasil Skrining Fitokimia Ekstrak Daun Tomat, Ekstrak Daun Cabai Merah, dan Esktrak Daun Ciplukan
No. Ekstrak Senyawa Rf Uji Rf
Literatur
Kesimpulan Sumber
1 Daun Tomat Polifenol 0,925 0,21 - Sulisyani, 2012 Saponin 0,27;
0,67; 0,95
0,48; 0,61; 0,83
+ Ninik ,dkk, 2011
Tanin 0,94 0,48 - Widyowati , 2010 Flavonoid 0,84 0,8 + Fajar,2011
2
Daun Cabai Merah
Polifenol 0,9285 0,21 - Sulisyani, 2012 Saponin - 0,48; 0,61;
0,83
- Ninik ,dkk, 2011 Tanin 0,97 0,48 - Widyowati ,
2010 Flavonoid 0,82 0,8 + Fajar, 2011
3 Daun Ciplukan Polifenol 0,95 0,21 - Sulisyani, 2012 Saponin 0,26;
0,31; 0,65; 0,78; 0,84 0,48; 0,61; 0,83
+ Ninik ,dkk, 2011
Tanin 0,95 0,48 - Widyowati , 2010 Flavonoid 0,85 0,8 + Fajar, 2011
Dari gambar dan tabel diatas dapat diketahui bahwa ekstrak kloroform daun tomat dan ciplukan positif mengandung senyawa saponin dan flavonoid. Namun untuk ekstrak kloroform daun cabai merah tidak mengandung saponin tetapi mengandung senyawa flavonoid.
warna ungu pada larutan DPPH sehingga dapat diukur absorbansinya pada panjang gelombang sekitar 520 nm (Antolovich, dkk, 2002).Interaksi antioksidan dengan DPPH yaitu menetralkkan radikal bebas dari DPPH dan membentuk DPPH tereduksi. Perubahan yang terjadi dari berubahnya elektron pada radikal bebas DPPH yang menjadi berpasangan yaitu terjadinya perubahan larutan dari warna ungu tua mejadi kuning terang (Molyncux, 2004).
Metode dengan DPPH ini dipilih karena metodenya yang relatif mudah, murah paling umum digunakan secara in vitro, sederhana, cepat, serta metode ini memerlukan sampel dalam jumlah yang tidak terlalu banyak dan tidak membutuhkan banyak reagen (Ozcelik, Lee & Min, 2003).
1. Penentuan Panjang Gelombang Maksimal
Penetapan panjang gelombang maksimal ini bertujuan untuk mengetahui besarnya panjang gelombang yang dibutuhkan dari larutan DPPH 0,004% untuk mencapai serapan maksimal (Rohmani, dkk., 2010). Hasil dari pengukuran panjang gelombang maksimal dari larutan DPPH 0,004% sebesar 514,5 nm(Lampiran V). Hasil yang didapat ini digunakan untuk mengukur absorbansi dari masing-masing sampel.
2. Analisa Kuantitatif Sampel dan Vitamin C
DPPH 0,004%, selanjutnya dilakukan pencampuran menggunakan vortex dengan tujuan agar larutan sampel dan larutan DPPH 0,004% dapat tercampur dengan baik. Setelah didiamkan selam 30 menit, kemudian dilakukan pengukuran absorbansi menggunakan panjang gelombang 514,5 nm. Nilai absorbansi dari semua larutan dapat dilihat pada tabel (Tabel III).
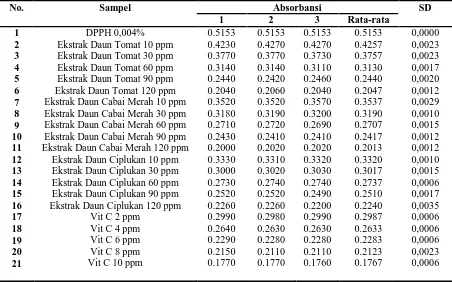
Tabel III. Data Absorbansi Sampel ekstrak dan Vitamin C
No. Sampel Absorbansi SD
1 2 3 Rata-rata
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 DPPH 0,004% Ekstrak Daun Tomat 10 ppm Ekstrak Daun Tomat 30 ppm Ekstrak Daun Tomat 60 ppm Ekstrak Daun Tomat 90 ppm Ekstrak Daun Tomat 120 ppm Ekstrak Daun Cabai Merah 10 ppm Ekstrak Daun Cabai Merah 30 ppm Ekstrak Daun Cabai Merah 60 ppm Ekstrak Daun Cabai Merah 90 ppm Ekstrak Daun Cabai Merah 120 ppm
Ekstrak Daun Ciplukan 10 ppm Ekstrak Daun Ciplukan 30 ppm Ekstrak Daun Ciplukan 60 ppm Ekstrak Daun Ciplukan 90 ppm Ekstrak Daun Ciplukan 120 ppm
Vit C 2 ppm Vit C 4 ppm Vit C 6 ppm Vit C 8 ppm Vit C 10 ppm
0.5153 0.4230 0.3770 0.3140 0.2440 0.2040 0.3520 0.3180 0.2710 0.2430 0.2000 0.3330 0.3000 0.2730 0.2520 0.2260 0.2990 0.2640 0.2290 0.2150 0.1770 0.5153 0.4270 0.3770 0.3140 0.2420 0.2060 0.3520 0.3190 0.2720 0.2410 0.2020 0.3310 0.3020 0.2740 0.2520 0.2260 0.2980 0.2630 0.2280 0.2110 0.1770 0.5153 0.4270 0.3730 0.3110 0.2460 0.2040 0.3570 0.3200 0.2690 0.2410 0.2020 0.3320 0.3030 0.2740 0.2490 0.2200 0.2990 0.2630 0.2280 0.2110 0.1760 0.5153 0.4257 0.3757 0.3130 0.2440 0.2047 0.3537 0.3190 0.2707 0.2417 0.2013 0.3320 0.3017 0.2737 0.2510 0.2240 0.2987 0.2633 0.2283 0.2123 0.1767 0,0000 0,0023 0,0023 0,0017 0,0020 0,0012 0,0029 0,0010 0,0015 0,0012 0,0012 0,0010 0,0015 0,0006 0,0017 0,0035 0,0006 0,0006 0,0006 0,0023 0,0006
Tabel IV. Data (%) Aktivitas Antioksidan Sampel Ekstrak dan Vitamin C
No Sampel (%) Aktivitas Antioksidan
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
Ekstrak Daun Tomat 10 ppm Ekstrak Daun Tomat 30 ppm Ekstrak Daun Tomat 60 ppm Ekstrak Daun Tomat 90 ppm Ekstrak Daun Tomat 120 ppm Ekstrak Daun Cabai Merah 10 ppm Ekstrak Daun Cabai Merah 30 ppm Ekstrak Daun Cabai Merah 60 ppm Ekstrak Daun Cabai Merah 90 ppm Ekstrak Daun Cabai Merah 120 ppm Ekstrak Daun Ciplukan 10 ppm Ekstrak Daun Ciplukan 30 ppm Ekstrak Daun Ciplukan 60 ppm Ekstrak Daun Ciplukan 90 ppm Ekstrak Daun Ciplukan 120 ppm Vit C 2 ppm
Vit C 4 ppm Vit C 6 ppm Vit C 8 ppm Vit C 10 ppm
17,39 27,10 39,26 52,65 60,28 31,37 38,09 47,47 53,10 60,93 35,57 41,46 46,89 51,29 56,53 42,04 48,90 55,69 58,79 65,72
Gambar 8. Grafik Persamaan Regresi Linear Sampel Ekstrak Daun Tomat
Gambar 9. Grafik Persamaan Regresi Linear Sampel Ekstrak Daun Cabai Merah
Gambar 10. Grafik Persamaan Regresi Linear Sampel Ekstrak Daun Ciplukan
0 10 20 30 40 50 60 70
0 50 100 150
% A k ti v it a s A n ti o k si d a n Konsentrasi (ppm) 0 10 20 30 40 50 60 70
0 50 100 150
% A k ti v it a s A n ti o k si d a n Konsentrasi (ppm) 0 10 20 30 40 50 60
0 50 100 150
Berdasarkan grafik diatas dihasilkan persamaan regresi linear Y=bx+a yang digunakan untuk menghitung IC50 dari masing-masing ekstrak. Persamaan regresi linear yang dihasilkan dari ekstrak daun tomat yaitu y=0.396x + 14.78, dengan R = 0.995 sehingga IC50 dari ekstrak daun tomat sebesar 88,94 ppm. Persamaan regresi linear dari ekstrak daun cabai merah yaitu y = 0.263x + 29.86, dengan R = 0.995 sehingga IC50 dari ekstrak daun cabai merah sebesar 76,58 ppm. Sedangkan persamaan regresi linear yang dihasilkan dari ekstrak daun ciplukan yaitu y = 0.183x + 34.98, dengan R=0.993, sehingga IC50 dari ekstrak daun ciplukan sebesar 82,07 ppm. Untuk pembanding sebagai agen antioksidan, digunakan vitamin C. Adapun dalam perhitungan nilai IC50 pada vitamin C juga digunakan persamaan regresi linear dengan grafik dari persamaan regresi linear (Gambar 11).
Gambar 11. Grafik Persamaan Regresi Linear Vitamin C
Berdasarkan grafik diatas dihasilkan persamaan regresi linear yaitu y=2.862x + 37.05 dengan nilai R = 0.993, sehingga nilai IC50 dari vitamin C injeksi sebesar 4,52 ppm.
y = 2.862x + 37.05 R = 0.993
0 10 20 30 40 50 60 70
0 2 4 6 8 10 12
Dalam melakukan perhitungan nilai IC50 digunakan persamaan regresi linear (lampiranX) dan juga dengan analisa probit menggunakan SPSS dengan probabilitas 0,015 (lampiran XI).Dari hasil perhitungan persamaan regresi linear dan hasil analisis probit dengan SPSS didapatkan nilai IC50 dari masing-masing sampel (Tabel V).
Tabel V. Data nilai IC50sampel dan vitamin C
No. Sampel Nilai IC50
(Regresi linear)
Nilai IC50 (Analisa probit)
P= 0,015 1 2 3 4 Ekstrak Daun Tomat Ekstrak Daun Cabai Merah Ekstrak Daun Ciplukan Vitamin C 88,94 ppm 76,58 ppm 82,07 ppm 4,52 ppm 89,25 ppm 89,69 ppm 89,17 ppm 76,24 ppm 76,54 ppm 76,91 ppm 82,36 ppm 82,57 ppm 81,09 ppm 4,58 ppm 4,48 ppm 4,48 ppm
hasil perhitungan dengan SPSS, dilihat pada tabel “Parameter Estimate”
bagian signifikansinya. Nilai signifikansi dari keempat sampel semuanya yaitu 0,000 < 0,005 yang artinya perbedaan konsentrasi secara signifikan memberikan pengaruh terhadap nilai persen (%) aktivitas dan nilai IC50.
BAB V PENUTUP
A. KESIMPULAN
1. Nilai IC50 pada ekstrak daun tomat (Solanum lycopersicum L.) sebesar 88,94 ppm ± 0,22, sehingga memiliki aktivitas antioksidan kuat.
2. Nilai IC50 ekstrak daun cabai merah (Capsicum a nnum L.) sebesar 76,58 ppm± 0,13, sehingga memiliki aktivitas antioksidan kuat.
3. Nilai IC50 ekstrak daun ciplukan (Physalis angulata L.) sebesar 82,07 ppm± 0,19, sehingga memiliki aktivitas antioksidan kuat.
B. SARAN
Perlu dilakukan pengujian kombinasi terhadap sampel daun tomat (Solanum lycopersicum L. ), daun cabai merah (Capsicum annum L.) dan daun ciplukan (Physalis angulata L.) untuk melihat kemungkinan dihasilkan profil antioksidan yang sangat kuat.
DAFTAR PUSTAKA
DepKes RI, 1979, Farmakope Indonesia Edisi III, Departemen Kesehatan Republik Indonesia, Jakarta.
DepKes RI, 1986, Sediaan Galenik, Departemen Kesehatan Republik Indonesia, Jakarta.
DepKes RI, 1995, Farmakope Indonesia Edisi IV, Departemen Kesehatan Republik Indonesia, Jakarta.
DepKes RI, 2000, Parameter Standar Umum Ekstrak Tumbuhan Obat, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 2015, 12 Manfaat Daun Cabai Bagi Kesehatan,
http://manfaat.co.id/manfaat-daun-cabai, 11 Maret 2016
Antolovich,M., Prenzler, P.D., Patsalides, E., McDonald, S., dan Robards, K., 2002, Methotds for Testing Antioxidant Activity, Analyst, 127: 183-198. Cahyadi, W., 2006, Analisis dan Aspek Kesehatan Bahan Tambahan Makanan,
Bumi Aksara, Jakarta.
Cannel, R.J.P., 1998, How To Approach The Isolation Of A Natural Product, In Natural Product Isolation 1st ad, 1, 51, Humawa Press,New Jersey. Chanda, S., Dave, R., 2009, In Vitro Models for Antioxidant Activity Evaluation
and Some Medicinal Plants Prossessing Antioxidant Properties: An overvie, African Journal of Microbiology Research,3(13) : 981-996. Darmawan, J., dan J. S. Baharsjah, 2010, Dasar-dasar Fisiologi Tanaman, SITC,
Jakarta.
Day., J.R dan Underwood, 2002, Analisis Kimia Kuantitatif Edisi Keenam, Penerbit Erlangga, Jakarta.
Droge, W. 2002. Free Radicals in the Physiological Control of Cell Function, Physiol Rev.
Fajar, M.D., Esti, R.S., dan Rismawati, E., 2011, Pengaruh Perbedaan Metode Ekstraksi Terhadap Aktivitas Antioksidan Ekstrak Etanol Daun Jambu Biji (Psidium guajava L.) Berdaging Buah Putih, Prosiding SnaPP2011 Sains, Teknologi, dan Kesehatan, 2: 1.
Fessenden, R.J., 1997,Organic Laboratory Techniques, 2nd ed, University of Montana, Erlangga.
Gandjar, G.I dan Rohman, A, 2007, Kimia Fa rma si Analisis Edisi Kedua, Pustaka Pelajar, Yogyakarta.
Gordon, M.H., 1990, The Mechanism of Antioxidant Action In Vitro, Dalam: B.J.F Hudson (ed), Food Antioxidans, Elsevier Applied Science, London, 1-18. Gritter, R, J., J. M. Bobbits, and Arthur, E. S., 1991, Pengantar Kromatografi,
Penerbit ITB, Bandung.
Harborne, J.B., 1987, Metode Fitokimia Penuntun dan Cara Menganalisis Tumbuhan , Edisi kedua (terjemahan) Kosasih Padmawinata dan Iwang Soediro, Penerbit ITB, Bandung 11-14.
Harpenas, Asep & R. Dermawan, 2010, Budidaya Cabai Unggul, Penebar Swadaya, Jakarta.
H Tugiyono, 1999, Bertanam Tomat, Niaga Swadaya.
Joseph, G.S., Jayaprakasha, Selvi A.T., Jena B.S., Sakariah K.K, 2005, Antiaflatoxigenic and Antioxidant Activities of Antidesma Extract, International Journal of Food Microbiology, 8:153-160
Kumalaningsih, 2008, Antioksidan Alami Cetakan Pertama, Trubus Agrisarana, Surabaya, 4-5, 16.
Kusumadewi, 2002, Integrasi Sistem Radikal Bebas dan Ja ringan Syaraf, Graha Ilmu, Yogyakarta.
Latifah, N., Ari, A.H., Sandro, R.Y., & Endang, S., 2016, Ciplukan (Physalis angulata L.), http://ccrc.farmasi.ugm.ac.id/?page_id=193
, 17 Mei 2016
Langseth. 1995. Oxidants, antioxidants and disease prevention. ILSI. Washington D.C., 215.
Limbono, Sylvia, 2013, Daya Antioksidan Ekstrak Etanol Biji Kenari (Cana rium indicum L.) Dengan Meode DPPH (1,1-Dipheny-2-picrylhydrazyl), Jurnal Ilmiah, 2 (2).
Mahmoud, A.s.,S.Chlark, B. Woodard B. and S.A. Deolu, 2010, Antioxidant and Free Radical Scavenging Activities of Essential Oil, Ethmicity and Disease, 20: 78-82.
Molyneux, P, 2004,The Use of The Sable Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity SongklanarinJ. Sci. Technol, 26 (2), 211-219.
Mun’im, A., Azizahwati, Trastiana., 2008, Aktivitas Antioksidan Cendawan Suku Pleurotaceae dan Polyporaceae dari Hutan UI, Jurnal Ilmia h Farma si,5(1), 36-41
Ninik, Y.W., Agnes, B., Igustin, A.S., 2011, Aktivitas Mukolitik In-vitro Ekstrak Etanol Daun Sirih Merah (Piper crocotum Ruiz dan Pav.) Pada Mukosa Usus Sapi dan Identifikasi Kandungan Kimianya, Publikasi Ilmiah Universita s Wahid Hasyim Semarang, 5-70.
Nuranda, A., Chairul S., Bohari Y., 2016, Potensi Tumbuhan Ciplukan (Physalis angulata L.) Sebagai Antioksidan Alami, Jurnal Atomik, 1(1) : 5-9. Osho, T. Adetunji, S.O Fayemi, and DO Moronkola, 2010, Antimicrobial Activity
Of Essential Oils Of Physalis angulataL., Afr J Tradit Complement Altern Med., 7(4):303-306.
Ozcelik,O., Lee,JH., & Min, D.B., 2003, Effects of Light, Oxygen and pH on the Absorbance of 2,2-Diphenyl-1-Picrylhydra zyl, Journal of Food Science, 68, 487-490.
Pinto, N.B., 2010, Topical Anti-inflammatory potential of Physalin E from Physalis angulata on experimental dermatitis in mice, Phytomedicine,17: 740-743.
Prajnanta, F, 2007, Agribisnis Cabai Hibrida, Penebar Swadaya, Jakarta. Prakash, A., 2001, Antioxidant Activity, Heart of Giant Recource, 19 (2),1-4. Rohmani, Prastiwati, Rhayu, W.S., Hartanti, Dwi , 2010, Perbandingan Da ya
Antioksidan Ekstrak Metanol Daun Tembakau (Nicotiana tabacum L) dengan Rutin Terhadap Radikal Bebas 1,1-Diphenil-2-Pikrilhidrazil (DPPH), Jurnal Pharmacy Vol.07 No. 01.
Rohdianan D. 2009. Teh ini Menyehatkanku. Jakarta : Alfabeta. Rukmana, R, 2000, Usaha Tani Jahe, Kanisius, Yogyakarta.
Sakung, J., Aminah S., dan Oktaviana Y., 2012, Pengaruh Lama Penyimpanan dan Konsentrasi Natium Benzoat terhadap kadar Vitamin C Cabai Merah, J., Akad., Kim,1: 193-199.
Salgado, Elsa Rengifo., dan Gabriel Vargas Arana, 2013, Physalis angulata L. (Bolsa Mullaca) : A Review of its Tradisional Uses, Chemistry and Pharmacology.
Shivaprasad, H. N., S. Mohan., MD. Kharya, 2005, In-vitro Models for Antioxidant Activity Evaluation, International Journal ofPharmacy and Technology, 2, 25-26, 512-524.
Subiyandono, 2009, Uji Aktivitas Antioksidan Ekstrak Camellia sinensis, Hibiscus sabdariffa, dan Phaleria macrocarpa (Scheff.) Boerl.Secara Spektrofotometri dengan DPPH, Jurnal Poltekkes Depa rtemen Kesehatan, Palembang, 3(4).
Sugianto, Irwan., 2015, Studi Aktivitas Antioksidan Ekstrak Etanol Daun Ciplukan (Physalis angulata L.) Terhadap Asam Loneat,Skripsi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Yogyakarta, Yogyakarta.
Stahl, E., 1969, Apparatus and General techniques in TLC. Dalam : Stahl, E.(ed). Thin Layer Chromatography a laboratory handbook. Terj. dari Dunnschitch chromatography, oleh Ashworth, M.r.F. Berlin-Verlag, 61-77.
Stahl, E., 1985, Analisis Obat Secara Kromatografi dan Mikroskopis, Penerbit ITB : Bandung, 3-18.
Sulistyani, Nanik, dan Kusuma, L.W., 2012, Uji Aktivittas Antibakteri Estrak Etil Asetat Daun Binahong (Anredera scandens (L.)Moq.) Terhadap Shigella flexneri Beserta Profil Kromatografi Lapis Tipis, Jurnal Ilmiah Kefarmasian, 2:1.
Takashi, Miyake and Takayumi, Shibamoto, 1997, Antioxidant Activity of Natural Compound Found in Plant, Journal Agric. Food. Chemi, 45, 1819-1822
Touchstone, J.C., M.F. Dobbins., 1983, Practice of Thin Layer Chromatography, John Wiley & Sons, Canada, 2,12.
Voight, R., 1995, Buku Pelajaran Teknologi Farmasi, Edisi Kedua, UGM Pers, Yogyakarta.
Wahyuningsih, M.S.H., Wahyuono, S., D., Setiadi, J., Soekotjo, Widiastuti, S.S, Rakhmawati, R., & Wahyuni, D.S.C., 2008, Eksplorasi Tumbuhan dari Hutan Kalimantan Tengah Sebagai Sumber Senyawa Bioaktif, Biodiversitas,9: 169-172.
Widyowati, Retno, et al, 2010, Kandungan Kimia dan Aktivitas Antimikroba Ekstrak Garcinia celebica I. Terhadap Staphylococcus aureus, Shigella dysenteriae dan Candida albicans, Majalah Farmasi Airlangga, 8:2. Winarsi, H., 2007, Antioksidan Alami dan Radikal, Penerbit Kanisius,
Yogyakarta.
Lampiran IV. Hasil Ekstraksi Sampel
1. Ekstrak Kloroform Daun Tomat (Solanum lycopersicum L. ) Perhitungan Rendemen
Rendemen Ekstrak = × 100%
= × 100%
= 4,511%
Organoleptik Ekstrak Daun Tomat (Solanum lycopersicum L. ) Bentuk Kental
Warna Hijau Kehitaman Aroma Beraroma Khas
2. Ekstrak Kloroform Daun Cabai Merah (Capsicum annum L.) Perhitungan Rendemen
Rendemen Ekstrak = × 100%
= × 100%
= 1,932%
Organoleptik Ekstrak Daun Cabai Merah (Capsicum annum L.) Bentuk Kental
Warna Hijau Kehitaman Aroma Beraroma Khas
3. Ekstrak Kloroform Daun Ciplukan (Physalis angulata L.) Perhitungan Rendemen
Rendemen Ekstrak = × 100%
= × 100%
Organoleptik Ekstrak Daun Ciplukan(Physalis angulata L.) Bentuk Kental
Warna Hijau Kehitaman Aroma Beraroma Khas
Lampiran V. Penentuan Panjang Gelombang (Skrining lamda maksimal)
Lampiran VI. Diagram Alir Cara Kerja Pembuatan Ekstrak Serbuk dari masing-masing daun (daun tomat,
daun cabai