1
Ketoprofen merupakan obat anti-inflamasi kelompok non-steroid yang poten. Ketoprofen secara luas digunakan untuk pengobatan akut dan jangka panjang
rheumatoid arthritis dan osteoarthritis (Shohin dkk., 2012). Ketoprofen merupakan salah satu obat yang digolongkan kategori kelas II dalam
Biopharmaceutical Classification System (BCS), yaitu golongan obat yang memiliki permeabilitas yang baik, akan tetapi kelarutannya sangat rendah dalam air (Keshavarao dkk., 2011). Salah satu cara yang dapat digunakan untuk meningkatkan kelarutan ketoprofen adalah dengan memformulasikannya dalam bentuk SNEDDS.
Menurut Patel dkk. (2011), SNEDDS adalah metode penghantaran obat melalui pembuatan campuran isotropik minyak, surfaktan, kosurfaktan, dan obat yang secara cepat membentuk nanoemulsi saat bercampur dengan air. SNEDDS mempunyai keuntungan berupa kemampuan membawa bahan obat yang kelarutannya rendah dalam air, yang teremulsi dengan air dalam tetesan berukuran nanometer. Proses pembentukan nanoemulsi melalui metode SNEDDS terjadi secara spontan di dalam saluran cerna.
SNEDDS disusun oleh beberapa komponen utama diantaranya, minyak sintetis/non-sintesis sebagai pembawa obat, surfaktan, dan kosurfaktan yang digunakan untuk melarutkan bahan-bahan yang sukar larut di dalam fase air.
Virgin Coconut Oil (VCO) digunakan sebagai fase minyak penyusun SNEDDS pada penelitian ini. VCO merupakan sumber triasil gliserol rantai sedang
(Medium Chain Triglycerides, MCTs) yang dapat membentuk nanoemulsi yang stabil (Norulaini dkk., 2009).
Tween 80 digunakan sebagai surfaktan. Tween 80 merupakan surfaktan non ionik yang paling sering digunakan sebagai surfaktan karena memiliki nilai toksisitas yang rendah dibandingkan dengan surfaktan lainnya (Rowe dkk., 2009). Tween 80 memiliki gugus hidroksil dan oksigen bebas yang memungkinkan pembentukan ikatan hidrogen dengan ketoprofen lebih banyak. Semakin banyak ikatan hidrogen yang terbentuk maka proses disolusi akan semakin cepat (Murtiningrum dkk., 2013). Selain meningkatkan disolusi, Tween 80 juga dilaporkan dapat meningkatkan permeabilitas dinding usus tikus untuk sulfadiazina (Susanti, 2003). PEG 400 sebagai kosurfaktan, merupakan pelarut semipolar yang dapat meningkatkan kelarutan dengan cara menurunkan lipofilisitas obat (Sudjaswadi, 1995). Menurunnya lipofilisitas obat menyebabkan obat akan semakin sulit untuk berdifusi melewati membran usus (Shargel dkk., 2005).
Membran usus merupakan barrier utama bagi obat dengan rute penggunaan oral. Air, molekul dengan ukuran kecil, dan molekul lipofil dapat dengan mudah melewati membran usus (Shargel dkk., 2005). Tween 80 dan PEG 400 yang menyusun SNEDDS, berinteraksi secara sinergis untuk melarutkan obat dalam minyak dan mendispersikan minyak menjadi tetesan (droplet) yang berukuran nanometer, sehingga dengan ukuran droplet yang kecil akan meningkatkan uptake
Pada penelitian ini dilakukan optimasi dan uji disolusi terhadap formula SNEDDS ketoprofen. Optimasi dilakukan berdasarkan profil difusi melalui membran usus untuk melihat pengaruh komposisi campuran Tween 80 dan PEG 400 dalam SNEDDS ketoprofen terhadap permeabilitas, sehingga diperoleh formula optimum yang dapat meningkatkan disolusi tanpa menurunkan permeabilitas ketoprofen. Uji disolusi dilakukan untuk melihat efektivitas formulasi SNEDDS dalam meningkatkan disolusi ketoprofen dalam cairan lambung.
B. RumusanMasalah
Permasalahan yang dapat dirumuskan dalam penelitian ini adalah:
1. Bagaimanakah pengaruh komposisi Tween 80 dan PEG 400 dalam SNEDDS ketoprofen terhadap jumlah ketoprofen terdifusi dan kecepatan difusi melalui membran usus secara in vitro?
2. Apakah formula SNEDDS optimum dapat meningkatkan disolusi ketoprofen dalam cairan lambung buatan secara in vitro?
C. Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui pengaruh komposisi Tween 80 dan PEG 400 dalam SNEDDS ketoprofen terhadap jumlah ketoprofen terdifusi dan kecepatan difusi melalui membran usus secara in vitro.
2. Melihat profil disolusi ketoprofen dalam cairan lambung buatan secara in vitro yang dihasilkan oleh formula SNEDDS optimum.
D. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai penggunaan komposisi Tween 80 dan PEG 400 yang optimal dalam SNEDDS ketoprofen yang efektif meningkatkan disolusi dan permeabilitas ketoprofen sehingga dapat menjadi alternatif baru untuk penggunaan ketoprofen secara oral.
E. Tinjauan Pustaka 1. Ketoprofen
COOH CH3 O
Gambar 1. Struktur kimia ketoprofen
Ketoprofen merupakan turunan ibuprofen, tergolong dalam nonsteroidal anti-inflammatory drug (NSAID) yang menghambat cyclooxygenase secara non selektif. Ketoprofen digunakan pada terapi osteoarthritis, rheumatoid arthritis, disminore, nyeri pasca operasi, dan menurunkan demam (Shohin dkk., 2012). Penggunaan oral ketoprofen menghasilkan kadar plasma tertinggi setelah 1-2 jam penggunaan. Ketoprofen tergolong obat yang memiliki permeabilitas tinggi dengan nilai bioavailabilitas absolut 90% (Shohin dkk., 2011), akan tetapi ketoprofen memiliki kelarutan yang rendah dalam air. Kelarutan ketoprofen dalam air murni pada suhu 22°-24° C sebesar 0,010 mg/mL dan kelarutan intrinsiknya dalam air pada suhu 37° C sebesar 0,253 mg/mL (Shohin dkk., 2012).
Ketoprofen merupakan senyawa asam lemah dengan nilai pKa sekitar 4,45 pada 25° C dan terionisasi dalam rentang pH gastrointestinal, dengan demikian
kelarutan ketoprofen akan meningkat seiring dengan meningkatnya pH media (Shohin dkk., 2011). Berikut data kelarutan ketoprofen yang dipengaruhi oleh pH disajikan dalam tabel I.
Tabel I. Data kelarutan ketoprofen (Shohin dkk., 2012)
pH Media Kelarutan ketoprofen pada suhu 37° C (mg/mL)
1,2 0,13
4,6 0,49
6,8 40,76 ± 0,01
Analisis ketoprofen dalam penentuan kadar dapat dilakukan menggunakan metode spektrofotometri. Nilai dalam larutan alkali dengan panjang gelombang 262 nm adalah 647 (Gandjar dan Rohman, 2007). Nilai dapat digunakan untuk menghitung nilai ekstingsi molar. Suatu senyawa dapat dianalisis menggunakan metode spektrofotometri jika nilai ekstingsi molarnya lebih besar dari atau sama dengan 1000 M-1.cm-1 (Moffat dkk., 2011).
2. Membran usus
Meskipun telah banyak dikembangkan teknologi sistem penghantaran obat, rute pemberian oral tetap menjadi rute yang paling disukai, karena alasan kenyamanan pasien dan kepatuhan terapi (Deferme dkk., 2008). Proses absorpsi (in vivo) merupakan hasil dari serangkaian peristiwa yang kompleks dan tergantung pada banyak parameter yang berkaitan dengan karakteristik obat serta aspek fisiologis saluran gastrointestinal (Buckley dkk., 2012).
Usus halus merupakan tempat absorpsi yang paling penting dalam sistem pencernaan. Dinding usus halus adalah bentuk penghalang utama yang mengontrol masuknya nutrisi dan xenobiotic (misalnya obat) ke dalam darah
(Deferme dkk., 2008). Faktor-faktor yang mempengaruhi laju dan tingkat absorpsi usus diperlihatkan pada tabel II.
Tabel II. Faktor utama yang mempengaruhi absorpsi (Deferme dkk., 2008). Faktor Fisika
Kimia Obat
Faktor Fisologis
Faktor
Formulasi Faktor Biokimia
Kelarutan pH usus Bentuk sediaan Metabolisme
Ukuran molekul Motilitas usus Pelepasan obat Efflux transporter
pKa Aliran darah Enhancers Uptake transporter
Agregasi/ Kompleksasi Permeabilitas membran Potensial hidrogen Kandungan luminal Luas permukaan Penyakit Hidrofobisitas
Permukaan usus halus merupakan satu lapisan yang terdiri dari sel epitel kolumnar dan juga mengandung sel-sel yang memproduksi mukus, limfosit dan sel microfold. Karena keberadaan tight junctions, ruang interseluler berkurang menjadi 0,8 nm (pada jejunum) dan 0,3 nm (pada kolon). Adapun jalur-jalur yang mungkin dilalui obat untuk dapat melewati membran usus dapat dilihat pada gambar 2.
Gambar 2. Jalur transpor melewati membran usus (Buckley dkk., 2012).
(A)Difusi pasif paraseluler, (B)difusi pasif transeluler, (C-F)transpor terfasilitasi protein membran (influx/efflux), (G)transitosis, dan (H)endositosis.
Molekul kecil, hidrofilik, dan polar bisa melewati epitel monolayer usus melalui ruang paraseluler. Jalur paraseluler umumnya menghasilkan penyerapan yang rendah karena ruang yang diberikan terbatas, sedangkan untuk obat yang lebih lipofilik akan didistribusikan ke dalam membran usus (epitel monolayer) melalui jalur transeluler secara pasif (Deferme dkk., 2008).
3. SNEDDS
SNEDDS merupakan metode penghantaran obat yang mengkombinasikan minyak, surfaktan, dan kosurfaktan menjadi campuran isotropik yang secara cepat dan mudah membentuk nanoemulsi pada pencampuran dengan air (Patel dkk., 2011). SNEDDS akan membentuk nanoemulsi saat kontak dengan cairan dalam saluran cerna, dan agitasi untuk proses self-emulsifying dalam saluran GI dibantu oleh gerakan pada lambung dan usus (Makadia dkk., 2013).Daya tarik utama dari formulasi nanoemulsi minyak dalam air adalah kemampuan membawa obat yang hidrofobik dalam minyak, sehingga dapat teremulsi di dalam air dan pada akhirnya meningkatkan kelarutan obat tersebut ketika berada di badan (Shafiq-un-Nabi dkk., 2007). Adapun komponen utama penyusun SNEDDS adalah sebagai berikut.
a. Minyak. Fase minyak memiliki peran penting dalam formulasi SNEDDS, yang menentukan spontanitas emulsifikasi, ukuran tetesan nanoemulsi, dan kelarutan obat. Biasanya minyak yang digunakan untuk SNEDDS merupakan minyak yang mampu melarutkan obat secara maksimal (Anton dkk., 2008). Selain mampu melarutkan obat, minyak harus mampu menghasilkan ukuran tetesan yang kecil agar dapat terbentuk nanoemulsi.
Minyak dengan banyak komponen rantai hidrokarbon atau trigliserida rantai panjang susah teremulsi dibandingkan trigliserida rantai menengah, monogliserida rantai menengah atau ester asam lemak. Trigliserida, digiserida ataupun monogliserida rantai medium juga memiliki kemampuan solubilisasi obat hidrofobik yang lebih baik (Anton dan Vandamme, 2009). Contoh minyak yang umum digunakan adalah VCO.
VCO mengandung asam lemak, trigliserida, dan senyawa fenolik. VCO merupakan sumber triasilgliserol rantai sedang (MCTs), mencapai 60% dari total kandungan minyak (Norulaini dkk., 2009). MCTs dalam VCO disusun oleh gliserol dengan tiga asam lemak jenuh yang mempunyai panjang rantai karbon 6-12 dikelompokkan sebagai asam lemak rantai sedang (MCFA). Asam lemak utama dalam VCO adalah asam laurat sebanyak 43-53%. Asam laurat (C12H24O2)
merupakan suatu asam lemak jenuh dengan dua belas rantai karbon yang memiliki efek antimikroba. Kandungan fenolik dalam VCO berupa asam protokatekuat, asam vanilat, asam kafeat, asam siringat, asam ferulat, dan asam p-kumarat. Asam-asam tersebut merupakan komponen yang bermanfaat sebagai antioksidan (Marina dkk., 2009).
OH O
Gambar 3. Struktur kimia asam laurat
b. Surfaktan. Konsentrasi surfaktan berperan dalam pembentukan tetesan berukuran nanoemeter (Dixit dan Nagarsenker, 2008). Peningkatan konsentrasi surfaktan menghasilkan tetesan partikel yang lebih kecil, tetapi emulsification time menjadi lebih lama. Ukuran partikel menjadi lebih kecil disebabkan jumlah
surfaktan yang tersedia telah optimal untuk membentuk lapisan di antarmuka minyak dan air (Zhao dkk., 2010). Surfaktan nonionik lebih sering digunakan dari pada surfaktan ionik, mengingat sifatnya yang kurang terpengaruh oleh pH, aman, dan biokompatibel untuk penggunaan melalui rute oral (Patel dkk., 2011). Secara umum, surfaktan untuk SNEDDS harus sangat hidrofilik dengan HLB berkisar antara 15-21. Struktur rantai alkil surfaktan memiliki efek dalam penetrasi minyak ke lapisan surfaktan yang memungkinkan pembentukan nanoemulsi seperti yang dimiliki oleh Tween 80 (Rao danShao, 2008).
HO O O O R O O O HO O HO z y x w w + x + y + z = 20; R = C17H33
Gambar 4. Struktur kimia Tween 80
Tween 80 atau polyoxyethylene 20 sorbitan monooleate (C64H124O26)
memiliki HLB 15 dan dikategorikan sebagai generally regarded as nontoxic and nonirritant (Rowe dkk., 2009). Selain dapat meningkatkan kelarutan, Tween 80 juga dapat meningkatkan permeabilitas obat pada tikus in vivo, sel Caco-2 in vitro, dan membran usus tikus ex vivo (Prabhakar dkk., 2013). Tween 80 dapat meningkatkan permeabilitas dengan cara melonggarkan tight junction dan menghambat P-glikoprotein pada membran sel epitel usus (Kumar dan Rajeshwarrao, 2011).
c. Kosurfaktan. Kosurfaktan ditambahkan dengan tujuan meningkatkan drug loading, mempercepat emulsification time, dan mengatur ukuran tetesan nanoemulsi. Kosurfaktan yang dipilih umumnya berupa alkohol rantai pendek, karena mampu mengurangi tegangan antarmuka dan meningkatkan fluiditas antarmuka. Alkohol juga mampu meningkatkan pencampuran air dan minyak, karena kemampuan partisinya di antara dua fase tersebut (Azeem dkk.,2009). Salah satu contoh kosurfaktan yang sering digunakan dalam formulasi SNEDDS adalah PEG 400.
HO
O
OH 8,7
Gambar 5. Struktur kimia PEG 400
PEG 400 tergolong dalam daftar generally regarded as nontoxic and nonirritant (Rowe dkk., 2009). PEG 400 merupakan pelarut semipolar, dapat meningkatkan kelarutan (kosolven) dengan cara menurunkan lipofilisitas obat, akan tetapi PEG juga dapat membentuk kompleks dengan obat, sehingga dapat mengurangi jumlah obat yang siap terabsorpsi (Sudjaswadi, 1995). Bobot molekul PEG 400 yakni 380-420.
4. Uji difusi side by side (Ussing chamber)
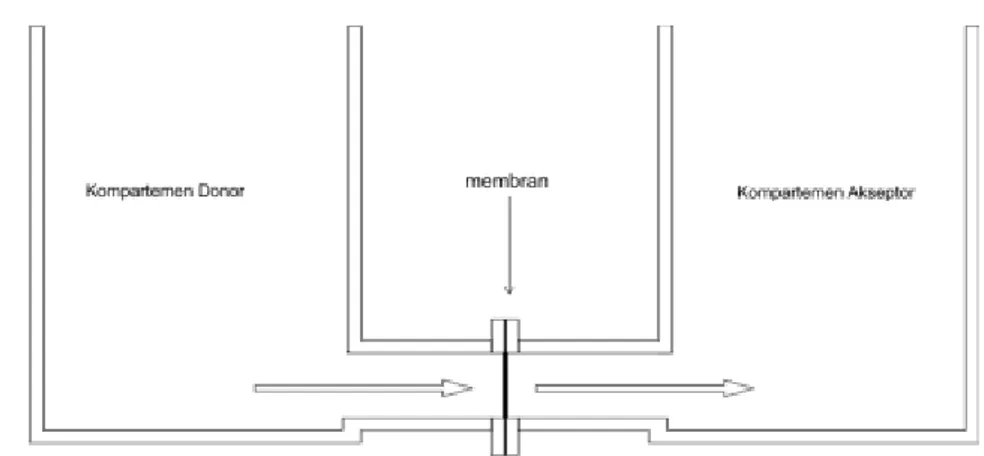
Uji difusi dilakukan untuk mengetahui profil difusi dari formula SNEDDS ketoprofen. Usus tikus yang terisolasi digunakan sebagai sel difusi pada Ussing chamber tipe horizontal yang terbagi dalam dua kompartemen yaitu kompartemen mukosal (donor) dan kompartemen serosal (aseptor). Penggunaan tikus dengan ras dan jenis kelamin yang sama, serta usia yang kurang lebih sama pada uji difusi bertujuan untuk mengendalikan variasi absorpsi melalui membran usus.
Uji difusi ini dapat digunakan untuk memperoleh parameter kinetik transpor obat melalui membran usus, serta mempelajari pengaruh bahan terhadap profil transpor obat (Deferme dkk., 2008). Keunggulan dan keterbatasan uji difusi dengan menggunakan metode side by side (Ussing chamber) disampaikan pada tabel III.
Tabel III. Keunggulan dan keterbatasan metode side by side diffusion (Deferme dkk., 2008)
Keunggulan Keterbatasan
Model skrining yang baik Viabilitas jaringan
Korelasi yang baik dengan data permeabilitas in vivo
Ketersediaan jaringan (manusia) Memungkinkan untuk mengevaluasi
semua saluran GI
Terdapat lapisan otot melingkar Mengevaluasi mekanisme transpor Kesulitan pada proses pengadukan Mengevaluasi enhancer
Menggambarkan daerah serap dengan baik
Proses oksigenasi yang baik
Pengujian terhadap daya absorpsi obat dengan isolasi usus tikus dilakukan sebagai studi pendahuluan obat yang tertranspor di usus dan untuk mengestimasi level first pass metabolism melewati kompartemen pada sel epitel usus. Mekanisme transpor obat menggunakan Ussing chamber tipe horizontal terlihat pada gambar 6.
5. Kuantifikasi hasil difusi
Difusi pasif digunakan untuk melukiskan lewatnya molekul-molekul obat melalui suatu membran yang bersifat inert dan tidak berpartisipasi aktif dalam proses tersebut. Difusi pasif dikendalikan oleh perbedaan konsentrasi yang ada di seberang membran dengan perjalanan obat terjadi dari tempat yang berkonsentrasi tinggi ke tempat yang berkonsentrasi rendah.
Proses difusi ini dapat digambarkan dengan persamaan yang diturunkan dari hukum Fick I.
J =
(1)
J atau fluks menggambarkan jumlah obat tiap satu satuan luas, tiap satu satuan waktu (Sinco, 2006). Besarnya fluks berbanding lurus dengan gradien kadar dC/dx dan koefisien difusi obat dalam membran, D.
J = -
(2)
Tanda negatif tersebut menggambarkan bahwa proses difusi berlangsung dari kompartemen dengan kadar obat tinggi ke rendah. Dua persamaan di atas dapat digabung menjadi sebuah persamaan baru, yaitu:
=
(3)
Jika dC = C2 – C1 dan dx = h (Sinco, 2006), maka: J =
=
-
(4) Besarnya C1 dan C2 tidak dapat dihitung secara langsung, karena merupakan kadar obat yang ada di dalam membran. Namun demikian, besarnya C1 dan C2
dapat diperhitungkan dari besarnya Cd (kadar obat dalam donor) dan Ca (kadar obat dalam aseptor).
C1 = Cd x K (5)
C2 = Ca x K (6)
Jika persamaan tersebut disubstitusikan ke persamaan (4), dengan K adalah koefisien partisi, maka diperoleh persamaan:
J =
=
-
(7) Proses difusi dalam tubuh ke saluran sistemik selalu dalam kondisi sink,
dimana kadar obat dalam aseptor (pembuluh darah) selalu jauh lebih kecil dibanding kadar obat dalam donor (Ca < 0,1 Cd), sehingga Ca dapat diabaikan (Ca = 0). Jika permeabilitas, P = DK/h, maka:
(8)
Jika diinginkan sebuah persamaan linier, maka dapat dilakukan integrasi dari M0 ke Mt untuk dM dan dari tlag ke t untuk dt dengan M0 = 0.
( ) - (9)
Diperoleh sebuah persamaan linear antara waktu perlakuan (t) dan jumlah obat yang tertranspor (Mt) dengan slope (P.Cd.S) dan intersep (tlag.P.Cd.S). Persamaan
ini mengasumsikan bahwa kadar di dalam kompartemen donor (Cd) konstan dan tanpa memperhitungkan volume kompartemen donor (Vd).
Jika asumsi Cd konstan ditolak, dapat menggunakan persamaan jumlah obat sama dengan kadar dikalikan volume, maka:
(10)
Jika diinginkan sebuah persamaan linier, maka dapat dilakukan integrasi dari t0 sampai t baik untuk dCd maupun dt dengan t0 = 0.
( ) -
(11)
Didapatkan persamaan linier antara waktu perlakuan (t) dan logaritma natural kadar obat di dalam kompartemen donor (ln Cd(t)) dengan slope (P.S/Vd) dan
intersep ln Cd(0). 6. Kinetika disolusi
Disolusi in vitro merupakan salah satu unsur penting dalam studi pengembangan obat. Beberapa model teori/kinetika digunakan untuk menggambarkan disolusi obat dari bentuk sediaan pelepasan segera dan dimodifikasi. Ada beberapa model untuk mewakili profil disolusi obat, di mana ft
adalah fungsi dari waktu (t) terkait dengan jumlah obat yang terlarut dari sistem sediaan farmasi. Interpretasi nilai kuantitatif yang diperoleh dalam uji disolusi difasilitasi oleh penggunaan dasar persamaan matematis yang menerjemahkan kurva disolusi fungsi dari beberapa parameter terkait dengan bentuk sediaan farmasi (Costa dan Lobo, 2001).
Kinetika orde nol menjelaskan disolusi obat dari sediaan terjadi secara perlahan. Model ini memperlihatkan grafik fraksi disolusi obat terbentuk linier terhadap waktu jika kondisi yang ditetapkan telah terpenuhi. Kinetika orde nol digunakan untuk menggambarkan disolusi obat pada beberapa jenis sediaan seperti sistem transdermal, tablet matriks dengan obat kelarutan rendah, bentuk salut, sistem osmosis, dan lain-lain. Sediaan tersebut melepaskan obat dengan jumlah yang sama tiap unit waktu dan metode ini ideal untuk menggambarkan
efek terapi prolonged (Costa dan Lobo, 2001). Kinetika orde nol dapat digambarkan dengan persamaan berikut.
(12)
Qt merupakan jumlah obat terdisolusi pada waktu t, Q0 adalah jumlah obat awal,
dan K0 adalah konstanta disolusi orde nol.
Selain untuk menggambarkan proses disolusi, kinetika orde satu digunakan untuk menggambarkan proses absorpsi dan eliminasi beberapa obat, meskipun sulit untuk membuat konsep mekanisme ini secara teoritis. Model ini menampilkan grafik logaritma desimal dari jumlah obat terdisolusi terhadap waktu yang linier. Kinetika orde satu menggambarkan disolusi obat sebanding dengan jumlah obat yang tersisa pada sediaan atau dengan kalimat lain, jumlah obat yang terdisolusi per satuan waktu semakin berkurang (Costa dan Lobo, 2001). Kinetika orde satu dapat digambarkan dengan persamaan berikut.
(13)
Qt merupakan jumlah obat terdisolusi pada waktu t, Q0 adalah jumlah obat awal,
dan K1 adalah konstanta disolusi orde satu.
7. WinSAAM
Metode pendekatan berbasis kompartemen memandang transpor obat melalui membran usus sebagai serangkaian proses perpindahan obat dari fase donor (kondisi in vitro) menuju membran usus, selanjutnya obat dari membran berpindah menuju fase aseptor (kondisi in vitro) atau ke dalam darah (kondisi in vivo). Untuk memudahkan penggambaran proses transpor obat dalam sistem kompartemen, dapat digunakan piranti lunak WinSAAM.
WinSAAM merupakan permodelan sistem biologi yang berbasis Windows
dengan menggunakan model matematis. Keunggulan WinSAAM antara lain: mudah dioperasikan, untuk sistem linier dan nonlinier dikerjakan dengan perintah umum, otomatis fitting data tanpa perlu menerjemahkan model konstruksi, secara otomatis menentukan parameter linier atau nonlinier sesuai model konstruksi, fleksibel untuk berbagai model, fasilitas spreadsheet memungkinkan output hasil pengolahan data dapat diekspor secara langsung ke excel atau sistem spreadsheet
lainnya (Linares dan Boston, 2010).
Analisis data dengan WinSAAM dimulai dengan listing, meliputi estimasi nilai awal, batas minimum, dan maksimum, serta penulisan parameter-parameter model yang disusun secara sistematis sesuai dengan konvensi yang ada. Proses
decking merupakan proses penerjemahan listing program ke dalam bahasa WinSAAM, yang dilakukan dengan mengetikkan kode deck pada jendela utama (terminal window). Pemecahan model dan persamaan diferensial terkait, dilakukan dengan mengetikkan solve pada jendela utama. Proses pencarian parameter model terbaik dilakukan dengan proses pencarian berulang (iteration), yang dapat diinisiasi dengan mengetikkan iter pada jendela utama.
8. SLD
Pada berbagai penelitian, perubahan satu atau lebih variabel proses dalam pengamatan efek dapat merubah variabel respon. Desain penelitian bertujuan untuk meningkatkan efisiensi prosedur dalam rencana penelitian yang berisi data yang dapat dianalisis, sehingga diperoleh hasil yang valid dan kesimpulan yang objektif. Desain penelitian yang dipilih dengan baik akan dapat memberikan
informasi yang cukup, sehingga dapat menjelaskan hasil penelitian dengan baik dalam mempelajari efek pada faktor yang berbeda, kondisi, dan respon interaksi pengamatan dalam penelitian (Patel dkk., 2010).
Beberapa keuntungan ketika mengggunakan desain penelitian antara lain: penafsiran faktor dan interaksi lebih efektif, dapat memprediksi efek yang diinginkan ketika tidak terjadi interaksi sehingga memberikan efisiensi yang maksimal, namun jika ada interaksi maka perlu mengungkapkan dan mengidentifikasi interaksi tersebut (Patel dkk., 2010).
Suatu formula merupakan campuran yang terdiri dari beberapa komponen atau bahan. Permasalahan umum dalam studi formulasi terjadi bila komponen-komponen formula diubah-ubah dalam upaya untuk mengoptimalkan hasil. Setiap perubahan fraksi dari salah satu komponen dalam campuran akan merubah sedikitnya satu variabel atau bahkan lebih fraksi komponen lain.
Metode SLD dapat digunakan untuk menentukan proporsi relatif bahan-bahan yang digunakan dalam suatu formula, sehingga diharapkan akan dapat dihasilkan suatu formula yang paling baik (dari campuran tersebut) sesuai kriteria yang ditentukan.
Jika Xi adalah fraksi komponen I dalam campuran fraksi, maka:
≤ Xi ≤ , I , ,……,q (14)
Campuran akan mengandung sedikitnya i komponen dan jumlah fraksi dari semua komponen adalah tetap (= 1), ini berarti:
Pengukuran respon dapat dihubungkan dengan model matematika yang cocok untuk masing-masing desain. Ada beberapa model yaitu model linier, kuadratik dan spesial kubik (Bolton, 1997).
a. Linier y β1X1+ β2X2+ β3X3 (16) b. Kuadratik y β1X1+ β2X2+ β3X3+ β12X1X2+ β13X1X3+ β23X2X3 (17) c. Spesial kubik y β1X1+β2X2+β3X3+β12X1X2+β13X1X3+β23X2X3+β123 X1X2X3 (18) Y = respon
X1, X2, X3 = fraksi dari tiap komponen
b1, b2, b3 = koefisien interaksi dari X1, X2, X3
b12, b13, b23 = koefisien interaksi dari X1-X2, X1-X3, X2-X3
b123 = koefisien interaksi dari X1-X2-X3
Desain dan interpretasi multi faktor eksperimen kombinasi proporsi dengan metode SLD dapat menggunakan bantuan piranti lunak Design Expert versi 7.1.5.
Piranti lunak ini menawarkan berbagai macam desain diantaranya faktorial, faktorial fraksional, dan desain gabungan. Piranti lunak ini memiliki beberapa kelebihan yaitu: dapat digunakan untuk kedua variabel proses dan variabel campuran, menghasilkan desain optimal untuk desain standar yang tidak
applicable, dan dapat meningkatkan desain yang sudah ada (Buxton, 2007).
F. Landasan Teori
Ketoprofen merupakan obat anti-inflamasi golongan non-steroidal yang biasa digunakan untuk pengobatan rheumatoid arthritis dan osteoarthritis. Kelarutan ketoprofen yang rendah dalam air menyebabkan waktu untuk mencapai konsentrasi ketoprofen maksimal dalam plasma (t maks) semakin lama, sehingga
untuk mengatasinya ketoprofen diformulasikan menjadi bentuk SNEDDS. Sistem SNEDDS ini nantinya akan membentuk nanoemulsi secara spontan ketika bercampur dengan cairan lambung. Sistem ini memungkinkan dispersi ketoprofen yang hidrofob ke dalam air. Ketoprofen akan terlarut dalam fase minyak yang dilingkupi oleh surfaktan dan kosurfaktan, sehingga dapat berada pada fase air dalam tetesan berukuran nanometer dan membantu meningkatkan disolusi ketoprofen dalam lambung, maka onset atau waktu tinggal obat di lambung menurun dan mempercepat obat sampai di usus untuk diabsorpsi. Nanoemulsi yang berukuran nanometer memungkinkan ketoprofen lebih mudah terdifusi melalui mekanisme paraseluler (celah antar sel).
SNEDDS dibuat dari minyak, surfaktan, dan kosurfaktan dengan komposisi yang sesuai, sehingga tercipta campuran isotropik yang stabil. Minyak merupakan komponen yang bertugas membawa obat. Minyak yang sering digunakan adalah VCO sebab aman untuk penggunaan secara oral. VCO tergolong MCTs yang efektif untuk solubilisasi obat hidrofobik. Surfaktan sebagai pembentuk lapisan antarmuka antara air dan minyak, sehingga minyak yang membawa obat mampu terdispersi di dalam air. Surfaktan nonionik yang relatif tidak toksik misalnya Tween 80. Kosurfaktan berupa PEG 400 ditambahkan untuk meningkatkan kerja surfaktan. Tween 80 dan PEG 400 bekerja secara sinergis untuk mendispersikan minyak menjadi tetesan nanoemulsi.
Peningkatan konsentrasi surfaktan menghasilkan tetesan partikel yang lebih kecil tetapi emulsification time menjadi lebih lama. Penambahan Tween 80 juga dapat meningkatkan permeabilitas membran dengan melonggarkan tight junction.
PEG 400dapat meningkatkan kelarutan, akan tetapi PEG juga dapat membentuk kompleks dengan obat sehingga dapat mengurangi jumlah obat yang siap terabsorpsi. Penggunaan kombinasi Tween 80 dan PEG 400 dalam SNEDDS ketoprofen yang optimal diharapkan dapat meningkatkan difusi dan disolusi ketoprofen secara oral.
G. Hipotesis
1. Kombinasi Tween 80 dan PEG 400 dalam SNEDDS ketoprofen dapat meningkatkan jumlah ketoprofen terdifusi dan kecepatan difusi melalui membran usus secara in vitro.
2. Formula SNEDDS optimum dapat meningkatkan disolusi ketoprofen dalam cairan lambung buatan secara in vitro.