Tinjauan Pustaka
p-ISSN : 2686-1437
e-ISSN : 2686-0201
http://ejournal.ukrida.ac.id/ojs/index.php/Meditek/index
Uji Fenotipik Deteksi Enzim Extended-Spectrum Beta-Laktamase,
Karbapenemase dan AmpC pada Bakteri Enterobacteriaceae
Ade Dharmawan
1, Nicolas Layanto
11Departemen Mikrobiologi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Kristen Krida
Wacana, Jakarta, Indonesia
Alamat korespondensi: [email protected]
Abstrak
Organisme yang mengekspresikan extended-spectrum β-lactamases (ESBLs) seperti
Enterobacteriaceae dilaporkan semakin meningkat selama empat puluh tahun terakhir. Organisme yang meng-ekspresikan enzim ini dapat menghidrolisis oksminosefalosporin dan monobactam, namun dapat dihambat menggunakan β-laktam inhibitor. Terdapat berbagai macam enzim yang berkontribusi dari resistensi sefalosporin dan monobaktam seperti AmpC β-lactamase, dan enzim karbapenemase.
Polymerase Chain Reaction (PCR) merupakan metode yang akurat dalam mendeteksi ESBL, tetapi metode ini merupakan metode genotipik yang membutuhkan alat khusus, sehingga masih dibutuhkan metode fenotipik untuk mendeteksi enzim ESBL, AmpC dan Karbapenemase yang dapat dilakukan pada berbagai laboratorium.
Kata Kunci: AmpC, Enterobacteriaceae, ESBL, karbapenemase
Phenotypic Test to Detect Extended-Spectrum Beta Lactamase,
Carbapenemase and AmpC Enzymes in Enterobacteriaceae
AbstractOrganisms that express extended-spectrum β-lactamase (ESBLs) such as Enterobacteriaceae have been increasing for the past forty years. Organisms that express this enzyme can hydrolyze oxyminocephalosporins and monobactam,but can be inhibited using β-lactam inhibitors. There are various types of enzymes that contribute to cephalosporin and monobactam resistances, such as AmpC β-lactamase, and carbapenemase enzymes. Polymerase Chain Reaction (PCR) is an accurate method for detecting ESBL, but this method is a genotypic method that requires a specialized instrument. Therefore there is a need for a phenotypic method to detect ESBL, AmpC and Carbapenemase that can be conducted in various laboratories.
Keywords : AmpC, Carbapenemase, Enterobacteriaceae, ESBL
Pendahuluan
Untuk mencegah peningkatan jumlah patogen resisten antibiotik diperlukan peran laboratorium mikrobiologi yang optimal. Resistensi antibiotik dapat menimbulkan masalah, tidak hanya di rumah sakit, namun juga dalam masyarakat sebagai penyebab meningkatnya jumlah infeksi. Berbagai
mekanisme resistensi antibiotik pada bakteri Gram negatif disebabkan oleh beberapa enzim seperti extended spectrum beta-lactamase (ESBL), AmpC β-lactamase, dan
karbapenemase. Peningkatan resistensi
antibiotik bakteri gram negatif perlu mendapat perhatian khusus mengenai bagaimana bakteri
mendapatkan, mempertahankan dan
dapat menimbulkan resistensi terhadap satu atau beberapa antibiotik.1
Organisme yang memproduksi enzim tersebut sangat sulit untuk dideteksi, karena enzim ini tidak selalu diekspresikan secara fenotipik pada uji resistensi antibiotik baik dengan metode difusi cakram konvensional
(conventional disc diffusion) atau tes kepekaan otomatis (automated susceptibility testing methods).1
Extended Spectrum Beta Lactamase (ESBL) Bakteri penghasil ESBL menjadi salah satu masalah yang menyebabkan infeksi nosokomial terutama di negara berkembang, dan kasus terbanyak ditemukan pada ruang perawatan intensif. Pasien yang berisiko
terinfeksi ESBL adalah pasien yang
membutuhkan perawatan dalam waktu yang lama di rumah sakit, pasien dengan kateter intravena dan kateter urin, pasien dengan
pemasangan intubasi dan penggunaan
ventilator serta telah mendapatkan berbagai jenis antibiotik sebelumnya (terutama golongan sefalosporin).2
Resistensi juga berkaitan dengan meningkatnya jumlah bakteri penghasil ESBL akibat penggunaan sefalosporin generasi ketiga secara berlebihan. Di Indonesia, prevalensi bakteri penghasil ESBL sekitar 33.3% untuk K. pneumoniae dan 23% untuk E. coli.2
ESBL merupakan suatu enzim beta laktamase yang dapat menginduksi resistensi terhadap penicillin, sefalosporin generasi 1, 2, 3 dan aztreonam (kecuali cephamin dan karbapenem).3,4 Enzim beta laktamase dibagi
menjadi empat kelompok, yaitu:5,6
a. Grup 1 (Ambler Kelas C), yang juga dikenal sebagai enzim AmpC
Grup ini resisten terhadap inhibitor beta laktamase seperti klavulanat. Enzim ini terutama ditemukan di kromosom, dan enzim ini diinduksi oleh paparan antibiotik beta laktam. Enzim ini banyak ditemukan pada golongan Enterobacteriaceae dan P. aeruginosa. Enzim ini dapat berpindah dari kromosom ke plasmid pada beberapa strain seperti E. coli dan
Klebsiella spp. Grup 1 beta laktamase resisten terhadap kombinasi antibotik
golongan beta laktam dengan
penghambat beta laksamase, penisilin, sefamisin, sefalosporin generasi 1, 2
dan 3, namun sensitif terhadap sefepim dan karbapenem.
b. Grup 2 (Ambler kelas A)
Gen pengkode enzim ini terdapat di
plasmid, sehingga mudah
ditransmisikan ke bakteri lain. Hal ini menyebabkan penyebaran resistensi menjadi lebih mudah. Enzim grup 2 dapat dihambat oleh penghambat enzim beta laktamase seperti asam klavulanat, sulbaktam dan tazobaktam. Enzim ini ditranskripsikan oleh gen TEM dan SHV. TEM-1 pertama kali diidentifikasi pada tahun 1965 di
Enterobacteriaceae dan kemudian menyebar ke bakteri lain, seperti
Haemophillus, Neiserria dan Vibrio spp. Grup 2 ini dapat menghidrolisis ampisilin, sefalosporin generasi 1, 2 dan 3 serta monobaktam (Extended Spectrum Beta Lactamase (ESBL). c. Grup 3 (Ambler kelas B)
Enzim grup ini adalah metalo enzim yang resisten terhadap karbapenem. Enzim ini banyak ditemukan pada P. aeruginosa, Bacteroides fragilis dan
Stenotrophomonas maltophilia.
d. Grup 4 Beta Laktamase
Grup ini merupakan enzim penisilinase yang berbeda karena tidak dapat dihambat oleh asam klavulanat. Grup 4 menunjukan kemampuan yang baik dalam menghidrolisis karbenisilin dan atau cloxacillin.
Tipe ESBL yang penting adalah sebagai berikut5:
a. TEM beta lactamase. Saat ini terdapat lebih dari 100 tipe TEM ESBL kecuali TEM-1 dan TEM-2. TEM ESBL tersering dijumpai pada bakteri E. coli
dan K. pneumoniae. Dapat juga dijumpai pada bakteri gram negatif lainnya.
b. SHV beta lactamase. Tipe ini merupakan tipe ESBL yang paling sering ditemukan. Kebanyakan strain mempunyai SHV di plasmid melalui pergantian serin menjadi glisin di urutan 238. Beberapa strain merubah lisin menjadi glutamat di urutan 240. Residu serin di urutan 238 penting untuk menghidrolisis seftazidim, dan
residu lisin penting untuk
telah diketahui terdapat lebih dari 100 jenis dan SHV ditemukan pada
Enterobacteriaceae, Pseudomonas aeruginosa dan Acinetobacter baumanii.
c. CTX-M beta lactamase. Tipe ini pertama kali dijelaskan pada tahun 2000, diberi nama CTX-M karena
kemampuannya menghidrolisis
sefoktaksim. Enzim ini dapat
menghidrolisis sefalotin lebih baik dibandingkan benzyl penicillin, dan sefotaksim daripada seftazidim, serta tazobaktam dibandingkan sulbaktam dan klavulanat. Enzim ini juga dapat menghidrolisis sefepim. Sampai saat ini terdapat 128 tipe CTX-M dan diklasifikasikan menjadi 5 kelas (CTX-M-1, CTX-M-2, CTX-M-8, CTX-M-9, dan CTX-M-25). Enzim ini ditemukan pada Enterobacteriaceae termasuk
Salmonella spp.5
Identifikasi ESBL
Saat ini tersedia medium kultur ChromIDTM ESBL yang dapat mendeteksi bakteri-bakteri penghasil ESBL secara akurat dalam waktu 24 jam. Media ini mengandung pepton, glukosa dan antibiotik yaitu
sefpodoksim yang digunakan sebagai marker mekanisme resistensi ESBL serta memiliki sensitifitas yang tinggi untuk mendeteksi
ESBL. Sensitifitas dan spesifisitas
ChromIDTM ESBL dalam mendeteksi E. coli
dan K. pneumoniae cukup tinggi sekitar 97,7% dan 89%. Interpretasi setelah 24 jam, terdapat koloni berwarna merah jambu hingga merah keunguan pada ChromID ESBL berarti koloni tersebut E. coli dan koloni berwarna hijau, coklat kehijau-hijauan atau kebiru-biruan adalah koloni kelompok KESC (Klebsiella, Enterobacter, Serratia, Citrobacter) dan kelompok Proteae (Proteus, Providencia, Morganella) akan berwarna coklat tua hingga coklat muda.2
Pada umumnya antibiotik yang
digunakan untuk uji ESBL pada isolat E. coli
dan Klebsiella spp adalah seftazidim (merupakan indikator yang paling baik untuk ESBLs tipe TEM dan SHV), sefotaksim (merupakan indikator yang paling baik untuk ESBLs tipe CTX-M), serta menggunakan kombinasi antibiotik yang digunakan dengan asam klavulanat. Metode yang digunakan untuk menguji menggunakan antibiotik tersebut
adalah metode difusi cakram yang
menggunakan media MHA (Mueller Hinton Agar) dan metode mikrodilusi yang
menggunakan CAMHB (Cation Adjusted
Mueller Hinton Broth).7
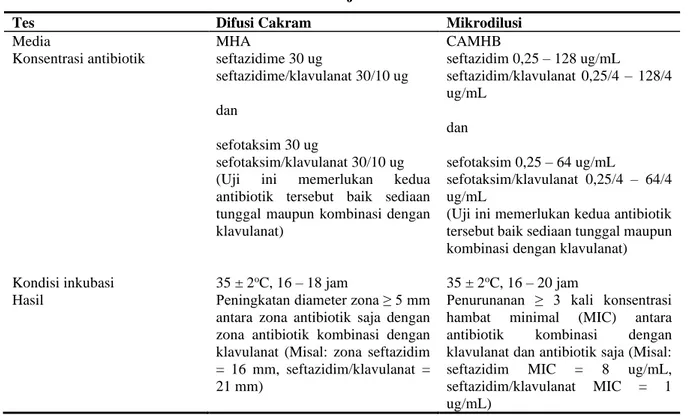
Tabel 1. Uji ESBL5
Tes Difusi Cakram Mikrodilusi
Media MHA CAMHB
Konsentrasi antibiotik seftazidime 30 ug
seftazidime/klavulanat 30/10 ug dan
sefotaksim 30 ug
sefotaksim/klavulanat 30/10 ug
(Uji ini memerlukan kedua
antibiotik tersebut baik sediaan tunggal maupun kombinasi dengan klavulanat) seftazidim 0,25 – 128 ug/mL seftazidim/klavulanat 0,25/4 – 128/4 ug/mL dan sefotaksim 0,25 – 64 ug/mL sefotaksim/klavulanat 0,25/4 – 64/4 ug/mL
(Uji ini memerlukan kedua antibiotik tersebut baik sediaan tunggal maupun kombinasi dengan klavulanat)
Kondisi inkubasi 35 ± 2oC, 16 – 18 jam 35 ± 2oC, 16 – 20 jam
Hasil Peningkatan diameter zona ≥ 5 mm
antara zona antibiotik saja dengan zona antibiotik kombinasi dengan klavulanat (Misal: zona seftazidim = 16 mm, seftazidim/klavulanat = 21 mm)
Penurunanan ≥ 3 kali konsentrasi
hambat minimal (MIC) antara
antibiotik kombinasi dengan
klavulanat dan antibiotik saja (Misal:
seftazidim MIC = 8 ug/mL,
seftazidim/klavulanat MIC = 1
Enzim Karbapenemase
Selama beberapa dekade terakhir
muncul bakteri gram negatif yang
menghasilkan enzim karbapenemase.8
Karbapenem merupakan pilihan utama untuk
infeksi bakteri gram-negatif yang
menghasilkan ESBL dan resisten terhadap sefalosporin generasi ke-3. Selama beberapa tahun terakhir, peningkatan bakteri penghasil
ESBL di seluruh dunia menyebabkan
peningkatan penggunaan antibiotik golongan karbapenem, terutama di unit perawatan bedah dan ruang perawatan intensif. Semakin seringnya penggunaan karbapenem dapat menginduksi resistensi terhadap karbapenem.9
Saat ini di negara Eropa ditemukan resistensi
karbapenem pada Enterobacteriaceae di
pelayanan kesehatan dan penyebabnya
dikaitkan dengan produksi beta laktamasemase yang mampu menghidrolisis karbapenem.10
Resistensi Enterobacteriacae dan bakteri gram negatif lainnya terhadap karbapenem dapat disebabkan oleh ekspresi ESBL tingkat tinggi disertai dengan perubahan porin, atau oleh enzim spesifik karbapenemase.9 Enzim ini
menghidrolisis karbapenem, dan juga antibiotik beta-laktam lainnya. Beberapa karbapenemase telah diketahui selama lebih dari 20 tahun (blaIMP, blaIMI) tetapi dibatasi pada spesies dan wilayah geografis tertentu. Misalnya karbapenemase IMP-type yang dimediasi plasmid pertama kali muncul di Jepang pada 1990-an, ditemukan pada spesies Pseudomonas
dan Acinetobacter.9 Perbedaan regional
mempengaruhi prevalensi resistensi terhadap karbapenem serta jenis karbapenemase yang paling mungkin ditemui.9
Bakteri dengan acquired carbapenem-hydrolyzing B-lactamase telah menyebar ke seluruh dunia. Bakteri yang dimaksud adalah
Escherichia coli, Pseudomonas aeruginosa, Citrobacter freundii/ braakii, Klebsiella pneumoniae dan Acinetobacter baumannii.8,9
Saat ini karbapenemase pada
Enterobacteriaceae adalah yang paling banyak ditemui. Karbapenemase terbagi menjadi empat kelas, yaitu: Ambler kelas A (KPC), kelas B (VIM, IMP, dan NDM), dan kelas D (OXA-48-like).8 Pada Acinetobacter spp.,
carbapenem-hydrolizing β-lactamase termasuk dalam Ambler kelas D, varian yang paling umum adalah enzim 23-, 24-, dan OXA-58-like enzyme, sedangkan kelas B metallo-β-laktamase (MBL), terutama VIM dan IMP berada pada tingkat lebih rendah dan paling sering ditemui pada Pseudomonas spp.8,11
Kelas karbapenemase tipe OXA-48 sudah semakin umum dijumpai pada carbapenem-nonsusceptible Enterobacteriaceae di wilayah Afrika Utara, Timur Tengah, dan Turki, yang
kemudian telah menyebar luas dan
menyebabkan wabah di beberapa negara Eropa dan juga menyebar secara sporadis di Amerika Utara dan Selatan, Israel, dan India. Karbapenemase tipe OXA-48 tersebar pada
Klebsiella pneumoniae, Escherichia coli dan spesies Enterobacteriaceae lainnya.10
Identifikasi karbapenemase umumnya tidak dilakukan secara rutin, sehingga biasanya
hanya untuk studi epidemiologi dan
pencegahan infeksi. Isolat Enterobacteriaceae
yang menghasilkan karbapenemase biasanya menunjukkan hasil intermediet atau resisten terhadap satu atau lebih karbapenem dengan
menggunakan breakpoints yang telah
ditetapkan, dan biasanya resisten terhadap satu atau lebih golongan sefalosporin generasi 3 (sefoperazon, sefotaksim, seftriakson, seftazidim, seftizoksim).7 Laboratorium
melakukan uji mCIM (Modified Carbapenem Inactivation Method) dengan atau tanpa
eCIM,(EDTA Carbapenem Inactivation
Method) CarbaNP dan atau uji molekuler untuk
memperkirakan Enterobacteriaceae yang
dicurigai menghasilkan enzim karbapenemase
dengan menggunakan MIC breakpoints
imipenem atau meropenem 2 – 4 ug/mL atau ertapenem 2 ug/mL.7
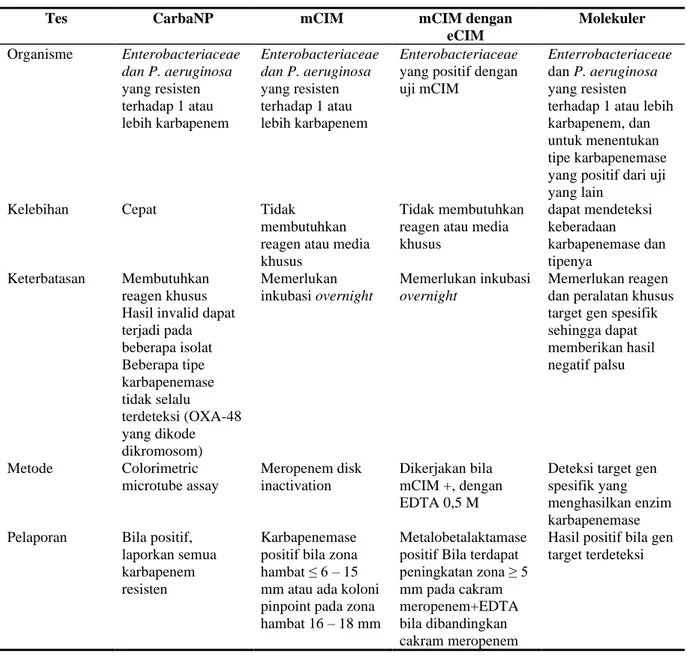
Tabel 2. Perbandingan Uji-uji yang Digunakan Untuk Mendeteksi Enzim Karbapenemase7
Tes CarbaNP mCIM mCIM dengan
eCIM Molekuler Organisme Enterobacteriaceae dan P. aeruginosa yang resisten terhadap 1 atau lebih karbapenem Enterobacteriaceae dan P. aeruginosa yang resisten terhadap 1 atau lebih karbapenem Enterobacteriaceae
yang positif dengan uji mCIM
Enterrobacteriaceae
dan P. aeruginosa
yang resisten terhadap 1 atau lebih karbapenem, dan untuk menentukan tipe karbapenemase yang positif dari uji yang lain
Kelebihan Cepat Tidak
membutuhkan reagen atau media khusus
Tidak membutuhkan reagen atau media khusus dapat mendeteksi keberadaan karbapenemase dan tipenya Keterbatasan Membutuhkan reagen khusus Hasil invalid dapat terjadi pada beberapa isolat Beberapa tipe karbapenemase tidak selalu terdeteksi (OXA-48 yang dikode dikromosom) Memerlukan inkubasi overnight Memerlukan inkubasi overnight Memerlukan reagen dan peralatan khusus target gen spesifik sehingga dapat memberikan hasil negatif palsu Metode Colorimetric microtube assay Meropenem disk inactivation Dikerjakan bila mCIM +, dengan EDTA 0,5 M
Deteksi target gen spesifik yang menghasilkan enzim karbapenemase
Pelaporan Bila positif,
laporkan semua karbapenem resisten
Karbapenemase positif bila zona hambat ≤ 6 – 15 mm atau ada koloni pinpoint pada zona hambat 16 – 18 mm
Metalobetalaktamase positif Bila terdapat peningkatan zona ≥ 5 mm pada cakram meropenem+EDTA bila dibandingkan cakram meropenem
Hasil positif bila gen target terdeteksi
AmpC
AmpC β-lactamase merupakan enzim sefalosporinase yang menjadi fokus utama karena mempunyai kemampuan untuk resisten terhadap semua antibiotik beta-laktam seperti penisilin, sefalosporin, dan monobaktam kecuali karbapenem, sefepim, sefpirom.12,13
Pada Enterobacteriaceae enzim AmpC di kode oleh kromosom dan gen yang dimediasi oleh plasmid. Kebanyakan enzim AmpC yang dikode oleh kromosom dapat ditemukan pada Enterobacter, Pseudomonas, Acinetobacter dan
Citrobacter spp.14 Mayoritas dari gen AmpC
yang dimediasi plasmid sering ditemukan pada isolat yang didapatkan dari infeksi nosokomial, seperti; Escherechia coli, Klebsiella
pneumonia, dan famili Enterobacteriaceae.
Namun tidak semua famili Enterobacteriaceae
membawa gen AmpC β-lactamase, contohnya adalah Enterobacter aerogenes.15,16
Enzim ini mempunyai massa 34-40 kDa, masukkan kedalam kelas C β-lactamase.13
Masalah utama dalam deteksi AmpC pada bakteri gram negatif menggunakan uji fenotipik, sering ditemukan kesalahan interpretasi hasil.17 Oleh karena itu, masih
terdapat kontroversi mengenai metode yang paling baik untuk mendeteksi bakteri penghasil AmpC.17
Terdapat beberapa uji fenotipik untuk skrining enzim AmpC β-lactamase seperti; cakram sefoksitin, D69C deteksi AmpC set,
(CC-DDS) dan uji induksi AmpC.14
Polymerase Chain Reaction (PCR) merupakan uji genotipik yang dapat digunakan sebagai
metode baku emas untuk mendeteksi
keberadaan gen AmpC, namun metode ini tidak cocok untuk digunakan sebagai penggunaan rutin pada laboratorium mikrobiologi klinik karena dibutuhkan peralatan khusus untuk melakukan uji tersebut.16,18
Gen AmpC dapat dibedakan dari extended-spectrum β-lactamase (ESBL) lainnya karena
kemampuannya untuk menghidrolisa sefamisin (sefoksitin dan sefotetan) dan sefalosporin, sehingga jika didapatkan hasil uji resisten terhadap sefamisin dapat dijadikan bukti tidak langsung adanya gen AmpC, namun hasil ini masih kurang spesifik karena terdapat mekanisme lain yang dapat menghasilkan resistensi dari sefamisin.12,19
Beberapa metode yang digunakan antara lain:14
1. Cakram sefoksitin. Uji ini dapat digunakan untuk skrining isolat bakteri yang memiliki gen AmpC. Isolat bakteri yang
menunjukkan zona hambat dengan
diameter ≤ 18 mm dikatakan positif untuk gen AmpC, oleh karena itu memastikan keberadaan gen tersebut. Karena meskipun sefoksitin bersifat stabil terhadap aktivitas berbagai enzim beta lactamase (seperti TEM-1, TEM-2 dan SHV-1), namun resistensi masih mungkin terjadi akibat perubahan dari membran luar bakteri. 2. D69C AmpC detection set. Uji ini
menggunakan sefpodoksim sebagai
skrining untuk mendeteksi baik AmpC yang dimediasi plasmid dan kromosom, maupun dengan keberadaan penginduksi AmpC atau inhibitor. Set deteksi terdiri dari tiga cakram, yaitu: cakram A (sefpodoksim 10 ug dan AmpC inducer), cakram B (sefpodoksim 10 ug, AmpC
inducer dan ESBL inhibitor) dan cakram C (sefpodoksim 10 ug, AmpC inducer,
ESBL inhibitor dan AmpC inhibitor). Isolat bakteri dinyatakan AmpC positif bila didapatkan zona hambat cakram C melebihi zona hambat cakram A dan B dengan selisih minimal 5 mm, dan negatif bila selisih zona hambat ≤ 3 mm. Jika zona hambat pada cakram B dan C melebihi zona hambat A dengan selisih minimal 5 mm, dan selisih ukuran zona hambat B dan C ≤ 4 mm, isolat dapat dikatakan AmpC
negatif, namun menunjukkan mekanisme resistensi yang berbeda.
3. Cefoxitin-cloxacillin double disc synergi test (CC-DDS). Uji ini dilakukan dengan dasar efek inhibisi cloxacillin pada penghasil AmpC. Isolat di inokulasikan pada MHA dan kemudian menggunakan 2 cakram yaitu cakram cefoxitin-cloxacillin
(230 ug) dan cakram cefoxitin (30 ug). Bila setelah inkubasi didapatkan perbedaan zona hambat ≥ 4 mm antara cakram
cefoxitin-cloxacillin dengan cakram
cefoxitin, maka hasil uji diindikasikan sebagai penghasil enzim AmpC.
4. Uji Induksi AmpC. Klavulanat digunakan sebagai penginduksi untuk mendeteksi AmpC beta lactamase yang dimediasi oleh plasmid pada Enterobacteriaceae dengan metode difusi cakram ganda (double disk diffusion test). Cakram mengandung seftazidim (30 ug) dan aztreonam (30 ug) diletakkan dengan jarak 15 mm dari tepi cakram amoksisilin-klavulanat (30 ug) pada MHA. Hasil uji dinyatakan positif ketika zona hambat cakram seftazidim dan aztreonam menjadi mendatar pada daerah
yang berdekatan dengan cakram
amoksisilin-klavulanat. Simpulan
Dari seluruh uji yang telah disebutkan, pemilihan untuk uji yang dapat dilakukan secara rutin untuk menunjang pemeriksaan klinis adalah uji cakram untuk deteksi ESBL, uji mCIM untuk deteksi karbapenemase, dan uji sefoksitin untuk uji deteksi AmpC. Uji mikrodilusi untuk ESBL lebih sulit untuk dikerjakan secara rutin walaupun dapat
mendeteksi MIC. Jika pengujian MIC
meggunakan metode pengujian otomatis
menggunakan alat, cara interpretasinya akan berbeda akibat dari perbedaan jenis antibiotik yang digunakan.
Daftar Pustaka
1. Gupta G, Tak V, Mathur P. Detection of Amp C β lactamases in gram‑negative bacteria. J Lab Physicians. 2014;6(1). doi:10.4103/0974-2727.129082
2. Savira M. Validitas metode konvensional modifikasi terhadap metode konvensional dan ChromIDTM ESBL untuk deteksi bakteri-bakteri penghasil
extended-spectrum beta-lactamases. J Ilmu Kedokt. 2014;8(1):81-90.
3. Naelasari DN, Koendhori EB, Dewanti L, Sarassari R, Kuntaman K, Airlangga U. The prevalence of extended spectrum beta-lactamase (ESBL) producing gut bacterial flora among patients in Dr . Soetomo Hospital and primary health centers in
Surabaya. Folia Medica Indones.
2018;54(4):256-62.
4. Tille PM. Bailey & Scott’s Diagnostic Microbiology. 13th ed. Elsevier; 2014. 5. Ghafourian S, Sadeghifard N, Soheili S,
Sekawi Z. Extended spectrum beta-lactamases: definition, classification and epidemiology. Curr Issues Mol Biol. 2015:11-22.
6. Murray PR, Rosenthal KS, Pfaller MA. Medical microbiology. 8th ed. Elsevier Inc.; 2016.
7. Clinical and Laboratory Standard Institute.
M100 Performance standards for
antimicrobial susceptibility testing. Clinical and Laboratory Standard Institute; 2018.
8. Noël A, Huang T, Berhin C, et al.
Comparative evaluation of four
phenotypic tests for detection of carbapenemase-producing gram-negative
bacteria. J Clin Microbiol.
2017;55(2):510-58.
9. Ruppelt A, Makarewicz O, Braun SD, et al. Rapid identification of carbapenemase genes in gram-negative bacteria with an oligonucleotide microarray-based assay.
PLoS One. 2014;9(7).
doi:10.1371/journal.pone.0102232
10. Tsakris A, Poulou A, Bogaerts P, Dimitroulia E, Pournaras S, Glupczynski Y. Evaluation of a new phenotypic OXA-48 disk test for differentiation of OXA-OXA-48 carbapenemase-producing
enterobacteriaceae. J Clin Microbiol. 2015;53(4):1245-51.
doi:10.1128/JCM.03318-14
11. Bennet JO, Dollin R, Blaser MJ. Infectious Diseases. 8th ed. Elsevier Inc. 2015(1). 12. Jacoby GA. AmpC beta-lactamases. Clin
Microbiol Rev. 2009;22(1):161-82.
doi:10.1128/CMR.00036-08
13. Drieux-rouzet L, Golmard J, Jarlier V. Comparison of nine phenotypic methods for detection of extended-spectrum
beta-lactamase production by
enterobacteriaceae. J Clin Microbiol. 2011;49(3):1048-57.
doi:10.1128/JCM.02130-10
14. Khari M, Izzati F, Karunakaran R; Rosli R; Tee Tay S. Genotypic and phenotypic detection of AmpC β-lactamases in
Enterobacter spp. isolated from a teaching hospital in Malaysia. PLoS One. 2016:1-12.
15. Rand KH, Turner B, Seifert H, Hansen C,
Johnson JA, Zimmer A. Clinical
laboratory detection of AmpC beta-lactamase: does it affect patient outcome? Am J Clin Pathol. 2011;(Jan):572-6. doi:10.1309/AJCP7VD0NMAMQCWA 16. Birgy A, Bidet P, Genel N, Doit C, Decre
D, Arlet G, Bingen E. Phenotypic
screening of carbapenemases and
associated β-lactamases in carbapenem-resistant Enterobacteriaceae.pdf. J Clin Microbiol. 2012:1295-1302.
17. Helmy MM, Wasfi R. Phenotypic and molecular characterization of plasmid mediated AmpC β-lactamases among
Escherichia coli, Klebsiella spp., and
Proteus mirabilis isolated from urinary tract infections in Egyptian hospitals.
Biomed Res Int. 2014:1-6.
doi:http://dx.doi.org/10.1155/2014/17154 8
18. Lutgring JD, Limbago BM. The problem
of
carbapenemase-producing-carbapenem-resistant- enterobacteriaceae
detection. 2016;54(3):529-534.
doi:10.1128/JCM.02771-15.Editor
19. Tan TY, Siew L, Ng Y, He J, Koh TH, Hsu LY. Evaluation of screening methods to
detect plasmid-mediated AmpC in
Escherichia coli, Klebsiella pneumoniae, and Proteus mirabilis. Antimicrob Agents
Chemother. 2009;53(1):146-9.