KESTABILAN PEWARISAN GEN entC DAN pmsB
PADA PADI TRANSGENIK GENERASI KETIGA (T
2)
INDRA BAYU NAFARI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Kestabilan Pewarisan Gen
entC
Dan
pmsB
Pada Padi Transgenik Generasi Ketiga (
T
2) adalah karya saya sendiri dan belum
diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber
informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak
diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Februari 2006
Indra Bayu Nafari
KESTABILAN PEWARISAN GEN entC DAN pmsB
PADA PADI TRANSGENIK GENERASI KETIGA (T
2)
INDRA BAYU NAFARI
Skripsi
Sebagai salah satu syarat melaksanakan penelitian
Untuk memperoleh gelar Sarjana Sains
Pada Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
Judul skripsi : Kestabilan Pewarisan Gen
entC
Dan
pmsB
Pada Padi Transgenik
Generasi Ketiga (
T
2)
Nama
: Indra Bayu Nafari
NIM
: G44101011
Disetujui
Komisi Pembimbing
Prof.Dr.H.Norman R.Azwar
Ketua
Enung Sri Mulyaningsih SP, M.Si
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Ir.Yonny Koesmaryono,MS.
NIP 131 473 999
DAFTAR ISI
Halaman
DAFTAR GAMBAR ...
ii
DAFTAR TABEL ...
ii
DAFTAR LAMPIRAN ...
ii
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Tanaman Transgenik ... 2
Interaksi Tanaman dan Patogen ...
3
Penyakit Blas ...
3
Asam Salisilat ...
4
Southern Blot ... 5
Gen
hpt
Penyandi Higromisin Fosfotransferase ...
6
BAHAN DAN METODE
Bahan dan Alat ...
6
Metode Penelitian ...
6
HASIL DAN PEMBAHASAN
Uji Higromisin ... 10
Uji Hayati dengan Cendawan Blas ... 10
Southern blot ... 12
SIMPULAN DAN SARAN ... 15
DAFTAR PUSTAKA ...
15
DAFTAR GAMBAR
Halaman
1
Peta plasmid oleh penyandi asam salsilat
pmsB
dan
entC
...
1
2
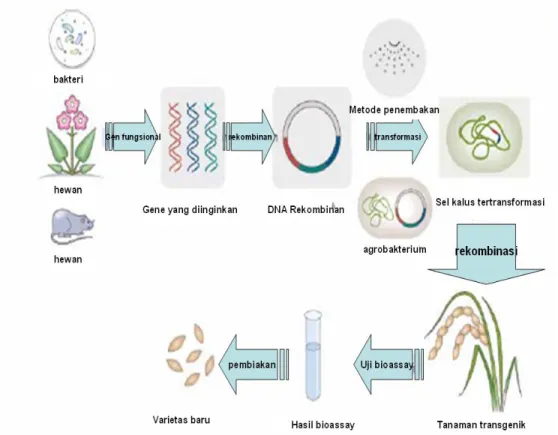
Prosedur untuk mengembangkan tanaman padi transgenik ...
2
3
Daun padi CO39 ...
3
4
Daun yang terserang blas ...
4
5
Proses infeksi konidia ...
4
6
komunikasi
systemic acquired resistance
(SAR) ...
5
7
Susunan perangkat bloting membran ...
9
8
Daun yang tersisipi gen
hpt
mengalami nekrotik
(kiri) dan yang tersisipi
gen
hpt
...
10
9 Hasil pengamatan uji higromisin ...
10
10 Hasil isolasi dan purifikasi DNA ...
13
11 Hasil pemotongan plasmid genom dengan enzim Hind III yang disusun
antara DNA potongan dan DNA tidak dipotong ...
13
12 DNA fragmen hasil PCR yang digunakan sebagai probe ...
16
13 DNA genom hasil pemotongan setelah dielektroforesis selama 18 jam dan
setelah proses transblot ...
13
14 Hasil foto southern dari membran ...
14
DAFTAR TABEL
Halaman
1
Hasil pengamatan uji skor blas padi pada daun 1 ...
11
2
Hasil pengamatan uji skor blas padi pada daun 2 ...
11
3
Hasil pengamatan uji skor blas padi pada daun 3 ...
12
4
Data hasil Southern, uji higromisin dan uji blas untuk galur E.10.1.43.8
E.10.1.27.11, E.10.1.5.15, C.30.1.2.29, E.10.1.10.29 ...
15
Halaman
1
Data uji lapangan higromisin ...
18
2
Jalur sintesis asam salisilat ...
20
3
Gambar plasmid pCAMBIA 1300 ...
21
PRAKATA
Alhamdulillah, segala puji hanyalah milik Allah Rabbul ‘Alamin yang telah
memberikan rahmat dan karunia kepada penulis sehingga karya ilmiah ini berhasil
diselesaikan. Penelitian ini dilaksanakan di Laboratorium Biologi Molekular
Pusat Penelitian Bioteknologi LIPI mulai bulan Oktober hingga Desember 2005
dengan judul : Kestabilan Pewarisan Gen
entC
dan
pmsB
Pada Padi Transgenik
Generasi Ketiga (
T
2).
Penulis mengucapkan terima kasih kepada Bapak Prof.Dr.H.Norman
R.Azwar selaku dosen pembimbing yang telah memberikan saran dan kritik serta
arahannya, Ibu Enung Sri Mulyaningsih S.P, M.Si selaku pembimbing yang telah
menerima dan membimbing penulis selama melakukan penelitian dan penyusunan
karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada banyak pihak di
Laboratorium Molekular Bioteknologi LIPI kepada Ibu Inez H.Loedin selaku
Kepala Laboratorium Molekular Bioteknologi LIPI, para staf peneliti: Ibu Ami,
Deswina, Syamsidah,Mas Satya, Sigit, Agus, dan kepada kakak kakak:Mbak
Anky, Dwi, Carla, Yuli,Fatimah ,Cahya ,Eva, ,Sri ,Mas Opik ,Budi ,Dadang yang
telah membantu kelancaran penelitian ini, juga kepada Widyo atas bantuan,
pengertian dan dorongannya. Ucapan terima kasih yang terpenting kepada ibu dan
bapak atas restu ,doa dan dukungan yang diberikan. Semoga karya ilmiah ini
bermanfaat.
Bogor, Februari 2006
Indra Bayu Nafari
ABSTRAK
INDRA BAYU NAFARI. Kestabilan Pewarisan Gen
entC
dan
pmsB
Pada Padi
Transgenik Generasi Ketiga (
T
2). Dibimbing oleh NORMAN R.AZWAR dan
ENUNG SRI MULYANINGSIH.
Sejak abad 19 asam salisilat telah diidentifikasi dari tanaman tersebut
sebagai zat aktif di dalam berbagai macam proses fisiologi, seperti penutupan
stomata, pembentukan bunga, proses ketahanan terhadap panas dan berperanan
penting dalam pertahanan terhadap serangan pathogen. Pada penelitian dilakukan
uji hayati terhadap cendawan
P.oryzae,
analisis ketahanan higromisin sebagai gen
penanda dan analisis Southern blot untuk melihat jumlah salinan dan integrasi
gen penanda
hpt
maupun gen penyandi asam salisilat (
pmsB
dan
entC
)
Hasil yang didapat dari analisis molekular menunjukan gen higromisin 2
galur transgenik (E.10.1.27 dan E.10.1.43) terekspresi dengan baik dan pola
segregasinya mengikuti hukum Mendel (3:1), sedangkan berdasarkan uji hayati
dengan cendawan blas diperoleh satu galur unggulan tahan (E.10.1.5).
Pengamatan tingkat ketahanan pada tanaman yang dapat dijadikan patokan
adalah pengamatan padi daun pertama, sedangkan pada daun yang lebih muda
tidak dapat dijadikan patokan. Hasil Southern menunjukan bahwa dengan
menggunakan probe
hpt
terdapat jumlah salinan gen masing-masing 1, yaitu pada
sub galur C.30.1.2.29, E.10.1.5.15, E.10.1.10.29, E.10.1.43.8 sedangkan dengan
pmsB
diperoleh 3 galur yaitu C.30.1.2.29, E.10.1.15 dan E.10.1.10.29 dengan
jumlah salinan DNA masing-masing 1.
ABSTRACT
INDRA BAYU NAFARI. The Stability of
entC
and
pmsB
Genes Inheritance
From The Third Generation Transgenic Rice (
T
2). Under direction by NORMAN
R.AZWAR and ENUNG SRI MULYANINGSIH.
Since the 19th centuris, salicylic acid has been identified as an active
compound responsible for numerous of biological activity such as
closing-opening movement of stomata, flower growth, heat resistance and induced
systemic resistance from pathogen attack. Bioassay was done to
P.oryzae
fungus,
higromycin bioassay as the marker gene and Southern blot analysis to check the
copy number and integration of
hpt
or
pmsB
genes.
The result from molecular analysis show 2 strain of transgenic plant
(E.10.1.27 and E.10.1.43) was integrated by higromycin gene (
hpt
), the phenotype
is expressed and segregation accordance to the Mendell law. From blast attack
bioassay show one strain that has highest score in blast attack resistance
(E.10.1.5). From field observation in blast attack scoring only the first leave
from plant that can be used as standard, because the miscorrelation in data scoring
from control and transgenic sample plant, that is the youngest leave (planula).
From Southern blot molecular analysis show four sub strain (C.30.1.2.29,
E.10.1.5.15, E.10.1.10.29, E.10.1.43.8) with one copy of
hpt
gene, and three sub
strain show one copy integration of
pmsB
gene C.30.1.2.29, E.10.1.15 dan
RIWAYAT HIDUP
Penulis dilahirkan di Samarinda pada tanggal 09 Januari 1984 dari Ayah
Muhtadin Nafari dan Ibu Ernawati Said. Penulis merupakan anak pertama dari
dua bersaudara.
Tahun 1989 penulis lulus dari TK Cendrawasih Jaya Bekasi, kemudian
masuk SD Negeri 1 Biak dan lulus pada tahun 1995, dilanjutkan ke SLTP Negeri
2 Jayapura hingga tahun 1998, dan kemudian masuk SMU PSKD 4 Jakarta
Selatan hingga lulus pada tahun 2001. pada tahun yang sama penulis diterima di
Institut Pertanian Bogor pada program Studi Biokimia (Sekarang menjadi
Departemen), Fakultas Matematika dan Ilmu Pengetahuan Alam melalui jalur
USMI
PENDAHULUAN
Pada abad ke 21 populasi penduduk dunia diperkirakan akan meningkat dengan dramatis. Seiring dengan keadaan tersebut maka diperlukan peningkatan dalam total produksi pangan dunia. Tetapi ketersediaan lahan produktif dan lingkungan agrikultural tidak akan dalam keadaan seimbang karena adanya kemajuan industrialisasi. Penggunaan pestisida dan pupuk yang mendorong revolusi hijau pada abad ke 20 mulai ditinggalkan karena ada kekhawatiran penumpukan bahan kimia di dalam tubuh yang mengakibatkan berbagai macam komplikasi penyakit antara lain alergi, kanker dan kerusakan syaraf.
Perakitan tanaman transgenik secara bioteknologi diyakini memberi harapan masa depan bagi penyediaan pangan dan lingkungan alam yang bersih. Tanaman hasil rekayasa genetik yang diproduksi secara umum antara lain tomat Flavr Savr® yang tahan pemasakan, kacang kedelai tahan herbisida, jagung tahan hama serangga.. Di Indonesia tanaman padi transgenik telah diperoleh Pusat Penelitian Bioteknologi LIPI, salah satu tanaman transgenik tersebut adalah yang mengandung gen gen penyandi asam salisilat (entC dan pmsB) untuk ketahanan
terhadap penyakit blas.
Penyakit blas (Magnaporthe grisea/Pyricularia oryzae) merupakan salah satu penyakit utama padi yang diakibatkan oleh cendawan yang berasal dari famili ascomycetes. Menurut statistik penyakit tanaman ini telah memusnahkan beras yang cukup untuk dikonsumsi oleh 60 juta masyarakat dunia. Penyakit ini telah lama dilaporkan sebagai penyakit penting baik pada padi gogo maupun padi sawah diseluruh dunia. Berbagai usaha telah dilakukan untuk mencegah penyakit tanaman ini, antara lain dengan menggunakan fungisida anti blas, pupuk dengan kadar nitrogen tinggi dan varietas tanaman padi yang kebal terhadap serangan M. grisea, namun menurut penelitian
tanaman padi dan jenis fungi ini telah berkembang bersama sama selama jutaan tahun sehingga fungi ini memiliki kemampuan yang sangat luar biasa dalam berevolusi dan menembus pertahanan yang dibangun oleh tanaman padi (Ou 1985) penyakit blas memiliki indikasi berupa bercak–bercak berwarna putih dan abu-abu pada daun. Bercak tersebut dapat berupa elips dengan warna bagian tengah abu abu keputihan dan bagian tepi coklat kemerahan sebagai tanda bahwa daun mengalami keadaan nekrotik. Penyakit ini dapat menyebabkan kerapuhan pada butiran beras
menginfeksi batang dan akar sehingga tanaman menjadi rapuh dan hancur pada seluruh permukaan daun yang berakibat produktivitas tanaman padi menurun. Berdasarkan data Biro Pusat Statistik (2002), intensitas kerusakan tertinggi akibat blas di pulau Jawa dan luar Jawa adalah 12,75% (Jawa Barat) dan 32,75% (Riau). Kerugian akibat penyakit blas cukup besar dibandingkan dengan penyakit lainnya (Ou 1972.) Jika intensitas penyakit ini meningkat, stabilitas produksi yang tinggi akan terancam dan dapat mengganggu ketahanan pangan.
Salah satu upaya yang dilakukan untuk mengatasi penyakit blas adalah dengan merakit tanaman yang tahan terhadap serangan cendawan melalui rekayasa DNA seperti yang dilakukan di Puslit Bioteknologi LIPI. Gen yang terkait dalam biosintesis asam salisilat ialah gen entC (yang di produksi oleh Escheria coli)dan pmsB ( asal Pseudomonas flourosens). Tanaman yang akan diuji pada
penelitian ini merupakan turunan ke tiga (T2).
Asam salisilat yang dihasilkan, menurut hasil penelitian terbaru dapat mengaktifkan suatu mekanisme sistem kekebalan tanaman terhadap patogen yang disebut ISR (induced systemic resistence) atau SAR (systemic acquired resistance) (Verberne et al. 2005).
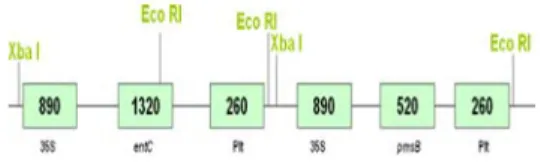
Transformasi kaset gen penyandi asam salisilat dilakukan melalui Agrobacterium tumefaciens dengan menyisipkan kaset
tersebut (Gambar 1) pada vektor ganda pCAMBIA 1300
Pada penelitian ini akan dilakukan bioassay terhadap cendawan P. oryzae,
analisis ketahanan higromisin sebagai gen penanda, analisis Southern blot untuk melihat jumlah salinan dan integrasi gen penanda hpt
maupun gen penyandi asam salisilat (pmsB
dan entC )
Penelitian ini bertujuan untuk menganalisa pola segregasi gen hpt (penanda) pada generasi ketiga (T2) padi transgenik.
Menguji ketahanan tanaman padi tersebut terhadap serangan blas. Mengetahui jumlah salinan gen pmsB dan hpt.
Ekspresi gen gen penyandi asam salisilat berpengaruh meningkatkan mekanisme
Gambar 1. Peta plasmid kaset penyandi asam salisilat pmsB dan entC
ketahanan terhadap cendawan P. oryzae
dibandingkan tanaman kontrol. Integrasi gen
entC dan pmsB dan gen penanda hpt yang
telah diintroduksi pada tanaman padi bersifat stabil pada generasi ketiga (T2) dan
diwariskan pada turunanya
.
TINJAUAN PUSTAKA
Tanaman Transgenik
Sejak awal abad ke 20, identifikasi fungsi gen telah dilakukan dengan identifikasi genomik, proteomik dan metabolimik (Choi et al. 2005) semua data didapatkan dari studi
yang terintegrasi dan teranalisis secara bioinformatik. Informasi genetik dari padi dan
Arabidopsis diaplikasi ke dalam studi genom
tanaman padi (Choi et al. 2005). Berbagai
usaha telah dikembangkan untuk membantu perkembangan bioteknologi tanaman padi diantaranya pengembangan ESTs (experienced sequence tags), mikroaray dan
sebagainya. Fungsi genomik telah dipelajari dalam skala besar dan beberapa tingkat ekspresi gen tertentu secara diferensial dalam berbagai tahap perkembangan genomik
Berbagai hasil studi dari struktur dan fungsi genom telah diaplikasi ke dalam bioteknologi terutama pertanian (Gambar 2).
Istilah tanaman transgenik dalam pengertian luas dipakai untuk tanaman yang memiliki gen asing yang terintegrasi ke dalam genom tanaman dan gen tersebut berfungsi (Uchimiya et al. 1989 dalam Aswidinnoor
1995). Berbagai metode saat ini telah dikembangkan dan digunakan untuk menghasilkan tanaman transgenik baik melalui transformasi langsung maupun tidak langsung (Herman 1996). Transformasi secara langsung antara lain dengan elektroporasi, fusi dengan PEG (polietilen glikol), mikro injeksi dan penembakan DNA. Transformasi gen secara tidak langsung ialah melalui vektor A.
tumefaciens. Perakitan tanaman padi
transgenik dapat menggunakan gen gen yang berasal dari tanaman padi itu sendiri, atau dari sumber lainya (misalnya bakteri atau tanaman lain). Gen gen yang telah teridentifikasi dan terkarakterisasi kemudian ditransformasikan ke dalam kromosom tanaman padi.. Metode yang banyak digunakan adalah dengan
Agrobacterium dan penembakan DNA (Choi et al. 2005).
Interaksi Tanaman dan Patogen
Pemuliaan tanaman untuk ketahanan terhadap blas telah banyak dilakukan pada berbagai jenis tanaman padi. Hal ini dilakukan karena secara alami tidak menunjukan hasil yang menggembirakan dalam ketahanan terhadap semua ras cendawan ini. Menurut penelitian Departement of Plant Phatology, pertahanan yang dirangsang oleh asam salisilat dibantu oleh gen-gen yang menghasilkan asam salisilat (SA), asam jasmonik ( JA), etilen dan asam absisat (AA). Masing masing zat tersebut memiliki fungsi yang terkoordinasi untuk membentuk pertahanan padi terhadap serangan blas. Asam salisilat berfungsi sebagai inducer dan sebagai antioksidan
yang melindungi padi dari stres oksidatif serta modul penyeimbang reaksi redox, asam jasmonik dan etilen muncul sebagai pemberi sinyal pada sistem pertahanan tanaman dengan mengaktifkan sintesis Allene oksida sintetase yang akan meningkatkan pertahanan padi pada cendawan. Gen lain yang diduga berperan dalam ketahanan tanaman padi terhadap cendawan M. grisea
ialah gen Rir1b yang berasal dari jagung.
Gen ini berperan dalam ketahanan tanaman padi terhadap zat hidrogen peroksida yang akan dihasilkan oleh cendawan, zat tersebut adalah pigmen flavonoid seperti antosianin ungu (Choi et al. 2005)
Dalam usaha memerangi penyakit blas, para peneliti di seluruh dunia lebih berkonsentrasi dalam merakit varietas tanaman padi melalui bioteknologi dan rekayasa genetika dan terus mengadakan penelitian tentang susunan genom dari cendawan. Beberapa penelitian yang baru dilakukan dan dipublikasikan oleh Universitas Purdue Amerika Serikat menyebutkan bahwa ada suatu enzim di dalam padi yang berfungsi sebagai kunci dalam mengkoordinasikan serangan cendawan, yang disebut pathogenity mitogen-activated protein (MAP). Enzim ini memperantarai komunikasi molekuler antara tanaman padi dan cendawan (Zhao et al.
2005). Oleh karena itu cendawan dapat mengetahui cara yang diperlukan untuk menembus pertahanan yang dibentuk oleh tanaman padi dan berevolusi. Cendawan tersebut juga memiliki sejenis protein yang dapat berfungsi sebagai ”perasa” dan memberi tahu apakah tanaman padi tersebut merupakan inang yang baik dan bagaimana mengatasi pertahanan yang dibangun oleh tanaman itu. Beberapa peneliti juga mengungkapkan bahwa M. grisea hanya
memiliki perbedaan 40 juta pasang basa dalam susunan DNAnya dengan sepupunya
Neurospora cassa (Dalke 2002) dengan
demikian dari 2 jenis patogen tersebut akan diperoleh informasi bagaimana sistem patogen tersebut bekerja. Suatu penelitian yang baru saja dipublikasi oleh ARS Cereal Crops Research Unit, menyebutkan bahwa tanaman padi dan cendawan M. grisea telah
berevolusi berdampingan sejak berjuta juta tahun lalu. Tanaman padi secara reflek melepaskan pertahanan jika ada gen yang menyadikan molekul atau protein patogen yang diproduksi oleh cendawan. Gen yang menyandikan pertahanan pada tanaman disebut gen R, sedangkan gen yang menyandikan penghasil zat patogen pada cendawan adalah gen Avr, tetapi masalahnya
bahwa gen Avr sangat ”cocok” dengan gen R, gen Avr dapat mengirimkan sinyal dan
”mematikan” ekspresi gen R. Seperti yang
terlihat pada Gambar 3. Daun dari varietas CO39 yang memiliki kekebalan terhadap patogenitas cendawan M. grisea karena dapat
mematikan fungsi dari gen Avr cendawan.
Kegiatan uji ketahanan dilakukan sebagai upaya dalam mengetahui tingkat ketahanan terhadap serangan pathogen. Pengujian dilakukan dengan cara menyemprotkan cairan konidia. Kemudian penilaian akan dilakukan dengan cara skoring. Tanaman yang dinilai tahan terhadap penyakit blas memiliki skor 1-3 sedangkan yang rentan memiliki skor 4-10 (IRTP 1988).
Gambar 3 . Daun padi CO39 , bintik hitam menunjukan sel M. grisea yang
mati
Penyakit Blas
Penyakit blas yang disebabkan untuk cendawan (P. Oryzae cavara (anamorph)
atau M. grisea (T.T Herbert)), merupakan
salah satu penyakit tanaman padi yang sangat merugikan. Laporan terakhir menyebutkan cendawan ini telah mengakibatkan kerusakan pada tanaman padi yang cukup untuk dikonsumsi oleh kurang lebih 60 juta orang
(Choi 2005). Cendawan ini menyerang dan membentuk bercak pada daun, batang, malai, bunga dan biji. Cendawan ini menghasilkan konidiaspora yang pada tahap infeksi akan membentuk suatu struktur yang disebut appresorium yang berbentuk balon. Appresorium akan menembus permukaan daun dan berkembang menjadi besar seiring dengan bertambahnya jumlah spora, ketika appresorium pecah karena tekanan turgor yang terlalu tinggi (Gambar 4). Tekanan yang dihasilkan sangat besar, lebih besar 40 kali dari tekanan di dalam ban sepeda (Zhao 2005) Cendawan M. grisea juga menyerang
berbagai macam tanaman Bercak pada pelepah daun jarang ditemukan. Bentuk khas bercak blas adalah elips yang kedua ujungnya kurang lebih runcing. Bercak yang telah berkembang pada bagian tepi berwarna coklat dan bagian tengah berwarna putih keabuan (Gambar 5). Dalam keadaan lembab bercak akan terus membesar terutama pada varietas peka (Amir dan Kardin 1991). Pada varietas padi peka, bercak tersebut dapat meluas dan bersatu sehingga akhirnya helai daun mengering dan mati. Pada padi yang tahan, gejala serangan hanya berupa bintik kecil berwarna coklat (Ou 1972).
Spora cendawan secara alami menyebar mulai tengah malam karena adanya embun atau hujan (Hashioka 1963). M. grisea juga
menyerang banyak tanaman lain selain padi. Penyebaran spora akan bertambah banyak sampai menjelang pagi hari dan berakhir pada saat terbit matahari. Pelepasan spora di daerah tropis dapat terjadi pula pada siang hari setelah turun hujan. Pada periode embun ini sangat berpengaruh terhadap pelepasan spora dan infeksi. Jika periode embun lebih lama, spora yang dilepaskan lebih banyak karena kelembaban akan bertambah sehingga infeksi yang terjadi semakin parah (IRRI 1975). Penyebaran spora dapat terjadi juga oleh angin, biji dan jerami sakit. Cendawan
Gambar 5.Proses infeksi konidia (Choi 2005)
Gambar 4. Daun yang terserang blas . Sumber: (Choi 2005)
P. oryzae dapat bertahan dalam sisa jerami
sakit dan gabah sakit selama lebih dari satu tahun pada suhu kamar. Sedangkan dalam bentuk miselia mampu bertahan sampai lebih dari tiga tahun (Amir dan Kardin 1991).
Asam Salisilat (SA)
Selama berabad abad telah diketahui bahwa mengunyah batang dari pohon willow (Sallix) dapat menghilangkan sakit kepala
dan demam, dan pada abad ke 19 asam salisilat telah diidentifikasi dari tanaman tersebut sebagai zat aktif di dalam berbagai macam proses fisiologi, seperti penutupan stomata , pembentukan bunga , proses ketahanan terhadap panas dan berperanan penting dalam pertahanan terhadap serangan pathogen. Ketika tanaman dalam keadaan diserang oleh suatu patogen, maka tanaman akan bereaksi dengan mengeluarkan ekspresi nekrotik untuk mengurung dan mencegah sumber infeksi untuk menyebar luas. Kemudian tanaman akan mengaktifkan
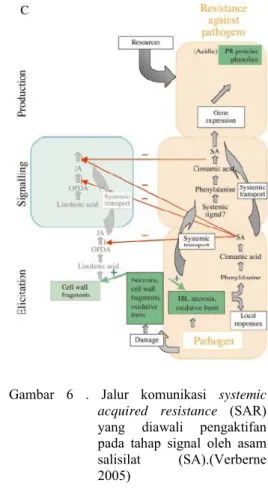
systemic acquired resistance (SAR) (Gambar
6), yang mekanisme lengkapnya masih menjadi misteri tetapi telah diketahui bahwa zat kimia yang mengaktifkan siklus ini adalah asam salisilat.
Metabolisme asam salisilat diawali dengan pembentukan asam shikimat (Lampiran 2), penambahan gen entC dan pmsB, yang masing masing akan membetuk
enzim isokorismat sintase dan isokrimat piruvat liase, yang memotong jalur lintasan metabolisme asam salisilat sehingga biosintesisnya lebih cepat dan efisien.
Gambar 6 . Jalur komunikasi systemic acquired resistance (SAR)
yang diawali pengaktifan pada tahap signal oleh asam salisilat (SA).(Verberne 2005)
Southern Blot
Southern blot adalah teknik analisis molekular yang ditemukan pertama kali oleh Edward M.Southern pada tahun 1970 di Universitas Edinburgh. Southern blot telah lama dikenal sebagai salah satu landasan analisis DNA. Transfer Southern blot dan teknik hibridisasi yang berkaitan telah dimanfaatkan untuk memperoleh informasi tentang organisasi fisik sekuen tunggal dan ganda pada kompleks genom, mempercepat suksesnya percobaan kloning pada gen eukariot (Doel et al. 1977). Teknik Southern
blot dapat digunakan dalam menganalisis keberadaan, jumlah salinan dari gen hasil transformasi pada tanaman transgenik. Apabila jumlah salinan gen transforman terlalu banyak pada genom maka kemungkinan akan terjadi proses silencing
pada gen tertentu (Kumpala et al. 1998),
namun apabila gen terkopi antara 1-10X kemungkinan tidak akan menimbulkan gene silencing pada gen gen lain (Christou et al.
2001)
Istilah Southern blot sekarang digunakan untuk menggambarkan transfer DNA dari gel ke membran, yang pada mulanya dilakukan secara kapiler ke membran nitroselulosa
(Brown 2000). Transfer DNA dalam Southern blot dapat dilakukan pada beberapa tipe membran, buffer transfer dan metode transfer. Membran yang paling populer digunakan adalah membran nitroselulosa, nilon bermuatan positif dan nilon tidak bermuatan. Walaupun ketiga membran ini mempunyai sifat yang berbeda tetapi ketiganya dapat digunakan untuk berbagai macam aplikasi. Keuntungan utama membran nilon adalah relatif kuat dan dapat digunakan untuk hibridisasi lebih dari 10X, sedangkan membran nitroselulosa mudah robek tetapi memberikan background yang
lebih jelas pada beberapa proses hibridisasi (Sambrook et al. 1989)
Transfer DNA dari gel ke membran dapat dilakukan dengan menggunakan metode transfer kapiler, elektroforesis dan vacum. Transfer kapiler seperti yang digunakan oleh Southern (1975), menggunakan aliran larutan garam untuk menarik DNA ke membran dengan adanya gaya kapiler yang ditimbulkan bahan penyerap seperti kertas dan tisu. Transfer kapiler hingga saat ini masih populer digunakan karena selain caranya cukup mudah, biaya relatif murah efisiensinyapun cukup tinggi. Metoda ini memerlukan waktu transfer yang relatif lama (12-16 jam), yang membuat gel beresiko mengalami dehidrasi. Transfer elektroforesis pada mulanya dikembangkan untuk transfer protein, dapat menekan waktu kerja tetapi tidak berkerja dengan baik pada konsentrasi buffer garam yang tinggi sehingga kurang cocok dengan buffer nitroselulosa. Transfer vakum mungkin merupakan cara yang paling ideal dengan waktu yang relatif cukup singkat (1-2 jam) mampu mentransfer DNA lebih efisien dan memberikan signal hibridisasi dua sampai tiga kali lipat dibandingkan transfer DNA kapiler (Sambrook et al. 1989)
Gen hpt Penyandi Higromisin Fosfotransferase
Modifikasi tanaman secara potensial memberikan peningkatan substansial dalam praktek pertanian, kualitas makanan dan kesehatan manusia. Kesuksesan hal ini tergantung pada kemampuan mengintegrasikan gen asing ke tanaman inang dan efisiensi regenerasi dari sel-sel tertransformasi. Efisiensi transformasi yang rendah memerlukan gen marker penyeleksi untuk mengidentifikasi tanaman transgenik (Hare 2002). Penggunaan gen marker dalam proses transformasi bertujuan memberikan keuntungan selektif untuk sel-sel
tertransformasi, sehingga mereka tumbuh lebih cepat dan lebih baik serta membunuh sel-sel non transforman (Brasileiro & Aragao 2001)
Efektifitas sistem ketahanan terhadap antibiotik tergantung terutama pada bahan seleksinya (selective agent) yang harus
sepenuhnya menghambat pertumbuhan sel-sel yang tidak tertransformasi. Konsentrasi terendah dari bahan toxic harus dapat menekan pertumbuhan sel-sel non transforman, akan tetapi tidak memberikan efek yang merusak pada sel-sel yang tertransformasi (Rodriguez & Notternburg 2002)
Gen-gen ketahanan terhadap antibiotik sebagai marka penyeleksi yang umum digunakan adalah neomisin fosfotransferase II (nptII) dan higromisin fosfotransferase
(hpt). Higromisin biasanya lebih toksik
dibandingkan kanamisin dan membunuh sel-sel sensitif lebih cepat (Rodriguez & Notternburg 2002) serta merupakan sistem marker ketahanan antibiotik yang lebih disukai untuk transformasi pada tanaman monokotiledon terutama gramineae (Bashir
et al. 2004).
Higromisin merupakan antibiotik aminoglikosida yang diproduksi dari
Streptomyces hygroscopicus dan merupakan
sistem marker penyeleksi yang sesuai untuk sistem tanaman dan hewan. Antibiotik ini menghambat sintesis protein dengan jalan mengganggu translokasi dan menyebabkan kesalahan translasi pada ribosom 80S (Bashir
et al. 2004).
Gen hpt penyandi higromisin
fosfotransferase (hpt) juga dikenal sebagai
aminoglykosida 4 - fosfotransferase (APH 4) dan dinotasikan dengan hpt, hph atau aphIV
(Rodriguez & Notternburg 2002). Gen ini diisolasi dari Eschirichia coli. Enzim
higromisin fosfotransferase yang dihasilkan gen hpt, dapat mendetoksifikasi aminosiklitol
antibiotik higromisin B (Rodriguez & Nottenburg 2002) dan mengkatalisis fosforilasi kelompok hydroksil dalam antibiotik higromisin sehingga membuatnya menjadi tidak aktif (Brasileiro & Aragao 2001).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan untuk isolasi DNA meliputi: daun tanaman padi, isolation buffer S (Tris-HCl pH 8.0 110 mM,EDTA 55 mM
pH 8.0 dan CTAB 1.1%);, N2 cair,buffer TE
(Tris-HCl pH 8.0 10 mM dan EDTA 1 mM pH 8.0) kloroform:isoamylalkohol(24:1), isopropanol, etanol 70%, etanol 96%, buffer TE (Tris-HCL pH 8.0 10 mM dan EDTA pH 8.0 1 mM). Bahan-bahan yang digunakan untuk analisis Southern blot ialah: Qiagen™ plasmid midi kit, Southern Alkphos kit, DNA tanaman, dH2O, agarose gel dan buffer Tris
Boric Acid EDTA (TBE), ultra pure™
agarose. Bahan bahan yang digunakan untuk uji higromisin adalah: higromisin 5% ,air akuades steril dan gelatin 10%. Tanaman padi transgenik generasi ketiga (T3) sebanyak
17 galur dari cv Rojolele, kontrol Rojolele, cv Asahan dan cv Kencana Bali.
Alat-alat yang digunakan antara lain: sarung tangan, seperangkat mikro pipet, freezer dan kulkas, nitogen cair, inkubator
with shaker, sentrifuse mikro dan makro,
rotator, gene quant, dry bath, water bath, vortex, vakum, seperangkat alat foto gel (Gel Doc UV), microwave, autoklaf, penggerus, , oven, UV cross linker, botol hibridisasi dan alat-alat lain yang digunakan dalam teknik Southern blot, alat penyemprot, gelas ”automizer”, kompresor dan alat penyemprot air (“Sprinkle irrigation”).
Metode Penelitian Penanaman Bibit
Penanaman dilakukan terhadap 17 galur tanaman padi transgenik penyandi asam salisilat yang terseleksi dari tanaman cv Rojolele, 1 galur kontrol Rojolele (non transgenik),1 galur cv Asahan (kontrol positif tahan serangan blas) dan 1 galur cv Kencana Bali (kontrol negatif rentan serangan blas), akan ditanam dan digunakan dalam penelitian ini. Masing masing galur ditanam 10 bibit dengan 3 ulangan.
Uji Higromisin
Uji higromisin dilakukan dengan menggunakan larutan higromisin 5% dan larutan kontrol (tanpa higromisin), uji dilakukan pada daun padi stadia bibit, pada daun uji diberi 2 tanda berupa bundaran berdiameter 0,5 cm dengan menggunakan spidol pada pangkal daun dan tengah daun. Satu lingkaran ditetesi dengan larutan higromisin dan lingkaran lainya dengan larutan tanpa higromisin sebagai kontrol. Pengamatan terhadap daun dilakukan 3 hari setelah penetesan dengan mengamati gejala nekrotik pada lingkaran tersebut.
Produksi Cendawan M.grisea
Media produksi OMA (Oatmeal Media Agar) dibuat dengan mencampurkan bahan-bahan antara lain pati larut air (soluble starch) 2%, glukosa 1%, soybean meal 1.5%, CaCO3 0.3%, oatmeal 10 %, agar 2%, dan
akuades, pH ditera hingga pH 7.0. Semua bahan dicampur hingga homogen, disterilisasi dengan autoklaf 121oC, 15 atm
selama 15 menit, kemudian dituang ke cawan petri steril dengan volume masing-masing 30cm.
Uji Ketahanan Terhadap Blas
Pengujian dilakukan tidak pada semua tanaman transgenik tetapi hanya yang tahan terhadap uji higromisin. Rancangan yang digunakan adalah acak lengkap (RAL) dengan 3 ulangan terdiri dari 10 bibit per ulangan. Data dianalisis menggunakan sidik ragam dengan tingkat kepercayaan 95%. Tanaman yang tahan terhadap serangan selanjutnya dianalisis dengan teknik Southern blot.
Produksi Cendawan
Pembuatan Inokulum. Isolat jamur P.
oryzae ras 173 diperoleh dari koleksi
laboratorium mikologi Balitpa Bogor. Biakan murni dikultur pada medium PDA dalam cawan petri selama 5 hari untuk memperbanyak koloni. Selanjutnya dilakukan sub kultur dari medium PDA (potato dextrose agar) ke medium OMA dan diinkubasi selama 10 hari pada suhu kamar di dalam inkubator bercahaya.
Pembuatan Suspensi Konidia Suspensi
konidia dibuat dengan terlebih dahulu dilakukan penggosokan miselia yang tumbuh pada permukaan medium OMA (oatmeal agar). Penggosokan miselia dengan menggunakan kuas bulu gambar No. 10 dan air steril yang telah dibubuhi streptomicin 0.01 gr/liter air. Setelah miselia udara bersih terbuang selanjutnya biakan tersebut diletakan dalam inkubator selama 2 hari pada suhu kamar dan disinari lampu TL 10 W. Kemudian dilakukan penggosokan koloni untuk mendapatkan suspensi konidia. Penggosokan menggunakan kuas gambar No. 10 dan air steril yang dicampur dengan tween 20 sebanyak 0.02%. Suspensi yang didapat disaring dengan kain kasa dan ditampung dalam gelas erlenmeyer.
Inokulasi. Inokulasi dilakukan setelah
tanaman padi berumur 18 hari dengan cara menyemprotkan suspensi konidia dengan konsentrasi 2x105 konidium/ml dengan
volume semprot 200 ml per ulangan.
Penyemprotan dilaksanakan di dalam rumah kaca yang telah dikondisikan agar kadar kelembapanya tinggi (90%). Dalam kamar kaca tersebut, pot-pot persemaian yang telah diinokulasi dengan isolat P. oryzae
ditempatkan di atas meja kayu dan sekeliling dinding kamar kaca ditutup dengan kain blacu. Lantai diusahakan tetap lembab dengan membiarkan air tergenang dan pada bagian atas pot digantungkan alat penyemprot air (Sprinkle irrigation) yang
menyemburkan air dalam bentuk embun. Penyemburan air berlangsung selama 24 jam setiap hari.Parameter yang diamati adalah menghitung jumlah bercak yang terjadi pada tiap daun tanaman serta menentukan kala kerusakan. Skala kerusakan menggunakan standar evaluasi Internasional Rice Testing Program (IRTP 1988) dengan kriteria sebagai berikut:
Skala
0= tidak ada bercak
1= bercak sebesar ujung jarum 2 =bercak lebih besar dari ujung
jarum
3 = bercak nekrotik abu-abu, bentuk bundar, agak lonjong, panjang 1-2 mm dan tepi coklat
4 = bercak khas blas, panjang 1-2 cm, luas daun terserang kurang dari 2%
5 =bercak khas blas, luas daun terserang kurang dari 10%
6 =bercak khas blas, luas daun terserang antara 11%-25%
7 =bercak khas blas, luas daun terserang 26%-50%
8 =bercak khas blas, luas daun terserang antara 51%-75%
9= semua daun mati Perhitungan chi kuadrat:
(Oi – Ei)2
σ = --- Ei
Oi adalah nilai pengamatan fenotipe ke-i
Ei adalah nilai harapan fenotipe ke-i
Southern Blot
Isolasi dan Purifikasi DNA.DNA untuk
analisis Southern blot diisolasi dari daun tanaman padi masing masing 2 individu tanaman dari galur yang diuji sehingga total individu 16, yang diambil secara acak. Teknik isolasi menggunakan modifikasi metode CTAB. Daun sebanyak ±2 gram digerus dengan penambahan nitrogen cair ,dimasukan ke dalam tube 50 ml yang berisi 7 ml buffer S (650C) kemudian ditambahkan
7 ml SDS 20%. Masukan tube berisi daun ke dalam oven 65oC selama 1 jam dan sesekali
dihomogenkan. Selanjutnya ditambahkan 7 ml kloroform (setelah suhu larutan turun) dan diinkubasikan di atas rotator selama 15 menit kemudian disentrifuse 15 menit 6000 rpm, suhu 4oC. Supernatan dipisahkan ke tube
baru dan ditambahkan 3,6 ml isopropanol lalu disentrifuse kembali pada 6000 rpm selama 30 menit. Supenatan dibuang dan pelet dicuci dengan alkohol 70% serta ditambahkan 7 ml ammonium asetat 7.5 M, tube dibolak-balikkan perlahan-lahan hingga terbentuk benang-benang DNA. Tabung disentrifuge selama 5 menit pada kecepatan 3000 rpm pada suhu 4oC selama 20 menit.
Supernatan di buang dan pellet ditambahkan buffer TE pH 8 sebanyak 4 ml. Larutan dapat dipindahkan ke dalam 1,5 ml dan disimpan dalam suhu –20oC. Purifikasi DNA
dilakukan dengan menambahkan fenol yang volumenya sama ke dalam tube dan sentrifuse pada 10000 rpm selama 5 menit. Lapisan atas diambil dan ditambahkan kloroform: isopropanol (24 : 1) dan disentrifuse 10000 rpm selama 2 menit. Lapisan atas dipisahkan dan ditambahkan larutan ammonium asetat 7,5M sebanyak 0,5X volume total dan ditambahkan etanol absolut 2X volume total. Larutan dapat diinkubasi selama 18 jam pada suhu 45oC.
Larutan kemudian disentrifuse pada 10000rpm selama 15 menit. Supernatan dibuang dan pelet dicuci dengan etanol 70%. DNA dilarutkan dengan menggunakan TE pH 8 sebanyak 4 ml dan ditambahkan RNAse 10 ng/µL sebanyak 2µL. Untuk melihat hasil isolasi, sampel DNA dirunning
dengan gel agarose 1%.
Isolasi Plasmid untuk Probe. Isolat
E.coli ,yang mengandung plasmid
pCAMBIA 1300 tersisipi gen entC dan pmsB
(pSA), diambil dan ditumbuhkan dalam media LB cair 100ml yang ditambahkan 10mg/L tetrasiklin dan 50mg/L kanamycin dan diinkubasi dengan shaker 200 rpm pada suhu 37oC selama 18 jam. DNA diisolasi
menggunakan Qiagen™ plasmid midi untuk volume medium (midi-prep). Kultur cair
bakteri akan disentrifuse pada 6000 rpm selama 15 menit dengan suhu 4oC. Pelet
diambil dan ditambahkan 4 ml buffer P1, 4 ml buffer P2 dicampur perlahan. Tambahkan 4 ml buffer P3 dan inkubasi di es selama 15 menit kemudian disentrifuse selama 30 menit pada 13000 rpm dengan suhu 4oC.
Supernatan dipindahkan ke tube 1,5 ml dan disentrifuse pada set sama seperti sebelumnya sekali lagi. QIAGEN-tip 100 dibersihkan dengan 4 ml buffer QBT dan biarkan mengalir sesuai gaya gravitasi. Masukkan supernatan dan biarkan DNA
terikat dalam QIAGEN-tip 100 kemudian QIAGEN-tip 100 dicuci dengan menggunakan 2 X 10 ml buffer QC dan larutkan DNA yang tersaring dalam QIAGEN-tip 100 dengan buffer QF. Presipitasi DNA dilakukan dengan menambahkan 3.5 ml isopropanol dan disentrifuse pada 11000 rpm pada suhu 4oC.
Pelet dicuci dengan 70% etanol dan dikeringanginkan. Setelah kering pelet dilarutkan dengan 500µL buffer TE pH 8. hasil PCR selanjutnya dirunning dalam
agarose gel elektroforesis 1%.
DNA plasmid hasil isolasi selanjutya digunakan sebagai probe. Probe dipersiapkan dengan cara melakukan PCR (polymerase chain reaction). Teknik PCR ini berguna
untuk mengamplifikasi DNA target. DNA target yang akan diamplifikasi adalah hpt dan pmsB. Volume yang dibutuhkan untuk 1X
reaksi adalah 25µL dengan komposisi sebagai berikut: 1X buffer PCR yang mengandung Mg, dNTP 0,05mM, enzim taq polymerase 0,05µL, primer hpt forward
(5’GATGCCTCCGCTCGAAGTA GGG3’)
dan hpt reverse (5’GCATCTCCCGCCC
GTGACAC3’), 1µL DNA plasmid hasil isolasi dan air hingga volume reaksi mencapai 25µL. Reaksi yang sama juga berlaku untuk PCR gen pmsB, dan posisi hpt forward dan hpt reverse diganti dengan pmsB forward dan reverse. Kondisi PCR
untuk gen hpt adalah satu siklus denaturasi
(95oC selama 10 menit) dan 35 siklus
amplifikasi (denaturasi 95oC selama 1
menit,annealing 55oC selama 1 menit,
sintesis 72oC 1 menit) dan 72oC kemudian
4oC. Kondisi yang sama berlaku untuk
amplifikasi gen pmsB.
Pita hasil PCR dipotong dari gel dan dipurifikasi menggunakan metode sephaglass brad kit. Cara kerja yang dilakukan adalah sebagai berikut: gel ditimbang (berat tube kosong ditimbang terlebih dahulu) dan ditambahkan dengan larutan gel solubilizer
(5µL GAA 50% dan gel solubilizer). Volume
larutan diberikan sesuai dengan berat gel. Jika berat gel ≤250mg maka volume yang ditambahkan adalah 250µL, jika berat gel
≥250µL maka penambahan larutan gel adalah sebanyak berat gel tersebut. Larutan diinkubasi pada suhu 60oC sampai semua gel
larut. Lalu sephaglas ditambahkan sebanyak 1/50 jumlah gel solubilazer dan disentrifuse
selama 10 menit pada 6000 rpm suhu 4oC.
Supernatan dibuang dan ditambahkan wash buffer sebanyak 8X jumlah sephaglass lalu
dibuang. Pelet dikeringanginkan dan kemudian ditambahkan elution buffer lalu
4oC. Supernatan siap dipindahkan ke tube
baru. Konsentrasi DNA hasil isolasi dapat diukur dengan elektroforesis gel 1% dengan menggunakan larutan DNA standar yang telah diketahui konsentrasinya (50ng/µL, 100 ng/µL, 200ng/µL dan 300ng/µL) atau dengan menggunakan metode gene quant.
Persiapan Membran. DNA genomik
tanaman hasil isolasi dengan kualitas baik selanjutnya dipotong dengan menggunakan enzim restriksi. Untuk DNA pelacak (probe)
hpt maka DNA genom dipotong dengan
menggunakan enzim Hind III sedangkan
untuk pelacak pmsB DNA genom dipotong
dengan menggunakan enzim Nco I. Proses
pemotongan genom dilakukan pada suhu 37
oC selama 18 jam. DNA yang telah dipotong
selanjutnya dirunning pada gel agarose 0,8%
dalam buffer TBE 0,5X. Running DNA dalam gel dilakukan selama 15 menit dan dicuci dengan air selama 15 menit. Gel hasil
staining diamati dibawah sinar UV.
Blotting. Gel dicuci dengan dH2O
selama 5 menit, direndam dalam larutan depurinasi selama 15 menit, dicuci dengan dH2O selama 20 menit, direndam dalam
larutan denaturasi selama 20 menit yang dilakukan 2x, cuci dengan dH2O selama 20
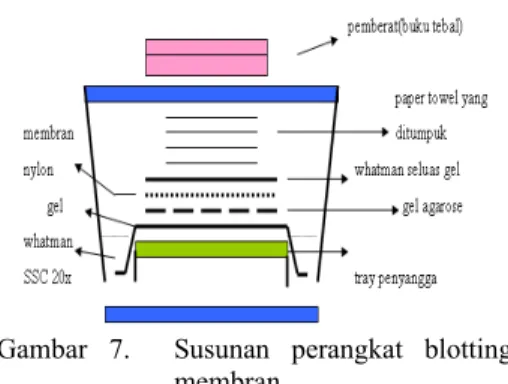
menit, rendam dalam larutan netralisasi selama 20 menit yang dilakukan 2x. Kertas saring Whatman disiapkan 2 lembar, lembar ke-1 seluas gel, yang dibasahi dengan larutan SSC 2x, lembar ke-2 untuk lapisan dasar, dipotong berlebih selebar tray, panjangnya sampai menjulur ke dasar tray, pasang diatas tray lalu basahi kertas dengan larutan SSC 20x. Peralatan disusun seperti pada Gambar 7. Blotting dilakukan selama 20 jam.
Membran diangkat dan direndam dalam larutan SSC 2x selama 1 menit, lalu dikeringanginkan. Gel yang telah di blotting
kemudian distaining dalam EtBr 7% selama 10 menit di rotator, lalu dicuci dengan dH2O
selama 10 menit. Kemudian gel diamati dibawah sinar UV, kegiatan ini dilakukan untuk melihat efisiensi transfer DNA ke membran. Membran kemudian dipaparkan di UV dengan menggunakan UVCrosslinker
dengan energi = 120.000 joule, selama 5 menit (imobilisasi). Selanjutnya membran siap untuk dihibridisasi dengan probe.
Gambar 7. Susunan perangkat blotting membran
Hibridisasi. Tujuannya adalah untuk
menghibrid pasangan homolog DNA probe dengan DNA genomik. Pelabelan dilakukan mengikuti prosedur Alkhpos Southern kit. Bufer hibridisasi dari kit dibuat sebanyak 100 ml, tambahkan NaCl sebanyak 2,92 gr dan
blocking reagent sebanyak 4 gr (w/v)
campurkan secara perlahan dengan stirer selama 1-2 jam.
Membran dipotong untuk memisahkan lambda Hind III dan sampel Nco I. Masing
masing 30 ml buffer hibridisasi dimasukkan ke dalam botol hibridisasi, untuk membran yang akan diprobe dengan pmsB dan hpt.
Pemanasan awal dilakukan selama kurang lebih 2 jam dengan suhu 55oC. Pelabelan
probe dilakukan dengan cara memanaskan DNA probe yang konsentrasinya 100 ng/µL dalam air mendidih selama menit kemudian disimpan dalam es segera, setelah itu DNA fragmen dicampurkan 10µL reaction buffer, labelling reagent 2µL dan crosslink 10µL.
kemudian dibiarkan dalam suhu 37 oC
selama 30 menit. Selanjutnya DNA probe yang telah dilabel dimasukkan ke dalam botol hibridisasi yang berisikan larutan hibridisasi dan membran dan diinkubasi dalam oven pada suhu 55oC selama 18 jam.
Deteksi. Membran hasil hibridisasi
dicuci dengan menggunakan primary wash
buffer (MgCl2 1M, NaH2PO4 pH 7 0.5M,
urea 120 gr, SDS 1 gr, NaCl 8,7 gr, blocking reagent 2 gr) sebanyak 500 ml yang
ditambahkan ke dalam tabung hibridisasi dan inkubasikan pada 55oC selama 10 menit
kemudian lakukan sekali lagi pada suhu ruang. Membran dicuci dengan secondary wash buffer (tris base 1M dan NaCl 2M)
sebanyak 500 ml selama 10 menit. Membran kemudian diletakkan dalam plastik dan diteteskan larutan deteksi CDP star ke permukaan DNA membran secara merata. Kemudian membran diexpose dengan kertas
film selama 2 jam (pemasangan membran dan foto dilakukan dalam ruang gelap). Hasil
dari transfer mebran dapat terlihat pada foto.
gelap. Film direndam dalam larutan
developer (ilford rapid fixer) selama 5 menit
lalu film direndam dalam larutan stopper
(air) selama 40 detik, terakhir film direndam dalam larutan fixer (ilford ilfotec lc 29)
selama 4 menit
HASIL DAN PEMBAHASAN Uji Higromisin
Uji higromisin merupakan tahap analisis awal menseleksi galur-galur untuk menduga keberadaan gen entC dan pmsB karena
gen-gen tersebut berada dalam daerah T-DNA. Uji higromisin dilakukan saat tanaman berumur ±2 minggu. Gen hpt adalah
penyandi sintesis antibiotik higromisin. Gen
hpt disisipkan bersamaan dengan kaset entC
dan pmsB yang berfungsi sebagai penanda,
sehingga dapat segera dilakukan analasis awal untuk membedakan tanaman transgenik dan non transgenik berdasarkan gen penanda tersebut (Wang et al. 1997). Hasil
pengamatan dipaparkan pada Gambar 9 dan contoh kondisi daun pada Gambar 8.
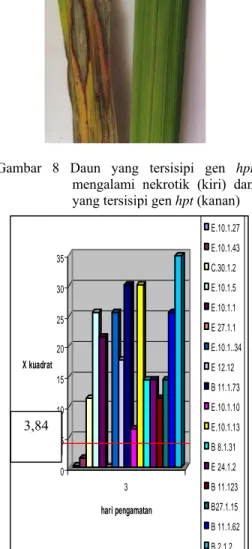
Hasil pengujian menunjukan bahwa pada lingkaran daun yang ditetesi larutan higromisin akan menunjukan gejala nekrotik apabila tanaman tersebut tidak mengandung gen penanda hpt Sedangkan pada daun yang
tanamanya diduga mengandung gen hpt,
lingkaran tersebut tetap segar. Hal ini disebabkan karena tanaman tersebut mampu mendegradasi antibiotik hpt sehingga
menjadi tidak toksik bagi tanaman tersebut Hasil pengamatan selanjutnya diuji dengan chi kuadrat untuk melihat pola segregasi gen
hpt tersebut. Diharapkan gen hpt dapat
tersegregasi secara Mendelian (3:1) sehingga gen tersebut dapat terus diwariskan pada turunanya. Diharapkan pula keberadaan gen penanda ini selalu disertai oleh gen-gen target (pmsB dan entC) karena gen-gen
tersebut berada dalam satu T-DNA. Daerah T-DNA ini akan masuk ke dalam genom tanaman. Berdasarkan data tersebut didapatkan 2 galur yang bersegregasi secara Mendelian berdasarkan uji chi kuadrat dan dinyatakan secara ekspresif gen hpt yang
mensintesis higromisin berhasil terintegrasi ke dalam genom kedua tanaman tersebut yaitu galur E 10.1.27 dan E 10.1.43 dengan jumlah tanaman yang tahan masing masing sebanyak 20 dan 18 tanaman
Gambar 8 Daun yang tersisipi gen hpt
mengalami nekrotik (kiri) dan yang tersisipi gen hpt (kanan)
.
Gambar 9 . Hasil pengamatan uji higromisin
Uji Hayati dengan Cendawan Blas
Uji hayati dengan cendawan blas (M.grisea) ini dilakukan terutama pada galur
galur yang tahan terhadap higromisin namun beberapa galur lain hasil transformasi tetap disertakan. Pengujian dilakukan saat tanaman berumur 21 hari. Hasil pengamatan yang dilakukan setelah 3 hari inokulasi tersaji pada tabel-tabel di bawah
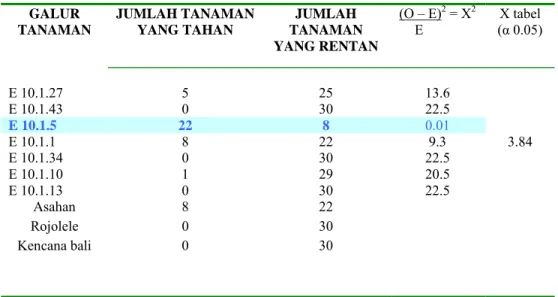
Pada Tabel 1 terlihat bahwa pada daun pertama (planula) sub galur E.10.1.5 menunjukkan ketahanan terhadap serangan blas. Jumlah tanaman yang tahan sebanyak 22 individu. Perhitungan statistik memiliki Ehitung yang lebih kecil dari Xtabel sehingga
data yang diamati sesuai dengan nisbah 3:1 (Mendelian). Sedangkan pada semua kontrol c.v Rojolele (kontrol isogenik), c.v Asahan (kontrol tahan) dan c.v Kencana Bali (kontrol
0 5 10 15 20 25 30 35 X kuadrat 3 hari pengamatan E.10.1.27 E.10.1.43 C.30.1.2 E.10.1.5 E.10.1.1 E 27.1.1 E.10.1..34 E 12.12 B 11.1.73 E.10.1.10 E.10.1.13 B 8.1.31 E 24.1.2 B 11.123 B27.1.15 B 11.1.62 B 2.1.2 3, 84 3,84
peka) (Loedin, 2005) menunjukkan skor yang tinggi dengan jumlah individu yang terinfeksi banyak, sehingga tergolongkan tidak tahan Percobaan ini menggunakan galur blas yang bersifat super virulen (galur 173) dan terbanyak menyerang pertanaman padi di Indonesia. Lingkungan percobaan telah cukup optimum bagi pertumbuhan cendawan sehingga dapat menyebar dan menyerang tanaman secara maksimal. Diduga pula pada daun pertama ini proses sintesis dari asam salisilatnya belum berjalan dengan normal dan dan maksimal sehingga asam salisilat yang dihasilkan belum cukup melindungi tanaman dari serangan blas
Tabel 1 . Skoring gejala blas pada daun pertama (planula)
Keterangan : bold adalah galur tahan terhadap serangan blas Hipotesis : Ho : Data yang diamati sesuai dengan nisbah 3:1
H1 : Data yang diamati tidak sesuai dengan nisbah 3:1 Jika nilai X2 hitung < X tabel (db = 1, α 0.05 = 3.84) maka terima H
0 yang berarti rasio segregasinya adalah 3:1.
, sedangkan pada sub galur transgenik E.10.1.5 diduga memiliki kemampuan dalam mensintesis asam salisilat dengan sempurna sejak daun pertama muncul.
Pada hasil pengamatan daun ke-2 terlihat bahwa sub galur E.10 1.5 masih menunjukkan tingkat ketahanan terhadap blas, walaupun dengan jumlah tanaman tahan menurun menjadi 14 tanaman (Tabel 2). Selanjutnya setelah diuji dengan chi kuadrat jumlah populasi tersebut masih menunjukan segregasi Mendel (3:1). Akan tetapi pada daun kedua ini beberapa .kontrol telah menunjukan ketahanan terhadap serangan blas yaitu pada kontrol
Tabel 2 .Hasil skoring gejala blas pada daun 2
Rojolele dan Asahan. Fenomena yang terjadi diduga bahwa semua tanaman mulai mensintesis asam salisilat lebih tinggi sebagai upaya pertahanan diri. Hasil ini kurang dapat menggambarkan tingkat ketahanan antara tanaman transgenik dan kontrol
Fenomena yang terlihat pada pengamatan sebelumnya juga terjadi pada pengamatan daun ke-3 (daun yang lebih muda). Berdasarkan data Tabel 3 tidak dapat dilihat tingkat ketahanan yang sebenarnya. Diduga karena pada daun yang lebih muda ini tanaman mulai meningkatkan lagi produksi asam salisilatnya sebagai upaya pertahanan diri. Dengan demikian ini adalah suatu kejadian fisiologi alami pada tanaman, dimana
GALUR TANAMAN JUMLAH TANAMAN YANG TAHAN JUMLAH TANAMAN YANG RENTAN (O – E)2 = X2 E (X tabel α 0.05) 3.84 E 10.1.27 5 25 13.6 E 10.1.43 0 30 22.5 E 10.1.5 22 8 0.01 E 10.1.1 8 22 9.3 E 10.1.34 0 30 22.5 E 10.1.10 1 29 20.5 E 10.1.13 0 30 22.5 Asahan 8 22 Rojolele 0 30 Kencana bali 0 30 GALUR TANAMAN JUMLAH TANAMAN YANG TAHAN JUMLAH TANAMAN YANG RENTAN (O – E)2 = X2 E X tabel (α 0.05) 3.84 E 10.1.27 5 25 13.6 E 10.1.43 0 30 22.5 E 10.1.5 22 8 0.01 E 10.1.1 8 22 9.3 E 10.1.34 0 30 22.5 E 10.1.10 1 29 20.5 E 10.1.13 0 30 22.5 Asahan 8 22 Rojolele 0 30 Kencana bali 0 30
saat ada serangan tanaman mulai mengaktifkan signal signal perlindungan diri agar tanaman mampu bertahan hidup
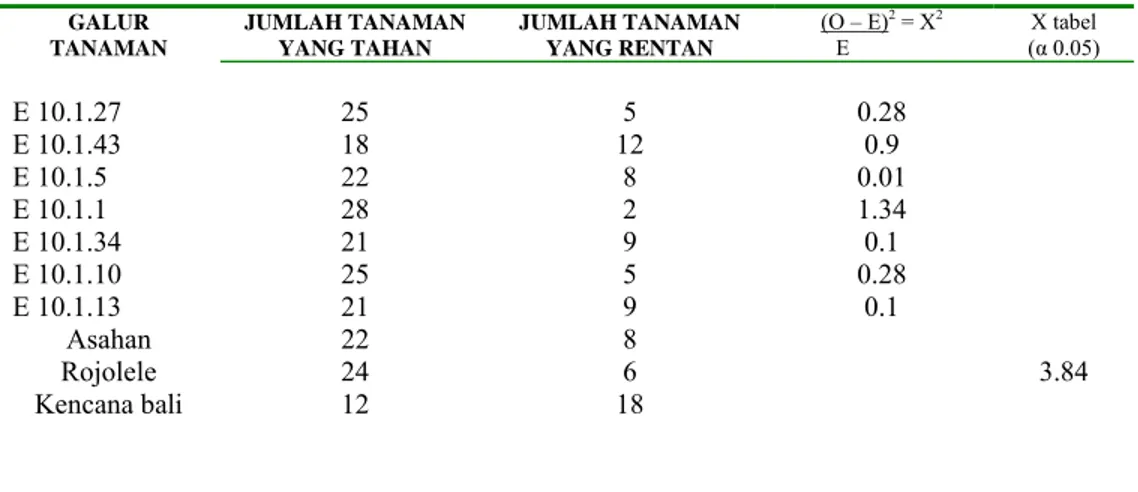
Pada daun ke-3 ini semua sampel daun tanaman transgenik, daun kontrol, kecuali kontrol peka Kencana Bali, menunjukan tingkat ketahanan yang sama terhadap penyakit blas. Berdasarkan bioassay tersebut terlihat bahwa galur E.10.1.5 merupakan kandidat transgenik unggul terhadap serangan blas, berdasarkan analisis uji khi-kuadrat dari data bioassay yang didapat pada daun 1. Kemudian seiring dengan perkembangan tanaman dan adanya serangan blas maka tanaman mulai meningkatkan produksi asam salisilat untuk pertahanan dirinya. Sehingga pada daun ke-2, ke-3 atau mungkin daun yang lebih muda lainya tidak dapat menggambarkan lagi tingkat ketahanan terhadap serangan blas, yang terkait dengan pembentukan asam salisilat.Diduga pada galur E.10.1.5 karena merupakan tanaman transgenik maka sintesis asam salisilat lebih cepat dibandingkan dengan kontrol, karena pada tanaman transgenik jalur metabolisme pembentukan asam salisilat adalah memotong jalur metabolisme alaminya. Sehingga produksi asam salisilat pada tanaman transgenik menjadi lebih cepat.
Analisis bioassay dilakukan berdasarkan Segregasi Mendel. Karena sifat dari setiap ekspresi yang diamati adalah satu (higromisin dan tahan blas) maka termasuk ke dalam monohibrid (Jusuf 2001). Maka secara hitungan matematis perbandingan sifat resesif (non transgenik) dan kodominan (transgenik) berdasar percobaan Mendel adalah 3 : 1 (Loedin 2005)
Tabel 3. Hasil skoring gejala blas pada daun 3
Southern Blot
Tanaman yang terseleksi berdasarkan uji higromisin dan bioassay selanjutnya dianalisis molekular dengan Southern blot. DNA diisolasi dari daun. Analisis Southern blot bertujuan untuk melihat integrasi kaset gen gen yang terkait dalam sintesis asam salisilat dan gen penanda hpt ke dalam genom
tanaman / inti sel tanaman (Loedin 2005). Sebelum dilakukan analisis Southern blot beberapa hal penting perlu diperhatikan agar diperoleh hasil yang baik. Hal hal tersebut diantaranya adalah persiapan DNA genom tanaman. DNA yang diisolasi harus memiliki kualitas yang baik yaitu murni dan tidak rusak. DNA yang diperoleh dapat dimurnikan menggunakan fenol untuk menghilangkan makromolekul yang berupa protein selain itu digunakan kloroform untuk mendegradasi lemak. Selain harus murni DNA juga tidak rusak / degradasi. Karena DNA rusak akan membentuk banyak potongan pita, begitu pula jika DNA dengan kualitas baik dipotong dengan enzim restriksi akan terlihat smear.
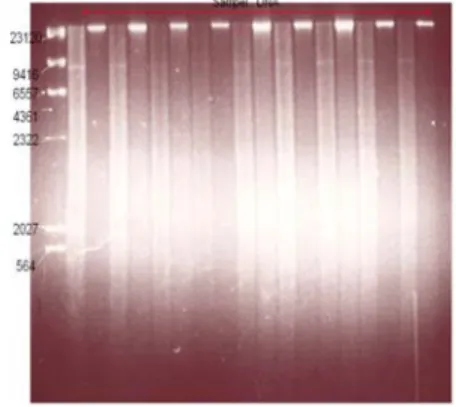
Hasil isolasi dan pemurnian dapat terlihat pada Gambar 10.
Pemotongan DNA genom, DNA dengan kualitas baik selanjutnya dipotong dengan enzim restriksi untuk tujuan hibridisasi dengan menggunakan probe hpt maka genom
dipotong dengan menggunakan enzim Hind
III. Enzim ini hanya akan memotong 1 kali potongan/pita yang akan muncul pada daerah T-DNA sehingga diharapkan jumlah yang akan muncul adalah jumlah salinan DNA hpt.
Untuk strategi lainya, DNA yang sama juga dipotong dengan menggunakan enzim Nco I
GALUR TANAMAN JUMLAH TANAMAN YANG TAHAN JUMLAH TANAMAN YANG RENTAN (O – E)2 = X2 E X tabel (α 0.05) E 10.1.27 25 5 0.28 3.84 E 10.1.43 18 12 0.9 E 10.1.5 22 8 0.01 E 10.1.1 28 2 1.34 E 10.1.34 21 9 0.1 E 10.1.10 25 5 0.28 E 10.1.13 21 9 0.1 Asahan 22 8 Rojolele 24 6 Kencana bali 12 18
Gambar 10. Hasil isolasi dan purifikasi DNA
dan hasil potongan ini akan dihibridisasi dengan probe pmsB. DNA hasil potongan
tersaji pada Gambar 11. Probe hpt dan pmsB
diperoleh dari hasil amplifikasi DNA plasmid. Probe hpt berukuran 429 bp dan probe pmsB
berukuran 335 bp. DNA probe dapat dilihat pada Gambar 12.
Proses transfer DNA ke membran (blotting) juga merupakan hal yang penting
dan menentukan keberhasilan Southern blot. Hal yang perlu diperhatikan adalah membran tidak bergelembung pada saat blotting. Jika
hal tersebut terjadi maka DNA tidak akan tertransfer sempurna ke dalam membran akibatnya pembacaan hasil Southern blot menjadi kurang jelas. Dengan demikian saat meletakkan membran di atas gel harus hati hati. Pengecekan keberhasilan transfer DNA dapat dilakukan dengan membandingkan kembali kondisi DNA dalam gel sebelum proses blotting dan setelah proses. Hasil
kegiatan blotting dapat dilihat pada Gambar
13. Hibridisasi adalah langkah penyatuan antara DNA probe dengan genom yang telah dipotong. Pada saat hibridisasi, DNA probe akan menyatu dengan DNA genom apabila pada DNA genom terdapat pasangan DNA tersebut (baik hpt dam pmsB) hal yang perlu
diperhatikan saat hibridisasi adalah dilakukanya pre-hibridisasi, ini adalah strategi yang harus dilakukan untuk menghilangkan
background pada hasil foto. Dengan
pre-hibridisasi ini, maka diharapkan hanya DNA yang benar benar bertemu pasangan yang akan muncul pada saat dilakukan deteksi.
Deteksi membran yang dilakukan dengan menggunakan CDP star kit bersifat non
radioaktif. Dengan larutan CDP ini DNA yang terhibrid akan mmberikan pendaran, dan pendaran akan ditangkap oleh lapisan film. Berdasar hasil Southern blot (Gambar 14) yang diperoleh terlihat bahwa teknik
pengerjaan yang dilakukan telah cukup baik. Hal ini didasarkan pada pita DNA dari lambda dan kontrol positif yang muncul. Dari foto hasil Southern blot (Gambar 14) didapatkan beberapa pita DNA tanaman transgenik yang menunjukan keberadaan gen hpt, yaitu pada
galur C.30.1.2.29, E.10.1.5.15, E.10.1.27.11, E.10.1.43.8 dan dengan probe pmsB pada
Gambar 11.Hasil pemotongan plasmid genom dengan enzim Hind III yang
disusun antara DNA potongan dan DNA tidak dipotong
Gambar 12. DNA fragmen hasil PCR yang digunakan sebagai probe
Gambar 13. DNA genom hasil pemotongan setelah dielektroforesis selama 18 jam (kiri) dan setelah proses transblot (kanan)
Gambar 14. Hasil foto Souther blot dari membran
galur C.30.1.2.29 ,E.10.1.15 dan E.10.1.10.29. Pita pita yang dihasilkan masing masing galur tersebut berjumlah 1. Dengan demikian diduga jumlah salinan gen hpt dan pmsB yang
terintegrasi ke dalam genom adalah satu salinan. Jumlah salinan yang demikian adalah yang diharapkan. Sehingga bila terjadi perubahan tingkat ekspresi, jika dibandingkan dengan kontrol, baik pada hasil uji higromisin dan ketahanan terhadap cendawan blas, diduga karena pengaruh dan integrasi gen gen yang ditransformasikan. Hal ini juga menunjukan kelebihan transformasi menggunakan bakteri Agrobakterium.
Jumlah dan letak kopi/salinan dalam genom sangat berperan dalam ekspresi dari gen target atau gen di dalam genom itu. Apabila jumlah salinan gen terlalu banyak tersalin di dalam genom maka kemungkinan akan menyebabkan gene silencing dari
ekspresi gen target dan gen lainya (Kumpatla 1998), namun apabila gen terkopi ke dalam genom dalam jumlah yang sedikit (1-10 salinan) maka kemungkinan tidak akan menimbulkan gene silencing (Christou 2001).
Dari hasil Southern blot pada galur
C.30.1.2.29 dan E.10.1.5.15 dan menunjukan keberadaan gen target pmsB dan gen penanda
hpt. Diduga daerah T-DNA dari tanaman A.tumefasiens terintegrasi lengkap ke dalam
gen tanaman. Sedangkan pada galur E.10.1.27.11 dan E.10.1.43.8 hanya menunjukan pita hpt. diduga wilayah T-DNA
tidak terintegrasi secara lengkap ke dalam genom tanaman. Begitu juga dengan galur E.10.1.27.11 dan E.10.1.43.8 hanya menunjukan pita hpt. diduga wilayah T-DNA
tidak terintegrasi secara lengkap ke dalam genom tanaman. Begitu juga dengan galur E.10.1.10.29 yang hanya menunjukan pita
pmsB.
Apabila hasil data Southern blot, uji higromisin dan uji ketahanan blas digabungkan terhadap 5 galur tersebut diperoleh data rangkuman seperti tersaji pada Tabel 4. Dari data diatas diperoleh bahwa galur E.10.1.43.8 dan E.10.1.27.11 memiliki ketahanan terhadap higromisin dan ini terbukti pula dengan hasil Southern blot yang didapatkan yang menunjukan pita hpt. Tetapi
galur ini tidak tahan terhadap blas dan berdasarkan hasil Souhern galur ini tidak menunjukan keberadaan gen pmsB. Galur E.10.1.5.15 memiliki ketahanan terhadap serangan blas dan hal ini berkorelasi dengan hasil Southern blot yang diprobe dengan
pmsB, tetapi sebaliknya galur ini tidak
memiliki ketahanan terhadap uji higromisin walau pada hasil Southern blot menunjukan keberadaan gen hpt. Fenomena ini diduga
disebabkan karena posisi T-DNA yang terintegrasi ke dalam genom, tepat pada posisi dimana ekspresi dari gen hpt tidak dapat
berlangsung meskipun gen tersebut ada di dalam tanaman (gene silencing /
pembungkaman gen) (Kumpatla 1998). Pada galur C.30.1.2.29 dan E.10.1.10.29 juga terjadi hal yang sama, dimana gen hpt/pmsB
tidak dapat terekspresi yang berdasarkan uji hayati blas dan higromisin gen tersebut tidak terekspresi, berlawanan dengan hasil Southern blot yang didapatkan.
Proses pembungkaman gen disebabkan oleh banyak faktor, seperti adanya gugus metil pada daerah gen terintegrasi, adanya gen lain dari tanaman yang akan menyebabkan gene silencing pada gen transforman (Kumpatla
1998)
Tabel 4. Hubungan antara data hasil Southern blot, uji higromisin dan uji hayati
blas untuk galur E.10.1.43.8,E.10.1.27.11 ,E.10.1.5.15
,C.30.1.2.29, E.10.1.10.29,
SIMPULAN DAN SARAN
simpulan
Gen higromisin 2 galur transgenik (E.10.1.27 dan E.10.1.43) terekspresi dengan baik dan pola segregasinya mengikuti hukum Mendel (3:1), sedangkan berdasarkan uji hayati dengan cendawan blas diperoleh satu galur unggulan tahan (E.10.1.5). Pengamatan tingkat ketahanan pada tanaman yang dapat dijadikan patokan adalah pengamatan padi daun pertama, sedangkan pada daun yang lebih muda tidak dapat dijadikan patokan. Hasil Southern blot menunjukan bahwa dengan menggunakan probe hpt terdapat
jumlah salinan gen masing-masing 1, yaitu pada sub galur C.30.1.2.29, E.10.1.5.15, E.10.1.10.29, E.10.1.43.8 sedangkan dengan pmsB diperoleh 3 galur yaitu
C.30.1.2.29, E.10.1.15 dan E.10.1.10.29
dengan jumlah salinan DNA masing-masing 1.
Saran
Perlu diteliti efek dari sintesis asam salisilat yang di percepat dan diperbanyak terhadap fungsi metabolisme lainya. Analisis lanjutan pada generasi selanjutnya perlu dilakukan untuk menguji kestabilan pewarisan dan ekspresi gen peyandi asam salisilat entC
dan pmsB
DAFTAR PUSTAKA
Amir M ,Kardin MK. 1991. Pengendalian penyakit jamur. Di dalam Buku 3, Bogor: Pusat Penelitian dan Pengembangan Tanaman Pangan.
Aswidinnoor H. 1995. Transformasi gen: sumber baru keragaman gGenetik dalam pemuliaan. Zuriat, 6 (2).
Baharsjah S, Kasryno F, Darmawani D. H. 1988. Kedudukan padi dalam perekonomian Indonesia. Bogor: Badan
Penelitian dan Pengembangan Tanaman Pangan.
Bashir K, Rafiq M, Fatima T, Husnain T, Riazuddin S. 2004. Hygromycin based selection of transformants in a local inbred line of Zea mays (L). Pakistan Journal of Biological Sciences.
7(3):318-323
Biro Pusat Statistik. 2002. Luas dan Intensitas Serangan Organisme Pengganggu Tanaman dan Bencana Alam Padi, Palawija, dan Sayuran di Jawa.
Jakarta: Biro Pusat Statistik.
Brasileiro ACM, Aragao FJL. 2001. Marker genes for in vitro selection of transgenic plants. J. Plant Biotechnology. 3(3) : 113-121
Brown T. 2000. Analysis of DNA Sequences by Blotting and Hybridization. Di dalam Current Protocol in Molecular Biology.USA: John Wiley and sons.
Cummins J. 2005. GM rice in India. http:/ /www.warda .cgiar.org /newsletter/ no%203 /trackingdown.html.[18 September 2005]
Choi YD and Jong-JC. 2005. The current status of GMOs development. http://www.ncbi.nlm.nih.gov/entrez/qu
No. Galur hpt pmsB Ujij blas Uji higromisin 1 E.10.1.43.8 + - - + 2 E.10.1.27.11 + - - + 3 E.10.1.5.15 + + + - 4 C.30.1.2.29 + + - - 5 E.10.1.10.29 - + - -
ery.fcgi?cmd=Retrieve&db=PubMed&l ist_uids=10632579&dopt=Abstract.[20 Januari 2006]
Christou P. Ford TL ,Kofron M 1991. Production of transgenic rice (Oryza sativa L.) plants from agronomically important indica and japonica varieties via electric discharge particle acceleration of exogenous DNA into immature zygotic embryos.
Biotechnology. 9:957-966.
Doel MT, Houghton M, Cook EA ,Carey NH. 1977. The presence of ovalbumin mRNA coding sequences in multiple restriction of chicken DNA.
Nucl.Acids Res. 4:3701-3713
Hashioka Y. 1963. Effects of Environmental Factors on Developments of Causal Fungus, Infection, Disease Developments and Epidemiology in Rice Blast Disease. http:/ /www.warda .cgiar.org.[20 Januari 2006]
IRRI. 1975. Research High Lights for 1974.
Los Banos :International Rice Research Institute,.
IRTP. 1988. Standard Evaluation System for Rice. Los Banos: International Rice
Testing Program.
Hare PD, Chua NM. 2002. Excision of selectable marker genes from transgenic plant. Nature Biotechnology. 20:575-580
Herman M. 1996. Rekayasa genetika untuk perbaikan tanaman. Bul. Agro. Bio
.1(1):24-34
Kumpatla SP, Hall TC. 1998. Organizational complexityof a rice transgene locus susceptible to methylation-based silencing.http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=P ubMed&list_uids=10632579&dopt=Ab stract.[20 Januari 2006]
Loedin HS, Mulyaningsih ES, Purwantomo S, Meiyer AH. 2005. Transformation of Aromatic Indonesian Rice and Upland Rice with Anti Fungal Genes for Blast
and Sheath Blight Tolerance.
Cibinong:Puslit Bioteknoligi LIPI Ou SH. 1985. Rice Disease. Commonwealth
Mycological . England: Kew Survey
Institute,
Rodriguez RC, Nottenburg C. 2003. Antibiotic resistance genes and their use in genetic transformation especially in plants. CAMBIA. http : www. cambiaip. org/ whitepapers/ Transgenic/ Ab_resistance /books / whole.pdf [18 September 2005]
Sambrook J, Fritsch EF ,Maniatis T. 1989.
Molecular cloning : a laboratory manual. 2nd edition.. England: Cold
Spring Harbor Laboratory Press Semangun H. 1990. Penyakit-penyakit
tanaman pangan di Indonesia.,
Yogyakarta: Gadjah Mada Press. Southern EM. 1975. Detection of specific
sequences among DNA fragments separated by gel electrophoresis.
Mol.Biol. 98:503
Van LLC. 1985. Pathogenesis-related protein.
Plant Mol. Biol. 4: 111-1166.
Verberne MC, Rob V, John FB, Jesus Mercado- Blanco and Huub JM Linthorst. 2005. Overproduction of salicilyc acid in Plants by bacterial transgenes enhances pathogen resistance. : http://biotech.nature.com
.[20 Januari 2006]
Wang M-B ,Peter MW. 1997. A rapid and simple method of assaying plants transformed with hygromycin or PPT resistance genes. Plant Mol. Biol
15:209-215
Zhao X et al. 2005. A mitogen-activated
protein kinase cascade regulating infection-related morphogenesis in
Magnaporthe grisea http :