PENGGUNAAN KOMBINASI SUHU, pH, DAN SALINITAS SEBAGAI STRESSOR TERHADAP
PERKEMBANGAN WHITE SPOT SYNDROME VIRUS (WSSV) PADA BENUR UDANG WINDU
(Penaeus monodon)
Muliani, Bunga Rante Tampangallo, dan Muharijadi Atmomarsono
Balai Penelitian dan Pengembangan Budidaya Air Payau Jl. Makmur Dg. Sitakka No. 129, Maros 90512, Sulawesi Selatan
E-mail: litkanta@indosat.net.id ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh kombinasi jenis stressor terhadap perkembangan WSSV pada benur udang windu (Penaeus monodon). Penelitian dilakukan di Laboratorium Basah Balai Penelitian dan Pengembangan Budidaya Air Payau (BPPBAP), Maros. Kontainer plastik yang bervolume 40 L sebagai wadah penelitian, diisi dengan air laut sebanyak 30 L dan dilengkapi dengan aerasi kecuali pada perlakuan tanpa aerasi. Setiap wadah ditebari benur windu (PL-13) sebanyak 500 ekor yang diambil dari panti perbenihan skala rumah tangga di Kabupaten Barru yang sebelumnya telah diketahui negatif white spot syndrome virus (WSSV) melalui analisi PCR. Perlakuan yang dicobakan adalah (A) suhu 20°C + pH 4 + salinitas 5 ppt dengan aerasi; (B) suhu 20°C + pH 4 + salinitas 5 ppt tanpa aerasi; (C) suhu 20°C + pH 4 dengan aerasi; (D) suhu 20°C + pH 4 tanpa aerasi; (E) suhu 20°C + salinitas 5 ppt dengan aerasi; (F) suhu 20°C + salinitas 5ppt tanpa aerasi; (G) pH 4 + salinitas 5 ppt dengan aerasi; (H) pH 4 + salinitas 5 ppt tanpa aerasi. Masing-masing perlakuan diulang 3 kali dengan waktu perendaman 15, 30, 45, dan 60 menit. Untuk pengecekan WSSV menggunakan PCR kompensional, contoh benur diambil sebanyak 50-100 ekor/wadah. Untuk mengetehui pengaruh perlakuan terhadap perkembangan WSSV, data dianalisis secara deskriptif melalui pembacaan pita-pita DNA hasil elektroforesis. Hasil penelitian menunjukkan bahwa kombinasi jenis stressor terbaik memicu perkembangan WSSV pada benur yang diambil dari perbenihan skala rumah tangga di Kabupaten Barru adalah kombinasi suhu 20°C + pH 4+ salinitas 5 ppt; kombinasi suhu 20°C + salinitas 5 ppt, baik dengan aerasi maupun tanpa aerasi dan pH 4 + salinitas 5 ppt dengan aerasi. Pada perlakuan ini benur udang windu positif WSSV pada taraf infeksi berat pada semua waktu perendaman. Penggunaan salinitas rendah lebih efektif sebagai stressor terhadap perkembangan WSSV jika dikombinasikan dengan stressor lainnya seperti suhu dan pH yang rendah.
KATA KUNCI: udang windu, penyakit, WSSV, PCR, screening, stressor
PENDAHULUAN
White spot syndrome virus (WSSV) adalah jenis virus yang paling banyak menginfeksi dan menyebabkan kematian pada udang. Virus ini termasuk virus DNA yang berbentuk batang (Rod) dan masuk ke dalam genus Whispovirus, famili Nimaviridae (Sanchez-Martinez et al., 2007). Tiga isolat pertama ditemukan pada tahun 1992 masing-masing di Thailand, Taiwan, dan Cina, Selanjutnya pada tahun 1999 di temukan di Amerika. Sedangkan di Indonesia serangan virus pada budidaya udang windu merebak sejak awal tahun 90-an. WSSV adalah termasuk DNA double straind dengan ukuran berkisar 292,9-307,2 kb) (Sanchez-Martinez et al., 2007).
WSSV merupakan jenis virus yang paling banyak menimbulkan kematian pada udang terutama di tambak pembesaran (Hulten et al., 2000; Dhar et al., 2001; Peng et al., 2001; Li et al., 2003; Vaseeharan et al., 2003; Kono et al., 2004; Maeda et al., 2004; Munn, 2004; Muliani et al., 2004). Menurut Lo et al. (1998), bahwa WSSV dapat menyebabkan kematian pada udang windu sebesar 100% dalam waktu 207 hari dengan tanda-tanda morfologi terdapat bintik putih di seluruh karapaks. Sedangkan Munn (2004), WSSV dapat menyebabkan kematian 80% selama 2-3 hari pada yuwana dan 7-10 hari pada udang dewasa. Laporan lain menyatakan bahwa WSSV dapat menyebabkan kematian 90%-100% selama 3-10 hari sejak adanya tanda-tanda serangan (Peinado-Guevara et al., 2006; Sanchez-Martinez et al., 2008).
Penyakit WSSV dalam Bahasa Indonesia dikenal juga dengan penyakit bintik putih. Jenis virus ini telah diidentifikasi menyerang baik udang windu, maupun organisme liar seperti udang api-api, jembret, ikan liar, kepiting, dan beberapa jenis moluska yang hidup di tambak (Muliani et al., 2004), maupun plankton dan larva insekta (Corsin et al., 2005). Hal ini menunjukkan bahwa WSSV menyerang udang baik secra vertikal maupun horisontal (Muliani et al., 2004; Sanchez-Martinez et al., 2007).
Serangan WSSV pada budidaya udang windu sangat erat kaitannya dengan benur atau tokolan udang yang digunakan, apakah benur atau tokolan tersebut sudah membawa WSSV atau tidak. Hal ini sangat erat kaitannya dengan induk yang memproduksi benur tersebut. Menurut Peng et al. (2001), induk udang yang terinfeksi WSSV sebelum memijah, 75% nauplii yang dihasilkannya akan terinfeksi WSSV. Dengan demikian kualitas induk yang digunakan sangat memengaruhi kualitas nauplii dan tentunya akan berlanjut ke postlarva yang diproduksi, dan juga hasil pentokolan di tambak. Tentunya ini akan berdampak pada keberhasilan budidaya udang di tambak. Hasil analisis WSSV dengan metode PCR kompensional seperti yang dilakukan selama ini menunjukkan perbandingan hasil PCR yang negatif masih lebih tinggi dibanding yang hasilnya positif. Hasil analisis PCR yang menunjukkan negatif belum berarti bahwa benur tersebut betul-betul bebas WSSV, akan tetapi boleh jadi sudah ada WSSV tapi karena intensitasnya rendah ataukah intensitasnya tinggi tapi prevalensinya rendah sehingga tidak dapat terdeteksi oleh metode yang digunakan. Dalam proses analisis dengan PCR, ada beberapa hal yang dapat dilakukan untuk menstimulasi agar WSSV dapat terdeteksi seperti menambah siklus PCR, menambah reagen PCR, atau bahkan mengklon sekuen DNA target dalam plasmid (Natividad et al., 2006). Perbandingan beberapa metode untuk deteksi keberadaan WSSV pada benur udang telah dilakukan oleh beberapa peneliti di Thailand (Sritunyalucksana et al., 2006), hal ini juga dimaksudkan agar hasil deteksi PCR benar-benar akurat sehingga WSSV dapat terdeteksi secara dini guna mencegah terjadinya peledakan penyakit di tambak pembesaran. Konsekuensi dari hal tersebut adalah penambahan biaya analisis. Oleh karena itu, diperlukan teknik untuk menginduksi perkembangan WSSV pada benur sebelum dideteksi dengan PCR sehingga prevalensi dan intensitasnya meningkat dan dapat terdeteksi secara dini dengan demikian peledakan WSSV pada saat budidaya dapat dicegah. Beberapa peneliti melaporkan bahwa fluktuasi salinitas, suhu, dan pH dapat memicu infeksi WSSV pada udang dan menyebakan kematian (Tendencia et al., 2010). Menurut Du et al. (2008), melaporkan bahwa tidak ada kematian pada crayfish yang telah diinfeksi oleh WSSV yang dipelihara pada suhu 10±1°C, akan tetapi terjadi kematian hingga 100% setelah dipindahkan ke suhu 24±1°C dan konsentrasi virus pada insang meningkat dari 106 menjadi 1010 copies/mg. Hal
sebaliknya terjadi pada udang kurma, di mana kematian udang yang diinfeksi WSSV lebih tinggi pada suhu 31°C dibanding pada suhu 27°C (You et al., 2010).
BAHAN DAN METODE Koleksi Contoh Benur
Sebelum dilakukan uji stressing terlebih dahulu dilakukan pengambilan sampel untuk deteksi WSSV sebagai data awal. Benur yang dideteksi sebagai data awal adalah benur yang sudah siap tebar (PL-10). Benur dimasukkan ke dalam botol sampel yang telah berisi bahan pengawet berupa ethanol 70%. Selanjutnya dibawa ke Laboratorium Patologi Balai Penelitian dan pengembangan Budidaya Air Payau (BPPBAP) untuk deteksi WSSV dengan PCR. Jika sampel awal negatif WSSV maka benur tersebut diambil untuk dilakukan uji stressing.
Persiapan Wadah dan Hewan Uji
Wadah yang digunakan dalam penelitian ini adalah kontainer plastik yang bervolume 40 L yang diisi air laut salinitas 28 ppt sebanyak 30 L (Gambar 1). Setiap wadah dilengkapi dengan aerasi sebagai sumber oksigen, kecuali pada perlakuan tanpa penggunaan aerasi. Pada perlakuan suhu rendah, suhu air dalam wadah penelitian diturunkan dengan menggunkana batu es yang sengaja dibuat dalam botol kemasan air minum, sehingga salinitas air dalam wadah tidak terpengaruh dan pada wadah penelitian dipasang termometer untuk memonitor suhu air dalam wadah penelitian sehingga tetap pada suhu yang diinginkan (suhu 20°C). Pada perlakuan pH, penurunan pH air dilakukan dengan penambahan H2SO4 pekat sambil dilakukan pengukuran hingga pH dalam wadah penelitian
mencapai konsentrasi yang diinginkan yaitu pH4, sedangkan adapun pada perlakuan salinitas, penurunan salinitas dilakukan dengan mencampurkan air tawar ke dalam wadah penelitian yang berisi air laut salinitas 28 ppt hingga mencapai salinitas 5 ppt.
Benur yang digunakan diambil dari panti perbenihan skala rumah tangga di Kabupaten Barru, Sulawesi Selatan. Benur yang akan di-stressing dibawa ke Laboratorium Basah BPPBAP dengan kantong plastik. Setiap kantong palstik diisi 2000 benur PL-11. Sebelum dilakukan uji stressing, benur udang windu ditampung pada bak penampungan. Benur yang akan ditebar pada bak penampungan terlebih dahulu diadaptasikan dengan mengapung-apungkan kantong plastik dalam bak penampungan kurang lebih 30 menit. Kantong plastik kemudian dibuka dan secara perlahan-lahan benur dibiarkan keluar dari kantong. Benur ditampung pada bak penampungan selama 2 hari sebelum uji stressing dilakukan (Gambar 2). Hal ini dimaksudkan agar benur dalam keadaan sehat sebelum distreskan sehingga jika benur mengalami stres pada saat perlakuan, maka hal tersebut disebabkan karena pengaruh pelakuan. Setelah ditampung selama 2 hari benur kemudian ditebar dalam wadah penelitian sebanyak sebanyak 500 ekor/wadah.
Gambar 1. Kontainer plastik yang digunakan sebagai wadah untuk uji stressing
Uji Stressing dan Sampling
Uji stressing dilakukan di Laboratorium Basah Balai Penelitian dan Pengembangan Budidaya Air Payau (BPPBAP). Penelitian diset dalam rancangan acak lengkap (RAL) dengan perlakuan kombinasi jenis stressor yaitu; (A) suhu 20°C + pH 4 + salinitas 5 ppt dengan aerasi; (B) suhu 20°C + pH 4 + salinitas 5 ppt tanpa aerasi; (C) suhu 20°C + pH 4 dengan aerasi; (D) suhu 20°C + pH 4 tanpa aerasi; (E) suhu 20°C + salinitas 5 ppt dengan aerasi; (F) suhu 20°C + salinitas 5 ppt tanpa aerasi; (G) pH 4 + salinitas 5 ppt dengan aerasi; (H) pH 4 + salinitas 5 ppt tanpa aerasi; masing-masing perlakuan diulang 3 kali sehingga terdapat 24 unit perlakuan. Sampling dilakukan setelah 15, 30, 45, dan 60 menit perendaman dengan mengambil 50-100 ekor/wadah. Jika pada saat sampling terdapat benur yang stres maka diambil benur yang stres dan selanjutnya diawetkan dalam larutan ethanol 70% yang telah disiapkan. Sampel kemudian dibawa ke Labaoratorium Kesehatan Ikan Lingkungan BPPBAP untuk analisis WSSV dengan metode PCR kompensional.
Deteksi WSSV dengan Teknik PCR
Benur yang telah diawetkan dalam larutan ethanol 70% kemudian diekstrak menggunakan kit ekstraksi DNA untuk mendapatkan total DNA. Kemudian DNA WSSV diamplifikasi dengan teknik First dan Nested PCR menggunakan kit amplifikasi spesifik WSSV (IQ 2000TM WSSV Detection and Prevention System) (Anonim, 2002), kemudian visualisasi DNA WSSV dilakukan dengan gel dokumentasi. Untuk mengetahui pengaruh perlakuan terhadap perkembangan WSSV, data dianalisis secara deskriptif melalui pembacaan pita-pita DNA hasil elektroforesis dengan membandingkan dengan kontrol positif (Suwanto et al., 2000; Anonim, 2002; Sulandari & Zei, 2003).
HASIL DAN BAHASAN
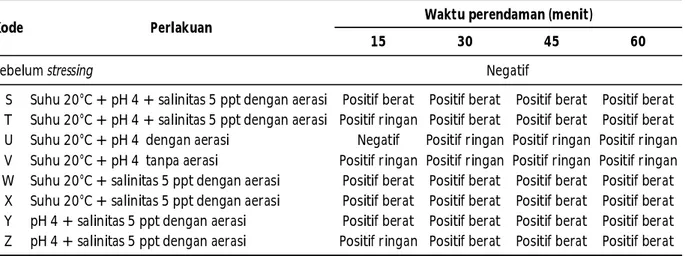
Hasil uji stressing pada penelitian ini disajikan pada Tabel 1. Pada Tabel 1 terlihat bahwa sebelum dilakukan uji stressing benur udang windu yang diambil dari panti perbenihan skala rumah tangga yang ada di Kabupaten Barru menunjukkan hasil yang negatif WSSV dan setelah diuji stressing dengan beberapa kombinasi faktor stres, beberapa perlakuan menunjukkan hasil positif WSSV.
Pada penelitian ini terlihat bahwa pada perlakuan kombinasi suhu 20°C + pH 4 + salinitas 5 ppt baik dengan ada aerasi mapun tidak ada aerasi menunjukkan hasil positif dengan tingkat infeksi pada taraf berat dan terjadi pada semua waktu perendaman, hal ini menunjukkan bahwa dengan kombinasi ketiga faktor stres tersebut mampu menginduksi WSSV pada benur sehingga terdeteksi dengan tingkat infeksi berat melalui teknik PCR kompensional yang digunakan. Selanjutnya kombinasi suhu 20°C + salinitas 5 ppt baik dengan adanya aerasi maupun tanpa aerasi juga menujukkna hasil positif dengan tingkat infeksi berat. Hal ini menunjukkan bahwa kombinasi kedua faktor tersebut efektif sebagai bahan stressor pada screening benur. Sebagaimana diketahui bahwa ketiga parameter Tabel 1. Hasil analisis PCR benur udang windu yang berasal dari panti perbenihan skala rumah
tangga di Kabupaten Barru sebelum dan sesudah uji stressing
15 30 45 60
S Suhu 20°C + pH 4 + salinitas 5 ppt dengan aerasi Positif berat Positif berat Positif berat Positif berat T Suhu 20°C + pH 4 + salinitas 5 ppt dengan aerasi Positif ringan Positif berat Positif berat Positif berat
U Suhu 20°C + pH 4 dengan aerasi Negatif Positif ringan Positif ringan Positif ringan
V Suhu 20°C + pH 4 tanpa aerasi Positif ringan Positif ringan Positif ringan Positif ringan W Suhu 20°C + salinitas 5 ppt dengan aerasi Positif berat Positif berat Positif berat Positif berat X Suhu 20°C + salinitas 5 ppt dengan aerasi Positif berat Positif berat Positif berat Positif berat Y pH 4 + salinitas 5 ppt dengan aerasi Positif berat Positif berat Positif berat Positif berat Z pH 4 + salinitas 5 ppt dengan aerasi Positif ringan Positif berat Positif berat Positif berat
Kode Perlakuan Waktu perendaman (menit)
kuliatas air ini (suhu, pH, dan salinitas) merupakan parameter kunci keberhasilan budidaya. Oleh karena itu, ketiga parameter tersebut juga paling sering digunakan dalam melakukan uji stressing baik secara bersama-sama maupun sendiri-sendiri untuk mengetahui vitalitas larva. Beberapa hasil penelitian menunjukkan bahwa ketiga parameter ini selain digunakan pada larva udang juga digunakan pada larva kepiting rajungan (Ashraf et al., 2010; Talpu & Ikhwanuddin, 2012). Suhu, pH, dan salinitas merupakan parameter yang memegang peranan penting terhadap keberhasilan budidaya di tambak. Murdjani et al. (2007) melaporkan bahwa suhu air di tambak ideal untuk budidaya udang windu intensif adalah 26°C–29°C. Sedangkan menurut Lu-Qing et al. (2007), bahwa suhu air merupakan faktor lingkungan yang berpengaruh pada metabolisme, konsumsi oksigen, pertumbuhan, dan sintasan udang yang dibudidayakan. Fluktuasi suhu yang ekstrim dan suhu air yang rendah merupakan penyebab terjadinya infeksi WSSV, hal ini disebabkan karena pada suhu rendah, WSSV akan menggandakan diri lebih cepat. Menurut Tendecia et al. (2010b), bahwa fluktuasi suhu pada tambak yang terserang WSSV lebih tinggi (9,5°C) dibanding fluktuasi suhu (4,75°C) pada tambak yang tidak terinfeksi WSSV. Sebaliknya, infeksi WSSV pada udang windu dapat ditekan pada suhu air yang lebih tinggi dan fluktuasi salinitas yang kecil, di mana pada saat itu keberadaan bakteri vibrio yang koloninya kuning lebih tinggi daripada yang koloninya hijau. Demikian pula yang dilaporkan oleh You et al. (2010) bahwa suhu yang lebih tinggi (31±0,5°C) sangat nyata mengurangi kematian udang yang terinfeksi WSSV dibanding suhu rendah (27±0,5°C) dan hal ini menunjukkan bahwa suhu yang tinggi menghambat replikasi virus WSSV dan sekaligus meningkatkan respons imun udang. de la-Vega et al. (2007) melaporkan bahwa penyebab stres pada udang yang akan berakibat kepada timbulnya penyakit adalah kondisi lingkungan yang menurun dan penanganan yang buruk.
Rahmann et al. (2007) melaporkan bahwa suhu 33°C efektif mencegah penyakit, menurunkan tingkat kematian udang, dan mencegah terjadi replikasi WSSV pada stadia awal infeksi WSSV. Sedangkan Vidal et al. (2001) melaporkan bahwa ditemukan kematian 100% pada udang yang terserang WSSV yang dipindahkan dari 32°C ke 25,8±0,7°C. Hal ini sejalan dengan hasil penelitian Rahman et al. (2006), yang menyatakan bahwa secara in-vivo suhu tinggi menghambat ekpresi envelop protein P28, sehingga menghambat replikasi WSSV. Demikian pula yang dilaporkan oleh Raj et al. (2012), bahwa tingkat kematian udang yang terinfeksi WSSV dapat ditekan pada suhu yang lebih tinggi.
Kombinasi stessor selanjutnya yang memperlihatkan hasil positif pada taraf infeksi berat adalah pH 4 + salinitas 5 ppt baik dengan adanya aerasi maupun tanpa aerasi. Dari hasil tersebut diketahui bahwa penggunaan pH rendah sebagai stressor baik dikombinasikan dengan suhu rendah dan salinitas rendah maupun kombinasi dengan salinitas rendah saja, mampu merangsang perkembangan WSSV pada benur. Hal ini menunjukkan bahwa pH merupakan salah satu parameter stressor yang cukup efektif.
Menurut beberapa laporan bahwa pH merupakan salah satu faktor pembatas pada proses budidaya, karena sangat berpengaruh terhadap proses metabolisme dan fisiologis udang, berefek kepada pertumbuhan dan sintasan udang. Pada pH air yang rendah (5,9) menyebabkan pertumbuhan udang windu menurun akibat stres. Penurunan pH air dari 7,0 menjadi 6,5 menyebabkan tekanan osmotik udang menurun secara nyata (Lemonniera et al., 2004). Penurunan tekanan osmotik akan berakibat pada penurunan vitalitas udang sehingga udang akan lebih stres dan terserang penyakit utamanya WSSV. Dengan kombinasi suhu rendah dan pH rendah membuat udang lebih stres sehingga lebih mudah terinfeksi oleh WSSV. Muliani et al. (2012) melaporkan bahwa stressor terbaik merangsang perkembangan WSSV pada benur adalah oksigen rendah, suhu rendah, pH, dan penggunaan formalin dan kecenderungan semakin lama waktu perendaman, maka semakin memicu perkembangan WSSV pada benur udang windu. Beberapa peneliti melaporkan bahwa parameter kualitas air yang dapat menyababkan udang stres di antaranya fluktuasi suhu dan salinitas, pH, oksigen, konsentrasi amonia (Cordova-Murueta, 2004; Tendencia et al., 2010b; 2011; Fouzi et al., 2012).
Gunalan et al. (2010) melaporkan bahwa pada suhu rendah dan pH yang tinggi menyebabkan infeksi WSSV pada budidaya udang windu dan berakibat pada kematian udang. Lebih lanjut dikatakan bahwa penurunan suhu dari 27°C ke 18°C menyebab adanya kematian udang yang cukup tinggi. Hal ini sejalan dengan yang dilaporkan oleh Tendencia et al. (2010b; 2011), bahwa fluktuasi suhu dan pH dapat memicu infeksi WSSV pada udang dan menyebabkan kematian. Oleh karena itu, penurunan
dan peningkatan suhu dan pH dapat digunakan untuk melakukan screning dengan metode stressing benur sebelum benur ditebar di tambak. Moser et al. ( 2012) melaporkan bahwa penggunaan metode stressing suhu sebelum uji PCR dilakukan akan mengurangi negatif false yang sering terjadi pada hasil analisis PCR yang disebabkan oleh konsentrasi viral yang rendah, dengan demikian penyebaran WSSV melalui benur dapat dicegah.
Dari hasil penelitian ini terlihat pula bahwa kombinasi antara suhu 20°C + pH 4 kurang efektif merangsang perkembangan WSSV pada benur. Hal ini dapat diketahui dari hasil analisis PCR yang menunjukkan hasil positif ringan pada semua waktu perendaman dan bahkan masih terdapat hasil yang masih negatif yaitu pada penggunaan aerasi dengan lama waktu perendaman 15 menit. Hal ini sejalan dengan hasil penelitian sebelumnya yang menunjukkan bahwa ada kecenderungan semakin lama waktu perendaman, maka semakin memicu perkembangan WSSV pada benur udang windu (Muliani et al., 2012).
KESIMPULAN
Kombinasi jenis stressor terbaik memicu perkembangan WSSV pada benur adalah kombinasi suhu 20°C + pH 5 + salinitas 5 pp, kombinasi suhu 20°C + salinitas 5 mg/L, dan kombinasi pH 4 dan salinitas baik dengan aerasi maupun tanpa aerasi dengan tingkat infeksi WSSV pada taraf infeksi berat.
Penggunaan salinitas rendah lebih efektif sebagai stressor terhadap perkembangan WSSV jika dikombinasikan dengan stressor lainnya seperti suhu dan pH yang rendah.
UCAPAN TERIMA KASIH
Kepada rekan-rekan peneliti dan teknisi yang penuh dedikasi dan tanggung jawab membantu terlaksananya penelitian ini. Penelitian ini dibiayai oleh APBN Tahun Anggaran 2012.
DAFTAR ACUAN
Anonim. 2002. Instruction manual. Detection and Prevention System for White Spot Syndrom Virus (WSSV). Taiwan, 18 pp.
Ashraf, M., Bengtson, D.A., & Simpson, K.L. 2010. Development of salinity stress tests for larval striped bass, Morone saxatilis and inland silver sides, Menidia beryllina, used in nutritional studies. Pakistan Journal of Nutrition, 9(6): 616-623.
Cordova-Murueta, J.H., Garcý´a-Carren, F.L., & Navarrete-del-Toro, M.A. 2004. Effect of stressors on shrimp digestive enzymes from assays of feces: an alternate method of evaluation. Aquaculture, 233: 439-449.
Corsin, F., Turnbull, J.F., Mohan, C.V., Hao, N.V., & Morgan, K.L. 2005. Use of epidemiological methods to limit the impact of white spot disease in Penaeus monodon farms of Vietnam and India. Aquaculture, 2: 21-30.
de la-Vega, E., Hall, M.R., Wilson, K.J., Reverter, A., Wood, R.G., & Degnan, B.M. 2007. Stress-induced gene expression profiling in the black tiger shrimp Penaeus monodon. Physiol Genomics, 31: 126– 138.
Dhar, A.K., Roux, M.M., & Klimpel K. R. 2001. Detection and quantification of infectious hypodermal and hematopoietic necrosis virus and white spot syndrome virus in shrimp using Real-Time quantitative PCR and SYBR green chemistry. Journal of Clinical Microbiology, 39: 2,835-2,845.
Du, H., Dai, W., Han, X., Li, W., Xu, Y., & Xu, Z. 2008. Effect of low water temperatur on viral replication of white spot syndrome virus in Procambarus clarkii. Aquaculture, 277: 149-151.
Fouzi, M.N., Shariff, M., & Yusof, F.M. 2012. Stress quantification in Penaeus monodon exposed to different level of ammonia and subsequent infection to WSSV. Res. J. of Vet. Sci., 5(1): 13-24. Gunalan, B., Soundarapandilan, P., & Dinakaran, G.K. 2010. The effect of temperature and pH on
WSSV infection in culture marine shrimp Penaeus Monodon (Fabricius). Middle-East J. Sci Res., 5(1): 28-33.
Hulten, M.C.W.V., Goldbach, W., & Vlak, J.M. 2000. Three function diverged major structural proteins of white spot syndrome virus evolved by gene duplication. J. Gen. Virol., 81: 2,525-2,529.
Kono, T., Savan, R., & Itami, T. 2004. Detection of white spot syndrome virus in shrimp by loop-mediated isolthermal amplification. J. Virol. Methods, 115: 59-65.
Lemonniera, H., Bernardb, E., Boglioa, E., Goaranta, C., & Cochardb, J.C. 2004. Influence of sediment characteristics on shrimp physiology: pH as principal effect. Aquaculture, 240: 297-312.
Li, Q., Yang, F., Zhang, J., & Chen Y. 2003. Proteomic analysis of protein that bands specifically to the homologous repeat regions of white spot syndrome virus. Biol. Pharm. Bull., 26: 1,517-1,522. Lo, C.F., Chang, Y.S., Cheng, C.T., & Kou, G.H. 1998. PCR monitoring of cultured shrimp for white spot
syndrome virus (WSSV) infection in growth ponds. In Flegel, T.W. (Ed.). Advances in shrimp biotechnology. BIOTEC. The National Center for Genetic Engineering and Biotechnology. Thailand, p. 281-286.
Lu-Qing, P., Fang bo, Ling-Xu, J., & Jing, L. 2007. The effect of temperature on selected immune parameters of white shrimp, Litopenaeus vannamei. Journal of the World Aquaculture Society, 38(2): 326-332.
Maeda, M., Saitoh, H., Mizuki, E., Itami, T., & Ohba, M. 2004. Replication of white spot syndrome virus in ovarian primary cultures from the kuruma shrimp, Marsupenaeus japonicus. J. Virol Methods, 116: 89-94.
Moser, J.R., Alvarez, D.A.G., Cano, F.M., Garcia, T.E., Molina, D.E.C., Clark, G.P., Marques, M.R.F., Barajas, F.J.M., & Lopez, J.H. 2012. Water temperature inûuences viral load and detection of white spot syndrome virus (WSSV) in Litopenaeus vannamei and wild crustaceans. Aquaculture, 326-329: 9-14. Muliani, Parenrengi, A., Sulaeman, & Atmomarsono, A. 2004. Prevalensi, intesitas, dan transmisi
white spot syndrome virus (WSSV) pada budidaya udang windu Penaeus monodon. J. Pen. Perik. Indonesia, 10: 103-110.
Muliani, Tampangallo, B.R., & Atmomarsono, A. 2011. Penggunaan beberapa metode stressing pada screening benur udang windu dengan teknik polymerase chain reaction (PCR). Dalam Taufiqurrahman, M., Winarno, A., & Hardianto, D. (Eds.) Prosiding Seminar Nasional KelautanVII. Universitas Hang Tua. Surabaya, hlm. B2-63-B274.
Muliani, Tanpangallo, B.R., & Kurniawan, K. 2012. Beberapa metode stressing untuk menginduksi perkembangan white spote syndrome virus (WSSV) pada benur udang wuindu (Penaeus monodon). J. Riset Akuakultur. (In Press).
Munn, C.B. 2004. Marine microbiology. Ecology and applications. BIOS Scientific Publisher. London and New York, 282 pp.
Murdjani, Arifin, Z., Adiwidjaya, D., Komaruddin, U., Nur, A., Susanto, A., Taslihan, A., Ariawan, K., Mardjono, M., Sutikno, E., Supito, Latief, M. S., Cokarkin, C., & Proyoutomo, T.P. 2007. Penerapan best management practices (BMP) pada budidaya udang windu (Penaeus monodon Fabricus) intensif. Departemen Kelautan dan Perikanan Direktorat Jenderal Perikanan Budidaya Balai Besar pengembangan Budidaya Air Payau. Jepara, 67 hlm.
Peinado-Guevara, L.I. & Lopez-Meyer, M. 2006. Detail monitoring of white spot syndrome virus (WSSV) in shrimp commercial ponds in Sinola, Mexico by nested PCR. Aquaculture, 251: 33-45.
Peng, S.E., Lo, C.F., Lin, S.C., Chen, L.L., Chang, Y.S., Liu, K.F., Su, M.S., & Kou, G.H. 2001. Performance of WSSV-infected and WSSV-negative Penaeus monodon postlarvae in culture ponds. Dis. Aquat. Org., 46: 165-172.
Rahman, M.M., Escobedo-Bonilla, C.M., Corteel, M., Dantas-Lima, J.J. Wille, M., Alday-Sanz, V., Pensaert., M.B., Sorgeloos, P., & Nauwynck, H.J. 2006. Effect of hight water temperature (33°C) on clinical and virological outcome of experimental infections with white spote syndrome virus (WSSV) in spesific pathogen-free (SPF) Litopenaeus vannamei. Aquaculture, 261: 842-849.
Rahman, M.M., Corteel, M., Wille, M., & Alday-Sanz, V. 20007. The effect of raising water temperature to 33°C in Penaeus vannamei juveniles at different stages of infection with white spot syndrome virus (WSSV). Aquaculture, 272: 240-245.
Raj, S., Vijayan, K.K., Alavandi, S.V., Balasubramanian, C.P., & Santiago, T.C. 2012. Effect of temperatureand salinity on the infectivity patten of white spot syndrome virus (WSSV) in giant tiger shrimp Penaeus monodon (Fabricius, 1837).
Sanchez-Martinez, J.G., Aguirre-Guzman, G., & Mejia-Ruiz, H. 2007. White spot syndrome virus in cultured shrimp: A review. Aquaculture, 38: 1,339-1,354.
Sritunyalucksana, K., Srisala, J., McColl, Nielsen, L., & Flegel T.W. 2006. Comparison of PCR testing methods for white spot syndrome virus (WSSV) infection in penaeid shrimp. Aquaculture, 255: 95-104.
Sulandari, S. & Zein, M.S. 2003. Panduan praktis laboratorium DNA. Bidang Zoologi. Pusat Penelitian Biologi. Lembaga Ilmu Pengetahuan Indonesia. Jakarta, 125 hlm.
Suwanto, A., Yogiara, Suryanto, D., Tan, I., & Puspitasari, E. 2000. Selected protocols. Training Course on Advances in Molecular Biology Techniques to Assess Microbial Diversity. Bogor, 28 pp. Talpur, A.D. & Ikhwanuddin, M. 2012. Effects of stress tests on larvae of blue swimming crab, Portunus
pelagicus (Linnaeus, 1758). Advances in Environmental Biology, 6(7): 1,909-1,915.
Tendencia, E.A., Bosma, R.H., Usero, R.C., & Verret, J.A.J. 2010a. Effect of rainfall and atmospheric temperature on the prevalence of white spote syndrome virus in pond culture Penaeus monodon. Aquaculture Research, 41: 594-597.
Tendencia, E.A., Bosma, R.H., & Verreth, J.A.J. 2010b. WSSV risk factors related to water physico-chemicalproperties and microflora in semi-intensive Penaeus monodon culture ponds in the Philippines. Aquaculture, 302: 164-168.
Tendencia, E.A. & Verreth, J.A.J. 2011. Temperture fluctuation, low salinity, water microflora: Risk factor for WSSV outbreaks in Penaeus monodon. The Israeli Journal of Aquaculture-Bamidgeh, IIC.63,548. 7 pp.
Vaseeharan, B., Jayakumar, R., & Ramasamy, P. 2003 PCR-base detection of white spot syndrome virus in cultured and captured crustaceans in India. Lett. Appl. Microbiol., 37: 443-447.
Vidal, O.M., Granja, C.B., Aranguren, F., Brock, J.A., & Salazar, M. 2001. A profound effect of hypothermania on survival of Litopenaeus vannamei juveniles infected with white spot syndrome virus. J. World. Aqua. Soc., 32: 364-372.
You, X.X., Su, Y.Q., Mao, Y., Liu, M., Wang, J., Zhang, M., & Wu, C. 2010. Effect of high water temperature on mortality, immune response, and viral replication of WSSV-infected Marsupenaeus japonicus juveniles and adults. Aquaculture, 305: 133-137.
DISKUSI
Nama Penanya: Tohir Pertanyaan:
Kita masih miss representasi sampling kira-kira seperti apa Tanggapan:
Lele yang ditebar ukuran 2-3gr, SOP pembesaran lelenya belum didapat, kami memakai aturan di petani dan tidak diganti airnya kurang lebih 2 bulan.
Nama Penanya: Iwan Pertanyaan:
Ikan nilanya ketika panen dapat berapa? Tanggapan: