6 II. TINJAUAN PUSTAKA
A. MINYAK IKAN
Minyak ikan merupakan fraksi lemak yang diperoleh dari ekstraksi ikan atau sebagai salah satu hasil samping dari industri pengalengan ikan yang dihasilkan karena pemanasan dan sterilisasi selama proses sehingga minyak dari ikan terekstrak dan terbuang bersamaan dengan panas. Minyak ikan dianjurkan untuk diet kesehatan karena banyak mengandung asam lemak tidak jenuh dengan banyak ikatan rangkap (PUFA) omega-3 yaitu asam eikosapentanoat (EPA) dan asam dokosaheksanoat (DHA) yang bermanfaat bagi tubuh (Aidos, 2002).
Minyak ikan umumnya terdiri dari berbagai jenis triasilgliserol berupa suatu molekul yang tersusun dari gliserol dan asam lemak. Rantai asam lemak yang terdapat dalam minyak ikan mempunyai jumlah lebih dari delapan belas atom karbon dan memiliki lima atau enam ikatan rangkap. Kandungan asam lemak esensial pada minyak ikan yang tinggi meliputi asam linoleat, linolenat dan arakhidonat. Hal ini berarti asam lemak esensial itu disebut asam lemak tidak jenuh karena banyak mengandung ikatan rangkap (85%), sedangkan sisanya (15%) terdiri atas asam lemak yang jenuh (Rasyid, 2001).
Minyak ikan yang mengandung EPA dan DHA diproduksi melalui pengirisan, pemotongan, dan pemasakan daging ikan pada suhu 90oC selama 15 menit. Minyak ikan kasar yang diperoleh dipisahkan, dimurnikan dengan alkali dan dipucatkan. Minyak yang diperoleh kemudian dihilangkan baunya dengan vacuum steam distillation pada suhu tinggi berkisar 200oC. Minyak ikan juga dapat diperoleh dari organ tubuh ikan seperti kepala dan jeroan ikan. Minyak ikan yang belum dimurnikan masih berbau ikan, tengik, dan berasa amis, hal ini dikarenakan proses autookidasi dari asam lemak tidak jenuh dengan banyak ikatan rangkap serta pembusukan bahan protein (Irianto, 2002).
Permintaan pasar minyak ikan untuk keperluan konsumsi manusia dapat dibagi menjadi tiga area yaitu sebagai komponen obat-obatan, komponen makanan kesehatan dan sebagai komoditi untuk industri makanan. Pada prinsipnya minyak
7 ikan dapat digunakan untuk berbagai produk makanan yang mengandung lemak (Ackman, 1982).
Minyak ikan mempunyai beberapa sifat kimia dan sifat fisik. Sifat kimia minyak ikan tersebut antara lain mudah beroksidasi dengan udara dan bersifat asam karena adanya asam lemak bebas, mempunyai sifat aditif karena adanya ikatan-ikatan karbon tidak jenuh dan mempunyai sifat dapat berpolimerisasi. Sifat fisik minyak ikan adalah mempunyai berat jenis yang lebih kecil dari berat jenis air, dapat membiaskan cahaya dengan sudut yang spesifik untuk setiap jenis minyak ikan, mempunyai derajat kekentalan yang spesifik dan bersifat tidak larut dalam pelarut kimia seperti eter, benzena dan petroleum eter. Selain itu, minyak ikan berwarna kuning muda sampai kuning emas (Aidos, 2002). Sifat fisikokimia minyak ikan komersial yang digunakan sebagai bahan baku untuk proses hidrolisis disajikan pada Tabel 1.
Tabel 1. Sifat fisikokimia minyak ikan komersial
KARAKTERISTIK NILAI
Bilangan Asam (mg KOH/g) Bilangan Penyabunan (mg KOH/g) FFA (%) Berat jenis (25oC) 10,15 187,4 4,6 0,93 Celik (2002)
Minyak ikan memiliki kandungan yang berbeda dengan kandungan minyak yang lain antara lain jenis asam lemak yang lebih bervariasi, jumlah asam lemak yang lebih banyak yaitu asam lemak C20 – C23 dan asam lemak tidak jenuh dengan
lima hingga enam ikatan rangkap (polyunsaturated fatty acid) (Wang et al., 1990). Menurut Wanasundara dan Shahidi (1998), kandungan asam lemak tidak jenuh (PUFA) yang tinggi pada minyak ikan menyebabkan mudah mengalami kerusakan oksidatif dan menghasilkan bau yang tidak sedap.
Kandungan minyak ikan berbeda-beda tergantung pada jenis ikan asal minyak ikan tersebut. Minyak ikan sarden memiliki komponen asam lemak tidak jenuh yang lebih banyak. Komposisi minyak ikan sarden menurut Gutierrez dan Silva (1993) dapat dilihat pada Tabel 2.
8 Tabel 2. Komposisi asam lemak pada minyak ikan sarden
Gutierrez dan Silva (1993)
B. ASAM LEMAK OMEGA-3
Asam lemak tidak jenuh jamak (PUFA) adalah asam lemak yang mempunyai ikatan ganda lebih dari satu pada rantai asam lemaknya (Rasyid, 2001). Jumlah PUFA yang optimum untuk konsumsi adalah 6-10 % dari total energi yang dibutuhkan setiap hari. Kekurangan PUFA dapat menyebabkan risiko terkena kanker, menurunkan kekebalan tubuh, meningkatkan risiko trombosis dan aterosklerosis, menurunkan HDL, oksidasi dinding pembuluh darah, meningkatkan jumlah peroksida, sehingga mempercepat proses penuaan dan meningkatkan risiko terkena batu empedu (Duthie dan Barlow, 1992).
Asam lemak tidak jenuh dengan banyak ikatan rangkap dalam minyak ikan dikenal dengan asam lemak omega-3. Omega-3 sebenarnya tidak diproduksi oleh tubuh ikan itu sendiri, tetapi merupakan akumulasi dari konsumsi mikroalga yang
Jenis atom karbon Nama Asam Lemak Jumlah (%)
C12:0 Asam Laurat 0,1 C14:0 Asam Miristat 9,8 C16:0 Asam Palmitat 16,2 C16:1 Asam Palmitoleat 11,3 C18:2 Asam Linoleat 1,3 C18:1 Asam Oleat 9,8 C20:0 Asam Eikosanoat 0,3
C18:3 dan C20:1 Asam Linolenat dan Asam
eikosamonoenoat 2,6
C20:2 Asam Eikosadienoat 2,5
C22:3 dan C22:1 Asam Dokosatrienoat dan Asam
Dokosamonoenoat 4,8 C20:4 Asam Eikosatetranoat 0,2 C20:5 Asam Eikosapentanoat 24,2 C22:4 Asam Dokosatetranoat 2,4 C22:5 Asam Dokosapentanoat 2,2 C22:6 Asam Dokosaheksanoat 6,5
9 memproduksi asam lemak. Beberapa asam lemak tidak jenuh omega-3 dalam minyak ikan adalah α-Linoleat, asam arakhidonat, EPA dan DHA (Pak, 2005).
Asam lemak omega-3 adalah asam lemak tidak jenuh dengan banyak ikatan rangkap. Ikatan rangkap pertama terletak pada atom karbon ketiga dari gugus metil omega. Ikatan rangkap berikutnya terletak pada nomor atom karbon ketiga dari ikatan rangkap sebelumnya. Gugus metil omega-3 adalah gugus terakhir dari rantai asam lemak. Asam lemak omega-3 merupakan turunan dari prekursor pendahulunya yaitu asam lemak esensial linoleat dan linolenat. Asam lemak esensial tidak bisa dibentuk dalam tubuh dan harus dicukupi langsung dari makanan (Aidos, 2002). Asam lemak omega-3 yang paling banyak pada ikan adalah asam lemak eikosapentaenoat (EPA C20:5, n-3) dan asam lemak dokosaheksaenoat (DHA C22:6, n-3) yang dapat menyembuhkan penyakit aterosklerosis (penyempitan dan pengerasan pembuluh darah), trombosis, penyakit tulang atau persendian, asma, dan mencegah proses penuaan (Duthie dan Barlow,1992). Struktur kimia EPA dan DHA yang banyak terdapat dalam minyak ikan dapat dilihat pada Gambar 1.
CH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2-CH=
CH-(CH2)3-COOH
Asam Eikosa Pentanoat(C20:5)
CH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2
-CH=CH-CH2-CH=CH-(CH2)2-COOH
Asam Dokosa Heksanoat (C22:6)
Gambar 1. Struktur kimia EPA dan DHA (Ackman, 1982)
Asam lemak omega-3 sangat penting untuk membantu fungsi kerja otak, terutama untuk proses pertumbuhan dan perkembangan otak. Asam lemak esensial ini banyak terakumulasi di dalam otak terutama penting untuk fungsi kognitif otak dan mengatur perilaku manusia. Kekurangan asam lemak omega-3 dalam tubuh manusia dapat menyebabkan kelelahan, daya ingat lemah, kulit kering, gangguan hati, depresi dan sirkulasi yang tidak teratur (DeBusk, 2007).
10 Aidos (2002) menyatakan bahwa produsen utama asam lemak omega-3 sebenarnya bukan ikan, melainkan mikroorganisme laut yang menjadi makanannya antara lain chlorella, diatomea, dan dinoflagellata yang merupakan fitoplankton. Mikroorganisme tersebut di samping mensintesis asam lemak omega-3 juga dapat mensintesa asam lemak omega-6. Sintesa asam lemak ini sangat efisien karena mikroorganisme tadi mempunyai siklus rantai makanan yang pendek. Sebenarnya sintesis asam lemak omega-3 tidak hanya dilakukan oleh fitoplankton tersebut, melainkan juga oleh bakteri, kapang, dan alga lain yang mempunyai tingkat efisiensi sintesis yang berbeda. Beberapa jenis asam lemak omega-3 yang terkandung di dalam minyak ikan dapat dilihat pada Tabel 3.
Tabel 3. Beberapa jenis asam lemak omega-3 yang terkandung di dalam minyak ikan
Nama Umum Rumus Nama Kimia
n/a 16:3 (n−3) all-cis-7,10,13 hexadecatrienoic
acid
α-Linolenic acid (ALA) 18:3 (n−3) all-cis-9,12,15-octadecatrienoic
acid
Stearidonic acid (SDA) 18:4 (n−3) all-cis-6,9,12,15-octadecatetraenoic acid
Eicosatrienoic acid (ETE) 20:3 (n−3) all-cis-11,14,17- eicosatrienoic acid
Eicosatetraenoic acid (ETA) 20:4 (n−3) all-cis-8,11,14,17-eicosatetraenoic acid
Eicosapentaenoic acid (EPA) 20:5 (n−3) all-cis-5,8,11,14,17-eicosapentaenoic acid Docosapentaenoic acid
(DPA), Clupanodonic acid 22:5 (n−3)
all-cis-7,10,13,16,19-docosapentaenoic acid Docosahexaenoic acid (DHA) 22:6 (n−3) all-cis-4,7,10,13,16,19-docosahexaenoic acid Tetracosapentaenoic acid 24:5 (n−3)
all-cis-9,12,15,18,21-docosapentaenoic acid Tetracosahexaenoic acid
(Nisinic acid) 24:6 (n−3)
all-cis-6,9,12,15,18,21-tetracosenoic acid
Wang et al. (1990) menyatakan bahwa kandungan minyak ikan dengan omega-3 tinggi terdapat pada ikan yang hidup pada kadar garam tinggi. Dinginnya suatu lingkungan hidup ikan tidak menjadikan indikasi dalam menentukan
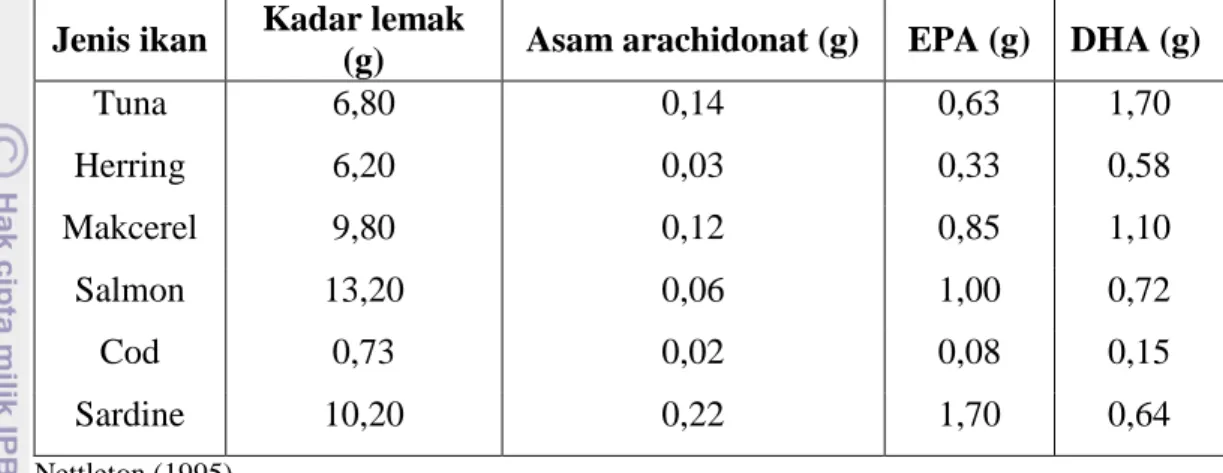
11 banyaknya kandungan omega-3. Kadar asam lemak omega-3 pada beberapa jenis ikan per 100 gram daging ikan dapat dilihat pada Tabel 4.
Tabel 4. Kadar omega-3 pada beberapa jenis ikan per 100 gram daging ikan Jenis ikan Kadar lemak
(g) Asam arachidonat (g) EPA (g) DHA (g)
Tuna 6,80 0,14 0,63 1,70 Herring 6,20 0,03 0,33 0,58 Makcerel 9,80 0,12 0,85 1,10 Salmon 13,20 0,06 1,00 0,72 Cod 0,73 0,02 0,08 0,15 Sardine 10,20 0,22 1,70 0,64 Nettleton (1995) C. HIDROLISIS ENZIMATIK
Hidrolisis pada prinsipnya merupakan reaksi pembentukan gliserol dan asam lemak bebas melalui pemecahan molekul lemak dan penambahan elemen air. Hidrolisis merupakan salah satu reaksi yang terjadi pada produk atau bahan pangan berlemak (Zarevucka dan Wimmer, 2008). Winarno (1997) menyatakan bahwa lemak dan minyak dapat terhidrolisis menjadi gliserol dan asam lemak bebas dengan adanya air. Reaksi ini dapat dipercepat dengan adanya basa, asam, dan enzim.
Pada awalnya hidrolisisi minyak dan lemak dilakukan dengan suhu 250oC dan pada tekanan 50-55 bar (Loebis, 1989). Penggunaan proses ini selain membutuhkan energi yang cukup besar dan investasi peralatan yang mahal, juga menghasilkan produk yang gelap dan berbau yang relatif kurang disukai konsumen (Herawan, 1993). Untuk meminimumkan biaya, energi dan produk yang kurang baik maka dilakukan hidrolisis secara enzimatik (Macrae, 1983).
Pada reaksi hidrolisis enzimatik, lipase mengkatalisis pelepasan ikatan ester triasilgliserol dengan membutuhkan sejumlah air secara bersamaan. Hidrolisis enzimatik dapat dilakukan dalam suatu media organik pada suhu ruang dan menghasilkan produk yang tidak berwarna gelap serta tidak teroksidasi. Asam lemak yang diproduksi setelah reaksi hidrolisis dipisahkan dari enzim
12 menggunakan pelarut organik. Rendemen yang diperoleh adalah sebesar 97% (Akoh dan Min, 1998).
Pada umumnya proses hidrolisis disebabkan adanya aktivitas enzim dan mikroba, dapat berlangsung bila tersedia sumber nitrogen, garam mineral, dan sejumlah air. Hidrolisis yang terjadi pada minyak atau lemak yang mempunyai asam-asam lemak dengan rantai karbon panjang mengalami proses yang lebih lambat (Macrae, 1983).
Reaksi hidrolisis triasilgliserol terjadi secara bertahap dan merupakan reaksi yang bersifat reversibel (bolak-balik) sehingga akan berakhir dalam suatu kesetimbangan (Kurashige et al., 1993). Secara sistematik, reaksi hidrolisis yang dikatalis oleh lipase disajikan pada Gambar 2.
Triasilgliserol + H20 Diasilgliserol + Asam Lemak Bebas
Diasilgliserol + H20 Monoasilgliserol + Asam Lemak Bebas
Monoasilgliserol+H20 gliserol + Asam Lemak Bebas
Triasilgliserol +3 H20 gliserol + 3Asam Lemak Bebas
Gambar 2. Tahapan hidrolisis triasilgliserol yang dikatalis oleh lipase (Brockman, 1984)
Kelebihan hidrolisis enzimatik antara lain reaksi dilakukan pada suhu rendah, sehingga kualitas produk lebih baik, menggunakan lipase spesifik, sehingga produk yang diinginkan dapat ditingkatkan dan produk samping dapat dikurangi, investasi lebih murah, serta lingkungan kerja aman (Herawan, 1993). Pada reaksi hidrolisis minyak ikan menhaden, lipase dari Aspergillus niger memiliki tingkat hidrolisis sebesar 9% selama 72 jam dengan kandungan EPA 14% dan DHA 10%. Sedangkan pada reaksi hidrolisis minyak ikan seal bubber, tingkat hidrolisis yang diperoleh selama 72 jam sebesar 25% dengan konversi EPA dan DHA sebesar 7% dan 10% (Wanasundara dan Shahidi, 1998).
Lipase Lipase
Lipase
13 D. LIPASE
Enzim adalah protein yang terdiri dari asam amino yang disatukan oleh ikatan peptida dalam komposisi dengan urutan yang teratur dan tetap serta mempunyai aktivitas katalisa. Enzim berfungsi sebagai katalis biologis yang digunakan makhluk hidup untuk melaksanakan berbagai konversi senyawa kimia (Ozturk, 2001). Semua enzim yang telah diamati sampai saat ini adalah protein, dan aktivitas katalitiknya bergantung kepada integritas strukturnya sebagai protein (Lehninger, 1995).
Asam lemak tidak jenuh dengan banyak ikatan rangkap sangat labil terhadap panas dan oksidasi. Reaksi enzim telah menarik perhatian karena enzim dapat melakukan proses pada suhu dan tekanan lingkungan serta di bawah tekanan nitrogen. Beberapa lipase tidak bereaksi secara baik pada asam lemak tidak jenuh sehingga asam lemak tidak jenuh dapat dipekatkan melalui keuntungan ini (Shimada et al., 1997).
Lipase didefinisikan sebagai enzim yang mengkatalis hidrolisis minyak atau lemak secara dapat balik pada kondisi alami. Menurut Nomenclature Committee of the International Union of Biochemistry (IUB), lipase diklasifikasikan sebagai enzim hidrolase dengan nama sistematik gliserol ester hidrolase (EC 3.1.1.3) yang menghidrolisis trigliserida menjadi asam lemak bebas, gliserida parsial (monogliserida atau digliserida) dan gliserol (Macrae, 1983).
Lipase (triacylglycerols acylhydrolases EC 3.1.1.3) telah menjadi katalis yang penting dalam sintesis organik karena memiliki kemampuan yang unik dalam mengkatalisis reaksi pemutusan ikatan ester di interfase pada substrat yang tidak larut dalam air. Lipase memiliki kemampuan untuk mengkatalisis reaksi kebalikan (esterifikasi, interesterifikasi dan transesterifikasi) dengan menggantikan media akueous dengan media non akueous. Lipase juga menunjukkan selektivitas yang tinggi termasuk stereoselektivitas dan memberikan hasil akhir produk yang murni dan berkualitas baik (Pera, 2006).
Penggunaan lipase sebagai katalis dalam proses hidrolisis mempunyai beberapa keuntungan daripada menggunakan metode fisika maupun kimia antara lain efisiensi katalitik lipase tinggi sehingga jumlah enzim yang dibutuhkan relatif rendah, daerah selektivitas yang luas di dalam asam lemak sehingga dikenal baik
14 dan penting untuk diaplikasikan lebih mendalam, menghilangkan penggunaan katalis inorganik dan bahan kimia berbahaya lainnya, bekerja optimal pada kondisi ringan sehingga dapat menghemat energi. Produk yang dihasilkan menggunakan katalis lipase lebih tinggi tingkat kemurnian dan kualitasnya baik rasa maupun warnanya (Haraldsson et al., 1997). Menurut Lehninger (1995), enzim merupakan katalis yang dapat mempercepat reaksi tanpa ikut bereaksi. Mekanisme peningkatan laju reaksinya dengan cara menurunkan energi aktivasi.
Pengkayaan Omega-3 dapat dilakukan melalui metode enzimatik sebagai katalis dalam reaksi kimia seperti esterifikasi, hidrolisis, dan perubahan asam lemak dalam ester (asidolisis) (Wanasundara dan Shahidi, 1998). Keuntungan penggunaan lipase sebagai katalis hanya membutuhkan suhu dan pH mendekati kondisi ruang (Moore et al., 1996). Efisiensi katalitis dari lipase sangat tinggi, sehingga hanya dibutuhkan dalam jumlah yang sedikit dan lipase dapat digunakan kembali jika enzim terimobilisasi (Haraldson et al., 1997).
Menurut Gandhi (1997), ada dua kategori dimana lipase dapat digunakan sebagai katalis yaitu :
a. Hidrolisis
RCOOR’ + H2O RCOOH + R’OH b. Sintesis
Reaksi sintesis dapat dipisahkan menjadi : i. Esterifikasi
RCOOH + R’OH RCOOR’ + H2O ii. Interesterifikasi
RCOOR’ + R”COOR’” RCOOR’” + R”COOR’ iii. Alkoholisis
RCOOR’ + R”OH RCOOR’’ + R’OH iv. Asidolisis
RCOOR’ + R”COOH R”COOR’ + RCOOH
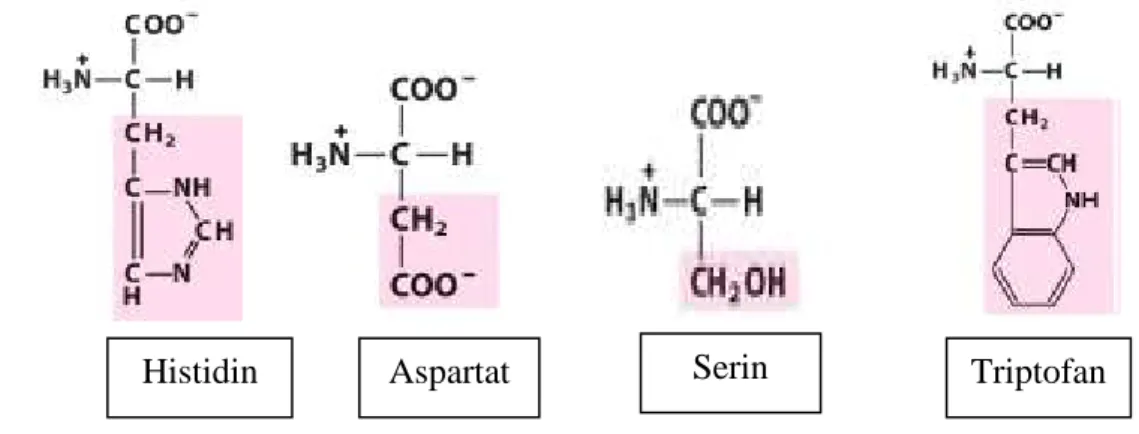
Menurut Lehninger (1982), sisi aktif lipase dari Aspergillus niger asam aminonya tersusun dari serin, histidin dan aspartat yang bersifat hidrofilik (polar) dan tertutup oleh triptofan. Asam amino triptofan merupakan asam amino yang cenderung non polar, sedangkan asam amino aspartat merupakan jenis asam
15 amino yang bermuatan negatif (asam). Asam amino histidin memiliki muatan positif (basa) sehingga tergolong dalam asam amino positif, sedangkan asam amino serin bersifat polar dan tidak bermuatan. Struktur asam amino penyusun lipase dari Aspergillus niger dapat dilihat pada Gambar 3.
Gambar 3. Struktur asam amino penyusun lipase dari Aspergillus niger (Lehninger, 1982)
Secara umum, lipase merupakan polipeptida yang terikat dalam dua gugus yaitu gugus terminal C dan terminal N. Gugus terminal N mengandung sisi aktif dengan terowongan hidrofobik dari sisi aktif serin ke permukaan yang dapat menampung asam lemak rantai panjang (Akoh dan Min, 1998).
Lipase diproduksi dari fermentasi bakteri, kapang dan khamir, seperti Rhizopus delemar, Aspergilus niger, Geotrichum candidum, Candida rugosa, dan Chromobacterium viscocum (Gandhi, 1997). Menurut Herawan (1993), lipase berdasarkan cara kerjanya dibagi menjadi tiga yaitu:
a. Lipase non spesifik yaitu lipase yang dapat mengkatalisis seluruh ikatan triasilgliserol
b. Lipase spesifik 1,3 atau 2 yaitu lipase yang dapat mengkatalisis triasilgliserol pada ikatan 1,3 atau 2
c. Lipase spesifik yaitu lipase yang hanya mengkatalisis jenis asam lemak tertentu.
Menurut Pederson dan Holmer (1995), salah satu keunggulan reaksi katalisis enzimatik adalah sifat spesifisitas enzim yang berbeda satu sama lain, sehingga sifat ini dimanfaatkan secara optimal untuk tujuan reaksi atau jenis produk yang diinginkan. Spesifisitas enzim didefinisikan sebagai ekspresi
16 kemampuan suatu enzim untuk mendiskriminasikan substrat-substratnya berdasarkan pada perbedaan afinitas substrat dalam berasosiasi dengan sisi aktif enzim untuk membentuk kompleks enzim substrat dan akhirnya menghasilkan produk. Adapun spesifisitas lipase diklasifikasikan menjadi spesifisitas asam lemak, spesifisitas posisional, spesifisitas alkohol, dan spesifisitas jenis lipid.
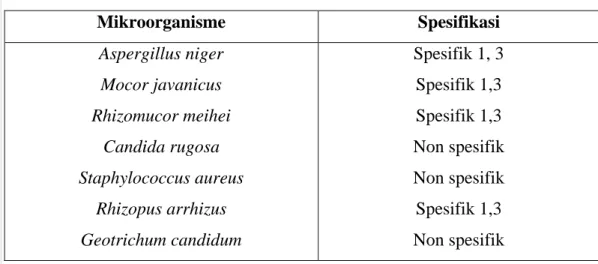
Menurut Lai et al. (1999), setiap lipase memiliki ciri tersendiri dalam melakukan pemotongan rantai ester asam lemak dalam minyak. Tabel 5 berikut menyatakan spesifikasi mikroorganisme penghasil lipase.
Tabel 5. Mikroorganisme penghasil lipase
Mikroorganisme Spesifikasi
Aspergillus niger Spesifik 1, 3
Mocor javanicus Spesifik 1,3
Rhizomucor meihei Spesifik 1,3
Candida rugosa Non spesifik
Staphylococcus aureus Non spesifik
Rhizopus arrhizus Spesifik 1,3
Geotrichum candidum Non spesifik
Lai et al. (1999), Kotting dan Eibl(1994)
Lipase dikenal bereaksi lemah terhadap asam lemak tak jenuh, seperti asam α-linolenat (GLA, 18:3n-6), asam arakhidonat (20:4n-6), asam eikosapentanoat (EPA, 20:5n-3), dan asam dokosaheksanoat (DHA, 22:6n-3) dan asam lemak ini dapat diperkaya melalui hidrolisis selektif (Shimada et al., 1997). Menurut Halldorsson (2003), lipase dapat digunakan untuk membuat konsentrat EPA dan DHA dari seluruh bagian komposisinya dengan efisien dan memiliki rendemen yang tinggi.
Menurut Fatimah (2002), penggunaan lipase sebagai katalis untuk menghasilkan konsentrat EPA dan DHA dapat lebih menguntungkan, hal ini dikarenakan katalis lipase mempunyai efesiensi katalitik yang tinggi dan bila dalam kondisi immobilisasi dapat dipergunakan kembali. Rentangan selektivitasnya terhadap asam lemak telah diketahui dan sangat penting dalam penggunaan berkelanjutan.
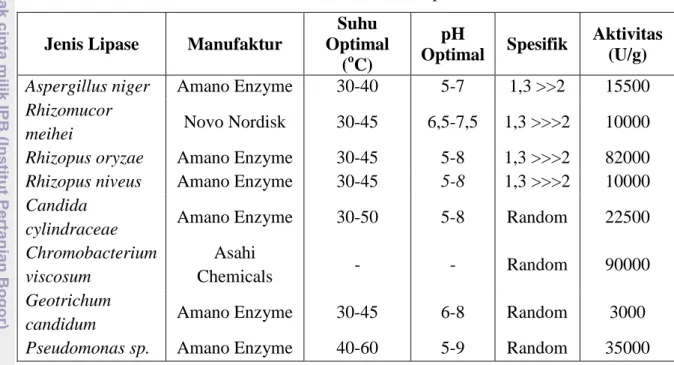
17 Enzim hidrolase telah banyak digunakan dalam sintesa organik karena ketersediaan bahan baku dan penanganan yang mudah. Enzim ini tidak membutuhkan koenzim, stabil dan toleran terhadap pelarut organik. Potensi mereka untuk melakukan sintesis regioselektif dan enantioselektif menjadikan mereka sebagai alat yang berharga (Shimada et al., 1997). Aktivitas dan karakteristik berbagai macam lipase disajikan pada Tabel 6.
Tabel 6. Aktivitas dan karakteristik lipase Jenis Lipase Manufaktur
Suhu Optimal (oC) pH Optimal Spesifik Aktivitas (U/g) Aspergillus niger Amano Enzyme 30-40 5-7 1,3 >>2 15500 Rhizomucor
meihei Novo Nordisk 30-45 6,5-7,5 1,3 >>>2 10000 Rhizopus oryzae Amano Enzyme 30-45 5-8 1,3 >>>2 82000 Rhizopus niveus Amano Enzyme 30-45 5-8 1,3 >>>2 10000 Candida
cylindraceae Amano Enzyme 30-50 5-8 Random 22500
Chromobacterium viscosum
Asahi
Chemicals - - Random 90000
Geotrichum
candidum Amano Enzyme 30-45 6-8 Random 3000
Pseudomonas sp. Amano Enzyme 40-60 5-9 Random 35000
Wanasundara dan Shahidi (1998)
Menurut Carvalho et al. (2009), salah satu jenis lipase yang memberikan hasil hidrolisis selektif terbaik dihasilkan oleh Aspergillus niger. Hal tersebut dikarenakan lipase dari Aspergillus niger mempunyai spesifisitas posisional memutus ikatan triasilgliserol pada posisi stereochemical numbering (sn)1 dan 3, sehingga dapat menjaga asam lemak tidak jenuh omega-3 yang mengandung asilgliserol yang umumnya terletak pada sn 2.
Lipase dari spesies kapang Aspergillus yang dikenal dengan nama Aspergillus niger mempunyai berat molekul antara 200.000 - 250.000, pH optimum antara 4,5 – 6,5, suhu optimum antara 40-50 oC dan titik isoelektrik (pI) 4,1 dan 9. Enzim tersebut menghidrolisis minyak kelapa, minyak zaitun dan minyak ikan dengan rendemen yang mencapai 48-93% (Petersen et al., 2001). Berdasarkan penelitian yang dilakukan oleh Nuraida et al. (2000), lipase
18 Aspergillus niger mengkatalisis asam palmitat, asam kaprilat, dan asam miristat lebih banyak.
Lipase Aspergillus niger dari Amano Pharmaceutical Manufactures Co. memiliki kandungan karbohidrat 68%, NaCl 0,1%, abu 6%, uap air 5,1%, lemak 0,1%, dan protein 20,8% pada tiap gram serbuknya. Kadar protein pada lipase tersebut cukup tinggi, tetapi kadar karbohidrat juga tinggi. Kandungan karbohidrat yang tinggi yang melebihi 50% akan menghambat aktivitas lipolitik dari enzim (Bloomer et al., 2001).
E. PELARUT ORGANIK
Pada dasarnya pelarut organik dan sejumlah air dalam media reaksi merupakan dua faktor mendasar yang menentukan perilaku enzim dalam lingkungan air yang dibatasi. Air mutlak diperlukan dalam aktivitas enzim karena berperan dalam semua interaksi non kovalen untuk menjaga protein dalam penyesuaian dan berperan penting dalam pergerakan enzim (Ogino dan Ishikawa, 2001).
Berdasarkan Ueji dan Takashi (1999), pelarut organik dapat menyebabkan modifikasi bentuk enzim yaitu mengubah efisiensi katalitiknya dan spesifisitasnya. Penggunaan media non konvensional akan meningkatkan enantioselektivitas pada reaksi katalisis oleh biokatalis.
Keuntungan lain penggunaan pelarut non akueous adalah resiko kontaminasi mikrobial lebih rendah daripada pada sistem akueous. Ketertarikan khusus terhadap media non konvensional pada reaksi hidrolisis dengan penambahan air yang rendah dapat digunakan untuk reaksi sintesis yang menyediakan kelarutan yang terbaik pada substrat hidrofobik dengan lipase sebagai katalis (Krieger et al., 2004). Menurut Drauz dan Waldmann (1995) hidrolisis ester menggunakan lipase merupakan proses dapat balik, oleh karena itu air sebagai katalis dibutuhkan dalam jumlah yang sedikit. Salah satu cara yang dilakukan untuk keperluan transformasi lipase dalam lingkungan yang sedikit air adalah dengan menambahkan pelarut organik.
Pelarut organik mempengaruhi hidrolisis enzimatik dalam berbagai cara antara lain mempengaruhi distribusi air antara enzim dan media reaksi, pelarut
19 organik secara langsung berinteraksi dengan enzim. Oleh karena itu, adanya sejumlah substrat atau produk dalam reaksi antara sisi aktif enzim dan media mempengaruhi kinetika dan parameter termodinamika dalam proses hidrolisis. Enzim di dalam lingkungan berpelarut organik menunjukkan peningkatan termostabilitas dan memungkinkan untuk melakukan reaksi pada lingkungan yang sedikit air (Koops et al., 1999).
Penggunaan pelarut organik mempunyai beberapa keuntungan dibandingkan menggunakan air yaitu memudahkan pemisahan enzim dan produk dengan metode nonekstraktif karena substrat bersifat larut dalam pelarut sedangkan enzim tidak larut, meningkatkan hasil rendemen, substrat yang sensitif terhadap air dapat digunakan, bila kesetimbangan reaksi berubah ester dan amida segera bereaksi, termostabilitas enzim meningkat sebab air yang dapat menghidrolisis ikatan peptida enzim jumlahnya sangat sedikit bahkan tidak ada, rigiditas enzim meningkat sehingga enzim menjadi lebih selektif dan tidak mengakibatkan perubahan pH. Akan tetapi, penambahan pelarut organik yang tidak sesuai dapat merubah aktivitas katalitik alaminya bahkan menginaktivasi enzim (Paez et al., 2003).
Baharum (2003) menyatakan bahwa untuk menentukan hidrofobisitas pelarut, beberapa parameter yang dapat digunakan adalah parameter kelarutan hidebran, solvatochromism of dye, konstanta dielektrika, momen dipol dan logaritma koefisien partisi (log P). Peptida dan protein merupakan molekul kompleks dimana kelarutannya pada beberapa pelarut akueous dan organik harus ditentukan secara empiris. Korelasi terbaik antara aktivitas katalitik dengan hidrofobisitas pelarut diperoleh jika menggunakan nilai log P sebagai parameter hidrofobisitas pelarut yang digunakan. Nilai log P merupakan logaritma koefisien partisi (P) yang didefinisikan sebagai rasio konsentrasi bahan organik dengan bahan akueous. Herees et al.(2008), menyatakan nilai log P suatu pelarut berkorelasi baik terhadap stabilitas panas dan stabilitas operasional enzim. Hubungan logaritma koefisien partisi dengan laju reaksi disajikan pada Tabel 7.
20 Tabel 7. Laju reaksi sebagai fungsi dari pelarut
Pelarut Nilai log P Laju reaksi (x 104 mol L-1s-1)
Decana 5,6 9,33
n-Heptana 4 8,17
n-Heksana 3,5 3,33
Toluena 2,5 2
Herees et al. (2008)
Sebagian besar lipase berada pada dua bentuk yaitu terbuka dan tertutup. Enzim berbentuk tertutup mendominasi larutan akueous, sedangkan pada enzim terbuka pada interfase hidrofobik. Pada enzim dengan bentuk yang tertutup, lid atau penutup membuka sisi hidrofilik terhadap air sedangkan sisi hidrofobik terhadap sisi katalitik. Kehadiran interfase hidrofobik menyebabkan lipase mengalami perubahan bentuknya dan sisi katalitiknya terhadap fase hidrofobik (triasilgliserol). Ada kemungkinan bahwa selama proses adsorpsi lipase merubah bentuknya pada interfase hidrofobik dan mengabsorpsi ke dalam sisi terbuka (Salis et al., 2008).
Menurut Rahman et al. (2006), media reaksi non akueous seperti n-heksana juga akan meningkatkan stabilitas enzim. Berdasarkan studi yang dilakukan Baharum et al. (2003), stabilitas dan aktivitas lipase mempunyai nilai tertinggi pada media yang menggunakan n-heksana sebagai pelarut organik. Hal tersebut diakibatkan oleh kemampuan pelarut organik n-heksana untuk meningkatkan daya larut substrat sehingga memudahkan terjadi reaksi hidrolisis. Menurut Kilbanov et al. (2001), pada pengamatan stabilitas S5 lipase diketahui bahwa pelarut heksana menjaga enzim dalam konformasi terbuka dimana lid enzim tidak menutup sisi aktif enzim tersebut dan menjaga enzim dalam bentuk yang fleksibel. Karakteristik pelarut organik heksana dapat dilihat pada Tabel 8.
21 Tabel 8. Karakteristik pelarut organik heksana
Rumus kimia C6H14
Sifat Non polar
Berat molekul 86,18
Tingkat kepolaran (Log P) 3,5
Titik didih ( oC) 69
Titik leleh (oC) -95
Densitas (g/mL) 0,659
Kelarutan didalam air (g/100g) 0,014
Konstanta dielektrik 1,89
Titik nyala ( oC) -22
Oxford H-Sci (2004)
F. FAKTOR-FAKTOR YANG BERPENGARUH TERHADAP REAKSI HIDROLISIS ENZIMATIK.
1. Suhu
Termostabilitas enzim merupakan faktor utama pada aplikasi industri, dikarenakan degradasi enzim pada suhu tinggi. Suhu dihubungkan dengan keterbatasan transfer massa. Suhu yang tinggi akan menurunkan viskositas campuran minyak dan akan meningkatkan transfer subsrat-produk pada permukaan atau di dalam partikel enzim. Suhu akan berpengaruh pada stabilitas enzim dan afinitas enzim terhadap substrat dan kompetisi reaksi dalam jumlah yang besar. Semakin tinggi suhu, akan berakibat pada penurunan densitas dan viskositas media reaksi. Pada penurunan densitas media, akan meningkatkan difusitas dan berakibat pada peningkatan transfer massa substrat dan produk (Kim et al., 2004).
Suhu dapat berpengaruh positif terhadap reaksi hidrolisis maupun sebaliknya. Pada suhu 50oC nilai tingkat konversinya berubah menjadi cukup rendah. Sedangkan suhu 45oC merupakan suhu optimum reaksi hidrolisis dengan menggunakan lipase sebab pada suhu diatas 45oC tingkat konversinya
22 turun secara tiba-tiba dikarenakan enzim mengalami denaturasi (Kamarudin et al., 2008).
Suhu berpengaruh terhadap aktivitas dan stabilitas lipase, suhu yang sesuai untuk penggunaan lipase sebagai katalis adalah dibawah 70oC karena pada suhu tinggi menyebabkan terjadinya migrasi alkil secara non enzimatik, oksidasi, isomerisasi dan denaturasi enzim. Industri menghendaki penggunaan suhu reaksi yang tinggi pada proses reaksinya. Hal ini bukan hanya ditujukan untuk mengurangi tingkat kontaminasi, tetapi suhu tinggi juga akan mengurangi masalah-masalah viskositas dan sekaligus meningkatkan laju reaksi (Wanasundara dan Shahidi, 1998).
Stabilitas panas enzim dipengaruhi oleh dua faktor yaitu struktur primer enzim dan komponen lain pada enzim. Tingginya kadar protein hidrofobik pada molekul enzim akan membuat struktur enzim rapat dan padat, dimana pada sistem ini enzim tidak mudah terdenaturasi karena perubahan lingkungan eksternal enzim. Komponen spesifik pada enzim seperti polisakarida dan kation divalen akan menstabilkan molekul enzim (Ozturk, 2001)
2. Derajat Keasaman (pH)
Derajat Keasaman (pH) merupakan salah satu faktor yang dapat mempengaruhi kerja dari enzim. Hal ini disebabkan oleh struktur enzim yang merupakan protein atau polimer dari asam amino. Protein memiliki karakteristik mudah terdenaturasi pada pH rendah atau dalam keadaan asam, sedangkan pada kondisi basa (pH tinggi) protein cenderung mengalami inaktivasi (Lehninger, 1995).
Sisi katalitik lipase aktif pada pH tertentu tergantung dari asal dan status ionisasi asam amino penyusunnya. Asam amino asam, basa, dan netral hanya aktif pada satu bagian status ionisasi (Ozturk, 2001). Berdasarkan Staufer (1989), ketertarikan studi mengenai tingkat enzim sebagai fungsi pH dikarenakan karena beberapa faktor yaitu :
a. Status protonasi sisi rantai asam amino pada sisi aktif kompleks enzim substrat (ES) mungkin akan berubah. Hasilnya perubahan kemampuan enzim substrat untuk menjadi produk.
23 b. Perubahan ionik molekul substrat atau perubahan ionik sisi aktif yaitu
kecenderungan dua molekul tersebut unutk menjadi kompleks ES.
c. Perubahan pH dari netral yang memungkinkan melemahkan kekuatan stabilitas bentuk protein, yang berakibat peningkatan denaturasi enzim (kehilangan aktivitas).
Enzim sangat sensitif terhadap perlakuan pH media, karena memungkinkan perubahan status ionisasi enzim, yang akan mempengaruhi aktivitas dan selektivitas. Berdasarkan studi yang telah dilakukan menunjukkan pH optimum untuk reaksi hidrolisis minyak sawit dengan pelarut heksana adalah 7,5 dengan rendemen yang dihasilkan 97,4%. Enzim optimum pada media alkali namun mendekati netral (Kamarudin et al., 2008).
Berdasarkan penelitian yang telah dilakukan Saxeena et al. (2009), titik isoelektrik lipase dari Aspergillus niger adalah 4,3. Stabilitas lipase pada kondisi asam berada pada pH diatas 4 sedangkan stabilitas lipase pada kondisi basa berada pada pH diatas 8.
3. Penambahan Air
Penambahan air memiliki pengaruh terhadap aktivitas lipase yang dipakai. Air merupakan suatu hal yang penting yang harus ada di dalam campuran reaksi, tetapi penambahan air tersebut harus memiliki jumlah yang tepat agar aktivitas lipase dapat mengalami peningkatan. Penambahan air erat pengaruhnya dengan sisi hidrofilik pada lipase (Gubicza et al., 2000).
Efek air terhadap kinetika reaksi hidrolisis sangat penting karena air dapat menyebabkan proses hidrolisis minyak dan akan mempengaruhi mutu produk yang dihasilkan. Hidrolisis minyak merupakan reaksi kesetimbangan yang memungkinkan terjadinya perubahan arah reaksi dengan cara mengatur penambahan air sistem reaksi atau kandungan air (Kurashige et al., 1993).
Sejumlah air diperlukan untuk membantu mengaktifkan lipase pada sisi-sisinya yang bersifat hidrofilik. Selain itu, air di sini juga dibutuhkan sebagai salah satu pereaksi di dalam reaksi hidrolisis. Jumlah air yang terlalu sedikit akan mengurangi kemungkinan kontak fisik antara lipase dengan air sebagai
24 pereaksi. Namun, jumlah air yang terlalu banyak justru akan menghambat kontak yang terjadi antara minyak ikan dan lipase tersebut (Paez et al., 2003).
Laju reaksi hidrolisis membutuhkan sejumlah air. Namun, terlalu banyak air akan berakibat pada reaksi hidrolisis triasilgliserol yang berlebihan sehingga mengakibatkan peningkatan asam lemak bebas. Pengaturan penambahan air pada sistem ini menjadi sangat penting karena semua proses didasarkan pada termodinamika dari kesetimbangan reaksi kimia yang bersifat bolak-balik dimana air berperan penting. Air diperlukan untuk integritas tiga dimensi struktur molekul enzim. Oleh sebab itu, aktivitas lipase merupakan fungsi dari penambahan air. Salah satu hipotesa menyatakan bahwa dimensi molekul enzim membutuhkan sedikit lapisan hidrasi yang akan bereaksi sebagai komponen utama pada enzim dalam media organik. Lapisan ini akan bertindak sebagai buffer diantara permukaan enzim dan media reaksi (Dordick, 1991).
Sejumlah air dibutuhkan untuk memaksimalkan aktivitas enzim. Klibanov (1986). Medina et al. (2003) menyatakan bahwa sedikit air diperlukan untuk mencapai aktivitas maksimal enzim pada pelarut hidrofobik daripada pelarut hidrofilik. Pada aktivitas penambahan air yang rendah, semakin rendah polaritas suatu pelarut berakibat semakin tinggi aktivitas enzim. Ketika aktivitas katalitik diplotkan terhadap banyaknya air yang terikat dengan enzim, suatu pola muncul untuk beberapa pelarut yang berbeda.
Menurut Zaks dan Kilbanov (1988), pada kondisi lingkungan hidrofobik, air cenderung akan berpartisi ke dalam molekul enzim, sehingga walaupun hanya sedikit air di dalam campuran reaksi (1%v/v) akan menyebabkan terjadinya akumulasi sampai 30% air di molekul protein. Menurut Medina et al. (2003), mekanisme pengikatan air dan media pelarut organik dapat dilihat pada Gambar 4.
25 Gambar 4. Mekanisme pengikatan air dan media pelarut organik dalam suatu
reaksi (Medina et al., 2003)
Menurut Salis et al. (2008), walaupun air tidak ikut serta dalam produk, namun penambahan air dalam suatu reaksi sangat penting karena mengekspresikan aktivitas enzimatik secara penuh. Air digunakan sebagai pelumas pada rantai polipeptida yang akan mempengaruhi mobilitas. Mobilitas lipase menjelaskan aktivitas enzimatik. Efek aktivitas enzim dipelajari sebagai fungsi bobot sejumlah air pada reaksi triasilgliserol metanolisis. Terlihat pada lipase Pseudomonas fluorescens inaktif ketika media yang digunakan kering. Peningkatan aktivitas secara tajam terjadi ketika 0,5 mg air/mg katalis ditambahkan.
Pada percobaan yang dilakukan oleh Schneider dan Berger (1991) menyatakan bahwa kenaikan laju reaksi menyebabkan disebabkan oleh sejumlah air. Namun, total 1,2 dan 1,3 digliserida menurun. Pada media bifase, monogliserida dan digliserida relatif lebih stabil terhadap migrasi asil pada pelarut organik dengan penambahan air maksimum 2%