i
SINTESIS SENYAWA 2-(4’-HIDROKSI-3’-METOKSIBENZILIDENA) SIKLOHEKSANA-1,3-DION DARI SIKLOHEKSANA-1,3-DION DAN
4-HIDROKSI-3-METOKSIBENZALDEHIDA DENGAN KATALIS ASAM
KLORIDA MENGGUNAKAN METODESOLID PHASE REACTION
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh :
Monica Sabrina Widiapranolo NIM : 108114104
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Karya ini kupersembahkan untuk :
Papa dan Mama yang selalu mendoakan, mendukung, dan
menyayangiku;
Adikku tersayang, Michelle dan Eugenia yang selalu
menghiasi hariku dengan canda dan tawa;
Pa Nugroho yang telah mengajarkanku banyak hal;
Someone special-ku, Kenny yang selalu ada dalam tawa dan
tangisku; serta
Ko Wawan atas semangat hidup dan perjuangan yang
vi PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas limpahan kasih dan
rahmat-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
“SINTESIS 2-(4’-HIDROKSI-3’-METOKSIBENZILIDENA)
SIKLOHEKSANA-1,3-DION DARI SIKLOHEKSANA-1,3-DION DAN 4-HIDROKSI-3-METOKSIBENZALDEHIDA DENGAN KATALIS ASAM
KLORIDA MENGGUNAKAN METODE SOLID PHASE REACTION”.
Skripsi ini disusun dalam rangka memenuhi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
Selama proses penelitian dan penyusunan skripsi ini, penulis
mendapatkan bantuan dari berbagai pihak. Oleh karena itu, penulis mengucapkan
terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma.
2. Jeffry Julianus, M.Si., selaku dosen pembimbing yang tak pernah henti
memberikan arahan, dukungan, dan saran dalam penelitian serta penyusunan
skripsi ini.
3. Enade Perdana Istyastono, Ph.D., Apt., selaku dosen penguji atas masukan
dan saran selama proses penelitian.
4. Phebe Hendra, M.Si., Ph.D., Apt., selaku dosen penguji atas masukan kritik
dan saran selama proses penelitian.
5. Dr. Sri Hartati Yuliani, Apt., selaku kepala laboratorium Farmasi atas ijin
yang diberikan kepada penulis dalam penggunaan laboratorium.
6. Pak Parlan, Mas Kunto, Mas Bimo, Mas Wagiran, Pak Musrifin, serta
segenap laboran Fakultas Farmasi yang telah membantu selama proses
pengerjaan penelitian di laboratorium.
7. Kenny, atas doa, dukungan, semangat, perjuangan yang tiada henti diberikan
vii
8. Semua pihak yang tidak dapat penulis sebutkan satu per satu yang telah membantu dalam proses penyusunan skripsi ini.
Akhir kata, penulis menyadari bahwa masih banyak kekurangan dalam
penyusunan skripsi ini mengingat keterbatasan dan kemampuan penulis. Oleh
karena itu, penulis mengharapkan kritik dan saran yang membangun dari semua
pihak. Semoga skripsi ini dapat memberikan manfaat bagi pembaca dan
mendukung perkembangan ilmu pengetahuan.
ix DAFTAR ISI
halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI... xvi
ABSTRACT ... xvii
BAB I PENGANTAR ... 1
A.Latar Belakang ... 1
1. Rumusan masalah ... 4
2. Keaslian penelitian ... 5
3. Manfaat penelitian ... 5
x
BAB II PENELAAHAN PUSTAKA ... 7
A.Kanker ... 7
B. Sintesis 2- -hidroksi- -metoksibenzilidena) sikloheksana-1,3-dion ... 8
C.Metode Pemurnian dan Pemeriksaan Kemurnian Senyawa Hasil Sintesis ... 12
1. Pemeriksaan organoleptis ... 12
2. Pemeriksaan kelarutan ... 13
3. Rekristalisasi ... 13
4. Pemeriksaan titik lebur ... 15
5. Kromatografi Lapis Tipis (KLT) ... 15
6. Liquid Chromatography (LC) ... 16
D.Elusidasi Struktur ... 17
1. Spektrofotometri Inframerah (Infrared Spectrophotometry) ... 17
2. Spektroskopi Massa (Mass Spectroscopy) ... 18
3. Proton Nuclear Magnetik Resonance Spectroscopy (1H-NMR) ... 19
E. Landasan Teori ... 20
F. Hipotesis ... 21
BAB III METODE PENELITIAN ... 22
A.Jenis dan Rancangan Penelitian ... 22
B. Definisi Operasional ... 22
C.Bahan Penelitian ... 23
D.Alat Penelitian ... 23
xi
1. Sintesis 2- -hidroksi- -metoksibenzilidena) sikloheksana-1,3-dion .. 24
2. Analisis senyawa hasil sintesis ... 24
F. Analisis Hasil ... 27
1. Perhitungan rendemen ... 28
2. Analisis pendahuluan ... 29
3. Pemeriksaan kemurnian dari senyawa hasil sintesis ... 29
4. Elusidasi struktur ... 29
BAB IV HASIL DAN PEMBAHASAN ... 29
A.Sintesis 2- -hidroksi- -metoksibenzilidena) sikloheksana-1,3-dion ... 29
B. Analisis Pendahuluan ... 32
1. Pemeriksaan organoleptis ... 32
2. Pemeriksaan kelarutan ... 33
3. Pemeriksaan titik lebur ... 34
4. Pemeriksaan kemurnian dengan kromatografi lapis tipis (KLT) ... 35
5. Kromatografi cair ... 37
C.Elusidasi Struktur Senyawa Hasil Sintesis ... 39
1. Elusidasi struktur senyawa hasil sintesis dengan spektroskopi massa .... 39
2. Elusidasi struktur senyawa hasil sintesis dengan spektrofotometri inframerah ... 41
3. Elusidasi struktur senyawa hasil sintesis dengan 1H-NMR ... 45
BAB V KESIMPULAN DAN SARAN ... 53
A.Kesimpulan... 53
xii
DAFTAR PUSTAKA ... 54
LAMPIRAN ... 58
xiii
DAFTAR TABEL
halaman
Tabel I. Istilah kelarutan zat menurut Farmakope Indonesia IV ... 14
Tabel II. Perbandingan sifat fisik senyawa hasil sintesis dan starting material
... 32
Tabel III. Perbandingan kelarutan senyawa hasil sintesis dan starting
material ... 34
Tabel IV. Jarak lebur senyawa hasil sintesis dan starting material ... 35
Tabel V. Nilai Rf senyawa hasil sintesis dan starting material ... 37
Tabel VI. Perbedaan hasil interpretasi spektra inframerah senyawa hasil
sintesis dengan starting material ... 45
xiv
DAFTAR GAMBAR
halaman
Gambar 1. Gugusan metilen aktif pada kurkumin ... 2
Gambar 2. Peningkatan elektrofilisitas dari 4-hidroksi-3-metoksibenzaldehida dengan adanya pengaruh asam ... 4
Gambar 3. Mekanisme reaksi pembentukan senyawa 2- hidroksi -metoksibenzilidena) sikloheksana-1,3-dion ... 11
Gambar 4. Sikloheksana-1,3-dion dengan enam hidrogen alfa dan dua gugus karbonil ... 29
Gambar 5. Penampakan lempeng KLT di bawah sinar UV 254 nm ... 36
Gambar 6. Kromatogram LC senyawa hasil sintesis ... 38
Gambar 7. Spektra massa senyawa hasil sintesis ... 40
Gambar 8. Interpretasi spektra massa senyawa hasil sintesis... 41
Gambar 9. Spektra inframerah senyawa hasil sintesis (pellet KBr) ... 42
Gambar 10. Spektra inframerah sikloheksana-1,3-dion (pellet KBr)... 43
Gambar 11. Spektra inframerah 4-hidroksi-3-metoksibenzaldehida (pellet KBr) ... 44
Gambar 12. Pembagian tipe proton dari perkiraan struktur senyawa hasil sintesis... 45
Gambar 13. Spektra 1H-NMR senyawa hasil sintesis ... 46
Gambar 14. Usulan mekanisme reaksi pembentukan
xv
DAFTAR LAMPIRAN
halaman
Lampiran 1. Data Penimbangan Starting Material dan Perhitungan
Massa Senyawa Hasil Sintesis Secara Teoretis... 58
Lampiran 2. Data Penimbangan dan Perhitungan Rendemen Senyawa Hasil Sintesis ... 61
Lampiran 3. Dokumentasi Proses Sintesis Senyawa 2- hidroksi -metoksibenzilidena) sikloheksana-1,3-dion ... 62
Lampiran 4. Perhitungan Indeks Polaritas Fase Gerak ... 64
Lampiran 5. Perhitungan Nilai Rf Senyawa Hasil Sintesis ... 65
Lampiran 6. Kondisi Alat Kromatografi Cair ... 67
Lampiran 7. Kromatogram LC Senyawa Hasil Sintesis ... 68
Lampiran 8. Spektra Massa Senyawa Hasil Sintesis ... 69
Lampiran 9. Spektra Inframerah Senyawa Hasil Sintesis (pellet KBr) ... 70
Lampiran 10. Spektra Inframerah Sikloheksana-1,3-dion (pellet KBr) ... 71
Lampiran 11. Spektra Inframerah 4-hidroksi-3-metoksibenzaldehida (pellet KBr) ... 72
Lampiran 12. Data Uji Titik Lebur Senyawa Hasil Sintesis... 73
Lampiran 13. Data Uji Titik Lebur Sikloheksana-1,3-dion ... 74
xvi INTISARI
Pada penelitian ini akan disintesis senyawa 2- hidroksi -metoksibenzilidena) sikloheksana-1,3-dion dari sikloheksana-1,3-dion dan 4-hidroksi-3-metoksibenzaldehida menggunakan katalis asam klorida. Penggunaan katalis HCl bertujuan untuk meningkatkan rendemen senyawa target dibandingkan dengan rendemen katalis kalium hidroksida sebesar 13%. Penggunaan katalis HCl memiliki keunggulan dibandingkan KOH yaitu dapat meningkatkan elektrofilisitas dari 4-hidroksi-3-metoksibenzaldehida sehingga mempermudah terjadinya reaksi.
Penelitian ini merupakan penelitian eksperimental deskriptif non-analitik. Sintesis dilakukan berdasarkan kondensasi aldol silang dengan mereaksikan 4 mmol sikloheksana-1,3-dion dan 4 mmol 4-hidroksi-3-metoksibenzaldehida dengan katalis HCl menggunakan metode solid phase reaction. Senyawa hasil sintesis dianalisis dengan: pemeriksaan organoleptis, kelarutan, titik lebur, kromatografi lapis tipis (KLT) dengan fase diam silika gel F254 dan fase gerak etil asetat : kloroform (1:5), kromatografi cair, dan elusidasi
struktur dengan spektroskopi massa, spektroskopi inframerah (IR), spektroskopi proton resonansi magnet inti (1H-NMR) dan dihitung jumlah rendemennya.
Senyawa hasil sintesis berupa kristal putih, tidak berbau dengan rerata rendemen sebesar 12,4% yang larut dalam kloroform, etil asetat, dan aseton. Kromatogram KLT menunjukkan adanya senyawa baru dengan Rf sebesar 0,30.
Kromatogram kromatografi cair menunjukan kemurnian senyawa hasil sintesis sebesar 100% dan jarak lebur sebesar 238,42 239,16°C. Hasil elusidasi struktur dengan spektroskopi massa, spektroskopi IR, dan 1H-NMR menunjukkan senyawa hasil sintesis adalah 9-(4'-hydroxy-3'-methoxyphenyl)-3,4,5,6,7,9-hexahydro-1H-xanthene-1,8-dione.
xvii ABSTRACT
In this study, 2- -hydroxy- -methoxybenzylidene) cyclohexane-1,3-dione was tempted to be synthesized from cyclohexane-1,3-cyclohexane-1,3-dione and 4-hydroxy-3-methoxybenzaldehide using hydrochloric acid as catalyst. Hydrochloric acid was used to improve the reaction yield compared to the reaction potassium hydroxide which give 13% of yield. This is due to the increasing electrophilicity of 4-hydroxy-3-methoxybenzaldehide by the application of acid catalyst, thus make this starting compound more reactive.
It was a non-experimental descriptive non-analytical research which conducted based on the crossed aldol condensation reaction by reacting 4 mmole of cyclohexane-1,3-dione and 4 mmole of 4-hydroxy-3-methoxybenzaldehyde with hydrochloric acid as the catalyst, using the solid phase reaction method. The yield then weighted, and analyzed with organoleptic test, solubility test, melting point test, thin layer chromatography using silica gel F254 as the stationary phase
and ethyl acetate : chloroform (1:5) as the mobile phase, infrared spectrophotometry, mass spectroscopy, and proton nuclear magnetic resonance spectroscopy (1H-NMR).
The yield of the reaction was white crystal with no specified odor and the yield values was 12.4%. The yield is soluble in chloroform, ethyl acetate, aceton. TLC analysis showed a new chemical substance with Rf value of 0.30. The 100%
purity of the yield has been proven by liquid chromatography analysis. The melting point range were 238.42 239.16°C. The results of structure elucidation analysis by infrared spectrophotometry, mass spectroscopy, and 1H-NMR spectroscopy concluded that the compound was 9-(4'-hydroxy-3'-methoxyphenyl)-3,4,5,6,7,9-hexahydro-1H-xanthene-1,8-dione.
Key words : 2-(4 -hydroxy-3 -methoxybenzilidene) cyclohexane-1,3-dione, solid phase reaction, crossed aldol condensation reaction, 9-(4'-
1 BAB I PENGANTAR
A. Latar Belakang
Kanker merupakan salah satu penyebab utama kematian di dunia. Pada
tahun 2008, WHO melaporkan sekitar 7,6 juta (13%) orang meninggal akibat
kanker (WHO, 2013). Penyakit kanker disebabkan adanya abnormalitas
pembelahan (proliferasi) sel yang dapat menginvasi jaringan lain dan menyebar
ke organ lainnya, bahkan dapat menimbulkan kematian. Pada sel tumor,
proliferasi yang sangat cepat disebabkan oleh adanya ekspresi berlebih protein
NF-kB(Lee, Jeon, Kim, Song, 2007; Hanahan and Weinberg, 2011). Sampai saat
ini, masih dilakukan pengembangan dalam pengobatan kanker untuk
meningkatkan kualitas hidup dari penderita penyakit kanker.
Penelitian sebelumnya menunjukkan bahwa gugusan α,β-unsaturated
karbonil pada senyawa kurkumin dapat mendeaktivasi proteinNF-κBoleh adanya
reaksi antara gugusan α,β-unsaturated karbonil dan residu sistein pada protein
NF-κB yang menyebabkan protein NF-κB menjadi inaktif (Surh, 2008). Namun
kurkumin sendiri memiliki kekurangan yaitu adanya gugusan metilen aktif
menyebabkan kurkumin mudah sekali terdegradasi pada pH fisiologis. Penelitian
Wang et al. (1997) menunjukkan kurkumin yang diinkubasi pada medium 0,1 M
bufer fosfat-tanpa serum, pH 7,2 dan suhu 37OC terdekomposisi sekitar 90%
-hidroksi-3’-metoksife
aktivitas sebagai inhi
Oleh karena itu, sen
1,3-dion secara in sili
NF-κByang lebih baik
Senyawa
2-merupakan senyawa
reaksi kondensasi aldol
suatu senyawa keton
suatu senyawa aldehida
Berdasarkan
3’-metoksibenzilidena
oksifenil)-2,4-dioxo-5-heksenal, sedangkan vanilin,
merupakan produk minor yang dihasilkan (Wa
ambar 1. Gugusan metilen aktif pada kurkumin
na itu pada penelitian ini akan disintesis se
oksibenzilidena) sikloheksana-1,3-dion yang merup
olongan enona, dimana telah diketahui bahwa
n dapat menghambat ekspresi proteinNF-kB(Webe
nelitian yang dilakukan Limanto (2013) menunj
droksi-3’-metoksibenzilidena)
sikloheksana-1,3-nhibitor protein NF-κB secara in silico (Webe
senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
silico diharapkan memiliki aktivitas sebagai inhi
h baik dari kurkumin sehingga layak untuk disinte
2-(4’-hidroksi-3’-metoksibenzilidena) siklohe
a α,β-unsaturated karbonil yang dapat dipe
aldol silang antara sikloheksana-1,3-dion ya
ton dan 4-hidroksi-3-metoksibenzaldehida ya
hida dengan adanya katalis asam ataupun basa kua
an penelitian Limanto (2013), sintesis senyawa
dena) sikloheksana-1,3-dion dengan katalis basa
nilin, asam ferulat,
anget al., 1997).
i inhibitor protein
ntesis.
hidroksida (KOH) memberikan hasil rendemen sebesar 13%. Hasil rendemen ini
terlalu kecil sehingga perlu dikembangkan suatu metode baru untuk
menghasilkan rendemen yang lebih besar. Salah satu cara yang dilakukan adalah
dengan menggunakan katalis asam. Penggunaan katalis asam pada sintesis
senyawa 2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion
mempunyai keunggulan dibandingkan katalis basa. Hal ini dikarenakan gugus
hidroksi fenolik pada senyawa 4-hidroksi-3-metoksibenzaldehida bersifat lebih
asam dibandingkan Hαsenyawa sikloheksana-1,3-dion. Adanya katalis basa kuat
seperti KOH akan lebih bereaksi dengan hidroksi fenolik pada
4-hidroksi-3-metoksibenzaldehida sehingga membentuk ion fenoksida (O-). Ion fenoksida
yang terbentuk dapat bereaksi dengan C karbonil pada sikloheksana-1,3-dion
yang bersifat elektrofil dan menyebabkan senyawa target tidak terbentuk.
Penggunaan katalis asam seperti HCl dalam sintesis senyawa 2-(4’-hidroksi-3’
-metoksibenzilidena) sikloheksana-1,3-dion akan memprotonasi atom oksigen
pada sikloheksana-1,3-dion sehingga membentuk enol yang kemudian bereaksi
dengan 4-hidroksi-3-metoksibenzaldehida membentuk senyawa 2-(4’
-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion. Selain itu, HCl merupakan asam
yang lebih kuat (pKa = -8,0) dibandingkan H2SO4 (pKa = -3,0) sehingga lebih
mudah dalam melepaskan H+dan menyebabkan pembentukan enol menjadi lebih
mudah. Penggunaan katalis asam juga dapat meningkatkan elektrofilisitas dari C
karbonil 4-hidroksi-3-metoksibenzaldehida sehingga lebih mudah diserang oleh
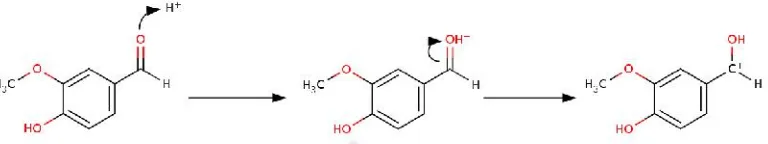
Gambar 2. Peningk
Sintesis seny
1,3-dion dilakukan de
merupakan salah satu
reaksi kimia dilakuka
banyak, sehingga jum
diminimalisir (Palleros,
senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
n dengan menggunakan metode solid phase
satu aplikasi dari “Green Chemistry”, dimana pe
kukan dengan menggunakan pelarut dalam jum
jumlah bahan berbahaya atau limbah yang di
eros, 2004). Penggunaan metode solid phase
2-(4’-hidroksi-3’-metoksibenzilidena) siklohe
rikan keuntungan, antara lain: pengerjaan prose
n sederhana, rendemen yang besar, reaksi sa
amah lingkungan.
asalah
awa 2-(4’-hidroksi-3’-metoksibenzilidena) si
disintesis dari sikloheksana-1,3-dion dan
ldehida dengan katalis asam klorida (HCl)
d phase reaction?
sintesis senyawa 2-(4’-hidroksi-3’-metoksi
-1,3-dion dengan katalis asam klorida membe
ik dibandingkan dengan katalis kalium hidroksi
sibenzaldehida
na)
sikloheksana-phase reaction yang
pengerjaan suatu
umlah yang tidak
dihasilkan dapat
phase reaction pada
oheksana-1,3-dion
oses sintesis yang
ksi samping dapat
sikloheksana-1,3-2. Keaslian penelitian
Sejauh penelusuran yang telah dilakukan oleh peneliti, penelitian yang
berjudul “sintesis senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion dari sikloheksana-sikloheksana-1,3-dion dan 4-hidroksi-3-metoksibenzaldehida
dengan katalis asam klorida (HCl) menggunakan metodesolid phase reaction”
belum pernah dilakukan. Senyawa sejenis yang pernah disintesis adalah
senyawa 2-benzilidensikloheksana-1,3-dion menggunakan katalis natrium
hidroksida (Istyastono, Yuniarti, dan Jumina, 2009), senyawa 2-(4’
-klorobenzilidena) sikloheksana-1,3-dion dengan katalis kalium hidroksida
(Christy, 2010), senyawa 2-(4’-hidroksibenzilidena) sikloheksana-1,3-dion
menggunakan katalis kalium hidroksida (Setiawati, 2012), senyawa 2-(4’
-hidroksibenzilidena) sikloheksana-1,3-dion menggunakan katalis asam klorida
(Santoso, 2012), dan senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion menggunakan katalis kalium hidroksida (Limanto,
2013).
3. Manfaat penelitian a. Manfaat teoretis
Memberikan informasi terkait dengan reaksi kondensasi aldol
silang pada sintesis senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion dari sikloheksana-1,3-dion dan
4-hidroksi-3-metoksibenzaldehida dengan katalis asam klorida (HCl) menggunakan
b. Manfaat metodologi
Memberikan informasi terkait tata cara dan kondisi dari sintesis
senyawa 2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion dari
sikloheksana-1,3-dion dan 4-hidroksi-3-metoksibenzaldehida dengan
katalis asam klorida (HCl) menggunakan metodesolid phase reaction.
c. Manfaat praktis
Memberikan informasi mengenai penggunaan metode yang ramah
lingkungan (Green Chemistry) untuk melakukan sintesis senyawa 2-(4’
-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion dengan katalis
asam klorida (HCl).
B. Tujuan Penelitian
Penelitian yang dilakukan ini bertujuan untuk:
1. Mengetahui apakah senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion dapat disintesis dari sikloheksana-1,3-dion dan
4-hidroksi-3-metoksibenzaldehida dengan katalis asam klorida (HCl)
menggunakan metodesolid phase reaction.
2. Mengetahui apakah sintesis senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion dengan katalis asam klorida memberikan rendemen yang
7 BAB II
PENELAAHAN PUSTAKA
A. Kanker
Kanker merupakan penyakit yang disebabkan oleh pertumbuhan sel yang
tidak normal dimana sel tumbuh dengan sangat cepat, tidak terkontrol, dan tidak
berirama yang dapat menginvasi jaringan tubuh normal sehingga mempengaruhi
fungsi tubuh (NCI, 2013). Menurut data WHO (World Health Organization), pada
tahun 2008 7,6 juta orang di dunia meninggal akibat kanker (WHO, 2013).
Secara umum, ciri-ciri dari sel kanker antara lain memiliki kemampuan
mencukupi signal pertumbuhan sendiri, tidak sensitif terhadap signal
antipertumbuhan, dapat menghindari proses apoptosis, memiliki potensi replikasi
yang tidak terbatas (immortal), memiliki kemampuan membentuk pembuluh
darah baru (angiogenesis), dapat menginvasi jaringan lain dan masuk ke
peredaran darah (Hanahan and Weinberg, 2011).
Penelitian yang ada menunjukan bahwa faktor transkripsi protein NF-κB
berperan penting dalam mengontrol proliferasi dan kelangsungan hidup sel kanker
(Escárcega, Fuentes, Garcia, Gatica, dan Zamora, 2007). Aktivasi protein NF-κB
ini banyak diperantarai oleh adanyacancer-promoting agents(Lin, Bai, Chen, Xu,
2010). Pada sel kanker, protein NF-κB mengalami mutasi sehingga tetap aktif
walaupun dalam keadaan yang tidak dibutuhkan. Protein NF-κB yang selalu aktif
menyebabkan sel kanker terus membelah dan melindungi sel kanker dari peristiwa
dalam penemuan obat antikanker baru yaitu dengan menjadikan protein NF-κB
sebagai target (Dolcet, Llobet, Pallares, Guiu, 2005).
Menurut penelitian Weber et al. (2006), salah satu senyawa alam yang
diketahui memiliki aktivitas antikanker sebagai inhibitor NF-κB yaitu kurkumin
dimana gugusan α,β-unsaturated karbonil (enon) pada kurkumin diperkirakan
dapat menginaktivasi protein NF-κB sehingga sel kanker tidak dapat melakukan
proliferasi dan akan mati. Adanya kematian sel kanker ini disebabkan interaksi
antara gugusan α,β-unsaturated karbonil dan residu sistein pada protein NF-κB
yang mengakibatkan proteinNF-κBmenjadi tidak aktif (Surh, 2008).
B. Sintesis 2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion
Senyawa 2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion
dapat disintesis dari starting material sikloheksana-1,3-dion dan
4-hidroksi-3-metoksibenzaldehida dengan katalis HCl berdasarkan reaksi kondensasi aldol
silang. Senyawa sikloheksana-1,3-dion merupakan senyawa karbonil golongan
keton yang memiliki hidrogen alfa (α). Sedangkan senyawa
4-hidroksi-3-metoksibenzaldehida merupakan suatu aldehid aromatis dengan substituen gugus
hidroksi dan metoksi. Senyawa karbonil dengan hidrogen alfa (α) dapat
membentuk enol dengan adanya katalis asam, maka kondensasi aldol silang antara
aldehid dengan senyawa yang memiliki hidrogen alfa (α) dapat terjadi. Reaksi
kondensasi aldol silang melibatkan adisi nukleofilik suatu enol keton ke suatu
aldehid sehingga produk yang dihasilkan melepaskan sebuah molekul air dan
H3CO
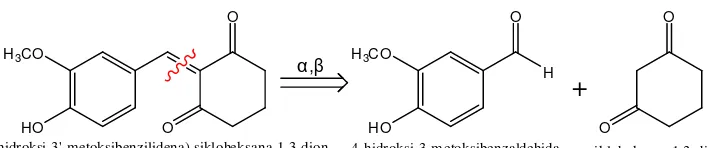
Gambar 3. Analisis diskoneksi senyawa 2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion
Sikloheksana-1,3-dion memiliki rumus molekul C6H8O2 dengan berat
molekul 112,12 g/mol dengan bentuk serbuk kristalin, titik lebur 103-105oC dan
titik didih 235,1oC. Senyawa ini larut dalam air dan pelarut lainnya, seperti
alkohol dan kloroform (Lide, 2004). Sedangkan senyawa
4-hidroksi-3-metoksibenzaldehida yang dikenal dengan nama dagangnya, yaitu vanilin
memiliki rumus molekul C8H8O3, memiliki berat molekul 152,15 g/mol. Vanilin
murni berupa kristal jarum berwarna putih atau krem (mengkilat) dengan
karakteristik aroma vanila dan rasa manis, larut dalam aseton, larutan alkali
hidroksida, kloroform, eter, metanol, dan minyak dan dapat teroksidasi pada
kondisi udara yang lembab dan paparan sinar matahari secara langsung. Berat
jenis vanilin adalah 1,056 g/mL dengan titik leleh 80-81oC dan titik didih pada
285oC. Di bidang kimia analitik, vanilin dapat digunakan sebagai pereaksi (Rowe,
Shesky dan Quinn, 2009).
Katalis merupakan suatu zat yang dapat mempercepat suatu reaksi kimia,
namun zat tersebut, secara kimiawi tidak mengalami perubahan yang permanen.
Penambahan katalis dalam suatu reaksi akan memberikan perubahan yang berarti
pada energi aktivasinya. Kehadiran suatu katalis dalam suatu reaksi dapat
menyediakan suatu rut
katalis memiliki energ
Katalis yang
metoksibenzilidena)-si
suasana asam, atom oksi
terprotonasi dan mem
alfa (α) untuk mengha
yang berfungsi seba
nukleofilisitas pada
karbonil pada senya
senyawa 2-(4’-hid
melepaskan molekul a
u rute alternatif bagi reaksi. Rute alternatif yang
nergi aktivasi yang rendah (Oxtoby, Gillis dan N
ang digunakan dalam sintesis senyawa
2-)-sikloheksana-1,3-dion adalah katalis asam
oksigen pada gugus karbonil pada sikloheksana
embentuk intermediate kation sehingga dapat
ghasilkan sebuah enol netral (McMurry, 2004)
sebagai nukleofil. Pembentukan enol akan
da Cα sikloheksana-1,3-dion dan akan meny
yawa 4-hidroksi-3-metoksibenzaldehida sehingg
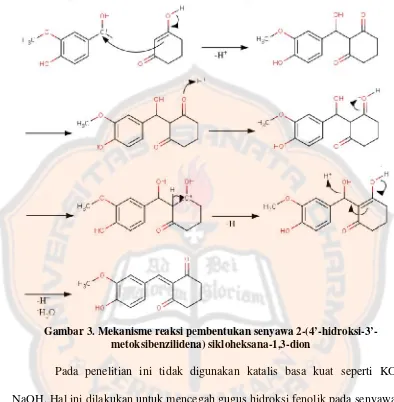
Gambar 3. Mek m
Pada penelit
NaOH. Hal ini dilakuka
hidroksi-3-metoksibenz
Gugus hidroksi fenol
lebih asam dibandingka
ekanisme reaksi pembentukan senyawa 2-(4’-hid metoksibenzilidena) sikloheksana-1,3-dion
nelitian ini tidak digunakan katalis basa kuat
kukan untuk mencegah gugus hidroksi fenolik pa
benzaldehida yang bersifat asam menjadi O- (
nolik pada senyawa 4-hidroksi-3-metoksibenza
ngkan Hαpada senyawa sikloheksana-1,3-dion.
OH akan cenderung lebih bereaksi dengan hi
3-metoksibenzaldehida dibandingkan denga
dion sehingga membentuk ion fenoksida (O-).
at bereaksi dengan C karbonil pada sikloheksan
dan menyebabkan senyawa target tidak terbentuk.
-hidroksi-3’
-n hidroksi fe-nolik
ngan Hα dari
-). Ion fenoksida
ksana-1,3-dion yang
seperti HCl akan memprotonasi atom oksigen pada sikloheksana-1,3-dion
sehingga membentuk enol yang kemudian bereaksi dengan
4-hidroksi-3-metoksibenzaldehida membentuk senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion. Selain itu penggunaan katalis asam mengarahkan reaksi
melalui kontrol termodinamika sehingga reaksi berjalan lebih lambat
dibandingkan dengan penggunaan katalis basa, tetapi memberikan reaksi samping
yang lebih kecil sehingga rendemen yang didapatkan lebih besar. Penggunaan
katalis asam juga dapat meningkatkan elektrofilisitas dari C karbonil
4-hidroksi-3-metoksibenzaldehida sehingga lebih mudah diserang oleh enol yang terbentuk.
C. Metode Pemurnian dan Pemeriksaan Kemurnian Senyawa Hasil Sintesis 1. Pemeriksaan organoleptis
Uji organoleptis adalah uji yang paling sederhana dan memuat paparan
mengenai sifat suatu zat secara umum meliputi wujud, warna, dan bau. Pernyataan
dalam uji ini tidak cukup kuat untuk menjadi syarat baku, tetapi meskipun
demikian secara tidak langsung dapat membantu penilaian pendahuluan terhadap
mutu zat yang bersangkutan (Dirjen POM RI, 1995). Selain itu, uji organoleptis
berguna sebagai identifikasi awal perbedaan antara senyawa hasil sintesis dengan
2. Pemeriksaan kelarutan
Uji kelarutan dilakukan untuk mengetahui sifat fisik suatu zat.
Pemeriksaan kelarutan zat padat dalam cairan dilakukan dengan melarutkan zat
padat tersebut hingga tepat jenuh pada suhu terkontrol kemudian hasilnya
dibandingkan dengan standar. Pada setiap pemeriksaan, kemurnian zat padat dan
pelarut harus terjamin karena sedikit pengotor dapat menyebabkan terjadinya
variasi hasil pemeriksaan (Jenkins, Knevel, and Digangi, 1965).
Kelarutan suatu zat sebagian besar disebabkan oleh polaritas dari pelarut
yaitu oleh momen dipolnya. Selain momen dipol, faktor lain yang berpengaruh
terhadap kelarutan zat antara lain tetapan dielektrik, asosiasi, solvasi, tekanan
dalam, reaksi asam-basa dan faktor-faktor lainnya (Martin and Bustamante, 1993).
Tabel I. Istilah kelarutan zat menurut Farmakope Indonesia IV Istilah kelarutan Jumlah bagian pelarut yang diperlukan
untuk melarutkan 1 bagian zat
Sangat mudah larut Kurang dari 1 Mudah larut 1 sampai 10
Larut 10 sampai 30 Agak sukar larut 30 sampai 100
Sukar larut 100 sampai 1.000 Sangat sukar larut 1.000 sampai 10.000 Praktis tidak larut Lebih dari 10.000
(Dirjen POM RI, 1995).
3. Rekristalisasi
Rekristalisasi merupakan suatu metode yang umum digunakan untuk
pemurnian zat padat. Metode ini didasarkan atas perbedaan antara kelarutan zat
memurnikan suatu zat harus disesuaikan dengan kondisi atau sifat zat yang akan
direkristalisasi (Bresnick, 2004). Berikut ini beberapa metode rekristalisasi:
a. Mengkristalkan kembali secara langsung dari cairan pelarut. Metode ini dilakukan dengan melarutkan zat padat ke dalam suatu pelarut, kemudian
disaring dan dikristalkan kembali dengan pendinginan atau dengan destilasi
pelarut tersebut.
b. Mengkristalkan kembali dengan asam atau basa. Prinsip metode ini adalah dengan melakukan pendesakan kristal dengan menetralkan pelarut. Senyawa
yang bersifat asam (seperti fenol) dilarutkan dalam natrium hidroksida atau
amonium hidroksida encer, kemudian direkristalisasi dengan mengasamkan
pelarut, sedangkan untuk senyawa basa (seperti amin) dilarutkan dalam asam
klorida atau asam sulfat kemudian direkristalisasi dengan membasakan pelarut.
c. Mengkristalkan kembali secara presipitasi dengan pelarut kedua. Metode ini dilakukan dengan melarutkan material dalam suatu pelarut, kemudian
dipilih pelarut kedua yang bercampur sempurna dengan pelarut pertama tetapi
senyawa yang dimurnikan tidak atau hampir tidak larut pada pelarut kedua.
Penambahan pelarut kedua akan membuat zat yang semula larut pada pelarut
pertama menjadi mengendap/mengkristal (Reksohadiprodjo, 1996).
Pelarut yang digunakan untuk proses rekristalisasi juga memiliki syarat
tertentu agar hasilnya optimal. Syarat pelarut yang digunakan adalah :
a. Pada suhu tinggi dapat melarutkan dalam jumlah banyak, namun pada suhu
rendah hanya sedikit melarutkan.
c. Dapat menghasilkan bentuk kristal yang baik dari senyawa yang dimurnikan
serta mudah dipisahkan dari bahan utama (titik didih pelarut rendah).
d. Tidak boleh bereaksi dengan senyawa yang dimurnikan atau bersifat inert
(Reksohadiprojo, 1996).
4. Pemeriksaan titik lebur
Pemeriksaan titik lebur adalah suatu aspek penting yang harus dilakukan
dalam penelitian sintesis suatu senyawa. Hal ini penting dilakukan karena
pemeriksaan titik lebur senyawa dapat memberikan informasi mengenai
kemurnian dari suatu senyawa yang telah disintesis. Umumnya suatu senyawa
dikatakan murni apabila memiliki rentang titik lebur yang tidak melebihi 2oC.
(MacKenzie, 1967).
5. Kromatografi Lapis Tipis (KLT)
Kromatografi merupakan suatu teknik pemisahan menggunakan dua fase
berbeda, fase diam (stationary phase) dan fase gerak (mobile phase) (Gandjar dan
Rohman, 2007). Senyawa yang akan dianalisis akan ditotolkan pada dasar
lempeng dan dielusi dengan fase gerak. Totolan tersebut akan bergerak naik oleh
adanya gaya kapilaritas (Bresnick, 2004).
Kromatografi Lapis Tipis dapat digunakan untuk analisis kualitatif
terhadap suatu senyawa. Parameter pada KLT yang digunakan untuk identifikasi
adalah nilai Rf. Nilai Rf (Retardation factor) merupakan nilai diperoleh dengan
membandingkan jarak yang ditempuh oleh bercak senyawa yang diidentifikasi
dikatakan identik apabila memiliki nilai Rf yang sama jika diukur pada kondisi
KLT yang sama (Ettre, 1993).
Untuk mengidentifikasi bercak yang ada pada lempeng KLT dapat
dilakukan dengan menempatkan lempeng KLT dibawah sinar UV atau dengan
menyemprotkan larutan yang dapat bereaksi dengan senyawa sehingga dapat
menimbulkan warna (Bresnick, 2004).
6. Liquid Chromatography(LC)
Kromatografi cair merupakan teknik pemisahan campuran senyawa
berdasarkan interaksi dengan fase diam di bawah aliran fase gerak, dimana fase
gerak dialirkan dengan bantuan tekanan menuju kolom secara cepat dan dideteksi
dengan detektor yang sesuai (Hendayana, 2006). Kromatografi Cair Kinerja
Tinggi (KCKT) merupakan metode kromatografi cair yang paling banyak
digunakan dalam analisis pemisahan, identifikasi dan penetapan kadar berbagai
macam komponen pada suatu campuran (Skoog, West, Holler, 1994).
Kegunaan umum KCKT antara lain untuk pemisahan sejumlah senyawa
organik, anorganik, maupun senyawa biologis, analisis ketidakmurnian, analisis
senyawa-senyawa yang tidak mudah menguap, penentuan molekul-molekul netral,
ionic maupun zwitter ion, isolasi dan pemurnian senyawa, pemisahan
senyawa-senyawa yang memiliki struktur yang mirip, pemisahan senyawa-senyawa-senyawa-senyawa dalam
jumlah yang sedikit, dalam jumlah banyak, dan dalam skala proses industri
Metode KCKT sendiri memiliki keterbatasan untuk identifikasi senyawa
kecuali jika KCKT dihubungkan dengan spektrometer massa (Gandjar dan
Rohman, 2007). Keuntungan dari penggunaan metode KCKT yang terintegrasi
dengan spektrometer massa antara lain memberikan hasil pemisahan yang lebih
baik dalam waktu yang relatif singkat, dapat digunakan untuk analisa kualitatif
maupun kuantitatif dari semua campuran senyawa-senyawa baik yang sukar
menguap atau mudah menguap, stabil atau tidak stabil terhadap panas, polar atau
non-polar (Wilson, Plumb, Granger, Major, Williams, Lenz, 2004).
D. Elusidasi Struktur
Elusidasi struktur senyawa hasil sintesis merupakan tahapan yang
penting sebab struktur dari senyawa hasil sintesis belum diketahui secara jelas.
Melalui elusidasi struktur ini, maka dapat diketahui struktur yang sebenarnya dari
senyawa hasil sintesis, apakah senyawa hasil adalah senyawa yang diharapkan
terbentuk atau bukan. Elusidasi struktur yang dilakukan meliputi :
1. Spektrofotometri inframerah (Infrared Spectrophotometry)
Spektrofotometri inframerah merupakan salah satu jenis spektroskopi
yang digunakan untuk mengidentifikasi gugus fungsional yang terdapat dalam
suatu senyawa. Bila radiasi elektromagnetik yang berkisar antara 400 cm-1 dan
4.000 cm-1(2.500 dan 20.000 nm) dilewatkan pada suatu sampel dan diserap oleh
ikatan-ikatan molekul di dalam sampel, maka molekul tersebut dapat mengalami
Spektra inframerah merupakan gambaran dari pita absorbsi yang khas
dari gugus fungsional yang ada pada molekul organik. Gugus-gugus fungsional
tersebut akan mengalami vibrasi karena adanya energi. Spektra yang dihasilkan
bisa digunakan untuk analisis kualitatif untuk mengetahui ada tidaknya suatu
gugus fungsional tertentu. Pembacaan spektra inframerah ini biasa dilakukan pada
daerah bilangan gelombang 650-4000 cm-1(Sastrohamidjojo, 2001).
Bila frekuensi energi elektromagnetik inframerah yang dilewatkan pada
suatu molekul sama dengan frekuensi meregang atau menekuk ikatan, maka
energi tersebut akan diserap oleh molekul tersebut. Serapan inilah yang kemudian
dapat direkam oleh detektor dan diubah menjadi pita serapan pada bilangan
gelombang tertentu (Atkins, Jones, dan Loretta, 2010).
2. Spektroskopi Massa (Mass Spectroscopy)
Spektroskopi massa merupakan salah satu jenis spektroskopi yang
digunakan untuk menentukan massa dan juga berat molekul suatu senyawa. Untuk
mendapatkan informasi yang mungkin mengenai struktur suatu senyawa, dapat
dilakukan dengan mengukur massa dari fragmen-fragmen yang terbentuk ketika
molekul mengalami pemecahan (Watson, 2009). Ada beberapa jenis teknik
ionisasi dari spektroskopi massa antara lain electron impact ionisation (EI), fast
atom bombardment (FAB), chemical ionisation (CI), atmospheric pressure
chemical ionisation (APCI), electrospray ionisation (ESI), field desorption (FD),
dan matrix assisted laser desorption ionisation(MALDI) (Willard, Merrit, Dean,
Metode FD-MS merupakan teknik ionisasi halus yang menghasilkan
sangat sedikit fragmentasi senyawa. Sejumlah kecil larutan sampel diendapkan
pada ujung kawat di spektrometer masa yang bertegangan +8kV. Medan listrik
terkuat terjadi pada ujung kawat yang sangat tajam sehingga dapat menyebabkan
keluarnya elektron dari sampel ke orbital kosong pada logam kawat dan sampel
membentuk ion positif (Williams, D.H., and Fleming, I., 1997).
Spektroskopi massa yang terintegrasi dengan kromatografi cair (Liquid
Chromatography-Mass Spectroscopy) merupakan metode yang sangat peka dan
spesifik dalam penentuan hampir semua jenis analit, dengan batas deteksi yang
rendah, dan memberikan informasi penting berupa spektra massa dari suatu
senyawa organik (Tureček dan McLafferty, 1993).
3. Proton Nuclear Magnetic Resonance Spectroscopy(1H-NMR)
Spektroskopi resonansi magnet inti merupakan salah satu metode yang
digunakan untuk melakukan elusidasi struktur senyawa. Ada beberapa jenis
spektroskopi resonansi magnet inti antara lain1H,2H,13C,15N,17O,27Al,29Si, dan
31
P (Silverstein, Webster, Kiemle, 2005). Spektroskopi 1H-NMR memberikan
keterangan tentang jumlah dan sifat lingkungan dari setiap tipe atom hidrogen
yang ada dalam struktur senyawa (Sastrohamidjojo, 2001).
Setiap inti isotop memiliki gerak berputar yang khas disekitar sumbu
yang menimbulkan adanya medan magnet disekelilingnya.. Analisis 1H-NMR
penyerapan energi yang berbeda dari tiap-tiap atom yang berputar dalam medan
magnet (Willard,et al., 1988).
E. Landasan Teori
Reaksi kondensasi aldol silang merupakan reaksi antara senyawa
aldehida atau keton yang memiliki sedikitnya satu hidrogen alfa dengan senyawa
karbonil lainnya pada suasana asam ataupun basa dengan melepaskan sebuah
molekul air dan membentuk senyawaα,β-unsaturatedkarbonil.
Sintesis senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
dion didasarkan pada reaksi kondensasi aldol silang antara
sikloheksana-1,3-dion dengan 4-hidroksi-3-metoksibenzaldehida. Senyawa sikloheksana-1,3-sikloheksana-1,3-dion
merupakan senyawa karbonil golongan keton yang memiliki hidrogen alfa (α).
Sedangkan senyawa 4-hidroksi-3-metoksibenzaldehida merupakan suatu aldehid
aromatis dengan substituen gugus hidroksi dan metoksi. Sikloheksana-1,3-dion
dapat membentuk enol dengan adanya katalis asam. Enol ini akan bertindak
sebagai nukleofil yang akan menyerang C karbonil pada
4-hidroksi-3-metoksibenzaldehida yang bermuatan parsial positif. Reaksi kondensasi aldol
silang tersebut akan menghasilkan produk akhir senyawaα,β-unsaturatedkarbonil
yaitu 2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion.
Sintesis 2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion
dilakukan dengan menggunakan katalis asam kuat (HCl). Penggunaan katalis
asam mengarahkan reaksi melalui kontrol termodinamika sehingga reaksi
memberikan reaksi samping yang lebih kecil sehingga rendemen yang didapatkan
lebih besar. Penggunaan katalis asam juga dapat meningkatkan elektrofilisitas
dari C karbonil 4-hidroksi-3-metoksibenzaldehida sehingga lebih mudah diserang
oleh enol yang terbentuk.
F. Hipotesis
1. Senyawa 2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion dapat
disintesis dari sikloheksana-1,3-dion dan 4-hidroksi-3-metoksibenzaldehida
dengan katalis asam klorida (HCl) menggunakan metodesolid phase reaction.
2. Sintesis senyawa 2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion
dengan katalis asam klorida memberikan rendemen yang lebih baik
22
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang berjudul “Sintesis 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion dari sikloheksana-1,3-dion dan
4-hidroksi-3-metoksibenzaldehida dengan katalis asam klorida (HCl) menggunakan metode
solid phase reaction”merupakan penelitian non-eksperimental deskriptif non analitik
karena pada penelitian ini tidak diberikan perlakuan pada subjek uji dan hanya
dipaparkan peristiwa yang terjadi sehingga tidak terdapat hubungan sebab akibat di
dalamnya.
B. Definisi Operasional
1. Starting materialmerupakan bahan awal yang digunakan dalam proses sintesis
2-(4’-hidroksi-3’-metoksibenzilidena) sikloheksana-1,3-dion. Starting material yang
digunakan adalah sikloheksana-1,3-dion dan 4-hidroksi-3-metoksibenzaldehida.
2. Katalisator adalah senyawa yang digunakan dalam reaksi untuk mempercepat
terjadinya reaksi antara starting material. Katalisator yang digunakan dalam
penelitian ini adalah asam klorida (HCl).
3. Senyawa targetmerupakan senyawa hasil sintesis yang diharapkan terbentuk dari
hasil reaksi. Senyawa target dalam penelitian ini adalah
4. Rendemen senyawa hasil sintesis merupakan perbandingan antara jumlah
senyawa yang diperoleh dari hasil sintesis (aktual) yang dibandingkan dengan
jumlah senyawa yang diperoleh secara teoretis. Dalam penelitian ini, rendemen
senyawa hasil sintesis adalah rendemen 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion.
C. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini meliputi
sikloheksana-1,3-dion (p.a., Aldrich), 4-hidroksi-3-metoksibenzaldehida (p.a, Merck), HCl (p.a.,
Merck), etil asetat (p.a., Merck), kloroform (p.a., Merck), etanol (p.a., Merck),
DMSO (p.a., Merck), silika gel 60 F254 (Merck), aquades (Laboratorium Kimia
Organik Universitas Sanata Dharma), dan aquabides (Laboratorium Kimia Analisis
Instrumental Universitas Sanata Dharma).
D. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini meliputi neraca analitik
(Mextler PM 100), mortir dan stamper, alat pengukur titik lebur (MP70, Mettler
Toledo), seperangkat alat gelas, corong Buchner, baskom, pompa vakum, kertas
lakmus, kertas saring, desikator, mikropipet, magnetic stirrer, penangas air, spatula,
lempeng kaca, lampu UV 254 nm, chamber kromatografi, spektrometer IR (IR
Shimadzu Prestige-21), kromatografi cair-spektrometer massa (Hitachi L 6200), dan
1
E. Tata Cara Penelitian
a. Sintesis 2-(4'hidroksi-3’-metoksibenzilidena)sikloheksana-1,3-dion
Senyawa 4-hidroksi-3-metoksibenzaldehida ditimbang sebanyak 0,608 g
(4 mmol) ditambah HCl pekat sebanyak 5 tetes di dalam mortir kecil kemudian
diaduk dengan stamper hingga tercampur merata. Setelah kedua senyawa
bercampur kemudian ditambah sikloheksana-1,3-dion sebanyak 0,448 g (4
mmol). Campuran tersebut diaduk selama 5 menit hingga homogen dan terjadi
perubahan warna campuran. Setelah itu, campuran ditambahkan natrium
bikarbonat 10% hingga mencapai pH netral. Campuran direkristalisasi dengan
menggunakan etanol 96% didalam beker gelas dan dipanaskan di atas penangas
air dengan bantuan magnetic stirrer hingga larut. Larutan tersebut kemudian
didinginkan hingga suhu ruangan dan ditutup denganparafilm. Beker gelas yang
berisi larutan tersebut didinginkan dalam lemari es selama 48 jam.
Endapan yang terbentuk dari hasil rekristalisasi disaring menggunakan
corong Buchner dengan bantuan pompa vakum kemudian direkristalisasi ulang
dengan etanol 96% panas. Kristal yang terbentuk dikeringkan didalam desikator
selama 24 jam. Setelah kering kristal ditimbang dan dihitung rendemennya.
b. Analisis senyawa hasil sintesis
a. Uji organoleptis
Senyawa hasil sintesis diamati sifat fisiknya yang meliputi bentuk,
b. Uji kelarutan dari senyawa hasil sintesis
Senyawa hasil sintesis sebanyak 10 mg dimasukkan ke dalam
tabung reaksi, kemudian ditambahkan dengan aquades tetes demi tetes,
amati kelarutannya. Prosedur in dilakukan juga pada pelarut etanol 96%,
kloroform, n-heksan, etil asetat, larutan natrium hidroksida 3N, dan larutan
asam klorida 3N. kemudian dibandingkan kelarutannya dengan starting
materialyang digunakan.
c. Uji titik lebur
Sejumlah serbuk hasil sintesis diisikan ke dalam electrotherma
capillary tubes, kemudian dimasukan dalam alat pengukur titik lebur.
Diamati peleburan kristalnya dan dicatat suhu waktu pertama kali melebur
hingga serbuk melebur seluruhnya. Hasil pengukuran kemudian
dibandingkan dengan hasil pengukuran titik lebur pada starting material
yang digunakan.
d. Kromatografi lapis tipis (KLT)
Senyawa hasil sintesis dan starting material masing-masing
dilarutkan dalam DMSO dengan co-solvent etil asetat. Masing-masing
senyawa tersebut ditotolkan sebanyak 20 µL menggunakan mikropipet pada
lempeng silika gel F254 yang telah diaktifkan pada suhu 125°C selama 30
menit. Setelah totolan kering, dielusi dengan fase gerak etil asetat :
bercak dilakukan di bawah sinar UV 254 nm. Setelah diketahui adanya
bercak, maka dilakukan perhitunganRfuntuk masing-masing bercak.
e. Kromatografi Cair
Senyawa hasil sintesis dilarutkan dengan pelarut metanol : air
(95:5), kemudian dilakukan pemeriksaan dengan kolom LC Supelco 5µ
C18m 250 x 2 mm, suhu kolom setara dengan suhu ruangan, pelarut A
adalah air dengan asam asetat 0,3%, dan pelarut B adalah asetonitril dengan
asam asetat 0,3%, kecepatan alir fase gerak total 1 mL/menit dengan elusi
isokratik.
Kemurnian masing-masing sampel dihitung berdasarkan rasio
antara luas area puncak kromatogram yang dimaksud terhadap jumlah luas
area dari seluruh puncak kromatogram dikalikan dengan seratus persen.
f. Elusidasi struktur senyawa hasil sintesis
Elusidasi struktur dari senyawa hasil sintesis dilakukan dengan
menggunakan spektrofotometer inframerah (IR), spektrometer massa (MS),
dan1H-NMR.
1) Spektroskopi inframerah
Senyawa hasil sintesis sebanyak ± 0,5-1 mg dicampur dengan ±10
mg KBr hingga homogen. Campuran tersebut kemudian dikempa dan dibuat
menjadi tablet. Cahaya inframerah keluar dari sumber sinar, kemudian
dilewatkan pada cuplikan. Cahaya yang dilewatkan tersebut nantinya akan
Intensitas relatif dari frekuensi individu tersebut akan terukur pada detektor
hingga diperoleh spektra inframerah untuk senyawa bersangkutan.
2) Mass Spectroscopy(MS)
Senyawa hasil sintesis dilarutkan dalam pelarut metanol kemudian
diinjeksikan ke dalam alat spektroskopi massa dengan metode Fluid
Desorption (FD). Spektra MS senyawa hasil sintesis murni yang diperoleh
diinterpretasikan dengan melihat ion molekul yang muncul sebagai M+,
sehingga dapat diketahui bobot molekul (BM) senyawa hasil sintesis murni.
3) Spektroskopi proton resonansi magnet inti (1H-NMR)
Sampel senyawa hasil sintesis dilarutkan dengan CDCl3 dalam
tabung, kemudian diperiksa dengan spektrometer 1H-NMR (Delta 2_NMR).
Hasil spektra 1H-NMR senyawa hasil sintesis diinterpretasikan dengan
melihat posisi atom H sehingga dapat diketahui perkiraan struktur senyawa
hasil sintesis berdasarkan posisi atom H-nya.
F. Analisis Hasil
1. Perhitungan rendemen
Perhitungan rendemen senyawa hasil sintesis dilakukan pada kristal yang
murni dan dikeringkan.
rendemen = berat senyawa hasil sintesis
2. Analisis pendahuluan
Analisis pendahuluan senyawa hasil sintesis didasarkan pada data
organoleptis, data kelarutan, dan kromatogram kromatografi lapis tipis hasil
pengujian.
3. Pemeriksaan kemurnian dari senyawa hasil sintesis
Untuk pemeriksaan kemurnian senyawa hasil sintesis, data yang
digunakan berupa hasil uji titik lebur dan uji kromatografi cair.
4. Elusidasi struktur
Elusidasi struktur dari senyawa hasil sintesis didasarkan pada data spektra
29 A. Sintesis 2-(4’
-Sintesis sen
1,3-dion dilakukan de
1,3-dion dan 4-hidroksi
dengan metode solid
yang memiliki dua
hidroksi-3-metoksibenz
hidrogen alfa. Kedua
kondensasi aldol sil
metoksibenzilidena) si
Gambar 4. Sikohe
Sikloheksana
hidrogen alfa yang be
tinggi karena adanya
karbonil kekurangan
sehingga enol akan m
29 BAB IV
HASIL DAN PEMBAHASAN
4’-hidroksi-3’-metoksibenzilidena) sikloheksan
senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
n dengan menggunakan starting material berupa
oksi-3-metoksibenzaldehida dengan katalis asa
solid phase reaction. Sikloheksana-1,3-dion merupa
dua gugus keton dengan enam hidrogen alfa,
benzaldehida merupakan suatu aldehida yang
dua starting material ini dimungkinkan bereaksi
silang sehingga menghasilkan senyawa
2-) sikloheksana-1,3-dion.
oheksana-1,3-dion dengan enam hidrogen alfa dan karbonil
ksana-1,3-dion memiliki enam hidrogen alfa (gam
berada diantara 2 gugus keton memiliki re
ng tidak memiliki
ksi melalui reaksi
2-(4’-hidroksi-3’
-a d-an du-a gugus
gambar 4) dimana
reaktivitas paling
yebabkan atom C
Proses sintesis senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion diawali dengan peningkatan elektrofilisitas dari
4-hidroksi-3-metoksibenzaldehida oleh katalis asam klorida. Kemudian ditambahkan
sikloheksana-1,3-dion yang akan membentuk intermediate enol. Pembentukan
intermediate enol diawali dengan adanya protonasi atom O pada gugus karbonil
dari sikloheksana-1,3-dion oleh katalis HCl sehingga terbentuk atom C karbonil
yang bermuatan positif. Terbentuknya muatan positif pada atom C karbonil
mengakibatkan atom Hα akan mudah lepas sehingga menghasilkan intermediate
enol. Intermediate enol akan meningkatkan nukleofilisitas Cα dari
sikloheksana-1,3-dion sehingga lebih reaktif dan lebih mudah menyerang atom C karbonil pada
senyawa 4-hidroksi-3-metoksibenzaldehida yang bermuatan parsial positif.
Muatan positif yang terbentuk pada C karbonil senyawa
4-hidroksi-3-metoksibenzaldehida merupakan akibat pengaruh induksi atom oksigen yang
bersifat elektronegatif dan resonansi pada gugus karbonil. Adanya atom O pada
gugus karbonil yang bersifat elektronegatif menyebabkan elektron pada atom C
karbonil lebih tertarik pada atom oksigen sehingga menyebabkan muatan parsial
positif pada atom C karbonil. Terbentuknya muatan parsial positif memungkinan
enol dari sikloheksana-1,3-dion dapat menyerang C karbonil dari senyawa
4-hidroksi-3-metoksibenzaldehida sehingga dihasilkan senyawa 2-(4’-hidroksi-3’
-metoksibenzilidena) sikloheksana-1,3-dion.
Proses sintesis senyawa 2-(4’-hidroksi-3’-metoksibenzilidena)
sikloheksana-1,3-dion dilakukan dengan metode solid phase reaction dimana
hingga homogen kemudian ditambahkan dengan sikloheksana-1,3-dion. Starting
material yang digunakan digerus didalam mortir dengan tujuan untuk meratakan
persebaran dan memperkecil ukuran partikel. Adanya penggerusan menyebabkan
ukuran partikel dari starting material menjadi lebih kecil dan luas bidang kontak
antar partikel semakin besar sehingga reaksi dapat berlangsung secara efisien.
Pada proses penggerusan, akan terjadi perubahan warna campuran dari yang
semula berwarna putih menjadi berwarna kekuningan yang menandakan adanya
reaksi yang terjadi. Perubahan warna tersebut disebabkan oleh perpanjangan
gugus kromofor yang terjadi dalam proses sintesis. Adanya energi yang diberikan
melalui proses penggerusan mengakibatkan terjadinya reaksi pada campuran
tersebut.
Proses penggerusan berlangsung selama 5 menit. Setelah itu campuran
ditambahkan natrium bikarbonat 10% untuk menghilangkan sisa dari katalis asam
(HCl) yang digunakan. Endapan yang terbentuk kemudian disaring dan
direkristalisasi dengan menggunakan etanol 96%. Proses rekristalisasi dilakukan
dengan bantuan pemanasan untuk meningkatkan kelarutan dari senyawa hasil
sintesis dalam etanol 96%. Dalam penelitian ini dilakukan dua kali proses
rekristalisasi untuk menghasilkan senyawa dengan kemurnian yang tinggi.
Endapan yang terbentuk dari proses rekristalisasi kemudian disaring dan
dikeringkan di dalam desikator selama dua hari. Pengeringan selama dua hari
dimaksudkan agar pengeringan berlangsung secara optimal dan didapatkan serbuk
Hasil rekrista
kali replikasi yaitu se
yang didapat perlu di
didapat merupakan se
sikloheksana-1,3-dion.
istalisasi menunjukkan berat kristal yang dida
u sebesar 0,091; 0,083; dan 0,087 gram. Krist
u dianalisis lebih lanjut untuk memastikan apaka
n senyawa target yaitu 2-(4’-hidroksi-3-metoksi
dion.
B. Analisis Pendahuluan organoleptis
ksaan organoleptis dilakukan dengan melihat pe
awa hasil sintesis yang dihasilkan. Pemeriksaa
hui sifat fisik dari senyawa hasil sintesi
n sifat fisik dari senyawa hasil sintesis denganst
. Pemeriksaan ini meliputi bentuk, warna, dan ba
rbandingan sifat fisik senyawa hasil sintesis d
material
ksaan organoleptis yang dilakukan pada senyaw
profil yang berbeda dengan starting material y
tampak nyata adalah starting materialberbent
dapatkan dari tiga
ristal hasil sintesis
pakah kristal yang
sedangkan senyawa hasil sintesis berbentuk kristal putih. Dari segi bau,
starting material masing-masing memiliki bau yang khas tetapi senyawa hasil
sintesis tidak berbau. Hasil pemeriksaan organoleptis menunjukkan bahwa
senyawa hasil sintesis merupakan senyawa yang berbeda dengan starting
materialyang digunakan dari segi bentuk dan bau.
2. Pemeriksaan kelarutan
Pemeriksaan kelarutan senyawa hasil sintesis dilakukan untuk
mengetahui profil kelarutan dari senyawa hasil sintesis pada beberapa pelarut
dengan kepolaran yang berbeda-beda dan untuk membandingkan kelarutan
antara senyawa hasil sintesis dengan starting materialyang digunakan. Dalam
pengujian, pelarut yang digunakan antara lain: air dingin, air panas, etanol,
DMSO, etil asetat, kloroform, NaOH 3N, HCl 3N, dan n-heksan. Pemeriksaan
kelarutan tersebut akan menghasilkan data kelarutan dari senyawa hasil sintesis
yang dapat digunakan sebagai panduan dalam pemilihan pelarut yang sesuai
Tabel III. Perbandingan kelarutan senyawa hasil sintesis danstarting
DMSO mudah larut mudah larut larut
Air dingin mudah larut sukar larut sangat sukar larut Air panas (80oC) mudah larut agak sukar larut sangat sukar larut NaOH 3N mudah larut mudah larut larut
HCl 3N larut agak sukar larut sukar larut Etanol 96% mudah larut mudah larut agak sukar larut Etil asetat mudah larut mudah larut larut
Aseton mudah larut mudah larut larut
Kloroform larut agak sukar larut mudah larut n-heksan praktis tidak
larut
praktis tidak larut praktis tidak larut
Hasil pemeriksaan kelarutan menunjukkan bahwa senyawa hasil sintesis
larut dalam pelarut etil asetat, aseton, dan kloroform. Selain itu, terlihat bahwa
senyawa hasil sintesis dan starting material memiliki profil kelarutan yang
berbeda. Hal tersebut menunjukkan bahwa senyawa hasil sintesis merupakan
senyawa yang berbeda dengan starting material yang digunakan dimana
senyawa hasil sintesis cenderung lebih larut pada pelarut yang bersifat non
polar.
3. Pemeriksaan titik lebur
Pemeriksaan titik lebur dilakukan untuk mengetahui kemurnian dari
senyawa hasil sintesis yang dihasilkan. Selain itu, pemeriksaan ini juga
berguna untuk memastikan bahwa senyawa hasil sintesis merupakan senyawa
yang berbeda dengan starting material yang digunakan dengan cara
yang digunakan. Dari hasil pengujian diketahui bahwa jarak lebur dari senyawa
hasil sintesis sebesar 238,42 - 239,16˚C. Hasil ini menunjukkan bahwa serbuk
senyawa hasil sintesis memiliki jarak lebur sebesar 0,74˚C yang menandakan
bahwa senyawa hasil sintesis sudah murni. Titik lebur tersebut menunjukkan
bahwa senyawa hasil sintesis merupakan senyawa yang berbeda dengan
starting material yang digunakan karena senyawa hasil sintesis memiliki titik
lebur yang jauh lebih tinggi dibandingkan dengan starting material yang
digunakan. Titik lebur senyawa hasil sintesis yang lebih tinggi disebabkan
ukuran molekul senyawa hasil sintesis yang lebih besar jika dibandingkan
denganstarting materialyang digunakan. Semakin besar ukuran molekul suatu
senyawa, maka titik leburnya akan semakin tinggi pula.
Tabel IV. Jarak lebur senyawa hasil sintesis danstarting material
Senyawa Jarak lebur (oC) Titik lebur
standar (oC)
Senyawa hasil sintesis 238,42–239,16 -Sikloheksana-1,3-dion 103,06–104,92 103–105 4-hidroksi-3-metoksibenzaldehida 082,45–083,02 080–081
(Lide, 2004; Roweet al., 2009).
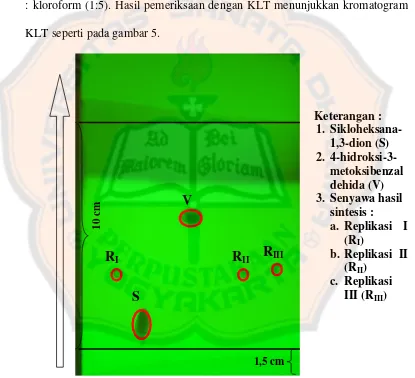
4. Pemeriksaan kemurnian dengan kromatografi lapis tipis (KLT)
Pemeriksaan kemurnian senyawa hasil sintesis menggunakan
kromatografi lapis tipis (KLT) dapat digunakan sebagai identifikasi awal
secara kualitatif yang menunjukkan bahwa senyawa hasil sintesis merupakan
senyawa yang berbeda dengan starting material yang digunakan. Selain itu,
pemeriksaan ini juga digunakan untuk menunjukkan kemurnian dari senyawa
hasil sintesis. Parameter yang digunakan adalah nilai Rf (retardation factor)
lempeng KLT. Tiap senyawa memiliki nilai Rf yang spesifik sesuai dengan
interaksinya pada fase diam dan fase gerak yang digunakan.
Pada penelitian ini, pemeriksaan KLT dilakukan dengan
menggunakan fase diam silika gel F254 yang dapat berfluoresensi hijau jika
dilihat dibawah sinar UV 254 nm. Fase gerak yang digunakan adalah etil asetat
: kloroform (1:5). Hasil pemeriksaan dengan KLT menunjukkan kromatogram
KLT seperti pada gambar 5.
Keterangan :
Gambar 5. Penampakan lempeng KLT dibawah sinar UV 254 nm
Hasil pemeriksaan dengan KLT memperlihatkan masing-masing
totolan menghasilkan bercak yang memadamkan fluoresensi (berwarna hitam).
Totolan dari kedua starting material yang digunakan (bercak S dan V) dan
senyawa hasil sintesis (bercak R) menunjukkan bercak tunggal.
Berdasarkan bercak yang muncul pada lempeng KLT, maka dapat
diidentifikasi secara kualitatif bahwa senyawa hasil sintesis merupakan
senyawa yang berbeda dengan starting material yang digunakan. Hal ini
ditunjukan dari adanya perbedaan nilai Rf pada bercak totolan senyawa hasil
sintesis dengan starting material yang digunakan seperti yang terlihat pada
tabel V.
Tabel V. Nilai Rfsenyawa hasil sintesis danstarting material
Senyawa Nilai Rf
Dalam pemeriksaan ini juga dilakukan pengelusian pada senyawa
hasil replikasi untuk mengetahui reprodusibilitas dari metode sintesis yang
digunakan. Dari hasil yang diperoleh, diketahui bahwa senyawa hasil replikasi
memiliki nilai Rf yang cenderung sama. Sehingga dapat disimpulkan bahwa
senyawa hasil replikasi merupakan senyawa yang sama dengan senyawa hasil
sintesis dan metode yang digunakan memiliki reprodusibilitas yang baik.
Dalam penelitian ini, analisis kemurnian senyawa hasil sintesis
dilakukan dengan menggunakan kromatografi cair. Penggunaan instrumen ini
memberikan keuntungan yaitu adanya pemisahan terhadap campuran senyawa
hasil sintesis.
Instrumentasi kromatografi yang digunakan dalam penelitian ini
merupakan kromatografi cair fase terbalik (reverse phase). Hal ini ditunjukkan
pada fase diam yang digunakan yaitu kolom C18 cenderung lebih non polar
dibandingkan fase geraknya yaitu metanol : air (95:5).
Gambar 6. Kromatogram LC senyawa hasil sintesis
Dari kromatogram yang diperoleh, terlihat bahwa hanya ada satupeak
senyawa yang muncul dengan waktu retensi 2,432 menit dan luas area 100%.
Hal tersebut membuktikan bahwa senyawa hasil sintesis merupakan senyawa
tunggal (murni). Walaupun telah diketahui bahwa senyawa hasil sintesis
merupakan senyawa murni, terbentuknya senyawa target belum dapat
diidentifikasi berdasarkan data kromatogram tersebut. Oleh sebab itu, perlu
dilakukan elusidasi struktur untuk mengetahui struktur dari senyawa yang
C. Elusidasi Struktur Senyawa Hasil Sintesis
Elusidasi struktur merupakan suatu bagian yang sangat penting dalam
proses sintesis senyawa baru dimana elusidasi struktur dilakukan untuk
mengetahui struktur dari senyawa hasil sintesis. Dalam penelitian ini, elusidasi
struktur yang dilakukan antara lain sebagai berikut:
1. Elusidasi struktur senyawa hasil sintesis dengan spektroskopi massa
Pengujian spektroskopi massa dari senyawa hasil sintesis dilakukan
dengan menggunakan menggunakan metode FD-MS ion positif. Dari spektra
massa diketahui puncak dengan intensitas tertinggi (base peak) yang muncul
pada spektra tersebut memberikan informasi terkait massa molekul senyawa
hasil sintesis yang dinyatakan dalam M+. Dari spektra tersebut terlihat senyawa
hasil sintesis memiliki massa molekul sebesar 340,1 g/mol. Hasil tersebut tidak
sesuai dengan massa molekul senyawa target yaitu 2-(4’-hidroksi-3’
-metoksibenzilidena) sikloheksana-1,3-dion sebesar 246 g/mol yang
Gambar 7. Spektra massa senyawa hasil sintesis
Spektra massa tersebut juga menunjukkan beberapa puncak lain yang
merupakan hasil ionisasi dari senyawa hasil sintesis yang terukur sebagai
[M+H]+, [M+2H]+, 2M+, dan [2M+H]+. M+
[M+H]+
[M+2H]+ 2M
+
Gambar 8. In 2. Elusidasi struktu
inframerah
Spektrofot
informasi terkait g
Dari hasil penguj
diketahui bahwa se
ditandai dengan munc
1
dengan intensita
munculnya pita se
serapan tersebut di
ar 8. Interpretasi spektra massa senyawa hasil ktur senyawa hasil sintesis dengan sp
ofotometri inframerah (IR) dapat memberi
t gugus fungsional yang terdapat dalam senyaw
gujian spektrofotometri inframerah senyawa
senyawa hasil sintesis memiliki gugus karboni
n munculnya pita serapan pada bilangan gelomba
nsitas kuat dan tajam. Gugus alkena (C=C) di
serapan pada panjang gelombang 1651,06
t diperkuat dengan serapan pada bilangan gelom
asil sintesis
spektrofotometri
berikan gambaran
awa hasil sintesis.
wa hasil sintesis,
bonil (C=O) yang
bang 1643,35 cm
-) ditandai dengan
1651,06 cm-1. Adanya
cm-1 yang merupakan penanda adanya alkil alifatis. Kedua pita serapan
tersebut mempertegas informasi adanya ikatan C=C alifatis yang merupakan
ciri khas dari senyawa yang diharapkan terbentuk yaitu α,β-unsaturated
karbonil. Interpretasi spektra inframerah senyawa hasil sintesis dapat dilihat
pada tabel VI.
Gambar 9. Spektra inframerah senyawa hasil sintesis (pelletKBr)
Jika dibandingkan dengan starting material yang digunakan, tampak
adanya perbedaan pita serapan yang muncul. Perbedaan tersebut terlihat pada
serapan gugusan karbonil sikloheksana-1,3-dion yang muncul pada bilangan
gelombang 1566,20 cm-1 dengan intensitas kuat dan melebar. Bentuk peak
yang melebar disebabkan oleh adanya hidrogen alfa yang diapit oleh dua gugus
keton menyebabkan terjadinya fenomena tautomerisasi, dimana pada kondisi
asam ataupun basa berair, sikloheksana-1,3-dion akan berada dalam bentuk
keto dan enol. Pita serapan lainnya yang merupakan ciri khas