PRAKTIKUM PROSES KIMIA PRAKTIKUM PROSES KIMIA
MATERI: MATERI: Elektroplating Elektroplating Disusun Oleh: Disusun Oleh: Dyah Ayu Dewi A
Dyah Ayu Dewi A 2103011512005821030115120058 Fiqky Akbar W. M
Fiqky Akbar W. M 2103011513014221030115130142 Gelbert
Gelbert Jethro Jethro S S 2103011513016521030115130165 Talita
Talita Maharani Maharani 2103011514018721030115140187
LABORATORIUM PROSES KIMIA LABORATORIUM PROSES KIMIA TEKNIK KIMIA FAKULTAS TEKNIK TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO UNIVERSITAS DIPONEGORO SEMARANG SEMARANG 2017 2017
HALAMAN
HALAMANPENGESAHANPENGESAHAN
Laporan praktikum berjudul Elektroplating yang disusun oleh Laporan praktikum berjudul Elektroplating yang disusun oleh Kelompok
Kelompok : : 2 2 / / KamisKamis Anggota
Anggota : : Dyah Dyah Ayu Ayu Dewi Dewi Anggraeni Anggraeni NIM: NIM: 2103011512210301151200580058 Fiqky
Fiqky Akbar Akbar Widya Widya Mukti Mukti NIM: NIM: 2103011513210301151301420142 Gelbert
Gelbert Jethro Jethro Sanyoto Sanyoto NIM: NIM: 2103011513210301151301650165 Talita
Talita Maharani Maharani NIM: NIM: 2103011514210301151401870187
Telah diterima dan disetujui pada : Telah diterima dan disetujui pada :
Hari : Hari : Tanggal : Tanggal : Semarang, 16 November 2017 Semarang, 16 November 2017 Mengetahui, Mengetahui, Dosen
Dosen Pembimbing Pembimbing Asisten Asisten PembimbingPembimbing
Prof. Dr. Istadi,ST., MT Prof. Dr. Istadi,ST., MT NIP 1971030
NIP 19710301199702100111997021001
Bayu Aji Pratama Bayu Aji Pratama NIM 2103011
HALAMAN
HALAMANPENGESAHANPENGESAHAN
Laporan praktikum berjudul Elektroplating yang disusun oleh Laporan praktikum berjudul Elektroplating yang disusun oleh Kelompok
Kelompok : : 2 2 / / KamisKamis Anggota
Anggota : : Dyah Dyah Ayu Ayu Dewi Dewi Anggraeni Anggraeni NIM: NIM: 2103011512210301151200580058 Fiqky
Fiqky Akbar Akbar Widya Widya Mukti Mukti NIM: NIM: 2103011513210301151301420142 Gelbert
Gelbert Jethro Jethro Sanyoto Sanyoto NIM: NIM: 2103011513210301151301650165 Talita
Talita Maharani Maharani NIM: NIM: 2103011514210301151401870187
Telah diterima dan disetujui pada : Telah diterima dan disetujui pada :
Hari : Hari : Tanggal : Tanggal : Semarang, 16 November 2017 Semarang, 16 November 2017 Mengetahui, Mengetahui, Dosen
Dosen Pembimbing Pembimbing Asisten Asisten PembimbingPembimbing
Prof. Dr. Istadi,ST., MT Prof. Dr. Istadi,ST., MT NIP 1971030
NIP 19710301199702100111997021001
Bayu Aji Pratama Bayu Aji Pratama NIM 2103011
RINGKASAN RINGKASAN
Kegiatan
Kegiatan pelapisan logam pelapisan logam akan akan menghasilkamenghasilkan n limbah limbah yang yang berbahaya dan berbahaya dan dapatdapat menjadi permasalahan yang kompleks bagi lingkungan sekitarnya. Limbah industri menjadi permasalahan yang kompleks bagi lingkungan sekitarnya. Limbah industri pelapisan
pelapisan logam logam yang yang tidak tidak dikelola dikelola dengan dengan baik baik dan dan benar benar dapat dapat mengakibatmengakibatkankan pencemar
pencemaran an lingkungan. lingkungan. Air Air limbah limbah industri industri pelapisan pelapisan logam logam umumnya umumnya banyakbanyak mengandung logam-logam berat, diantaranya adalah logam krom (Cr), tembaga (Cu), mengandung logam-logam berat, diantaranya adalah logam krom (Cr), tembaga (Cu), nikel (Ni). Tujuan dari praktikum ini adalah membekali mahasiswa dalam hal mengkaji nikel (Ni). Tujuan dari praktikum ini adalah membekali mahasiswa dalam hal mengkaji proses
proses reduksi reduksi dan dan pengendapapengendapan n logam-logam logam-logam berat berat yang yang terkandung terkandung dalam dalam larutanlarutan secara elektro
secara elektrokimia atau elektrolisis, mekankimia atau elektrolisis, mekanisme reaksi redukisme reaksi reduksi dan pengendapan logam-si dan pengendapan logam-logam berat dalam larutan secara reaksi elektrokimia, dan mengkaji kinetika reaksi logam berat dalam larutan secara reaksi elektrokimia, dan mengkaji kinetika reaksi reduksi dan pengendapan logam-logam berat dalam larutan
reduksi dan pengendapan logam-logam berat dalam larutan secara elektroksecara elektrokimiaimia Reaksi
Reaksi elektrokimelektrokimia ia sangat sangat penting penting dalam dalam mempelajarmempelajari i ilmu ilmu kimia kimia dan dan jugajuga aktivitas sehari-hari. Reaksi elektrokimia adalah reaksi spontan reduksi-oksidasi (reaksi aktivitas sehari-hari. Reaksi elektrokimia adalah reaksi spontan reduksi-oksidasi (reaksi redoks) yang dapat manghasilkan listrik. Melalui reaksi elektrokimia dapat diperoleh redoks) yang dapat manghasilkan listrik. Melalui reaksi elektrokimia dapat diperoleh informasi mengenai perubahan energi reaksi kimia sehingga membantu menganalisa informasi mengenai perubahan energi reaksi kimia sehingga membantu menganalisa sistem-sistem
sistem-sistem kimia. kimia. Michael Michael Faraday Faraday telah telah menjelasmenjelaskan kan adanya adanya hubungan hubungan kuantitatifkuantitatif antara jumlah perubahan kimia yang terjadi pada reaksi elektrokimia dengan jumlah antara jumlah perubahan kimia yang terjadi pada reaksi elektrokimia dengan jumlah arus. Jumlah perubahan kimia sebanding dengan jumlah mol elektron yang digunakan arus. Jumlah perubahan kimia sebanding dengan jumlah mol elektron yang digunakan pada reaks
pada reaksi oksidasi-reduki oksidasi-reduksisi Alat
Alat yang yang digunakan digunakan adalah adalah rangkaian rangkaian dari dari bak bak elektroplating, elektroplating, larutanlarutan elektrolit,power supply, kabel penghubung anoda dan kabel penghubung katoda. Bahan elektrolit,power supply, kabel penghubung anoda dan kabel penghubung katoda. Bahan yang digunakan
yang digunakan adalah larutan adalah larutan elektrolit CuSO4, elektrolit CuSO4, logam elektroda logam elektroda (tembaga dan (tembaga dan seng).seng). Praktikum
Praktikum ini ini dilakukan dilakukan dengan dengan mencarmencari i waktu waktu optimum optimum terlebih terlebih dahulu dahulu kemudiankemudian dilanjutkan dengan penentuan kuat arus dan
dilanjutkan dengan penentuan kuat arus dan konsentraskonsentrasi optimum.i optimum. Berdasarka
Berdasarkan n praktikum praktikum yang yang telah telah dilakukan dilakukan didapatkan didapatkan hasil hasil waktu waktu optimaloptimal elektroplating adalah 10 menit dengan penambahan berat Zn tertinggi yaitu 0,372 gr. elektroplating adalah 10 menit dengan penambahan berat Zn tertinggi yaitu 0,372 gr. Sementara pada penentuan kuat arus optimum, didapatkan kuat arus optimum sebesar Sementara pada penentuan kuat arus optimum, didapatkan kuat arus optimum sebesar 0,13 A dengan penambahan berat Zn tertinggi yaitu 0,372 gr. Pada penentuan 0,13 A dengan penambahan berat Zn tertinggi yaitu 0,372 gr. Pada penentuan konsentrasi larutan elektrolit CuSO4 dengan kuat arus 0,13 A, didapatkan konsentrasi konsentrasi larutan elektrolit CuSO4 dengan kuat arus 0,13 A, didapatkan konsentrasi larutan elektrolit optimum sebesar 2 gr/l dengan penambahan berat Zn tertinggi yaitu larutan elektrolit optimum sebesar 2 gr/l dengan penambahan berat Zn tertinggi yaitu 0,372 gr. Untuk proses elektroplating dengan kuat arus 0,13 A dan dengan konsentrasi 0,372 gr. Untuk proses elektroplating dengan kuat arus 0,13 A dan dengan konsentrasi larutan elektrolit CuSo4 sebesar 2 gr/l didapatkan nilai konstanta laju reaksi pelapisan larutan elektrolit CuSo4 sebesar 2 gr/l didapatkan nilai konstanta laju reaksi pelapisan Zn sebesar 0
Zn sebesar 0,372 gr/menit.,372 gr/menit.
Saran untuk praktikum ini adalah memastikan elektroda tercelup merata dan Saran untuk praktikum ini adalah memastikan elektroda tercelup merata dan sejajar saat dimasukkan ke dalam larutan elektrolit, menghindari kontak langsung antar sejajar saat dimasukkan ke dalam larutan elektrolit, menghindari kontak langsung antar elektroda karena dapat menyebabkan loncatan arus listrik serta memastikan elektroda karena dapat menyebabkan loncatan arus listrik serta memastikan penimbangan e
SUMMARY SUMMARY
Metal
Metal coating coating activitieactivities s will will producproduce e hazardhazardous ous waste waste and and can can be be a a complcomplexex problem f
problem for or the the enviroenvironment. nment. Non-manNon-managed aged and and propeproperly rly managemanaged d metal metal coatingcoatings s cancan cause environmental pollution. Metal coating wastewater generally contains heavy cause environmental pollution. Metal coating wastewater generally contains heavy metals, including chromium (Cr), copper (Cu), nickel (Ni). The purpose of this workshop metals, including chromium (Cr), copper (Cu), nickel (Ni). The purpose of this workshop is to equip students in studying the process of reduction and precipitation of heavy metals is to equip students in studying the process of reduction and precipitation of heavy metals contained in electrolysis or electrolysis solutions, reduction reaction mechanisms and contained in electrolysis or electrolysis solutions, reduction reaction mechanisms and precip
precipitation of itation of heavy metals in heavy metals in solution by solution by electrelectrochemochemical reaction, and ical reaction, and examinexamining theing the reaction kinetics of metal reduction and precipitation heavy metals in solution reaction kinetics of metal reduction and precipitation heavy metals in solution electrochemically
electrochemically Electr
Electrochemiochemical cal reactioreaction n is is very important very important in in studyinstudying g chemischemistry try as as well well as as dailydaily activities. The electrochemical reaction is a spontaneous reduction-oxidation reaction activities. The electrochemical reaction is a spontaneous reduction-oxidation reaction (redox reaction) that can produce electricity. Through the electrochemical reaction can be (redox reaction) that can produce electricity. Through the electrochemical reaction can be obtained information about changes in energy of chemical reactions so as to help analyze obtained information about changes in energy of chemical reactions so as to help analyze chemical systems. Michael Faraday has explained the quantitative relationship between chemical systems. Michael Faraday has explained the quantitative relationship between the amount of chemical changes that occur in electrochemical reactions with the amount the amount of chemical changes that occur in electrochemical reactions with the amount of current. The amount of chemical change is proportional to the number of moles of of current. The amount of chemical change is proportional to the number of moles of electrons used in oxidation-reduction reactions
electrons used in oxidation-reduction reactions
The instrument used is a series of electroplating basin, electrolyte solution, power The instrument used is a series of electroplating basin, electrolyte solution, power supply,
supply, anode anode connecconnector tor cable cable and and cathode cathode connecconnecting ting cable. cable. The The matermaterials ials used used areare CuSO4 electrolyte solution, metal electrode (copper and zinc). This practice is done by CuSO4 electrolyte solution, metal electrode (copper and zinc). This practice is done by finding
finding the the optimum optimum time time first first then then followed followed by by determdetermination ination of of currecurrent nt strengstrength th andand optimum concentration.
optimum concentration. Based on th
Based on the expere experiments thaiments that have beet have been obtainen obtained the optimad the optimal electropl electroplating time lating time isis 10 minutes with the highest Zn weight 0.372 gr. While on the determination of the 10 minutes with the highest Zn weight 0.372 gr. While on the determination of the optimum current strength, we get a strong optimum current of 0.13 A with the highest Zn optimum current strength, we get a strong optimum current of 0.13 A with the highest Zn weight increase is 0.372 gr. In determining the concentration of CuSO4 electrolyte weight increase is 0.372 gr. In determining the concentration of CuSO4 electrolyte solution
solution with with a a strong strong currecurrent nt of of 0.13 0.13 A, A, obtained obtained the the optimum optimum electrelectrolyte olyte solutionsolution concentration of 2 g / l with the highest Zn weight addition of 0.372 gr. For electroplating concentration of 2 g / l with the highest Zn weight addition of 0.372 gr. For electroplating proces
process s with with a a strong strong currencurrent t of of 0.13 0.13 A A and and with with a a conceconcentration ntration of of CuSo4 CuSo4 electrelectrolyteolyte solution o
solution of 2 g / l of 2 g / l obtained the btained the value of value of Zn coaZn coagulation rgulation rate conate constant rastant rate of 0.37te of 0.372 g / min.2 g / min. The advice for this practicum is to ensure that the electrodes are immersed and The advice for this practicum is to ensure that the electrodes are immersed and parallel when
parallel when inserteinserted d into into the the electroelectrolyte lyte solution, avoiding solution, avoiding direct contact direct contact betweebetween n thethe electrodes as they can cause electrical current jumps and ensure that the electrode electrodes as they can cause electrical current jumps and ensure that the electrode weighing is carried out in a dry state.
KATA
KATAPENGANTAR PENGANTAR
Puji dan syukur kami panjatkan kehadirat Allah SWT. Karena atas Puji dan syukur kami panjatkan kehadirat Allah SWT. Karena atas berkat- Nya
Nya lah lah kami kami dapat dapat menyusun menyusun laporan laporan Praktikum Praktikum Proses Proses materi materi ElektroplatingElektroplating dengan lancar dan sesuai dengan harapan kami.
dengan lancar dan sesuai dengan harapan kami.
Tujuan dari pembuatan laporan ini adalah untuk mengkaji proses reduksi Tujuan dari pembuatan laporan ini adalah untuk mengkaji proses reduksi dan pengendapan logam-logam berat yang terkandung dalam larutan secara dan pengendapan logam-logam berat yang terkandung dalam larutan secara elektrokimia atau elektrolisis, mengkaji mekanisme reaksi reduksi dan elektrokimia atau elektrolisis, mengkaji mekanisme reaksi reduksi dan pengendapan
pengendapan logam-logam logam-logam berat berat dalam dalam larutan larutan secara secara reaksi reaksi elektrokimia, elektrokimia, dandan mengkaji kinetika reaksi reduksi dan pengendapan logam-logam berat dalam mengkaji kinetika reaksi reduksi dan pengendapan logam-logam berat dalam larutan secara
larutan secara elektrokielektrokimia.mia.
Laporan ini tidak dapat terselesaikan tanpa bantuan dan kerja sama dari Laporan ini tidak dapat terselesaikan tanpa bantuan dan kerja sama dari berbagai
berbagai pihak, pihak, oleh oleh karena karena itu itu dalam dalam kesempatakesempatan n ini ini terima terima kasih kasih disampaikandisampaikan kepada :
kepada : 1.
1. Didi Dwi Anggoro, M.Eng selaku Koordinator Dosen PembimbingDidi Dwi Anggoro, M.Eng selaku Koordinator Dosen Pembimbing Praktikum
Praktikum Proses Kimia Proses Kimia Departemen TekDepartemen Teknik Kimia nik Kimia Fakultas Fakultas TeknikTeknik Universitas Diponegoro Semarang Tahun 2017.
Universitas Diponegoro Semarang Tahun 2017. 2.
2. Prof. Dr. Istadi, S.T, M.T selaku Dosen Pembimbing MateriProf. Dr. Istadi, S.T, M.T selaku Dosen Pembimbing Materi Elektroplating.
Elektroplating. 3.
3. Bayu Aji Pratama selaku Asisten Laboratorium Proses KimiaBayu Aji Pratama selaku Asisten Laboratorium Proses Kimia pengampu
pengampu materi materi Elektroplating, Elektroplating, dan dan segenap segenap Asisten Asisten LaboratoriumLaboratorium Proses Kimia Departemen Teknik Kimia Fakultas Teknik Universitas Proses Kimia Departemen Teknik Kimia Fakultas Teknik Universitas Diponegoro Semarang Tahun 2017.
Diponegoro Semarang Tahun 2017. 4.
4. Pranata Laboratorium Proses Departemen Teknik Kimia FakultasPranata Laboratorium Proses Departemen Teknik Kimia Fakultas Teknik Universitas Diponegoro Semarang Tahun 2017.
Teknik Universitas Diponegoro Semarang Tahun 2017.
Pelaksanaan dan pembahasan praktikum Elektroplating diuraikan secara Pelaksanaan dan pembahasan praktikum Elektroplating diuraikan secara jelas
jelas pada pada laporan laporan kegiatan kegiatan ini, ini, diantaranya: diantaranya: tujuan tujuan yang yang hendak hendak dicapai,dicapai, manfaat praktikum, pembahasan dan juga saran. Semoga dapat menjadi Kritik manfaat praktikum, pembahasan dan juga saran. Semoga dapat menjadi Kritik dan saran masih perlu diberikan kepada penyusun agar dapat lebih baik dalam dan saran masih perlu diberikan kepada penyusun agar dapat lebih baik dalam praktikum dan penyusunan laporan.
praktikum dan penyusunan laporan.
Semarang, 16 November 2017 Semarang, 16 November 2017
Penyusun Penyusun
DAFTARISI HALAMAN JUDUL... i HALAMAN PENGESAHAN ... ii RINGKASAN ... iii SUM MA R Y ... iv KATA PENGANTAR ... v DAFTAR ISI... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN... x BAB I PENDAHULUAN 1.1. Latar Belakang ... 1 1.2. Rumusan Masalah ... 2 1.3. Tujuan Praktikum ... 2 1.4. Manfaat Praktikum ... 3
BAB II TINJAUAN PUSTAKA 2.1. Konsep Dasar Reaksi Elektrokimia ... 4
2.2. Aspek Kuantitatif Reaksi Elektrokimia atau Elektrolisis ... 8
2.3. Kinetika Reaksi Elektrokimia atau Elektrolisis ... 9
BAB III METODE PRAKTIKUM 3.1. Rancangan Praktikum ... 12
3.1.1. Skema rancangan percobaan ... 12
3.1.2. Variabel operasi ... 12
3.2. Bahan dan Alat yang Digunakan ... 12
3.2.1 Bahan yang digunakan ... 12
3.2.2. Alat yang digunakan ... 13
3.3. Gambar Alat Utama ... 13
3.4. Prosedur Praktikum ... 14
BAB IV HASIL DAN PEMBAHASAN 4.1. Pengaruh Waktu Kontak terhadap Kinerja Reaksi Elektroplating ... 14
4.2. Hubungan Kuat Arus terhadap Kinerja Reaksi Elektroplating ...18
4.3. Pengaruh Konsentrasi terhadap Kinerja Reaksi Elektroplating ... 21
4.4. Pengaruh Kuat Arus terhadap Konstanta Laju Reaksi Elektroplating ... 24
BAB V PENUTUP
5.1. Kesimpulan ... 27 5.2. Saran ... 27 DAFTAR PUSTAKA ... 28
DAFTARTABEL
Tabel 4.1 Hubungan waktu dan selisih berat Zn dan Cu 15 Tabel 4.2 Data praktikum hubungan kuat arus dan berat Zn 18 Tabel 4.3 Hubungan konsentrasi dengan berat Zn 21
DAFTARGAMBAR
Gambar 3.1. Skema Rancangan Percobaan... 12
Gambar 3.2. Rangkaian alat proses elektroplating... 13
Gambar 4.1. Hubungan antara waktu vs massa Cu yang terlepas dan menempel pada Zn ... 15
Gambar 4.2. Gambar plat Cu dan Zn saat 5 menit dan 25 menit ... 16
Gambar 4.3. Hubungan antara kuat arus dan berat Zn ... 18
Gambar 4.4. Pelapisan logam Zn sebelum proses elektroplating ... 18
Gambar 4.5 Pelapisan logam Zn 0,05A ... 18
Gambar 4.6 Pelapisan logam Zn sebelum proses elektroplating ... 19
Gambar 4.7 Pelapisan logam Zn 0,13 A ... 19
Gambar 4.8 Pelapisan logam Zn sebelum proses electroplating ... 19
Gambar 4.9 Pelapisan logam Zn 0,13 A ... 19
Gambar 4.10 Pengaruh konsentrasi terhadap berat Zn ... 21
Gambar 4.11 Pelapisan logam Zn sebelum electroplating ... 21
Gambar 4.12 Pelapisan logam Zn konsentrasi 1,5gr/l ... 21
Gambar 4.13 Pelapisan logam Zn sebelum proses elektroplatting ... 22
Gambar 4.14 Pelapisan logam Zn konsentrasi 2gr/l ... 22
Gambar 4.15 Pelapisan logam Zn sebelum proses elektroplatting ... 22
Gambar 4.16 Pelapisan logam Zn konsentrasi 2,7gr/l ... 22
DAFTAR LAMPIRAN
LAPORAN SEMENTARA ... A-1 LEMBAR PERHITUNGAN ... B-1
BAB I
PENDAHULUAN 1.1. Latar Belakang
Kegiatan pelapisan logam akan menghasilkan limbah yang berbahaya dan dapat menjadi permasalahan yang kompleks bagi lingkungan sekitarnya. Limbah industri pelapisan logam yang tidak dikelola dengan baik dan benar dapat mengakibatkan pencemaran lingkungan. Air limbah industri pelapisan logam umumnya banyak mengandung logam-logam berat, diantaranya adalah logam krom (Cr), tembaga (Cu), nikel (Ni). Limbah cair yang mengandung logam-logam berat di atas dapat membahayakan lingkungan dan kesehatan. Elektrodeposit logam-logam pelapis seperti krom (Cr), tembaga (Cu), nikel (Ni), dan lain-lain banyak digunakan di industri dalam hal perbaikan kinerja. Pelapisan logam-logam di atas adalah biasa dilakukan dalam bak elektroplating. Demikian juga dengan proses pengambilan kembali logam-logam di atas dari sisa-sisa buangan larutan dari bak elektroplating perlu dilakukan agar mengurangi efek buruk terhadap lingkungan.
Limbah industri pelapisan logam yang mengandung ion-ion logam berat tersebut jika langsung dibuang ke lingkungan tanpa pengolahan terlebih dahulu akan menimbulkan dampak negatif terhadap komponen-komponen lingkungan, sehingga akan menurunkan kualitas lingkungan. Menurut Peraturan Pemerintah Republik Indonesia Nomor 18 tahun 1999 tentang Pengelolaan Limbah Berbahaya dan Beracun disebutkan bahwa limbah logam berat yang dibuang ke lingkungan tidak boleh melebihi batas ambang yang ditetapkan.
Dalam pengolahan limbah, pengendapan merupakan salah satu metode pengolahan limbah yang banyak digunakan untuk memisahkan logam berat dari limbah cair tersebut. Namun, banyak kendala dalam pengolahan limbah tersebut bahwa kadang-kadang logam-logam berat tersebut sulit diendapkan. Oleh karena itu, agar pengendapan dapat mencapai efisiensi yang tingg, logam-logam berat tersebut harus direduksi terlebih dahulu.
Penelitian mengenai reduksi limbah-limbah logam berat dari industri pelapisan logam dan proses pengendapannya melalui proses elektrolisis perlu dikenalkan kepada mahasiswa Jurusan Teknik Kimia. Terlebih lagi kajian kinetika dari proses reduksi dan pengendapan logam-logam berat tersebut, agar dapat diketahui kinerja reaksinya dan dapat diketahui pula cara-cara meningkatkan kinerja prosesnya.
Kecepatan reaksi dari proses reduksi dan pengendapan secara elektrolisis tergantung pada pH larutan elektrolitnya, yaitu makin tinggi pH kecepatan reaksi akan turun. Agar reduksi dan pengendapan berjalan sempurna diperlukan konsentrasi larutan reduktor berlebih.
1.2. Rumusan Masalah
Penelitian mengenai reduksi limbah logam berat di industri sangat perlu dikenalkan untuk mengetahui bagaimana proses reduksi limbah-limbah logam berat dari industri pelapisan logam dan proses pengendapannya melalui proses elektrolisis, bagaimana mekanisme reaksi reduksi pada pengendapan logam-logam berat pada larutan secara elektrokimia, bagaimana kinetika reaksi reduksi dan pengendapan logam-logam berat dalam larutan secara elektrokimia. Hal tersebut sangat berguna bagi seorang sarjana teknik kimia. Oleh karena itu kami melakukan praktikum ini.
1.3. Tujuan Praktikum
1. Mengkaji proses reduksi dan pengendapan logam-logam berat yang terkandung dalam larutan secara elektrokimia atau elektrolisis.
2. Mengkaji mekanisme reaksi reduksi dan pengendapan logam-logam berat dalam larutan secara reaksi elektrokimia.
3. Mengkaji kinetika reaksi reduksi dan pengendapan logam-logam berat dalam larutan secara elektrokimia.
1.4. Manfaat Praktikum
1. Membekali mahasiswa dalam hal mengkaji proses reduksi dan pengendapan logam-logam berat yang terkandung dalam larutan secara
elektrokimia atau elektrolisis.
2. Membekali mahasiswa dalam hal mengkaji mekanisme reaksi reduksi dan pengendapan logam-logam berat dalam larutan secara reaksi elektrokimia.
3. Membekali mahasiswa dalam hal mengkaji kinetika reaksi reduksi dan pengendapan logam-logam berat dalam larutan secara elektrokimia.
BAB II
TINJAUAN PUSTAKA
2.1 Konsep Dasar Reaksi Elektrokimia
Studi hubungan antara reaksi kimia dan aliran listrik disebut elektrokimia. Reaksi elektrolisis, dimana perubahan non-spontan terjadi dengan mengalirkan arus listrik melalui sistem kimia, adalah termasuk elektrokimia. Reaksi spontan reduksi- oksidasi (reaksi redoks) yang dapat manghasilkan listrik juga termasuk elektrokimia. Perubahan yang terjadi dalam suatu sistem kimia karena reaksi elektrolisis dan reaksi redoks dibahas dalam reaksi elektrokimia.
Reaksi elektrokimia sangat penting dalam mempelajari ilmu kimia dan juga aktivitas sehari-hari. Melalui reaksi elektrokimia dapat diperoleh informasi mengenai perubahan energi reaksi kimia sehingga membantu menganalisa sistem- sistem kimia. Pengaruh reaksi elektrokimia pada masyarakat modern hampir ditemukan dimana-mana. Industri kimia Al, Cl2
dan NaOH serta industri elektroplating adalah contoh penerapan reaksi elektrokimia elektrolisis. Dan semua sumber energi listrik kecil (baterai) diperoleh dari reaksi elektrokimia reduksi- oksidasi.
Sebelum mengerti sistem elektrokimia perlu mengetahui bagaimana terjadinya hantaran listrik. Proses hantaran listrik berbeda antara logam dan sistem kimia. Logam adalah konduktor yang mampu menggerakkan muatan listriknya (elektron) berpindah dari satu tempat ke tempat lain jika suatu elektron ditambahkan atau dikurangi di salah satu ujungnya. Hantaran listrik karena perpindahan (transport) elektron disebut hantaran logam. Leburan senyawa ion dan larutan yang disebut elektrolit juga dapat menghantarkan listrik, walaupun di dalam sistem ini tidak terdapat elektron bebas yang mudah bergerak. Dengan demikian timbul pertanyaan, bagaimana sistem ini dapat menghasilkan hantaran listrik?
Jawabannya dapat diperoleh dengan menguji apa yang terjadi pada larutan dan elektroda dalam susunan alat elektrolisis. Bila ada aliran listrik dari baterai (sumber arus DC) maka akan terjadi:
(
(1). Elektroda (-) mendapat muatan listrik e (-);
(2). Karena kelebihan muatan listrik e (-) maka elektroda (-) menarik ion muatan berbeda dalam larutan, ion (+);
(3). Pada saat yang sama elektroda (+) kekurangan elektron sehingga menarik ion muatan berbeda dalam larutan yaitu ion (-);
(4). Karena adanya hantaran listrik maka terjadi reaksi kimia (reaksi redoks) pada elektroda;
(5). Pada elektroda (+), ion (-) disekitarnya melepaskan e- sehingga terjadi oksidasi. Setiap terjadi oksidasi maka ion (-) ini diganti oleh ion (-) lain disekitarnya sehingga terjadi aliran ion-ion (-) dari larutan ke elektroda (+);
(6). Elektron-elektron yang dilepaskan dari ion-ion (-) mengalir ke sumber arus DC kemudian diteruskan ke elektroda dimana terdapat ion-ion (+) yang kemudian mengalami reduksi;
(7). Akibat reduksi ini, ion (+) lain yang terdapat disekitarnya menggantikannya sehingga terjadi aliran ion (+) dari larutan ke elektroda (+). Jadi, jika terjadi reaksi redoks maka elektron bergerak melalui kabel circuit (arus DC) dan ion bergerak di dalam cairan.
Aliran ion dalam cairan disebut hantaran elektrolit. Pada hantaran elektrolit, terjadinya migrasi ion terutama karena perbedaan jumlah antara ion (+) dan ion (-) dalam kumpulan ion (+) atau (-) sehingga tidak stabil, sehingga dalam cairan ada kecenderungan untuk mempertahankan muatan listrik yang netral dan ini dilakukan dengan aliran ion.
Reaksi kimia yang terjadi pada elektroda selama ada hantaran elektrolitik disebut reaksi elektrolisis. Tempat terjadinya reaksi elektrolisis disebut sel elektrolisis atau sel elektrolitik. Sebagai contoh pada elektrolisis larutan CuSO4. Reaksi-reaksi yang mungkin terjadi pada anoda adalah:
2SO42-(aq)→ S2O82- (aq) + 2e
2H2O(l) → O2 (g) + 4H+ + 4e
Reaksi pada katoda: Cu2+ (aq)+ 2e → Cu(s)
(
Dari hasil percobaan diperoleh gelembung gas O2 pada anoda dan
pelapisan logam Cu pada katoda. Jadi pada elektrolisis larutan CuSO4 terjadi
reaksi-reaksi:
2H2O(l) → O2 (g) + 4H++ 4e (Anoda)
Cu2+ (aq)+ 2e → Cu(s) (Katoda)
2H2O(l) + 2Cu2+aq)→ O2 (g)+ 4H+ + 2Cu(s) (Reaksi sel)
Berdasarkan hasil-hasil reaksi yang diperoleh, maka dapat disimpulkan bahwa pada elektrolisis CuSO4, Cu2+ lebih mudah tereduksi
daripada H2O dan H2O lebih mudah teroksidasi daripada SO42-.
Salah satu penggunaan elektrolisis adalah refining (memurnikan) atau pemurnian logam Cu. Setelah dipisahkan dari bijihnya, kemurnian logam Cu
99% dengan pengotor utama Zn, Zn, Ag, Au dan Pb. Pada proses refining , Cu yang belum murni digunakan sebagai anoda pada sel elektrolitik CuSO4. Anoda terbuat dari Cu kemurnian tinggi. Proses
elektrolisis dilakukan dengan pengaturan tegangan dimana hanya Cu dan logam yang lebih aktif, seperti Zn dan Zn yang teroksidasi. Logam Ag, Au dan Pt tidak larut tetapi jatuh dan mengendap pada dasar sel elektrolisis. Pada katoda hanya Cu2+ yang tereduksi sehingga terbentuk deposit Cu. Hasil keseluruhan dari preses sel elektrolisis ini adalah:
1. Cu dipindahkan dari anoda ke katoda.
2. Pengotor Zn dan Zn tetap dalam larutan sebagai Zn2+ dan Zn2+. 3. Logam lain seperti Ag, Au, dan Pt mengendap di dasar sel.
Bila Ag, Au, dan Pt diambil kemudian dijual maka nilainya dapat membayar biaya listrik yang diperlukan selama elektrolisis. Logam Cu yang diperoleh dengan proses ini mempunyai kemurnian 99,96 %.
Jika pada pembuatan Cu murni, katoda diganti dangan Zn, maka akan tetap terbentuk endapan Cu pada katoda Zn. Proses pelapisan katoda dangan logam lain dengan elektrolisis disebut elektroplating. Proses ini banyak digunakan secara komersial seperti pada pelapisan bemper mobil dengan Cr dengan tujuan: (a) mencegah korosi, dan (b) agar penampilan lebih menarik.
Reaksi redoks adalah gabungan reaksi kimia yang terjadi pada sel elektrokimia. Reaksi oksidasi adalah suatu perubahan kimia dimana suatu
zat melepas elektron. Pada sel elektrokimia oksidasi terjadi di anoda. Reaksi reduksi adalah suatu perubahan kimia dimana suatu zat menangkap elektron. Pada sel elektrokimia reduksi terjadi di katoda. Pada reaksi redoks, zat yang mengoksidasi disebut oksidator, sedangkan zat yang mereduksi zat lain disebut reduktor. Suatu reaksi reduksi dapat menimbulkan potensial listrik tertentu, yang disebut potensial elektroda (E) dan semakin mudah suatu unsur mengalami reduksi, maka makin besar potensial elektrodanya. Harga potensial elektroda yang sebenarnya dalam suatu reaksi reduksi tidak dapat dihitung, sebab tidak ada reaksi reduksi yang berlangsung tanpa diikuti rekasi oksidasi. Oleh karena itu harga potensial elektroda yang dipakai adalah harga potensial standar. Itulah sebabnya harga potensial
Elektroda lebih tepat disebut potensial reduksi standar atau potensial elektroda standar (E0). Elektroda yang dipakai sebagai standar dalam
menentukan harga potensial elektroda adalah elektroda hidrogen. Cara memperoleh dengan mengalirkan gas hidrogen murni pada elektroda platina (Pt) yang bersentuhan dengan asam (ion H+), sehingga terjadi keseimbangan sebagai berikut:
H2→ 2H+ + 2e
Harga potensial elektroda dari reaksi ini ditetapkan 0 volt. Kemudian harga potensial elektroda standar dari semua reaksi reduksi adalah harga yang dibandingkan terhadap potensial elektroda standar hidrogen.
Berdasarkan harga E0 maka dapat disusun suatu deret unsur mulai dari
unsur dengan harga E0 terkecil sampai terbesar yang disebut “deret volta”,
yaitu :
K-Ba-Ca-Na-Mg-Al-Mn-Zn-Cr-Zn-Cd-Co-Ni-Sn-Pb-H-Cu-Hg-Ag-Pt-Au Sifat - sifat dari deret volta ini adalah:
1. Logam yang terletak di sebelah kanan H memiliki harga E0 positif sedangkan di sebelah kiri H mempunyai harga E0 negatif.
2. Makin ke kanan letak suatu logam pada deret volta, maka harga E0 logam makin besar. Hal ini berarti bahwa logam – logam di
sebelah kanan H mudah mengalami reduksi atau sulit teroksidasi. Logam ini disebut logam pasif atau logam mulia.
3. Makin ke kiri, harga E0 dari logam semakin kecil yang berarti logam tersebut sulit tereduksi dan mudah teroksidasi. Logam ini disebut logam aktif.
2.2 Aspek Kuantitatif Reaksi Elektrokimia atau Elektrolisis
Michael Faraday telah menjelaskan adanya hubungan kuantitatif antara jumlah perubahan kimia yang terjadi pada reaksi elektrokimia dengan jumlah arus. Jumlah perubahan kimia sebanding dengan jumlah mol elektron yang digunakan pada reaksi oksidasi-reduksi. Contoh reaksi pada katoda, Ag+(aq) + e → Ag(s), bila katoda mensuplai 1 mol elektron maka
dihasilkan 1 mol endapan Ag. Pada sistem SI, 1 mol e setara dengan 96.494 Coulomb (C) dan biasanya digunakan, 1 mol e setara dengan 96.500 C. Coloumb adalah jumlah muatan listrik yang melawati satu titik circuit listrik bila arus 1 Ampere (A) mengalir selama 1 detik (S).
Jadi:
1 C = 1 A. 1 S
Dengan mengukur kuat arus (I) dan lamanya arus (t) dapat ditentukan jumlah muatan Coulomb (Q), dan dari jumlah muatan Coulomb dapat ditentukan jumlah mol elektron, sehingga memperoleh jumlah mol zatnya.
Dalam Hukum elektrolisis, Michael Faraday menemukan :
1. Jumlah bahan yang terdekomposisi saat elektrolisa berbanding lurus dengan kuat arus ( I ) dan waktu (t ) dalam laruran elektrolit.
2. Jumlah perubahan kimia oleh satuan arus listrik sebanding dengan banyaknya arus yang mengalir ( I ).
Pernyataan tersebut dirumuskan sebagai:
=e.i.t / 96500 W: massa endapan pelapis (g)
i: kuat arus (A) t : waktu (detik)
e : berat ekivalen kimia (massa atom dibagi dengan valensinya). Dari rumus tersebut, volume endapan diperoleh dengan perhitungan :
Volume (cm3) = massa endapan (g) / densitas (g/cm3) = W/ ρ : kerapatan logam pelapis (g/cm3)
W: massa endapan (g).
Sehingga untuk mendapatkan nilai ketebalan:
Ketebalan (cm) = Volume (cm3) / luas permukaan (cm2)
Hukum Faraday dapat menjelaskan pengaruh penambahan waktu pada proses elektroplating. Semakin lama waktu yang digunakan, maka lapisan logam yang dihasilkan juga semakin besar. Ketebalan lapisan logam juga dipengaruhi oleh berat equivalen kimia sebuah unsur kimia yang digunakan sebagai anoda. Dalam persamaan juga dapat diketahui bahwa semakin besar jumlah deposit lapisan logam (jumlah berat edapan) maka semakin besar pula ketebalan dari lapisan. Sehingga dapat disimpulkan bahwa waktu yang digunakan pada proses pelapisan dan variasi anoda mempengaruhi jumlah deposit lapisan dan juga ketebalan lapisan yang terbentuk.
2.3 Kinetika Reaksi Elektrokimia atau Elektrolisis
Kinetika reaksi mempelajari laju reaksi kimia secara kuantitatif dan mempelajari faktor-faktor yang mempengaruhi laju reaksi tersebut. Laju reaksi kimia adalah jumlah mol reaktan per satuan volume yang bereaksi dalam satuan waktu tertentu. Bila dibuat sebuah kurva penurunan konsentrasi reaktan sebagai fungsi waktu, maka akan diperoleh kurva bahwa slope kurvanya pada setiap titik selalu negatif, karena konsentrasi reaktan selalu menurun. Jadi laju reaksi pada setiap titik sepanjang kurva = - dC/dt. Tetapi apabila laju reaksi dituliskan sebagai laju pembentukan produk, maka laju reaksi akan bernilai positif. Jika konsentrasi produk setelah reaksi berlangsung t detik adalah x mol dm-3, maka laju reaksinya + dx/dt. Laju reaksi pada setiap waktu sebanding dengan konsentrasi (C) yang tersisa pada setiap waktu. Secara matematik dapat dituliskan – dC/dt = k.C, dan dC/dt = sering kali disebut sebagai
diferenrential rate expression dan k = konstanta laju reaksi. Bentuk persamaan laju reaksi yang lebih umum adalah :
Laju = k[A]x[B]y[C]z
dan seterusnya dan orde reaksi keseluruhan merupakan jumlah semua pangkat yang terdapat dalam persamaan laju reaksi, orde reaksi total :
x + y + z + .... dan seterusnya.
Laju reaksi = perubahan konsentrasi / waktu yang diperlukan untuk perubahan ∆t , atau Laju reaksi = ± ∆X/∆t.
Tanda negatif digunakan jika X adalah pereaksi dan tanda positif digunakan jika X adalah produk reaksi. Laju keseluruhan dari suatu reaksi kimia pada umumnya bertambah jika konsentrasi salah satu pereaksi dinaikkan. Hubungan laju reaksi dan konsentrasi dapat diperoleh dari data eksperimen. Untuk reaksi, A + B → produk, dapat diperoleh bahwa laju reaksi dapat berbanding lurus dengan [A] x dan [B] y.
Laju reaksi = k[A]x[B]y
Disebut hukum laju reaksi atau persamaan laju reaksi, dengan k adalah tetapan laju reaksi, x dan y merupakan bilangan bulat yang menyatakan orde ke x terhadap A dan orde ke y terhadap B, sedangkan ( x + y) adalah orde reaksi keseluruhan. Hukum laju diperoleh secara eksperimen dan tidak bergantung pada persamaan stoikiometri. Orde reaksi adalah jumlah pangkat konsentrasi dalam bentuk diferenrensial. Secara teoritis orde reaksi merupakan bilangan bulat kecil, namun dalam beberapa hal pecahan atau nol. Pada umumnya orde reaksi terhadap suatu zat tertentu tidak sama dengan koefisien dalam persamaan stoikiometri reaksi. Reaksi Orde Nol
Suatu reaksi disebut orde ke nol terhadap suatu pereaksi jika laju reaksi tidak dipengaruhi oleh konsentrasi pereaksi tersebut. Jika [A] adalah konsentrasi dan [A]0adalah konsentrasi pada saat t = 0, maka:
− d[A]/dt = k, dan hasil integral [A]0 − [A] = k.t
Suatu reaksi orde satu dapat dinyatakan dengan: − d[A]/dt = k[A]
Hasil integral untuk memperoleh hubungan antara konsentrasi pereaksi terhadap waktu: ln([A]0/[A] = k.t
Suatu reaksi orde dua dapat dinyatakan dengan: - d[A]/dt = k[A]2
Hasil integral untuk memperoleh hubungan antara konsentrasi pereaksi terhadap waktu:
1/[A] - 1/[A]0= k.t
Suatu reaski orde dua dapat dinyatakan dengan: − d[A]/dt = k[A]3
Hasil integral untuk memperoleh hubungan antara konsentrasi pereaksi terhadap waktu :
BAB III
METODE PRAKTIKUM
3.1 Rancangan Praktikum
3.1.1 Skema rancangan percobaan
Gambar 3.1. Skema rancangan percobaan 3.1.2 Variabel operasi
Konsentrasi larutan : 1,5 gr/l; 2gr/l; 2,7 gr/l Kuat arus : 0,05 A; 0,13 A; 0,28 A
Waktu : 5 menit, 10 menit, 15 menit, 20 menit, 25 menit
3.2. Bahan dan Alat yang Digunakan 3.2.1 Bahan yang digunakan
1. CuSO4 18,6 gr
2. Plat Cu sebagai anoda 1 buah 3. Plat Zn sebagai katoda 3 buah 4. Aquades 9 L Merangkai alat elektroplating Memepersiapkan reagen yang dibutuhkan
Mencari waktu kontak optimum dengan kuat arus tetap 0,13 A setiap 5 menit selama 25 menit. Waktu optimum terjadi saat efisiensinya
Mencari kuat arus optimum dengan variabel 0,05 A; 0,13 A dan 0,28 A dengan menggunakan waktu optimum yang telah didapatkan. Mencari konsentrasi optimum
dengan variabel 1,5 gr/l; 2 gr/l; dan 2,7 gr/l dengan menngunakan waktu optimum dan kuat arus 0 13 A.
3.2.1. Alat yang digunakan
1. Bak electroplating 4. Anoda
2. Amperemeter 5. Katoda
3. Voltmeter 6. Sumber Arus DC
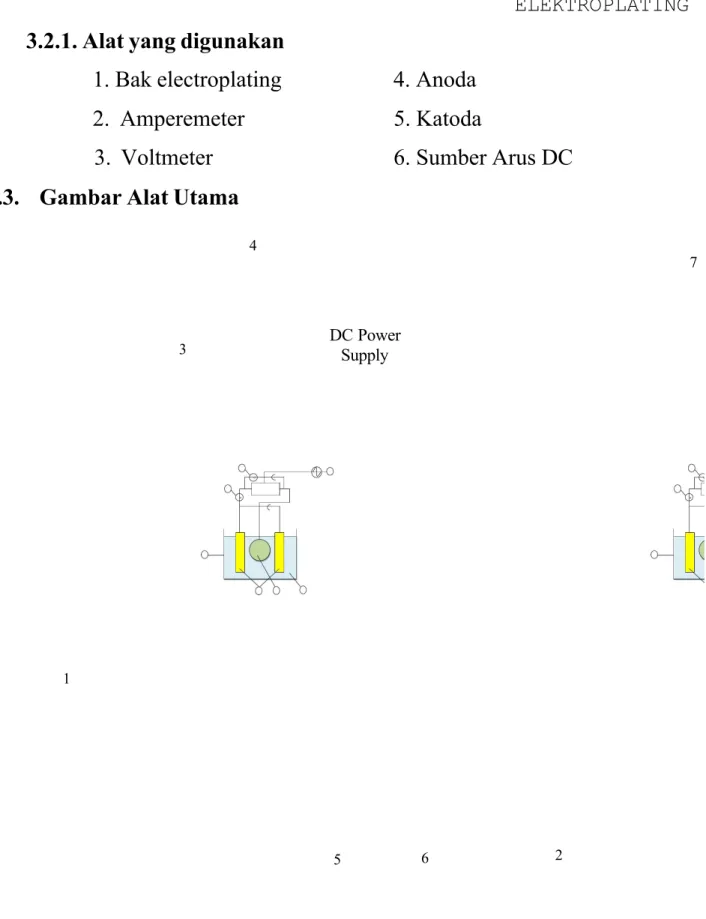
3.3. Gambar Alat Utama
Gambar 3.2. Rangkaian alat proses elektroplating
Keterangan gambar :
(1) bak elektroplating, (2) larutan elektroplating, (3) amperemeter, (4) voltmeter, (5) anoda, (6) katoda, (7) sumber arus DC
DC Power Supply 7 4 3 1 5 6 2
3.4.Prosedur Praktikum
1. Mencari Waktu Kontak Optimum
Larutan limbah atau larutan sintetis yang ada pada bak elektroplating diambil setiap 5 menit selama 25 menit. Disini variabel lain yang dipakai yaitu kuat arus pada 0,13 A konsentrasi 2 g/l. Sampel yang diperoleh dianalisa dan dihitung efisiensi penurunan kadar tembaga, sampel yang menghasilkan efisiensi yang paling tinggi merupakan waktu kontak yang optimum. Untuk proses sel anjutnya waktu kontak ini yang digunakan.
2. Mencari Kuat Arus Optimum
Larutan dimasukkan ke dalam saluran input dengan konsentrasi yang tetap dan pada waktu kontak optimum, tetapi kuat arus yang digunakan berbeda yaitu masing-masing 0,05 A; 0,13 A; 0,28 A. Hasil Elektroplating dianalisa, sampel yang menghasilkan efisiensi yang paling tinggi merupakan kuat arus yang optimum dan digunakan pada proses selanjutnya.
3. Mencari Konsentrasi Optimum
Larutan yang dimasukkan dengan konsentrasi yang berbeda yaitu 1,5 g/l, 2g/l dan 2,7 g/l, tetapi waktu kontak dan kuat arus yang digunakan yang pada kondisi optimum. Hasil ketiga sampel dianalisa dan dihitung efisiensi penurunan kadar tembaga, sampel yang menghasilkan efisiensi yang paling tinggi merupakan konsentrasi optimu
BABIV
HASIL PERCOBAAN DAN PEMBAHASAN
4.1 Pengaruh Waktu Kontak Terhadap Kinerja Reaksi Elektroplatting
Berdasarkan praktikum elektroplating yang telah dilakukan, diperoleh data percobaan sebagai berikut :
Tabel 4.1 Hubungan waktu dan selisih berat Zn dan Cu
t (s) W Zn (gr) W Zn (gr) W Cu (gr) W Cu (gr) 0 4,987 0 4,34 0 5 5,17 0,183 4,315 -0,025 10 5,359 0,372 4,31 -0,03 15 5,46 0,473 4,3 -0,04 20 5,542 0,555 4,278 -0,062 25 5,555 0,568 4,264 -0,076
Sehingga didapatkan grafik hubungan waktu vs massa Cu yang menempel sebagai berikut.
Gambar 4.1 Hubungan antara waktu vs massa Cu yang menempel
0.000 0.100 0.200 0.300 0.400 0.500 0.600 0 5 10 15 20 25 30 M a s s a C u y a n g m e n e m p e l ( g r a m ) t (waktu)
Gambar 4.2. Gambar plat Cu dan Zn saat 5 menit dan 25 menit
Berdasarkan data pada table 4.1, dapat diamati bahwa terjadi penambahan berat katoda Zn dari waktu ke waktu. Pada praktikum ini perubahan berat elektroda diamati setiap 5 menit hinga menit ke-25 serta menggunakan larutan CuSO4 yang berguna sebagai larutan elektrolit dengan
konsentrasi 2gr/l dan kuat arus sebesar 0,13 A. Sebelum proses elekroplating dilakukan, berat awal plat Zn yang digunakan sebagai katoda adalah 4,987 gr. Setelah proses elektroplating dilakukan, berat katoda terus mengalami penambahan seiring berjalannya waktu hingga menit ke-25 beratnya menjadi 5,555 gr yang berarti terjadi penambahan berat sebanyak 0,568 gr. Selain fenomena tersebut, berat anoda Cu mengalami penurunan, berat awal anoda yang awalnya sebesar 4,34 gr setelah dilakukan proses elektroplating hingga menit ke-25 berat katoda menjadi 4,264 gr yang berarti terjadi pengurangan berat sebanyak 0,076 gr.
Penambahan berat katoda Zn ini disebabkan karena terjadi pelapisan logam Cu yang terlepas dari anoda, sehingga berat anoda Cu mengalami penurunan. Hal ini sesuai dengan persamaan reaksi sebagai berikut:
2H2O (l) O2 (g) + 4H+ + 4e- (Anoda)
Cu2+ + 2e- Cu (s) (Katoda)
Ion Cu2+ yang teroksidasi akan mengambil elektron dan menjadi logam tembaga yang menempel pada plat Zn. Lama kelamaan berat tembaga berkurang dan plat Zn akan terlapisi tembaga. Bila proses ini makin lama,
Faraday I, yang menyatakan bahwa “Massa zat yang dihasilkan pada suatu elektroda selama proses elektrolisis berbanding lurus dengan waktu dan muatan listrik yang digunakan” (Hassanudin, 2015).
=e.i.t / 96500 Dimana :
W = Berat logam yang diendapkan (gr) e = Berat ekivalen
I = Kuat arus (A) t = Waktu (s)
Sehingga semakin lama proses elektroplating yang dilakukan, maka semakin besar pula dan semakin optimal pula proses elektroplating tersebut. Akibatnya logam yang akan melapisi akan semakin banyak dan tebal (Dewi, 2013). Nilai efisiensi terbesar adalah 14,5 % pada penambahan berat Zn yang terjadi pada menit ke-10, karena pada menit ke-15 dan seterusnya efisiensi menurun yaitu 9,118%, maka waktu optimum proses elektroplating ini adalah 10 menit.
Dari hasil penelitian sebelumnya diperoleh kecenderungan semakin besar waktu yang digunakan akan semakin efisien, tetapi terjadi sedikit penurunan efisiensi pada waktu 15 menit, hal ini disebabkan oleh beberapa faktor antara lain tidak terkontrolnya suhu pada elektrolit yang ditandai dengan banyaknya gelembung yang tidak konstan, serta permukaan logam yang akan dilapisi masih terdapat oksida logam (Dewi dan Ahmadi, 2013). Hasil penelitian lainnya juga menunjukan bahwa semakin lama waktu pelapisan, maka ion-ion yang terkandung di dalam larutan elektrolit akan semakin banyak terlapis/terdeposit dispesimen, lapisan Cu yang terbentuk akan semakin tebal sehingga persentase massanya juga semakin meningkat. Namun hal ini juga mempunyai batas tertentu, karena jika waktu yang digunakan terlalu lama maka hasil elektroplating juga tidak bagus (Putri dan Handani, 2015).
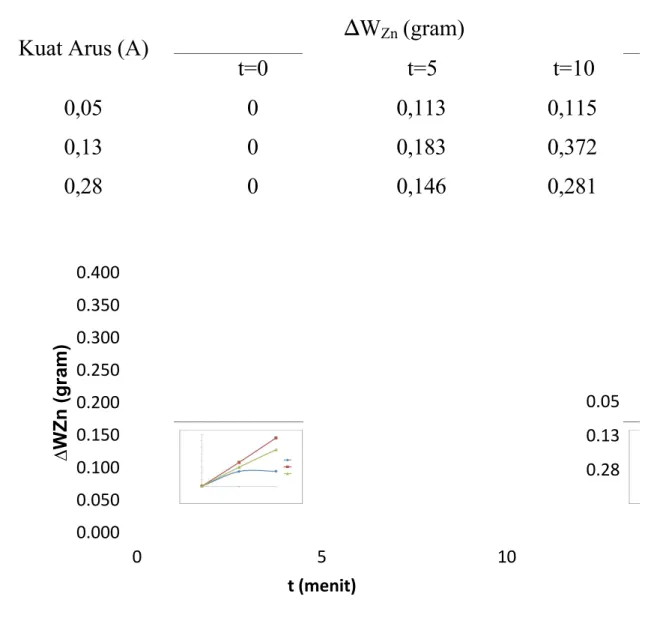
4.2 Pengaruh Kuat Arus Terhadap Kinerja Reaksi Elektroplatting Tabel 4.2 Hubungan Kuat Arus dan Berat Zn
Kuat Arus (A) ∆WZn (gram)
t=0 t=5 t=10
0,05 0 0,113 0,115
0,13 0 0,183 0,372
0,28 0 0,146 0,281
Gambar 4.3 Hubungan Kuat Arus dan Berat Zn
0.000 0.050 0.100 0.150 0.200 0.250 0.300 0.350 0.400 0 5 10 ∆ W Z n ( g r a m ) t (menit) 0.05 0.13 0.28
Gambar 4.4 pelapisan logam Zn sebelum proses elektroplatting
Gambar 4.5 pelapisan logam Zn 0,05 A
Untuk menentukan kuat arus optimum proses elektroplating dilakukan menggunakan larutan elektrolit CuSO4 2 gr/l selama waktu 10 menit dan
variabel kuat arus yang digunakan 0,05 A; 0,13 A; 0,28 A. Dari praktikum yang telah dilakukan, terjadi peningkatan berat katoda Zn saat menggunakan kuat arus yg lebih besar. Pada penggunaan kuat arus 0,05 A didapatkan nilai W Zn terbesar yaitu 0,115 gr, sedangkan pada penggunaan kuat arus 0,13 A dan 0,28 A nilai W Zn yaitu 0,372 gr serta 0,281 gr.
Semakin besar arus yang mengalir, maka semakin banyak elektron yang mengalir, akibatnya semakin banyak pula elektron yang berpindah dari katoda menuju anoda. Hal ini sesuai dengan hukum Faraday I, yang menyatakan bahwa “Massa zat yang dihasilkan pada suatu elektroda selama proses elektrolisis berbanding lurus dengan waktu dan muatan listrik yang
digunakan” (Hassanudin, 2015).
Gambar 4.6 pelapisan logam Zn sebelum proses elektroplatting
Gambar 4.7 pelapisan logam Zn 0,13 A
Gambar 4.8 pelapisan logam Zn sebelum proses elektroplatting
Gambar 4.9 pelapisan logam Zn 0,28 A
=e.i.t / 96500 Dimana :
W = Berat logam yang diendapkan (gr) e = Berat ekivalen
I = Kuat arus (A) t = Waktu (s)
Pada waktu yang sama, besar arus yang digunakan berbanding lurus dengan berat lapisan logam yang terlapis (Sutomo dkk, 2012). Pada Praktikum ini kenaikan kuat arus juga meningkatkan berat logam Zn yang terlapis oleh Cu dari kuat arus 0,05 dan 0,13. Namun pada kuat arus 0,28 A berat logam yang terlapis mengalami penurunan. Sehingga kuat arus
optimum pada proses elektroplating ini ada 0,13 A.
Penurunan berat logam yang terlapis ini terjadi karena pengaruh efisiensi arus. Efisiensi arus merupakan perbandingan berat logam yang terendapkan di katoda terhadap berat logam yang terendapkan secara teoritis pada proses elektrolisis. Efisiensi katoda sering dipakai sebagai pedoman
menilai apakah semua arus yang masuk digunakan untuk mengendapkan ion logam pada katoda. Pada arus listrik yang tinggi, reaksi itu berjalan semakin cepat dan semakin banyak terjadi adanya reaksi samping yang membentuk gas hydrogen di katoda atau membentuk gas oksigen di anoda akibat dari penguraian air yang terdapat dalam larutan (Hartomo, 1995 dalam Sopiah,
2008). Selain itu, penurunan efisiensi arus listrik dapat terjadi karena adanya kebocoran arus listrik (Irwanto, 2010). Menurunnya efisiensi arus berkaitan dengan rapat arus yang digunakan, dimana rapat arus adalah arus per satuan luas permukaan elektroda. Penggunaan rapat arus yang besar pada anoda dibandingkan dengan luas permukaan anoda yang cukup kecil, tidak berimbang. Sehingga arus akan lewat dengan cepat menyebabkan terjadinya reaksi yang cepat terjadi di katoda. Akibat dari proses reduksi yang berlangsung dengan cepat maka endapan tembaga di katoda pun cepat terbentuk, sehingga endapan tembaga ini tidak melekat dengan baik, akibatnya banyak endapan Cu yang jatuh kembali ke dalam larutan elektrolit CuSO4 (Sopiah, 2008).
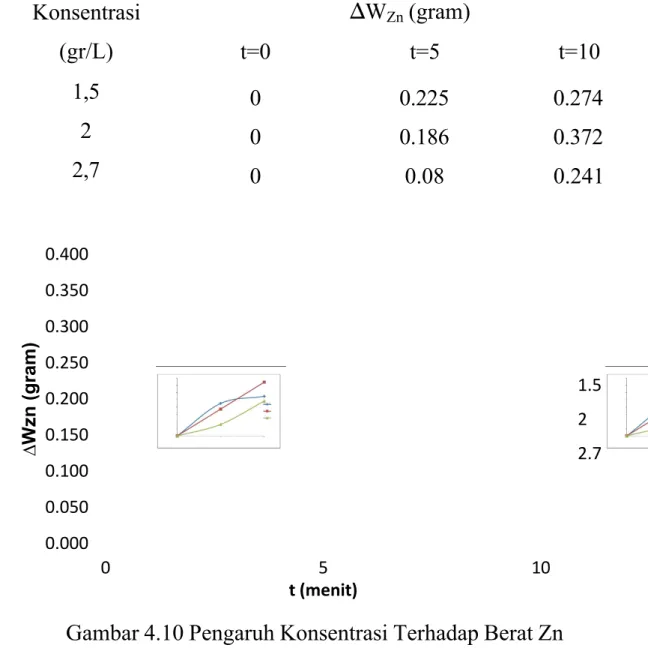
4.3 Pengaruh Konsentrasi terhadap Kinerja Reaksi Elektroplating Tabel 4.3 Pengaruh Konsentrasi Terhadap Berat Zn Konsentrasi (gr/L) ∆WZn (gram) t=0 t=5 t=10 1,5 0 0.225 0.274 2 0 0.186 0.372 2,7 0 0.08 0.241
Gambar 4.10 Pengaruh Konsentrasi Terhadap Berat Zn
0.000 0.050 0.100 0.150 0.200 0.250 0.300 0.350 0.400 0 5 10 ∆ W z n ( g r a m ) t (menit) 1.5 2 2.7
Gambar 4.11 pelapisan logam Zn sebelum proses elektroplatting
Gambar 4.12 pelapisan logam Zn konsentrasi 1,5gr/l
Dengan menggunakan kuat arus 0,13 A selama 10 menit, dapat diketahui hubungan antara konsentrasi larutan CuSO4 dengan WZn dan
WCu. Pada larutan CuSO4 dengan konsentrasi 1,5 gr/l terjadi pengendapan
Cu sebesar 0,274 gr, pada konsentrasi 2gr/l terjadi pengendapan Cu sebesar 0,372 gr, dan pada konsentrasi 2,7 gr/l terjadi pengendapan Cu sebesar 0,241 gr
Hal ini berbanding terbalik dengan teori. Seharusnya semakin besar konsentrasi ion Cu2+ maka semakin positif nilai potensial elektroda yang digunakan sehingga semakin banyak tembaga yang mengendap di katoda (Sopiah, 2008). Konsentrasi optimum elektroplating ini adalah 2gr/l.
Berdasarkan percobaan yang telah dilakukan, hasil yang didapat tidak sesuai teori dikarenakan pada umumnya konsentrasi logam yang terlalu
Gambar 4.13 pelapisan logam Zn sebelum proses elektroplatting
Gambar 4.14 pelapisan logam Zn konsentrasi 2gr/l
Gambar 4.15 pelapisan logam Zn sebelum proses elektroplatting
Gambar 4.16 pelapisan logam Zn konsentrasi 2,7gr/l
tinggi pada elektrolit akan mengakibatkan distribusi elektron yang semakin banyak dan cepat sehingga endapan tembaga ini tidak melekat dengan baik, akibatnya banyak endapan Cu yang jatuh kembali ke dalam larutan elektrolit CuSO4 menyebabkan hasil pengendapan yang didapatkan kurang optimal
(Sopiah, 2008). Berdasarkan perhitungan molaritas, dengan konsentrasi 2gr/l didapatkan molaritas CuSO4.5H2O sebesar 0,01 M. Dari hasil
penelitian sebelumnya didapatkan konsentrasi optimum yaitu 0,01 M dan 0,1 M karena pada konsentrasi tersebut logam yang mengendap di katoda terus meningkat seiring dengan pertambahan waktu elektroplating (Buyang dan Asmaningrum, 2015).
Karena nilai efisiensi atau WZn pada konsentrasi larutan elektrolit
CuSO4 2 gr/l mencapai titik tertinggi dibanding dengan konsentrasi lain,
maka dapat disimpulkan bahwa konsentrasi larutan elektrolit optimum untuk proses elektroplating ini adalah 2 gr/l.
4.4 Pengaruh Kuat Arus terhadap Konstanta Laju Reaksi Elektroplating
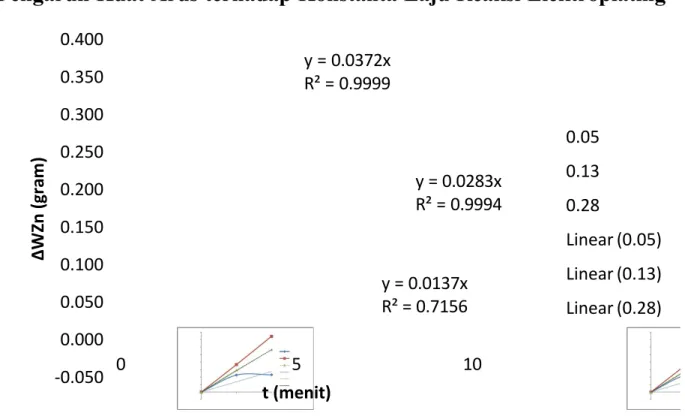
Gambar 4.17 Hubungan antara waktu vs masa Cu yang menempel
Berdasarkan gambar 4.18, perubahan massa ditunjukkan pada sumbu y sebagai massa Cu yang menempel pada Zn dan sumbu x adalah waktu. Laju reaksi kimia adalah jumlah mol reaktan per satuan volume yang bereaksi dalam satuan waktu tertentu. Bila dibuat sebuah kurva sebagai
fungsi waktu, maka akan diperoleh kurva bahwa slope yang
y = 0.0137x R² = 0.7156 y = 0.0372x R² = 0.9999 y = 0.0283x R² = 0.9994 -0.050 0.000 0.050 0.100 0.150 0.200 0.250 0.300 0.350 0.400 0 5 10 ∆ W Z n ( g r a m ) t (menit) 0.05 0.13 0.28 Linear (0.05) Linear (0.13) Linear (0.28)
menggambarkan tentang konstanta laju reaksi. Semakin besar nilai R 2 atau maksimal mendekati 1 maka proses tersebut dapat dikatakan memiliki kesamaan dengan persamaan kinetika. Nilai regresi linear di dalam grafik menunjukan kesamaan antara persamaan kinetika dengan kinerja proses elektrolisis.
Laju suatu reaksi kimia sangat dipengaruhi oleh besarnya kuat arus yang digunakan dalam reaksi. Semakin besar kuat arus yang digunakan, laju reaksi akan meningkat. Di samping itu, laju reaksi juga dipengaruhi oleh nilai konstanta laju reaksi (k ). Reaksi akan berlangsung lebih cepat jika nilai k lebih besar.
Berdasarkan gambar 4.18 pada proses elektroplating dengan konsentrasi 2 gr/L dan berbagai kuat arus, perubahan massa ditunjukan pada sumbu y sebagai massa Cu yang menempel pada Zn dan sumbu x sebagai waktu. Maka laju reaksi merupakan nilai gradient atau slope, dimana pada kuat arus 0,13 A menghasilkan nilai k yang paling besar yaitu sebesar 0,0372. Sedangkan pada kuat arus 0,05 A dan 0,28 A menghasilkan nilai k sebesar 0,0137 dan 0,0283.
Menurunnya laporan dari Sopiah (2008), efisiensi berkaitan dengan rapat arus yang digunakan. Rapat arus adalah arus per satuan luas permukaan elektroda, biasanya dinyatakan dalam Ampere.cm-2 permukaan. Penggunaan rapat arus yang terlalu besar pada anoda bila dibandingkan dengan luas permukaan anoda yang cukup kecil tidak berimbang. Sehingga arus akan lewat dengan cepat menyebabkan terjadi reaksi reduksi yang cepat di katoda. Reduksi dapat terlihat dari terbentuknya endapan tembaga di katoda. Karena reduksi di katoda berlangsung cepat maka endapan tembaga di katoda pun cepat terbentuk. Endapan tembaga ini tidak melekat dengan baik sehingga banyak yang jatuh kembali ke dalam larutan elektrolit dan
menyebabkan masa endapan yang didapatkan kurang optimal (Sopiah, 2008).
4.5 Mekanisme Perpindahan Elektron pada Proses Elektroplating
Perpindahan elektron pada proses elektroplating terjadi bila arus listrik (potensial) searah dialirkan antara kedua elektroda anoda dan katoda dalam laruan elektrolit, sehingga muatan ion positif ditarik oleh elektroda katoda. Sementara ion bermuatan negatif berpindah ke arah elektroda bermuatan positif (Suarsana, 2008 dalam Buyang, 2015) Contoh pada praktikum ini sebagai katoda adalah logam Zn yang akan dilapisis oleh tembaga (Cu) dimana larutan elektrolis yang digunakan adalah CuSO4.5H2O. Elektroda
anoda (Zn) yang kelebihan muatan listrik negatif, akan menarik muatan ion yang berbeda dalam larutan, yaitu ion Cu2+. Sedangkan elektroda positif (Cu) yang kekurangan elektron akan menarik ion negatif dalam larutan. Adanya arus listrik yang dialirkan akan menyebabkan terjadinya reaksi redoks, dimana pada elektroda Cu, ion negatif disekitarnya akan melepaskan elektron sehingga terjadi reaksi oksidasi. Pada saat terjadi proses oksidasi, ion negatif akan digantikan oleh ion negatif lain dari larutan, sehingga terjadi aliran ion negatif dari larutan ke elektroda Cu, yang menyebabkan elektroda Cu mengalami reduksi. Akibat dari reduksi ini, ion positif dari sekitar akan menggantikannya sehingga terjadi aliran ion positif dari dari larutan ke elektroda Cu. Pada aliran elektrolit, terjadinya migrasi ion terutama karena perbedaan jumlah antara ion (+) dan ion (-) dalam kumpulan ion (+) atau (-) sehingga tidak stabil, sehingga dalam cairan ada kecenderungan untuk mempertahankan muatan listrik yang netral dan ini dilakukan dengan aliran ion.
Reaksi pada anoda :
2SO42-(aq)→ S2O82-(aq) + 2e
2H2O(l) → O2 (g) + 4H+ + 4e
Reaksi pada katoda: Cu2+(aq)+ 2e → Cu(s)
Jadi pada elektrolisis larutan CuSO4 terjadi reaksi-reaksi: 2H2O(l) → O2 (g) + 4H++ 4e (Anoda)
Cu2+(aq)+ 2e → Cu(s) (Katoda)
2H2O(l) + 2Cu2+(aq)→ O2 (g) + 4H+ + 2Cu(s) (Reaksi sel)
BAB V PENUTUP
5.1. Kesimpulan
1. Semakin lama waktu yang digunakan pada proses pelapisan, maka semakin besar pula pelapisan logam Zn dengan Cu, waktu optimum pada praktikum ini adalah 10 menit.
2. Berat Zn akan terus bertambah seiring dengan meningkatnya kuat arus, kuat arus, namun pada kuat arus yang terlalu tinggi, proses reduksi akan terjadi secara cepat sehingga endapan yang terbentuk di katoda tidak melekat dengan baik. Kuat arus optimum pada praktikum ini adalah 0,13 A.
3. Seiring dengan bertambahnya konsentrasi larutan elektrolit CuSO4 maka
Zn akan mengalami penambahan berat akibat terlapisi oleh Cu, namun pada konsentrasi yang tinggi akan menyebabkan distribusi electron yang cepat dan mengakibatkan endapan Cu jatuh kembali ke larutan elektrolit. Konsentrasi optimum pada praktikum ini adalah 2 gr/l.
4. Pengaruh Kuat Arus terhadap Konstanta laju reaksi proses pelapisan Zn oleh Cu ini pada kuat arus 0,05 A sebesar 0,0137 gr/menit, sedangkan pada kuat arus 0,13 A dan 0,28 A sebesar 0,0372 gr/menit dan 0,0283
gr/menit.
5.2. Saran
1. Pastikan bak elektroplating dicuci dengan bersih setiap pergantian variabel.
2. Hindari goncangan/gerakan pada elektroda yang dapat mengganggu proses elektroplating.
3. Pastikan elektroda tercelup merata dan sejajar saat dimasukkan ke dalam larutan elektrolit.
4. Hindari kontak langsung antar elektroda karena dapat menyebabkan loncatan arus listrik.
DAFTARPUSTAKA
Buyang, Y., & Asmaningrum, H. P. (2015). Pengaruh Voltase dan Waktu Terhadap Pengendapan Logam Mangan dan Seng pada Lempeng Tembaga Menggunakan Metode Electroplating . Magistra, 2 (2), 226-236. Dewi, C.A & Ahmadi. (2013). Pengaruh Waktu Pada Elektroplating Krom
Dekoratif Dengan Logam Basis Tembaga Terhadap Laju Korosi . IKIP Mataram: Jurnal Ilmiah Pendidikan Kimia “Hydrogen”.
Fogler, H.S. (2006). Elements of Chemical Reaction Engineering . 4th Edition. Prentice Hall PTR.
Gautama. (2009). Hukum Faraday. Dikutip dari
http://www.kimiadasar.com/hukum-faraday/. 1-2.
Hassanudin. (2015). Hukum Faraday. Dikutip dari http://www.kimiadasar.com/hukum-faraday/ pada 1 September 2017.
Irwanto. (2013). Pengaruh Jarak Anoda-Katoda dan Pemerataan Arus Terhadap Ketebalan Lapisan dan Efisiensi Katoda Pada Electroplating Tembaga Asam Untuk Baja Karbon Sedang. UNILA, 14-26.
Martin S. Silberberg. (2006). Chemistry: The Molecular Nature of Matter and Change, 4th Edition, The McGraw-Hill Companies, Inc., ISBN 0-07-111658-3
Mordechay Schlesinger, Milan Paunovic (Editors). (2010). Modern Electroplating, 5th Edition. John Wiley & Sons, Inc.
Putri, A. & Handani, S. (2015). Karakterisasi Sifat Mekanik Hasil Elektroplating Nikel Karbonat (NiCo3 ) Pada Tembaga (Cu). Jurnal Fisika Unand Vol. 4,
No.1, ISSN 2302-8491. Padang: Universitas Andalas.
Sopiah, Siti. (2008). Laporan Tesis Analisis Faktor-Faktor yang Mempengaruhi Proses Elektrolisis Larutan CuSO4 sebagai Bahan Kajian dalam
Pembuatan Modul Praktikum dan Pembelajaran Elektronik . Bandung: Digilib.itb.
Sutomo, dkk. (2012). Pengaruh Arus Dan Waktu Pada Pelapisan Nikel Dengan Elektroplating Untuk Bentuk Plat . UNDIP Semarang: Sekolah Vokasi
LAPORAN SEMENTARA PRAKTIKUM PROSES KIMIA
MATERI: Elektroplating
Disusun Oleh: Kelompok
2/Kamis
Dyah Ayu Dewi A 21030115120058 Fiqky Akbar Wisnu M 21030115130142
Gelbert Jethro S 21030115130165 Talita Maharani 21030115140187
LABORATORIUM PROSES KIMIA TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
I. TUJUAN PERCOBAAN
1. Mengkaji proses reduksi dan pengendapan logam-logam berat yang terkandung dalam larutan secara elektrokimia atau elektrolisis
2. Mengkaji mekanisme reaksi reduksi dan pengendapan logam-logam berat dalam larutan secara reaksi elektrokimia
3. Mengkaji kinetika reaksi reduksi dan pengendapan logam-logam berat dalam larutan secara elektrokimia.
II. PERCOBAAN
2.1 Bahan Yang Digunakan CuSO418,6 gram
Plat Cu sebagai anoda 1 buah Plat Zn sebagai Katoda 1 buah Aquadest
2.2 Bahan Yang Digunakan Bak electroplating Amperemeter Voltmeter Anoda Katoda Sumber arus DC 2.3 Variabel Percobaan Variabel tetap Konsentrasi larutan : 1,5 gr/l; 2gr/l; 2,7 gr/l Kuat arus : 0,05 A; 0,13 A; 0,28 A
Waktu : 5 menit, 10 menit, 15 menit, 20 menit, 25 menit
2.4 Cara Kerja
1. Mencari Waktu Kontak Optimum
Larutan limbah atau larutan sintetis yang ada pada bak elektroplating diambil setiap 5 menit selama 25 menit. Disini variabel lain yang dipakai yaitu kuat arus pada 0,13 A konsentrasi 2 g/l. Sampel yang diperoleh dianalisa dan dihitung efisiensi penurunan kadar tembaga, sampel yang menghasilkan efisiensi yang paling tinggi merupakan waktu kontak yang optimum. Untuk proses selanjutnya waktu kontak ini yang digunakan.
2. Mencari Kuat Arus Optimum
Larutan dimasukkan ke dalam saluran input dengan konsentrasi yang tetap dan pada waktu kontak optimum, tetapi kuat arus yang digunakan berbeda yaitu masing-masing 0,05 A; 0,13 A; 0,28 A. Hasil Elektroplating dianalisa, sampel yang menghasilkan eZnsiensi yang paling tinggi merupakan kuat arus yang optimum dan digunakan pada proses selanjutnya.
3. Mencari Konsentrasi Optimum
Larutan yang dimasukkan dengan konsentrasi yang berbeda yaitu 1,5 g/l, 2g/l dan 2,7 g/l, tetapi waktu kontak dan kuat arus yang digunakan yang pada kondisi optimum. Hasil ketiga sampel dianalisa dan dihitung efisiensi penurunan kadar tembaga, sampel yang menghasilkan eZnsiensi yang paling tinggi merupakan konsentrasi optimum.
2.5 Hasil Percobaan
Penentuan Waktu Kontak Optimal t = 0 W Zn = 4,702 gr
W Cu = 5,104 gr
t = 5 W Zn = 4,822 gr W Zn = W5 Zn – W0Zn = 0,120 gr
W Cu = 5,102 gr
W Cu = 4,928 gr t = 15 W Zn = 4,849 gr W Zn = W15 Zn – W0 Zn = 0,147 gr W Cu = 4,876 gr t = 20 W Zn = 4,901 gr W Zn = W20 Zn – W0 Zn = 0,199 gr W Cu = 4,855 gr t = 20 W Zn = 4,943 gr W Zn = W25 Zn – W0 Zn = 0,241 gr W Cu = 4,827 gr
Penentuan Kuat Arus Optimal
I = 0,08 A t = 0 W Zn = 4,739 gr W Cu = 5,109 gr t = 5 W Zn = 4,917 gr W Zn = W5 Zn – W0 Zn = 0,178 gr W Cu = 5,006 gr t = 10 W Zn = 5,012 gr W Zn = W10 Zn – W0 Zn = 0,273 gr W Cu = 4,982 gr t = 15 W Zn = 5,030 gr W Zn = W15 Zn – W0 Zn = 0,291 gr W Cu = 4,897 gr I= 0,15 A t = 0 W Zn = 4,702 gr W Cu = 5,104 gr t = 5 W Zn = 4,822 gr W Zn = W5 Zn – W0 Zn = 0,120 gr W Cu = 5,102 gr t = 10 W Zn = 4,843 gr W Zn = W10 Zn – W0 Zn = 0,140 gr W Cu = 4,928 gr t = 15 W Zn = 4,849 gr W Zn = W15 Zn – W0 Zn = 0,147 gr W Cu = 4,876 gr I = 0,45 A t = 0 W Zn = 4,699 gr W Cu = 5,066 gr t = 5 W Zn = 4,838 gr W Zn = W5 Zn – W0 Zn = 0,139 gr W Cu = 5,033 gr t = 5 W Zn = 4,871 gr W Zn = W10 Zn – W0 Zn = 0,172 gr W Cu = 5,005 gr t = 5 W Zn = 4,979 gr W Zn = W15 Zn – W0 Zn = 0,280 gr W Cu = 4,986 gr Penentuan Konsentrasi Optimal
W Cu = 5,103 gr t = 5 W Zn = 4,823 gr W Zn = W20 Zn – W0 Zn = 0,085 gr W Cu = 5,030 gr t = 10W Zn = 4,922 gr W Zn = W20 Zn – W0 Zn = 0,184 gr W Cu = 4,965 gr t = 5 W Zn = 4,948 gr W Zn = W20 Zn – W0 Zn = 0,210 gr W Cu = 4,871 gr C = 2 gr/l t = 0 W Zn = 4,739 gr W Cu = 5,109 gr t = 5 W Zn = 4,917 gr W Zn = W5 Zn – W0 Zn = 0,178 gr W Cu = 5,006 gr t = 10 W Zn = 5,012 gr W Zn = W10 Zn – W0 Zn = 0,273 gr W Cu = 4,982 gr t = 15 W Zn = 5,030 gr W Zn = W15 Zn – W0 Zn = 0,291 gr W Cu = 4,897 gr C = 2,7 gr/lt = 0 W Zn = 4,698 gr W Cu = 5,102 gr t = 5 W Zn = 4,868 gr W Zn = W5 Zn – W0 Zn = 0,170 gr W Cu = 5,001 gr t = 10 W Zn = 5,008 gr W Zn = W10 Zn – W0 Zn = 0,310 gr W Cu = 4,987 gr t = 15 W Zn = 5,271 gr W Zn = W15 Zn – W0 Zn = 0,573 gr W Cu = 4,964 gr Semarang, 28 September 2017 Praktikan
Ayu, Fiqky, Talita, Gelbert
Mengetahiu Asisten
Bayu Aji Pratama NIM 21030115130136
LEMBAR PERHITUNGAN
Untuk Mencari Waktu Kontak dan Kuat Arus Optimum I = 0,15 A
Basis = 3 L C = 2 gr/L
W = 2 gr/L x 3 L = 6 gr CuSO4
Untuk Mencari Konsentrasi Optimum C = 1,5 gr/L basis 3 L W = 1,5 gr/L x 3 L = 4,5 gr CuSO4 C = 2,5 gr/L basis 3 L W = 2,5 gr/L x 3 L = 7,5 gr CuSO4 C = 4,75 gr/L basis 3 L W = 4,75 gr/L x 3 L = 14,25 gr CuSO4
Penentuan Waktu Kontak Optimal t = 0 W Zn = 4,702 gr W Cu = 5,104 gr t = 5 W Zn = 4,822 gr W Zn = W5 Zn – W0Zn = 0,120 gr W Cu = 5,102 gr t = 10 W Zn = 4,843 gr W Zn = W10 Zn – W0 Zn = 0,140 gr W Cu = 4,928 gr t = 15 W Zn = 4,849 gr W Zn = W15 Zn – W0 Zn = 0,147 gr W Cu = 4,876 gr t = 20 W Zn = 4,901 gr W Zn = W20 Zn – W0 Zn = 0,199 gr W Cu = 4,855 gr t = 25 W Zn = 4,943 gr W Zn = W25 Zn – W0 Zn = 0,241 gr W Cu = 4,827 gr
Penentuan Kuat Arus Optimal
I = 0,08 A t = 0 W Zn = 4,739 gr W Cu = 5,109 gr
t = 5 W Zn = 4,917 gr W Zn = W5 Zn – W0 Zn = 0,178 gr
t = 10 W Zn = 5,012 gr W Zn = W10 Zn – W0 Zn = 0,273 gr W Cu = 4,982 gr t = 15 W Zn = 5,030 gr W Zn = W15 Zn – W0 Zn = 0,291 gr W Cu = 4,897 gr I= 0,15 A t = 0 W Zn = 4,702 gr W Cu = 5,104 gr t = 5 W Zn = 4,822 gr W Zn = W5 Zn – W0 Zn = 0,120 gr W Cu = 5,102 gr t = 10 W Zn = 4,843 gr W Zn = W10 Zn – W0 Zn = 0,140 gr W Cu = 4,928 gr t = 15 W Zn = 4,849 gr W Zn = W15 Zn – W0 Zn = 0,147 gr W Cu = 4,876 gr I = 0,45 A t = 0 W Zn = 4,699 gr W Cu = 5,066 gr t = 5 W Zn = 4,838 gr W Zn = W5 Zn – W0 Zn = 0,139 gr W Cu = 5,033 gr t = 5 W Zn = 4,871 gr W Zn = W10 Zn – W0 Zn = 0,172 gr W Cu = 5,005 gr t = 5 W Zn = 4,979 gr W Zn = W15 Zn – W0 Zn = 0,280 gr W Cu = 4,986 gr Penentuan Konsentrasi Optimal
C = 1 gr/l t = 0 W Zn = 4,738 gr W Cu = 5,103 gr t = 5 W Zn = 4,823 gr W Zn = W20 Zn – W0 Zn = 0,085 gr W Cu = 5,030 gr t = 10W Zn = 4,922 gr W Zn = W20 Zn – W0 Zn = 0,184 gr W Cu = 4,965 gr t = 5 W Zn = 4,948 gr W Zn = W20 Zn – W0 Zn = 0,210 gr W Cu = 4,871 gr C = 2 gr/l t = 0 W Zn = 4,739 gr W Cu = 5,109 gr t = 5 W Zn = 4,917 gr W Zn = W5 Zn – W0 Zn = 0,178 gr W Cu = 5,006 gr t = 10 W Zn = 5,012 gr W Zn = W10 Zn – W0 Zn = 0,273 gr W Cu = 4,982 gr
t = 15 W Zn = 5,030 gr W Zn = W15 Zn – W0 Zn = 0,291 gr W Cu = 4,897 gr C = 2,7gr/lt = 0 W Zn = 4,698 gr W Cu = 5,102 gr t = 5 W Zn = 4,868 gr W Zn = W5 Zn – W0 Zn = 0,170 gr W Cu = 5,001 gr t = 10 W Zn = 5,008 gr W Zn = W10 Zn – W0 Zn = 0,310 gr W Cu = 4,987 gr t = 15 W Zn = 5,271 gr W Zn = W15 Zn – W0 Zn = 0,573 gr W Cu = 4,964 gr
Variabel waktu Optimum
x y x2 xy 0 0 0 0 5 0.12 25 0.6 10 0.14 100 1.4 15 0.147 225 2.205 20 0.199 400 3.98 25 0.241 625 6.025 Ʃ 75 0.847 1375 14.21 Y = bx + a Y= 0.00828 x + 0.037667 Variabel I = 0.08 A x y x2 xy 0 0 0 0 5 0.178 25 0.89 10 0.273 100 2.73 15 0.291 225 4.365 Ʃ 30 0.742 350 7.985
Y = bx + a Y = 0.01936 x + 0.0403 Variabel I = 0.15 A x y x2 xy 0 0 0 0 5 0.12 25 0.6 10 0.14 100 1.4 15 0.147 225 2.205 Ʃ 30 0.407 350 4.205 Y = bx + a Y = 0.0326 x + 0.00922 Variabel I = 0.22 A x y x2 xy 0 0 0 0 5 0.139 25 0.695 10 0.172 100 1.72 15 0.28 225 4.2 Ʃ 30 0.591 350 6.615 Y = bx + a Y = 0.01746x + 0.0168