HASIL DAN PEMBAHASAN
A. PENGUJIAN BAKTERI TRANSFORMANPengujian bakteri hasil transformasi dilakukan untuk memastikan bahwa gen pengkode enzim arabinosa isomerase (AI) dari Geobacillus stearothermophilus lokal yaitu gen araA benar-benar masuk ke vektor ekspresi dan kemudian dapat terekspresi dengan sistem induksi IPTG. Bakteri atau inang E.coli BL21 pLysS dan E. coli BL21 (DE3) pLysS pET21b digunakan sebagai pembanding. Protein target yang diharapkan terekspresi kemudian dianalisis dengan Sodium Dedocyl Sulfate Polyacrilamide Gel Electrophoresis (SDS-PAGE) berdasarkan berat molekul.
Hasil yang diperoleh menunjukkan bahwa protein atau enzim target telah terekspresi dengan sistem induksi IPTG pada bakteri transfroman E. coli BL21 pET21b(+) araA. Sedangkan pada inang E. coli BL21 tanpa plasmid ataupun E.coli BL21 dengan plasmid pET21b, protein atau enzim target tidak ada (data tidak ditampilkan). Enzim arabinosa isomerase (AI) dari Geobacillus stearothermophilus lokal memiliki berat molekul 56 kDa (Fitriani & Saksono 2010). Penelitian-penelitian sebelumnya menunjukkan bahwa enzim AI yang dikodekan oleh gen araA dari G. stearothermophilus T6, G. thermodenitrificans, B. stearothemophilus US100 dan B. stearothermophilus IAM 11001 setelah terekspresi menggunakan inang E. coli memiliki berat molekul 56 kDa (Lee et al 2005a; Kim & Oh 2005; Rhimi & Bejar 2006; Cheng et al 2009).
Terekspresinya enzim AI pada bakteri transforman disebabkan adanya gen araA yang mengkodenya. E. coli BL21 dan E. coli BL21 pET21b tidak memiliki gen araA asal Geobacillus stearothermophilus lokal. Gen araA ini telah disisipkan pada vektor ekpresi yaitu pET21b(+) tepatnya pada bagian hilir T7 promoter dan bagian hulu terminator. Gen araA akan diekpresikan menjadi protein atau enzim AI setelah ditambahkan senyawa penginduksi isopropyl-ß-D-thiogalactopyranoside (IPTG). IPTG menyebabkan represor terlepas dari operator. Sehingga terjadi sintesis atau pembentukan protein/enzim target dengan melibatkan T7 RNA polimerase asal bakteri BL21 (DE3) (Sorensen & Mortensen 2005).
116 kDa
B. PRODUKSI ENZIM ARABINOSA ISOMERASE
Produksi enzim AI dilakukan dengan memodifikasi medium ekspresi. Modifikasi medium ekspresi dilakukan karena enzim target yang diharapkan tidak terekspresi secara maksimal pada medium ekspresi yang biasa digunakan yaitu media cair Luria Bertani (LB). Pita yang masih tipis dari analisis SDS-PAGE (data tidak ditampilkan) menunjukkan bahwa tidak diperolehnya kondisi overekspresi.
Berdasarkan penelitian Putri (2010) diketahui bahwa limbah cair tahu yang ditambahkan ekstrak khamir dan diatur pH-nya dapat digunakan sebagai medium pertumbuhan dan medium ekspresi protein rekombinan. E. coli transfroman yang ditumbuhkan pada media limbah cair tahu dengan penambahan ekstrak kamir 0,5% (m/v) memberikan level ekspresi yang tinggi. Penggunaan limbah cair tahu sebagai medium ekspresi lebih memudahkan tahapan pemisahan enzim target dari protein membran setelah freeze-thaw dibandingkan medim LB.
~56 kDa
LB LCT+YE
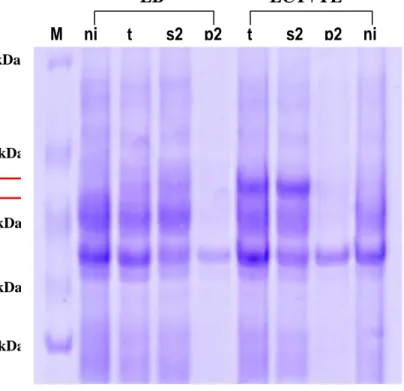
Gambar 11. Perbandingan ekpresi enzim AI pada 2 jenis medium ekpresi
berbeda. Keterangan: LB = luria bertani, LCT+YE=limbah cair tahu + yeast extract, M=marker, ni= non induksi, t=total suspensi sel, s2=supernatan 2, p2=pellet 2.
66.2 kDa
45 kDa
35 kDa
25 kDa
Dari analisis dengan SDS-PAGE (gambar 11) telah terkonfirmasi bahwa medium ekpresi yang lebih baik untuk produksi enzim arabinosa isomerase adalah limbah cair tahu yang ditambahkan ekstrak kamir (LCT+YE). Media cair LB juga dapat digunakan sebagai medium ekspesi, akan tetapi pita (band) enzim target yang dihasilkan sangat tipis dibandingkan dengan medium LCT + YE. Perlakuan non induksi atau tanpa penambahan isopropyl-beta-D-thiogalactopyranosidasei (IPTG) bertujuan agar lebih meyakinkan bahwa yang terekspresi dengan berat molekul 56 kDa adalah enzim target. Sedangkan adanya running terhadap total, supernatant ke-2 dan pellet ke-2 agar diketahui bahwa enzim AI terdapat pada supernatan.
Sistem ekspresi protein rekombinan dengan inang E. coli BL21 dan plasmid pET21b merupakan sistem ekspresi modern dan telah banyak diterapkan. Gen target yang dikloning pada plasmid pET21b berada pada posisi hilir (downsteam) dari promoter atau T7 promoter. T7 promoter berada pada bagian hulu dari operator. T7 promoter ini hanya akan mengenali T7 RNA polimerase dari T7 faga pada E. coli BL21 untuk memulai transkripsi gen target. Karena keberadaan represor pada operator masing-masing genom E. coli BL21 (DE3) dan plasmid pET menyebabkan kecil kemungkinan T7 RNA polimerase diproduksi. Meskipun diproduksi, plasmid pLysS yang mengkode T7 lisosim akan menginaktifkan T7 RNA polimerase sebelum bergabung dengan T7 promoter. Jika T7 lisosim tidak mampu juga menginaktifkan seluruh T7 RNA polimerase, maka keberadaan represor pada operator pET akan menghambat transkripsi gen target (Sambrook & Russell 2001). Penambahan IPTG sebagai senyawa penginduksi akan menyebabkan represor terlepas dari operator sehingga RNA polimerase diproduksi dan kemudian berikatan dengan T7 promoter (Sorensen & Mortensen 2005). Hal inilah yang menyebabkan tidak adanya enzim target yang dihasilkan apabila tidak diinduksi dengan IPTG. Oleh karena gen pengkode T7 RNA polimerase berasal dari virus bakteri (faga), maka proses transkripsi ini akan berlangsung dengan cepat dan T7 RNA polimerase diproduksi dalam jumlah banyak.
Limbah cair tahu yang ditambahkan ekstrak khamir (LCT+YE) dapat digunakan sebagai medium untuk memproduksi enzim AI asal Geobacillus stearothermophilus lokal menggunakan inang E. coli BL21 pLysS pET21b dikarenakan medium ekspresi ini mengandung sumber carbon (C), nitrogen (N) dan mineral yang dibutuhkan oleh bakteri transfroman tersebut. Limbah cair tahu cukup potensial digunakan sebagai media fermentasi karena masih memiliki komponen nutrisi yang cukup lengkap bagi pertumbuhan mikroba (Kawira 1993). Limbah cair tahu mengandung 0.01% sumber karbon, 0.08% sumber nitrogen dan 27.5% mineral berupa kalsium, magnesium, besi, natrium, kalium, dan fosfor (Nurdin 1989). C dan N berguna sebagai sumber energi untuk metabolisme atau sintesis protein. Sedangkan mineral berfungsi sebagai kofaktor serta membantu membawa nutrisi ke dalam sel.
Pemilihan media fermentasi merupakan faktor yang sangat penting dalam memproduksi enzim dari mikroba, disamping faktor lain seperti kondisi fermentasi dan spesies mikroorganisme (Aunstrup 1979). Menurut Meyrath & Volvasek (1975), konsentrasi karbon murni yang rendah dan protein yang tinggi pada media akan meningkatkan produksi enzim dari mikroba. Ketika bakteri diinokulasikan ke dalam medium, bakteri akan memanfaatkan karbon sebagai sumber energi untuk beradaptasi dengan medium. Setelah sumber karbon murni habis atau tersisa sedikit, bakteri kemudian mulai mensintesis enzim-enzim yang dapat digunakan untuk menghidrolisis protein menjadi asam-asam amino.
Asam-Gambar 12. Mekanisme ekspresi terinduksi IPTG pada inang E. coli BL21(DE3)
asam amino ini akan digunakan sebagai sumber energi oleh bakteri untuk bertahan hidup dan melakukan replikasi.
Limbah cair tahu diperkirakan masih mengandung sedikit sumber karbon dari pati kedelai. Protein pada limbah cair tahu berasal dari kedelai. Dalam proses pembuatan tahu, pada proses ekstraksi dengan air panas, sekitar 79-82% kandungan protein kedelai dapat diekstrak. Dari protein yang terekstrak ini, pada waktu pengendapan tahu tidak semuanya mengendap. Banyaknya protein yang dapat digumpalkan atau diendapkan tergantung pada jenis penggumpalnya. Karena tidak terekstraksinya dan terendapnya semua protein yang terdapat pada kedelai, maka pada limbah cair tahu masih terdapat protein kedelai (Nurdin 1989). Penambahan ekstrak khamir ke dalam media limbah cair tahu meningkatkan kandungan nutrisi medium. Ekstrak khamir merupakan protein sel tunggal yang kaya akan asam amino, peptida, vitamin-vitamin B dan trace element. Ekstrak khamir juga mengandung asam nukleat terutama RNA (Singleton & Sainsbury 2006).
Penelitian yang dilakukan oleh Nurdin (1989) menunjukkan bahwa limbah cair tahu lebih baik dalam menghasilkan enzim protease asal bakteri Bacillus licheniformis BCC 0607 dibandingkan medium sintetis. Pada penelitian ini, medium LCT+YE lebih baik sebagai medium ekpresi enzim AI dibandingkan LB karena LCT+YE mengandung mineral yang lebih lengkap. Natrium, kalium dan kalsium menjaga agar protein dan komponen nutrisi lainnya dapat secara simultan dibawa ke dalam sel melalui mekanisme transpor aktif. Sedangkan magnesium (Mg) berfungsi sebagai kofaktor esensial dalam sintesis protein. Sintesis protein oleh E. coli membutuhkan Mg untuk mengaktifkan asam amino dari poolnya, mengawali proses translasi (initiation) dan pada tahap pemanjangan (elongation) menjadi oligopeptida atau protein (Stader 1995; Prescott 2002). Kalsium juga diketahui dapat meningkatkan produksi enzim rekombinan pada E. coli BL21. Penelitian yang telah dilakukan oleh Delgado (2009) menunjukkan bahwa level ekpresi protein rekombinan oleh E. coli BL21 secara jelas meningkat 15% lebih tinggi pada medium LB yang ditambahkan kalsium (Ca) dibandingkan medium LB saja. Ca diduga berperan sebagai pembawa pesan intreseluler (intracellular messenger) dalam sel prokariotik.
C. OPTIMASI PRODUKSI DENGAN LAMA WAKTU INDUKSI
Ekspresi protein rekombinan dengan sistem terinduksi masih merupakan pilihan untuk memproduksi enzim AI. Enzim AI yang dihasilkan dari beberapa genus bakteri, menggunakan senyawa penginduksi supaya gen target mengalami transkripsi dan translasi. Lama waktu induksi yang digunakan untuk ekspresi enzim ini bervariasi. Lee et al (2005a) memproduksi enzim AI asal G. stearothermophilus T6 dan B. halodurans dengan lama waktu induksi 4 jam, sedangkan Lee et al (2004) menggunakan lama waktu induksi 5 jam untuk ekpresi enzim AI asal T. maritima. Chouayekh et al (2007), Cheng et al (2009) dan Cheng et al (2010) memproduksi enzim AI yang masing-masing secara berurutan berasal dari L. plantarum, B. stearothermophilus IAM 11001, dan Acidothermus cellulolytics dengan lama waktu induksi 6 jam. Kim et al (2002) menggunakan lama waktu induksi 15 jam untuk menghasilkan enzim AI asal T. neapolitana. Enzim AI asal Lactobacillus sakei dihasilkan dengan menginduksi inang ekspresi selama semalaman (overnight) (Rhimi et al 2010). Lama waktu induksi yang dilakukan pada studi tersebut diatas adalah untuk menghasilkan enzim AI, dan pada studi tersebut tidak disebutkan atau dibahas tentang optimasi produksi.
Menurut Donovan (1996) terdapat dua poin penting yang perlu diperhatikan agar diperoleh hasil maksimum dari ekspresi terinduksi protein rekombinan pada bakteri. Yang pertama adalah siklus pertumbuhan bakteri tersebut, sehingga diketahui kapan induksi mulai dilakukan. Dan yang kedua yaitu lama waktu induksi. Induksi sebaiknya dilakukan pada saat siklus bakteri telah mencapai setengah fase eksponensial (mid eksponential) karena pada fase ini metabolisme bakteri berlangsung cepat dan sinstesis senyawa metabolitnya meningkat beberapa kali lipat dibandingkan fase-fase lainnya. Semakin lama induksi dilakukan maka semakin lama represor terlepas dari operator dan RNA polimerase yang dihasilkan akan semakin banyak pula. Kopetzki et al (1989) menyatakan bahwa induksi yang terlalu kuat akan menyebabkan beban metabolisme bagi inang dan bisa merangsang terbentuknya inclusion bodies. Oleh karena itu, konsentrasi senyawa penginduksi yang ditambahkan harus minimal. Konsentrasi akhir senyawa penginduksi sebesar 1 mM pada media ekpresi merupakan konsentrasi yang ideal.
Jam ke-0 Jam ke-4 Jam ke-8 Jam ke-12 Jam ke-16 Jam ke-20 Jam ke-24 116 kDa 66.2kDa 45kDa 35kDa ~ 56 kDa
Khoo et al (2010) menyimpulkan bahwa konsentrasi IPTG 1 mM adalah konsentrasi terbaik untuk menghasilkan protein rekombinan menggunakan inang E. coli. Chen & Morgan (2006) menyebutkan bahwa waktu induksi yang terlalu lama akan menyebabkan nutrisi yang diperlukan oleh kultur akan cepat habis. Sehingga sangat penting untuk menyeimbangkan kapasitas induksi dan produksi protein rekombinan, agar diperoleh enzim target dalam jumlah banyak dan dengan aktivitas maksimum.
M
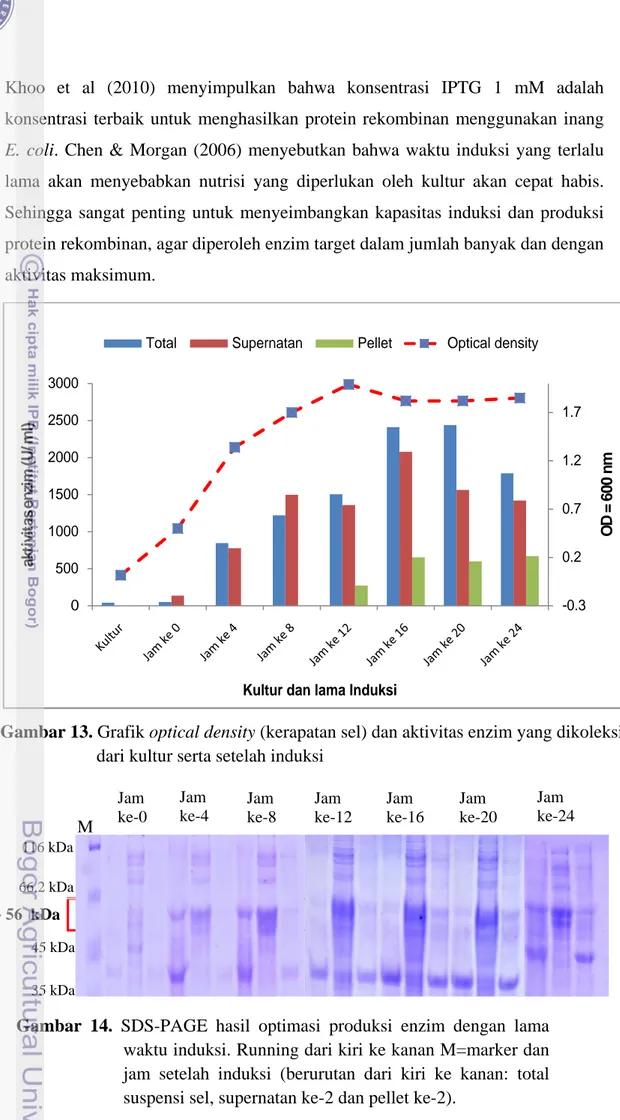
Gambar 13. Grafik optical density (kerapatan sel) dan aktivitas enzim yang dikoleksi
dari kultur serta setelah induksi
Gambar 14. SDS-PAGE hasil optimasi produksi enzim dengan lama
waktu induksi. Running dari kiri ke kanan M=marker dan jam setelah induksi (berurutan dari kiri ke kanan: total suspensi sel, supernatan ke-2 dan pellet ke-2).
-0.3 0.2 0.7 1.2 1.7 0 500 1000 1500 2000 2500 3000 O D = 6 0 0 n m a k ti v it a s e n zi m (U /m l)
Kultur dan lama Induksi
Pada gambar 14 terlihat hasil ekspresi enzim target (supernatan ke-2) antara jam ke-12 , 16 dan 20 hampir sama tebal (bandnya). Akan tetapi pada gambar 13 terlihat produksi enzim AI yang paling optimum adalah dengan lama waktu induksi 16 jam. Gambar 13 menunjukkan bahwa aktivitas enzim tertinggi terdapat pada lama waktu induksi 16 jam dan 20 jam. Tetapi induksi 16 jam memiliki aktivitas enzim pada bagian supernatan yang lebih tinggi (±2000 U/ml) dibandingkan jam ke-20 (±1500 U/ml). Bagian supernatan ke-2 merupakan bagian enzim yang larut dan memiliki aktivitas tinggi.
Gambar 13 menunjukkan bahwa kultur dan induksi jam ke-0 tidak memiliki aktivitas enzimatis terhadap substrat galaktosa yang diberikan. Hal ini menjelaskan bahwa tidak ada enzim AI yang diproduksi pada perlakuan tersebut. Karena jika dibandingkan dengan jam ke-4 setelah induksi, aktivitas enzim AI nampak meningkat secara tajam. Dari gambar 13 diketahui bahwa aktivitas enzim AI terus meningkat apabila waktu induksi diperpanjang hingga 16 jam. Kemudian setelah itu, aktivitas enzim AI kembali menurun. Gambar 13 juga menunjukkan bahwa enzim AI diproduksi secara optimal pada fase stasioner dari fase pertumbuhan inang ekspresi (E. coli BL21 pET21b-araA). Enzim dari mikroba dihasilkan secara optimal pada akhir fase eksponensial atau awal fase stasioner. Tetapi ada juga enzim dihasilkan secara maksimal pada fase stasioner. Optimasi produksi enzim keratinase dari bakteri termofilik diperoleh pada fase pertumbuhan stasioner (Gumulya 2004). Dan enzim protease dari Bacillus subtilis rekombinan dihasilkan secara maksimal pada awal fase stasioner (Sugiarto 2001). Saat memasuki fase stasioner, bakteri akan mengeluarkan senyawa metabolit lebih banyak. Hal ini merupakan bentuk respon stress bakteri terhadap kondisi yang sedang dialaminya, karena akan memasuki fase kematian (Jay et al 2005).
Pada gambar 13 terlihat bahwa pellet ke-2 yang merupakan campuran membrane sel bakteri dan inclusion bodies tidak memiliki aktivitas apabila induksi dilakukan selama 4 dan 8 jam. Tetapi jika waktu induksi diperpanjang maka pellet sedikit memberikan aktivitas. Hal ini kemungkinan disebabkan karena adanya beberapa bagian enzim yang membentuk inclusion bodies dan bergabung bersama pellet ke-2. Kemungkinan terbentuknya inclusion bodies dipertegas melalui keberadaan pita pada posisi 56 kDa dibagian pellet dari perlakuan 12-24
jam setelah induksi (gambar 14). Sedangkan perlakuan 4 dan 8 jam setelah induksi tidak terdapat pita pada bagian pelletnya. Sorensen & Mortensen (2005) menyatakan bahwa masalah yang sering timbul ketika memproduksi enzim rekombinan adalah terbentuknya inclusion bodies. Inclusion bodies adalah aggregat protein target yang tidak larut dan tidak aktif. Inclusion bodies terbentuk karena kesalahan pelipatan (folding) protein akibat dari kondisi stress mikroba sehingga menyebabkan terjadinya beban metabolisme. Salah satu faktor penyebab terjadinya respon stress mikroba dan beban metabolisme adalah tingkat ekspresi yang tinggi. Pada penelitian ini, isolasi enzim AI dilakukan dengan 2 kali sentrifugasi. Setelah induksi dihentikan dengan meletakkan kultur di es, kemudian kultur disentrifugasi dan akan diperoleh supernatan ke-1 (S1) dan pellet ke-1 (P1). Supernatan ke-1 yang merupakan medium ekspresi dibuang sedangkan pellet ke-1 yang merupakan total suspensi sel bakteri ditambahkan larutan buffer dan diberi perlakukan freeze-thaw. Setelah itu, total suspensi sel disentrifugasi kembali untuk mendapatkan supernatan ke-2 (S2) dan pellet ke-2 (P2). Penjelasan lebih rinci mengenai mekanisme pemisahan enzim AI dengan inclusion bodies akan dibahas pada bagian purifikasi.
Pada gambar 14 terlihat bahwa induksi jam ke-0 tidak terdapat pita pada posisi 56 kDa. Ini karena induksi baru diberikan dan ekspresi gen target belum terjadi. Pita dari total suspensi sel pada jam ke-12, 16 dan 20 setelah induksi tidak terlalu jelas dibandingkan jam ke-4, 8 dan 24. Hal ini disebabkan karena running SDS-PAGE atau analisis dengan SDS-PAGE terhadap jam ke-4, 8 dan 24 setelah induksi dilakukan terlebih dahulu. Sedangkan running terhadap jam ke-12, 16 dan 20 setelah induksi dilakukan beberapa hari kemudian. Sehingga diduga enzim total terdegradasi oleh protease-protease yang kemungkinan terdapat pada bakteri. Menurut Stader (1995), E. coli BL21 sangat sedikit mengeluarkan protease Lon dan ompT (protease VII). Namun E. coli juga mampu menghasilkan protease-protease lainnya, baik protease-protease spesifik ataupun protease-protease non-spesifik. Beberapa protease spesifik dan non-spesifik yang mampu dihasilkan oleh E. coli antara lain yaitu protease III dan IV yang berada pada bagian dalam membran (inner membrane), protease V yang dihasilkan dari membran luar dan membran dalam
bakteri, serta protease VI dan serin protease yang dihasilkan oleh membran luar E. coli.
Setelah total suspensi sel (T) dikoleksi, kemudian total suspensi sel ini disimpan pada suhu 4ºC, sedangkan enzim pada supernatant 2 dan pellet 2 disimpan pada suhu -20ºC. Enzim pada total suspensi sel masih bergabung dengan protein-protein lain termasuk dengan protein membran sel. Sedangkan enzim pada supernatant ke-2 lebih murni dan telah terpisah dari protein membran sel serta disimpan pada suhu freezer (-20ºC) yang dapat menginaktifkan enzim secara maksimal. Oleh karena itulah pita pada supernatan ke-2 dari induksi jam ke-12, 16 dan 20 masih terlihat jelas dan tebal.
D. PURIFIKASI
Setelah diperoleh kondisi optimum untuk memproduksi enzim arabinosa isomerase (AI) yaitu dengan menggunakan medium (LCT+YE) dan lama waktu induksi 16 jam, kemudian enzim yang dihasilkan dimurnikan (purifikasi) untuk keperluan karakterisasi dan untuk menghilangkan protein lain yang berikatan dengan enzim AI. Purifikasi dilakukan dengan 3 tahap antara lain: 1) freeze-thaw, 2) heat treatment, dan 3) kolom ion-exchange. Pemilihan metode freeze-thaw sebagai bagian dari tahapan purifikasi karena ekstrak enzim AI berada dalam sitosol bakteri. Dengan freeze-thaw menggunakan suhu -70ºC sebanyak 3 kali ulangan, akan melukai membran sel bakteri. Kristal-kristal es yang terbentuk akan membuat lubang pada membran sel sehingga ketika disentrifugasi, cairan sitoplasma akan mudah dipisahkan dari membran atau protein membran dan inclusion bodies. Inclusion bodies adalah protein target yang tidak larut dan memiliki aktivitas yang sangat rendah, bahkan kemungkinan tidak memiliki aktivitas. Keuntungan memproduksi enzim termostabil adalah dapat mempermudah tahapan purifikasi. Menurut Olichon et al (2007), metode heat treatment dapat menyederhanakan protokol purifikasi protein termotoleran. Heat treatment atau perlakuan panas pada kondisi stabil enzim target akan mendegradasi enzim ataupun protein lain yang tidak tahan panas.
Tahapan akhir dari purifikasi yaitu melewati enzim AI pada kolom yang berisi resin dietil amino etil (DEAE). Resin DEAE merupakan resin anion exchange. Resin DEAE yang bermuatan positif akan mengikat enzim AI yang
bermuatan negatif ketika enzim AI dilewatkan pada kolom. Muatan negatif pada enzim AI karena enzim ini telah dicampurkan dengan buffer tris HCl pH 7.5 pada saat isolasi. Pada kondisi pH diatas pI-nya (pH isoelektrik) enzim AI akan bermuatan negatif. Kolom kromatografi DEAE dapat memisahkan enzim AI dari protein lain yang bermuatan positif. Enzim AI yang berikatan negatif akan berikatan dengan resin DEAE yang bermuatan positif. Enzim AI dielusi dengan garam NaCl, ion garam yang bermuatan negatif dengan afinitas yang lebih kuat akan cenderung berikatan dengan DEAE, sehingga enzim AI akan meluruh.
Protein yang meluruh ditampung masing-masing sebanyak 2 ml per fraksi dan kemudian diukur fingerprint proteinnya atau perkiraan kandungan proteinnya pada panjang gelombang 280 nm. Sebagian besar protein menunjukkan tingkat penyerapan maksimumnya pada panjang gelombang 280 nm, hal ini karena keberadaan rantai samping aromatik dari asam-asam amino (Gupta et al 2003).
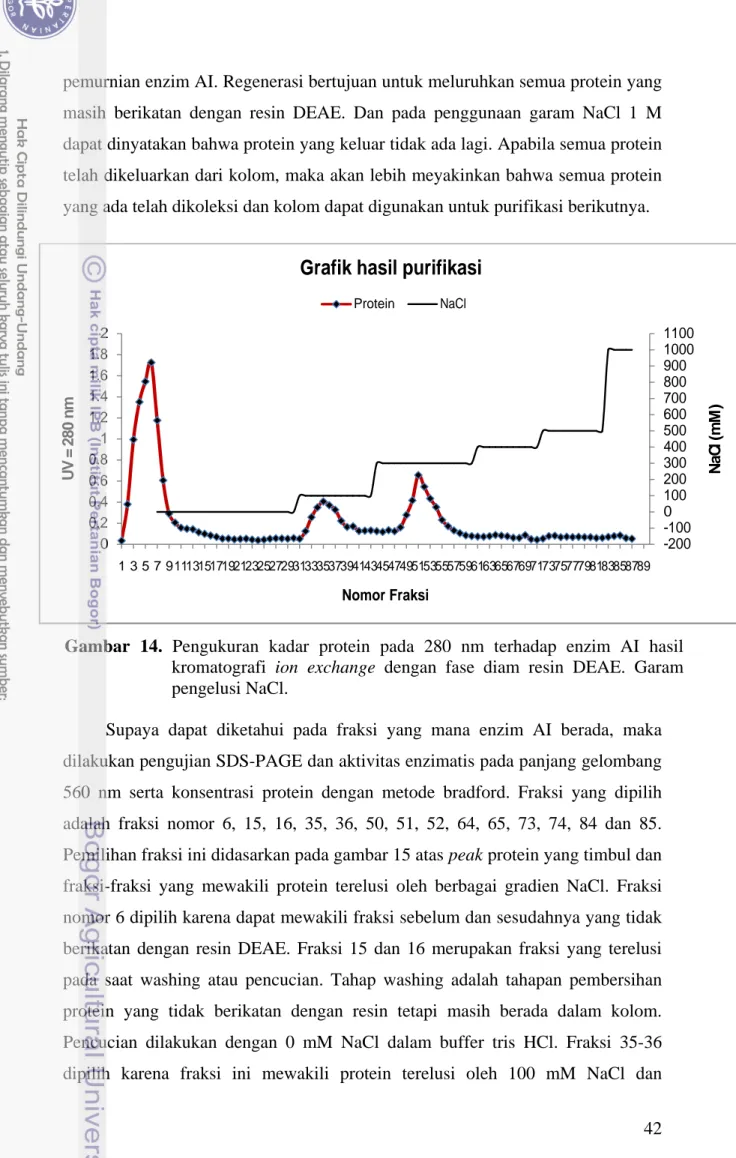
Pada gambar 15 terlihat bahwa peak protein yang muncul berada pada fraksi 3-8, 32-37 dan 49-55. Fraksi 1-6 kemungkinan merupakan protein atau asam amino yang tidak berikatan dengan resin DEAE. Protein ini bermuatan positif, karena ketika sampel enzim AI di masukkan ke dalam kolom, fraksi yang keluar ditampung dan diberi nomor 1–6. Pencucian atau washing terhadap enzim AI yang tidak berikatan lainnya dilakukan menggunakan 10 mM buffer tris HCl, dan fraksi yang ditampung pada tahap washing diberi nomor 7-30. Ketika elusi dilakukan menggunakan 100 mM garam NaCl, protein yang awalnya berikatan mulai keluar pada fraksi 31-43. Akan tetapi enzim AI yang meluruh masih sedikit, sebab ketika dilakukan elusi menggunakan 300 mM NaCl terjadi peningkatan jumlah protein yang keluar. Hal ini terlihat pada gambar 15, tepatnya pada fraksi 49-55 yang puncak proteinnya sangat tinggi dibandingkan protein hasil peluruhan menggunakan 100 mM NaCl. Konsentrasi garam NaCl yang lebih tinggi menyebabkan kekuatan ionik antara resin dengan garam (ion Cl
-) lebih kuat dibandingkan dengan enzim. Sehingga posisi enzim yang terikat dengan resin DEAE digantikan oleh Cl-. DEAE adalah resin ion exchange yang lemah, artinya tidak terlalu kuat dalam mengikat anion . Maka dari itu, konsentrasi 300 mM garam NaCl sudah cukup meluruhkan sebagian besar enzim. Penggunaan garam NaCl 400 dan 500 mM dapat dinyatakan sebagai tahapan regenerasi dalam
pemurnian enzim AI. Regenerasi bertujuan untuk meluruhkan semua protein yang masih berikatan dengan resin DEAE. Dan pada penggunaan garam NaCl 1 M dapat dinyatakan bahwa protein yang keluar tidak ada lagi. Apabila semua protein telah dikeluarkan dari kolom, maka akan lebih meyakinkan bahwa semua protein yang ada telah dikoleksi dan kolom dapat digunakan untuk purifikasi berikutnya.
Supaya dapat diketahui pada fraksi yang mana enzim AI berada, maka dilakukan pengujian SDS-PAGE dan aktivitas enzimatis pada panjang gelombang 560 nm serta konsentrasi protein dengan metode bradford. Fraksi yang dipilih adalah fraksi nomor 6, 15, 16, 35, 36, 50, 51, 52, 64, 65, 73, 74, 84 dan 85. Pemilihan fraksi ini didasarkan pada gambar 15 atas peak protein yang timbul dan fraksi-fraksi yang mewakili protein terelusi oleh berbagai gradien NaCl. Fraksi nomor 6 dipilih karena dapat mewakili fraksi sebelum dan sesudahnya yang tidak berikatan dengan resin DEAE. Fraksi 15 dan 16 merupakan fraksi yang terelusi pada saat washing atau pencucian. Tahap washing adalah tahapan pembersihan protein yang tidak berikatan dengan resin tetapi masih berada dalam kolom. Pencucian dilakukan dengan 0 mM NaCl dalam buffer tris HCl. Fraksi 35-36 dipilih karena fraksi ini mewakili protein terelusi oleh 100 mM NaCl dan
Gambar 14. Pengukuran kadar protein pada 280 nm terhadap enzim AI hasil
kromatografi ion exchange dengan fase diam resin DEAE. Garam pengelusi NaCl. -200 -100 0 100 200 300 400 500 600 700 800 900 1000 1100 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2 1 3 5 7 911131517192123252729313335373941434547495153555759616365676971737577798183858789 N a C l (m M ) U V = 2 8 0 n m Nomor Fraksi
Grafik hasil purifikasi
70 kDa 56 kDa 56 kDa
peak-nya yang lebih tinggi dibandingkan peak sesama terelusi oleh 100 mM NaCl. Alasan yang sama juga menjadi dasar pemilihan fraksi 50, 51 dan 52 yang mewakili fraksi terelusi oleh 300 mM NaCl. Fraksi 64 dan 65 mewakili fraksi terelusi oleh 400 mM NaCl, fraksi 73 dan 74 mewakili terelusi oleh 500 mM NaCl, serta 84 dan 85 mewakili protein yang terelusi oleh 1 M NaCl.
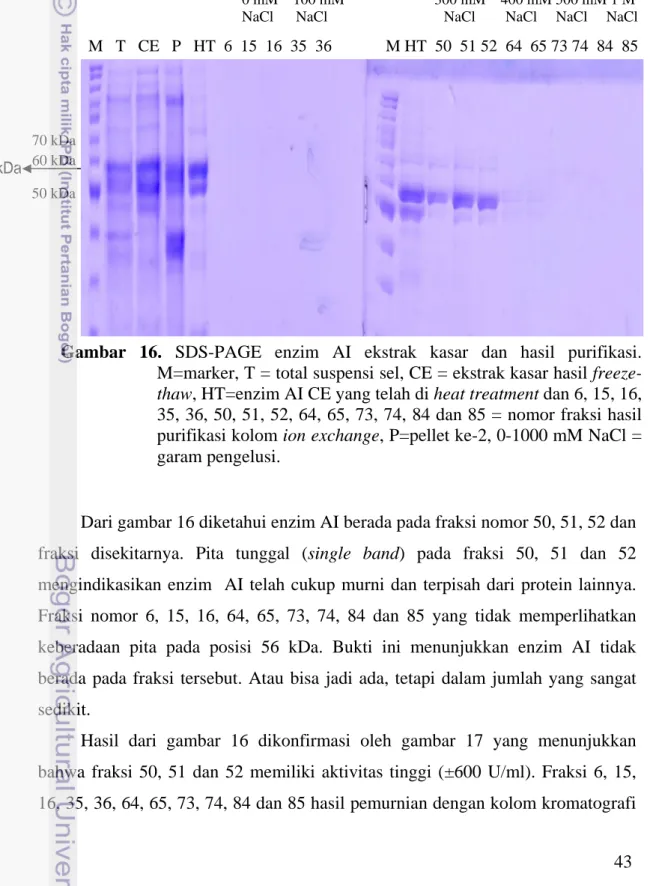
Dari gambar 16 diketahui enzim AI berada pada fraksi nomor 50, 51, 52 dan fraksi disekitarnya. Pita tunggal (single band) pada fraksi 50, 51 dan 52 mengindikasikan enzim AI telah cukup murni dan terpisah dari protein lainnya. Fraksi nomor 6, 15, 16, 64, 65, 73, 74, 84 dan 85 yang tidak memperlihatkan keberadaan pita pada posisi 56 kDa. Bukti ini menunjukkan enzim AI tidak berada pada fraksi tersebut. Atau bisa jadi ada, tetapi dalam jumlah yang sangat sedikit.
Hasil dari gambar 16 dikonfirmasi oleh gambar 17 yang menunjukkan bahwa fraksi 50, 51 dan 52 memiliki aktivitas tinggi (±600 U/ml). Fraksi 6, 15, 16, 35, 36, 64, 65, 73, 74, 84 dan 85 hasil pemurnian dengan kolom kromatografi
56 kDa 50 kDa
60 kDa M T CE P HT 6 15 16 35 36 M HT 50 51 52 64 65 73 74 84 85
0 mM 100 mM 300 mM 400 mM 500 mM 1 M NaCl NaCl NaCl NaCl NaCl NaCl
Gambar 16. SDS-PAGE enzim AI ekstrak kasar dan hasil purifikasi.
M=marker, T = total suspensi sel, CE = ekstrak kasar hasil freeze-thaw, HT=enzim AI CE yang telah di heat treatment dan 6, 15, 16, 35, 36, 50, 51, 52, 64, 65, 73, 74, 84 dan 85 = nomor fraksi hasil purifikasi kolom ion exchange, P=pellet ke-2, 0-1000 mM NaCl = garam pengelusi.
penukar ion tidak menunjukkan adanya aktivitas. Pengukuran aktivitas enzim AI dilakukan dengan mereaksikan enzim dan substrat galaktosa. AI akan merubah galaktosa menjadi tagatosa. Dengan adanya larutan karbazol sistein asam sulfat, maka tagatosa yang merupakan gula ketosa akan berwarna ungu. Semakin banyak tagatosa yang dibentuk maka aktivitas enzimatik AI berarti semakin tinggi. Semakin banyak tagatosa akan menyebabkan intensitas warna ungu semakin meningkat sehingga absorbansi pada panjang gelombang 560 nm juga akan semakin tinggi (Dische & Borenfreund 1951).
Putri (2010) melakukan penelitian tentang purifikasi enzim AI menggunakan kolom penukar ion dengan fase diam resin DEAE. Hasil yang diperoleh menunjukkan enzim AI terelusi pada konsentrasi 300 mM NaCl. Pada penelitian ini, fraksi 50, 51 dan 52 terelusi pada konsentrasi 300 mM NaCl.
Penentuan konsentrasi protein juga dianalisis dengan metode Bradford terhadap enzim ektrak kasar dan enzim hasil pemurnian, serta fraksi yang mewakili masing-masing elusi hasil pemurnian dengan kolom DEAE. Hal ini dilakukan untuk memastikan konsentrasi protein karena pada panjang gelombang
Gambar 17. Pengukuran aktivitas terhadap enzim ekstrak kasar dan fraksi
hasil kromatografi dengan kolom DEAE. 0 200 400 600 800 1000 1200 1400 A k ti v it a s e n zi m (U /m l)
280 nm keberadaan asam amino atau asam nukleat juga kemungkinan dapat terdeteksi oleh spektrofotometer (Gupta et al 2003).
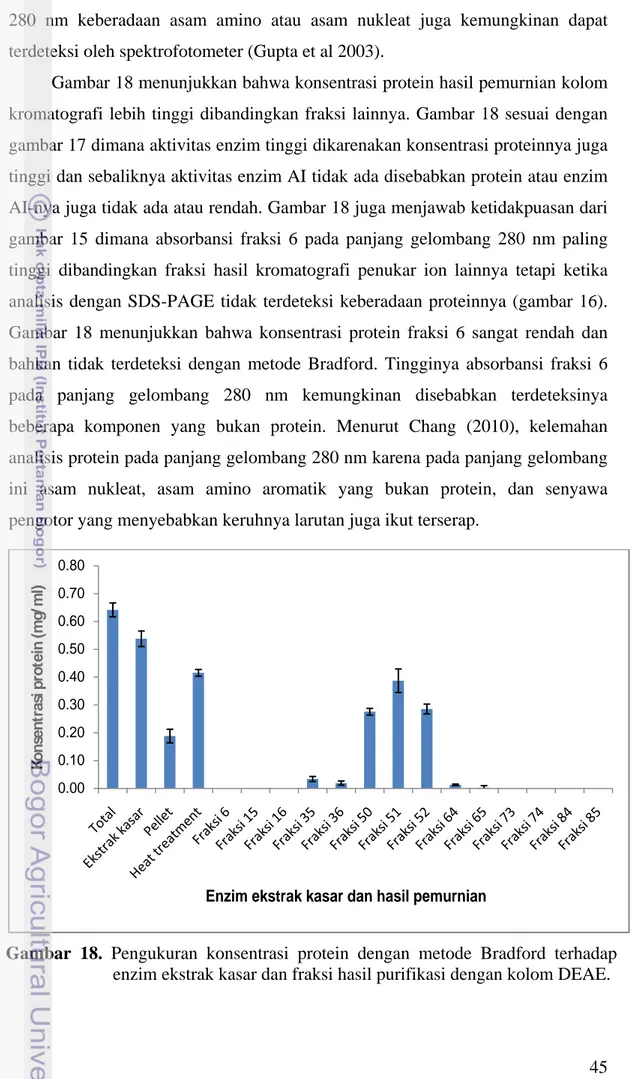
Gambar 18 menunjukkan bahwa konsentrasi protein hasil pemurnian kolom kromatografi lebih tinggi dibandingkan fraksi lainnya. Gambar 18 sesuai dengan gambar 17 dimana aktivitas enzim tinggi dikarenakan konsentrasi proteinnya juga tinggi dan sebaliknya aktivitas enzim AI tidak ada disebabkan protein atau enzim AI-nya juga tidak ada atau rendah. Gambar 18 juga menjawab ketidakpuasan dari gambar 15 dimana absorbansi fraksi 6 pada panjang gelombang 280 nm paling tinggi dibandingkan fraksi hasil kromatografi penukar ion lainnya tetapi ketika analisis dengan SDS-PAGE tidak terdeteksi keberadaan proteinnya (gambar 16). Gambar 18 menunjukkan bahwa konsentrasi protein fraksi 6 sangat rendah dan bahkan tidak terdeteksi dengan metode Bradford. Tingginya absorbansi fraksi 6 pada panjang gelombang 280 nm kemungkinan disebabkan terdeteksinya beberapa komponen yang bukan protein. Menurut Chang (2010), kelemahan analisis protein pada panjang gelombang 280 nm karena pada panjang gelombang ini asam nukleat, asam amino aromatik yang bukan protein, dan senyawa pengotor yang menyebabkan keruhnya larutan juga ikut terserap.
17
Gambar 18. Pengukuran konsentrasi protein dengan metode Bradford terhadap
enzim ekstrak kasar dan fraksi hasil purifikasi dengan kolom DEAE. 0.00 0.10 0.20 0.30 0.40 0.50 0.60 0.70 0.80 K o n se n tr a si p ro te in (m g /m l)
Tabel 7. Perhitungan konsentrasi protein (metode Bradford) dan aktivitas spesifik
yang diberikan Perlakuan Volume (ml) Protein (mg/ml) Total Protein (mg) Aktivitas (U/ml) Total aktivitas (U) Aktivitas spesifik (U/mg) Ekstrak kasar 24 2.58 61.9 1117 26814 433 Heat treatment 23 1.97 45.3 855 19677 434 Fraksi 50 2 1.27 2.55 440 881 345 Fraksi 51 2 1.83 3.66 517 1034 282 Fraksi 52 2 1.33 2.65 483 965 364
Tabel 7 menunjukkan aktivitas spesifik enzim AI murni pada fraksi 50, 51 dan 52 masing-masing secara berurutan adalah 345, 282 dan 364 U/mg. Aktivitas spesifik ini lebih rendah dibandingkan enzim kasar dan enzim hasil heat treatment. Penurunan aktivitas spesifik enzim setelah pemurnian kemungkinan disebabkan oleh pengukuran aktivitas enzim yang dilakukan pada masing-masing fraksi secara terpisah. Apabila fraksi yang telah disimpulkan mengandung enzim AI yaitu fraksi 49-56 kemudian digabungkan dan dihomogenkan serta dipekatkan, maka aktivitas spesifik enzim hasil pemurnian tersebut kemungkinan dapat meningkat. Pemekatan akan meningkatkan konsentrasi protein.
Berdasarkan pada grafik hasil purifikasi (gambar 15), SDS-PAGE (gambar 16), aktivitas enzim (gambar 17) dan konsentrasi protein (gambar 18) diatas, maka fraksi dengan nomor dan disekitar 50, 51 serta 52 dikoleksi untuk keperluan karakterisasi.
E. KARAKTERISASI
Aktivitas dan stabilitas enzim dipengaruhi oleh berbagai faktor, diantaranya adalah waktu penyimpanan, suhu, pH, logam dan senyawa-senyawa yang dapat menginaktifkan enzim. Aktivitas enzim merupakan karakter terpenting dari enzim. Aktivitas enzim dibawah pengaruh suhu tertentu dapat dinyatakan dengan aktivitas relatif atau aktivitas sisa. Aktivitas relatif adalah hasil bagi antara aktivitas enzim pada kondisi (suhu, pH dan waktu) tertentu dengan aktivitas enzim pada suhu optimum. Aktivitas sisa sering kali dinyatakan sebagai aktivitas enzim setelah mengalami pra-inkubasi (Gumulya 2004).
Menurut Suhartono (1989), konfigurasi struktur tersier enzim dipertahankan oleh ikatan sulfida, interaksi hidrofobik dan ikatan hidrogen. Struktur tersier ini secara keseluruhan berperan penting dalam membentuk ruang tiga dimensi pada tapak aktif, sehingga dengan adanya perubahan pada struktur ini dapat mengakibatkan terhambatnya pengikatan dan pengubahan substrat. Faktor-faktor yang dapat mempengaruhi struktur tersier dari enzim diantaranya adalah suhu, pH dan kekuatan ion.
1. Suhu Optimum
Pada umumnya semakin tinggi suhu semakin naik laju reaksi kimia, baik yang tidak dikatalisis maupun yang dikatalisis oleh enzim. Enzim adalah protein, jadi semakin tinggi suhu maka proses inaktivasi enzim juga semakin meningkat. Keduanya mempengaruhi laju enzimatik secara keseluruhan. Penentuan suhu optimum aktivitas enzim sangat diperlukan dalam penerapan suatu enzim.
Pada penelitian ini penentuan suhu optimum dilakukan pada suhu 50, 60, 70, 80 dan 90 ºC. Enzim AI murni dari lokal G. stearothermophilus adalah enzim yang bersifat termostabil. Suhu pertumbuhan ideal bakteri termofilik G. stearothermophilus berkisar antara 55-65ºC (Nazina et al 2001). Dasar lain pemilihan kisaran suhu-suhu tersebut karena beberapa penelitian yang telah dilakukan menunjukkan bahwa enzim AI dari genus yang sama memiliki suhu optimum 60-80ºC.
Gambar 19. Suhu optimum enzim murni AI dari strain lokal G. stearothermophilus
0 10 20 30 40 50 60 70 80 90 100 110 40 45 50 55 60 65 70 75 80 85 90 95 A k ti v it a s re la ti f (% ) Suhu (0C)
Suhu optimum enzim AI dari strain lokal G. stearothermophilus adalah 60ºC (gambar 19). Aktivitas enzim AI belum mencapai maksimum pada suhu 50ºC yakni hanya memiliki aktivitas relatif sebesar 70%. Pada suhu 70ºC, aktivitas relatif enzim AI adalah 80% dibandingkan aktivitas pada suhu optimum. Apabila suhu dinaikkan melebihi 70ºC, aktivitas enzim AI semakin menurun. Secara umum terdapat hubungan antara suhu dengan aktivitas maksimum dari enzim. Setiap enzim berfungsi secara optimum pada suhu tertentu. Mulai dari suhu rendah, aktivitas enzim bertambah dengan naiknya suhu sampai aktivitas optimumnya tercapai. Kenaikan suhu lebih lanjut berakibat berkurangnya aktivitas dan pada akhirnya terjadi denaturasi enzim (Nurdin 1989).
Meningkatnya aktivitas enzim hingga sampai suhu maksimum disebabkan oleh meningkatnya energi kinetik molekul-molekul enzim. Dengan demikian gerak vibrasi, rotasi enzim dan substrat dipercepat sehingga memperbesar peluang keduanya untuk bertumbukan dan bereaksi. Sebaliknya setelah melewati suhu optimum (60ºC), konformasi enzim mengalami perubahan sehingga tapak aktif tidak berfungsi sebagaimana mestinya. Pada suhu tinggi substrat juga mengalami perubahan konformasi, akibatnya mengalami kesulitan dalam memasuki dan mengenali enzim (Machielsen et al 2007).
Menurut Cheng et al (2009) suhu 60-65ºC merupakan suhu yang tepat untuk memproduksi tagatosa menggunakan enzim AI pada skala industri. Penggunaan suhu yang lebih tinggi atau = 80ºC akan mengawali terjadinya pengaruh yang tidak diinginkan seperti reaksi browning dan terbentuknya produk sampingan.
2. pH Optimum
Enzim mempunyai aktivitas maksimum pada suatu kisaran pH yang disebut pH optimum. Suatu enzim memiliki kisaran pH optimum yang sangat sempit. Apabila enzim berada pada kondisi pH lingkungan optimum, maka enzim akan mempunyai stabilitas yang tinggi. Pada penelitian ini kisaran pH yang digunakan adalah 5-9. Sebagian besar penelitian yang telah dilakukan sebelumnya menyatakan bahwa enzim AI mempunyai aktivitas maksimum pada pH netral atau
sedikit basa. AI yang berasal dari bakteri asam pun memiliki aktivitas maksimum pada kondisi mendekati pH netral (pH 6.5) (Lee et al 2005b).
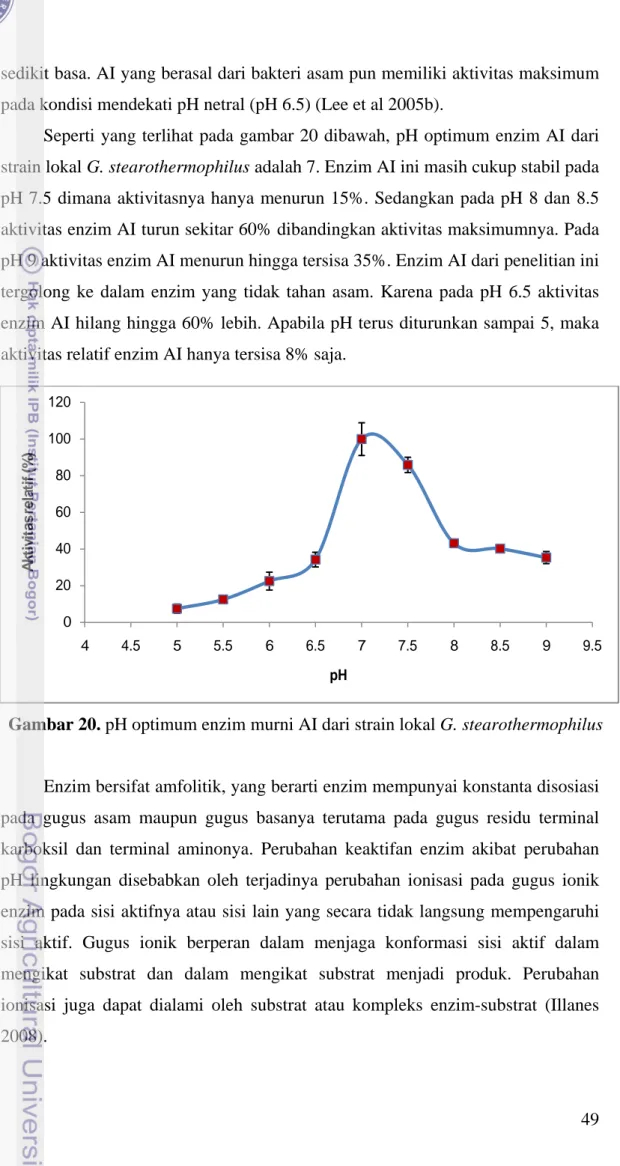
Seperti yang terlihat pada gambar 20 dibawah, pH optimum enzim AI dari strain lokal G. stearothermophilus adalah 7. Enzim AI ini masih cukup stabil pada pH 7.5 dimana aktivitasnya hanya menurun 15%. Sedangkan pada pH 8 dan 8.5 aktivitas enzim AI turun sekitar 60% dibandingkan aktivitas maksimumnya. Pada pH 9 aktivitas enzim AI menurun hingga tersisa 35%. Enzim AI dari penelitian ini tergolong ke dalam enzim yang tidak tahan asam. Karena pada pH 6.5 aktivitas enzim AI hilang hingga 60% lebih. Apabila pH terus diturunkan sampai 5, maka aktivitas relatif enzim AI hanya tersisa 8% saja.
Enzim bersifat amfolitik, yang berarti enzim mempunyai konstanta disosiasi pada gugus asam maupun gugus basanya terutama pada gugus residu terminal karboksil dan terminal aminonya. Perubahan keaktifan enzim akibat perubahan pH lingkungan disebabkan oleh terjadinya perubahan ionisasi pada gugus ionik enzim pada sisi aktifnya atau sisi lain yang secara tidak langsung mempengaruhi sisi aktif. Gugus ionik berperan dalam menjaga konformasi sisi aktif dalam mengikat substrat dan dalam mengikat substrat menjadi produk. Perubahan ionisasi juga dapat dialami oleh substrat atau kompleks enzim-substrat (Illanes 2008).
Gambar 20. pH optimum enzim murni AI dari strain lokal G. stearothermophilus
0 20 40 60 80 100 120 4 4.5 5 5.5 6 6.5 7 7.5 8 8.5 9 9.5 A k ti v it a s re la ti f (% ) pH
Suhu dan pH optimum enzim AI dari strain lokal berada pada kisaran suhu dan pH optimum enzim AI dari beberapa bakteri termofilik lainnya. Enzim AI dikodekan oleh gen yang sama yaitu araA. Similaritas gen araA strain lokal dengan beberapa bakteri termofilik lainnya sangat tinggi ( > 95%) (Fitriani & Saksono 2010), sehingga kisaran suhu dan pH optimum enzim AI dari strain lokal ini dapat diterima. Dari karakteristik suhu dan pH optimum enzim AI diketahui bahwa meskipun berasal dari jenis, genus dan spesies yang sama bahkan dikodekan oleh gen yang sama, karakteristik yang diberikan oleh enzim AI tidak ada yang 100% sama. Masing-masing mempunyai karakter yang berbeda apabila sumber isolasi bakteri berbeda.
Tabel 8. Karakteristik suhu dan pH optimum enzim AI dari beberapa bakteri
termofilik
Nama bakteri Suhu
optimum
pH
optimum Referensi
G. stearothermophilus lokal 60ºC 7 Penelitian ini
G. stearothermophilus T6 70ºC 7.5 Lee et al 2005a
B. stearothermophilus US100 80ºC 7.5 Rhimi & Bejar 2006
A. acidocaldarius 65ºC 6-6.5 Lee et al 2005b
Thermus sp. 60ºC 8 Kim et al 2003
B. stearothermophilus IAM11001 65ºC 7.5 Cheng et al 2009
G. thermodentrificans 70ºC 8.5 Kim & Oh 2005
Tabel 5 menunjukkan bahwa kisaran suhu optimum enzim AI dari beberapa bakteri termofilik yang telah diteliti adalah 60-80ºC. Sedangkan pH optimumnya berkisar antara 6-8.5. Enzim AI dari beberapa bakteri termofilik yang telah diteliti tidak ada yang menunjukkan karakteristik suhu dan pH optimum yang sama. Dari tabel 5 diketahui bahwa meskipun enzim AI dihasilkan oleh gen yang sama (gen araA), namun genus, spesies, strain ataupun tempat isolasi bakteri yang berbeda dapat memberikan karakteristik yang berbeda pula.
3. Pengaruh Logam
Penelitian pengaruh ion logam terhadap aktivitas enzim AI dilakukan menggunakan logam yang diperkiran adalah logam aktivator atau yang dapat meningkatkan aktivitas enzim. Enzim AI dari berbagai jenis bakteri sangat membutuhkan logam Mn2+ dan Co2+ untuk meningkatkan aktivitasnya dan
mempertahankan stabilitasnya. Dalam penelitian ini logam yang diujikan adalah logam Mn2+
. Logam Co2+ tidak diujikan karena diharapkan enzim AI nantinya akan digunakan untuk memproduksi tagatosa yang aplikasinya pada produk pangan ataupun aplikasi oral (suplemen dan obat). Logam Co2+ termasuk logam berat yang berbahaya terhadap kesehatan. Logam lain yang digunakan adalah kalsium (Ca), besi (Fe) dan magnesium (Mg). Pemilihan logam-logam ini karena diketahui ada enzim AI dari beberapa bakteri yang aktivitasnya ditingkatkan oleh logam-logam tersebut. Meskipun juga ada aktivitas enzim AI yang tidak dipengaruhi atau bahkan dihambatnya.
Percobaan awal menunjukkan bahwa logam Ca dan Mn meningkatkan aktivitas enzim AI, logam Mg tidak mempengaruhi aktivitas enzim, sedangkan logam Fe menghambat enzim (data tidak ditampilkan). Oleh sebab itu, pada penelitian ini logam yang diujikan adalah Ca dan Mn. Penambahan masing-masing logam adalah sebesar 1 dan 5 mM.
Konsentrasi 1 mM logam Co dan Mn sudah dapat meningkatkan aktivitas enzim AI (Rhimi & Bejar 2005; Lee et al 2004). Penelitian Cheng et al (2009) menunjukkan konsentrasi optimum ion logam Mn2+ terhadap aktivitas enzim AI asal B. stearothermophilus IAM11001 adalah 1 mM. Penelitian Kim & Oh (2005) menunjukkan konsentrasi optimum ion logam Mn2+ terhadap aktivitas enzim AI asal G. thermodenitrificans adalah 5 mM, jika konsentrasi ditingkatkan hingga 10 mM aktivitas enzimnya menurun. Kebanyakan penelitian-penelitain tersebut diatas dilakukan dengan memberikan perlakuan kelating menggunakan senyawa EDTA terhadap enzimnya. Enzim AI dari strain lokal pada penelitian ini tidak diberi perlakuan kelating dengan EDTA sebelum diuji aktivitasnya. Penambahan ion logam dilakukan secara langsung pada enzim murni hasil kromatografi penukar ion.
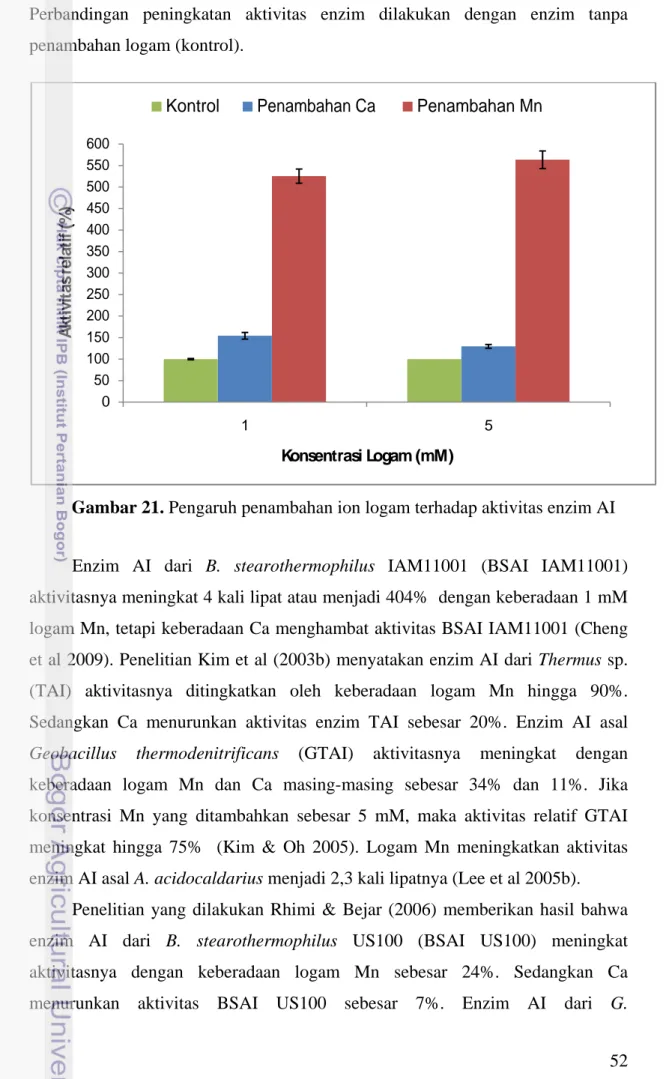
Gambar 21 menunjukkan bahwa aktivitas enzim AI sangat membutuhkan logam Mn untuk meningkatkan aktivitasnya. Logam Mn meningkatkan aktivitas enzim AI dari G. stearothermophilus lokal hingga 525% pada konsentrasi 1 mM dan 560% pada konsentrasi 5 mM. Logam Ca meningkatkan aktivitas enzim sebesar 54% pada konsentrasi 1 mM dan 30% pada konsentrasi 5 mM.
Perbandingan peningkatan aktivitas enzim dilakukan dengan enzim tanpa penambahan logam (kontrol).
Enzim AI dari B. stearothermophilus IAM11001 (BSAI IAM11001) aktivitasnya meningkat 4 kali lipat atau menjadi 404% dengan keberadaan 1 mM logam Mn, tetapi keberadaan Ca menghambat aktivitas BSAI IAM11001 (Cheng et al 2009). Penelitian Kim et al (2003b) menyatakan enzim AI dari Thermus sp. (TAI) aktivitasnya ditingkatkan oleh keberadaan logam Mn hingga 90%. Sedangkan Ca menurunkan aktivitas enzim TAI sebesar 20%. Enzim AI asal Geobacillus thermodenitrificans (GTAI) aktivitasnya meningkat dengan keberadaan logam Mn dan Ca masing-masing sebesar 34% dan 11%. Jika konsentrasi Mn yang ditambahkan sebesar 5 mM, maka aktivitas relatif GTAI meningkat hingga 75% (Kim & Oh 2005). Logam Mn meningkatkan aktivitas enzim AI asal A. acidocaldarius menjadi 2,3 kali lipatnya (Lee et al 2005b).
Penelitian yang dilakukan Rhimi & Bejar (2006) memberikan hasil bahwa enzim AI dari B. stearothermophilus US100 (BSAI US100) meningkat aktivitasnya dengan keberadaan logam Mn sebesar 24%. Sedangkan Ca menurunkan aktivitas BSAI US100 sebesar 7%. Enzim AI dari G.
Gambar 21. Pengaruh penambahan ion logam terhadap aktivitas enzim AI
0 50 100 150 200 250 300 350 400 450 500 550 600 1 5 A k ti v it a s re la ti f (% ) Konsentrasi Logam (mM)
stearothermophilus T6 membutuhkan logam Mn dan Ca untuk meningkatkan aktivitasnya. Aktivitas relatif enzim AI dari bakteri G. stearothermophilus T6 meningkat 75% dan 49% masing-masing secara berurutan dengan keberadaan logam Mn dan Ca (Lee et al 2005a).
Menurut Illanes (2008), sebagian besar enzim membutuhkan ion logam (kofaktor) untuk meningkatkan aktivitasnya. Peningkatan aktivitas dengan keberadaan ion logam karena logam akan berikatan pada sisi aktif enzim dan meningkatkan kekuatan ion enzim. Dengan peningkatan kekuatan ion pada konformasi sisi aktif enzim, maka enzim akan lebih cenderung kuat mengikat substrat dan reaksi katalisisnya menjadi lebih cepat. Ion logam biasanya akan terikat kuat pada struktur enzim sehingga tidak terlepas dari enzim selama reaksi enzimatis berlangsung.
4. Stabilitas Panas
Stabilitas enzim merupakan faktor penting pada aplikasi komersial terutama dengan jangka waktu yang lama dalam biokonservasi enzimatik. Untuk mengetahui stabilitas panas enzim AI dari G. stearothermophilus strain lokal, maka enzim diuji pada suhu 65ºC tanpa logam serta dengan keberadaan logam Mn dan Ca . Pemilihan suhu 65ºC karena produksi tagatosa menggunakan enzim AI yang direkomendasikan untuk aplikasi skala industri adalah suhu 60-65ºC (Cheng et al 2009).
Pada gambar 22 terlihat bahwa semakin lama waktu inkubasi, maka stabilitas enzim AI semakin menurun. Inkubasi pada suhu 65ºC hingga 150 menit menurunkan aktivitas enzim AI murni sekitar 57%. Penambahan logam Ca dan Mn meningkatkan kestabilan enzim. Aktivitas enzim AI menurun 30% selama 150 menit inkubasi pada suhu 65ºC dengan keberadaan logam Ca. Sedangkan dengan keberadaan logam Mn, aktivitas enzim AI hanya menurun 9%.
Pada penelitian Cheng et al (2009), native enzim AI dari B. stearothermophilus IAM11001 aktivitasnya menurun 50% setelah diinkubasi selama 1 jam. Tetapi dengan keberadaan logam Mn, aktivitas enzim AI stabil hingga 2 jam inkubasi. Cheng et al (2009) menyatakan bahwa BSAI IAM11001 sebagai enzim termostabil.
Tanpa keberadaan logam, aktivitas enzim AI dari B. stearothermophilus US100 menurun 50% setelah diinkubasi 2 jam pada suhu 70ºC. Pengujian pada kondisi diatas suhu optimumnya (80ºC), aktivitas BSAI US100 menurun hingga 90% dalam waktu 30 menit. Dengan keberadaan logam Mn, aktivitas BSAI US100 turun 60% setelah diinkubasi 2 jam pada suhu 80ºC (Rhimi & Bejar 2006). Penelitian Kim & Oh (2005) menunjukkan bahwa tanpa logam pada suhu optimumnya, aktivitas enzim AI dari G. thermodenitrificans (GTAI) tersisa 65% setelah 2 jam. Sedangkan dengan adanya logam Mn, aktivitasnya masih tersisa 80% setelah 2 jam inkubasi. Pada kondisi diatas suhu optimumnya (80ºC), aktivitas GTAI hilang setelah 50 menit jika tidak ada logam. Dan dengan keberadaan Mn, aktivitas GTAI turun 50% setelah 50 menit pada suhu 80ºC.
Stabilitas enzim dipertahankan oleh adanya ikatan hidrogen antara H, O, N dan S dari molekul-molekul asam amino penyusunnya, ikatan van der waals, interaksi hidrofobik dan gaya elektrostatik dari muatan-muatan yang dimiliki oleh molekul protein itu sendiri. Menurut Illanes (2008), stabilitas termal molekul enzim tergantung pada beberapa faktor antara lain substrat, inhibitor, molekul protein lain, ion logam dan molekul polimer. Beberapa jenis enzim memerlukan
Gambar 22. Stabilitas enzim AI pada suhu 65ºC tanpa dan dengan keberadaan
logam Pengaruh ion logam 0 20 40 60 80 100 120 0 30 60 90 120 150 180 A k ti v it a s si sa (% )
Lama Inkubasi (menit)
ion logam tertentu untuk menjaga aktivitasnya. Ion logam dapat terikat pada jembatan disulfida dari enzim sehingga mempertahankan struktur enzim dan menstabilkan enzim terhadap denaturasi oleh panas. Logam Mn lebih baik dalam menjaga stabilitas panas GSAI lokal dibandingkan logam Ca kemungkianan disebabkan karena logam Mn lebih kuat dan stabil selama berikatan dengan enzim.
5. Pendugaan waktu paruh (t
1/2) enzim
Konstanta laju deaktivasi enzim (k) dapat ditentukan dari hubungan ln aktivitas enzim terhadap waktu inkubasi (pemanasan) pada suhu tertentu. Slope persamaan linier hubungan ln aktivitas enzim terhadap waktu inkubasi dinyatakan sebagai nilai k. Nilai k enzim AI tanpa logam pada suhu 65ºC adalah 0.0051/menit (gambar 24). Semakin tinggi suhu maka konsanta deaktivasi enzim biasanya semakin tinggi.
Waktu paruh enzim murni pada suhu 65ºC diperoleh dari penurunan rumus kinetika deaktivasi enzim (pada metodologi, persamaan 3). Dari persamaan tersebut diperoleh nilai t1/2 enzim AI tanpa logam pada suhu 65ºC adalah 136 menit. Artinya pemanasan pada suhu 65ºC dengan lama waktu inkubasi 136 menit, aktivitas GSAI strain lokal tinggal setengahnya. Penelitian Kim & Oh
Gambar 23. Hubungan ln aktivitas enzim tanpa logam terhadap waktu inkubasi pada
suhu 65ºC y = -0.0051x + 13.0433 0 2 4 6 8 10 12 14 0 30 60 90 120 150 Ln a k ti v it a s (U /L )
(2005) menunjukkan GTAI memiliki waktu paruh 203 menit pada suhu optimumnya. Nilai t
1/2 GSAI dari penelitian Kim et al (2003a) adalah 72, 14 dan 2.4 menit masing-masing pada suhu 65, 70 dan 80 ºC. BSAI US100 tanpa logam pada suhu 70, 75 dan 80 memiliki t1/2 masing-masing 90, 60 dan 10 menit (Rhimi & Bejar 2006).
Keberadaan logam Ca menurunkan nilai k dari enzim. Nilai k enzim dengan keberadaan logam Ca pada suhu 65ºC menjadi 0.0023/menit. Nilai t1/2 enzim GSAI strain lokal dengan keberadan logam Ca menjadi 301 menit pada suhu 65 ºC. Hubungan ln aktivitas AI terhadap waktu inkubasi dengan keberadaan logam Ca dapat dilihat pada gambar 24.
Dengan adanya logam Mn, nilai k enzim AI semakin kecil dibandingkan dengan keberadaan logam Ca dan tanpa logam. Hal ini menunjukkan bahwa kinetika deaktifasi enzim semakin lambat. Nilai k enzim AI dengan keberadaan logam Mn adalah 0.0007/menit pada suhu 65ºC. Perhitungan waktu paruh (t1/2) enzim AI dengan keberadaan logam Mn memberikan nilai sebesar 990 menit atau 16.5 jam pada suhu 65ºC. Gambar 25 memperlihatkan hubungan ln aktivitas enzim terhadap lama inkubasi dengan keberadaan logam Mn.
Gambar 24. Hubungan ln aktivitas enzim dengan penambahan logam Ca
terhadap waktu inkubasi pada suhu 65 0C
y = -0.0023x + 13.0157 0 2 4 6 8 10 12 14 0 30 60 90 120 150 Ln a k ti v it a s (U /L )
Lama Inkubasi (menit) Dengan logam Ca
Enzim AI dari G. thermodenitrificans dengan keberadaan logam Mn memiliki nilai t1/2 366 menit pada suhu optimumnya (70ºC) dan 41.7 menit pada
suhu 75ºC (Kim & Oh 2005). Penelitian Rhimi & Bejar (2006) menyatakan nilai t1/2 enzim BSAI US100 dengan keberadaan logam pada suhu 75 dan 80 ºC masing-masing adalah sebesar 110 menit dan 18 menit. Kim (2004) menyatakan bahwa salah satu strategi peningkatan produksi tagatosa menggunakan enzim AI adalah mencari enzim dengan waktu paruh yang lama.
Gambar 25. Hubungan ln aktivitas enzim dengan penambahan logam Mn
terhadap waktu inkubasi pada suhu 65 0C
y = -0.0007x + 13.2879 0 2 4 6 8 10 12 14 0 30 60 90 120 150 Ln a k ti v it a s (U /L )
Lama Inkubasi (menit) Dengan logam Mn