LAPORAN RESMI
PRAKTIKUM PROSES KIMIA
Materi :
ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
Disusun oleh:
Ainun Khoiriyah 21030111120037
Anisa Dien R 21030111110154
Zulhaq Dahri S 21030111130136
LABORATORIUM PROSES KIMIA
TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO
SEMARANG
LABORATORIUM PROSES KIMIA 2013 i HALAMAN PENGESAHAN
Laporan Resmi Praktikum Proses Kimia berjudul Absorbsi Gas Karbon Dioksida dengan Larutan NaOH yang disusun oleh
Kelompok : 5/Senin
Anggota : 1. Ainun Khoiriyah (21030111120037)
2. Anisa Dien R. (21030111110154) 3. Zulhaq Dahri S. (21030111130136) ini telah disahkan pada :
Tanggal :
Di :
Semarang, Desember 2013
Dosen Pembimbing Asisten Pembimbing
Dr. Andri Cahyo Kumoro, S.T, M.T, PhD Inggit Prillasari
LABORATORIUM PROSES KIMIA 2013 ii
INTISARI
Absorbsi merupakan salah satu proses separasi dalam industri kimia dimana suatu campuran gas saling kontak dengan suhu cairan penyerap tertentu sehingga satu atau lebih komponen gas tersebut larut dalam cairannya. Percobaan absorbsi CO2 dengan NaOH bertujuan untuk mempelajari
pengaruh konsentrasi terhadap jumlah CO2 terserap, menentukan besar koefisien perpindahan massa
pada proses absorbsi, dan menentukan waktu terhadap proses absorbsi. Pada percobaan ini, variabel tetapnya adalah konsentrasi NaOH yaitu 0,15 N, beda waktu pengambilan sampel, yaitu 1 menit dengan variabel berubahnya adalah laju alir NaOH ( 75 ml/menit; 150 ml/menit; 225 ml/menit ). Percobaan ini diawali dengan membuat larutan NaOH 0,15 N. Kemudian mencari laju alir yang sesuai, dilanjutkan proses berikutnya yaitu proses absorbsi yaitu NaOH dipompa dan diumpankan pada bagian atas menara pada laju alir 75 ml/menit;150 ml/menit; 225 ml/menit, dan gas CO2
dipompa melalui bagian bawah absorber. Larutan NaOH dan CO2 dibiarkan saling kontak. Sebanyak
10 ml sampel diambil dari bagian dasar menara dengan interval 1 menit dan dianalisis kadar CO3
2-dengan cara titrasi acidi alkalimetri. Dari hasi percobaan didapat bahwa semakin besar laju alir NaOH maka semakin banyak CO2 yang terserap, dikarenakan semakin banyak molekul NaOH, CO2
pun akan semakin banyak terserap. Semakin besar laju alir NaOH maka nilai Kga, KLa juga semakin besar. Nilai k2 juga semakin besar seiring dengan meningkatnya nilai laju alir NaOH dikarenakan
semakin besar faktor tumbukan yang terjadi. Kesimpulan dari percobaan ini adalah semakin besar laju alir NaOH maka nilai Kga, KLa, k2,dan CO2 yang terserap makin besar. Saran yang dapat
diberikan antara lain larutan NaOH dialirkan sampai overflow sebelum dikontakkan dengan CO2, dan
laju alir CO2 sebaiknya dijaga agar tidak terlalu besar sehingga pengeluaran CO2 dapat
LABORATORIUM PROSES KIMIA 2013 iii
SUMMARY
Absorption is a separation processes in the chemical industry where a gas mixture of mutual contacts with specific absorbent liquid temperature so that one or more components of the gas dissolved in the liquid. CO2 Absorption experiments aimed to study the effect of NaOH concentration
on the amount of CO2 absorbed, determine the coefficient of mass transfer on the absorption process,
and determine the time of the absorption process. In this experiment, the variable is a fixed concentration of NaOH is 0,15 N, different sampling time, which is 1 minute, the studied variables is the flow rate of NaOH (75 ml/menit; 150ml/menit; 225ml/menit). This experiment began with a solution of NaOH according to the variable (V NaOH= 10 liters). Then is the process of absorption, the NaOH solution pumped and fed to the top of the tower with a flow rate of 100 L/min, and CO2 gas
was delivered using a compressor through the bottom of the absorber. NaOH solution and CO2
allowed contact with each other. A total of 10 ml sample is taken from the base of the tower with a 1-minute intervals and analyzed levels of CO3
2-titration by acidi-alkalimetry. From the experimental results obtained that the greater the flow rate of NaOH, the more CO2 is absorbed, because the more
molecules NaOH, CO2 will be more and more absorbed. The greater the flow rate of NaOH, the value
kLa, kGa and k2 will be higher. Number of K2 will increase with increase of NaOH flow rate because
the number of slam factor is higher. The conclusions of this experiment is the greater flow rate of NaOH, the value of Kga, KLa, k2 and the smaller CO2 absorbed. Advice given acquired include NaOH
solution flows to overflow before It is contacted with CO2, and CO2 flow rate should be maintained so
LABORATORIUM PROSES KIMIA 2013 iv
PRAKATA
Puji syukur kepada Tuhan yang Maha Esa atas segala rahmat dan karunia-Nya sehingga penyusunan laporan resmi Praktikum Proses Kimia materi “Absorbsi Gas Karbon Dioksida dengan Larutan NaOH” ini dapat terselesaikan dengan baik.
Penyusunan laporan resmi ini ditujukan sebagai salah satu syarat untuk melengkapi mata kuliah Praktikum Proses Kimia yang telah diberikan pada semester V.
Pada kesempatan ini, penyusun menyampaikan ucapan terima kasih kepada:
1. Dr. Andri Cahyo Kumoro, S.T, M.T, PhD selaku dosen pembimbing Praktikum Proses Kimia materi Hidrodinamika Reaktor.
2. Inggit Prillasari selaku asisten Praktikum Proses Kimia pengampu materi Hidrodinamika Reaktor yang telah membantu dan membimbing selama praktikum.
3. Segenap laboran Praktikum Proses Kimia yang telah membantu kelancaran pelaksanaan praktikum.
4. Semua pihak yang telah mendukung tersusunnya laporan ini.
Penyusun menyadari bahwa masih banyak kekurangan dalam laporan resmi ini. Oleh karena itu, penyusun mengharap kritik dan saran yang dianggap akan memperbaiki laporan resmi ini.
Semoga laporan resmi Praktikum Proses Kimia materi Absorbsi Gas CO2 dengan
Larutan NaOH ini dapat berguna dan bermanfaat bagi para pembaca.
Semarang, Desember 2013
LABORATORIUM PROSES KIMIA 2013 v
DAFTAR ISI
HALAMAN PENGESAHAN ... i RINGKASAN ... ii SUMMARY ... iii PRAKATA ... Iv DAFTAR ISI ... vDAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 2
1.3 Tujuan Percobaan ... 2
1.4 Manfaat Percobaan ... 2
BAB II TINJAUAN PUSTAKA 2.1 Absorbsi ... 4
2.2 Analisis Perpindahan Massa dan Reaksi dalam Proses Absorbsi Gas Oleh Cairan ... 5
BAB III PELAKSANAAN PERCOBAAN 3.1 Bahan dan Alat yang Digunakan ... 9
3.2 Gambar Alat ... 9
3.3 Variabel Operasi ... 10
3.4 Respon Uji Hasil ... 10
3.5 Prosedur Percobaan ... 10
BAB IV PEMBAHASAN 4.1 Profil perubahan konsentrasi CO2 pada berbagai laju alir NaOH dan waktu ... 12
4.2 Pengaruh Konsentrasi NaOH terhadap Nilai kGa ... 13
4.3 Pengaruh Konsentrasi NaOH terhadap Nilai kLa... 13
4.4 Pengaruh Konsentrasi NaOH terhadap Nilai k2 ... 14
4.5 Hubungan CO2 yang Terserap terhadap Waktu ... 15
BAB V PENUTUP 5.1 Kesimpulan ... 17
LABORATORIUM PROSES KIMIA 2013 vi 5.2 Saran ... 17 DAFTAR PUSTAKA ... 18 LEMBAR PERHITUNGAN ... 20 LAPORAN SEMENTARA LEMBAR ASISTENSI
LABORATORIUM PROSES KIMIA 2013 vii
DAFTAR TABEL
Tabel 4.1 Hasil Percobaan jumlah CO2 dengan Variabel Laju Alir NaOH ... 12
LABORATORIUM PROSES KIMIA 2013 viii
DAFTAR GAMBAR
Gambar 2.1 Proses Absorbsi dan Desorbsi CO2 dengan Pelarut MEA di Pabrik Amonia ... .4
Gambar 2.2 Mekanisme Absorbsi gas CO2 dalam Larutan NaOH ... .5
Gambar 3.1 Gambar Rangkaian Alat Absorbsi ... .9
Gambar 4.1 Pengaruh Konsentrasi NaOH terhadap Nilai kGa ... .13
Gambar 4.2 Pengaruh Konsentrasi NaOH terhadap Nilai kLa ... .13
Gambar 4.3 Pengaruh Konsentrasi NaOH terhadap Nilai k2... .14
LABORATORIUM PROSES KIMIA 2013 1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Hampir semua reaksi kimia yang diterapkan dalam industri kimia melibatkan bahan baku yang berbeda wujudnya, baik berupa padatan, gas maupun cairan. Oleh karena itu, reaksi kimia dalam suatu industri dapat terjadi dalam fase ganda atau heterogen, misalnya biner atau bahkan tersier (Coulson, 1996). Walaupun terdapat perbedaan wujud pada bahan-bahan baku yang direaksikan, namun terdapat satu fenomena yang selalu terjadi sebelum reaksi kimia berlangsung. Maka salah satu atau lebih bahan baku (reaktan) akan berpindah dari aliran utamanya menuju ke lapisan antarfase/batas atau menuju aliran utama bahan baku yang lain yang berada di fase yang berbeda.
Absorpsi gas-cair merupakan proses heterogen yang melibatkan perpindahan komponen gas yang dapat larut menuju penyerap yang biasanya berupa cairan yang tidak mudah menguap (Franks, 1967). Reaksi kimia dalam proses absorpsi dapat terjadi di lapisan gas, lapisan antarfase, lapisan cairan atau bahkan badan utama cairan, tergantung pada konsentrasi dan reaktifitas bahan-bahan yang direaksikan. Untuk memfasilitasi berlangsungnya tahapan-tahapan proses tersebut, biasanya proses absorpsi dijalankan dalam reactor tangki berpengaduk bersparger, kolomg elembung (bubble column) atau kolom yang berisi tumpukan partikel inert (packed bed column). Proses absorpsi gas-cair dapat diterapkan pada pemurnian gas sintesis, recovery beberapa gas yang masih bermanfaat dalam gas buang atau bahkan pada industri yang melibatkan pelarutan gas dalam cairan, seperti H2SO4, HCl, HNO3, formadehid dll (Coulson, 1996). Absorpsi gas
CO2 dengan larutan hidroksid yang kuat merupakan proses absorpsi yang disertai dengan
reaksi kimia order 2 antara CO2 dan ion OH-membentuk ion CO32- dan H2O. Sedangkan
reaksi antara CO2 dengan CO32- membentuk ion HCO3- biasanya diabaikan (Danckwerts,
1970; Juvekar dan Sharma, 1972). Namun, menurut Rehmet et al. (1963) proses ini juga biasa dianggap mengikuti reaksi order 1 jika konsentrasi larutan NaOH cukup rendah (encer).
LABORATORIUM PROSES KIMIA 2013 2 Perancangan reaktor kimia dilakukan berdasarkan pada permodelan hidrodinamika reaktor dan reaksi kimia yang terjadi di dalamnya. Suatu model matematika merupakan bentuk penyederhanaan dari proses sesungguhnya di dalam sebuah reaktor yang biasanya sangat rumit (Levenspiel, 1972). Reaksi kimia biasanya dikaji dalam suatu proses batch berskala laboratorium dengan mempertimbangkan kebutuhan reaktan, kemudahan pengendalian reaksi, peralatan, kemudahan menjalankan reaksi dan analisis, dan ketelitian.
1.2 Perumusan Masalah
1. Bagaimana pengaruh laju alir NaOH terhadap jumlah CO2 yang terserap pada
berbagai waktu reaksi ?
2. Bagaimana pengaruh laju alir NaOH terhadap nilai tetapan perpindahan massa-gas CO2 (kGa) ?
3. Bagaimana pengaruh laju alir NaOH terhadap nilai tetapan perpindahan massa-cair CO2 (kLa) ?
4. Bagaimana pengaruh laju alir NaOH terhadap nilai tetapan reaksi antara CO2 dan
NaOH (k2) ?
5. Bagaimana hubungan CO2 yang terserap terhadap waktu ?
1.3 Tujuan Percobaan
Setelah melakukan percobaan ini, mahasiswa mampu menjelaskan mengenai beberapa hal berikut:
1. Pengaruh laju alir NaOH terhadap jumlah CO2 yang terserap pada berbagai waktu
reaksi.
2. Pengaruh laju alir NaOH terhadap nilai tetapan perpindahan massa-gas CO2 (kGa).
3. Pengaruh laju alir NaOH terhadap nilai tetapan perpindahan massa-cair CO2 (kLa).
4. Pengaruh laju alir NaOH terhadap nilai tetapan reaksi antara CO2 dan NaOH (k2).
5. Hubungan CO2 yang terserap terhadap waktu
1.4 Manfaat Percobaan
1. Mengetahui pengaruh laju alir NaOH terhadap jumlah CO2 yang terserap pada
berbagai waktu reaksi.
2. Mengetahui pengaruh laju alir NaOH terhadap nilai tetapan perpindahan massa CO2
LABORATORIUM PROSES KIMIA 2013 3 3. Mengetahui pengaruh laju alir NaOH terhadap nilai tetapan reaksi antara CO2 dan
NaOH (k2).
LABORATORIUM PROSES KIMIA 2013 4
BAB II
LANDASAN TEORI
2.1 Absorbsi
Absorbsi merupakan salah satu proses separasi dalam industri kimia dimana suatu campuran gas dikontakkan dengan suatu cairan penyerap tertentu sehingga satu atau lebih komponen gas tersebut larut dalam cairannya. Absorbsi dapat terjadi melalui dua mekanisme, yaitu absorbsi fisik dan absorbsi kimia.
Absorbsi fisik merupakan suatu proses yang melibatkan peristiwa pelarutan gas dalam larutan penyerap, namun tidak disertai dengan reaksi kimia. Contoh proses ini adalah absorbsi gas H2S dengan air, methanol, propilen karbonase. Penyerapan terjadi
karena adanya interaksi fisik. Mekanisme proses absorbsi fisik dapat dijelaskan dengan beberapa model, yaitu: teori dua lapisan (two films theory) oleh Whiteman (1923), teori penetrasi oleh Dankcwerts dan teori permukaan terbaharui.
Absorbsi kimia merupakan suatu proses yang melibatkan peristiwa pelarutan gas dalam larutan penyerap yang disertai dengan reaksi kimia. Contoh peristiwa ini adalah absorbsi gas CO2 dengan larutan MEA, NaOH, K2CO3 dan sebagainya. Aplikasi dari
absorbsi kimia dapat dijumpai pada proses penyerapan gas CO2 pada pabrik Amonia
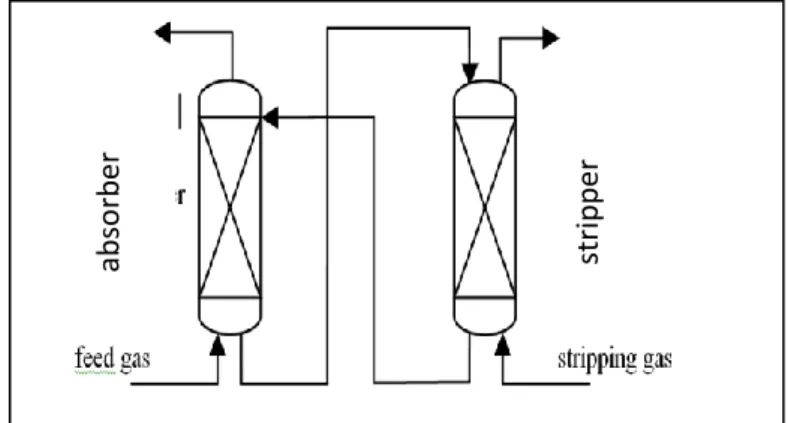
seperti yang terlihat pada gambar 2.1
Gambar 2.1.Proses absorpsi dan desorpsi CO2 dengan pelarut MEA di pabrik Amonia
Proses absorpsi dapat dilakukan dalam tangki berpengaduk yang dilengkapi dengan sparger, kolom gelembung (bubble column), atau dengan kolom yang berisi packing yang inert (packed column) atau piringan (tray column). Pemilihan peralatan
ab so rb er strip p er
LABORATORIUM PROSES KIMIA 2013 5 proses absorpsi biasanya didasarkan pada reaktifitas reaktan (gas dan cairan), suhu, tekanan, kapasitas, dan ekonomi.
2.2 Analisis Perpindahan Massa dan Reaksi dalam Proses Absorpsi Gas oleh Cairan
Secara umum, proses absorbsi gas CO2 kedalam larutan NaOH yang disertai
reaksi kimia berlangsung melalui empat tahap, yaitu perpindahan massa CO2 melalui
lapisan gas menuju lapisan antarfase gas-cairan, kesetimbangan antara CO2 dalam fase
gas dan dalam fase larutan, perpindahan massa CO2 dari lapisan gas kebadan utama
larutan NaOH dan reaksi antara CO2 terlarut dengan gugus hidroksil (OH-). Skema proses
tersebut dapat dilihat pada Gambar 2.2.
Gambar 2.2.Mekanisme absorpsi gas CO2 dalam larutan NaOH
Laju perpindahan massa CO2 melalui lapisan gas:
Ra = Kga ( pg – pai ) (1)
Kesetimbangan antara CO2 dalam fase gas dan dalam fase larutan :
pai H
A* . (2)
dengan H pada suhu 30oC = 2,88 10-5 g mole/cm3. atm.
Laju perpindahan massa CO2 dari lapisan gas ke badan utama larutan NaOH dan reaksi
antara CO2 terlarut dengan gugus hidroksil:
] .[ . *] [ 2 A a D k OH Ra A (3)
Gas bulk flow
pg
pai
A*
Liq. bulk flow Gas film Liq. film
LABORATORIUM PROSES KIMIA 2013 6 Keadaan batas: (a) . 2.[ ] 1 L A k OH k D (b) B A L A D D A z OH k OH k D * . ] [ ] .[ . 2
dengan z adalah koefisien reaksi kimia antara CO2 dan [OH-}, yaitu = 2.
Di fase cair, reaksi antara CO2 dengan larutan NaOH terjadi melalui beberapa tahapan
proses: NaOH (s) Na+ (l) + OH- (l) (a) CO2 (g) CO2 (l) (b) CO2 (l) + OH- (l) HCO3- (l) (c) HCO3- (l) + OH- (l) H2O (l) + CO32- (l) (d) CO32- (l) + Na+ (l) Na2CO3(l) (e)
Langkah d dan e biasanya berlangsung dengan sangat cepat, sehingga proses absorpsi biasanya dikendalikan oleh peristiwa pelarutan CO2 ke dalam larutan NaOH terutama jika
CO2 diumpankan dalam bentuk campuran dengan gas lain atau dikendalikan
bersama-sama dengan reaksi kimia pada langkah c (Juvekar dan Sharma, 1973). Eliminasi A* dari persamaan 1, 2 dan 3 menghasilkan :
Ga A A k OH k D H a OH k D pg H a Ra ] .[ . . . 1 ] .[ . . . . 2 2 (4)
Jika nilai kL sangat besar, maka: 1
] .[ . 2 L A k OH k D
, sehingga persamaan di atas
menjadi: Ga L A L A k k OH k D H a k OH k D pg H a Ra 2 2 2 2 ] .[ . . . 1 ] .[ . . . . (5)
LABORATORIUM PROSES KIMIA 2013 7 Jika keadaan batas (b) tidak dipenuhi, berarti terjadi pelucutan [OH-] dalam larutan. Hal ini berakibat: B A L A D D A z OH k OH k D * . ] [ ] .[ . 2 (6) Dengan demikian, maka laju absorpsi gas CO2 ke dalam larutan NaOH akan mengikuti
persamaan: Ga L L k k H a k pg H a Ra . . . 1 . . . . (7)
Dengan adalah enhancement faktor yang merupakan rasio antara koefisien transfer
massa CO2 pada fase cair jika absorpsi disertai reaksi kimia dan tidak disertai reaksi
kimia seperti dirumuskan oleh Juvekar dan Sharma (1973):
2 / 1 2 * . ] [ . * . ] [ 1 . ] .[ . A B A B L A D D A z OH D D A z OH k OH k D (8)
Nilai diffusivitas efektif (DA) CO2 dalam larutan NaOH pada suhu 30oC adalah 2,1 10-5
cm2/det (Juvekar dan Sharma, 1973).
Nilai kGa dapat dihitung berdasarkan pada absorbsi fisik dengan meninjau perpindahan
massa total CO2 ke dalam larutan NaOH yang terjadi pada selang waktu tertentu di dalam
alat absorpsi. Dalam bentuk bilangan tak berdimensi, kGa dapat dihitung menurut
persamaan (Kumoro dan Hadiyanto, 2000):
3 / 1 2 2 4003 , 1 2 2 2 2 . . . 0777 , 4 . A CO CO CO CO CO A Ga D a Q D dp k (9) Dengan dp a 6(1) dan T V Vvoid
LABORATORIUM PROSES KIMIA 2013 8 . . . . ) ( . . . . ) , ( 2 32 lm lm GA p Z A CO mol p Z A liq CO mol k (10)
Jika tekanan operasi cukup rendah, maka plm dapat didekati dengan p = pin-pout.
Sedangkan nilai kla dapat dihitung secara empirik dengan persamaan (Zheng dan and Xu,
1992): 5 , 0 3 , 0 . . . 2258 , 0 . A NaOH NaOH A la D a Q D dp k (11)
Jika laju reaksi pembentukan Na2CO3 jauh lebih besar dibandingkan dengan laju difusi
CO2 ke dalam larutan NaOH, maka konsentrasi CO2 pada batas film cairan dengan badan
cairan adalah nol. Hal ini disebabkan oleh konsumsi CO2 yang sangat cepat selama reaksi
sepanjang film. Dengan demikian, tebal film (x) dapat ditentukan persamaan:
T R CO mol p p D x A in out . ). ( ) .( 2 3 (12)
LABORATORIUM PROSES KIMIA 2013 9
BAB III
PELAKSANAAN PERCOBAAN
3.1 Bahan dan Alat yang Digunakan
1. Bahan yang digunakan
a. Kristal Natrium Hidroksida (NaOH)
b. Cairan Gas Karbondioksida (CO2) yang disimpan di tabung bertekanan
c. Udara
d. Aquadest (H2O)
e. Larutan HCl 0,15 N dengan kemurnian 25% dan f. Indikator PP dan MO
2. Alat yang digunakan
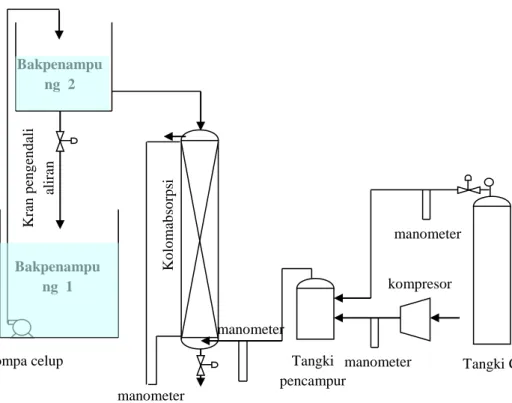
Rangkaian alat praktikum absorbsi terlihat pada gambar 3.1
Gambar 3.1 Rangkaian Alat Utama Tangki pencampur Tangki CO2 Bakpenampu ng 2 Bakpenampu ng 1 Pompa celup kompresor Ko lo m ab so rp si manometer manometer Kr an p en g en d ali alir an manometer manometer
LABORATORIUM PROSES KIMIA 2013 10 3.2 Variabel Operasi a. Variabel tetap 1. Tekanan CO2 : 1 atm 2. Suhu : 30 oC 3. Konsentrasi NaOH : 0,15 N b. Variabel berubah
Laju alir NaOH : 75 L/menit, 150 L/menit, 225 L/menit 3.3 Respon Uji Hasil
Konsentrasi ion CO32- dalam larutan sampel dan CO2 yang terserap akan semakin besar
seiring dengan meningkatnya laju alir NaOH 3.4 Prosedur Percobaan
1. Membuat larutan induk NaOH dengan konsentrasi 0,15 N sebanyak 10 L Menimbang 60 gr NaOH
Dilarutkan dalam aquadest sebanyak 10 L
Larutan NaOH ditampung dalam tangki untuk dioperasikan 2. Menentukan fraksi ruang kosong pada kolom absorpsi
Pastikan kran di bawah kolom absorpsi dalam posisi tertutup
Alirkan larutan NaOH dari bak penampung 2 ke dalam kolom absorpsi. Hentikan jika tinggi cairan di dalam kolom tepat setinggi tumpukan packing. Keluarkan cairan dalam kolom dengan membuka kran di bawah kolom,
tampung cairan tersebut dan segera tutup kran jika cairan dalam kolom tepat berada pada packing bagian paling bawah.
Catat volume cairan sebagai volume ruang kosong dalam kolom absorpsi =
Vvoid.
Tentukan volume total kolom absorpsi, yaitu dengan mengkur diameter kolom (D) dan tinggi tumpukan packing (H),
4 . 2 H D VT Fraksi ruang kosong kolom absorpsi =
T V Vvoid 3. Operasi Absorbsi
LABORATORIUM PROSES KIMIA 2013 11 NaOH 0,15 N dipompa dan diumpankan ke dalam kolom melalui bagian atas
kolom pada laju alir tertentu hingga keadaan mantap tercapai.
Mengalirkan gas CO2 melalui bagian bawah kolom. Ukur beda ketinggian
cairan dalam manometer 1, manometer 2 dan manometer 3, manometer 4 jika aliran gas sudah steady.
Mengambil 10 mL sampel cairan dari dasar kolom absorpsi tiap 1 menit selama 10 menit dan dianalisis kadar ion karbonat atau kandungan NaOH bebasnya.
Mengulangi percobaan untuk nilai variabel kajian yang berbeda. 4. Menganalisis sampel
Sebanyak 10 mL sampel cairan ditempatkan dalam gelas erlenmeyer 100 mL. Menambahkan indikator fenol fthalein (PP) sampai merah jambu, dan titrasi
sample dengan larutan HCl 0,15 N sampaiwarna merah hampir hilang (kebutuhan titran = a mL), maka mol HCl = a 0,1 mmol.
Menambahkan 2-3 tetes indikator metil jingga (MO), dan titrasi dilanjutkan lagi sampai warna jingga berubah menjadi merah (kebutuhan titran=b mL), atau kebutuhan HCl = b 0,1 mmol.
Jumlah NaOH bebas = (2a-b) 0,1 mmol di dalam 10 mL sample Konsentrasi NaOH bebas = (2a-b) 0,01 mol/L
LABORATORIUM PROSES KIMIA 2013 12
BAB IV
PEMBAHASAN
4.1 Profil perubahan konsentrasi CO2 pada berbagai laju alir NaOH dan waktu
Berdasarkan data-data percobaan yang diperoleh dari praktikum, kemudian dilakukan perhitungan dengan bantuan perangkat komputer. Maka hasil percobaan kami dapat disajikan dalam bentuk tabel sebagai berikut:
Tabel 4.1 Hasil Percobaan jumlah CO2 dengan Variabel Laju Alir NaOH
NaOH (ml/menit) kGa (mol/m3.pa) kla (mol/m3.pa) k2 (mol/m3.pa) CO2 terserap (mol) 75 5,5066 x 10-6 0,03365 0,6115 150 1,493 x 10-5 0,6135 225 2,156 x 10-5 0,9915
Tabel 4.2 Hasil Jumlah CO2 Terserap
Waktu (menit) CO2 yang terserap (75 ml/menit NaOH) CO2 yang terserap ( 150 ml/menit NaOH) CO2 yang terserap (225 ml/menit NaOH) 0 0,007 0,053 0,064 1 0,024 0,0355 0,0715 2 0,0385 0,068 0,06 3 0,0335 0,0775 0,1 4 0,0375 0,071 0,0585 5 0,0455 0,0915 0,093 6 0,0355 0,066 0,089 7 0,0575 0,075 0,0895 8 0,038 0,0525 0,052 9 0,0375 0,076 0,085 10 0,026 0,0625 0,0595 0,3805 0,7285 0,822
LABORATORIUM PROSES KIMIA 2013 13 4.2 Pengaruh Konsentrasi NaOH terhadap CO2 yang terserap
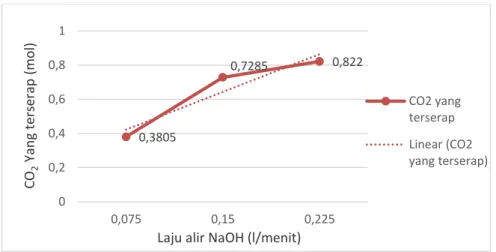
Gambar 4.1 Hubungan Laju Alir NaOH vs Jumlah CO2 yang terserap
Dari gambar 4.1 dapat dilihat bahwa semakin besar laju alir NaOH, maka semakin banyak pula CO2 yang terserap. Hal ini disebabkan karena semakin besar laju alir maka
semakin banyak larutan NaOH yang mengalami kontak dengan CO2. Sehingga semakin
banyak pula partikel NaOH yang mampu menyerap CO2. Dapat dilihat pada saat Q=
0,075 l/mnt CO2 yang terserap sebanyak 0,3805; pada saat Q= 0,15 l/mnt CO2 yang
terserap sebanyak 0,7285; dan pada saat Q= 0,225 l/mnt CO2 yang terserap sebanyak
0,822. Sehingga dapat ditarik kesimpulan bahwa jumlah CO2 yang terserap akan semakin
meningkat seiring dengan semakin besarnya laju alir (Luluk Endahwati, UPN Veteran). 4.3 Pengaruh Konsentrasi NaOH terhadap Nilai Kga
Gambar 4.2 Hubungan Laju Alir NaOH vs kGa
0,3805 0,7285 0,822 0 0,2 0,4 0,6 0,8 1 0,075 0,15 0,225 CO 2 Y an g t ers era p (m o l)
Laju alir NaOH (l/menit)
CO2 yang terserap Linear (CO2 yang terserap) 103,995 244,4226 334,8698 0 50 100 150 200 250 300 350 400 0,075 0,15 0,225 kGa (m o l/m 3.p a)
Laju alir NaOH (L/menit)
LABORATORIUM PROSES KIMIA 2013 14 Dari gambar 4.2 dapat dilihat bahwa terjadi kenaikan nilai konstanta kGa (konstanta perpindahan massa antar fase gas-cair) seiring dengan kenaikan Laju alir larutan penyerap NaOH. Hal ini dapat terjadi karena dengan semakin tinggi laju alir cairan, maka kontak fase antara gas dengan cairan semakin baik. Dengan demikian, maka jumlah gas yang dapat berpindah dari dari fase gas menuju fase cair juga semakin besar. Besarnya harga koefisien perpindahan massa CO2 ke larutan NaOH dipengaruhi oleh
reaksi kimia yang terjadi. Semakin cepat reaksi kimia terjadi maka jumlah gas yang dapat berpindah dari fase gas menuju fase cairan juga semakin besar (Kumoro, Andri Cahyo dan Hadiyanto, 2000).
4.4 Pengaruh Konsentrasi NaOH terhadap Nilai kLa
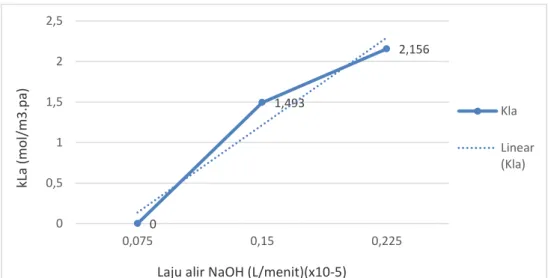
Gambar 4.3 Hubungan Laju Alir NaOH vs kla
Dari gambar 4.3 menunjukkan bahwa semakin besar laju alir NaOH maka semakin besar nilai kLa. Hal ini disebabkan karena laju alir (Q) berbanding lurus dengan nilai kLa, sesuai rumus:
5 , 0 3 , 0 . . . 2258 , 0 . A NaOH NaOH A la D a Q D dp k
Berdasarkan persamaan tersebut, dapat disimpulkan bahwa semakin besar laju alir suatu cairan, maka nilai kLa semakin besar sebagai akibat dari kontak antara gas dengan cairan yang semakin banyak (buku panduan praktikum proses kimia/ landasan teori).
0 1,493 2,156 0 0,5 1 1,5 2 2,5 0,075 0,15 0,225 kL a (m o l/m 3.p a)
Laju alir NaOH (L/menit)(x10-5)
Kla Linear (Kla)
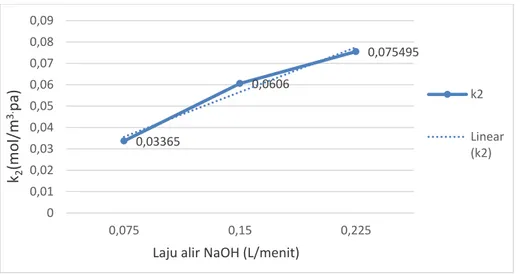
LABORATORIUM PROSES KIMIA 2013 15 4. 5 Pengaruh Konsentrasi NaOH terhadap Nilai k2
Grafik 4.4 Hubungan Laju Alir NaOH vs k2
Dari gambar 4.4 dapat dilihat bahwa terjadi peningkatan nila konstanta kecepatan reaksi (k2) seiring dengan kenaikan laju alir NaOH. Fenomena ini sesuai dengan
persamaan Arhenius : k=A ×e(-Ea/RT )
Nilai k dipengaruhi oleh adanya A, dimana A merupakan faktor tumbukan. Semakin besar laju alir NaOH maka semakin besar tumbukan yang terjadi antara gas CO2
dengan NaOH. Semakin banyak bagian zat yang bertumbukan maka nilai k akan semakin besar. (Levenspiel, 1972)
4. 6 Hubungan CO2 yang Terserap terhadap Waktu
Gambar 4.5 Hubungan CO2 yang terserap terhadap waktu
0,03365 0,0606 0,075495 0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09 0,075 0,15 0,225 k2 (m o l/ m 3.p a)
Laju alir NaOH (L/menit)
k2 Linear (k2) 0 0,02 0,04 0,06 0,08 0,1 0,12 1 2 3 4 5 6 7 8 9 10 CO2 y an g ters era p Waktu (menit)
LABORATORIUM PROSES KIMIA 2013 16 Dari gambar 4.5 dapat disimpulkan, semakin lama waktu operasi, maka jumlah CO2 yang terserap akan semakin banyak. Hal ini disebabkan karena kesempatan kontak
antara NaOH dan CO2 semakin lama sehingga konversi akan meningkat dan
menyebabkan reaksi akan berjalan lebih sempurna. Pada awalnya akan terjadi peningkatan jumlah CO2 yang terserap, kemudian pada suatu waktu jumlah CO2 yang
terserap akan konstan. Hal ini dapat dilihat dari jumlah CO2 yang terserap konstan
dalam grafik. Dapat ditarik kesimpulan bahwa jumlah CO2 yang terserap akan konstan
seiring dengan berjalannya waktu. Hal ini disebabkan karena reaksi berjalan secara kontinyu (Luluk Endahwati, UPN Veteran).
LABORATORIUM PROSES KIMIA 2013 17
BAB V
PENUTUP
5.1 Kesimpulan
1. Semakin besar laju alir NaOH maka CO2 yang terserap akan semakin besar pula karena
semakin banyak jumlah partikel NaOH yang mengalami kontak dengan gas CO2
2. Nilai koefisien perpindahan massa di lapisan gas (kGa) akan semakin besar seiring dengan meningkatnya laju alir NaOH. Pada laju alir 75 ml/menit nilai kGa=103,995 mol/m3.pa, laju alir 150 ml/menit nilai kGa=244,4226 mol/m3.pa dan laju alir 225 ml/menit nilai kGa=334,8698 mol/m3.pa
3. Nilai koefisien perpindahan massa dilapisan cair (kLa) akan semakin besar seiring dengan meningkatnya laju alir NaOH. Nilai kLa pada laju alir 75 ml/menit adalah 5,5066x10-6 mol/m3.pa, pada laju alir 150 ml/menit adalah 1,4935x10-6 mol/m3.pa dan pada laju alir 225 ml/menit adalah 2,156x10-6 mol/m3.pa
4. Nilai k2 pada laju alir 75 ml/menit adalah 0,03365 mol/m3.pa, pada laju alir 150
ml/menit adalah 0,0606 mol/m3.pa dan pada laju alir 225 ml/menit adalah 0,0754 mol/m3.pa. Sehingga semakin besar laju alir NaOH maka semakin besar pula nilai tetapan laju reaksi (k2).
5. Semakin lama waktu operasi, maka jumlah CO2 yang terserap akan semakin banyak.
Hal ini disebabkan karena kesempatan kontak antara NaOH dan CO2 semakin lama
5.2 Saran
1. larutan NaOH dialirkan sampai overflow sebelum dikontakkan dengan CO2
2. laju alir CO2 sebaiknya dijaga agar tidak terlalu besar sehingga pengeluaran CO2 dapat
LABORATORIUM PROSES KIMIA 2013 18
DAFTAR PUSTAKA
Coulson, J.M. dan Richardson, J.F., 1996, Chemical Engineering: Volume 1: Fluid flow, heat
transfer and mass transfer, 5
th
ed. Butterworth Heinemann, London, UK.
Danckwerts, P.V. dan Kennedy, B.E., 1954, Kinetics of liquid-film process in gas absorption.
Part I: Models of the absorption process, Transaction of the Institution of Chemical Engineers, 32:S49-S52.
Danckwerts, P.V., 1970, Gas Liquid Reactions, McGraw-Hill Book Company, Inc., New York, pp. 42-44,
Edahwati, Luluk (2011), Kinetika Reaksi pembuatan NaOH dari Soda Ash. Jawa Timur. Franks, R.G.E., 1967, Mathematical modeling in chemical engineering. John Wiley and Sons,
Inc., New York, NY, USA, pp. 4-6.
Higbie, R., 1935, The rate of absorption of a pure gas into a still liquid during short period of
exposure, Transaction of the Institution of Chemical Engineers, 31,365-388.
Juvekar, V. A. dan Sharma, M.M., 1972, Absorption of CO, in a suspension of lime,
Chemical Engineering Science, 28, 825-837.
Kumoro dan Hadiyanto, 2000, Absorpsi Gas Karbondioksid dengan Larutan Soda Api dalam
Unggun Tetap, Forum Teknik, 24 (2), 186-195.
Levenspiel, O., 1972, Chemical reaction engineering, 3rd ed. John Wiley and Sons, Inc., New York, NY, USA, pp. 210-213, 542-551.
Olutoye, M. A. dan Mohammed, A., 2006, Modelling of a Gas-Absorption Packed Column for Carbon Dioxide-Sodium Hydroxide System, African Union Journal of Technology, 10(2),132-140
LABORATORIUM PROSES KIMIA 2013 19 Rehm, T. R., Moll, A. J. and Babb, A. L., 1963, Unsteady State Absorption ofCarbon Dioxide by Dilute Sodium Hydroxide Solutions, American Institute of Chemical Engineers
Journal, 9(5), 760-765.
Zheng, Y. and Xu, X. (1992), Study on catalytic distillation processes. Part I. Mass transfer characteristics in catalyst bed within the column, Transaction of the Institution of
LABORATORIUM PROSES KIMIA 2013 20
LEMBAR PERHITUNGAN
A. PERHITUNGAN REAGEN
Larutan NaOH 0.15N sebanyak 10 liter Larutan HCl 0.15 N B. PERHITUNGAN DENSITAS
Densitas larutan NaOH 0.15N
Densitas HCl
C. PERHITUNGAN FRAKSI RUANG KOSONG
Vvoid = 125 cm3
LABORATORIUM PROSES KIMIA 2013 21 H = 30.3 cm D. OPERASI ABSORBSI
Untuk laju alir 75 ml/menit ΔZ = 1.8 cm = 0.018 m PKompresor = 2,2 kg/ x PCO2 = 5,8 bar Q = 75 ml/menit = 0.075 L/menit Untuk laju alir 150 ml/menit
ΔZ = 1.8 cm = 0.185 m PKompresor = 2,2 kg/ x PCO2 = 5,9 bar Q = 150 ml/menit = 0.15 L/menit Untuk laju alir 225 ml/menit
ΔZ = 1.8 cm = 0.018 m PKompresor =2,2 kg/ x PCO2 = 5,9 bar Q = 225 ml/menit = 0.225 L/menit
LABORATORIUM PROSES KIMIA 2013 22 E. PERHITUNGAN LAJU ALIR
Massa jenis raksa = 13.543 Kg/m3 Massa jenis CO2 = 1.977 Kg/m3
F. PERHITUNGAN LAJU ALIR PADA KOMPRESOR CO2
Laju alir 75 ml/menit
( ) ( ) √ ( ) ( ) √ ( ) ( )
G. PERHITUNGAN LAJU ALIR UDARA
Massa jenis raksa = 13.543 Kg/m3 Massa jenis O2 = 1.2 Kg/m3
Laju alir 75 ml/menit
( ) ( )
LABORATORIUM PROSES KIMIA 2013 23 √ ( ) ( ) √ ( ) ( )
H. PENENTUAN KADAR CO2 MULA-MULA
Laju alir 75 ml/menit NERACA TOTAL Q1 = QCO2 = L/menit Q2 = Qudara = L/menit Q3 = Q1 + Q2 = ( + ) L/menit = 88,744 L/menit NERACA KOMPONEN C3 x Q3 = C1 x Q1 + C2 x Q2 (C1=0) C3 = (C2 x Q2)/Q3 P.V=n.R.T ,
Tekanan CO2 dalam tabung C2
=
C2 = 0,23 mol/L Q3 Q1 Q2
LABORATORIUM PROSES KIMIA 2013 24
I. PERHITUNGAN HASIL PERCOBAAN
NaOH 0,5 N ; Q = 0,075 L/menit t (menit) a (ml) b (ml) Na2CO3 NaHCO3 C02 terserap N CO2 0 0,8 1,4 0,004 0,003 0,007 0,00035 1 4,8 0,5 0,0025 0,0215 0,024 0,0012 2 7,7 0,7 0,0035 0,035 0,0385 0,001925 3 6,7 0,5 0,0025 0,031 0,0335 0,001675 4 7,5 0,5 0,0025 0,035 0,0375 0,001875 5 9,1 1,4 0,007 0,0385 0,0455 0,002275 6 7,1 0,8 0,004 0,0315 0,0355 0,001775 7 12 1 0,005 0,0525 0,0575 0,002875 8 7,6 0,9 0,0045 0,0335 0,038 0,0019 9 7,5 0,5 0,0025 0,035 0,0375 0,001875 10 5,2 1,8 0,009 0,017 0,026 0,0013 jumlah 0,047 0,3335 0,3805 0,019025 NaOH 0,15 N ; Q = 0,15 L/menit t (menit) a (ml) b (ml) Na2CO3 NaHCO3 C02 terserap N CO2 0 10,6 0,9 0,0045 0,0485 0,053 0,00265 1 7,1 1,8 0,009 0,0265 0,0355 0,001775 2 13,6 1,5 0,0075 0,0605 0,068 0,0034 3 15,5 2,5 0,0125 0,065 0,0775 0,003875 4 14,2 1,7 0,0085 0,0625 0,071 0,00355 5 18,3 1,8 0,009 0,0825 0,0915 0,004575 6 13,2 1,4 0,007 0,059 0,066 0,0033 7 15 4 0,02 0,055 0,075 0,00375 8 10,5 2,4 0,012 0,0405 0,0525 0,002625 9 15,2 3,2 0,016 0,06 0,076 0,0038 10 12,5 1,5 0,0075 0,055 0,0625 0,003125 jumlah 0,1135 0,615 0,7285 0,036425
LABORATORIUM PROSES KIMIA 2013 25 NaOH 0,15 N ; Q = 0,225 L/menit t (menit) a (ml) b (ml) Na2CO3 NaHCO3 C02 terserap N CO2 0 12,8 1,3 0,0065 0,0575 0,064 0,0032 1 14,3 1,6 0,008 0,0635 0,0715 0,003575 2 12 3,1 0,0155 0,0445 0,06 0,003 3 20 4 0,02 0,08 0,1 0,005 4 11,7 3,1 0,0155 0,043 0,0585 0,002925 5 18,6 2,6 0,013 0,08 0,093 0,00465 6 17,8 4 0,02 0,069 0,089 0,00445 7 17,9 2,1 0,0105 0,079 0,0895 0,004475 8 10,4 2,7 0,0135 0,0385 0,052 0,0026 9 17 2,5 0,0125 0,0725 0,085 0,00425 10 11,9 4,1 0,0205 0,039 0,0595 0,002975 jumlah 0,1555 0,6665 0,822 0,0411
J. PERHITUNGAN HARGA Kga Rumus
Dimana :
A = luas kolom absorbsi = Z = tinggi packing = 30,3 cm
ε = fraksi ruang kosong = 0,58
Variabel 1 Laju alir NaOH 75 ml/menit
P = PCO2 - Pkompresor = 5,8 bar - 2,16 bar = 3,64 bar
Kga =
Variabel 2 Laju alir NaOH 150 ml/menit
P = PCO2 - Pkompresor = 5,9 bar – 2,16 bar = 3,74 bar
Kga =
Variabel 3 Laju alir NaOH 225 ml/menit
LABORATORIUM PROSES KIMIA 2013 26 Kga = K. PERHITUNGAN kla ( ) ( ) ( ) DA = 2,1 . 10-9 m2/s ( ) ρ NaOH = 969,9 kg/m3 μ NaOH = 3,95. 10-3 N NaOH = 0,15 N
Variabel I Laju alir 75 ml/menit
( ) ( ) ( ) ( ) 4107945058 4107945058 ( ) ( ) ( ) ( ) ( ) kla = 5,5066 x 10-6
Variabel II Laju alir 150 ml/menit
( ) ( ) ( ) ( )
LABORATORIUM PROSES KIMIA 2013 27 4107945058 4107945058 ( ) ( ) ( ) ( ) ( ) kla = 1,493 x 10-5
Variabel III Laju alir 225 ml/menit
( ) ( ) ( ) ( ) 4107945058 4107945058 ( ) ( ) ( ) ( ) ( ) kla = 2,156 x 10-5 L. PERHITUNGAN k2
Laju alir 75 ml/menit t(menit)
[x]
CO2
terserap [y] x.y
x2 0 0,007 0 0 1 0,024 0,024 1 2 0,0385 0,077 4 3 0,0335 0,1005 9 4 0,0375 0,15 16
LABORATORIUM PROSES KIMIA 2013 28 5 0,0455 0,01365 25 6 0,0355 0,213 36 7 0,0575 0,4025 49 8 0,038 0,304 64 9 0,0375 0,3375 81 10 0,026 0,26 100 Jumlah 55 0,3805 1,88215 385 ∑ ∑ ∑ ∑ (∑ ) c = ∑ ∑ ∑ ∑ ∑ (∑ ) y = mx + c = ( ) k2 = 0,03365
Laju alir 150 ml/menit t(menit)
[x]
CO2
terserap [y] x.y
x2 0 0,053 0 0 1 0,0355 0,0355 1 2 0,068 0,136 4 3 0,0775 0,2325 9 4 0,071 0,284 16 5 0,0915 0,4575 25 6 0,066 0,396 36 7 0,075 0,525 49 8 0,0525 0,42 64 9 0,076 0,684 81 10 0,0625 0,625 100 Jumlah 55 0,7285 3,7955 385
LABORATORIUM PROSES KIMIA 2013 29 ∑ ∑ ∑ ∑ (∑ ) c = ∑ ∑ ∑ ∑ ∑ (∑ ) y = mx + c = ( ) k2 =
Laju alir 225 ml/menit t(menit)
[x]
CO2
terserap [y] x.y
x2 0 0,064 0 0 1 0,0715 0,0715 1 2 0,06 0,12 4 3 0,1 0,3 9 4 0,0585 0,234 16 5 0,093 0,465 25 6 0,089 0,534 36 7 0,0895 0,6265 49 8 0,052 0,416 64 9 0,085 0,765 81 10 0,0595 0,595 100 Jumlah 55 0,822 4,127 385 ∑ ∑ ∑ ∑ (∑ ) c = ∑ ∑ ∑ ∑ ∑ (∑ ) y = mx + c = ) k2 =
LAPORAN SEMENTARA PRAKTIKUM PROSES KIMIA
Materi :
ABSORBSI GAS CO2 DENGAN LARUTAN NaOH
Disusun oleh :
Ainun Khoiriyah 21030111120037
Anisa Dien Rahmawati 21030111110154
Zulhaq Dahri Siqhny 21030111130136
LABORATORIUM PROSES KIMIA TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
I. TUJUAN PERCOBAAN:
1. Pengaruh laju alir NaOH terhadap jumlah CO2 yang terserap pada berbagai
waktu reaksi.
2. Pengaruh laju alir NaOH terhadap nilai tetapan perpindahan massa-gas CO2 (kGa)
3. Pengaruh laju alir NaOH terhadap nilai tetapan perpindahan massa-cair (kLa)
4. Pengaruh laju alir NaOH terhadap nilai tetapan reaksi antara CO2 dan
NaOH (k2).
5. Hubungan CO2 yang terserap terhadap waktu
II. PERCOBAAN
II.1.Bahan yang digunakan
1. Natrium Hidroksida (NaOH) 2. Gas Karbon dioksida (CO2)
3. Udara
4. Aquadest (H2O)
5. HCl dengan kemurnian 25% 6. Indikator Titrasi (PP dan MO) II.2. Alat yang digunakan
1. Tabung CO2 2. Kolom Packing 3. Tangki NaOH 4. Pompa 5. Manometer 6. Kompresor 7. Tabung Penyampur 8. Ember
II.3. Cara kerja
1) Buat larutan induk NaOH dengan konsentrasi 0,15 N sebanyak 10 L Timbang 60 gr NaOH
Dilarutkan dalam aquadest sebanyak 10L
2) Menentukan fraksi ruang kosong pada kolom absorpsi
Pastikan kran di bawah kolom absorpsi dalam posisi tertutup
Alirkan larutan NaOH dari bak penampung 2 ke dalam kolom absorpsi. Hentikan jika tinggi cairan di dalam kolom tepat setinggi tumpukan
packing.
Keluarkan cairan dalam kolom dengan membuka kran di bawah kolom, tampung cairan tersebut dan segera tutup kran jika cairan dalam kolom tepat berada pada packing bagian paling bawah.
Catat volume cairan sebagai volume ruang kosong dalam kolom absorpsi =
Vvoid.
Tentukan volume total kolom absorpsi, yaitu dengan mengkur diameter kolom (D) dan tinggi tumpukan packing (H),
4 . 2 H D VT Fraksi ruang kosong kolom absorpsi =
T V Vvoid 3) Operasi Absorpsi
NaOH 0,15 N dipompa dan diumpankan ke dalam kolom melalui bagian atas kolom pada laju alir tertentu hingga keadaan mantap tercapai.
Alirkan gas CO2 melalui bagian bawah kolom. Ukur beda ketinggian cairan
dalam manometer 1, manometer 2 dan manometer 3, manometer 4 jika aliran gas sudah steady.
Ambil 10 mL sampel cairan dari dasar kolom absorpsi tiap 1 menit selama 10 menit dan dianalisis kadar ion karbonat atau kandungan NaOH bebasnya.
Ulangi percobaan untuk nilai variabel kajian yang berbeda.
4) Analisis sampel
Sebanyak 10 mL sampel cairan ditempatkan dalam gelas erlenmeyer 100 mL.
Tambahkan indikator fenol fthalein (PP) sampai merah jambu, dan titrasi sample dengan larutan HCl 0,15 N sampaiwarna merah hampir hilang (kebutuhan titran = a mL), maka mol HCl = a 0,1 mmol.
Tambahkan 2-3 tetes indikator metil jingga (MO), dan titrasi dilanjutkan lagi sampai warna jingga berubah menjadi merah (kebutuhan titran = b mL), atau kebutuhan HCl = b 0,1 mmol.
Jumlah NaOH bebas = (2a-b) 0,1 mmol di dalam 10 mL sample Konsentrasi NaOH bebas = (2a-b) 0,01 mol/L
II. 4. Hasil percobaan Variabel laju alir NaOH
(L/menit)
P Kompresor (kg/cm2) Tinggi manometer (cm)
0,075 2.2 1.8
0.15 2.2 1.8
0,225 2.2 1.8
t Variabel 1 Variabel 2 Variabel 3
a(ml) b(ml) a(ml) b(ml) a(ml) b(ml)
0 0.8 1.4 10.6 0.9 12.8 1.3 1 4.8 0.5 7.1 1.8 14.3 1.6 2 7.7 0.7 13.6 1.5 12 3.1 3 6.7 0.5 15.5 2.5 20 4 4 7.5 0.5 14.2 1.7 11.7 3.1 5 9.1 1.4 18.3 1.8 18.6 2.6 6 7.1 0.8 13.2 1.4 17.8 4 7 11.5 1 15 4 17.9 2.1 8 7.6 0.9 10.5 2.4 10.4 2.7 9 7.5 0.5 15.2 3.2 17 2.5 10 1.8 1.8 12.5 1.5 11.9 4.1 Semarang, Desember 2013 MENGETAHUI ASISTEN Inggit Prillasari
DIPERIKSA KETERANGAN TANDA TANGAN NO TANGGAL 1. 2. 3. 12 Desember 2013 12 Desember 2013 13 Desember 2013
1. Lengkapi dengan daftar isi, daftar tabel dan daftar gambar
2. Rapikan format penulisan (jenis font, spasi dll)
3. Sesuaikan rumusan masalah, tujuan dan manfaat percobaan dengan variabel percobaan yang dilakukan 4. Sesuaikan format penulisan tabel
dan grafik sesuai buku pedoman penulisan yang ada
5. Ganti referensi pembahasan di bab IV
6. Perbaiki penulisan daftar pustaka 1. Perbaiki penulisan daftar isi 2. Perbaiki penulisan tabel sesuai
format resmi
3. Perbaiki penulisan daftar pustaka sesuai format resmi