Materi : ESTERIFIKASI
Disusun Oleh :
Juhnizar P. Buminata 21030112130124
Rizkia Risang Khairunnisa 21030112140041 Vicky Kartika Firdaus 21030112130146
LABORATORIUM PROSES KIMIA JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
LABORATORIUM PROSES KIMIA 2014 ii
HALAMAN PENGESAHAN
1. Judul Praktikum : Esterifikasi
2. Anggota
1. Nama Lengkap : Juhnizar P. Buminata
NIM : 21030112130124
Jurusan : S-1 Teknik Kimia
Universitas/Institut/Politeknik : Universitas Diponegoro
2. Nama Lengkap : Rizkia Risang Khairunnisa
NIM : 21030112140041
Jurusan : S-1 Teknik Kimia
Universitas/Institut/Politeknik : Universitas Diponegoro
3. Nama Lengkap : Vicky Kartika Firdaus
NIM : 21030112130146
Jurusan : S-1 Teknik Kimia
Universitas/Institut/Politeknik : Universitas Diponegoro
Semarang, 12 Juni 2014
Dosen Pembimbing
Dr. Ir. Ratnawati, MT NIP. 19600412 198603 2 001
KATA PENGANTAR
Puji syukur kami panjatkan kepada Tuhan Yang Maha Esa karena berkat rahmat dan hidayahnya kami dapat menyelesaikan laporan resmi Praktikum Proses Kimia dengan lancar dan sesuai dengan harapan kami.
Ucapan terimakasih juga kami ucapkan kepada Ibu Ratnawati selaku dosen pembimbing Praktikum Proses Kimia serta koordinator laboratorium Proses Kimia, koordinator asisten laboratorium Proses KimiaWinda Putri Haryanti , asisten Mutia Anissa Marsya sebagai asisten laporan praktikum esterifikasikami, bapak laboran Proses Kimia dan segenap asisten yang telah membimbing sehingga tugas laporan resmi ini dapat terselesaikan. Kepada teman-teman yang telah membantu baik dalam segi waktu maupun motivasi apapun kami ucapkan terima kasih.
Kami menyadari bahwa laporan resmi ini masih banyak sekalikekurangannya. Oleh karena itu, kritik dan saran yang membangun demikesempurnaan laporan ini sangat kami harapkan. Semoga Laporan Resmi Praktikum Proses Kimia materi Esterifikasi ini dapat berguna bagipara pembaca. Sekian dan terima kasih.
Semarang, Juni 2014
LABORATORIUM PROSES KIMIA 2014 iv
DAFTAR ISI
Halaman Cover ...i
Halaman Pengesahan ...ii
Prakata...iii
Daftar Isi...iv
Daftar Gambar ...vi
Daftar Tabel ...vii
Intisari ...viii
Summary ...ix
BAB I PENDAHULUAN I.1 Latar Belakang... 1
I.2 Tujuan Percobaan... 1
I.3 Manfaat Percobaan ... 1
BAB II TINJAUAN PUSTAKA II.1 Kinetika Reaksi ... 2
II.2 Tinjauan Thermodinamika ... 3
II.3 Mekanisme Reaksi... 5
II.4 Variabel yang Berpengaruh ... 6
BAB III METODOLOGI PERCOBAAN III.1 Bahan dan Alat yang Digunakan... 8
III.2 Gambar Alat... 8
III.3 Variabel Operasi... 9
III.4 Respon Uji Hasil ... 9
III.5 Cara Kerja... 9
BAB IV HASIL PERCOBAAN DAN PEMBAHASAN IV.1 Hasil Percobaan... 11
IV.2 Pembahasan... 12 BAB V PENUTUP V.1 Kesimpulan... 17 V.2 Saran ... 17 DAFTAR PUSTAKA... 18 LEMBAR PERHITUNGAN... 19
1. Perhitungan Reagen...19 2. Perhitungan Variabel 1 ...20 3. Perhitungan Variabel 2 ...23 LAMPIRAN 1. Laporan Sementara 2. Referensi 3. Lembar Asistensi
LABORATORIUM PROSES KIMIA 2014 vi DAFTAR GAMBAR
Gambar 3.1 Rangkaian Alat Utama ... 8
Gambar 3.2 Rangkaian Alat Titrasi... 8
Gambar 4.1 Hubungan Waktu dan Konversi Esterifikasi ... 12
Gambar 4.2 Hubungan Variabel Suhu terhadap Konversi Esterifikasi... 13
Gambar 4.3 Hubungan Variabel Suhu terhadap Konstanta Laju Reaksi Esterifikasi... 14 Gambar 4.4 Hubungan Variabel Suhu terhadap Konstanta Kesetimbangan Esterifikasi . 15
DAFTAR TABEL
Tabel 4.1 Hasil Percobaan Variabel 1(Suhu Reaksi 510C)... 11
Tabel 4.2 Nilai Konstanta Kesetimbangan dan Laju Reaksi Variabel 2... 11
Tabel 4.3 Hasil Percobaan Variabel 1(Suhu Reaksi 610C)... 11
LABORATORIUM PROSES KIMIA 2014 viii
INTISARI
Esterifikasi merupakan reaksi pembentukan ester. Tujuan dari percobaan esterifikasi adalah untuk mempelajari pengaruh suhu reaksi terhadap konversi yang didapat, menghitung konstanta kesetimbangan dan konstanta laju reaksi. Dalam industri, metil asetat merupakan pelarut untuk senyawa: cellulose acetate butyrate, nitrocellulose, vinyl copolymers, acrylics, epoxies, polyamides, phenolics, alkyds, dan polyesters.
Esterifikasi merupakan reaksi antara asam karboksilat dengan alcohol dengan hasil ester dan air. Reaksi esterifikasi berjalan lambat sehingga dibutuhkan katalis untuk dapat mempercepat reaksi. Variabel yang dapat mempercepat reaksi esterifikasi adalah perubahan konsentrasi, katalis, kecepatan pengadukan, waktu serta suhu reaksi. Reaksi esterifikasi merupakan reaksi endotermis dan merupakan reaksi reversibel.
Bahan yang digunakan dalam proses esterifikasi adalah metanol, asamasetat, HCl 0,4 N, NaOH 0,21 N, aquadest dan indicator PP. Langkah kerja dalam praktikum ini adalah merangkai alat, kemudian mencampurkan asam asetat dengan HCl, panaskan hingga suhu 51°C, kemudian campurkan metanol 51°C dan variabel perbandingan asam asetat dengan metanol 1,1: 2,1 yang disertai pengadukan lalu dilakukan proses esterifikasi. Setelah dicampurkan ambil 5 ml sampel mulai dari t = 0 menit sampai dengan waktu pengambilan 5 kali setiap 13 menit, tambahkan 3 tetes indicator PP lalu titrasi dengan NaOH 0,21 N hingga warna merah muda. Langkah tersebut diulangi untuk variabel lperbandingan suhu reaksi 61oC.
Dari hasil percobaan yang dilakukan, konversi pembentukan metil asetat dari asam asetat dan metanol semakin besar seiring dengan bertambahnya waktu karena semakin lama waktu reaksi molekul akan memperoleh tambahan kesempatan untuk bergerak lebih dan meningkatkan energi kinetik yang dihasilkan sehingga konversi menjadi semakin besar. Pada suhu reaksi 51°C didapatkan konversi sebesar 0,659 sedangkan pada suhu reaksi 61oC didapatkan konversi sebesar 0,6766. Pada percobaan dengan suhu reaksi 51°C didapatkan K sebesar 1,0182, sedangkan pada percobaan dengan suhu reaksi 61°C didapatkan K sebesar 1,1477. Peningkatan suhu menyebabkan kontanta keseimbangan meningkat karena konversi reaktan menjadi produk meningkat. Peningkatan suhu sampai batas suhu optimum akan meningkatkan nilai konstanta laju reaksi karena semakin besar konsentrasi maka semakin besar pula tumbukan sehingga nilai konstanta laju reaksi semakin besar.
Kesimpulan yang kami peroleh adalah konversi ester pada kedua variabel suhu akan bertambah seiring bertambahnya waktu operasi. Semakin besar suhu reaksi maka akan meningkatkan konversi ester dan meningkatkan nilai konstanta kesetimbangan, dan konstanta kesetimbangan reaksi. Saran yang kami berikan adalah suhu operasi harus dijaga agar konstan, memastikan larutan teraduk sempurna, lebih teliti dalam pengamatan TAT, asisten harus memperhatikan praktikan yang sedang menjalani praktikum agar tidak mengalami kesalahan prosedur, dan laboran harus mengecek kembali alat-alat praktikum dengan baik, agar alat-alat yang sudah tidak berfungsi bisa diganti dengan yang baru sehingga praktikum dapat berlangsung dengan baik.
SUMMARY
Esterification is an ester making reaction. The purpose of this esterification experiment is to learn the impact of reaction temperature to the conversion resulted and count the equilibrium constant and reaction rate constant. In industry, methyl acetate is a solvent for : cellulose acetate butyrate, nitrocellulose, vinyl copolymers, acrylics, epoxies, polyamides, phenolics, alkyds, and polyesters.
Esterification is reaction between carboxylic acid and alcohol with having ester and water as a reaction result. Esterification reaction runs slowly that it needs catalyst to make the reaction run faster. Variable that affect esterification reaction is the change of concentration, catalyst, stirring rate, time, and reaction temperature. Esterification reaction is an endotermic reaction and a reversible reaction.
Ingredient used in esterification process is methanol, acetic acid, HCl 0,4 N, NaOH 0,21 N, aquadest, and PP indicator. Working steps in this experiment is string the tools, then mix acetic acid with HCl, boil it until 51oC, after that mix the 51oC methanol and variable ratio of acetic acid and methanol 1,1:2,1 followed by stirring then run the esterification process. After all ingeridients had mixed, take 5 ml of sample from t=0 minute until 5 times taking every 14 minutes, add 3 drops of PP indicator then do the titration with NaOH 0,21 N until the color changed to pink. Repeat those steps for 61oC temperature variable.
From experiment results done, the conversion of methyl acetate formation from acetic acid and methanol is getting higher with the increasing of time because molecules will get more chances to move with longer reaction time and and improve kinetic energy resulted so that the conversion become higher. In 51oC reaction temperature, the conversion obtained is 0,659, while in 61oC the conversion is 0,6766. In experiment with 51oC reaction temperature, the K obtained is 1,018 while in 61oC the K obtained is 1,147. The increasing temperature makes equilibrium constant rises because reactant conversion to product increases. Increase in temperature until optimum temperature limit will increase the value of reaction rate constant because the higher concentration given, the bigger collision will happen so that reaction rate constant will be higher.
Conclusion we get is the ester conversion in both of temperature variable will increase with the increasing of operation time. With higher reaction tempetature, ester conversion will increase and equilibrium constant will also increase. Advise we suggest is the operation temperature should be kept to a constant, make sure the solution stirred perfectly, be more precise in observing TAT, assistents should watch the practician when doing the experiment so that the experiment procedure will not go wrong, and laboratory assistant should check the experiment tools so that the tools which is broken can be replaced with the new one in order to make the experiment runs well.
LABORATORIUM PROSES KIMIA 2014 1
BAB I
PENDAHULUAN
I.1 Latar BelakangEsterifikasi merupakan reaksi pembentukan ester. Salah satu jenis reaksi ini adalah reaksi antara asam karboksilat dengan alkohol. Produk reaksi berupa ester dan air. Persamaan umum reaksi ini dapat ditentukan sebagai berikut :
R – COOH + HO - R’ R - COOR’ + H2O
Reaksi ini bersifat dapat balik dan umumnya sangat lambat sehingga memerlukan katalis agar diperoleh ester yang maksimal maka perlu dipelajari faktor-faktor yang mempengaruhi proses esterifikasi.
Aplikasi esterifikasi sendiri dalam industri sangat banyak, beberapa di antaranya adalah sebagai pelarut/solvent dan pemberi aroma dalam industri makanan, serta digunakan pula dalam reaksi energi yang terbarukan yaitu pembuatan biodiesel. Oleh karena itu sebagai sarjana Teknik Kimia perlu untuk mempelajari reaksi esterifikasi dalam skala laboratorium dan mengetahui aplikasinya di industri.
I.2 Tujuan Percobaan
1. Mengetahui pengaruh waktu terhadap konversi ester yang terbentuk.
2. Mengetahui penegaruh variabel temperatur (51°C dan 61°C) terhadap konversi ester yang terbentuk.
3. Mengetahui pengaruh variabel temperatur (51°C dan 61°C) terhadap konstanta laju reaksi (k) esterifikasi.
4. Mengetahui pengaruh variabel temperatur (51°C dan 61°C) terhadap konstanta kesetimbangan reaksi (K) esterifikasi.
I.3 Manfaat Percobaan
1. Dapat memahami pengaruh waktu terhadap konversi ester yang terbentuk. 2. Dapat memahami pengaruh variabel temperatur (51°C dan 61°C) terhadap
konversi ester yang terbentuk.
3. Dapat memahami pengaruh variabel temperatur (51°C dan 61°C) terhadap konstanta laju reaksi (k) esterifikasi.
4. Dapat memahami pengaruh variabel temperatur (51°C dan 61°C) terhadap konstanta kesetimbangan reaksi (K) esterifikasi.
BAB II
TINJAUAN PUSTAKA
II.1 Kinetika ReaksiEsterifikasi atau pembuatan ester merupakan reaksi antara asam karboksilat dan alkohol dengan hasil reaksi ester dan air. Contohnya yaitu reaksi antara asam asetat dengan metanol. Reaksi esterifikasi antara lain sebagai berikut:
CH3COOH + CH3OH ↔ CH3COOCH3+ H2O
A + B ↔ C + D Persamaan kecepatan reaksi kimia :
Keterangan :
rc = kecepatan reaksi pembentukan ester
[A] = konsentrasi asam asetat [CH3COOH]
[B] = konsentrasi metanol [CH3OH]
[C] = konsentrasi metil asetat [CH3COOCH3]
[D] = konsentrasi air [H2O]
k1 = konstanta kecepatan reaksi ke kanan (arah produk)
k2 = konstanta kecepatan reaksi ke kiri (arah reaktan)
t = waktu reaksi
Ditinjau dari kinetika reaksi, kecepatan reaksi pembentukan ester akan makin besar dengan kenaikan suhu, adanya pengadukan dan ditambahkan katalis. Hal ini dapat dijelaskan oleh persamaan Arrhenius yaitu :
Dengan :
k = konstanta kecepatan reaksi
A = faktor frekuensi tumbukan
T = suhu
EA = energi aktivasi
R = konstanta gas ideal
Berdasarkan persamaaan Arrhenius dapat dilihat bahwa konstanta laju reaksi dipengaruhi oleh nilai A, EA, dan T. Semakin besar faktor tumbukan (A) maka
LABORATORIUM PROSES KIMIA 2014 3
konstanta laju reaksinya semakin besar. Nilai energi aktivasi (EA) dipengaruhi oleh
penggunaan katalis, adanya katalis akan menurunkan energi aktivasi sehingga nilai k semakin besar. Semakin tinggi suhu (T) maka nilai k juga semakin besar. Dari hasil penelitian yang dilakukan oleh Kirbaskar dkk. (2001) untuk reaksi esterifikasi asam asetat dengan etanol menggunakan katalis asam dengan ion exchange resin diperoleh bahwa untuk reaksi ke arah pembentukan produk (k1) memiliki nilai EA = 104129
kJ/kmol dan A = 2,6.1014(m3)2kmol -2s -1
II.2 Tinjauan Termodinamika
Berdasarkan tinjauan termodinamika kita dapat mengetahui apakah reaksi tersebut searah atau bolak-balik dengan meninjau melalui perubahan energi Gibbs (∆G˚). Reaksi esterifikasi antara asam asetat dan metanol terjadi menurut reaksi berikut :
CH3COOH + CH3OH → CH3COOCH3 + H2O
‘∆Gof reaksi = ∆Gofproduk -∆Gof reaktan
Diketahui data ∆Gostandar (Smith,2010) dan (Perry’s Chemical Engineers’ Handbook,
7th ed) ∆Gof 298CH3COOH = -389900 J/mol ∆Gof 298CH3OH = -166270 J/mol ∆Gof 298CH3COOCH3 = -324200 J/mol ∆Gof 298H2O = -237129 J/mol Maka : ∆Gof 298= (∆Gof 298CH3COOCH3+ ∆Gof 298H2O) – (∆Gof 298CH3COOH + ∆Gof 298CH3OH) = (-324200 -237129) – (-389900-166270) = - 5159 J/mol
Dari persamaan van’t Hoff : ∆Go
f 298 = -RT ln K - 5159 J/mol = -(8,314 J/mol K) (298 K) ln K ln K = −95 m olJ −8,314 m ol KJ 298 ? K = 8,023 Pada reaksi : CH3COOH + CH3OH → CH3COOCH3 + H2O
Diketahui data ∆Hofstandar ( Smith dkk .,2010) dan (Perry’s Chemical Engineers’ Handbook, 7th ed) : ∆Ho f 298CH3COOH = - 484500 J/moL ∆Hof 298CH3OH = - 238660 J/mol ∆Hof 298CH3COOCH3 = - 411900 J/mol ∆Hof 298H2O = - 285830 J/mol Maka : ∆Hof 298= (∆Hof 298CH3COOCH3+ ∆Hof 298H2O) – (∆Hof 298CH3COOH + ∆Hof 298CH3OH) = (-411900-285830)-(-484500-238660) = 25430 J/mol
Dengan persamaan maka harga K pada suhu 510C (324 K) dapat dihitung :
ln (K2/K1) = ∆H 298R ?T21 T11?
ln (K324/k298) = 254308,314?3241 2981 ?
ln (k324/8,023) = -0,82366
K324/8,023 = 0,43882
K324 = 3,5207
Dari perhitungan energi Gibbs di dapat nilai K >1 , maka dapat disimpulkan reaksi esterifikasi asam asetat dengan metanol merupakan reaksi irreversible.
Dengan persamaan maka harga K pada suhu 610C (334 K) dapat dihitung : ln (K2/K1) = ∆H 298R ?T21 T11?
ln (K334/K298) = 254308,314?3341 2981 ?
ln (K334/8,023) = -1,10631
K334/8,023 = 0,33078
k334 = 2,6538
Dari perhitungan energi Gibbs didapat nilai K> 1 , maka dapat disimpulkan reaksi esterifikasi asam asetat dengan metanol merupakan reaksi irreversible.
Selain dapat mengetahui reaksi tersebut irreversible, berdasarkan tinjauan termodinamika juga dapat diketahui bahwa reaksi tersebut endotermis atau eksotermis dengan meninjau perubahan entalpi menurut perhitungan sebagai berikut :
CH3COOH + CH3OH → CH3COOCH3 + H2O
Diketahui data ∆Ho
fstandar ( Smith dkk .,2010) dan (Perry’s Chemical Engineers’
Handbook, 7th ed) : ∆Hof 298CH3COOH = - 484500 J/moL ∆Hof 298CH3OH = - 238660 J/mol ∆Hof 298CH3COOCH3 = - 411900 J/mol ∆Hof 298H2O = - 285830 J/mol Maka : ∆Ho f 298= (∆Hof 298CH3COOCH3+ ∆Hof 298H2O) – (∆Hof 298CH3COOH + ∆Hof 298CH3OH) = (-411900-285830)-(-484500-238660) = 25430 J/mol
Dari perhitungan perubahan entalpi ∆Ho298 bernilai positif yang menandakan bahwa
reaksi esterifikasi asam astetat dengan metanol bersifat endotermis.
II.3 Mekanisme Reaksi
Reaksi esterifikasi adalah suatu reaksi antara asam karboksilat dan alkohol membentuk ester. Turunan asam karboksilat membentuk ester asam karboksilat. Ester asam karboksilat ialah suatu senyawa yang mengandung gugus –CO2R dengan R
dapat berbentuk alkil ataupun aril.
Pada percobaan ini asam karboksilat yang digunakan berupa asam asetat yang direaksikan dengan sebuah alkohol berupa metanol menggunakan katalis asam. Untuk pembuatan metil asetat, reaksi esterifikasi yang terjadi dalam percobaan ini dan mekanisme katalis asam pada hidrolisa ester adalah sebagai berikut :
asam asetat metanol metil asetat air
Mekanisme katalis asam pada hidrolisa ester adalah sebagai berikut:
1. Oksigen karbonil diprotonasi oleh asam
2. Alkohol nukleofilik menyerang
3. Eliminasi molekul air diikuti penarikan H+ dari H
2O akan menghasilkan
ester
II.4 Variabel yang berpengaruh
1. Perbandingan mol zat pereaksi
Perbandingan mol zat pereaksi akan mempengaruhi hasil reaksi. Bila ditinjau dari segi kesetimbangan. Dalam penjelasan Le Chateleur, yang lebih sering dikenal dengan prinsip atau asas Le Chateleur, jika suatu system dalam kesetimbangan, diganggu dari luar sistem, maka sistem tersebut akan berusaha menghilangkan gangguan sampai dicapai kesetimbangan baru. Salah satu gangguan dari luar yang dapat mempengaruhi kesetimbangan adalah perubahan mol reaktan. Reaksi esterifikasi antara asam asetat dan alkohol (metanol) dapat bergeser ke kanan dengan cara memberikan alkohol berlebih. Pemakaian salah satu reaktan berlebih akan memperbesar kemungkinan tumbukan antar molekul zat yang bereaksi sehingga kecepatan reaksinya bertambah besar. Selain itu dikarenakan sifatnya reversible dan harga alkohol lebih murah maka alkohol dibuat berlebih agar optimal dalam pembentukan produk ester yang ingin dihasilkan atau konversi maksimum
(www.chemical-engineer.digitalzones.com/biodiesel.html) 2. Konsentrasi katalis
Katalis berfungsi untuk menurunkan energi aktivasi sehingga reaksi berjalan lebih cepat. Besarnya konsentrasi katalis dapat mempengaruhi kecepatan reaksi.
3. Kecepatan pengadukan
Pengadukan dilakukan untuk memperbesar kemungkinan terjadinya tumbukan molekul pereaksi, sehingga kecepatan reaksinya bertambah besar.
LABORATORIUM PROSES KIMIA 2014 7
Dalam rentang suhu yang diinginkan, jika suhu reaksi semakin tinggi maka kecepatan reaksi akan semakin besar, sehingga reaksi akan berjalan semakin cepat.
BAB III
METODE PERCOBAAN
III.1 Bahan dan Alat yang DigunakanIII.1.1 Bahan yang digunakan:
1. Asam asetat @108,5ml 2. Metanol @149 ml 3. HCl @13,5 ml 4. NaOH 0,21 N 500 ml 5. Indikator PP @3 tetes 6. Aquadest secukupnya
III.1.2 Alat yang digunakan: 1. Labu leher tiga 2. Pendingin balik 3. Kompor listrik 4. Magnetic stirrer 5. Termometer 6. Pengaduk
7. Buret, statif, dan klem 8. Pipet tetes dan pipet ukur 9. Erlenmeyer
10. Beaker glass
III.2 Gambar Alat
LABORATORIUM PROSES KIMIA 2014 9
Keterangan : 1. Labu leher tiga 2. Pendingin balik 3. Termometer 4. Heater 5. Magnetic stirrer 6. Statif 7. Waterbath
III.3 Variabel Operasi
a. Variabel tetap
Katalis : HCl 0,4 N 25%
Volume total : 271 ml
Volume sampel diambil : 5 ml
Waktu pengambilan sampel : 14 menit
Perbandingan mol asam asetat : metanol : 1,1 : 2,1
Jenis alkohol : Metanol 96%
b. Variabel berubah
Suhu : 51°C dan 61°C
III.4 Respon Uji Hasil
Mengamati konsentrasi sisa asam asetat (CH3COOH) dengan titrasi menggunakan
NaOH.
III.5 Cara Kerja
1. Merangkai alat seperti gambar
2. Mencampurkan asam asetat 108,5 ml dan katalis HCl 13,5 ml di dalam labu leher tiga panaskan sampai suhunya 51°C
3. Memanaskan metanol 149 ml dalam beaker glass sampai suhunya 51°C
4. Setelah suhu kedua reaktan sama, kedua rekatan tersebuat dicampurkan ke dalam labu leher tiga
5. Suhu campuran diamati sampai tercapai suhu 51°C. Setelah tercapai suhu 51°C, sampel diambil 5 ml sebagai t0menit dan dengan waktu pengambilan setiap 14
menit dan suhu selalu dipertahankan 51°C sampai t52menit. Jadi ada 5 kali titrasi.
Keterangan : 1. Statif 2. Klem 3. Buret 4. Erlenmeyer
6. Metode analisis
Mengambil 5 ml sampel lalu ditambahkan 3 tetes indikator PP, kemudian sampel dititrasi dengan NaOH 0,21 N. Amati perubahan warna yang terjadi yaitu dari tidak berwarna menjadi warna merah muda hampir hilang. Catat kebutuhan titran. Menghentikan pengambilan sampel setelah diperoleh hasil volume titran sebanyak 5 kali, yaitu pada menit ke 52.
LABORATORIUM PROSES KIMIA 2014 11
BAB IV
HASIL PERCOBAAN DAN PEMBAHASAN
IV.1 Hasil Percobaana. Variabel 1 (suhu reaksi 51oC)
Tabel 4.1 Hasil percobaan variabel 1 (suhu reaksi 51oC) t (menit) Volume titran (ml) CA= 0,042v – 0,4 XA
0 109,5 4,199 0,394258511
13 99,1 3,7622 0,457270629
26 93,3 3,5186 0,492412002
39 79,8 2,9516 0,574206578
52 65,8 2,3636 0,659030583
Tabel 4.2 Nilai konstanta kesetimbangan dan laju reaksi variabel 1
K k1 (mol/menit) k2 (mol/menit)
1,0182 4,65 x 10-3 4,56 x 10-3
b. Variabel 2 (suhu reaksi 61oC)
Tabel 4.3 Hasil percobaan variabel 2 (suhu reaksi 61oC) t (menit) Volume titran (ml) CA= 0,042v – 0,4 XA
0 97,2 3,6824 0,468782458
13 93,5 3,527 0,491200231
26 88,3 3,3086 0,52270629
39 75,5 2,771 0,600259665
52 62,9 2,2418 0,676601269
Tabel 4.4 Nilai konstanta kesetimbangan dan laju reaksi variabel 2
K k1 (mol/menit) k2 (mol/menit)
IV.2 Pembahasan
IV.2.1 Pengaruh Waktu Reaksi terhadap Konversi
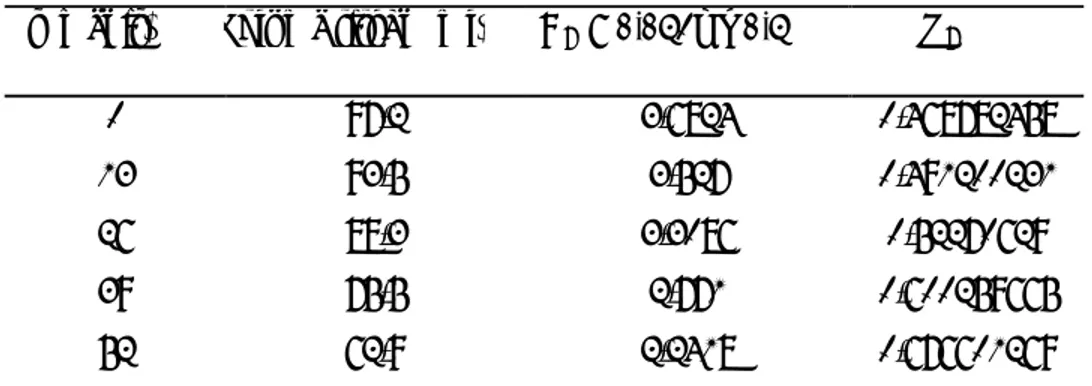
Gambar 4.1 Hubungan waktu dan konversi esterifikasi
Gambar 4.1 menunjukkan grafik hubungan waktu terhadap konversi ester yang terbentuk yang cenderung naik, baik pada suhu 51°C dan 61°C. Pada suhu 51°C ester yang terkonversi pada menit ke 52 sebesar 0,659, sedangkan pada suhu 61°C ester yang terkonversi sebesar 0,6766.
Berdasarkan Gambar 4.1 semakin lama waktu reaksi esterifikasi yang terjadi maka konversi senyawa ester (metil asetat) yang dihasilkan akan semakin besar pula. Selain itu pada Gambar 4.1 juga dapat dilihat bahwa kurva perbandingan ester yang terkonversi pada suhu 51°C lebih besar dibandingkan dengan suhu 61°C.
Konversi ester yang terbentuk semakin besar seiring dengan bertambahnya waktu dikarenakan semakin lama waktu reaksi yang diberikan maka jumlah tumbukan yang terjadi antar zat reaktan yaitu asam asetat dan metanol semakin banyak sehingga mengakibatkan reaktan yang bereaksi semakin banyak pula sehingga konversi yang dihasilkan semakin besar. Semakin lama waktu reaksi, molekul akan memperoleh tambahan kesempatan untuk bergerak lebih dan meningkatkan energi kinetik yang dihasilkan. Karena kesempatan untuk bergerak lebih maka kesempatan untuk bertumbukan makin besar pula, sehingga konversi untuk menghasilkan metil asetat semakin besar pula.
Kenaikan konversi selama reaksi esterifikasi dapat dibuktikan dengan jumlah titran NaOH pada percobaan yang semakin menurun. Titran NaOH digunakan untuk mengamati konsentrasi sisa asam asetat (CH3COOH). Titrasi
ini berdasarkan reaksi acidi alkalimetri (asam-basa), NaOH sebagai basa akan 0 0.2 0.4 0.6 0.8 0 13 26 39 52 Ko nv er si (XA ) t (menit) suhu 51 C suhu 61 C
LABORATORIUM PROSES KIMIA 2014 13
bereaksi dengan asam asetat sisa. Apabila jumlah kebutuhan NaOH semakin sedikit karena asam asetat yang sisa juga semakin sedikit karena telah bereaksi dengan metanol membentuk ester (Hikmah dan Zuliyana, 2012).
IV.2.2 Pengaruh Variabel Suhu Reaksi terhadap Konversi
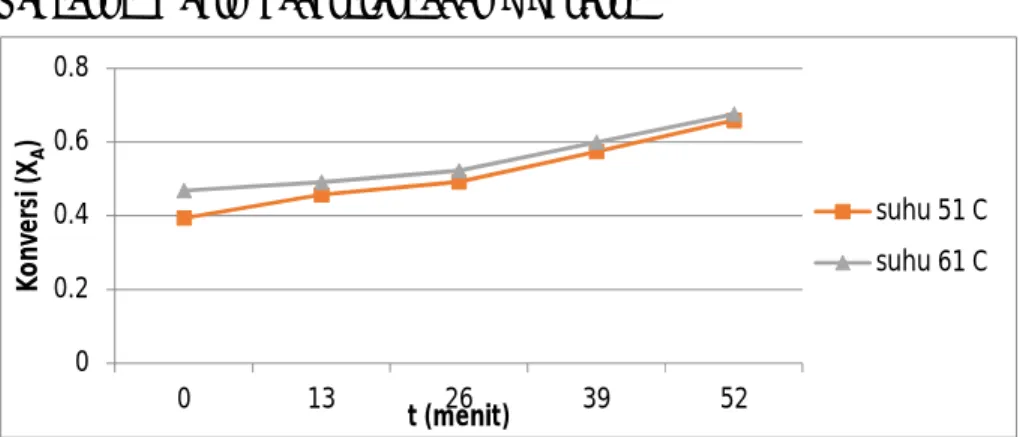
Gambar 4.2 Hubungan variabel suhu terhadap konversi esterifikasi
Gambar 4.2 menunjukkan grafik hubungan variabel suhu terhadap konversi ester yang terbentuk yang cenderung naik, baik pada suhu 51°C dan 61°C. Pada suhu 51°C ester yang terkonversi pada menit ke 52 sebesar 0,659, sedangkan pada suhu 61°C ester yang terkonversi sebesar 0,6766.
Dari gambar 4.2 dapat dilihat bahwa konversi asam asetat dengan metanol menjadi ester (metil asetat) dengan suhu 51°C mempunyai nilai konversi yang lebih besar daripada konverasi esterifikasi pada suhu 61°C.
Hal ini menunjukkan semakin tinggi suhu maka konversi esterifikasi juga akan meningkat untuk waktu yang sama. Hal ini sesuai dengan persamaan Arrhenius :
k = A exp (-Ea/RT)
Peningkatan suhu menyebabkan tumbukan antar partikel semakin besar, sehingga reaksi berjalan semakin cepat dan konstanta reaksi semakin besar. Peningkatan laju reaksi ini disebabkan oleh meningkatnya konstanta laju reaksi yang merupakan fungsi dari temperatur. Semakin tinggi temperaturnya, maka semakin besar konstanta laju reaksinya. Sehingga dapat disimpulkan bahwa suhu dapat mempercepat kecepatan reaksi untuk membentuk produk ester (metil asetat). Semakin banyak metil asetat yang terbentuk menunjukkan bahwa konversi esterifikasinya semakin besar (Hikmah dan Zuliyana, 2012).
0 0.2 0.4 0.6 0.8 0 13 26 39 52 Ko nv er si (XA ) t (menit) suhu 51 C suhu 61 C
IV.2.3 Pengaruh Variabel Suhu terhadap Konstanta Laju Reaksi
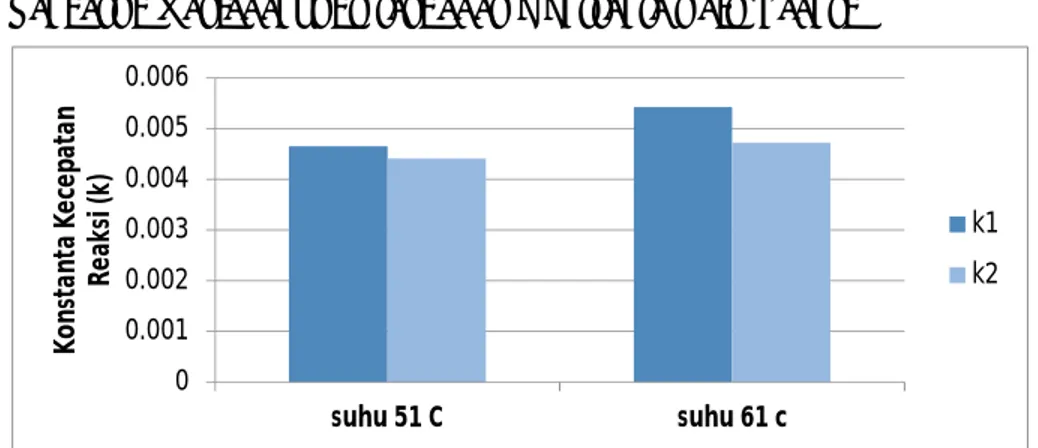
Gambar 4.3 Hubungan variabel suhu terhadap konstanta laju reaksi esterifikasi Gambar 4.3 menunjukkan hubungan variabel suhu dengan konstanta laju reaksi (k1 dan k2). Berdasarkan Gambar 4.3 saat suhu 51oC harga k1
sebesar 4,65×10-3 mol/menit dan k2 sebesar 4,56×10-3 mol/menit. Sedangkan
saat suhu 61oC harga k1 sebesar 5,42×10-3 mol/menit dan harga k2 sebesar
4,72×10-3 mol/menit.
Berdasarkan Gambar 4.3 konstanta laju reaksi (k1 dan k2) saat suhu
61oC lebih tinggi daripada saat suhu 51oC. Hal ini sesuai dengan teori yang
mengatakan bahwa konstanta laju reaksi bertambah besar seiring dengan naiknya suhu operasi. Dimana teori tersebut sesuai dengan persamaan Arhenius:
? = ? ?−? ?? ?
Dimana: A = Faktor frekuensi tumbukan
T = Suhu
EA = Energi Aktivasi
R = konstanta tetapan gas
Peningkatan suhu menyebabkan tumbukan antar partikel semakin besar, sehingga reaksi berjalan semakin cepat. Peningkatan laju reaksi ini disebabkan oleh meningkatnya konstanta laju reaksi yang merupakan fungsi dari temperatur. Semakin tinggi temperaturnya, maka semakin besar konstanta laju reaksinya.
Peningkatan suhu mengakibatkan energi aktivasi dari reaksi akan menurun, sehingga reaksi pembentukan produk (metil asetat) akan berjalan lebih cepat. Artinya reaksi akan cenderung berjalan lebih cepat ke kanan atau ke arah produk (k1). Dengan demikian reaksi yang berjalan ke kiri atau reaksi
0 0.001 0.002 0.003 0.004 0.005 0.006 suhu 51 C suhu 61 c Ko ns ta nt a Ke ce pa ta n Re ak si (k ) k1 k2
LABORATORIUM PROSES KIMIA 2014 15
penguraian produk berlangsung lebih lambat (k2). Hal ini menunjukkan bahwa
peningkatan suhu mempercepat reaksi ke arah kanan antara asam asetat dengan metanol (k1) dan memperlambat reaksi ke arah kiri antara senyawa ester
dengan air (k2). Sehingga dapat disimpulkan bahwa suhu dapat mempercepat
kecepatan reaksi untuk membentuk produk (metil asetat) dan memperlambat kecepatan reaksi penguraian produk.
(Hikmah dan Zuliyana, 2012) (Nuryoto, dkk. 2011)
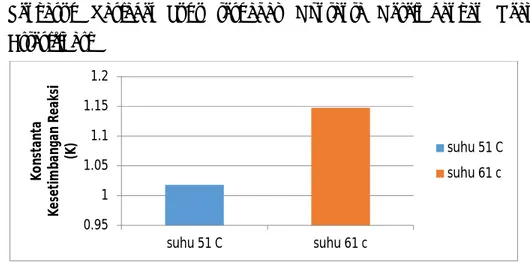
IV.2.4 Pengaruh Variabel Suhu terhadap Kontanta Keseimbangan Reaksi Esterifikasi
Gambar 4.4 Hubungan variabel suhu terhadap konstanta kesetimbangan esterifikasi
Gambar 4.4 menunjukkan hubungan variabel suhu dengan konstanta kesetimbangan (K). Pada saat suhu 51oC harga K sebesar 1,0182 dan saat suhu
61oC harga K sebesar 1,1477. Kedua nilai konstanta kesetimbangan tersebut
memiliki nilai K > 1 maka reaksi kesetimbangan mengarah ke produk (metil asetat). Nilai konstanta kesetimbangan (K) pada suhu 61oC lebih besar dari suhu 51oC.
Berdasarkan Gambar 4.4 semakin tinggi suhu maka konstanta keseimbangan reaksi akan meningkat. Hal tersebut terjadi karena menurut persamaan Arrhenius r=AoCACBexp(-E/RT) saat suhu dinaikkan, maka laju
reaksi akan meningkat, sehingga reaksi ke kanan ke arah produk akan lebih cepat terjadi atau Cc.CD meningkat menurut persamaan reaksi:
A + B C + D 0.95 1 1.05 1.1 1.15 1.2 suhu 51 C suhu 61 c Ko ns ta nt a Ke se tim ba ng an R ea ks i (K ) suhu 51 C suhu 61 c
Menurut persamaan ? =? ? .? ?
? ? .? ?, konstanta kesetimbangan dirumuskan sebagai konsentrasi produk (Cc.CD) dibagi dengan konsentrasi reaktan (CA.CB).
Apabila reaksi bergeser ke kanan karena meningkatnya suhu maka konsentrasi produk yaitu konsentrasi C dan konsentrasi D juga akan meningkat. Konstanta kesetimbangan berbanding lurus dengan konsentrasi produk sehingga dengan meningkatnya konsentrasi produk maka konstanta kesetimbangan juga meningkat. Hal tersebut disebabkan karena dengan meningkatnya suhu maka akan meningkatkan laju rekasi ke kanan atau ke kiri dengan tanpa mengubah nilai konstanta kesetimbangan yang ada pada suatu kesetimbangan reaksi tertentu. Peningkatan suhu hanya akan mengubah waktu yang diperlukan suatu reaksi sampai selesai atau mencapai kesetimbangan.
Sehingga dapat disimpulkan bahwa semakin tinggi suhu makan reaksi akan semakin cepat terjadi sehingga semakin cepat reaksi bergeser ke arah produk dan mengakibatkan kesetimbangan lebih cepat tercapai (Hikmah dan Zuliyana, 2012).
LABORATORIUM PROSES KIMIA 2014 17
BAB V
PENUTUP
V.1 Kesimpulan1. Pada menit ke 52, suhu reaksi 51oC menghasilkan konversi sebesar 0,659 dan
suhu reaksi 61oC menghasilkan konversi sebesar 0,676. Konversi yang dihasilkan
dari produk ester akan semakin meningkat seiring dengan lama waktu reaksi karena semakin banyak tumbukan yang terjadi antar reaktan.
2. Konversi pada suhu reaksi 61oC (0,676) lebih besar bila dibandingkan dengan konversi pada suhu reaksi 51oC (0,659). Hal ini menunjukkan bahwa semakin tinggi suhu maka semakin tinggi pula konversi ester yang terbentuk karena kecepatan laju reaksinya semakin besar.
3. Laju reaksi pada suhu 61oC (k1=5,42x10-3 dan k2=4,72x10-3) lebih besar bila
dibandingkan dengan laju reaksi pada suhu 51oC (k1=4,65x10-3dan k2=4,56x10-3).
Hal ini menunjukkan bahwa semakin tinggi suhu maka semakin besar konstanta laju reaksinya karena molekul yang bertumbukan semakin banyak.
4. Konstanta kesetimbangan pada suhu 61oC (1,1477) lebih besar bila dibandingkan dengan laju reaksi pada suhu 51oC (1,0182). Hal ini menunjukkan bahwa semakin tinggi suhu maka konstanta kesetimbangan reaksinya akan meningkat karena kecepatan laju reaksinya semakin besar.
V.2 Saran
1. Pada saat praktikum titrasi dilakukan hingga mendapatkan volume titran 3 kali konstan atau konversi yang setimbang atau dengan kata lain mencapai kesetimbangan, sehingga tidak ada asumsi kesetimbangan pada saat t (waktu) ke 52. Sehingga mendapatkan kejelasan bahwa reaksi tersebut sudah setimbang. 2. Asisten harus memperhatikan praktikan yang sedang menjalani praktikum, agar
tidak mengalami kesalahan prosedur.
3. Laboran harus mengecek kembali alat-alat praktikum dengan baik, agar alat-alat yang sudah tidak berfungsi bisa diganti dengan yang baru sehingga praktikum dapat berlangsung dengan baik.
DAFTAR PUSTAKA
Hikmah, Maharani Nurul dan Zuliyana. 2012. Pembuatan Metil Ester (Biodiesel) dari Minyak Dedak dan Metanol dengan Proses Esterifikasi dan Transesterifikasi. Semarang: Universitas Diponegoro.
Nuryoto, dkk. 2011. Kinetika Reaksi Esterifikasi Gliserol dengan Asam Asetat Menggunakan Katalisator Indion 225 Na. Yogyakarta: Universitas Gadjah Mada.
Smith, J.M., Van Ness, H.C., Abbott, M.M., 2001, Introduction to Chemical Engineering Thermodynamics Sixth Edition, McGraw-Hill Co-Singapore.
Stacy, C.J., Melick, C.A., Cairncross, R.A., 2014, Esterification of Free Fatty Acids to Fatty Acid Alkyl Esters in A Bubble Column Reactor for Use As Biodiesel, Fuel Processing Technology 124 (2014) 70-77.
LABORATORIUM PROSES KIMIA 2014 19
LEMBAR PERHITUNGAN REAGEN
1. Perhitungan NaOH 0,21 N 500 mL N = ? ? ??? ? ? × 1000 ?? ?? ? ? ×ekivalensi 0,21 = ? ? ??? 40 × 1000 500 ×1 Massa = 4,2 gr
2. Perhitungan densitas metanol
???? ? ? ?= 36,16825−16,125= 0,802 ? ??? ? 3. Perhitungan densitas asam asetat
?? ?? ? ? ???? ?= 42,61825−16,125= 1,06? ??? ? 4. Perhitungan densitas katalis (HCl)
?? ? ? = 45,07−2516,125= 1,175 ? ??? ? 5. Perhitungan volume katalis 0,4 N HCl
VHCl= 1000 ×1,175 ×25 %×1 0,4 ×36,5 ×271 = 13,5 mL
6. Perhitungan volume asam asetat dan metanol Volume Total = Vasam asetat + Vmetanol + VHCl 271 mL = Vasam asetat + Vmetanol + 13,5 mL
Vasam asetat + Vmetanol = 257,5 mL Vmetanol = 257,5 mL – Vasam asetat
Perbandingan mol ? ?? ? ? ???? ? ? ?? ?ℎ? ?
=
1,1 2,1=
(? ×?? ?? ? ? ×? ? ? ? ? )? ?? ? ? ?? ?? ? ? ? ? ?? ? ? ???? ? (? ×?? ?? ? ? ×? ? ? ? ? )? ?? ? ? ? ? ? ? ?? ? ? ? 1,1 2,1=
? ? ?? ? ? ?? ?? ? ×1,06 ×0,98 60 (257,5? ? ? ? ?? ? ? ?? ?? ?)×0,802 ×0,96 32 →Vasam asetat = 108,5 mL Vmetanol = 149 mLLEMBAR PERHITUNGAN
Variabel 1 (Suhu 51oC)
Wasam asetat = ρ x Vasam asetat x kadar
= 1,06? ? ? ?× 108,5 ml × 0,98 = 112,7098 gram CA0 = ? ? ? ?? ? ? ???? ?? ? ?? ? ? ???? ? ×? (? ?)1000 CA0 = 112,7098 60 ×1000271 CA0 = 6,93 mol/L
Wmetano l = ρx Vmetanol x kadar
= 0,802 ? ? ? ?× 149 ml × 0,96 = 114,71808 gram CB0 = ? ? ? ??? ? ? ?? ? ??? ? ? ? ×? (? ?)1000 CB0 = 114,7180832 × 1000271 CB0 = 13,23 mol/L
CA = (V x N)NaOH−(Vsampel x N katalis HCL)Vsampel
= ( ? ? 0.21)− (5 ? 0.4)
5 = 0,042v – 0.4
XA = 1 -? ? 0? ? =? ? 0? ? 0−? ?
T (menit) Volume NaOH CA= 0.042v – 0.4 Xa
0 109,5 4,199 0,394258511
13 99,1 3,7622 0,457270629
26 93,3 3,5186 0,492412002
39 79,8 2,9516 0,574206578
52 65,8 2,3636 0,659030583
Menentukan Konstanta Keseimbangan
CH3COOH + C2H5OH C2H5COOCH3+ H2O
LABORATORIUM PROSES KIMIA 2014 21 CA= CAO(1-XA) = CAO– CAO.XA = 6,93(1-XA) CB= CBO– CAO.XA= 13,23 – 6,93 XA CC= CAO.XA= 6,93 XA CD= CAO.XA= 6,93 XA M = ?? ? ?? ?= 13,23 6,93 = 1,91 -?? = −? ?? ? ? = k1??? × ?? ??×?? ? ? ?? ?× ? ? ?? ? = k1??? × ?? ??×?? ?? ?? ?× ? ? ?? ? = k1??? ?(1 ??) × (?? ? ?? ? × ??) (?? ?×??)(?? ? ?×??)? ?? ?× ? ? ?? ? = k1??? ?(1 ??)? ? ? ???? ? ? ? ??? ?? ?2 ×??2 ? ? ?? ? × ? ? ?? ? = k1× ?? ?2 ? (1 ??) × ???? ? ? ? ??? ??2 ? ? ? ? ? ? ? = k1× ?? ? ? (1 ??) × ? ?? ? ?? ? ??? ??2 ? ? ? ? ? ? ? = k1×?? ? ? (1 ??) × (? ??) ??2 ? ? Pada saat kesetimbangan
k = ?? ×? ? ?? ×? ? = (?? ?.??)(?? ?.??) ?? ?(1−??)(?? ?− (?? ?.??) Konstanta Kesetimbangan K = (?? ?)2 (1−?? ?)×(? −?? ?)= (0,659)2 (1−0,659)(1,91−0,659)= 1,0182 ? ? ? ? ? = k1×?? ? ? (1 ??) × ? ?? ? ?? ? ??? ??2 ? ? ? ? ? ? ? = k1×?? ? ? (1 ??) × (? ??) ??2 ? ? Mencari Nilai XA ? ?? ? ? = ?1 ?? ? ?(1 ??)(? ??) ??2 ? ? ? ?? ? ? = ?1 × 6,93 ?(1 ??)(1,91 ??) ??2 1,0396? ? ?? ? ? = ?1 × 6,93(0,018??2 2,91?? + 1,91) ? ?? ? ? = ?1 × 0,124(??2 162,63?? + 106,74)
1 0,124? ? ?? (??2 162,63?? + 106,74) ?? ? = ?1 ? ? ? ? ? Rumus ABC (??2 162,63?? + 106,74)= (XA-0,66) (XA-161,97) 8,065 ? (? ? ?? ?2 162,63?? + 106,74)= ? ?? 0,66 + ? ? 0 ? ?? 161,97 ? ?? 0,66 + ? ?? 161,97 = ? (?? 161,97) + ? (?? 0,66) (?? 0,66)(?? 161,97) =? ?(?? 161,97A + ? ?? 0,66? ? 0,66)(?? 161,97) =(? + ? )?(? ? 161,97A 0,66? ? 0,66)(?? 161,97) A + B = 0 →B = -A 161,97A 0,66? = 1 161,97 A + 0,66? = 1 161,31A = 1 A = -0,0062 B = 0,0062
Sehingga persamaan menjadi ,
8,065 ?? ? 0,0062 ? 161,97 ? ? 0 ? ? ? ? 0,0062 ?? 0,66 ? ? ? ? ? 0 ? = ?1 × ? 0,05 ?? ?(??−161,97)(−0,66) (??−0,66)(−161,97)? = ?1 × ?→ y = mx
Menghitung laju reaksi dan konstanta kesetimbangan reaksi
t (x) XA y xy x2 0 0,394258511 0,045363937 0 0 13 0,457270629 0,058877036 0,765401 169 26 0,492412002 0,068384324 1,777992 676 39 0,574206578 0,101837303 3,971655 1521 52 0,659030583 0,325961145 16,94998 2704 Σ = 0,600423745 23,46503 5070
LABORATORIUM PROSES KIMIA 2014 23
k1= ??∑∑? 2? ?−−? ? ? ?(? ? )2 =4,65 x 10-3mol/menit
k2= ? 1? = 0,677 x 10^1,0182−5= 4,56 x 10-3mol/menit
Variabel 2(Suhu 61oC)
Wasam asetat = ρ x Vasam asetat x kadar
= 1,06? ? ? ?× 108,5 ml × 0,98 = 112,7098 gram CA0 = ? ? ? ?? ? ? ???? ?? ? ?? ? ? ???? ? ×? (? ?)1000 CA0 = 112,7098 60 ×1000271 CA0 = 6,932 mol/L
Wmetano l = ρx Vmetanol x kadar
= 0,802 ? ? ? ?× 149 ml × 0,96 = 114,71808 gram CB0 = ? ? ? ??? ? ? ?? ? ??? ? ? ? ×? (? ?)1000 CB0 = 114,7180832 × 1000271 CB0 = 13,229 mol/L
CA = (V x N)NaOH−(Vsampel x N katalis HCL)Vsampel
= ( ? ? 0.21)− (5 ? 0.4)
5 = 0,042v – 0.4
XA = 1 -? ? 0? ? =? ? 0? ? 0−? ?
T (menit) Volume NaOH CA= 0.042v – 0.4 Xa
0 97,2 3,6824 0,468782458
13 93,5 3,527 0,491200231
26 88,3 3,3086 0,52270629
39 75,5 2,771 0,600259665
52 62,9 2,2418 0,676601269
Menentukan Konstanta Keseimbangan
CH3COOH + C2H5OH C2H5COOCH3+ H2O
CA= CAO(1-XA) = CAO– CAO.XA = 6,93(1-XA) CB= CBO– CAO.XA= 13,23 – 6,93 XA CC= CAO.XA= 6,93 XA CD= CAO.XA= 6,93 XA M = ?? ? ?? ?= 13,23 6,93 = 1,91 -?? = −? ?? ? ? = k1??? × ?? ??×?? ? ? ?? ?× ? ? ?? ? = k1??? × ?? ??×?? ?? ?? ?× ? ? ?? ? = k1??? ?(1 ??) × (?? ? ?? ? × ??) (?? ?×??)(?? ? ?×??)? ?? ?× ? ? ?? ? = k1??? ?(1 ??)? ? ? ???? ? ? ? ??? ?? ?2 ×??2 ? ? ?? ? × ? ? ?? ? = k1× ?? ?2 ? (1 ??) × ???? ? ? ? ??? ??2 ? ? ? ? ? ? ? = k1× ?? ? ? (1 ??) × ? ?? ? ?? ? ??? ??2 ? ? ? ? ? ? ? = k1×?? ? ? (1 ??) × (? ??) ??2 ? ? Pada saat kesetimbangan
k = ?? ×? ? ?? ×? ? = (?? ?.??)(?? ?.??) ?? ?(1−??)(?? ?− (?? ?.??) Konstanta Kesetimbangan K = (?? ?)2 (1−?? ?)×(? −?? ?)= (0,6766)2 (1−0,6766)(1,91−0,6766)= 1,1477 ? ? ? ? ? = k1×?? ? ? (1 ??) × ? ?? ? ?? ? ??? ??2 ? ? ? ? ? ? ? = k1×?? ? ? (1 ??) × (? ??) ??2 ? ? Mencari Nilai XA ? ?? ? ? = ?1 ?? ? ?(1 ??)(? ??) ??2 ? ? ? ?? ? ? = ?1 × 6,93 ?(1 ??)(1,91 ??) ??2 1,1477? ? ?? ? ? = ?1 × 6,93(0,1287??2 2,91?? + 1,91) ? ?? ? ? = ?1 × 0,8918(??2 22,612?? + 14,842)
LABORATORIUM PROSES KIMIA 2014 25 1 0,8918? ? ?? (??2 22,612?? + 14,842) ?? ? = ?1 ? ? ? ? ? Rumus ABC (??2 22,612?? + 14,842)= (XA-0,677) (XA-21,935) 1,12 ? (? ? ?? ?2 22,612?? + 14,842)= ? ?? 0,677 + ? ? 0 ? ?? 21,935 ? ?? 0,677 + ? ?? 21,935 = ? (?? 21,935) + ? (?? 0,677) (?? 0,677)(?? 21,935) =? ??(? 21,935A + ? ?? 0,677? ? 0,677)(?? 21,935) =(? + ? )?(? ? 21,935A 0,677? ? 0,677)(?? 21,935) A + B = 0 →B = -A 21,935 A 0,677? = 1 21,935 A + 0,677 ? = 1 21,258A = 1 A = -0,047 B = 0,047
Sehingga persamaan menjadi ,
1,12 ?? ? 0,047 ? 21,935 ? ? 0 ? ? ? ? 0,047 ?? 0,677 ? ? ? ? ? 0 ? = ?1 × ? 0,0527 ?? ?(??−21,935)(−0,677) (??−0,677)(−21,935)? = ?1 × ?→ y = mx
Menghitung laju reaksi dan konstanta kesetimbangan reaksi
t (x) XA y xy x2 0 0,468782458 0,060999446 0 0 13 0,491200231 0,06694764 0,870319 169 26 0,52270629 0,076662425 1,993223 676 39 0,600259665 0,113278494 4,417861 1521 52 0,676601269 0,390286148 20,29488 2704 Σ = 1,147687915 0,708174153 5070
k1= ??∑∑? 2? ?−−? ? ? ?(? ? )2 = 5,42 x 10-3mol/menit
MATERI Esterifikasi
Disusun Oleh :
Juhnizar P. Buminata 21030112130124
Rizkia Risang Khairunnisa 21030112140041 Vicky Kartika Firdaus 21030112130146
LABORATORIUM PROSES KIMIA TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
2. Mengetahui pengaruh variabel temperatur (51°C dan 61°C) terhadap konversi ester yang terbentuk.
3. Mengetahui pengaruh variabel temperatur (51°C dan 61°C) terhadap konstanta laju reaksi (k) esterifikasi.
4. Mengetahui pengaruh variabel temperatur (51°C dan 61°C) terhadap konstanta kesetimbangan reaksi (K) esterifikasi.
II. PERCOBAAN
2.1 Bahan Yang Digunakan
1. Asam asetat @108,5ml 2. Metanol @149 ml 3. HCl @13,5 ml 4. NaOH 0,21 N 500 ml 5. Indikator PP @3 tetes 6. Aquadest secukupnya
2.2 Alat yang Digunakan
1. Labu leher tiga 2. Pendingin balik 3. Termometer 4. Heater
5. Magnetic stirrer 6. Pengaduk
7. Buret, statif, dan klem 8. Pipet tetes dan pipet ukur 9. Erlenmeyer 10. Beaker glass 2.3 Variabel Operasi a. Variabel tetap Katalis : HCl 0,4 N 25% Volume total : 271 ml
Perbandingan mol asam asetat : metanol : 1,1 : 2,1
Jenis alkohol : Metanol 96%
b. Variabel berubah
Suhu : 51°C dan 61°C
2.4 Cara Kerja
1. Merangkai alat seperti gambar
2. Mencampurkan asam asetat 108,5 ml dan katalis HCl 13,5 ml di dalam labu leher tiga panaskan sampai suhunya 51°C
3. Memanaskan metanol 149 ml dalam beaker glass sampai suhunya 51°C
4. Setelah suhu kedua reaktan sama, kedua rekatan tersebuat dicampurkan ke dalam labu leher tiga
5. Suhu campuran diamati sampai tercapai suhu 51°C. Setelah tercapai suhu 51°C, sampel diambil 5 ml sebagai t0menit dan dengan waktu pengambilan
setiap 14 menit dan suhu selalu dipertahankan 51°C sampai t52menit. Jadi ada 5
kali titrasi. 6. Metode analisis
Mengambil 5 ml sampel lalu ditambahkan 3 tetes indikator PP, kemudian sampel dititrasi dengan NaOH 0,21 N. Amati perubahan warna yang terjadi yaitu dari tidak berwarna menjadi warna merah muda hampir hilang. Catat kebutuhan titran. Menghentikan pengambilan sampel setelah diperoleh hasil volume titran sebanyak 5 kali, yaitu pada menit ke 52.
7. Ulangi langkah di atas untuk variabel suhu 61°C
2.5 Hasil Percobaan 1. Perhitungan NaOH 0,21 N 500 mL N = ? ? ??? ? ? × 1000 ?? ?? ? ? ×ekivalensi 0,21 = ? ? ??? 40 × 1000 500 ×1 Massa = 4,2 gr
2. Perhitungan densitas metanol
25 ? ? 4. Perhitungan densitas katalis (HCl)
?? ? ? = 45,07−2516,125= 1,175 ? ??? ? 5. Perhitungan volume katalis 0,4 N HCl
VHCl= 1000 ×1,175 ×25 %×1 0,4 ×36,5 ×271 = 13,5 mL
6. Perhitungan volume asam asetat dan metanol Volume Total = Vasam asetat + Vmetanol + VHCl 271 mL = Vasam asetat + Vmetanol + 13,5 mL Vasam asetat + Vmetanol = 257,5 mL
Vmetanol = 257,5 mL – Vasam asetat
Perbandingan mol ? ?? ? ? ???? ? ? ?? ?ℎ? ?
=
1,1 2,1=
(? ×? ? ?? ? ? ×? ? ? ? ? )? ?? ? ? ???? ? ? ? ? ?? ? ? ?? ?? ? (? ×? ? ?? ? ? ×? ? ? ? ?)? ?? ? ? ? ? ? ? ?? ? ? ? 1,1 2,1=
? ? ?? ? ? ?? ?? ? ×1,06 ×0,98 60 (257,5? ? ? ? ?? ? ? ?? ?? ?)×0,802 ×0,96 32 →Vasam asetat = 108,5 mL Vmetanol = 149 mL 7. Hasil PercobaanWaktu (menit) Variabel 1 (Suhu 51oC) Variabel 2 (Suhu 61oC)
0 109,5 97,2 13 99,1 93,5 26 93,3 88,3 39 79,8 75,5 52 65,8 62,9 Semarang, 16 April 2014 Praktikan Mengetahui Asisten
Juhnizar P. Rizkia Risang Vicky Kartika Mutia Anissa Marsya
ESTERIFIKASI DAN TRANSESTERIFIKASI
Maharani Nurul Hikmah (L2C308022) dan Zuliyana (L2C308041)
Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro Jln. Prof. Sudharto,Tembalang Semarang 50239, Telp/Fax (024)7460058
Pembimbing: Aprilina Purbasari, ST, MT. Abstrak
Kandungan asam lemak bebas (Free Fatty Acid (FFA)) yang tinggi menyebabkan minyak dedak padi dapat dikonversi menjadi Fatty Acid Methyl Ester (biodiesel) dengan proses esterifikasi dan transesterifikasi. Tujuan dari penelitian ini adalah memanfaatkan dedak sebagai bahan baku pembuatan biodiesel dengan proses esterifikasi dan transesterifikasi, mempelajari pengaruh waktu dan suhu pada proses esterifikasi, serta pengaruh waktu dan konsentrasi katalis dalam proses transesterifikasi. Metode yang dilakukan untuk pembuatan metil ester (biodiesel) dalam penelitian ini adalah esterifikasi kemudian dilanjutkan dengan transesterifikasi. Untuk mendapatkan minyak dedak, dilakukan proses ekstraksi dedak menggunakan methanol sebagai solvent, selanjutnya pada proses esterifikasi minyak dedak ditambahkan katalis H2SO4, tujuan proses
esterifikasi dalam penelitian ini adalah untuk mengkonversi asam lemak bebas menjadi metil ester. Setelah esterifikasi, dilanjutkan dengan transesterifikasi untuk mengkonversi trigliserida menjadi metil ester (biodiesel) dengan menambahkan NaOH sesuai dengan variabel percobaan sebagai penetral dan katalis. Variabel tetap yang digunakan dalam proses esterifikasi adalah jumlah katalis H2SO41% v/v, sedangkan dalam proses transesterifikasi
adalah suhu operasi 60 oC. Variabel berubahnya pada proses esterifikasi adalah waktu esterifikasi 60; 75; 90; 105;
120 menit dan suhu operasi 40; 45; 50; 55; 60 oC, sedangkan untuk proses transesterifikasi adalah waktu operasi
60; 75; 90; 105; 120 menit dan jumlah katalis 1,5; 1,75; 2; 2,25; 2,5 % w/w. Dalam penelitian ini, proses esterifikasi dan transesterifikasi minyak dedak dapat menghasilkan 84,93 % metil ester, komponen terbesar metil ester biodiesel didominasi metil oleat yaitu sebesar 60,61 %, waktu esterifikasi optimum untuk menghasilkan metil ester (biodiesel) adalah 60 menit dan suhu optimumnya adalah 60 oC, dan waktu optimum transesterifikasi adalah
120 menit dengan konsentrasi katalis NaOH 1,75 % w/w.
Kata kunci : minyak dedak ;asam lemak bebas; metil ester; esterifikasi; transesterifikasi Abstract
High Free fatty acid (FFA) content in rice bran oil can be converted into the Fatty Acid Methyl Ester (biodiesel) by esterification and transesterification process. The objectives of this research was to use rice bran as raw material for biodiesel production by esterification and transesterification process, studying the influence of time and temperature on the esterification process, and the influence of time and concentration of catalyst in the transesterification process. The method used to create methyl ester (biodiesel) in this research is the esterification followed by transesterification. To get the rice bran oil,done by rice bran extraction process using methanol as a solvent, then in the process of esterification of rice bran oil added H2SO4 catalyst, the
objectives of esterification process in this research is to convert free fatty acids into methyl ester. After esterification, followed by transesterification to convert triglycerides into methyl esters (biodiesel) by adding NaOH in accordance with the variables as a neutralizing and catalyst. The constant variable used in the esterification process is the amount of catalyst H2SO4 1% v/v, while in the process of transesterification is the
operating temperature of 60 oC. The manipulated variable in the esterification process is a time of esterification 60;
75; 90; 105; 120 minutes and the operating temperature of 40, 45, 50, 55, 60 oC, while the transesterification process
is the time for operation 60; 75; 90; 105; 120 minutes and amount of catalyst 1,5; 1,75; 2; 2,25; 2,5% w/w. In this research, esterification and transesterification rice bran oil can produce 84.93% methyl ester, the largest component of methyl ester biodiesel are methyl oleate 60.61%, the optimum esterification time to produce methyl esters (biodiesel) is 60 minutes and the optimum temperature is 60 oC, then optimum transesterification time is 120
minutes with the catalyst concentration of NaOH 1.75% w/w.
bakar terdiri dari metil atau etil ester, hasil transesterifikasi baik dari triakilgliserida (TG) atau esterifikasi dari asam lemak bebas (FFA) (Ma et al., 1999).
Indonesia sebagai penghasil padi terbesar ketiga di dunia memproduksi padi 54 juta ton pada tahun 2006, kemudian tahun 2007 adalah 57 juta ton (Organisasi Pangan dan Pertanian/FAO). Dengan suplai bahan baku yang melimpah maka produksi biodiesel dari minyak dedak amatlah menjanjikan. Bergantung pada varietas beras dan derajat penggilingannya, dedak padi mengandung 16%-32% berat minyak (Putrawan, 2006). Sekitar 60%-70% minyak dedak padi tidak dapat digunakan sebagai bahan m/akanan (non-edible oil) dikarenakan kestabilan dan perbedaan cara penyimpanan dedak padi (Goffman, dkk. 2003). Minyak dedak padi merupakan salah satu jenis minyak berkandungan gizi tinggi karena adanya kandungan asam lemak, komponen-komponen aktif biologis, dan komponen-komponen-komponen-komponen antioksi seperti: oryzanol, tocopherol, tocotrienol, phytosterol, polyphenol dan squalene (Goffman, dkk. 2003; Özgul dan Türkay, 1993). Tetapi dengan waktu penyimpanan yang cukup, kandungan asam lemak bebas dapat meningkat lebih dari 60%. Peningkatan asam lemak bebas secara cepat terjadi karena adanya enzim lipase yang aktif dalam dedak padi setelah proses penggilingan padi (Lakkakula, dkk. 2004). Asam lemak bebas tersebut dapat dikonversi menjadi biodiesel (metil ester) dengan esterifikasi menggunakan alkohol. Oleh karena itu, dapat dipastikan bahwa dedak merupakan bahan baku pembuatan biodiesel yang potensial. Pengaruh waktu penyimpanan dedak terhadap kandungan FFA dalam minyak dedak dapat dilihat pada tabel 1.
Tabel 1. Karakteristik Minyak Dedak Padi (SBP Board of Consultants and Engineers 1998) Waktu Penyimpanan FFA (%)
3 jam 3,0 15 hari 10,7 30 hari 18,2 49 hari 27,0 72 hari 34,3 100 hari 62,5
Pembuatan biodiesel dari minyak tanaman memiliki kasus yang berbeda-beda sesuai dengan kandungan FFA. Pada kasus minyak tanaman dengan kandungan asam lemak bebas tinggi dilakukan dua jenis proses, yaitu esterifikasi dan transesterifikasi, sedangkan untuk minyak tanaman yang kandungan asam lemak rendah dilakukan proses transesterifikasi. Proses esterifikasi dan transesterifikasi bertujuan untuk mengubah asam lemak bebas dan trigliserida dalam minyak menjadi metil ester (biodiesel) dan gliserol.
Esterifikasi adalah tahap konversi dari asam lemak bebas menjadi ester. Esterifikasi mereaksikan minyak lemak dengan alkohol. Reaksi esterifikasi dari asam lemak menjadi metil ester adalah :
RCOOH + CH3O ↔ RCOOH3 + H2O
Asam Lemak Metanol Metil Ester Air
Faktor-faktor yang berpengaruh pada reaksi esterifikasi adalah waktu reaksi, pengadukan, katalisator, dan suhu reaksi. Transesterifikasi (biasa disebut dengan alkoholisis) adalah tahap konversi dari trigliserida (minyak nabati) menjadi alkyl ester, melalui reaksi dengan alkohol, dan menghasilkan produk samping yaitu gliserol. Reaksi transesterifikasi trigliserida menjadi metil ester adalah :
Faktor-faktor yang berpengaruh pada reaksi transesterifikasi adalah pengaruh air dan asam lemak bebas, pengaruh perbandingan molar antara molar alkohol dengan bahan mentah, jenis alkohol, jenis katalis, dan temperatur. Tujuan penelitian ini adalah memanfaatkan dedak sebagai bahan baku pembuatan biodiesel dengan proses esterifikasi dan transesterifikasi, mempelajari pengaruh waktu operasi dan suhu operasi pada proses esterifikasi minyak dedak dalam pembuatan biodiesel, dan mempelajari pengaruh waktu operasi dan konsentrasi katalis NaOH pada proses transesterifikasi dalam pembuatan biodiesel.
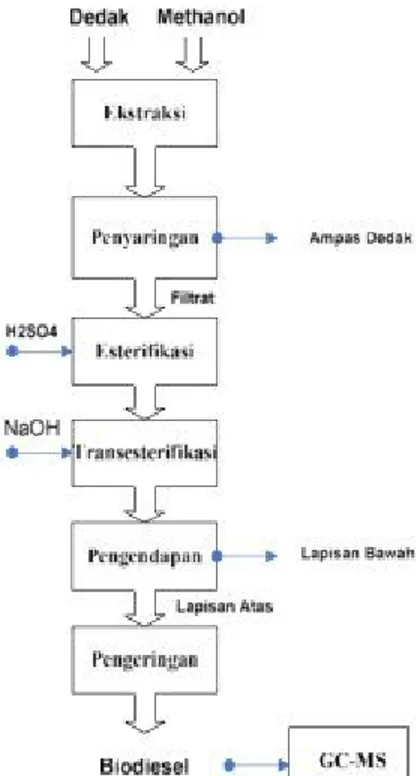
Gambar 1. Skema Pelaksanaan Penelitian
Dedak diperam selama 4 bulan untuk meningkatkan kandungan asam lemak bebas dalam dedak. Pada pembuatan biodiesel dari minyak dedak dengan menggunakan metanol ini digunakan metode esterifikasi dan transesterifikasi. Untuk proses ekstraksi, dedak dimasukkan ke dalam labu leher tiga, kemudian ditambahkan metanol dengan perbandingan berat dedak dan metanol adalah 1:5, proses ekstraksi dilakukan selama 120 menit pada suhu 60 oC. Setelah 120 menit dilakukan pemisahan sisa ampas dedak dari minyak dan metanol
menggunakan kertas saring dan akan diperoleh filtrat berupa campuran antara minyak dedak dan metanol yang berwarna kuning kecoklatan. Filtrat hasil ekstraksi dengan volume tertentu dimasukkan kembali ke dalam labu leher tiga untuk proses esterifikasi menggunakan katalis H2SO4 sebanyak 1% v/v minyak. Proses esterifikasi
berlangsung sesuai dengan variabel percobaan, yaitu selama 60; 75; 90; 105; dan 120 menit, pada suhu 40; 45; 50; 55; dan 60 oC. Selama proses esterifikasi berlangsung, dilakukan titrasi menggunakan larutan NaOH 0,1 N
setiap 15 menit untuk mengetahui konversi FFA menjadi fatty acid ester. Titik akhir titrasi ditandai dengan perubahan warna sampel dari kuning kecoklatan menjadi merah muda. Setelah proses esterifikasi, dilanjutkan dengan proses transesterifikasi dengan katalis NaOH pada suhu 60 oC, waktu dan konsentrasi katalis sesuai dengan
variabel percobaan yaitu 60; 75; 90; 105; dan 120 menit, serta konsentrasi katalis NaOH sebanyak 1,5 ; 1,75 ; 2 ; 2,25 ; 2,5 % w/w. Hasil dari reaksi transesterifikasi adalah metil ester.
Setelah proses transesterifikasi selesai, produk didiamkan selama 24 jam hingga terbentuk 2 lapisan, lapisan atas berupa metil ester dan lapisan bawah berupa gliserol. Metil ester yang terbentuk dikeringkan pada suhu 100 oC untuk menghilangkan air dan sisa metanol yang masih ada, kemudian dianalisa densitas dan kandungan
metil esternya dengan GC-MS.
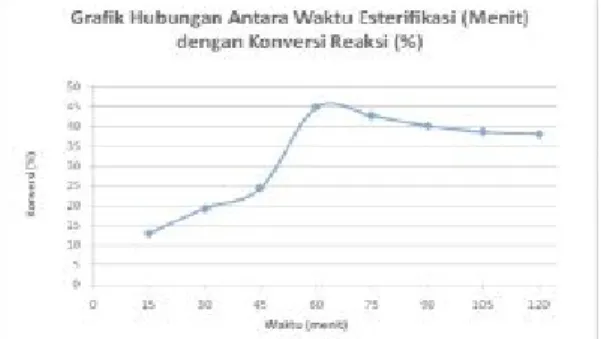
Gambar 3. Grafik Hubungan antara Waktu dan Konversi Reaksi pada Proses Esterifikasi
Berdasarkan teori semakin lama waktu reaksi, maka kemungkinan kontak antar zat semakin besar sehingga akan menghasilkan konversi yang besar. Jika kesetimbangan reaksi sudah tercapai maka dengan bertambahnya waktu reaksi tidak akan menguntungkan karena tidak memperbesar hasil. Dalam penelitian, diperoleh data bahwa selama waktu 15 menit sampai dengan 60 menit hasil konversi reaksi terus meningkat, namun pada waktu 60 menit sampai 120 menit hasil konversi reaksi semakin menurun, hal ini disebabkan karena kesetimbangan reaksi sudah tercapai dalam waktu kurang lebih 60 menit, sehingga dalam waktu yang lebih lama dari 60 menit tidak akan menguntungkan, karena tidak memperbesar hasil dan karena reaksi yang terjadi dalam proses esterifikasi adalah reversible (bolak- balik), maka apabila sudah terjadi kesetimbangan, reaksi akan bergeser ke kiri, dan akan memperkecil produk yang diperoleh.
2. Pengaruh Suhu terhadap Konversi Reaksi pada Proses Esterifikasi 60 Menit
Dari penelitian yang dilakukan, jika disajikan dalam bentuk grafik, akan diperoleh hasil sebagai berikut:
Gambar 4. Grafik Hubungan antara Suhu dan Konversi Reaksi pada Proses Esterifikasi
Percobaan untuk mempelajari pengaruh suhu reaksi esterifikasi dilakukan dengan mengubah-ubah suhu reaksi untuk setiap percobaan (40, 45, 50, 55, 60 °C). sedangkan untuk waktu esterifikasi dan jumlah katalis dibuat tetap yaitu 1 jam dan 1% v/v.
Dari grafik di atas menunjukkan bahwa semakin tinggi suhu reaksi yang dioperasikan sampai dengan 60 oC,
maka konversi metil ester semakin besar. Hal ini terjadi karena dengan naiknya suhu, maka tumbukan antar partikel semakin besar, sehingga reaksi berjalan semakin cepat dan konstanta reaksi semakin besar. Reaksi esterifikasi minyak dedak dengan methanol menjadi Fatty Acid Methyl Ester (FAME) dengan metanol merupakan reaksi endotermis (Vieville et al, 1993), sehingga apabila suhu reaksi dinaikkan, maka kesetimbangan akan bergeser ke kanan/ke produk (Dogra, 1990).
Peningkatan laju reaksi ini disebabkan oleh meningkatnya konstanta laju reaksi yang merupakan fungsi dari temperatur. Semakin tinggi temperaturnya, maka semakin besar konstanta laju reaksinya. Hal ini sesuai dengan persamaan Archenius :
Ea = energi aktivasi
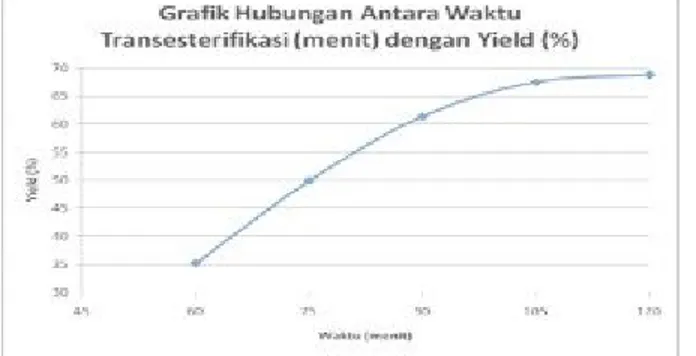
( Levenspiel, 1985 ) 3. Pengaruh Waktu terhadap Yield pada Proses Transesterifikasi (Waktu Esterifikasi 2 Jam pada Suhu 60 OC)
Dari penelitian yang dilakukan, jika disajikan dalam bentuk grafik, akan diperoleh hasil sebagai berikut:
Gambar 5. Grafik Hubungan antara Waktu dan Yield pada Proses Transesterifikasi
Untuk mempelajari pengaruh waktu reaksi transesterifikasi dilakukan dengan mengubah-ubah waktu reaksi untuk setiap percobaan ( 60, 75, 90, 105, 120 menit ), sedangkan suhu dan jumlah katalis NaOH dibuat tetap yaitu 60°C dan 2% w/w.
Dari grafik dapat dilihat bahwa semakin lama waktu transesterifikasi maka yield yang dihasilkan semakin besar. Dari titik waktu 60 menit ke 75 menit mengalami kenaikan yield yang signifikan yaitu 14,66 %, dan dari titik waktu 75 menit ke 90 menit kenaikan yield mengalami penurunan yaitu hanya sebesar 11,49 %. Demikian juga pada waktu transesterifikasi 105 menit dan 120 menit, kenaikan yield mengalami penurunan berturut- turut yaitu 6,11 % dan 1,34 %. Hal ini disebabkan karena pada waktu yang terlalu lama, sisa asam lemak bebas yang tidak ikut bereaksi pada proses esterifikasi akan bereaksi dengan NaOH membentuk sabun, sehingga yield yang terbentuk tidak mengalami kenaikan yang signifikan. Dari grafik diatas yield optimum untuk reaksi tersebut adalah pada waktu transesterifikasi 120 menit, apabila waktu transesterifikasi dilanjutkan, kemungkinan yield akan mengalami penurunan.
4. Pengaruh Konsentrasi Katalis NaOH terhadap Yield pada Proses Transesterifikasi 2 Jam
Dari penelitian yang dilakukan, jika disajikan dalam bentuk grafik, diperoleh hasil sebagai berikut :
Gambar 6. Grafik Hubungan antara Konsentrasi Katalis dan Yield pada Proses Transesterifikasi
Hasil percobaan menunjukkan bahwa pada konsentrasi katalis 1,5 % sampai 1,75%, semakin besar konsentrasi katalis NaOH, maka produk yang terbentuk juga semakin banyak, sehingga yield metil ester semakin besar. Sedangkan pada konsentrasi NaOH 1,75% sampai 2,5%, yield yang diperoleh cenderung konstan. Masih adanya asam lemak bebas sisa yang tidak bereaksi cenderung membentuk reaksi penyabunan dengan katalis NaOH dalam jumlah besar yaitu di atas 1,75%. Adanya sabun pada reaksi transesterifikasi akan menghambat pembentukan produk (metil ester) sehingga hasil yang didapat tidak menunjukkan kenaikan yang signifikan. Sabun pada hasil transesterifikasi akan meningkatkan viskositas dari biodiesel dan mengganggu pemisahan gliserol.
tabel komponen metil ester dari biodiesel yang dihasilkan :
Tabel 2. Komponen Metil Ester pada Biodiesel Berdasarkan Analisa GC MS Komponen Metil Ester Jumlah (%berat)
Metil Oleat 60,61 Metil Palmiat 21,21 Metil Stearat 3,31
Berdasarkan analisa densitas yang kami lakukan, densitas biodiesel yang dihasilkan adalah 0,86 g/ml . 4. Kesimpulan
Waktu optimum esterifikasi adalah 60 menit dengan konversi 45 % dan suhu optimum esterifikasi 60 oC
dengan konversi sebesar 44,87 %. Waktu optimum transesterifikasi adalah 90 menit dengan yield 61,4 % dan konsentrasi NaOH optimum adalah sebanyak 2,5 % dengan yield sebesar 71,15 %. Biodiesel yang dihasilkan mengandung 84,93 % metil ester, dengan komponen utamanya adalah metil oleat.
Ucapan terima kasih
Terima kasih disampaikan kepada Ibu Aprilina Purbasari, ST.MT. atas bimbingannya selama ini Daftar Pustaka
Dogra, S.K. dan S. Dogra., 1990, Kimia Fisik dan Soal-soal, Universitas Indonesia, Jakarta.
Goffman, F.D., Pinson, S., and Bergman C., 2003, Genetic Diversity for Lipid Content and Fatty Acid Profile in Rice Bran, J. Am. Oil Chem. Soc., pp. 485-490.
Lakkakula, N.R., M. Lima, T. Walker, 2004, Rice bran stabilization and rice bran oil extraction using ohmic heating, Biores. Tech., vol. 92, pp. 157-161.
Levenspiel, O., 1985, Chemical Reaction Engineering, 2nded, John Wiley and Sons, New York.
Ma, F. and Hanna, M.A., 1999, Biodiesel Production : A Review, Journal Bioresource Technology 70, pp. 1-15.
Ozgul, Y. and Turkay. S., 1993, In Situ Esterification of Rice Bran Oil with Methanol and Ethanol, J. Am. Oil Chem. Soc., pp. 145-147.
SBP Board of Consultants & Engineers, 1998, SBP Handbook Oil Seeds, Oils, Fats & Derivatives, SBP Publication Division, New Delhi.
Vieville, C., Moulooungui, Z., and Gaset, A., 1993, Etherification of Oleic Acid by Methanol Catalyzed by p-Toluenesulfonic Acid and the Cation-exchange Resin K2411 and K1481 I Supercritical Carbon Dioxide, Industrial Engineering Chemical Research, 32, 2065-2068.
1. 2. 3. 11 Juni 2014 12 Juni 2014 12 Juni 2014 Perbaiki Format Perbaiki Format ACC