LAPORAN BAKTERIOLOGI
PEMERIKSAAN Vibrio cholerae
OLEH
KELOMPOK 1
MADE INDAH KESUMA DEWI (PO7134011001) A.A.PT SINTYA DARMAYANI (PO7134011017) KOMANG BAYU HENDRAWAN (PO7134011019) NI WAYAN NENIK PRAYANTI (PO7134011021) NI KETUT SUTARIASIH (PO7134011041)
KEMENTERIAN KESEHATAN REPUBLIK INDONESIA
POLITEKNIK KESEHATAN DENPASAR
JURUSAN ANALIS KESEHATAN
2013
LEMBAR PENGESAHAN
Denpasar, 21 Juni 2012
Praktikan
Made Indah Kesuma Dewi P07134011001 ( )
A.A. Pt. Sintya Darmayani P07134011017 ( ) Komang Bayu Hendrawan P07134011019 ( )
Ni Wayan Nenik Prayanti P07134011021 ( ) Ni Ketut Sutariasih P07134011041 ( )
Pembimbing Praktikum
Penanggung Jawab
Mata Kuliah Bakteriologi
( Nyoman Mastra, SKM., S.Pd., M.Si)
BAB I PENDAHULUAN
Bakteri adalah organisme yang paling banyak jumlahnya dan lebih tersebar luas dibandingkan makhluk hidup yang lain. Bakteri memiliki ratusan ribu spesies yang hidup di darat hingga lautan dan pada tempat-tempat yang ekstrim. Bakteri ada yang menguntungkan tetapi ada pula yang merugikan. Bakteri memiliki ciri-ciri yang membedakannya dengan makhluk hidup yang lain. Bakteri adalah organisme uniselluler dan prokariot serta umumnya tidak memiliki klorofil dan berukuran renik atau mikroskopik .
Bakteri terdapat ditempat dimana manusia hidup. Terdapat pada udara yang kita hirup, pada makanan yang kita makan, juga terdapat pada permukaan kulit, pada jari tangan, pada rambut, dalam rongga mulut, usus, dalam saluran pernafasan dan pada seluruh permukaan yang terbuka dan dianggap sebagai flora normal.
Vibrio merupakan jenis bakteri yang hidupnya saprofit di air, air laut, dan tanah.
Bakteri ini juga dapat hidup di salinitas yang relatif tinggi. Sebagian besar juga bersifat halofil yang tumbuh optimal pada air laut bersalinitas 20-40‰.
Terdapatnya bakteri pathogen Vibrio di perairan laut menandakan adanya kontak dengan buangan limbah industri dan rumah tangga seperti tinja manusia atau sisa bahan makanan lainnya, di mana bakteri tersebut secara langsung akan tumbuh dan berkembang bila kondisi perairan tersebut memungkinkan. Selanjutnya dari keadaan ini kemudian akan berpengaruh terhadap biota perairan dan akhirnya pada manusia.
Penyakit saluran pencernaan akut yang disebabkan oleh bakteri dan ditandai gejala dalam bentuknya yang berat dengan onset yang tiba-tiba, diare terus menerus, cair seperti air cucian beras, tanpa sakit perut, disertai muntah dan mual di awal timbulnya penyakit. Pada kasus-kasus yang tidak diobati dengan cepat dan tepat dapat terjadi dehidrasi, asidosis, kolaps, hipoglikemi pada anak serta gagal ginjal. Infeksi tanpa gejala biasanya lebih sering terjadi daripada infeksi dengan gejala. Gejala ringan dengan hanya diare, umum terjadi, terutama dikalangan anak-anak. Pada kasus berat yang tidak diobati (kolera gravis), kematian bisa terjadi dalam beberapa jam, dan CFR-nya bisa mencapai 50 %. Dengan pengobatan tepat, angka ini kurang dari 1 %.
Berdasarkan uraian diatas maka pada praktikum ini dilakukanlah pemeriksaan
Vibrio cholera yang dimana bakteri tersebut dapat menyebabkan terjadinya penyakit
cholera pada manusia. Kolera adalah penyakit yang menyerang saluran pencernaan yang disebabkan oleh kuman vibrio cholerae.. Diagnosa ditegakkan dengan mengisolasi Vibrio
cholera dari serogrup O1 atau O139 dari tinja. Jika pemeriksaan ditunda dapat digunakan
media Cary Blairt untuk membawa atau menyimpan spesimen apus dubur (Rectal Swab).
1.1 Rumusan Masalah
1.1.1 Bagaimana teknik pemeriksaan Vibrio cholerae ? 1.1.2 Bagaimanakah hasil pemeriksaan Vibrio cholerae?
1.2 Tujuan
1.2.2 Untuk mengetahui hasil pemeriksaan hasil pemeriksaan Vibrio cholerae pada sampel rectal swab.
1.3 Manfaat
1.3.1 Manfaat teoritis
Agar dapat menambah wawasan mahasiswa dan pembaca dalam bidang mikrobiologi serta mahasiswa dapat menggunakannya sebagai referensi metode perhitungan bakteri.
1.3.2 Manfaat praktis
Mahasiswa dapat melaksanakan teknik pemeriksaan kuman patogen pada saluran pencernaan dengan menggunakan metode pemeriksaan rektal swab pada pasien.
BAB II
DASAR TEORI
2.1 Penyakit Kolera
Penyakit kolera (cholera) adalah penyakit infeksi saluran usus bersifat akut yang disebabkan oleh bakteri Vibrio cholerae, bakteri ini masuk kedalam tubuh seseorang melalui makanan atau minuman yang terkontaminasi. Bakteri tersebut mengeluarkan enterotoksin (racunnya) pada saluran usus sehingga terjadilah diare (diarrhoea) disertai
muntah yang akut dan hebat, akibatnya seseorang dalam waktu hanya beberapa hari kehilangan banyak cairan tubuh dan masuk pada kondisi dehidrasi. (Tjaniadi,2003)
Kolera dapat menyebar sebagai penyakit yang endemik, epidemik, atau pandemik. Meskipun sudah banyak penelitian bersekala besar dilakukan, namun kondisi penyakit ini tetap menjadi suatu tantangan bagi dunia kedokteran modern. Bakteri Vibrio cholerae berkembang biak dan menyebar melalui feaces (kotoran) manusia, bila kotoran yang mengandung bakteri ini mengkontaminasi air sungai dan sebagainya maka orang lain yang terjadi kontak dengan air tersebut beresiko terkena penyakit kolera itu juga. Misalnya cuci tangan yang tidak bersih lalu makan, mencuci sayuran atau makanan dengan air yang mengandung bakteri kolera, makan ikan yang hidup di air terkontaminasi bakteri kolera, Bahkan air tersebut (seperti disungai) dijadikan air minum oleh orang lain yang bermukim disekitarnya.(Tjaniadi,2003)
Pada orang yang feacesnya ditemukan bakteri kolera mungkin selama 1-2 minggu belum merasakan keluhan berarti, Tetapi saat terjadinya serangan infeksi maka tiba-tiba terjadi diare dan muntah dengan kondisi cukup serius sebagai serangan akut yang menyebabkan samarnya jenis diare yg dialami. (Tjaniadi,2003)
Akan tetapi pada penderita penyakit kolera ada beberapa hal tanda dan gejala yang ditampakkan, antara lain ialah :
• Diare yang encer dan berlimpah tanpa didahului oleh rasa mulas atau tenesmus.
• Feaces atau kotoran (tinja) yang semula berwarna dan berbau berubah menjadi cairan putih keruh (seperti air cucian beras) tanpa bau busuk ataupun amis, tetapi seperti manis yang menusuk.
• Feaces (cairan) yang menyerupai air cucian beras ini bila diendapkan akan mengeluarkan gumpalan-gumpalan putih.
• Diare terjadi berkali-kali dan dalam jumlah yang cukup banyak.
• Terjadinya muntah setelah didahului dengan diare yang terjadi, penderita tidaklah merasakan mual sebelumnya.
• Kejang otot perut bisa juga dirasakan dengan disertai nyeri yang hebat.
• Banyaknya cairan yang keluar akan menyebabkan terjadinya dehidrasi dengan tanda-tandanya seperti ; detak jantung cepat, mulut kering, lemah fisik, mata cekung,
hypotensi dan lain-lain yang bila tidak segera mendapatkan penangan pengganti cairan tubuh yang hilang dapat mengakibatkan kematian. (Tjaniadi,2003)
2.2 Bakteri Vibrio sp. • Bakteri Vibrio Klasifikasi Vibrio Kingdom : Eubacteria Divisi : Bacteri Class : Schizomycetes Ordo : Eubacteriales family : Vibrionaceae Genus : Vibrio
Spesies : Vibro anguillarum, Vibrio vulnificus, Vibrio salmonicida, Vibrio
hollisae, Vibrio alginolyticus, Vibrio damsel, Vibrio cholera Vibrio fluvialis, V. parahaemolyticus , dan Vibrio mimicus (Thompson,2004)
• Vibrio sp dalam TCBS agar (Thompson,2004)
Contoh bakteri yang dapt tumbuh pada agar TCBS beserta karakteristiknya : V. cholerae : Kuning koloni.
V. parahaemolyticus : Blue berpusat hijau koloni. V. mimicus, V. damsela : hijau koloni.
V. vulnificus : Hijau (85%) atau kuning (15%).
V. hollisae : Hijau (pertumbuhan yang sangat miskin).
• Morfologi dan Identifikasi Ciri khas organisme Vibrio
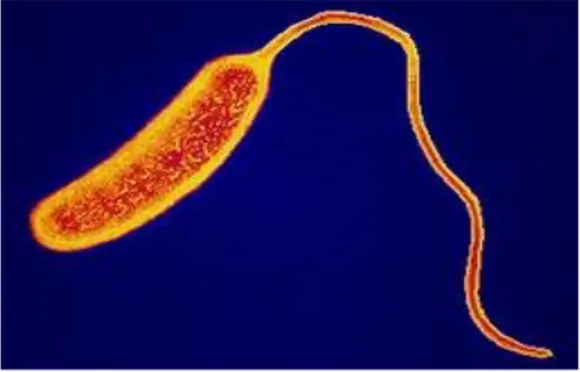
Secara umum, morfologi atau struktur tubuh dari bakteri Vibrio bila diisolir dari faeces penderita atau dari biakkan yang masih muda adalah batang bengkok seperti koma, tetapi akan berbentuk batang lurus bila diambil atau didapat dari biakan yang sudah tua. (Melnick,1996)
Mempunyai sifat Gram negatif dengan ukuran 1 – 3 x 0,4 – 0,6 µm tetapi ada beberapa literatur yang mengatakan bahwa Vibrio berukuran panjang (1,4 – 5,0) µm dan lebar (0,3 – 1,3) µm. (Melnick,1996)
Gambar bakteri Vibrio cholera
Biakan
Berdasarkan pengamatan visual terhadap bakteri pathogen spesies Vibrio, maka bakteri ini dapat dibedakan berdasarkan warna, bentuk, dan ukuran koloni yang tumbuh pada media TCBS agar setelah masa inkubasi 24 - 48 jam pada suhu kamar (30°C). TCBS adalah media yang lebih dianjurkan untuk kultur tinja, dimana sebagian besar galur menghasilkan koloni-koloni yang berwarna biru-hijau (sukrosa negatif). (Jawetz, dkk. 2005).
Dari hasil penelitian terhadap isolat bakteri Vibrio sp, ditemukan enam spesies bakteri patogen Vibrio sp, yaitu :
a. Vibrio Anguillarum
Mempunyai ciri-ciri warna putih kekuning-kuningan, bulat, menonjol dan berkilau. Karakteristik biokimia adalah mempunyai sifat fermentatif, katalase, oksidase, glukosa, laktosa, sellobiosa, galaktosa dan manitol positif. Sedangkan methyl red dan H2S negatif. (Jawetz, dkk. 2005).
b. Vibrio alginolyticus.
Mempunyai ciri-ciri berwarna kuning, diameter 3-5 mm. Karakteristik biokimia adalah mempunyai sifat fermentatif, katalase, oksidase, methyl red dan H2S, glukosa,
laktosa, dan manitol positif. Sedangkan sellobiosa, fruktosa, galaktosa negatif. (Jawetz, dkk. 2005).
c. Vibrio cholera
Mempunyai ciri-ciri yaitu berwarna kuning, datar, diameter 2-3 mm, warna media berubah menjadi kuning. Karakteristik biokimia adalah mempunyai sifat fermentatif, katalase, oksidase, methyl red dan H2S, glukosa, laktosa, galaktosa dan manitol positif. Sedangkan sellobiosa, fruktosa, bersifat negatif. (Jawetz, dkk. 2005).
d. Vibrio salmonicida
Mempunyai ciri-ciri berwarna bening, diameter < 1 mm, bulat, menonjol dan utuh. Karakteristik biokimia adalah mempunyai sifat fermentatif, katalase, oksidase, glukosa positif. Sedangkan methyl red, H2S, laktosa, galaktosa, manitol, sellobiosa, fruktosa, bersifat negatif. (Jawetz, dkk. 2005).
e. Vibrio vulnificus.
Mempunyai ciri-ciri berwarna biru sampai hijau, diameter 2-3 mm. Karakteristik biokimia adalah mempunyai sifat fermentatif, katalase, oksidase, methyl red dan H2S glukosa, sellobiosa, fruktosa, galaktosa dan manitol positif. Sedangkan, laktosa bersifat negatif. (Jawetz, dkk. 2005).
f. Vibrio parahaemolyticus.
Mempunyai ciri-ciri berwarna biru sampai hijau, diameter 3- 5 mm, dipusat koloni berwarna hijau tua. Karakteristik biokimia adalah mempunyai sifat fermentatif, katalase, oksidase, glukosa, laktosa, galaktosa dan manitol positif. Sedangkan sellobiosa, fruktosa, methyl red dan H2S bersifat negatif. Vibrio parahaemolyticus (Vp) merupakan bakteri halofilik Gram negatif.Bakteri ini tumbuh pada kadar NaCl optimum 3%, kisaran suhu 5 – 43°C,pH 4.8 – 11 dan aw 0.94 – 0.99.Pertumbuhan berlangsung cepat pada kondisi suhu optimum (37°C) dengan waktu generasi hanya 9–10 menit.Seafood yang merupakan produk hasil laut, memberikan semua kondisi yang dibutuhkan oleh Vp untuk tumbuh dan berkembang biak: keberadaan garam, nutrien yang baik serta pH dan aw yang cocok sehingga Vp sering terdapat sebagai flora normal di dalam seafood. Mereka terkonsentrasi dalam saluran pencernaan moluska, seperti kerang, tiram dan mussel yang mendapatkan makanannya dengan cara mengambil dan menyaring air laut .Strain Vp patogen merupakan penyebab penyakit gastroenteritis yang disebabkan oleh produk hasil
laut ( seafood ), terutama yang dimakan mentah, dimasak tidak sempurna atau terkontaminasi dengan seafood mentah setelah pemasakan. Gastroenteritis berlangsung akut, diare tiba-tiba dan kejang perut yang berlangsung selama 48 – 72 jam dengan masa inkubasi 8 – 72 jam. Gejala lain adalah mual, muntah, sakit kepala, badan agak panas dan dingin. Pada sebagian kecil kasus, bakteri juga menyebabkan septisemia. Sejak tahun 1997, jumlah kasus Kejadian Luar Biasa (KLB) yang disebabkan oleh Vp meningkat secara tajam di berbagai kawasan dunia.Terjadinya KLB ini telah teridentifikasi disebabkan oleh konsumsi seafood terutama tiram ( oyster ) mentah yang terkontaminasi oleh Vp.Sejak tahun 1997 tersebut, maka seafood terutama tiram dianggap sebagai jenis pangan yang penting diwaspadai dari aspek keamanan pangan.Strain Vp patogen penyebab gastroenteritis sangat beragam.Strain Vp patogen dengan serotype O3:K6 sejak tahun 1996 muncul menjadi sumber patogen baru penyebab keracunan pangan. Kasus keracunan karena Vp lebih banyak terjadi pada musim panas.Kondisi ini berkorelasi positif dengan prevalensi dan jumlah kontaminasi Vp pada sampel seafood lingkungan yang juga meningkat dengan meningkatnya suhu perairan.Tingkat salinitas air laut juga berpengaruh pada tingkat kontaminasi. Teknik analisis berpengaruh pada tingkat prevalensi dan tingkat isolasi Vp dari seafood. Untuk pengendalian tingkat kontaminasi didalam seafood, diperlukan pemilihan metode analisis yang lebih sensitifitas dengan waktu deteksi yang lebih cepat.Teknik analisis berdasarkan deteksi gen (tlh, tdh dan/atau trh) memberikan hasil yang lebih akurat untuk mendeteksi strain patogen dibandingkan dengan teknik MPN-konvensional yang berdasarkan pada reaksi biokimiawi. Pada sampel seafood dari lingkungan dan pasar ritel, Vp patogen hanya terdeteksi dalam jumlah rendah (<100 sel per-gram).Prevalensi dan tingkat kontaminasi Vp dalam sampel seafood lingkungan dan pasar ritel juga seringkali jauh lebih kecil dari batas maksimum Vp yang diijinkan FDA didalam seafood yang akan dijual (104 sel per-gram).Kondisi ini juga terjadi pada sampel yang diambil selama terjadinya. (Jawetz, dkk. 2005).
• Media Perbenihan Vibrio sp.
Bakteri Vibrio adalah jenis bakteri yang dapat hidup pada salinitas yang relatif tinggi. Menurut Rheinheiner (1985) cit. Herawati (1996), sebagian besar bakteri berpendar bersifat halofil yang tumbuh optimal pada air laut bersalinitas 20-40‰. Bakteri Vibrio berpendar termasuk bakteri anaerobic fakultatif, yaitu dapat hidup baik dengan
atau tanpa oksigen. Bakteri Vibrio tumbuh pada pH 4 - 9 dan tumbuh optimal pada pH 6,5 - 8,5 atau kondisi alkali dengan pH 9,0 (Baumann et al., 1984 cit. Herawati, 1996).
Media yang sering digunakan adalah T.C.B.S. Agar plate. Biasanya koloni Vibrio yang tumbuh pada media ini berwarna kuning, koloni sedang - besar, bulat, smooth, konveks, jernih, tepinya tipis, dilingkari oleh zone berwarna kuning, bergranula pada sinar cahaya, dan ada yang koloninya berwarna hijau. (Soemarno, 1962)
Media TCBS mempunyai pH yang sangat tinggi (8,5-9,5) yang dapat menekan pertumbuhan flora usus selain Vibrio sp. Kandungan utama terdiri dari protein nabati dan hewani, campuran garam (bile salts), 1% Sodium Chlorida, Sodium Thiosulfate, Ferric
Citrat, Sukrosa dan ekstrak kapang. Sukrosa ditambahkan sebagai bahan karbohidrat
yang dapat difermentasi oleh Vibrio dan sodium chlorida dapat merangsang pertumbuhan Vibrio dengan indikator campuran Bromothymol blue dan Thymol blue. Perubahan warna hijau menjadi kuning terjadi karena pH media bersifat basa kuat. Vibrio cholera menghasilkan koloni berwarna kuning pada media TCBS Agar disebabkan karena bakteri tersebut memfermentasi sukrosa. (Soemarno, 1962)
2.3 Flora normal pada tubuh manusia
Manusia secara konstan berhubungan dengan beribu-ribu mikroorganisme. Mikroba tidak hanya terdapat dilingkungan, tetapi juga menghuni tubuh manusia. Mikroba yang secara alamiah menghuni tubuh manusia disebut flora normal, atau mikrobiota.(Pelczar,2008)
Selain itu juga disebutkan bahwa, flora normal adalah kumpulan mikroorganisme yang secara alami terdapat pada tubuh manusia normal dan sehat. Kebanyakan flora normal yang terdapat pada tubuh manusia adalah dari jenis bakteri. Namun beberapa virus, jamur, dan protozoa juga dapat ditemukan pada orang sehat. (Pelczar,2008)
Mikrobiota normal tubuh manusia yang sehat perlu diketahui karena alasan-alasan berikut:
1. Diketahuinya hal ini dapat membantu menduga macam infeksi yang mungkin timbul setelah terjadinya kerusakan jaringan pada situs-situs yang khusus.
2. Hal ini memberikan petunjuk mengenai kemungkinan sumber dan pentingnya mikroorganisme yang teramati pada beberapa infeksi klinis. Sebagai contoh, Escherichia coli tidak berbahaya di dalam usus tetapi bila memasuki
kandung kemih dapat menyebabkansistitis, suatu peradangan pada selaput lendir organ ini.
3. Hal ini dapat membuat kita menaruh perhatian lebih besar terhadap infeksi yang disebabkan oleh mikroorganisme yang merupakan mikrobiota normal atau asli pada inang manusia. (Pelczar,2008)
Flora Normal Pada Sistem Pencernaan
Di dalam tubuh manusia, kolon atau usus besar, mengandung populasi mikrobe yang terbanyak. Telah diperkirakan bahwa jumlah mikroorganisme di dalam spesimen tinja adalah kurang lebih 1012 organisme per gram. (Pelczar,2008)
Basilus gram negatif anaerobik yang ada meliputi spesiesBacteroides (B. fragilis,
B. melaninogenicus, B. oralis) danFusobacterium. Basilus gram positif diwakili oleh
spesies-spesiesClostridium (termasuk Cl. Perfringens yang mempunyai kaitan dengan kelemayuh, suatu infeksi jaringan disertai gelembung gas dan keluar nanah) serta spesies-spesies Lactobacillus. (Pelczar,2008)
• Saat lahir, kondisi usus steril namun organism akan segera masuk bersamaan
dengan makanan yang dimakan oleh bayi. Sangatlah menarik perhatian bahwa mikrobiota usus seorang bayi yang disusui oleh ibunya hampir seluruhnya terdiri dari laktobasilus. Dengan diberikan susu botol, jumlah laktobasilus menurun dan akhirnya, dengan diberikannya makanan padat serta nutrisi tipe dewasa, maka mikrobiota gram negatif menjadi predominan. (Pelczar,2008)
• Saat menyusui, usus akan mengandung flora seperti Strptocokokki asam laktat dan
lactobacilli dalam jumlah besar. Organisme aerob dan anaerob, gram positif, non motil ini menghasilkan asam dari karbohidrat dan tahan pada pH 5,0. (Pelczar,2008)
• Pada orang dewasa, esophagus terdiri atas mikroorganisme yang masuk bersama
dengan saliva dan makanan. pH asam lambung yang di hasilkan akan melindungi terhadap infeksi bakteri pathogen usus seperti cholera. Pada duodenum terdapat 105 – 108 bakteri/gram. Pada usus halus bagian atas, lactobacillus dan enterococcus
mendominasi dan pada usus halus bagian bawah yang mendominasi adalah flora tinja. Pada kolon sigmoid dan dan rectum, terdapat sekitar 1011bakteri/gram isi
Spesies-spesies anaerobik fakultatif yang dijumpai di dalam usus tergolong dalam genus Escherichia, Proteus, Klebsiella, danEnterobacter. Peptostreptokokus (streptokokus anaerobik) juga umum. Khamir Candida albicans juga dijumpai. Flora saluran pencernaan berperan dalam sintesis vitamin K, konversi pigmen empedu dan asam empedu, absorpsi zat makanan serta antagonis mikroba patogen. (Pelczar,2008).
2.4 Pengambilan sampel rectal swab
Rectal Swab merupakan apusan yang dilakukan pada daerah rectum (+_ 2 ± 3 cm diatas lubang anus). Kuman-kuman pathogen penyebab gastroenteritis dapat diisolasi dari swab rectum. Kuman-kuman yang ditemukan dari swab rectum juga terdapat dalam saluran pencernaan. (Sri, 2005)
Teknik pengambilan sampel
Tangan kiri petugas pengambil swab membuka lubang anus dan tangan kanan memasukan lidi kapas seteril ke dalam lubang anus dengan cara memutar sampai kurang lebih 2-3 cm ke dalam lubang anus. Setelah itu lidi kapas ditarik ke luar dengan sambil tetap diputar. Selanjutnya lidi kapas tadi dimasukkan dalam media carry and blair sampai terbenam ke dalam media. Apabila lidi/ tangkainya terlalu panjang, kita potong sehingga botol bisa ditutup dengan rapat. Setelah diberi label, specimen kita bawa ke laboratorium untuk diperiksa. (Sri, 2005)
2.5 Penanaman Sampel
Identifikasi biakan mikroorganisme seringkali memerlukan pemindahan ke biakansegar tanpa terjadi pencemaran. Pemindahan mikroorganisme ini dilakukan dengan teknik aseptik untuk mempertahankan kemurnian biakan selama pemindahan berulangkali.Mikroorganisme dapat ditumbuhkan dalam biakan cair atau padat. Kekeruhan dalam kaldu menunjukkan terjadinya pertumbuhan mikroorganisme. Bila mikroorganisme menumpuk pada dasar tabung maka akan membentuk sedimen, sedangkan pada permukaan kaldupertumbuhannya terlihat sebagai pelikel (Lay, 1998).
Pertumbuhan mikroorganisme dalam kaldu seringkali menggambarkan aktivitasmetabolismenya. Mikroba aerob obligat berkembang biak pada lapisan
permukaan karenapada bagian ini kandungan oksigen tinggi. Selain dalam media cair, mikroorganisme jugamemperlihatkan pertumbuhan dengan ciri tertentu dalam biakan padat seperti agar miringatau lempengan agar. Agar miring lazimnya digunakan untuk menyimpan biakan murnisedangkan agar lempengan lazimnya digunakan untuk memurnikan mikroorganisme (Lay,1998)
Penanaman bakteri atau biasa disebut juga inokulasi adalah pekerjaan memindahkanbakteri dari medium yang lama ke medium yang baru dengan tingkat ketelitian yang sangattinggi. Untuk melakukan penanaman bakteri (inokulasi) terlebih dahulu diusakan agarsemua alat yang ada dalam hubungannya dengan medium agar tetap steril, hal ini agarmenghindari terjadinya kontaminasi (Dwijoseputro, 1998).
Ada beberapa tahap yang harus dilakukan sebelum melakukan teknik penanamanbakteri (inokulasi) yaitu :
1. Menyiapkan ruangan
Ruang tempat penanaman bakteri harus bersih dan keadannya harus steril agar tidak terjadi kesalahan dalam pengamatan atau percobaaan .dalam labotarium pembuataanserum vaksin dan sebagainya. Inokulasi dapat dilakukan dalam sebuah kotak kaca(encast ) udara yang lewat dalam kotak tersebut dilewatkan saringan melalui suatu jalanagar tekena sinar ultraviolet (Pelczar, 1986).
2. Pemindahan dengan dengan pipet
Cara ini dilakukan dalam penyelidikan air minum atau pada penyelidikan untuk diambil1 ml contoh yang akan diencerkan oleh air sebanyak 99 ml murni (Pelczar, 1986).
3. Pemindahan dengan kawat inokulasi
Ujung kawat inokulasi sebaliknya dari platina atau nikel .ujungnya boleh lurus jugaboleh berupa kolongan yang diametrnya 1-3mm. Dalam melakukuan penanaman bakterikawat ini terlebih dahulu dipijarkan sedangkan sisanya tungkai cukup dilewatkan nyalaapi saja setelah dingin kembali kawat itu disentuhkan lagi dalam nyala (Pelczar, 1986).
Ada beberapa metode yang digunakan untuk mengisolasi biakan murnimikroorganisme yaitu :
Teknik ini lebih menguntungkan jika ditinjau dari sudut ekonomi dan waktu, tetapimemerlukan ketrampilan-ketrampilan yang diperoleh dengan latihan. Penggoresan yangsempurna akan menghasilkan koloni yang terpisah. Inokulum digoreskan di permukaanmedia agar nutrien dalam cawaan petri dengan jarum pindah (lup inokulasi). Di antaragaris-garis goresan akan terdapat sel-sel yang cukup terpisah sehingga dapat tumbuhmenjadi koloni (Winarni, 1997).
Cara penggarisan dilakukan pada medium pembiakan padat bentuk lempeng. Biladilakukan dengan baik teknik inilah yang paling praktis. Dalam pengerjaannya terkadangberbeda pada masing-masing laboratorium tapi tujuannya sama yaiitu untuk membuatgoresan sebanyak mungkin pada lempeng medium pembiakan (Kus Irianto, 2006)
Teknik Penanaman dengan Goresan (Streak) bertujuan untuk mengisolasi mikroorganisme dari campurannya atau meremajakan kultur ke dalam medium baru. (Winarni, 1997).
Ada beberapa teknik metode gores (Winarni, 1997) : Goresan Sinambung
Cara kerja :
Sentuhkan inokulum loop pada koloni dan gores secara kontinyu sampai setengah permukaan agar.
Jangan pijarkan loop, lalu putar cawan 180oC lanjutkan goresan sampai habis.
Goresan sinambung umumnya digunakan bukan untuk mendapatkan koloni tunggal, melainkan untuk peremajaan ke cawan atau medium baru.
Goresan T Cara kerja :
Bagi cawan menjadi 3 bagian menggunakan spidol marker Inokulasi daerah 1 dengan streak zig-zag
Panaskan jarum inokulan dan tunggu dingin, kemudian lanjutkan streak zig-zag pada daerah 2 (streak pada gambar). Cawan diputar untuk memperoleh goresan yang sempurna
Goresan Kuadran (Streak quadrant) Cara kerja :
Hampir sama dengan goresan T, namun berpola goresan yang berbeda yaitu dibagi empat. Daerah 1 merupakan goresan awal sehingga masih mengandung banyak sel mikroorganisma.Goresan selanjutnya dipotongkan atau disilangkan dari goresan pertama sehingga jumlah semakin sedikit dan akhirnya terpisah-pisah menjadi koloni tunggal.
2. Metode tebar
Setetes inokolum diletakan dalam sebuah medium agar nutrien dalam cawanpetridish dan dengan menggunakan batang kaca yang bengkok dan steril. Inokulasi itudisebarkan dalam medium batang yang sama dapat digunakan dapat menginokulasikanpinggan kedua untuk dapat menjamin penyebaran bakteri yang merata dengan baik. Padabeberapa pinggan akan muncul koloni koloni yang terpisah-pisah (Winarni, 1997)
3. Metode tuang
Isolasi menggunakan media cair dengan cara pengenceran. Dasar melakukanpengenceran adalah penurunan jumlah mikroorganisme sehingga pada suatu saat hanyaditemukan satu sel di dalam tabung (Winarni, 1997).
4. Metode tusuk
Metode tusuk yaitu dengan dengan cara meneteskan atau menusukan ujung jarumose yang didalamnya terdapat inokolum, kemudian dimasukkan ke dalam media (Winarni,1997)
BAB III METODE 3.1. Waktu dan Tempat
3.1.1. Waktu
Praktikum ini dilaksanakan dalam dua tahap yaitu,
• Tahap 1
Pembuatan media TCBS pada Rabu, 12 Mei 2013
• Tahap 2
Penanaman pada media TCBS pada Rabu, 19 Mei 2013
• Tahap 3
Proses pengamatan makroskopis pada Senin, 21 Mei 2013
3.1.2. Tempat
Laboratorium Bakteriologi Jurusan Analis Kesehatan Poltekkes Kemenkes Denpasar
3.2 Alat dan Bahan
3.2.1 Alat-alat 1. Gelas beaker 50 ml 2. Spatel 3. Gelas Ukur 250 ml 4. Neraca Analitik 5. Batang pengaduk 6. Erlenmeyer 500 ml 7. Botol semprot 8. Plate 9. Api Bunsen 10. Pipet Ukur 11. Bola Hisap
12. Incubator 13. Pinset 14. Oven
3.1.3. Bahan
1. Media TCBS Agar
2. Sampel Rectal Swab dalam cotton buds yang dimasukkan ke dalam media Carry and Blair
3. Label
4. Kapas lemak 5. Aluminium foil 6. Kertas Koran
3.3 Cara Kerja
Pembuatan media TCBS (Thiosulfate Citrate Bile Salts ) Agar
Alat dan bahan disiapkan dan di beri label
Ditimbang sebanyak 17,6 gram bubuk media TCBS OXOID CM0333
Bubuk yang sudah ditimbang kemudian dilarutkan dengan 200 mL aquades steril
Dipanaskan di atas kompor listrik sampai larut sempurna
Pembuatan media TSI (Triple Sugar Iron)
Media dituang pada masing-masing plate ± 15 mL dan dibiarkan sampai membeku
Media siap untuk digunakan
Alat dan bahan disiapkan dan di beri label
Ditimbang 3,9 gram bubuk TSI OXOID CM0381 menggunakan gelas beaker
Dilarutkan dengan aquades dan diaduk hingga homogen
Dimasukkan ke dalam Erlenmeyer dan ditambahkan aquades sampai volumenya mencapai 60 ml
Pembuatan media SIM (Sulfur Indol Motility)
Ditutup dengan aluminium foil dan dipanaskan di atas kompor listrik sampai larut sempurna
Dipipet dengan pipet ukur masing-masing sebanyak 5 mL ke dalam 10 buah tabung reaksi
Disterilisasi pada autoclave dengan suhu 1210 C selama
15 menit
Tabung diletakkan dalam posisi miring
Media siap untuk digunakan
Ditimbang 1,8 gram bubuk SIM OXOID CM0435 pada neraca analitik dengan menggunakan gelas beaker
Dilarutkan dengan aquades dan diaduk hingga homogen
Ditutup dengan aluminium foil dan dipanaskan di atas kompor listrik sampai larut sempurna
Dipipet dengan pipet ukur masing-masing sebanyak 5 mL ke dalam 10 buah tabung reaksi
Disterilisasi pada autoclave dengan suhu 1210 C selama
15 menit
Dimasukkan ke dalam Erlenmeyer dan ditambahkan aquades sampai volumenya mencapai 60 ml
Pembuatan media Simmons Citrate Agar
Alat dan bahan disiapkan dan di beri label
Ditimbang 1,38 gram bubuk Simmons Citrate Agar OXOID CM155 dengan menggunakan gelas beaker
Dilarutkan dengan aquades dan diaduk hingga homogen
Dimasukkan ke dalam Erlenmeyer dan ditambahkan aquades sampai volumenya mencapai 60 ml
Pemeriksaan Sampel Rectal Swab
Alat dan bahan disiapkan
Lidi kapas yang berisi sampel diambil dengan pinset dan digoreskan pada media TCBS agar pada satu bagian dengan cara cotton buds dioleskan di satu titik. Ditutup dengan aluminium foil dan dipanaskan di atas
kompor listrik sampai larut sempurna
Dipipet dengan pipet ukur masing-masing sebanyak 5 mL ke dalam 10 buah tabung reaksi
Disterilisasi pada autoclave dengan suhu 1210 C selama
15 menit
BAB IV PEMBAHASAN
4.1 Hasil Pengamatan
Kemudian, diinkubasi pada incubator dengan suhu 37°C selama 2 x 24 jam
Hasil pengamatan makroskopis dicatat
Kemudian dengan menggunakan ose, titik olesan sampel rektal swab disebarkan pada empat kuadran media, proses pengerjaan dilakukan di belakang api Bunsen.
Setelah 2 x 24 jam pertumbuhan koloni pada media TCBS diamati secara makroskopis
Dari hasil pengamatan secara makroskopis pada media TCBS yang diinkubasi selam 3 × 24 jam pada suhu 37 o C di dapatkan hasil yng negative
yaitu tidak ada pertumbuhan bakteri Vibrio cholerae ataupun bakteri lainnya.
Gambar :
Kode sampel Gambar Keterangan Sampel rectal swab 1 Negative : tidak ada pertumbuhan bakteri Vibrio cholerae ataupun bakteri lainnya. Sampel rectal swab 2 Negative : tidak ada pertumbuhan bakteri Vibrio cholerae ataupun bakteri lainnya. Sampel rectal swab 3 Negative : tidak ada pertumbuhan bakteri Vibrio cholerae ataupun bakteri lainnya. 4.2 Pembahasan
4.2.1 Sampel Rectal Swab
Pemeriksaan sampel rectal swab sering dilakukan untuk mengetahui adanya bakteri pathogen pada saluran percernaan salah satu bakteri Vibrio
diperlukan dalam pemeriksaan bakteri Vibrio cholerae pada sampel rectal swab adalah
1. Persiapan Media
Media pertumbuhan mikroorganisme adalah suatu bahan yang terdiri dari campuran zat-zat makanan (nutrisi) yang diperlukan mikroorganisme untuk pertumbuhannya. Mikroorganisme memanfaatkan nutrisi media berupa molekul-molekul kecil yang dirakit untuk menyusun komponen sel. Dengan media pertumbuhan dapat dilakukan isolat mikroorganisme menjadi kultur murni dan juga memanipulasi komposisi media pertumbuhannya. Ada berbagai jenis media pertumbuhan yang akan memiliki fungsi yang berbeda-beda. Pada praktikum ini media pertumbuhan yang digunakan adalah media TCBS. Karena media TCBS ini merupakan media selektif terhadap pertumbuhan bakteri, khususnya spesies Vibrio sp.
Media TCBS mempunyai pH yang sangat tinggi (8,5-9,5) yang dapat menekan pertumbuhan flora usus selain Vibrio sp. Kandungan utama terdiri dari protein nabati dan hewani, campuran garam (bile salts), 1% Sodium Chlorida,
Sodium Thiosulfate, Ferric Citrat, Sukrosa dan ekstrak kapang. Sukrosa
ditambahkan sebagai bahan karbohidrat yang dapat difermentasi oleh Vibrio dan
sodium chlorida dapat merangsang pertumbuhan Vibrio dengan indikator
campuran Bromothymol blue dan Thymol blue.
Selain itu, media yang digunakan dalam pemeriksaan rectal swab ini adalah media Carry and Blair. Cary-Blair dianjurkan untuk pengumpulan dan pengangkutan sampel kotoran dan dubur, menjaga kelangsungan hidup Salmonella dan Shigella dalam sampel tinja. Media ini memiliki potensioksidasi / reduksi rendah, yang menjamin bakteri kelangsungan hidup untuk jangka waktu yang lama. Cary-Blair memiliki kandungan nutrisi yang rendah dan buffer fosfat, bersama dengan Natrium thioglycollate, yang menghambat pertumbuhan besar strain seperti Escherichia coli dan Klebsiella aerogenes. Agar adalah agen memperkuat.
Karena pH tinggi, Cary-Blair telah digambarkan sangat baik untuk studi epidemiologi dari Vibrio parahemolyticus, memungkinkan kelangsungan hidup jangka panjang (sampai dengan 35 hari pada suhu 22-31 ° C) dari penyeka dubur.
Cotton bud ditempatkan di bagian bawah dari tabung media transportasi yang digunakan untuk pengumpulan sampel. Kelangsungan hidup bakteri dalam media transportasi tergantung pada berbagai faktor seperti jenis bakteri dan konsentrasi dalam spesimen, formulasi media transportasi, dan transportasi suhu dan durasi. Optimal pertumbuhan dan khas morfologi hanya dapat diharapkan jika inokulasi langsung dan budidaya yang sesuai diikuti.
2. Pengambilan Sampel Rektal Swab
Rectal Swab merupakan apusan yang dilakukan pada daerah rectum (± 2- 3 cm) diatas lubang anus). Kuman-kuman pathogen penyebab gastroenteritis dapat diisolasi dari swab rectum. Kuman-kuman yang ditemukan dari swab rectum juga terdapat dalam saluran pencernaan. (Mastra,2010).
Hal yang dilakukan dalam pengambilan sampel adalah alat dan bahan yang digunakan harus dipersiapkan terlebih dahulu, seperti lidi kapas dan media carry and blair. Lidi kapas harus disterilisasi terlebih dahulu dengan oven pada suhu 150°C selama 1 jam.
Lidi kapas steril dimasukkan ke dalam media carry and blair agar basah. Hal ini dikarenakan, biasanya orang yang sehat rektumnya dalam keadaan kering sehingga kapas perlu dibasahi agar proses pengambilan sampel lebih mudah dan tidak menimbulkan rasa sakit pada rectum pasien. Kemudian, dilakukan pengambilan sampel rectal swab. Pasien yang diambil sampelnya berjumlah 4 orang. Pasien yang akan diambil sampelnya, dengan sopan disuruh bersimpuh dan menungging diatas tempat tidur. Tangan kiri petugas pengambil swab membuka lubang anus dan tangan kanan memasukan lidi kapas steril ke dalam lubang anus dengan cara memutar sampai kurang lebih 2-3 cm ke dalam lubang anus. Putaran
dilakukan searah jarum jam karena arah putaran kapas searah jarum jam. Jika dibalik, kapas bisa terlepas dan tertinggal di dalam rectal.
Setelah itu lidi kapas ditarik ke luar dengan sambil tetap diputar searah jarum jam . Selanjutnya lidi kapas tadi dimasukkan dalam media carry and blair sampai kapas terbenam ke dalam media. Apabila lidi/tangkainya terlalu panjang, lidi bisa dipotong sehingga botol bisa ditutup dengan rapat. Sebelum ditutup bibir botol sampel difiksasi dengan api Bunsen. Setelah itu, botol diberi label dan specimen kita bawa ke laboratorium untuk diperiksa.
Namun pada praktikum ini tidak dilakukan pengambilan sampel rektal swab karena telah terdapat sampel rektal swab yang siap untuk dianalisa, sampel ini ketika diperiksa sebelumnya telah menunjukkan hasil positif. Sampel rektal swab ini disimpan dalam botol coklat yang berisi media carri and blair dan sampel berada dalam cotton but, yang sisi berisi sampelnya dicelupkan ke dalam media carry and blair.
3. Inokulasi Pada Media Pertumbuhan
Identifikasi biakan mikroorganisme seringkali memerlukan pemindahan ke biakan segar tanpa terjadi pencemaran. Pemindahan mikroorganisme ini dilakukan dengan teknik aseptik untuk mempertahankan kemurnian biakan selama pemindahan berulangkali. Mikroorganisme dapat ditumbuhkan dalam biakan cair atau padat. Pada permukaan padat pertumbuhannya terlihat sebagai pelikel (Lay, 1998)
Penanaman bakteri atau biasa disebut juga inokulasi adalah pekerjaan memindahkan bakteri dari medium yang lama ke medium yang baru dengan tingkat ketelitian yang sangat tinggi. Untuk melakukan penanaman bakteri
(inokulasi) terlebih dahulu diusahakan agar semua alat yang ada dalam hubungannya dengan medium agar tetap steril, hal ini agar menghindari terjadinya kontaminasi (Dwijoseputro, 1998).
Dalam praktikum ini, inokulasi dilakukan dengan teknik Goresan Kuadran (Streak quadrant). Teknik ini dilakukan dengan cara membagi bidang media menjadi empat bagian. Kemudian, lidi kapas yang berisi sampel diambil dengan pinset dan dioleskan pada satu tempat pada media dengan mengoleskan cotton but melingkar kemudian dengan menggunakan ose disposible titik pengolesan sampel disebar dengan cara digoreskan pada keempat bidang. Tujuan dilakukan cara seperti ini adalah agar jumlah koloni yang nantinya akan tumbuh pada media tidak telalu banyak dan bertumpuk – tumpuk karena jumlah sampel yang terlalu banyak, jika disebarkan dengan menggunakan ose diharapkan nanti koloni yang tumbuh lebih mudah untuk diamati karakteristiknya. Sebelumnya ose disposible difiksasi dengan methanol karena sebelumnya kemasan ose sudah terbuka dan tidak diketahui waktu pembukaannya sehingga perlu difiksasi untuk menghindari kontaminasi bakteri lain. Lalu ditunggu hingga alkohol mongering, setelah kering baru boleh digunakan agar tidak mengganggu pertumbuhan bakteri yang diinginkan.
Daerah 1 merupakan goresan awal sehingga masih mengandung banyak sel mikroorganisme. Goresan selanjutnya dipotongkan atau disilangkan dari goresan pertama sehingga jumlah semakin sedikit dan akhirnya terpisah-pisah menjadi koloni tunggal. Media yang digunakan adalah media TCBS.
Teknik ini lebih menguntungkan jika ditinjau dari sudut ekonomi dan waktu, tetapi memerlukan ketrampilan-ketrampilan yang diperoleh dengan latihan. Penggoresan yang sempurna akan menghasilkan koloni yang terpisah. Di antara garis-garis goresan akan terdapat sel-sel yang cukup terpisah sehingga dapat tumbuh menjadi koloni (Winarni, 1997).
Sebelum benar-benar dilakukan proses kultur mikroorganisme, pertama kali kita harus mempertimbangkan bagaimana agar tidak terjadi kontaminasi. Mikroorganisme ada dimana-mana. Karena ukurannya yang sangat kecil, mereka mudah lepas dalam udara dan permukaan. Kontaminasi udara paling sering menjadi masalah karena udara selalu kontak dengan partikel debu dan umumnya
banyak komunitas mikroorganisme didalamnya. Ketika wadah dibuka maka segera ditangani agar tidak terkontaminasi dengan udara sekitar. Maka dari itu, kita harus mensterilisasikan medium kultur secepatnya. Teknik yang digunakan dalam pencegahan kontaminasi hingga kultur manipulasi dan media kultur steril disebut teknik aseptik. Hal ini dilakukan dengan cara inokulasi dilakukan didekat api Bunsen. Hal ini sangat penting untuk tindakan pencegahan sampai penanganan berikutnya media kultur harus tetap steril.
4. Inkubasi
Selanjutnya media yang telah berisi sampel rectal swab, diinkubasi selama 2 x 24 jam pada suhu 37 ºC dalam keadaan terbalik. Vibrio cholera tumbuh dengan baik pada suhu 37°C. Biakan diinkubasi dalam keadaan terbalik untuk menghindari kontaminasi dari air yang mengembun diatas cawan petri yang mungkin menetes jika cawan petri diletakan pada posisi normal. Inkubasi dilakukan selama 2 x 24 jam karena jumlah mikrobia maksimal yang dapat dihitung, optimal setelah masa tersebut yaitu akhir inkubasi. Selama masa inkubasi, sel yang masih hidup akan membentuk koloni yang dapat dilihat langsung oleh mata. (Riesama, 2009).
4.2.2 Hasil Pemeriksaan Rectal Swab
Secara umum, morfologi atau struktur tubuh dari bakteri Vibrio bila diisolir dari faeces penderita atau dari biakkan yang masih muda adalah batang bengkok seperti koma, tetapi akan berbentuk batang lurus bila diambil atau didapat dari biakan yang sudah tua. Mempunyai sifat Gram negatif dengan ukuran 1 – 3 x 0,4 – 0,6 µm tetapi ada beberapa literatur yang mengatakan bahwa Vibrio berukuran panjang (1,4 – 5,0) µm dan lebar (0,3 – 1,3) µm.
Untuk melakukan isolasi dan pemeliharaan vibrio, dapat menggunakan media Thiosulfate Citrate Bile Salts Agar (TCBS) yang merupakan media selektif untuk isolasi dan pemurnian Vibrio. Vibrio mampu menggunakan sukrosa sebagai sumber karbon akan berwarna kuning, sedangkan yang lainnya berwarna hijau.
Akan tetapi terdapat beberapa mikrob yang juga dapat tumbuh pada media ini, seperti Staphylococcus, Flavobacterium, Pseudoalteromonas, and Shewanella. Sedangkan untuk perbanyakan Vibrio, dapat digunakan media Alkaline Peptone
Water (APW) yang memiliki pH relatif tinggi, yaitu berkisar 8.4 dan mengandung
NaCl sebesar 1-2%. Adapun pertumbuhan optimum vibrio adalah pada suhu berkisar antara 20- 35oC. Pemeriksaan dinyatakan positif Vibrio cholerae apabila
pada media Thiosulfate Citrate Bile Salts Agar (TCBS) ditemukan koloni sedang sampai besar, berwarna kuning, jernih, smooth, keping, tepinya tipis, dilingkari oleh zona yang berwarna kuning. Perubahan warna hijau menjadi kuning terjadi karena pH media bersifat basa kuat. Vibrio cholera menghasilkan koloni berwarna kuning pada media TCBS Agar disebabkan karena bakteri tersebut memfermentasi sukrosa.
Dalam praktikum ini, dari tiga sampel yang telah diperiksa menunjukkan hasil yang negative dimana pada media TCBS tidak terdapat koloni bakteri yang tumbuh satupun media, TCBS setelah diinkubasi 2 X 24 jam tidak terjadi pertumbuhan koloni. Beberapa hal yang menyebabkan hal ini kemungkinan dapat terjadi adalah
1. Sampel yang sudah disimpan dalam jangka waktu yang terlalu lama, sehingga kemungkinan bakteri yang terdapat dalam cotton but tersebut telah mati, ataupun telah terkontaminasi oleh bakteri lain.
2. Pada saat penanaman bakteri pada media terjadi kesalahan, kemungkinan tidak tumbuhnya bakteri pada media TCBS disebabkan oleh karena terbunuhnya bakteri oleh karena adanya kandungan alkohol di ose, karena sebelum digunakan untuk mengores bakteri ose sempat diolesi dengan alkohol untuk desinfektan kemungkinan alkohol belum kering kan mengganggu kehidupan bakteri pada media TCBS tersebut.
Dari hasil pengamatan, dapat disimpulkan bahwa tidak terdapat bakteri yang tumbuh pada media TCBS jadi tidak terdapat bakteri Vibrio cholerae pada sampel rektal swab yang kita periksa pada praktikum ini. Namun untuk mendapatkan hasil pemeriksaan yang lebih pasti sebaiknya dilakukan
pemeriksaan ulang dengan tidak mengulang kesalahan yang dilakukan pada pemeriksaan pertama, jika hasilnya tetap sama hasil dapat disimpulkan tidak terdapat bakteri Vibrio cholerae pada sampel rektal swab yang kita periksa.
BAB V
PENUTUP
5.1 Simpulan
1. Pemeriksaan sampel rectal swab pada praktikum ini dilakukan dengan menggunakan media TCBS untuk mengetahui ada tidaknya bakteri, khususnya Vibrio Cholera. Setelah sampel diinokulasikan pada media TCBS dengan metode gores, media diinkubasi dalam suhu 37oC selama 2
× 24 jam. Dan diamati koloni yang tumbuh di dalam media tersebut.
2. Hasil pengamatan makroskopis yang dilakukan pada media TCBS yang telah diinkubasi didapatkan hasil bahwa tidak terdapat koloni yang tumbuh pada media TCBS, hal ini kemungkinan memang tidak terdapat bakteri Vibrio cholera pada sampel atau terjadi kesalahan pada prosedur kerja dan pengaruh dari sampel yang sudah disimpan terlalu lama. Sebaiknya dilakukan pemeriksaan pengulangan pada sampel yang sama untuk mendapatkan hasil yang pasti.
5.2 Saran
Dalam melaksanakan praktikum, sebaiknya sebelum melakukan praktikum di laboratorium mahasiswa diberi penjelasan secara mekanisme kerja yang benar terlebih dahulu hal – hal apa saja yang dilakukan ketika praktikum, sehingga praktikum dapat berjalan lancar dan menunjukkan hasil yang maksimal.
DAFTAR PUSTAKA
(Michael J. Pelczar, Jr. dan E.C.S Chan, Dasar-Dasar Mikrobiologi, 2008: 545 Anonim.tt. http://ankes09.blogspot.com/2010/01/media-selektif.html diakses pada
20 Mei 2013
Anonim.tt. http://www.fkh.unair.ac.id/artikel/Ainul%20060710372.pdf. diakses pada 20 Mei 2013
Jawetz, Melnick and Adelberg’s, 2005. Mikrobiologi Kedokteran (Medical
Michael J. Pelczar and E.C.S Chan. 2008. Dasar-Dasar Mikrobiologi Jilid 2. Jakarta: UI-Press
Staf Pengajar Fakultas Kedokteran UI. 1994. Mikrobiologi Kedokteran Edisi Revisi. Jakarta: Bina Rupa Aksara.