ANALISA KOMPONEN BIOAKTIF
PANGAN FUNGSIONAL
Kompetensi yang diharapkan :
•
Mahasiswa
mampu
menjelaskan
metode
pengujian
komponen
bioaktif pangan fungsional
METODE ANALISIS
Tipe Analisis Ruang Lingkup
Metode Parameter
Micro of trace Konstituen mikro
Kromatografi dan Spektroskopi
Sifat kimia dari komponen
Macro Konstituen
Major
Fisiko-kimia, analisis termal
Sifat kimia, perilaku termal
Bulk Produk Reologi Tekstur,
viskositas
Pengembangan Metode
Analisis sesuai Metode
Dokumentasi
Kontrol Mutu secara Statistik
Jaminan Mutu
Tidak diperlukan pengulangan setiap kali analisis dilakukan
Variasi dari satu lab dengan lab yang lain harus dihindari dan hasilnya harus dapat diulang
Dapat dilakukan pengembangan dengan perubahan sesuai kebutuhan
Korelasi fungsi dan konstituen kimia dikembangkan
Memberi keuntungan bagi konsumen
We Do So that
ANALISIS MIKRO
• Langkah-langkah yang harus dikerjakan adalah :
– Defenisi masalah
– Persiapan sampel yang mewakili
– Persiapan sampel atau ekstraksi
– Seleksi alat dan kondisi analisis
– Analisis berdasarkan metode yang dipilih
– Kompilasi hasil
– Metode
Pengembangan metode : Cara-cara ekstraksi :
Presipitasi Ekstraksi Solvent Ekstraksi fase padat Hati-hati dalam memilih :
Ekstraksi Analit dari Matriks
Sistem Metodologi Relefansi Keterangan
Cair Pemisahan
Cair-cair
Isolasi komponen dari matriks
Pemecahan emulsi dengan cara presipitasi atau desalting
Padat Ekstraksi
Soxhlet
Jangan ada kebocoran untuk mencegah kehilangan
KOMPONEN FENOLIK TANAMAN
• Fenoilk : komponen yang memiliki 1 atau lebih cincinaromatik dengan 1 atau lebih gugus hidroksil.
• Terdistribusi secara luas pada hampir semua jenis tanaman sebagai metabolit sekunder
• Saat ini lebih dari 8000 struktur fenolik yang dikenal, dari mulai molekul yang sederhana seperti asam fenolat hingga struktur polimer seperti tanin.
• Fenoiik tanaman biasanya terbentuk untuk melawan radiasi matahari, patogen, parasit dan ppredator, juga berkontribusi terhadap warna pada tanaman.
• Terdapat pada hampir semua bagian tanaman merupakan bagian dari diet manusia
• Berkontribusi terhadap karakteristik organoleptik, misalnya rasa pahit, astrigen (sepat) yang disebabkan interaksi
• Bereaksi dengan oksigen dan merupakan faktor kritis pada pengawetan, pematangan dan aging dari anggur (wine)
FENOLIK TANAMAN
•
Asam fenolat
•
Flavonoid
•
Tanin
•
Stilbenes
•
lignan
FLAVONOID
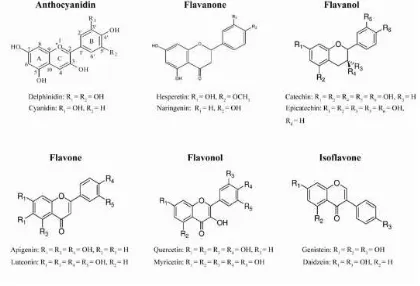
• Struktur : inti flavon tdd 15 atom C dengan 3 cincin (C6-C3-C6) yang disebut dengan A,B,C
• Tdd 6 sub kelompok : 1. Flavone 2. Flavonol 3. Flavanol 4. Flavanon 5. Isovlavon 6. Antosianin
FLAVONOID
• Quercitin adalah flavonol terdapat pada bawang, brokoli, apel
• Katekin adalah flavanol yang terdapat pada beberapa jenis buah
• Naringin flavanon yang terdapat pada grapefruit (jeruk besar)
• Cyanindin-glikosida antosianin yang terdapat pada buah2 beri seperti black currant, rasberi, blackberry dll
• Daidzein, genistein dan glisitin isoflavon pada kedelai
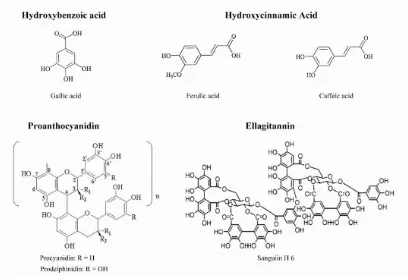
ASAM FENOLAT
• Tdd 2 kelas :1. Turunan asam benzoat : asam galat
2. Turunan asam sinamat : asam kumarat, asam kafeat dan asam ferulat
• Asam kafeat :
Diesterifikasi dengan asam quinat asam klorogenat yaitu komponen fenolik pada kopi
• Asam ferulat :
Terdapat pada serealia
Diesterifikasi menjadi hemiselulosa pada dinding sel
TANIN
• Tdd atas 2 kelompok : 1. Hydrolyzable tannin 2. Condensed tannin
• Hydrolyzable Tannin :
Komponen yang terdiri dari gugus inti glukosa atau poliol teresterifikasi lain dengan asam galat disebut gallotannin
Jika dengan hexahydoxilpenat disebut elagitannin
• Condensed Tannin :
Oligomer atau polimer dari flavon 3-ol yang berikatan dengan ikatan karbon interflavon
Dikenal sebagai asam proantosianin didekomposisi membentuk antosianin melalui reaksi oksidasi yang dikatalis asam melalui pemanasan larutan alkohol asam
Gambar. Struktur Flavonoid, Asam Fenolat dan tanin
Gambar. Struktur Stilbenes dan Lignan
EKSTRAKSI FENOLIK
• Dapat diekstrak dari sampel segar, beku atau yang dikeringkan
• Perlakuan sebelum ekstraksi : Milling, grinding, homogenisasi didahului dengan pengeringan duara atau freeze drying
• Metode ekstraski yang banyak digunakan solvent rendemen tergantung pada :
Polaritas pelarut Waktu ekstraksi Suhu
Rasio sampel : pelarut
Komposisi kimia dan sifat fisik sampel
EKSTRAKSI FENOLIK (2)
• Jenis pelarut : Metanol Etanol Aseton Etil asetat Kombinasi pelarut
Kombinasi dengan air pada berbagai proporsi
• Metanol efisien untuk komponen polifenol dengan BM rendah
• Aseton aqueous untuk flavanol dengan BM tinggi
EKSTRAKSI FENOLIK (3)
• Ekstraksi fenolik dari tanaman yang kaya akan antosianin : Pelarut organik yang diasamkan
Sistem pelarut akan mendenaturasi membran sel melarutkan antosianin dan menstabilkannya
Penambahan asam harus hati-hati karena kelebihan asam akan menghidrolisis antosianin
Asam yang digunakan : asam organik lemah : asam formiat, asam asetat, asam sitrat, asam tartarat dan asam posporik, atau asam kuat dengan konsentrasi rendah misalnya asam trifluroasetat 0.5-3%, HCl <1%
Air yang disulfurisasi dapat digunakan untuk mengurangi pelarut organik dan biaya ekstraksi
EKSTRAKSI FENOLIK (3)
• Ekstraksi fenolik dari tanaman yang kaya akan antosianin : Pelarut organik yang diasamkan
Sistem pelarut akan mendenaturasi membran sel melarutkan antosianin dan menstabilkannya
Penambahan asam harus hati-hati karena kelebihan asam akan menghidrolisis antosianin
Asam yang digunakan : asam organik lemah : asam formiat, asam asetat, asam sitrat, asam tartarat dan asam posporik, atau asam kuat dengan konsentrasi rendah misalnya asam trifluroasetat 0.5-3%, HCl <1%
Air yang disulfurisasi dapat digunakan untuk mengurangi pelarut organik dan biaya ekstraksi
EKSTRAKSI FENOLIK (4)
• Suhu ekstraksi : 20-50oC, suhu diatas 70oC akan mendegradasi
antosianin
• Metode ekstraksi : Soxhlet Maserasi Mikrowave
Ultrasound-assisted extraction (UAE) Subcritical water extraction (SWE) Pressurized Fluid Extraction (PFE) Accelerated Solvent Extraction (ASE)
Efisiensi rendah dan berpotensi mencemari lingkungan
Ultrasound-Assisted Extraction (UAE)
• Berpotensi dikembangkan tidak membutuhkan peralatan yang kompleks dan relatif murah
• Dapat digunakan untuk skala kecil maupun besar • Mekanisme :
Gaya geser akan timbul akibat kavitasi gelembung oleh propagasi gelombang akustik.
Gelembung akan kolaps melalui pengaruh fisik, kimia dan mekanis yang mengakibatkan rusaknya membran bo=iologis memudahkan ekstraksi komponen dan penetrasi pelarut ke dalam sel serta meningkatkan laju pindah massa. • Digunakan secara luas untuk ekstraski komponen fenolik dari
Pressurized Liquid Extraction (PLE)
•Istilah dalam industri Accelerated solvent extraction (ASE)
•Teknologi yang realtif baru dengan suhu dan tekanan tinggi
•Tekanan diaplikasikan untuk meningkatkan ekstraski pelarut ekstraksi pelarut > jika digunakan suhu yang lebih tinggi dari titik didih normal.
•Kombinasi tekanan tinggi (3.3-20.3 MPa) dan suhu tinggi (40-200°C) mempercepat proses dan membutuhkan sedikit pelarut (contoh : 20 menit menggunakan 10–50 mL pelarut jika dibandingkan ekstraksi tradisional yang butuh waktu 10–48 jam dan > 200 ml pelarut.
•Suhu dan tekanan tinggi meningkatkan kelarutan analit dan kinetika desporpsi dari matriks.
Subcritical Water Extraction (SWE)
•Sama dengan PLE tapi pelarut yang digunakan adalah air
•Air dipanaskan hingga suhu200°C dan terjadi perubahan konstanta dielektrik air sehingga air bersifat sebagaimana pelarut organik.
•Contoh konstanta dielektrik air pada suhu 200°C = 36 yang mendekati konstanta dielektrik metanol.
• PLE (80–100°C) menggunakan air yang diasamkan asam efektifnya dengan metanol 60% yang diasamkan untuk mengekstraksi antosianin dari kulit anggur.
•Komponen fenolik lebih mudah teroksidasi pada suhu tinggi, sehingga perlu dicegah degradasi pada kondisi PLE.
•PLE efektif digunakan untuk ekstraksi komponen fenolok pada biji anggur, apel, bayam, terung dan tepung barley.
Microwave Assited Extraction (MAE)
• Ekstraksi dengan menggunakan energi gelombang mikro untuk memudahkan pemisahan analit dari matriks sampel ke dalam pelarut.
• Keuntungan : mengurangi waktu ekstraksi dan volume pelarut jika dibandingkan metode ekstraksi konvensional.
• Digunakan untuk ekstraski fenolik : asam galatm elagat, quersitin, isoflavon dan trans-resveratrol menggunakan mikrowave pada suhu 100 °C selama 20 menit.
• Komponen fenolik yang dihasilkan memiliki susbtituen hydroksil dengan jumlah tinggi (misal tanin) dan sensitif terhadap kenaikan suhu antosianin tidak dapat diekstraksi dengan MAE
Extraction of
Extraction of phlorotannins
phlorotannins
Bubuk Bubuk AlgalAlgal (0.5 g)(0.5 g)
Pengadukan dengan
Pengadukan dengan shaker shaker menggunakan menggunakan methanol (2 ml) methanol (2 ml) pada suhu ruang selama 2 jampada suhu ruang selama 2 jam
Penambahan
Penambahan CHClCHCl3 3 (4 ml) (4 ml) pengadukan dengan tangan selama 5 menitpengadukan dengan tangan selama 5 menit
Filtratra
Filtratrasi menggunakan kapas bebas lemaksi menggunakan kapas bebas lemak
Penambahan air bebas ion
Penambahan air bebas ion 1.5 ml 1.5 ml dan pengadukan dengan tangan selama 5 menitdan pengadukan dengan tangan selama 5 menit
Pemisahan campuran antara bagian atas dan bagian bawah, lapisan atas merupakan fraksi non Pemisahan campuran antara bagian atas dan bagian bawah, lapisan atas merupakan fraksi non
lemak dikumpulkan lemak dikumpulkan
Diekstraksi 2 kali menggunakan
Diekstraksi 2 kali menggunakan ehylehyl ether (3 ml) ether (3 ml) dan ambil lapisan atas (2 kali)dan ambil lapisan atas (2 kali)
Fraksi
Fraksi ethyl ether ethyl ether dievaporasi menggunakan blower dievaporasi menggunakan blower nitrogennitrogen
P
Pemurnian
Pemurnian phlorotannins
phlorotannins
••
Analisa secara quantitatif menggunakan
Analisa secara quantitatif menggunakan
HPLC
HPLC
••
Sistem
Sistem HPLC
HPLC tdd
tdd Waters 600 pump,
Waters 600 pump,
detektor
detektor UV dan kolom
UV dan kolom and C 18.
and C 18.
••
Laju aliran
Laju aliran 1.0
1.0 mL
mL/m
/menit
enit
••
Gradien linier
Gradien linier 30
30--100% methanol
100% methanol
••
Detektor
Detektor UV
UV diatur pada
diatur pada 290 nm
290 nm
25 25
PEMISAHAN DAN PEMURNIAN
•
Dilakukan dengan kombinasi beberapa teknik
kromatografi yaitu TLC (
Thin Layer
Chromaography
) dan kromatografi kolom
(
Column Chromaography
).
KROMATOGRAFI KOLOM
• Terdiri dari fase stasioner (fase diam) dan fase mobil (fase bergerak).
• Fase diam berupa adsorben berbentuk bubuk yang dimasukkan ke dalam kolom gelas vertikal. Sampel yang akan dianalisa dimasukkan di bagian atas dari kolom ini.
• Fase bergerak adalah pelarut yang dialirkan dari atas ke kolom sehingga komponen dari bahan akan terdistribusi di antara adsorben dan pelarut dan terjadi pemisahan komponen, sedangkan pelarut akan mengalir ke bagian bawah kolom.
• Pada pemisahan ini ada komponen yang lebih cepat terelusi dan ada yang lebih lambat.
• Prinsip dasar kromatografi adalah komponen yang berbeda akan mempunyai kelaurtan dan adsorpsi yang berbeda di antara 2 fase sehingga dapat dipisahkan. Fase mobil kemudian dipaksa melalui sebuah fase sasioner yang tidak bergerak dan tidak dapat bersatu.
KROMATOGRAFI KOLOM
• Pemilihan fase didasarkan pada kelarutan komponen pada tiap fase.
THIN LAYER CHROMATIGRAPHY (TLC)
• Teknik pemisahan padat-cairan dimana fase stasioner berupa bahan padat sedangkan fase bergeraknya adalah cair.
• Bahan padat yang biasa digunakan dalam kromatografi adalah silika gel (SiO2xH2O) dan alumina (AL2O3xH2O). Kedua
adsorben ini merupakan adsorben yang bersifat polar, tetapi alumina lebih polar dibandingkan silika gel.
• Silika bersifat asam, sedangkan alumina terdapa dalam bentuk netral, basa atau asam.
• TLC merupakan teknik kromatografi yang sensitif, cepat, sederhana, murah, membutuhkan sampel dalam jumlah kecil (1-20 mg/ml), dan dengan visualisasi kimia yaitu mengekspos plate agar terjadi reaksi kimia dengan komponen akan terbentuk warna yang dapat dilihat dengan sinar ultraviole pada panjang gelombang tertentu.
THIN LAYER CHROMATIGRAPHY (TLC)
• Digunakan untuk menentukan :
banyaknya komponen di dalam campuran idenifikasi dua substansi/komponen memonitor terjadinya reaksi Efektivitas proses pemurnian
Kondisi yang sesuai untuk pemisahan dengan kolom kromatografi
Memonitor kromatografi kolom
Ekstraksi Komponen Bioaktif dari Kedele dan Tempe
•
Bahan-Bahan :
bubuk kedele kering, tempe pelarut (hexan, etanol)
pelarut/eluen untuk kromatografi kolom (hexan, etil asetat, metanol)
eluen untuk TLC (hexan, eil asetat, dikloromettan, metanol)
silika gel
Reagen untuk visualisasi (larutan sulfur atau pospomolibdat dalam etanol)
TLC
Ekstraksi Komponen Bioaktif dari Kedele dan
Tempe
• Alat-alat :
Vacuum filter funnel
Kromatografi kolom
Lampu UV (254, 365 nm)
Botol
Sprayer
Hotplate/oven
Ekstraksi Komponen Bioaktif dari Kedele dan Tempe
• Cara kerja :
Sampel dalam bentuk bubuk diekstraksi/maserasi dengan hexan dan etanol sebanyak 3 kali.
Hasil ekstraksi dievaporasi sehingga diperoleh ekstrak kasar Siapkan TLC yang dilengkapi dengan indikator fluorescense
yang akan bervisualisasi dengan lampu ulraviolet pada panjang gelombang 254 nm, dengan dua atau lebih pelarut untuk menentukan pelarut yang terbaik.
Teteskan hasil ekstraksi/maserasi pada TLC
Ambil 3 ml pelarut (MeOH, etil asetat, hexan dan lain-lain) Masukkan ke dalam beaker glass
Letakkan TLC di dalamnya, tutup dan tunggu. Jika pelarut sudah sampai 0.5 cm di bagian atas TLC, angkat TLC. Beri anda dengan pensil, kemudian dikering anginkan. Lihat di bawah lampu UV
Solvent Depan
Origin Solvent Depan
Origin
Hexan:EtOAc Hexan:DOM 1 : 1 1 : 2
Gambar. Penentuan pelarut terbaik
Metode Analisa Antioksidan
• Pengujian kapasitas antioksidan suatu senyawa dilakukan secara bertahap sebagai berikut :bertahap sebagai berikut :
1. Uji in vitro menggunakan reaksi kimia misalnya metil-linoleat, DPPH (1,1-diphenyl -2- pycrylhydrazyl)
2. Uji in vitro menggunakan materi biologis, misalnya mengukur viabilitas sel (teknik kultur sel), pembentukan dien terkonjugasi dan kadar TBARS dari isolat LDL, dll 3. Uji in vivo pada model hewan percobaan, misalnya
aktifitas enzim antioksidan, kadar TBARS 4. Uji in vivo pada manusia
Metode Analisa Antioksidan (2)
Pengujian in vitro menggunakan reaksi DPPH atau ABTS
• DPPH dan ABTS merupakan senyawa radikal yang relatif stabil.
• DPPH berwarna ungu, namun apabila DPPH tereduksi oleh suatu antioksidan akan mengakibatkan penurunan intensitas warna ungu (memudar).
Metode Analisa Antioksidan (3)
Pengujian in vitro menggunakan reaksi kimia
Dien Terkonjugasi
Oksidasi asam lemak tidak jenuh mengubah ikatan rangkap menjadi konfigurasi dien terkonjugasi atau konfigurasi trien terkonjugasi.
Konfigurasi-konfigurasi ini dapat diukur dengan spektrofotometer UV langsung atau melalui kompleks turunan dengan spektra absorpsi.
Untuk pengujian antioksidan suatu senyawa uji, senyawa tersebut diinkubasi bersama-sama dengan asam linoleat, kemudian dioksidasi oleh CuSO4. Kadar dien terkonjugasi diukur pada 245 nm setiap
interval waktu tertentu sejak penambahan CuSO4 sehingga
membentuk kurva oksidasi. Semakin besar aktivitas antioksidan ditunjukkan oleh semakin panjangnya fase lag (dalam menit) oksidasi.
Metode Analisa Antioksidan (4)
Pengujian in vitro menggunakan materi biologis
Teknik Kultur Sel
Senyawa uji dikultur bersama sel limfosit yang diisolasi dari hewan atau manusia, kemudian diukur tingkat proliferasi sel hewan atau manusia, tersebut setelah masa inkubasi tertentu.
Sebagai pembanding digunakan model yang sama namun diberi stres oksidatif menggunakan senyawa oksidator (misalnya H2O2), dan sebagai kontrol adalah model tanpa penambahan senyawa uji.
Agar dapat menerima respon/sinyal untuk berpoliferasi, sel harus memiliki membran utuh. Adanya oksidasi pada lipid penyusun struktur membran sel, mengakibatkan sel tidak dapat merespon sinyal sehingga tingkat proliferasi sel menurun.
Dengan kultur sel dapat juga diukur TBARS sebagai indikator peroksidasi lipid
Metode Analisa Antioksidan (5)
Pengujian in vitro menggunakan materi biologis
LDL Teroksidasi
Model ini menggunakan LDL yang diisolasi dari hewan atau manusia.
Senyawa uji diinkubasi bersama-sama dengan LDL, kemudian dioksidasi oleh CuSO4. Kadar dien terkonjugasi diukur pada 245 nm setiap interval waktu tertentu sejak penambahan CuSO4 sehingga membentuk kurva LDL teroksidasi.
Semakin besar aktivitas antioksidan ditunjukkan oleh semakin panjangnya fase lag (dalam menit) oksidasi.
Sebagai pembanding digunakan model yang sama namun tanpa penambahan senyawa uji
Metode Analisa Antioksidan (6)
Pengujian in vivo (menggunakan hewan percobaan atau manusia)
Mula--mula senyawa uji diberikan kepada subyek, kemudian diukur keberadaan beberapa komponen yang terlibat dalam sistem antioksidan tubuh (vitamin E, glutation, askorbat, sistem antioksidan tubuh (vitamin E, glutation, askorbat, aktivitas enzim antioksidan dan lainnya)
Indikator lainnya yaitu dari pernafasan (hidrokarbon volatil, H2O2), dari
urin (TBARS, eikosanoids) dan dari darah, dari urin (TBARS, eikosanoids) dan dari darah (TBARS, LDL teroksidasi, H (TBARS, LDL teroksidasi, H2O2), glutation dan lainnya.
Metode Analisa Antioksidan (7)
Pengujian in vivo (menggunakan hewan percobaan atau manusia)
Mula--mula senyawa uji diberikan kepada subyek, kemudian diukur keberadaan beberapa komponen yang terlibat dalam sistem antioksidan tubuh (vitamin E, glutation, askorbat, sistem antioksidan tubuh (vitamin E, glutation, askorbat, aktivitas enzim antioksidan dan lainnya)
Indikator lainnya yaitu dari pernafasan (hidrokarbon volatil, H2O2), dari
urin (TBARS, eikosanoids) dan dari darah, dari urin (TBARS, eikosanoids) dan dari darah (TBARS, LDL teroksidasi, H (TBARS, LDL teroksidasi, H2O2), glutation dan lainnya.
Apabila menggunakan hewan percobaan dapat dibandingkan dengan model yang diberi stres oksidatif dengan model yang diberi stres oksidatif.
Metode Uji Aktivitas Antimikroba
Metode Dilusi cair atau dilusi padat
• Pada prinsipnya, antibiotik diencerkan hingga diperoleh beberapa konsentrasi. Pada dilusi cair, masing-masing konsentrasi senyawa bioaktif ditambah suspensi kuman dalam media. Pada dilusi padat, tiap konsentrasi senyawa bioaktif dicampur dengan media agar, lalu ditanami kuman. Metode Difusi
• Cara Kirby Bauer
• Cara Sumuran (Cup Plate)
• Cara Pour Plate
•Skema penyiapan suspensi bakteri
Diambil 1 koloni bakteri dari stok bakteri (Staphylococcus aureus atau Escherichia coli)
Dimasukkan dalam BHI 1 ml
Diinkubasi 18-24 jam pada suhu 37ºC
Diambil 100 µl, dimasukkan dalam 1 ml BHI Diinkubasi 4-8 jam pada suhu 37ºC
Diencerkan dengan NaCl 0,9% sampai konsentrasi bakteri 108 CFU/ml
(Kekeruhan disamakan dengan Standar Mc Farland)
Diencerkan sampai 106 CFU/ml dengan BHI DS
(diperoleh suspensi bakteri dg konsentrasi 106 CFU/ml)
CONTOH
1 2 3 4 K1 K2 K3 K4
Tabung uji
+ suspensi bakteri 106 CFU/ml
Tabung kontrol
K1 : Kontrol media K2 : Kontrol pelarut K3 : Kontrol sampel K4 : Kontrol suspensi bakteri
Diinkubasi selama 24 jam pada suhu 37C
Diamati kejernihan dalam tabung uji (Menentukan KHM) Digores ke media padat
Agar darah (Staphylococcus aureus) atau Agar Mc.Conkey ( Escherichia coli)
Diinkubasi selama 24 jam pada suhu 37C
No Tabung Perlakuan % b/v (kadar akhir) HASIL PENGAMATAN Kejernihan Koloni
1. 0,6125% K +
2. 1,25% J
-3. 2,5% J
-4. 5 % J
-5. K
-6. K
-7. K.I J
-8. K.II J
-9. K.III K
-10. K.IV K +
Contoh Hasil Uji Aktivitas
Keterangan :
KK = Kekeruhan + = Ada koloni bakteri J = Jernih - = Tidak ada koloni bakteri K = Keruh
Kadar akhir = kadar ekstrak awal dibagi 2 Jadi, KHM = 1,25% b/v
KBM = 1,25% b/v
Kontrol (data dan gambar belum ditampilkan) K.I (Kontrol media)
K.II (Kontrol pelarut) K.III (Kontrol sampel) K.IV (Kontrol bakteri)
1 2 3 4
1 2 3 4 KHM KBM
8 4 2 1 0
Tetracycline (μg/ml)
MIC = 2 μg/ml
Determination of MIC
1 2 3 4 K1 K2 K3 K4
Petri uji
suspensi bakteri 106 CFU/ml
Dg cara spread plate
Petri kontrol
K1 : Kontrol media K2 : Kontrol pelarut K3 : Kontrol sampel K4 : Kontrol suspensi bakteri
Diinkubasi selama 24 jam pada suhu 37C
Diamati tumbuh tidaknya koloni bakteri di atas media agar (Menentukan KHM/KBM)
Metode Dilusi Padat
No No growth growth
Kirby
Kirby--Bauer
Bauer
Susceptible
Susceptible Not susceptibleNot susceptible
Bacterial Bacterial lawnlawn
Growth Growth
Antibiotic disk Antibiotic disk
Chl Amp Ery Str
Tet
Disk Diffusion Test
Size of zone of inhibition depends on
sensitivity, solubility, rate of diffusion. Compare
results to MIC tables generated using
standards.
Disk Diffusion
Zone Diameter Standards for Disk Diffusion
Tests
Antimicrobial Agent (amt.per disk) and organism
Zone Diameter (mm) Approx.MIC (g/L) for
R I MS S R S
Ampisilin (10 g/disk)
Enterobacteriaciae <11 12-13 >14 >32 <8
Harmophillus <19 >20 >4 <2
Enterococci <16 >17 >16
Measuring Antimicrobial
Sensitivity
• MIC: Minimal inhibitory concentration
E-Test method
Ekstraksi Komponen Bioaktif Kulit Buah Manggis dan Pengujian Aktivitas Antibakterinya
• Bahan : kulit buah manggis matang dari pasar
• Perlakuan terhadap kulit buah manggis :
Pencucian dengan air bersih
Dikeringanginkan
Dikeringkan pada pengering vakum suhu 50oC tekanan 62 cm Hg, 4
jam
Penghancuran dengan blender bubuk kulit biah manggis
• Kultur mikroba uji : Leuconostoc mesenteroides dan Lactobacillus plantarum penyebab kerusakan nira
Kultur ditumbuhkan pada media MRS broth, suhu 30oC, 24 jam
Diatur densitasnya dengan aquades hingga mencapai OD = 0.1 pada panjang gelombang 625 nm
Ekstraksi Komponen Bioaktif Kulit Buah Manggis dan Pengujian Aktivitas Antibakterinya (1)
• Ekstraksi :
20 g bubuk kulit manggis kering diekstrak dengan 100 ml metanol dengan metode maserasi disertai pengadukan dengan magnetic stirer pada suhu kamar selama 3 jam.
Campuran disaring berturut-turut dengan kertas whatman no.4 dan no.1 Filtrat I
Residu diekstrak kembali dengan 100 ml etanol Filtrat II
Filtrat I dan II dicampur dan dikeringkan dengan rotary vacuum evaporator suhu 45oC
Ekstrak kering yang diperoleh dilarutkan kembali dengan metanol
ekstrak metanol kulit buah manggis 5% (50g/L)
Ekstraksi Komponen Bioaktif Kulit Buah Manggis dan Pengujian Aktivitas Antibakterinya (2)
• Fraksinasi :
Menggunakan metode partisi
20 ml ekstrak metanol kulit buah manggis dikeringkan dengan rotary vacuum evaporator suhu 45oC
Disuspensikan dengan aquades sampai volumenya 100 ml Suspensi ekstrak dipartisi berturut-turut dengan heksana, kloroform, etil asetat dan n-butanol fraksi dari masing2 pelarut dikeringkan dengan rotary vacuum evaporator pada suhu 45oC
Ekstraksi Komponen Bioaktif Kulit Buah Manggis dan Pengujian Aktivitas Antibakterinya (3)
• Pengujian Aktivitas Antimikroba: Menggunakan uji difusi cakram
20 L esktrak diteteskan apda cakram kertas saring dikeringkan pada laminar flow selama 60 menit Cakram yang mengandung ekstrak ditempelkan pada
media agar yang telah diinokulasi dengan suspensi mikroba 250L/cawan.
Media diinkubasikan pada suhu 30oC selama 24 jam
Kontrol : cakram kertas saring yang ditetesi 20 L pelarut. Pengamatan : zona bening di sekitar cakram (mm) zona
penghambatan
Ekstraksi Komponen Bioaktif Kulit Buah Manggis dan Pengujian Aktivitas Antibakterinya (4)
• Analisis GC-MS
Dilakukan terhadap fraksi ekstrak yang positif menunjukkan aktivitas antimikroba
Gas pembawa : helium dengan laju aliran 30 ml/menit. Suhu GC : suhu injektor 300oC, suhu awal oven 100oC
dengan laju kenaikan suhu 10oC/menit, suhu akhir oven
300oC
Identifikasi Senyawa Ekstrak Kloroform
Penentuan Glisemik Indeks Pangan (Miller, 1996)
• Pangan tunggal yang akan ditentukan GI-nya (yang mengandung 50 gram karbohidrat) diberikan kepada relawan yang telah menjalani puasa penuh (kecuali air). Sebagai contoh, untuk menentukan GI kentang rebus diperlukan 250 gram kentang untuk menyediakan karbohidrat sebanyak 50 gram (setara dengan 3 sendok makan bubuk glukosa murni).
• Selama dua jam pasca pemberian (atau tiga jam apabila relawan menderita diabetes), sampel darah diambil untuk setiap 15 menit pada jam pertama kemudian setiap 30 menit pada jam kedua untuk diukur kadar glukosanya.
• Pada waktu yang berlainan hal yang sama dilakukan dengan memberikan 50 gram glukosa murni (sebagai pangan acuan) kepada relawan. Hal ini dilakukan sebanyak 2 kali untuk mengurangi efek ragam hari-ke-hari respon gula darah.
• Kadar gula darah (pada setiap waktu pengambilan sampel) ditebarkan pada dua sumbu, yaitu sumbu waktu dan kadar glukosa darah.
Kategori Pangan menurut Rentang Indeks Glisemik
Perhitungan GI Makanan Campuran
Pengujian Efek Hipoglikemik (Antidiabetes)• Pengujian Secara In vivo (menggunakan hewan percobaan)
24 ekor tikus wistar dimasukkan ke dalam kandang kolektif dengan suhu ruang 20-25oC
Tikus diberi pakan dan minum secara ad libitum
Tikus diadaptasikan selama 1 minggu sebelum perlakuan
Berat badan tikus ditimbang setiap 3 hari sekali
Kadar gula darah diukur setiap minggu
Tikus dibagi menjadi kelompok perlakuan dan 1 kelompok kontrol
Induksi aloksan (untuk menginduksi tikus menjadi hiperglikemia) dilakukan 3 hari sebelum diberi perlakuan, kemudian kadar gula darahnya diukur memastikan bahwa tikus sudah hiperglikemik. Tikus yang digunakan adalah tikus dengan kadar gula darah >126 mg/dl
Masing-masing kelompok diberi ransum standard, tetapi pada kelompok perlakuan diberi tambahan makanan berupa perlakuan yang ingin diuji.
Uji Aktivitas Antidiabetes Secara In Vitro
Dengan Uji aktivitas -Glukosidase
Pembuatan Kurva Standar 4-nitrofenol
Menggunakan 6 deret standar (15,30,45,60,75 dan 90 M), dengan cara melarutkan 4-nitrofenol dalam larutan buffer fosfat pH 7. Blanko = buffer fosfat pH 7. Diukur absorbansinya pada 400 nm
Uji inhibisi -Glukosidase
Menggunakan substrat p-nitrofenil--Dglukopiranosida (p-NPG) dan enzim -Glukosidase.
Larutan enzim dibuat dengan melarutkan 1.0 mg enzim -Glukosidase dalam larutan buffer fosfat (pH 7) yang mengandung serum bovin albumin, kemudian diencerkan 25 kali dengan puffer fosfat pH 7.
Ekstrak sampel dilarutkan dalam DMSO.
Penghentian reaksi enzim substrat dilakukan dengan penambahan Na2CO3 200 mM. Larutan diukur absorbansinya pada panjang
gelombang 400 nm.
Uji Aktivitas Antikanker
Preparasi kultur sel mieloma mencit
• Sel mieloma mencit di thawing setelah dibekukan pada suhu -80°C. Hasil thawing diinisiasi pada inkubator 5% CO2 pada
suhu 37 °C dan pH 7,4 -7,7 di dalam media RPMI 1640 dan FBS 10%, 100µg/ml streptomisin, 100 unit/ml penisilin. Bila kepadatan sel hasil inisiasi telah mencapai 105– 2.106 maka
suspensi sel tersebut dapat digunakan lebih lanjut untuk uji antikanker dan induksi apoptosis.
Pengamatan aktivitas antikanker dengan metode viabilitas sel dengan pewarnaan tripan biru.
• Sebanyak 0,2 mL dari masing -masing larutan baku kerja dengan konsentrasi 1 25, 250, 500, 750, 1000 µg/mL, kontrol positif dan kontrol negatif dimasukkan ke dalam sumuran microplate. Tiap konsentrasi
dilakukan 3 pengulangan (3 lubang sumuran).
• Setelah itu, ke dalam masing -masing lubang sumuran di tambahkan suspensi sel mieloma seb anyak 0,8 ml sehingga didapatkan konsentrasi larutan uji 25, 50,100, 150 , 200 dan 300 µg/ml serta kontrol positif etoposida sebesar 10 µg/ml. Bersama-sama kemudian diinkubasi pada inkubator 5% CO2 selama 24 jam pada suhu 37 °C dan pH 7,4 -7,7.
dilakukan panen sel dan diamati persentase viabilitasnya menggunakan pewarnaan laru tan tripan biru 0,4% dengan perbandingan susp ensi sel : tripan biru = 1:1 dihitung dengan menggunakan hemositometer, di mana sel mati akan terwarnai biru sedangkan sel hidup akan berwarna jernih.
Pendekatan terbaru studi pencernaan
• Secara In vivo :
Uji pernafasan
Scintigraf
USG
MRI (Magnetic Resonance Imaging)
• Secara in vitro :
Gastrointestinal model (GIM) static dan dinamyc