TUGAS KIMIA ANORGANIK
TEORI IKATAN VALENSI DAN HIBRIDISASI ORBITAL
ESTER ALNINTA BASA SIAGIAN
(21030116140082)
JURUSAN TEKNIK KIMIA
FAKULTAS TEKNIK
A. DASAR TEORI IKATAN VALENSI
Ikatan valensi menjelaskan sifat ikatan kimia dalam suatu molekul dari sudut valensi atom.
Prinsip dasar teori ikatan valensi adalah bahwa ikatan kovalen terbentuk ketika orbital dari
dua atom saling mengisi atau berbagi elektron dan daerah pengisian atau berbagi, yang berada
diantara inti, ditempati oleh sepasang elektron. Dasar teori ikatan valensi ini berasal dari tiga
prinsip yang ada, yaitu:
1. Bilangan kuantum spin yang berlawanan arah pada
pasangan elektron. Dalam prinsip pengecualian
yang dikemukakan Wolfgang Pauli (bahwa tidak
ada dua elektron dalam atom yang sama mempunyai
empat bilangan kuantum yang sama), ruang elektron
yang terbentuk oleh orbital yang saling mengisi
akan mempunyai kapasitas maksimum dua elektron
dan harus memiliki bilangan kuantum spin yang
berlawanan arah. Molekul H2 dengan atom H (1s)
akan saling berikatan da membentuk elektron
berpasagan ang memiliki bilangan kantum spin yang
berlawanan arah.
2. Pengisisan maksimum pada orbital-orbital ikatan elektron. Semakin besar orbital saling
tumpang tindih, semakin kuat juga ikatannya, maka ikatan tersebut juga dapat disebut
stabil. Contohnya ikatan HF, pada orbital 1s atom H akan melengkapi orbital 2p atom F
yang berisi setelah penuh.
3. Hibridisasi orbital atom. Hibridisasi adalah konsep bersatunya orbital-orbital atom dan
membentuk orbital hibrida yang sesuai dengan pasangan elektron untuk membentuk
ikatan kimia. Sebagai contoh hibridisasi atom C. Atom karbon seharusnya membentu
ikatan kovalen CH2 karena karbon mempunyai dua elektron tidak berpasagan da
membentuk C-H-C. Namun, yang terbentuk bukanlah CH2 dengan sudut C-H 90 0
melainkan CH4 dengan sudut C-H 109,5 0
.
Dua hal penting mengenai jumlah dan jenis orbital hibrida yaitu:
Jumlah orbital hibrida yang diperoleh sama dengan jumlah orbital atom keseluruhan.
Jenis orbital hibrida yang didapat bervariasi dari jenis orbital atom keseluruhan.
B. JENIS-JENIS ORBITAL HIBRIDA
1. Hibridisasi sp
Jika terdapat 2 elektron saling berkumpul dan menyatu di satu pusat atom, maka akan
hibrida memperbesar pengisisan elektron dengan orbital atom lain dalam ikatan. Contoh
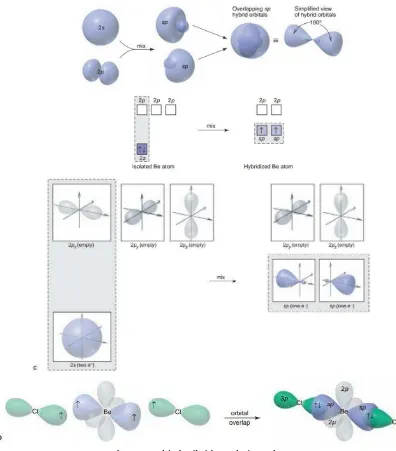
hibridisasi sp adalah BeCl2.
Konfigurasi atom Be yaitu 1s2 2s2, satu elektron di subkulit 2s direlokasikan ke subkulit 2p, lalu elektron 2s dan 2p mengalami hibridisasi sp. Elektron di 2s dan 2p ini
masing-masing berpasagan dengan atom Cl da tebentuklah BeCl2.
Gambar 1.1 Orbital Hibrida sp dari BeCl2
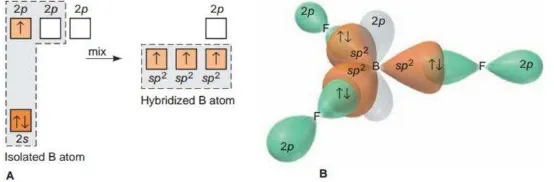
2. Hibridisasi sp2
Bentuk molekul yang akan terbentuk dari hibridisasi ini adalah trigonal planar. Bentuk
sehingga menghasilkan tiga orbital yang hibrid yang membentuk segitiga dengan sudut
masing-masing sebesar 120o . Contoh hibridisasi ini adalah BF3.
Gambar 1.2 Orbital Hibrida sp2 dari BF3
Terdapat bentuk molekul lain dalam kelompok elekton tertentu yang mengandung
pasangan elektron tunggal (lone pair). Ozon (O3) misalnya. O sebagai pusat atom dengan
hibridisasi sp2 dan pasangan elektron tunggal (lone pair) mengisi salah satu dari tiga orbital sp2 yang ada, sehingga akan menghasilkan bentuk molekul ozon yang bengkok.
Gambar 1.3 Orbital Hibrida sp2 dari O3
3. Hibridisasi sp3
Hibridisasi ini menghasilkan bentuk molekul tetrahedral dimana satu orbital s dan semua
Gambar 1.4 Orbital Hibrida sp3 dari CH4, NH3, dan H2O
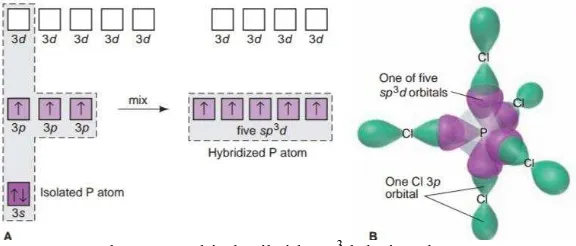
4. Hibridisasi sp3d
Bentuk molekul yang terbentuk adalah trigonal bipiramida. Pusat atom pada sp3d berasal dari periode 3 atau lebih sehingga atom di orbital d, s, dan p bergabung
membentuk orbital hibrida. Hibridisasi sp3d juga dapat membentuk bentuk molekul
seesaw, T-shaped, dan linear bila terdapat lone pairs. Contohnya adalah PCl5.
Gambar 1.5 Orbital Hibrida sp3d dari PCl5
5. Hibridisasi sp3d2
Bentuk molekul yang terbentuk yaitu oktahedral dengan satu orbital 3s, tiga orbital
3p, dan dua dari lima orbital 3d yang bergabung da membentuk enam orbital hibrida
sp3d2. Contohnya adalah SF6.
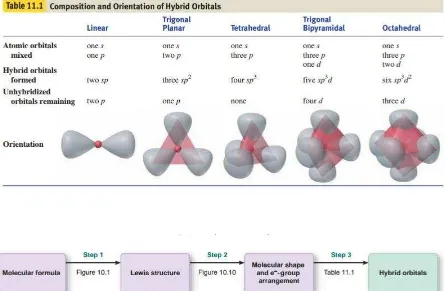
Tabel 1.1 Komposisi dan Bentuk Molekul dari Orbital Hibrida
Gambar 1.7 Tahapan dari Rumus Molekul Menjadi Orbital Hibrida
6. Jika Konsep Hibridisasi Tidak Berlaku
Beberapa senyawa atau molekul akan membentuk suatu bentuk molekul yang tidak
sesuai dengan teori ikatan valensi sehingga teori tersebut tidak berlaku. Contohnya
H2S yang apabila ditinjau dengan teori ikatan valensi akan terbentuk sudut 92 o
pada
ikatannya. Tetapi pada kenyataannya, senyawa H2S memiliki sudut 92 o
. Hal ini
terjadi karena dipengaruhi berbagai macam faktor seperti panjang ikatan, besar atom,
REFERENSI
Armansyah, W. (2015). Teori Hibridisasi dan Contoh Berbagai Macam Hibridisasi http://www.
belajarbagus.com/2015/10/teori-hibridisasi.html
Silberberg, M.S. (1996). Chemistry The Molecular Nature of Matter and Change (5th ed.) .McGraw-