Tempat dan Waktu Penelitian
Percobaan dilaksanakan di rumah kaca Kebun UF IPB, Tajur dan di rumah kaca kedap serangga Departemen Proteksi Tanaman Faperta IPB, Cikabayan, dari bulan Juli 2005 sampai dengan bulan Oktober 2006. Analisis laboratorium dilakukan di laboratorium Virologi Faperta IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah 13 genotipe cabai koleksi AVRDC serta 2 kultivar lokal Tit Super dan Jatilaba koleksi Bagian Genetika dan Pemuliaan Tanaman. Sebagai bahan penguji digunakan inokulum ChiVMV isolat Cikabayan, koleksi laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman Faperta IPB.
Metode Penelitian
Untuk menguji hipotesis yang telah disajikan pada bab sebelumnya maka metode dan pelaksanaan penelitian dibagi menjadi tiga tahapan seperti yang dapat dilihat pada bagan alir penelitian (Gambar 1) yaitu:
1. Evaluasi respon ketahanan tanaman terhadap infeksi ChiVMV
Kegiatan ini dimaksudkan untuk meguji hipotesis 1, yaitu bahwa terdapat respon ketahanan terhadap infeksi ChiVMV yang bervariasi pada genotipe cabai yang diuji. Selain itu, kegiatan ini juga dimaksudkan untuk memilih tetua yang paling tahan dan yang paling rentan sebagai bahan pembuatan populasi dalam studi pewarisan ketahanan terhadap inveksi ChiVMV.
Percobaan dilakukan dalam 2 tahap. Evaluasi tahap I, yang merupakan evaluasi pendahuluan, dilakukan terhadap 13 genotipe cabai. Pengamatan dilakukan terhadap kejadian penyakit (KP) berdasarkan ELISA. Paling sedikit digunakan 30 tanaman untuk setiap genotipe yang diinokulasi. Evaluasi ketahanan tahap II dilakukan terhadap genotipe terpilih hasil evaluasi tahap I, yang mewakili genotipe dengan karakter tahan dan sangat rentan. Evaluasi tahap II ini dilakukan dengan rancangan acak lengkap (RAL) 2 faktor (genotipe dan perlakuan inokulasi), dilakukan dengan tujuan untuk melihat konsistensi respon ketahanan
pada genotipe-genotipe terpilih. Pengamatan dilakukan terhadap kejadian penyakit, intensitas gejala, dan titer virus.
Gambar 1. Bagan Alir Penelitian Pewarisan Karakter Ketahanan Tanaman Cabai terhadap Infeksi chilli veinnal motle virus
Kejadian penyakit (KP) adalah proporsi tanaman yang menunjukkan reaksi ELISA positif dalam suatu populasi tanaman tertentu pada 14 HSI. Intensitas gejala diukur berdasarkan tingkat keparahan gejala yang muncul (indeks gejala) secara visual. Titer virus diduga melalui nilai absorban ELISA yang dapat menggambarkan tinggi rendahnya konsentrasi virus pada tanaman setelah tanaman terinfeksi. Peubah tersebut merupakan tolok ukur ketahanan tanaman terhadap infeksi virus (Green 1991). Genotipe yang paling tahan adalah yang menunjukkan respon KP paling rendah, intensitas serangan paling rendah, dan tingkat konsentrasi virus paling rendah.
Perbedaan respon antar genotipe cabai terhadap infeksi ChiVMV dilihat berdasarkan peringkat ketahanan mengikuti peringkat yang dikemukakan oleh Dolores (1996). Tingkat variabilitas respon tersebut diukur berdasarkan nilai
koefisien variasi fenotipik menggunakan rumus Singh dan Chaudhary (1979); Steel dan Torrie (1981).
% 100 × = X s KK ……..(rumus 1)
Dengan KK, s dan X berturut-turut adalah koefisien keragaman, standar deviasi, dan nilai rata-rata pengamatan. Untuk menentukan tinggi rendahnya keragaman respon berdasarkan koefisien keragaman mengikuti pengelompokan yang dikemukakan oleh Mattjik dan Sumertajaya (2000), yaitu rendah (KK < 20%), sedang (20% ≤ KK ≤ 25%), dan tinggi (KK > 25%).
Koefisien korelasi antar peubah yang diamati dihitung berdasarkan rumus Singh dan Chaudhary (1979); Steel dan Torrie (1981) sebagai berikut:
y x xy s s Cov r 2 2 = …….(rumus 2)
Keterangan : r = koefisien korelasi
Covxy = koefisien keragaman peubah XY s2x = ragam peubah X
s2y = ragam peubah Y
Menurut Young (1982) dikutip Djarwanto dan Subagyo (1993) derajat keeratan hubungan antar peubah yang dianalisis dapat dilihat dari nilai koefisien korelasinya (r). Nilai 0.7 < r < 1.0 menunjukkan keterkaitan yang erat, 0.4 < r ≤ 0.7 sedang, dan r ≤ 0.2 adalah tidak berkaitan.
2. Pembuatan materi kegenetikaan untuk studi pola pewarisan
Persilangan dilakukan secara buatan (Gambar 2) antara tetua yang memiliki karakter tahan terhadap infeksi ChiVMV dengan tetua rentan. Persilangan dilakukan antara pukul 9.00 – 11.00 pagi (saat hari cerah). Bunga tetua betina dipilih yang masih kuncup, tetapi telah mencapai ukuran penuh. Pada fase ini diperkirakan putik sudah matang tetapi kotak sari belum pecah. Emaskulasi dilakukan dengan cara membuka mahkota bunga dan membuang seluruh benang sari secara hati-hati dengan menggunakan pinset kecil agar kotak sari tidak pecah.
Gambar 2. Teknik persilangan buatan pada cabai. A. Bunga betina yang siap diserbuki; B. Kastrasi; C. Emaskulasi; D. Hasil kastrasi dan emaskulasi; E. Bunga jantan siap diambil serbuksarinya; F. Pengambilan serbuksari; G. Hasil pengumpulan serbuksari; H. Pernyerbukan dengan pinset; I. Penyerbukan menggunakan tabung; J. Pemasangan label; K. Isolasi menggunakan isolatif; L. Setelah diisolasi dan dilabel (Sumber: Yunianti 2007)
Setiap kali akan digunakan untuk emaskulasi, pinset terlebih dahulu dicelupkan ke dalam alkohol 70% dan dikeringkan. Hal ini dilakukan untuk menghindari kontaminasi terhadap bunga yang diemaskulasi oleh serbuk sari dari bunga yang diemaskulasi sebelumnya (Greenleaf, 1986).
Bunga yang telah diemaskulasi selanjutnya diserbuki dengan serbuk sari bunga tetua jantan yang diambil dari bunga mekar yang masih segar. Penyerbukan dilakukan segera setelah emaskulasi guna menghindari persilangan yang tidak diinginkan. Bunga yang sudah diserbuki selanjutnya ditutup (diisolasi) selama
satu minggu. Bunga tersebut diberi label kecil pada tangkainya, bertuliskan kombinasi persilangan dan tanggal persilangan.
Buah dipanen pada saat telah berwarna merah penuh, yang merupakan tanda buah telah matang. Ekstraksi biji dilakukan dengan membelah buah secara membujur, biji-bijinya dikeluarkan dan dijemur sampai kering. Biji dari buah hasil persilangan (F1, F1R, BC1(P1), dan BC1(P2)) dan hasil silang dalam tanaman F1 diekstraksi secara terpisah untuk masing-masing buah.
3. Studi Pola Pewarisan Ketahanan terhadap ChiVMV
Bahan percobaan yang digunakan adalah satu set populasi hasil persilangan tetua tahan dan tetua rentan ChiVMV yang diseleksi pada tahap sebelumnya. Satu set populasi tersebut terdiri atas tetua tahan (P1), tetua rentan (P2), hasil persilangan antara tetua tahan dan tetua rentan (F1), hasil persilangan resiproknya (F1R), silang balik dengan tetua tahan (BC1(P1)), silang balik dengan tetua rentan (BC1(P2)) dan keturunan kedua hasil persilangan (F2).
Populasi tanaman dalam famili F2 berasal dari satu tanaman F1. Sejumlah buah F1 diambil secara acak, kemudian benihnya dicampur. Jumlah buah yang diambil disesuaikan dengan jumlah tanaman minimum yang diperlukan dalam famili F2.
Jumlah tanaman minimum dalam F2 ditentukan berdasarkan perhitungan populasi minimum yang diperlukan untuk memperoleh paling sedikit satu genotipe yang diinginkan. Rumus yang digunakan untuk menentukan besarnya populasi minimum adalah sebagai berikut (Burnham, 1961):
…….(Rumus 3) ) /( ) (Log F Log q n=
dengan n, F dan q berturut-turut adalah jumlah tanaman minimum yang dibutuhkan, taraf kesalahan (α) yaitu 0.05, dan peluang kegagalan mendapatkan genotipe yang diinginkan.
Dengan asumsi bahwa ketahanan terhadap ChiVMV dikendalikan paling banyak oleh tiga gen, maka jumlah tanaman minimum pada populasi F2 adalah sebagai berikut: 191 00684 . 0 30103 . 1 ) 64 / 63 log( 05 . 0 log = − − = = n
Peubah yang diamati adalah indeks penyakit dan nilai absorban ELISA untuk menduga titer virus.
Pelaksanaan Percobaan 1. Pembibitan
Sebelum disemai, benih terlebih dahulu direndam dalam air panas (50oC) selama satu jam untuk menghilangkan hama dan patogen yang menempel pada kulit biji dan mempercepat perkecambahan. Benih disemai di baki yang berisi campuran tanah dan pupuk kandang matang (1:1), yang telah disterilisasi, dengan kedalaman lubang 0.5 – 1 cm. Baki kemudian ditutup dengan kain lembab hingga benih berkecambah.
Bibit berumur 3 minggu setelah semai dipindahkan ke polibag berdiameter 40 cm yang berisi 8 kg media steril (campuran tanah dan pupuk kandang dengan perbandingan 1:1 berdasarkan volume). Pemeliharaan dilakukan di rumah kaca kedap serangga. Selama pembibitan, kelembaban harus tetap dijaga. Penyiraman dilakukan secukupnya, tidak terlampau basah, sebab dapat mengakibatkan damping off. Pemupukan dilakukan pada saat tanaman berumur dua minggu, melalui penyemprotan pupuk daun Gandasil D (1.5 g/l) bersamaan dengan pencegahan hama dan penyakit, dengan frekuensi seminggu sekali. Pencegahan hama dan penyakit dilakukan dengan insektisida Curacron, Supracide, Furadan 3G dan Kelthane, bakterisida Dithane M-45 dan fungisida Antracol dengan dosis sesuai anjuran.
2. Inokulasi
Inokulasi dilakukan secara mekanik (Gambar 3). Inokulum disiapkan dengan cara menggerus daun tanaman yang terinfeksi ChiVMV dalam mortar steril bersama dengan larutan penyangga fosfat 0.01 M, pH 7, dengan perbandingan 1 g daun terinfeksi virus per 5 ml larutan penyangga fosfat (1:5 b/v). Inokulasi dilakukan dengan cara mengoleskan sap tersebut ke permukaan daun tanaman yang akan diuji dengan bola kapas secara hati-hati, segera setelah penggerusan. Inokulasi dilakukan pada dua helai daun termuda yang telah membuka penuh (4 – 5 minggu setelah semai). Sebelum diinokulasi permukaan atas daun ditaburi bubuk karborundum (600 mesh) dengan tujuan untuk membuat
pelukaan, agar infeksi virus dapat terjadi pada saat pengolesan. Pengolesan sap dimulai dari bagian pangkal daun ke bagian ujung secara searah, tanpa mengulangi pada daerah yang sama. Segera setelah pengolesan sap dilakukan pembilasan sisa-sisa sap yang masih melekat pada permukaan daun tanaman uji menggunakan air mengalir. Inokulasi diulang satu minggu setelah inokulasi pertama, untuk memastikan seluruh tanaman dapat terinfeksi.
Gambar 3. Teknik inokulasi virus secara mekanis. A. Tanaman cabai yang siap diinokulasi (± umur 4 mss); B. Persiapan inokulum; C. Penaburan bahan abrasive pada permukaan daun yang akan diinokulasi; D dan E. Pengolesan sap inokulum dengan bola kapas; F. Pembilasan sisa-sisa sap setelah inokulasi.
Dalam penelitian ini digunakan isolat ChiVMV asal Cikabayan. Berdasarkan hasil penelitian Taufik (2005) diketahui bahwa isolat ChiVMV asal Cikabayan memiliki virulensi yang lebih baik karena dapat menginfeksi hampir semua galur inang diferensial yang digunakannya. Berdasarkan reaksinya pada inang diferensial, diketahui bahwa isolat ChiVMV asal Cikabayan adalah strain yang berbeda dengan isolat-isolat lainnya. Perbanyakan isolat virus dilakukan dengan cara menularkan virus dari tanaman terinfeksi ke tanaman paprika (C. annuum L) sehat.
3. Pengamatan
Tipe Gejala. Tipe gejala ditunjukkan oleh tekstur warna dan penampilan pada daun termuda yang telah membuka penuh. Tipe gejala infeksi ChiVMV secara umum adalah belang berwarna hijau tua dan pemucatan pada tulang daun, mosaik serta kelainan bentuk pada daun. Belang merupakan bercak-bercak tanpa batas yang jelas. Mosaik adalah bercak-bercak kekuningan yang dibatasi dengan tulang daun. Tipe gejala ini diklasifikasikan berdasarkan tingkat keparahan atau kualitasnya untuk kemudian diindeks.
Intensitas Gejala. Intensitas gejala diukur berdasarkan indeks gejala yang diamati pada 5 minggu setelah inokulasi (awal fase generatif). Indeks gejala untuk infeksi ChiVMV pada tanaman cabai ditentukan berdasarkan tipe gejala (Gambar 4) seperti pada Tabel 2. Penghitungan intensitas gejala dilakukan dengan menggunakan rumus 4, dan pengelompokan tanaman berdasarkan tingkat ketahanannya terhadap ChiVMV dilakukan sesuai dengan kriteria Dolores (1996) seperti tertera pada Tabel 3.
Gambar 4. Tipe gejala infeksi ChiVMV: 0. Tidak ada gejala; 1. Belang ringan; 2. Belang dan permukaan daun tidak rata; 3. Belang berat dan atau malformasi daun serta pengkerdilan tanaman (Sumber: koleksi pribadi dan kutipan dari CABI 2000)
Intensitas gejala (I) dihitung dengan rumus:
(
)
% 100 × × × =∑
V N v n I ... (rumus 4)dengan n adalah jumlah tanaman pada tiap indeks gejala, v = indeks gejala pada tiap tanaman yang diamati, N = jumlah total tanaman yang diamati, dan V = indeks gejala tertinggi, yaitu 3.
Tabel 2. Penentuan indeks gejala pada tanaman cabai yang terinfeksi ChiVMV
Indeks Gejala Gejala
0 1 2 3
tidak ada gejala belang ringan
belang dan permukaan daun tidak rata
belang berat dan atau malformasi daun serta pengkerdilan tanaman
Tabel 3. Penentuan peringkat ketahanan tanaman cabai terhadap ChiVMV Intensitas Serangan
(%)
Hasil ELISA Peringkat Ketahanan * 0 x ≤ 10 10 < x ≤ 20 20 < x ≤ 30 30 < x ≤ 50 x > 50 - + + + + + imun tahan agak tahan agak rentan rentan sangat rentan * Dolores (1996)
Titer Virus. Uji serologi dilakukan dengan DAS-ELISA (Double antibody sandwich- Enzyme-link imunosorbance assay) untuk menduga titer virus pada tanaman (Green 1991). Pengujian dilakukan terhadap daun termuda yang telah berkembang penuh, satu minggu setelah inokulasi terakhir. Deteksi dilakukan dengan DAS-ELISA sesuai petunjuk dari DSMZ-Plant Virus Collection (Braunschweig, Germany). Tahapan uji tersebut adalah Coating, sumuran plat mikrotiter diisi dengan 200μl antiserum ChiVMV yang telah disuspensikan ke dalam bufer coating. Plat mikrotiter diinkubasikan pada suhu 37oC selama 2 – 4 jam. Setelah proses inkubasi selesai, plat mikrotiter dicuci dengan PBST dengan menggunakan botol pencuci, direndam selama beberapa menit dan pencucian
diulangi sebanyak 2 kali, kemudian plat dikeringkan dengan cara mengetuk-ngetuk dengan arah terbalik di atas kertas tissue. Selanjutnya plat mikrotiter diisi dengan 200μl sap tanaman yang akan diuji yang telah diekstraksi pada bufer ekstraksi, masing-masing sampel dimasukkan pada dua sumuran (duplo), kemudian diinkubasikan pada suhu 4oC selama satu malam. Plat mikrotiter kemudian dicuci lagi dengan PBST dengan cara seperti sebelumnya, sebanyak 3 kali. Selanjutnya plat mikrotiter diisi dengan 200μl konjugat antivirus di dalam bufer konjugat ke dalam tiap sumuran, dan diinkubasikan pada suhu 37oC selama 4 jam. Setelah inkubasi, plat mikrotiter dicuci lagi dengan PBST dengan cara seperti sebelumnya, sebanyak 3 kali. Tahap akhir, plat mikrotiter yang telah dicuci diisi dengan PNP sebanyak 200μl/sumuran dan diinkubasikan selama 30 – 60 menit pada suhu ruang, atau selama yang diperlukan untuk dapat melihat reaksi perubahan warna yang jelas. Perubahan warna pada larutan dalam plat mikrotiter menunjukkan sampel tanaman yang diuji positif terinfeksi dengan ChiVMV. Untuk mengkuantifikasi hasil digunakan ELISA reader pada panjang gelombang 405 nm. Analisis titer virus dilakukan secara kualitatif berdasarkan pengelompokan nisbah nilai absorban sampel terhadap kontrol negatif (Tabel 4). Tabel 4. Penentuan skor titer virus berdasarkan nisbah nilai absorban dari sampel
tanaman cabai yang diinokulasi oleh ChiVMV
Skor Kategori nisbah nilai absorban sampel (χ) 1 χ ≤1 kali nilai absorban kontrol negatif
2 1 kali nilai absorban kontrol negatif <χ≤ 2 kali nilai absorban kontrol negatif
3 2 kali nilai absorban kontrol negatif <χ≤ 3 kali nilai absorban kontrol negatif
4 χ>3 kali nilai absorban kontrol negatif
Kejadian Penyakit. Kejadian penyakit adalah proporsi tanaman yang menunjukkan reaksi ELISA positif dalam suatu populasi tanaman tertentu pada 14 HSI, dihitung dengan rumus (Sinaga 2003):
% 100 ) / (n N x KP= …….. (rumus 5)
Analisis Data 1. Efek Maternal
Ada tidaknya efek indung (maternal effect) yang mengendalikan karakter ketahanan terhadap ChiVMV pada tanaman cabai ditentukan berdasarkan uji beda nilai tengah (uji t) pada taraf 5% terhadap nilai tengah populasi F1 dibandingkan dengan F1 resiproknya. Uji t menurut Steel dan Torrie (1981) adalah sebagai berikut: R F R F F F R F F n S n S X X t 1 2 1 1 2 1 1 1 + − = …….. (rumus 6) Keterangan : 1 F
X , XF1R = nilai tengah populasi F1 dan F1 resiprok
2 1
F
S , SF21R = varians populasi F1 dan F1 resiprok
nF1, nF1R = jumlah individu dalam populasi F1 dan F1 resiprok
Jika kedua nilai tengah berbeda tidak nyata, maka berarti tidak ada efek indung dalam pewarisan karakter yang diamati. Jika varian populasi F1 dan F1R juga homogen, maka kedua populasi tersebut dapat digabungkan dalam analisis selanjutnya. Kehomogenan ragam diuji dengan uji F (Steel dan Torrie, 1981). Fhit = (S2besar)/(S2kecil) dibandingkan dengan nilai Ftabel(0.025, n-1). Bila Fhit < Ftabel maka ragam kedua populasi adalah homogen.
2. Derajat dominansi
Derajat dominansi dihitung untuk menduga aksi gen yang mengendalikan ketahanan terhadap ChiVMV pada cabai. Derajat dominansi dapat dihitung berdasarkan rumus pendugaan potensi rasio (hp) yang dikemukakan oleh Petr dan Frey (1996): MP HP MP F hp − − = 1 …..…. (rumus 7) Keterangan :
hp = potensi rasio HP = rata-rata nilai tetua tertinggi F1 = rata-rata nilai F1 MP = nilai tengah kedua tetua
Berdasarkan nilai potensi rasio tersebut, derajat dominansi diklasifikasikan seperti dalam Tabel 5.
Tabel 5. Klasifikasi derajat dominansi berdasarkan nilai potensi rasio (hp) Kisaran nilai hp Derajat dominansi hp = 0
hp = 1 atau hp = -1 0 < hp < 1
-1 < hp < 0
hp > 1 atau hp < -1
tidak ada dominansi
dominan atau resesif sempurna dominan tidak sempurna
resesif dengan aksi gen tidak penuh overdominan
3. Pendugaan jumlah gen pengendali
Jumlah gen pengendali ketahanan diduga berdasarkan pada sebaran frekuensi populasi F2. Populasi tanaman dalam famili F2 berasal dari satu tanaman F1. Sejumlah buah F1 diambil secara acak, kemudian benihnya dicampur. Jumlah buah yang diambil disesuaikan dengan perkiraan dapat menghasilkan benih yang melebihi jumlah tanaman minimum yang diperlukan dalam famili F2.
Sebaran frekuensi pada populasi F2 selanjutnya diuji apakah mengikuti
sebaran normal atau tidak. Uji normalitas sebaran frekuensi F2 dilakukan dengan metode Kolmogorov Smirnov (Lilliefore 1967) menggunakan perangkat minitab 14.0. Jika grafik sebaran frekuensi pada populasi F2 membentuk sebaran kontinyu satu puncak dan menyebar normal, maka karakter yang diamati dikendalikan oleh banyak gen minor (poligenic). Oleh karena itu, pendugaan jumlah gen yang bersegregasi dilakukan dengan pendekatan seperti digunakan Wright (1968) dalam Xu et al (2004) sebagai berikut:
(
)
[
]
(
)
(
2 /4)
8 ) 1 ( 2 5 . 1 2 2 2 2 2 2 1 2 1 1 2 F P P F b b P P n σ σ σ σ − + + − − − = ……… (rumus 8) keterangan :n = jumlah gen pengendali σP22 = ragam populasi P2
1
P = rata-rata tetua 1 σF21 = ragam populasi F1
2
2
1
P
σ = ragam populasi P1 b =F1 −P1/P2 −P1
Rumus tersebut digunakan bila terpenuhi asumsi (1) gen-gen yang bersegregasi terletak pada satu tetua, (2) gen ketahanan tidak terpaut, (3) semua gen mempunyai pengaruh yang sama terhadap ketahanan, (4) tidak ada pengaruh epistasis, (5) tidak ada pengaruh dominan, dan (6) tidak ada pengaruh lingkungan (Wright 1968, diacu dalam Xu et al 2004). Jika salah satu asumsi tersebut tidak terpenuhi, digunakan rumus (Mather dan Jink 1977):
H MP F k 2 ) 1 ( − = ……… (rumus 9) Keterangan: k : faktor efektif 1 F : rata-rata F1
MP : nilai tengah tetua
H : ragam dominan = 4σB1+4σB2 −4σF2 −1/3(σP1+σP2 +σF1)
Bila grafik sebaran frekuensi populasi F2 tidak mengikuti sebaran normal, maka kemungkinan ada peran gen mayor yang mengendalikan karakter tersebut. Analisis genetik untuk karakter yang dikendalikan oleh gen mayor biasanya dilakukan dengan analisis genetika Mendel, yaitu membandingkan nisbah frekuensi fenotipik hasil pengamatan pada populasi F2 terhadap nisbah Mendel, atau nisbah fenotipik tertentu dengan uji Chi-Kuadrat (χ2), yaitu dengan menggunakan rumus (Singh dan Chaudhary 1977; Steel dan Torrie 1981; Fehr 1987; Gardner et al. 1991; Crowder 1993; Gomez dan Gomez 1995):
X2 =
∑
(
)
= − n i ei ei oi 1 2 …….. (rumus 10) keterangan : n = jumlah kelas; i = 1, 2, 3,…..noi = nilai pengamatan dalam kelas ke-i ei = nilai yang diharapkan dalam kelas ke-i
Untuk keperluan analisis Mendel, data pengamatan F2 dikelompokkan mendekati kategori yang mungkin dari model pewarisan atau tipe aksi gen yang diduga. Pendekatan ini menghasilkan dugaan jumlah dan aksi gen yang bersegregasi untuk karakter yang dipelajari.
Persilangan yang melibatkan satu pasangan alel (interaksi alel-alel pada lokus yang sama), berdasarkan hukum Mendel, dapat memberikan konsekuensi rasio fenotipik keturunan F2 hasil hibridisasi sebagai berikut (Strickberger 1972): (1) 3:1 (satu gen bersifat dominan sempurna atau satu gen dengan aksi gen alel ganda), (2) 1:2:1 (satu gen bersifat dominan sebagian), (3) 1:2 (satu gen dengan aksi gen letal).
Persilangan yang melibatkan dua pasang alel yang memberikan pengaruh pada penampilan karakter yang sama (interalelik), berdasarkan hukum segregasi dan kombinasi secara bebas dari Mendel, akan memberikan konsekuensi rasio fenotipik keturunan F2 hasil hibridisasi sebagai berikut (Strickberger 1972):
(1) 9:3:3:1 (dua pasang gen bersifat dominan sempurna; fenotipe baru dihasilkan dari interaksi di antara homozigos dominan maupun resesif)
(2) 9:3:4 (dua pasang gen bersifat dominan sempurna, tetapi satu pasang gen bila berada dalam keadaan homozigot resesif akan memberikan pengaruh kepada pasangan yang lain).
(3) 9:7 (dua pasang gen bersifat dominan sempurna, tetapi keduanya bila berada dalam keadaan homozigot resesif akan saling memberikan pengaruh).
(4) 12:3:1 (dua pasang gen bersifat dominan sempurna, tetapi satu pasang gen bila berada dalam keadaan homozigot dominan akan memberikan pengaruh kepada pasangan yang lain).
(5) 15:1 (dua pasang gen bersifat dominan sempurna, tetapi keduanya bila berada dalam keadaan homozigot resesif akan saling memberikan pengaruh).
(6) 13:3 (dua pasang gen bersifat dominan sempurna, tetapi satu pasang gen bila berada dalam keadaan dominan akan memberikan pengaruh kepada pasangan gen kedua, dan pasangan gen kedua bila berada dalam keadaan homozigot resesif akan memberikan pengaruh kepada pasangan gen pertama).
(7) 9:6:1 (dua pasang gen bersifat dominan sempurna; interaksi di antara pasangan dominan akan memunculkan fenotipe baru).
(8) 7:6:3 (dua pasang gen, dengan satu pasang gen bersifat dominan sempurna dan pasangan gen yang lain bersifat dominan sebagian; pasangan gen yang pertama jika berada dalam keadaan homozigot resesif akan memberikan pengaruh kepada pasangan gen ke-dua).
(9) 6:3:3:4 (dua pasang gen, dengan satu pasang gen bersifat dominan sempurna dan pasangan gen yang lain bersifat dominan sebagian; masing-masing bila berada dalam keadaan homozigot resesif saling memberikan pengaruh, dan bila kedua pasangan gen hadir bersama dalam keadaan homozigot resesif, pasangan gen ke-dua akan memberikan pengaruh pada pasangan gen pertama).
(10)7:4:3:2 (dua pasang gen, dengan satu pasang gen bersifat dominan sempurna dan pasangan gen yang lain bersifat dominan sebagian; fenotipe heterozigot gen dominan sebagian sama dengan homozigot resesif pada pasangan gen dominan sempurna, dan menimbulkan suatu pengaruh aditif bila keduanya muncul bersama).
(11)1:2:2:1:4:1:2:2:1 (dua pasang gen bersifat dominan sebagian dan menimbulkan pengaruh aditif untuk setiap bagian gen dominan).
Jika perbedaan nilai harapan dari nilai pengamatan adalah kecil, x2
mendekati nol, maka nilai kecocokan adalah baik (the fit is good) (Gardner et al. 1991). Perbedaan nilai pengamatan dari nilai harapan dikatagorikan tidak nyata apabila nilai x2 hitung lebih kecil dari nilai x2 tabel dengan derajat bebas (db)
jumlah kelas dikurangi 1 (Gomez dan Gomez 1995). Artinya nisbah hasil pengamatan dengan nisbah harapan dianggap sesuai.
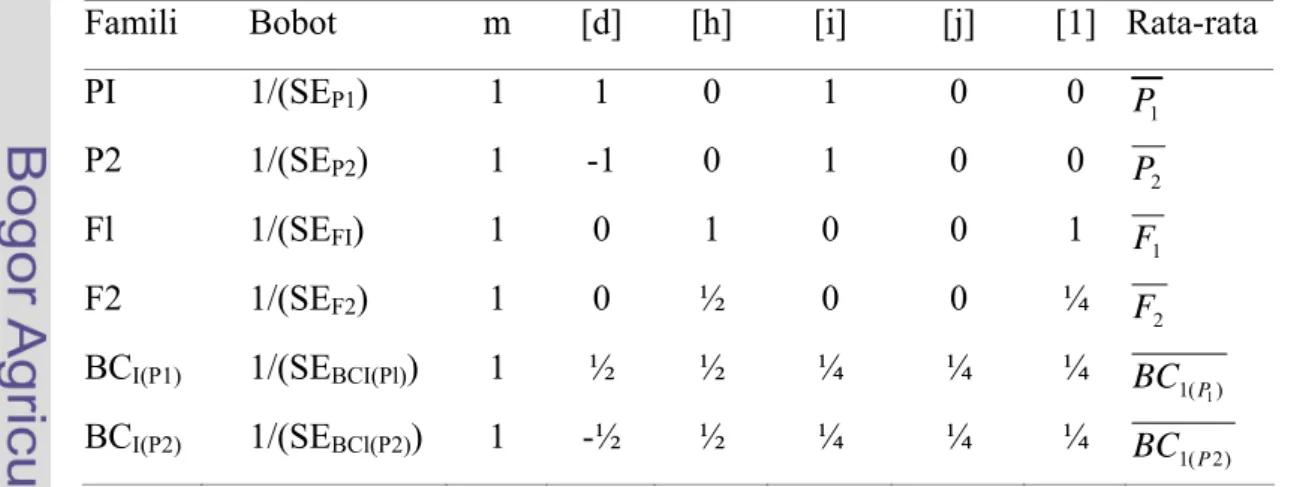
4. Pendugaan Komponen Genetik
Analisis rata-rata generasi dilakukan untuk menentukan model genetik yang paling sesuai menggambarkan hubungan rata-rata antar generasi, menggunakan Uji Skala (Scaling Test) dan Uji Skala Gabungan (Joint Scaling Test) dengan pembobot x2(Mather dan Jink 1982). Ada enam komponen genetik dalam suatu model lengkap digenik, yaitu: pengaruh rata-rata (m), jumlah pengaruh aditif [d], jumlah pengaruh dominan [h], jumlah pengaruh interaksi aditif x aditif [i], jumlah pengaruh interaksi aditif x dominan [j]. dan jumlah pengaruh interaksi dominan x dominan [1]. Model genetik yang diuji adalah kombinasi dari keenam komponen genetik tersebut. Dengan enam famili, maka ada maksimum 8 model genetik yang dapat diuji, yang digolongkan ke dalam: (1) model dua komponen genetik, yaitu model m[d], (2) model tiga komponen, yaitu m[d][h], yang merupakan model aditif-dominan, (3) model empat komponen, yang terdiri atas m[d][h][i],
m[d][h][j]. dan m[d][h][l], dan (4) model lima komponen, yang terdiri atas m[d][h][i][j], m[d][h][i][l], dan m[d][h][j][l]. Model genetik lengkap enam komponen tidak dapat diuji. Pengujian dilakukan secara bertahap mulai dari model dua, tiga, empat dan lima komponen genetik. Model dianggap paling sesuai jika nilai x2
hitung menunjukkan nilai terkecil, dan lebih kecil dari x2tabel. Apabila
model telah menujukkan kesesuaian dengan model aditif-dominan (m[d][h]), maka pengujian tidak dilanjutkan ke model selanjutnya karena dianggap tidak ada interaksi non-alelik.
Berdasarkan model genetik yang paling sesuai maka dapat diduga besarnya nilai komponen genetik tersebut beserta dengan galat bakunya. Dengan uji t maka selanjutnva dapat ditentukan nyata tidaknya peran komponen genetik tersebut (Singh dan Chaudary 1979, Mather dan Jink 1982), dengan menggunakan pembanding ttab(0.05,∼) = 1.96.
thit = [d] / SE[d] …….. (rumus 11) dengan [d] adalah komponen genetik, dan SE[d] adalah galat bakunya.
Prosedur Uji Skala Gabungan menurut Mather dan Jink (1982) serta Singh dan Chaudhary (1979) adalah dengan menyatakan nilai rata-rata peubah yang diamati pada setiap famili ke dalam bentuk persamaan komponen genetik dan pembobotnya. Koefisien komponen genetik dalam Uji Skala Gabungan disajikan pada Tabel 6.
Tabel 6. Koefisien komponen genetik dalam Joint Scaling Test
Famili Bobot m [d] [h] [i] [j] [1] Rata-rata
PI 1/(SEP1) 1 1 0 1 0 0 P1
P2 1/(SEP2) 1 -1 0 1 0 0 P2
Fl 1/(SEFI) 1 0 1 0 0 1 F1
F2 1/(SEF2) 1 0 ½ 0 0 ¼ F2
BCI(P1) 1/(SEBCI(Pl)) 1 ½ ½ ¼ ¼ ¼ 1( )
1 P BC BCI(P2) 1/(SEBCl(P2)) 1 -½ ½ ¼ ¼ ¼ ) 2 ( 1P BC
Dalam pengujian, terlebih dahulu dilakukan pengujian kesesuaian dengan model aditif-dominan. Karena ada enam, maka tersedia enam persamaan untuk
menduga tiga komponen. Selanjutnya, keenam persamaan digabungkan untuk memperoleh tiga persamaan, dengan cara: 1) masing-masing persamaan dikalikan dengan koefisien m dan bobotnya, kemudian dijumlahkan; 2) masing-masing persamaan dikalikan dengan koefisien [d] dan bobotnya, kemudian dijumlahkan; dan 3) masing-masing persamaan dikalikan dengan koefisien [h] dan bobotnya, kemudian dijumlahkan. Dengan demikian diperoleh tiga persamaan sebagai berikut:
a1m + b1[d] + c1[h] = y1 a2m + b2[d] + c2[h] = y2 a3m + b3[d] + c3[h] = y3
Ketiga persamaan tersebut dapat ditulis dalam bentuk matriks sebagai berikut:
[ ]
[ ]
S M J y y y h d m c c c b b b a a a = ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎣ ⎡ = ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎣ ⎡ ⎥ ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎢ ⎣ ⎡ 3 2 1 3 2 1 3 2 1 3 2 1 M = J-1 SBerdasarkan nilai m, [d], dan [h] yang diperoleh, maka nilai harapan dari rata-rata pengamatan dari masing-masing generasi dapat dihitung.
Kesesuaian antara nilai pengamatan dan nilai harapan diuji dengan Chi-kuadrat (χ2) sebagai berikut:
(
Oi Ei)
WiX2 =
∑
− 2 ; db = 6-3 =3 …….. (rumus 12) dengan Oi, Ei, dan Wi berturut-turut adalah nilai pengamatan, nilai harapan, dan bobot dari famili ke-i. Oleh karena hanya tiga komponen yang diduga dengan enam persamaan maka derajat bebasnya (db) adalah 6-3 = 3.Apabila nilai χ2
hitung lebih kecil dari nilai χ2tabel, maka aksi gen yang berperan dalam mengendalikan karakter yang diamati adalah bersifat aditif-dominan. Apabila aksi gen tidak memenuhi model aditif-dominan, maka berarti ada interaksi gen non-alelik. Untuk mengetahui model genetik epistatik yang paling sesuai dilakukan pengujian model dengan menggunakan model genetik dengan empat atau lima komponen. Prosedur pengujiannya sama seperti pada pengujian model untuk tiga komponen (Mather dan Jink 1982).
5. Pendugaan Nilai Heritabilitas
Nilai duga heritabilitas arti luas (h2bs) dan arti sempit (h2ns) dapat dihitung dengan rumus sebagai berikut:
(
)
2 2 1 1 2 2 2 2 2 2 2 /3 F P P F F bs h σ σ σ σ σ − + + = (Allard 1960) ….. (rumus 13)(
)
2 ) 2 ( 1 ) 1 ( 1 2 2 2 2 2 2 2 F BC BC F ns P P hσ
σ
σ
σ
− + = (Warner 1952) ….. (rumus 14) dengan σ2PI, σ2P2, σ2F1 , σ2F2, σ2BC1(P1 ) dan σ2BC1(P2) berturut-turut adalah ragam populasi P1, P2 , F1 , F2 , BC1(P1) , dan BC1(P2). Nilai duga heritabilitas dianggap rendah bila h2 < 0.2, sedang bila 0.2 ≤ h2≤ 0.5, dan tinggi bila h2 > 0.5 (Stansfield 1983).