57
RECOVERY
TIMBAL DENGAN EKSTRAKSI FASE PADAT MENGGUNAKAN
KITOSAN TERIMOBILISASI DITIZON
Cicilia Valentia Allen1*, Lia Destiarti1, Titin Anita Zaharah1
1Progam Studi Kimia, Fakultas MIPA, Universitas Tanjungpura, Jln. Prof. Dr. H. HadariNawawi 78124, Pontianak
*email: cicilia.valentia.allen@gmail.com
ABSTRAK
Keberadaan logam berat di lingkungan perairan kebanyakan berada dalam jumlah yang relatif kecil sehingga tidak dapat terukur oleh alat analisis. Oleh karena itu, perlu dilakukan penelitian tentang pengembangan teknik prekonsentrasi logam Pb(II) dengan menggunakan kolom prekonsentrasi yang berisi kitosan terimobilisasi ditizon untuk mengatasi persoalan tersebut. Kitosan terimobilisasi ditizon dibuat dengan mencetak larutan kitosan menggunakan syringe 3 mL menjadi kitosan bead kemudian diimobilisasi dengan ditizon dalam medium klorofom. Kitosan terimobilisasi ditizon yang diperoleh diuji kelarutannya dan dikarakterisasi dengan Fourier Transform Infra Red Spectrometer (FT-IR) yang menunjukkan spektrum baru pada bilangan gelombang 1080,14 cm-1 dan 2137,13 cm-1untukgugus S=C
dan S-H.Adsorben ini selanjutnya digunakan sebagai pengisi fasa diam pada kolom prekonsentrasi. Sebanyak 20 mL larutan timbal 3 ppm diadsorpsi pada kolom prekonsentrasi dengan variasi pH 6, 7 dan 8; laju alir 0,15 ml/menit. Desorpsi dilakukan menggunakan 10 mL EDTA dengan variasi konsentrasi 0,05;0,10;0,15 dan 0,25 M. Penentuan kadar Pb pada larutan sisa adsorpsi dan hasil desorpsi dianalisis dengan spektrofotometer serapan atom. Penyerapan 20 mL larutan Pb(II) pada kolom prekonsentrasi mencapai optimum pada pH 6 dan konsentrasi EDTA 0,05 M dengan volume 10 mL. Kondisi optimum yang diperoleh selanjutnya diaplikasikan pada 20 mL larutan Pb(II) dan diperoleh persen recovery sebesar 79,75%.
Kata Kunci: Kitosan-ditizon, prekonsentrasi, timbal, ekstraksi fase padat PENDAHULUAN
Logam berat yang telah menjadi pencemar lingkungan umumnya berada dalam jumlah yang kecil di lingkungan perairan.Berdasarkan data hasil pemantauan kualitas air permukaan olehBadan Lingkungan Hidup Kota Pontianak pada tahun 2012, kadar timbal di beberapa titik sungai Kapuas konsentrasinya berada di bawah rentang kerja pengukuran yaitu <0,0001 mg/L. Oleh karena itu, perlu dilakukan prekonsentrasi atau pemekatan agar dapat memperoleh konsentrasi analit yang cukup tinggi sehingga dapat terukur pada rentang kerja metode analisis.
Ekstraksi fase padat atau Solid Phase Extraction (SPE) yang akan digunakan dalam penelitian ini merupakan teknik pemisahan dan prekonsentrasi ion logam yang lebih efisien dan dapat mengatasi kelemahan ekstraksi pelarut (Anthemidis,et al.2002) dan memiliki ketepatan serta selektivitas yang tinggi(Jing, et al. 2007). Rohyami (2011) melaporkan bahwa dengan menggunakan kitin terimobilisasi ditizon sebagai adsorben pengisi kolom ekstraksi fasa padat untuk prekonsentasi ion logam Cu(II) kapasitas
adsorpsinya dapat meningkat. Proses imobilisasi ditizon pada kitin juga telah dilakukan oleh Mudasir, et al.(2008) yang juga menghasilkan peningkatan kapasitasadsorpsi terhadap logam Cd(II) dan Cu(II).
Menurut Rohyami (2013) Modifikasi adsorben dapat dilakukan dengan menggunakan ligan organik untuk meningkatkan kapasitas adsorpsi dan selektifitas pemisahan. Ditizon (1,5-difeniltiokarbazon) merupakan salah satu ligan organik yang banyak digunakan karena mempunyai atom S dan N pada gugus –S-H dan –N-H yang berperan sebagai donor pasangan elektron untuk membentuk khelat dengan adsorben. Juhana, dkk., (2010) juga menggunakan adsorben zeolit yang diimobilisasi dengan ditizon untuk prekonsentrasi logam Cu(II) dengan metode SPE.Imobilisasiligan ditizon pada resin ester polimetakrilat juga dilakukan oleh Chwastowska, et al. (2008).
Wiyarsi, dkk (2009) menyatakan bahwa kitosan diketahui tidak larut di dalam air dan beberapa pelarut organik seperti dimetilsulfoksida (DMSO) dan pelarut alkohol organik namun kitosan dapat larut dalam asam
58 organik encer melalui protonasi gugus amino bebas pada pH kurang dari 6,5. Sebagai pengembangan dari penelitian yang dilakukan oleh Ketkangplu, et al. (2005) yang melakukan prekonsentrasi logam Cu(II), Cd(II) dan Pb(II) menggunakan adsorben kitosan, maka akan dilakukan modifikasi dari kitosan yang memiliki gugus aktif amina (-NH2) dengan penambahan ditizon agar kemampuan adsorpsi dan kestabilannya menjadi semakin baik. peningkatan kemampuan penyerapan logam diperkirakan terjadi karena adanya penambahan gugus aktif baru pada kitosan yang telah diimobilisasi menggunakan ditizon. Penelitian lain juga dilakukan oleh Sehol (2006) yangmensintesis kitosan-tiourea untuk adsorpsi logam Cu(II) sehingga meningkatkan daya adsorpsinya.
Pada penelitian ini digunakan adsorben kitosan terimobilisasi ditizon sebagai pengisi kolom prekonsentrasi. Parameter yang dipelajari meliputi optimasi adsorpsi, dengan menentukan optimum pH larutan Pb(II), serta optimasi desorpsi logam dengan pemilihan konsentrasi eluen EDTA yang sesuai untuk mendesorpsi Pb(II) yang sudah teradsorpsi dan diperoleh persen recovery.
METODE PENELITIAN Alat dan Bahan
Alat
Alat-alat yang digunakan dalam penelitian ini adalah peralatan gelas standar yang digunakan di laboratorium kimia, neraca analitik dengan ketelitian 0,001 g, kolom kaca berdiameter 1,2 cm, pemanas listrik, pengaduk magnetik, spektrofotometer serapan atom merk Shimadzu AA-7000, spektrofotometer FT-IR 8201PC Shimadzu dan syringe 3 mL.
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah akuades (H2O), akua demineralisasi, asam asetat glasial (CH3COOH), asam klorida (HCl), asam nitrat pekat (HNO3), ditizon(C13H12N4S), kitosan (C6H11NO4)n, kloroform(CHCl3),larutan bufer posfat pH 3, 5, 6, 7, 8, dan 9, natrium hidroksida (NaOH), Na-EDTA (C10H14N2Na2O8+2H2O), dan timbal nitrat (Pb(NO3)2).
CARA KERJA
Pembuatan Larutan Kitosan (Muthoharoh, 2012)
Sebanyak 20 gram serbuk kitosan ditimbang dan dilarutkan dengan asam asetat 2,5%. Ditambahkan sebanyak 500 mL asam asetat
perlahan sambil diaduk sampai semua serbuk kitosan larut. Didiamkan selama 24 jam sampai semua serbuk larut sempurna.
Pembuatan Kitosan Terimobilisasi Ditizon (Zaharah, dkk., 2013)
Dimasukan sejumlah larutan kitosan ke dalam syringe 3 mL lalu diteteskan ke dalam 1 L larutan NaOH 1 M sampai semua larutan kitosan habis. Kitosan bead lalu diaduk menggunakan strirrer selama 15 menit. Setelah itu disaring dan dicuci hingga diperoleh filtrat dengan pH netral. Kitosan bead selanjutnya diimobilisasi dengan cara direndam dalam 15% larutan ditizon dan dibiarkan selama 6 hari. Setelah direndam, kitosan terimobilisasi ditizon dicuci hingga pH netral dan dikarakterisasi dengan FT-IR.
Uji Kelarutan Kitosan Terimobilisasi Ditizon Ditimbang ±1 gram kitosan terimobilisasi ditizon, kemudian masing-masing dimasukkan ke tabung reaksi. Ditambahkan 2 mL akuades ke dalam semua tabung yang berisi adsorben kemudian dikondisikan masing-masing tabung dengan nilai pH 5, 6, 7, dan 8 kemudian dihomogenkan. Setelah dikondisikan dalam pH yang sesuai, adsorben ditimbang kembali untuk melihat pengurangan berat setelah dilakukan uji. Dihitung persen berat yang hilang untuk semua variasi pH. Dilakukan 3 kali penggulangan untuk setiap perlakuan.
Recovery Timbal dengan Kolom Prekonsentrasi SPE (Ketkangplu, 2005)
a. Penentuan pH optimum
Sebanyak 20 mL larutan Pb(II) 3 ppm dialirkan pada kolom prekonsentrasi dengan variasi pH 6, 7 dan 8 dan digunakan massa adsorben kitosan terimobilisasi ditizon sebesar5 gram sebagai fase diam dengan laju alir 0,15 mL/menit. Dialiri kembali ke dalam kolom sebanyak 10 mL larutan EDTA 0,10 M sebagai agen pendesorpsi. Eluat dan hasil desorpsi dikumpulkan dengan menggunakan wadah dan diukur dengan SSA. Dilakukan 3 kali penggulangan untuk setiap percobaan. Persen penyerapan kitosan terimobilisasi ditizon terhadap ion Pb(II) yang tertahan pada kolom dapat ditentukan dari perbedaan antara konsentrasi logam awal (Ns) dan jumlah konsentrasi logam pada eluat (Nf) dengan persamaan 1:
59 b. Desorpsi menggunakan variasi konsentrasi EDTA sebagai pendesorpsi
Sebanyak 20 mL larutan Pb(II) 3 ppm dialirkan pada kolom prekonsentrasi dengan pH optimum yang diperoleh dan digunakan massa adsorben kitosan terimobilisasi ditizon sebesar 5 gram sebagai fase diam dengan laju 0,15 mL/menit. Sebanyak 10 mL larutan EDTA dilewatkan pada kolom prekonsentrasi sebagai pendesorpsi. Eluat dan hasil desorpsinya kemudian dikumpulkan dan dianalisis menggunakan SSA. Perlakuannya diulangi sebanyak 3 kali dengan konsentrasi EDTA yang bervariasi yaitu dalam konsentrasi 0,05; 0,10; 0,15 dan 0,25 M.
c. Recovery timbal pada kolomprekonsentrasi Sebanyak 20 mL larutan Pb(II) 3 ppm dialirkan pada kolom prekonsentrasi dengan pH 6 dan digunakan massa adsorben kitosan terimobilisasi ditizon sebesar 5 gram sebagai fase diam dengan laju alir 0,15 mL/menit. Kemudian sebanyak 10 mL larutan EDTA 0,05 M dilewatkan pada kolom prekonsentrasi sebagai pendesorpsi. Eluat dan hasil desorpsinya kemudian dikumpulkan dan dianalisis menggunakan SSA. Perlakuannya diulangi sebanyak 3 kali dan hasilnya dianalisis untuk menentukan persen recovery berdasarkan Persamaan 2.
% Recovery = HASIL DAN PEMBAHASAN
Preparasi Kitosan Hidrogel dan Pembuatan Adsorben Kitosan Terimobilisasi Ditizon Larutan kitosan dalam asam asetat yang diperoleh, diteteskan menggunakan syringe 3 mL ke dalam larutan NaOH 1 M sehingga akan terbentuk bead sesuai dengan bentuk tetesan dari syringe yang digunakan. Setiap celah dalam struktur kitosan bead yang terbentuk diisi oleh larutan encer asam asetat. Pada proses tersebut diketahui bahwa tidak terjadi perubahan ikatan pada gugus fungsi kitosan, yang terjadi hanya perubahan pada bentuk fisiknya saja (Basuki, 2009). Kitosan bead yang terbentuk kemudian dicuci hingga diperoleh pH 7 bertujuan untuk menghindari pengaruh pH terhadap kitosan bead karena sifat kitosan yang mudah larut dalam asam. Lalu dilanjutkan dengan proses imobilisasi menggunakan ditizon dan dikarakterisasi menggunakan spektrofotometer infra merahuntuk mengetahui keberhasilan proses imobilisasi. Imobilisasi antara kitosan dan ditizon merupakan salah satu cara untuk meningkatkan kemampuan adsorpsi dari kitosan terhadap
logam Pb(II) terlarut. Proses imobilisasi adsorben kitosan dengan ditizon bertujuan untuk menambahkan gugus aktif pada kitosan (gambar 1). Sehingga dapat meningkatkan kapasitas adsorpsi terhadap logam Pb(II) (Mudasir,et al. 2008). Selain bertujuan untuk menambah gugus aktif pada adsorben kitosan, proses imobilisasi ditizon pada kitosan juga dapat meningkatkan kestabilan kitosan terhadap asam sehingga saat adsorben digunakan untuk mengadsorpsi Pb(II) (gambar 2) pada kolom ekstraksi fase padat, adsorben kitosan ditizon bersifat stabil.
Kestabilan dari adsorben kitosan terimobilisasi ditizon dapat diketahui dengan melakukan uji kelarutan.Proses pengujiannya dilakukan dengan mengkondisikan sejumlah kitosan terimobilisasi ditizon dalam beberapa variasi kondisi pH, lalu dihitung persen selisih berat yang hilang setelah uji.
Salah satu syarat adsorben yang dapat digunakan sebagai fasa diam pada proses kolom ekstraksi fase padat adalah tidak larut dalam larutan yang digunakan. Pada kondisi asam dengan pH kurang dari 6,5, adsorben kitosan mengalami pengurangan massa, hal tersebut dikarenakan sifat kitosan yang dapat larut dalam asam (Wiyarsi, dkk.,2009).
Tabel 1. Data hasil uji kelarutan adsorben kitosan terimobilisasi ditizon
pH Persen Selisih Berat (%)
5 20,98
6 24,93
7 50,53
8 36,98
Berdasarkan hasil uji kelarutan pada pH 5-8, kitosan terimobilisasi ditizon tidak larut pada pH 5 yang mewakili suasana asam, hal tersebut membuktikan bahwa proses imobilisasi dapat meningkatkan kestabilan dari kitosan.
Penelitian serupa juga telah dilakukan oleh Santoso (2008) yang mengimobilisasi asam humat pada kitosan menggunakan metode reaksi pengikatan-silang terproteksi dan aplikasinya sebagai adsorben Pb(II), Cd(II), dan Cr(III) dilaporkan bahwa terjadi peningkatan kapasitas dan stabilitas dari adsorben yang signifikan setelah proses imobilisasi.
60 Karakterisasi Kitosan Terimobilisasi Ditizon Berdasarkan Tabel 2, nilai spektra FT-IR kitosan bead pada bilangan gelombang 3417,86 cm-1 mengalami pergeseran bilangan gelombang dan menghasilkan pita serapan yang lebih lebar setelah diimobilisasi dengan ditizon pada 3433,29 cm-1 yang menunjukan gugus O-H. Sedangkan serapan pada bilangan gelombang 2924,09 cm-1 merupakan rentang C-H dari metilen (-CH2) juga muncul dari rantai utama kitosan hidrogel yang berbentuk siklik.
Tabel 2. Interpretasi gugus fungsi spektra inframerah kitosan dan kitosan terimobilisasi ditizon
Bilangan Gelombang (cm-1)
Interpretasi Gugus Fungsional Kitosan * Kitosan** Kitosan
*** Kitosan Terimobilisasi Ditizon *** 3444,2 3433,8 3417,86 3433,29 -OH - 2916,9 2931,80 2924,09 C-H (-CH2) - - - 2137,13 S-H 1651,9 1655,3 1635,64 1635,64 -C=O- 1574,69 1563,0 - - N-H (Amida) 1423,15 - - 1419,61 N-H (Amina) - 1378,0 1381,03 1381,03 C-H (CH3) 1318,08 1310,0 1327,03 1319,31 -CH2 bending 1260,43 - 1257,59 1257,59 -CH3 bending - 1156,3 1149,57 - C-O streching - 1085,4 1087,85 - C-O - - - 1080,14 S=C 1029,4 - 1033.85 1033,85 C-N
*hasil isolasi Laksono, dkk., (2008) ; **hasil isolasi Mohadi, dkk., (2007); ***hasil isolasi peneliti
Serapan pada bilangan gelombang 1635,64 cm-1 menunjukkan pita serapan C=O yang berasal dari gugus amina dan menunjukkan kemungkinan bahwa masih terdapat kandungan kitin yang tidak terdeasetilasi (Rahmi dan Julinawati, 2009). Munculnya spektra baru pada bilangan gelombang 1080,14 cm-1 yang semula tidak muncul pada spektra kitosan menandakan pita serapan gugus S=C dari ditizon yang terikat pada kitosan.
Hilangnya spektra pada bilangan gelombang 2368,59 cm-1 dan 2291,43 cm-1 diikuti dengan munculnya spektra baru pada bilangan gelombang 2137,13 cm-1 pada spektra kitosan hasil imobilisasi yang menandakan pita serapan S-H yang kemungkinan merupakan gugus baru hasil interaksi antara gugus amina pada kitosan dengan gugus S=C dari ditizon (Sehol, dkk., 2001). R C O H H H R C O H H H H S C N N Ph HN N Ph H C H H R
Kitosan Terimobilisasi Ditizon H+ Tahap 1 : Tahap 2 :R C O H H H H + S C N N Ph HN N Ph H S C N N Ph HN N Ph C H H R -H+
Gambar 1. Reaksi imobilisasi kitosan dengan ditizon + C H H HN R S C N N Ph HN N Ph C H H NH R S C N N Ph N N Ph C H H NH R S C N N Ph N N Ph Pb2+ Pb
Gambar 2. Interaksi Pb(II) dengan adsorben kitosan terimobilisasi ditizon(Rohyami, 2013)
Penentuan pH Optimum
Proses adsorpsi dalam larutan pada umumnya dipengaruhi oleh pH, karena pH akan mempengaruhi muatan pada situs aktif atau ion H+ akan berkompetisi dengan kation untuk berikatan dengan situs aktif (Utami, dkk., 2009).Kondisi keasaman dari larutan ion logam juga memberikan pengaruh terhadap persen penyerapan sehingga perlu ditentukan pH optimum proses adsorpsi (Safrianti, 2012).
61 Persen penyerapan pada Tabel 3 menunjukan bahwa pada pH 6 jumlah Pb(II) yang teradsorpsi mencapai jumlah maksimum 87,51% lebih tinggi dibandingkan pada pH lain. Oleh karena itu, kondisi optimum pH yang digunakan adalah pH 6. Hal tersebut sesuai dengan penelitian yang telah dilakukan oleh Ketkangplu,et al. (2005) yang juga menggunakan kitosan sebagai fasa diam dari kolom prekonsentrasi.
Tabel 3.Persen penyerapan kitosan terimobilisasi ditizon berbagai pH terhadap Pb(II)
pH sampel Pb(II) Persen penyerapan (%)
6 87,51
7 76,51
8 33,28
Berdasarkan pada Tabel 3, adsorpsi Pb(II) oleh kitosan terimobilisasi ditizon pada kisaran pH 7-8 jumlah Pb(II) yang teradsorpsi cenderung turun dari 76,51-33,28% karena menurut Wardiyati (2007) pada pH tinggi (berkurangnya ion H+) dapat menyebabkan reaksi antara Pb2+ dengan OH-, sehingga membentuk endapan Pb(OH)2, endapan ini dapat menghalangi proses adsorpsi yang berlangsung menyebabkan persen penyerapannya semakin menurun selain itu menurut Mudasir, et al. (2008) akan ada persaingan antara situs aktif bermuatan negatif dari adsorben dan ion OH- untuk menarik ion logam. Oleh karena itu, terjadi penurunan persen penyerapan pada pH 7 dan 8. Persen penyerapan terbesar terjadi pada pH 6 yang menandakan jumlah situs aktif adsorben masih relatif cukup besar untuk dapat diakses oleh ion logam Pb(II).Gyananath (2011) juga mempelajari pengaruh pH terhadap persen penyerapan Pb(II) dengan menggunakan adsorben kitosan bead dan memperoleh pH 6 sebagai pH optimum. Persen penyerapannya menurun pada pH 7 dan 8 diduga bahwa spesi Pb2+ terdapat dalam jumlah yang kecil dan telah terjadi reaksi antara Pb2+ dengan OH- sehingga membentuk endapan Pb(OH)2 yang menyebabkan proses adsorpsinya terhalang.
Recovery Timbal dengan Kolom Prekonsentrasi
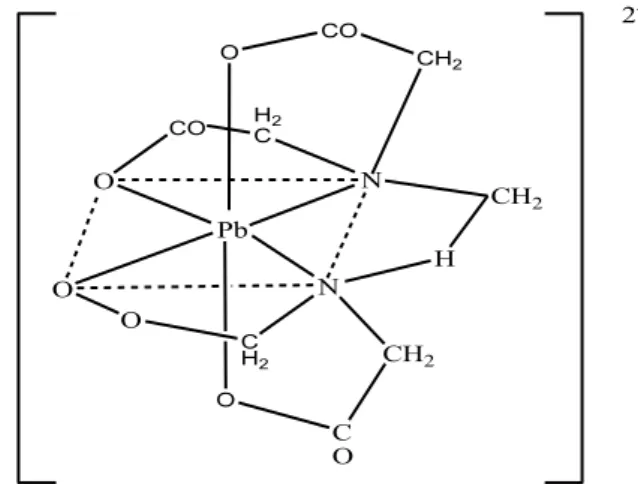
Etilen diamin tetra asetat merupakan senyawa pengompleks yang berperan sebagai agen khelat karena kemampuannya untuk mengikat ion logam, sehingga dapat digunakan sebagai agen pendesorpsi seperti terlihat pada gambar 3. Sifat EDTA yang mengandung donor elektron dari
atom oksigen dan atom nitrogen sehingga dapat menghasilkan khelat bercincin enam (Santoso, dkk., 2008). O CO CH2 CO HC2 Pb O N N O O H C H2 O CH2 C O CH2 2
-Gambar 3 Desorpsi Pb dengan EDTA membentuk senyawa kompleks (Suwarsa, 2011) Tabel 4.Jumlah Pb(II) yang dapat didesorpsi oleh EDTA pada berbagai konsentrasi
[EDTA] (mg/L) Recovery (%)
0,05 79,75
0,10 62,19
0,15 45,03
0,25 27,67
Berdasarkan Tabel 4 dapat dilihat bahwa hasil desorpsi Pb(II) paling maksimum yaitu dengan menggunakan konsentrasi EDTA 0,05 M dan menghasilkan nilai recovery sebesar 79,75 %. Akan tetapi pada kondisi yang telah optimum, terjadi penurunan persen recovery Pb(II). Menurut Khasanah (2006) fenomena ini dapat dimungkinkan akibat terjadinya deprotonisasi sebagian EDTA sehingga gugus asam karboksil tidak terionisasi sempurna sehingga pembentukkan ikatan koordinasiantara EDTA dan ion logam tidak optimal. Dengan ion logam Pb (II) sebagai ion pusat menyiapkan orbital kosong sedangkan EDTA sebagai ligan yang memiliki pasangan elektron bebas.
SIMPULAN
Berdasarkan penelitian maka dapat diperoleh kesimpulan sebagai berikut :
1. Hasil karakterisasi FT-IR menunjukkan kitosan telah berhasil diimobilisasi dengan ditizon, terlihat dengan munculnya gugus baru pada bilangan gelombang 1080,14 cm-1 dan 2137,13 cm-1 yang menandakan adanya gugus S=C dan S-H.
62 2. Persen penyerapan Pb(II) pada kolom
prekonsentrasi mencapai optimum pada pH 6 dengan nilai sebesar 87,51%.
3. RecoveryPb(II) menggunakan kolom prekonsentrasi dengan adsorben kitosan terimobilisasi ditizon mencapai maksimum perolehan recovery Pb(II) sebesar 79,75 % dengan menggunakan EDTA 0,05 M sebagai agen pendesorpsi.
DAFTAR PUSTAKA
Anthemidis, A.N.; Zachariadis, G.A.; Stratis, J.A., 2002, On-line Preconcentration and Determination of Copper, Lead and Chromium(VI) Using Unloaded Polyurethane Foam Packed Column by Flame Atomic Absorption Spectrometry inNatural Waters and Biological Samples, J.Talanta 58 : 831−840.
Badan Lingkungan Hidup Kota Pontianak, 2012, Laporan Tahunan “Hasil Pemantauan Kualitas Air Permukaan”, Pontianak
Basuki dan Sanjaya., 2009, Sintesis Ikat Silang Kitosan dengan Glutaraldehid serta Identifikasi Gugus Fungsi dan Derajat Deasetilasinya, J. Ilmu Dasar, Vol. 10 (1): 93-101
Chwastowska, J.; Skwara, W.; Sterliñska, E.; Dudek, J.M.; D.browska and Pszonicki, L., 2008, GF AAS Determination of Cadmium, Lead and Copper in Environmental Materials and Food Products after Separation on Dithizone Sorbent, Chem. Anal. (Warsaw), Vol. 53: 887-894
Gyananath, G and D. K. Balhal., 2012, Removal of Lead (II) from Aqueous Solutions by Adsorption Onto Chitosan Beads, Cellulose Chem.Technol, 46 (1-2): 121-124
Jing ; Wu. C.; Wei. Y.; Peng. C and Peng. P, 2007, Preparation of Xylanol Orange Fungtionalized Silica Gel as a Selective Solid Phase Extractor and its Application for Preconcentration-Sepration of Mercury from Waters, J.Hazard Mater 145 : 323–330.
Juhana;Swatika dan Aprilita, N.H., 2010, Kajian Prekonsentrasi logam Cu(II) dalam adsorben zeolit terimmobilisasi dithizon dengan ekstraksi fase padat, Universitas Gajahmada, Fakultas Matematika dan Ilmu Pengetahuan Alam, Yogyakarta, (Tesis).
Ketkangplu, P.; Chanyut, P. and Unob. F., 2005, Preconcentration of Heavy Metals from Aqueous Solution Using Chitosan Flake, J.Sains Res Chula University, Vol 30 (1): 87-95
Khasanah, D.W., 2006, Studi Penggunaan Na2edta dalam Desorpsi Ion Logam Kobalt (Ii) pada Kitin Terdeasetilasi dari Limbah Cangkang Kepiting Hijau (Scylla Serrata) dalam Medium Air, Universitas Negeri Semarang, Fakultas Matematika dan Ilmu Pengetahuan Alam, Semarang, (Skripsi). Laksono, W.L.; Projosantoso, AK dan Ikhsan, J.,
2008, Adsorpsi Kitosan Terhadap Ion Ni(II) dan Mn(II) Pada Berbagai pH, J. Penelitian Saintek, Vol. 13(1): 95-109
Mohadi, R.; Hidayati, N. dan N.R Melany., 2007, Preparasi dan Karakterisasi Kompleks Kitosaan Hidrogel-Tembaga(II), J. Molekul, Vol. 2(1) : 35-43
Mudasir, et al. 2008, Immobilization of Dithizone onto Chitin Isolated from Prawn Seawater Shells (P. merguensis) and its Preliminary Study for the Adsorption of Cd(II) Ion, J. Physical Science, Vol. 19(1): 63-78
Muthoharoh, S.P., 2012, Sintesis Polimer Superabsorben dari Hidrogel Kitosan Terikat Silang, Universitas Indonesia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Depok, (Skripsi).
Rahmi dan Julinawati., 2009, Aplication of Modified Khitosan for Adsorben Ionic Cu2+ Metal in Diesel Oil, J.Natural, Vol. 9(2)
Rohyami, Y., 2013, Penentuan Cu, Cd dan Pb dengan AAS Menggunakan Solid Phase Extraction, J. Inovasi dan Kewirausahaan, Vol.2(1): 19-25
Rohyami, Y., 2011, Kajian Prekonsentrasi Cu(II) dengan Metode Ekstraksi Fasa Padat Menggunakan Kitin Terimobilisasi Ditizon sebagai Adsorben, Universitas Gajahmada, Fakultas Matematika dan Ilmu Pengetahuan Alam, Yogyakarta, (Tesis).
Safrianti, I.; Wahyuni, N. dan Zaharah, T.A., 2012, Adsorpsi Timbal (II) oleh Selulosa Limbah Jerami pada Teraktivasi Asam Nitrat: Pengaruh pH dan Waktu Kontak, JKK,Vol 1 (1) : 1-7
Santoso, U.T.; Umaningrum, D.; Irawati, U. dan Nurmasari, R., 2008, Imobilisasi Asam Humat pada Kitosan Menggunakan Metode Reaksi Pengikatan-Silang Terproteksi dan Aplikasinya sebagai Adsorben Pb(II), Cd(II), dan Cr(III), Indo. J. Chem, Vol. 8(2) : 177-183 Sehol, M., 2006, Sintesis Kitosan-Tiourea dan
Aplikasinya Terhadap Adsorpsi Logam Cu(II), J.Sains dan Teknologi,hal:170-181 Suwarsa, S., 2011, Catatan Kuliah Kimia Analitik
63 Utami, U.B.L.; Rohman, T. dan Mahmud., 2009,
Adsopsi Pb(II) oleh Kitosan Terlapiskan pada Arang Aktif Cangkang Kelapa Sawit, J. Sains MIPA, Vol. 15(2) : 89 – 99
Wiyarsi, A dan Priyambodo, E., 2009, Pengaruh Konsentrasi Kitosan dari Cangkang Udang Terhadap Efisiensi Penjerapan Logam Berat, Universitas Negeri Yogyakarta, Fakultas Matematika dan Ilmu Pengetahuan Alam, Yogyakarta, (Skripsi)
Zaharah, T.A.; Shofiyani, A. dan Sayekti, E., 2013, Kinetika Adsorpsi Ion Cr(III) pada Biomassa-Kitosan Imprinted Ionik, Prosiding Semirata FMIPA Universitas Lampung, Lampung