DEGRADASI PESTISIDA ORGANOKLORIN
DENGAN METODE OKSIDASI-FENTON
HASNA KASNIANTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Fenton. Dibimbing oleh MUHAMMAD FARID dan ZAINAL ALIM MAS’UD.
Beberapa senyawa organoklorin telah digunakan untuk pestisida, di antaranya p-diklorobenzena (p-DCB), p-klorofenol, asam 2,4-diklorofenoksiasetat (2,4-D), dan dikofol. Senyawa ini cukup digemari masyarakat karena tergolong pestisida yang ampuh dan efektif. Akan tetapi, keberadaan senyawa ini dapat menimbulkan dampak buruk bagi lingkungan karena sangat beracun, persisten, dan bioakumulatif. Berbagai negara maju telah melarang produksi dan penggunaan senyawa tersebut. Namun hal ini masih sulit dilakukan oleh negara berkembang karena dibutuhkan kesiapan pemerintah dan produsen. Salah satu aspek yang perlu dipersiapkan ialah manajemen pengolahan limbah. Oksidasi-Fenton merupakan metode yang telah diterapkan untuk pengolahan berbagai limbah industri. Metode ini menggunakan hidrogen peroksida (H2O2) sebagai pengoksidasi dan
besi sebagai katalis. Penelitian ini bertujuan menentukan pengaruh pH dan nisbah FeSO4⋅7H2O−H2O2 (b/b) dalam reaksi oksidasi-Fenton. Sampel yang digunakan ialah
p-DCB, p-klorofenol, dan 2,4-D. Ragam pH yang digunakan 1, 3, 4, 5, 6, 8, dan 11; sedangkan ragam nisbah yang digunakan 1:10, 1:20, 1:40, 1:80, dan 1:100. Rerata persen degradasi p-klorofenol, p-DCB, dan 2,4-D berturut-turut berkisar 84.32−94.66%, 0−42.75%, dan 17.06−99.87%. Pola degradasi ketiga senyawa tersebut cukup beragam sehingga belum dapat ditentukan rentang pH dan nisbah FeSO4⋅7H2O−H2O2 yang baik
untuk reaksi oksidasi-Fenton. Pengaruh pH dan nisbah pun diteliti melalui dekomposisi H2O2 dengan ragam pH 1 dan 11, serta ragam nisbah FeSO4⋅7H2O−H2O2 1:10 dan 1:100.
Persen dekomposisi H2O2 tertinggi diperoleh pada nisbah 1:10 dengan kondisi pH 11.
ABSTRACT
HASNA KASNIANTI. Degradation Pestisida of Organochlorine with Oxidation-Fenton
Method. Supervised by MUHAMMAD FARID and ZAINAL ALIM MAS’UD.
Several compounds of organochlorine have been used as pesticides, namely para-dichlorbenzene (p-DCB), para-chlorophenol, 2,4-dichlorophenoxyacetic acid (2,4-D), dichlorodiphenil trichloroethane (DDT), and dicofol. These chlorinated hydrocarbons are very effective to control several insect pests. Despite the effectivenes, such compounds have shown negative impact to the environment due to its highly toxic property and persistence. Some modern countries have banned such chlorinated hydrocarbon pesticides but some developing countries are still facing dilema. Some developing countries have not yet totally banned the products. The Fenton-oxidation method may be used to solve the chlorinated hydrocarbon pollutant in the environment. This method utilizes hydrogen peroxyde (H2O2) as oxidant and ferum (Fe) as catalyst. Through this study, the roles of
pH and the ratio of FeSO4 to H2O2 in the Fenton-oxydative reaction were investigated.
The tested materials were p-DCB, p-chlorophenol and 2,4-D while the tested pH and the ratio of FeSO4 to H2O2 were 1, 2, 3, 4, 5, 6, 8, 11 and 1:10, 1:20, 1:40, 1:80, 1:100,
respectivelly. The average degradation of p-chlorophenol, p-DCB, and 2,4-D were 84.32−94.66%, 0.00−42.75%, and 17.06−99.87%, respectivelly. The degradation pattern of the three tested materials varied so the precise ranges of pH as well as the ratio FeSO4
to H2O2 for the effective Fenton-oxydative reaction had to be identified. The effect of pH
and ratio of FeSO4 to H2O2 were also tested through the decomposition of H2O2 within pH
1 and 11, and ratio of 1:10 and 1:100. The result showed that the highest percentage decomposition of H2O2 was achieved on ratio 1:10 of pH 11.
DEGRADASI PESTISIDA ORGANOKLORIN
DENGAN METODE OKSIDASI-FENTON
HASNA KASNIANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
NRP : G44202045
Menyetujui:
Drs. Muhammad Farid
Dr. Zainal Alim Mas’ud, DEA
NIP 132 002 064 NIP 131 578 815
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131 578 806
5
PRAKATA
Segala puji dan syukur hanya tercurah kepada Allah SWT atas segala nikmat dan karunia yang telah diberikanNya, serta hanya dengan izinNya, saya dapat menuntaskan skripsi ini. Shalawat dan salam selalu dilimpahkan kepada Rasulullah SAW, yang telah membimbing manusia dari kegelapan menuju cahaya.
Ucapan terima kasih saya haturkan kepada Bapak Drs. Muhammad Farid dan Bapak Dr. Zainal Alim Mas’ud sebagai Pembimbing I dan II, dan Bapak Ahmad Sjahriza yang telah membimbing saya dalam mengolah data dengan program Umetric Modde. 5. Ucapan ini saya tujukan pula kepada Mas Khotib beserta seluruh kru Lab. Terpadu atas bimbingan, keramahan, dan kemudahan fasilitas yang diberikan selama penelitian di laboratorium tersebut. Begitu pun juga kepada Bapak Sobur, Ibu Yeni, dan rekan-rekan di Lab. Organik yang telah mempercayakan saya untuk bekerja malam sehingga dapat mempercepat waktu penelitian. Ucapan ini pun saya sampaikan kepada semua rekan Kimia 39, rekan FSA Al Ghufran SMUN 3 Bogor, dan adik-adik kelas atas semua bantuan, motivasi, dan doa agar saya terus melangkah untuk menyelesaikan penelitian ini. Terakhir, ucapan ini saya haturkan secara spesial kepada Ibu dan Bapak atas kesabaran dan lantunan doa yang selalu mengiringi langkah anakmu ini.
Saya berharap karya ini dapat memberi kontribusi bagi lahirnya karya-karya besar di waktu mendatang. Ibarat nyala lilin kecil di dalam gulita, yang dapat membantu orang di sekitarnya untuk memulai pekerjaan yang lebih besar. Dan ibarat sebuah batu bata yang tersusun di antara bangunan megah ilmu pengetahuan dan teknologi, menuju Indonesia serta dunia yang lebih baik dan sejahtera.
Bogor, Juni 2008
Hasna Kasnianti
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 1 Februari 1984 dari Bapak Ir. Kasno, M.Sc dan Ibu Sri Muryantini. Penulis merupakan anak ketiga dari empat bersaudara.
Tahun 2002, penulis lulus dari SMU Negeri 3 Bogor dengan memperoleh DANUN IPA tertinggi di SMU Negeri 3 Bogor. Pada tahun yang sama, penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Tahun 2005, penulis menjalankan kegiatan praktik lapangan di Laboratorium Pangan Pakan SEAMEOBIOTROP Bogor, dengan judul Analisis Kandungan Aflatoksin BB1 pada Produk Kacang Tanah dengan Metode Kromatografi Lapis Tipis dan ELISA.
vi
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1 TINJAUAN PUSTAKA Penggolongan Organoklorin ... 1 Pestisida Organoklorin ... 1 Degradasi Organoklorin ... 3 Reagen Fenton ... .... 3 Analisis Klorida ... 4
BAHAN DAN METODE Bahan dan Alat ... 4
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN Degradasi Senyawa p-Klorofenol ... 5
Degradasi Senyawa p-Diklorobenzena ... 6
Degradasi Senyawa Asam 2,4 Diklorofenoksi Asetat... 7
Dekomposisi Hidrogen Peroksida ... 8
SIMPULAN DAN SARAN Simpulan ... 9
Saran ... 9
DAFTAR PUSTAKA ... 9
LAMPIRAN ... 11
DAFTAR TABEL
Halaman
1 Kekuatan oksidasi relatif dari gugus reaktif ... 3
2 Rerata persen degradasi p-klorofenol ... 5
3 Rerata persen degradasi p-diklorobenzena ... 6
4 Rerata persen degradasi asam 2,4 diklorofenoksi asetat ... 7
5 Rerata persen dekomposisi hidrogen peroksida ... 8
DAFTAR GAMBAR
Halaman
1
Struktur senyawap-DCB, p-klorofenol, dan 2,4-D
... 22
Kurva tiga dimensi rerata persen degradasi p-klorofenol ... 63 Kurva kontur rerata persen degradasi p-klorofenol ... 6
4 Kurva tiga dimensi rerata persen degradasi p-diklorobenzena ... 7
5 Kurva kontur rerata persen degradasi p-diklorobenzena ... 7
6 Kurva tiga dimensi rerata persen degradasi asam 2,4-D ... 8
7 Kurva kontur rerata persen degradasi asam 2,4-D ... 8
DAFTAR LAMPIRAN
Halaman
1
Prosedur pembuatan pereaksi ... 122 Diagram alir penelitian ... 13
3 Prosedur analisis dan standardisasi ... 15
PENDAHULUAN
Organoklorin merupakan salah satu kelompok senyawa yang banyak berperan di masyarakat, baik di bidang pertanian, industri, maupun kesehatan. Beberapa senyawa organoklorin (p-diklorobenzena, p-klorofenol, asam 2,4-diklorofenoksiasetat (2,4-D), DDT (dikloro difenil trietilena), dikofol, dan lainnya) telah lama digunakan di bidang pertanian. Senyawa tersebut cukup digemari masyarakat karena tergolong pestisida yang ampuh dan efektif. Hal ini dapat dilihat dari tingginya angka produksi senyawa tersebut. Pada tahun 1982, angka produksi senyawa 2,4-D telah mencapai 45.1 juta pon, sedangkan senyawa p-DCB pada tahun 1995 telah mencapai 80 juta pon (Krishnamurti 1999).
Keberadaan senyawa organoklorin dapat menimbulkan dampak buruk bagi lingkungan karena sangat beracun, persisten, dan bioakumulatif. Bahkan beberapa senyawa organoklorin telah dilarang penggunaannya, terutama yang termasuk dalam kelompok POP (polutan organik persisten), seperti DDT. Sementara itu, penggunaan organoklorin selain kelompok POP masih ditanggapi berbeda oleh berbagai negara. Sebagian besar negara maju memang telah mengurangi bahkan melarang produksi dan penggunaan senyawa ini melalui program ekolabel. Namun, bagi negara berkembang, hal ini masih sulit dilaksanakan karena dibutuhkan kesiapan pemerintah dan produsen. Oleh karena itu, diperlukan kesiapan langkah untuk meminimalkan dampak limbah organoklorin, terutama bagi negara yang belum menghentikan penggunaan senyawa tersebut. Salah satu kesiapan yang dibutuhkan ialah manajemen pengolahan limbah.
Oksidasi Fenton merupakan metode oksidasi yang menggunakan hidrogen peroksida (H2O2) sebagai pengoksidasinya dan besi sebagai katalis. Metode ini telah diterapkan untuk pengolahan berbagai macam limbah industri yang mengandung senyawaan organik toksik (fenol, formaldehida, BTEX, dan limbah kompleks dari pestisida, cat, maupun zat aditif plastik) (US Department of Energy 1999). Gugus reaktif yang berperan dalam metode ini adalah radikal hidroksil yang dihasilkan dari reaksi antara H2O2 dan Fe2+. Namun, pembentukan radikal hidroksil membutuhkan kondisi pH yang tepat karena pada kondisi pH yang tidak sesuai, bentuk ion fero (Fe2+) dapat berubah menjadi bentuk koloid ion feri (Fe3+). Selain itu, kondisi ini pun dapat menyebabkan katalisis dekomposisi H2O2 oleh ion besi tanpa menghasilkan radikal
hidroksil (Industrial Wastewater 2007). Oleh karena itu, data mengenai pengaruh pH terhadap kinerja reagen Fenton ini sangat dibutuhkan untuk mendapatkan hasil yang optimum.
Salah satu segi yang perlu diperhatikan dalam memilih suatu metode pengolahan limbah ialah kandungan residu akhir. Walaupun residu dari proses pengolahan limbah sangat sulit dihindari, akan tetapi diperlukan upaya untuk meminimumkan dampak dari residu tersebut. Salah satu residu yang perlu diminimumkan pada metode oksidasi Fenton ialah besi. Oleh karena itu, diperlukan data nisbah FeSO4·7H2O–H2O2 (b/b) terkecil, yang masih baik digunakan dalam metode tersebut.
Penelitian ini bertujuan menentukan pengaruh pH dan nisbah FeSO4·7H2O–H2O2 dalam reaksi oksidasi Fenton untuk pendegradasian pestisida organoklorin.
TINJAUAN PUSTAKA
Penggolongan Organoklorin
Organoklorin merupakan senyawa hidrokarbon yang terklorinasi, minimal ada satu posisi hidrogen pada hidrokarbon yang digantikan oleh klorin. Berdasarkan sifat kelembaman atau persistensinya, organo-klorin dibagi menjadi tiga kelompok yaitu senyawa POP, kandidat POP, dan non-POP. Berdasarkan konvensi Stockholm pada tanggal 23 Mei 2001, senyawa POP diklasifikasikan ke dalam 3 golongan, yaitu pestisida organoklor, bahan industri organo-klor, dan senyawa yang terbentuk secara tidak sengaja dari sumber antropogenik (Nugrohati 2004).
Kandidat POP merupakan kelompok senyawa yang memiliki ciri seperti senyawa POP. Kelompok senyawa ini belum tercantum dalam daftar senyawa POP yang disepakati dalam konvensi Stockholm, namun termasuk senyawa yang dinominasikan menjadi senyawa POP. Program ini ditangani oleh sebuah komite peninjau POP, POPRC (persistent organic pollutant review committee) yang disepakati pula dalam konvensi Stockholm. Sedangkan senyawa organohalogen yang tidak tergolong kedua kelompok tersebut dikenal dengan non-POP (IPEN 2005).
Pestisida Organoklorin
Beberapa senyawa organoklorin memiliki aktivitas biologis yang signifikan. Hal ini
dapat dibuktikan oleh banyaknya insektisida ampuh dan efektif yang berasal dari senyawa ini. Organoklorin yang telah digunakan sebagai insektisida yaitu p-diklorobenzena,
p-klorofenol, asam 2,4-diklorofenoksiasetat (2,4-D), DDT (dikloro difenil trietilena), dikofol, heptaklor, endosulfan, klordan, dan mireks.
Cl Cl a. p-DCB b. p-klorofenol O HO O Cl Cl c. 2,4-D HO Cl
Klorobenzena pertama kali disintesis pada tahun 1905 dan diproduksi secara komersil pada tahun 1909. Kemudian pada tahun 1915, perusahaan Hooker Electrochemical Co. di New York memproduksi klorobenzena dalam skala besar dengan kapasitas 8200 metrik ton per tahun. Penemuan berbagai senyawa derivat klorobenzena menjadikan angka produksi senyawa ini terus meningkat, terutama di negara Eropa dan Amerika. Bahkan senyawa benzena terklorinasi ini sempat mendominasi produk komersil di daerah tersebut selama lebih dari 50 tahun. Namun pada perjalanannya, senyawa derivat klorobenzena, seperti 2,4,5-triklorofenol dan DDT dihentikan penggunaannya karena dinilai berbahaya bagi lingkungan. Akhirnya, hanya tiga senyawa klorobenzena yang masih diperbolehkan untuk diproduksi dalam jumlah besar, yaitu klorobenzena, o-diklorobenzena, and p-diklorobenzena (Krishnamurti 1999).
Senyawa para-diklorobenzena (DCB), p-C6H4Cl2, CAS number [106-46-7], merupakan bahan organik berupa padatan kristal putih dengan bau seperti kapur barus. Bobot molekul senyawa ini adalah 147.005 g/mol dengan struktur senyawa pada Gambar 1a. Sifatnya tidak larut dalam air, tetapi larut dalam alkohol, eter, aseton, dan benzena. Senyawa ini memiliki titik didih 174 °C dan titik lebur 53 °C (Arokor Holding Inc. 2007).
Fungsi utama bahan ini ialah sebagai bahan pembuat kapur barus pakaian, deodoran, serta fumigan untuk gudang dan kamar mandi. Selain itu, p-DCB pun banyak digunakan untuk insektisida dan fungisida dalam pertanian, industri bahan organik, plastik polifenilena sulfida, serta farmasi. Tingginya penggunaan p-DCB dapat berpengaruh buruk bagi lingkungan. Selain itu, p-DCB pun tergolong senyawa toksik, bahkan dapat bersifat karsinogenik bagi manusia (US EPA 2006).
Senyawa para-klorofenol, p-C6H4Cl(OH), CAS number [106-48-9], umumnya berbentuk padat pada suhu ruang dan memiliki bau yang tajam. Bobot molekul senyawa ini ialah 128.56 g/mol dengan struktur senyawa pada Gambar 1b. Senyawa p-klorofenol ini sedikit larut dalam air, memiliki titik didih 219 °C, dan titik lebur 40−41 °C (Desmurs et al. 1999).
Gambar 1 Struktur senyawa p-DCB, p-klorofenol, dan 2,4-D.
Senyawa p-klorofenol digunakan sebagai bakterisida, fungisida, dan zat pengawet. Senyawa p-klorofenol merupakan bahan baku germisida seperti 2-benzil-4-klorofenol, lalu dapat dikonversi lagi menjadi analgesik asetofenetidin. Selain itu, dapat digunakan sebagai antingengat, antiseptik, disinfektan benih, dan bahan yang dapat meningkatkan produksi latek dari pohon karet tua. Data produksi p-klorofenol di dunia sangat terbatas. Namun, BASF Corp. sebagai produsen klorofenol terbesar di dunia, telah memproduksi 100000−999000 pon klorofenol pada tahun 1996−1998 (ATSDR 1999a, 1999b, Desmurs et al. 1999).
Sinar matahari dan mikroorganisme dapat membantu penguraian senyawa ini pada level rendah. Namun demikian, EPA (environ-mental pollution agency) menempatkan klorofenol di urutan prioritas ke 166 dari 1457 rencana pelaksanaan nasional (national implemation plann, NIP) sebagai langkah pelaksanaan Konvensi Stockholm (ATSDR 1999).
Asam 2,4-diklorofenoksiasetat (2,4-D), C(OC6H3Cl2)COOH, CAS number [94-75-7], merupakan produk derivat klorofenol (sintesis dari 2,4-klorofenol). Bobot molekulnya ialah 221.0 g/mol dengan struktur senyawa pada Gambar 1c. Senyawa 2,4-D ini sedikit larut dalam air dan memiliki titik lebur 138 °C (US EPA 2006).
Senyawa ini berperan sebagai herbisida dalam perkebunan tembakau dan kayu. Selain itu, digunakan juga pada pemanenan gandum dan jagung, serta penanaman padang rumput (US EPA 2006). Senyawa 2,4-D ini dapat terdegradasi oleh mikrob di lingkungan dengan waktu paruh 20-200 hari (Sierra Club of Canada 2007). Walaupun demikian, senyawa ini tetap berbahaya karena terbukti dapat berubah menjadi senyawa dioksin.
3
Selain itu, 2,4-D pun tergolong senyawa toksik bagi hewan dan manusia karena dapat mengganggu sistem saraf, ginjal, dan hati (US EPA 2006).
Degradasi Organoklorin
Dahulu, limbah POP dan senyawa lain yang sulit dihancurkan diolah dengan teknologi remediasi sederhana, yaitu metode landfill cap
system dan deep well injection, dengan
penimbunan pada lahan yang telah dilengkapi lapisan pembatas dan drainase. Akan tetapi, ternyata teknologi ini sangat tidak efektif untuk senyawa persisten, bahkan dapat membahaya-kan lingkungan. Perkembangan teknologi selanjutnya ialah pembakaran bersuhu tinggi dan tanur semen. Teknologi pembakaran dengan suhu tinggi bekerja pada suhu 870– 1200 °C, sedangkan teknologi tanur semen 1100–1450 °C dalam suasana pH tinggi. Ternyata teknologi ini juga berdampak buruk bagi lingkungan dan kesehatan manusia, serta membutuhkan infrastruktur yang memadai serta manajemen emisi udara dan residu lainnya (Rahuman et al. 2000).
Dampak negatif dari teknologi pembakaran mendorong banyak ilmuwan dunia untuk merancang berbagai teknologi tanpa pembakaran. Beberapa teknologi tanpa pembakaran yang telah dikomersilkan yaitu GPCR (gas phase chemical reduction), BCD (base catalysed decomposition), SCWO (super-critical water oxidation), PLASCON (plasma arc), Reduksi Natrium, dan Pirolisis (McDowald et al. 2004).
Pengolahan limbah selain kelompok POP, umumnya lebih sederhana. Beberapa metode yang sudah digunakan untuk pengolahan limbah tersebut ialah biodegradasi dan degradasi secara kimia. Menurut Papp (1996), senyawa 2,4-diklorofenol dan diklorometana dapat didegradasi dengan metode biodegradasi inheren (membutuhkan mikrob yang sesuai). Sementara, senyawa trikloroetilena, tetra-kloroetilena, pestisida, dan hidrokarbon petroleum dapat didegradasi secara kimia melalui metode oksidasi-Fenton (US Department of Energy 1999).
Reagen Fenton
Reagen Fenton merupakan pereaksi yang terdiri atas hidrogen peroksida dan katalis besi. Reagen Fenton digunakan untuk pengolahan berbagai macam limbah industri yang mengandung senyawa organik toksik (fenol, formaldehida, BTEX, dan limbah kompleks dari pestisida, cat, maupun zat aditif plastik). Reagen ini dapat diaplikasikan untuk limbah
cairan, lumpur, atau kontaminan tanah (US Department of Energy 1999).
Hidrogen peroksida tergolong oksidator kuat. Namun, terkadang membutuhkan proses aktivasi terutama untuk beberapa senyawa seperti hidrokarbon, asam karboksilat, alkohol, dan eter. Hal ini dikarenakan dalam senyawa tersebut tidak memiliki sisi nukleofilik atau sisi reaktif lainnya yang dapat bereaksi dengan hidrogen peroksida dalam suasana normal. Salah satu cara aktivasi H2O2 ialah melalui dekomposisi radikal dari H2O2 oleh pasangan redoks satu elektron (Strukul 1992).
Besi mempunyai daya transfer oksigen khusus, yang dapat digunakan untuk mengaktivasi H2O2 dengan menghasilkan radikal hidroksil (·OH) yang tingkat kereaktifannya sangat tinggi (Industrial Wastewater 2007). Hal ini dapat dilihat dalam Tabel 1 (Metcalf & Eddy 2003).
Reaksi pembentukan radikal hidroksil dari dekomposisi H2O2 adalah sebagai berikut (Strukul 1992):
Fe 2+ + H
2O2 Fe 3+ + OH - + · OH (1) Ion feri (fe3+) yang terbentuk dapat kembali menjadi ion fero, bila bereaksi dengan H2O2, sesuai dengan persamaan berikut:
Fe 3+ + H
2O2 Fe 2+ + · OOH + H+ (2) Tabel 1 Kekuatan oksidasi relatif dari
gugus reaktif (Metcalf & Eddy 2003) Gugus Reaktif Kekuatan Oksidasi relatif (Cl2 = 1,0) Fluorin 2.25 Radikal hidroksil 2.05 Atom oksigen (singlet) 1.78 Ozon 1.52 Hidrogen peroksida 1.30 Asam hipoklorat 1.10 Klorin 1.00 Klorin dioksida 0.93 Bromin 0.80 Oksigen (molekul) 0.90 Iodin 0.54
Berdasarkan parameter COD (kebutuhan oksigen kimia), nisbah Fe–H2O2 adalah 1:5– 1:10 (b/b) dengan konsentrasi besi < 25–50 mg/L dapat bereaksi selama 10–24 jam. Produk oksidasinya (asam organik) terpisah dari besi. Reagen Fenton ini cukup efektif sebagai pengolahan pendahuluan untuk
limbah dengan nilai COD > 500 mg/L (Industrial Wastewater 2007).
Katalis besi dapat digunakan baik dalam bentuk garam fero (Fe2+) maupun feri (Fe3+). Hal ini dikarenakan sirkulasi perubahan kedua ion tersebut sangat cepat. Akan tetapi, jika konsentrasi reagen Fenton yang digunakan rendah (< 10–25 ppm H2O2), maka lebih baik menggunakan garam fero (Industrial Wastewater 2007).
Kecepatan reaksi reagen Fenton meningkat dengan peningkatan suhu (20–40 °C). Namun, jika suhu reaksi > 40–50 °C, peranan H2O2 sebagai pengoksidasi semakin berkurang karena dekomposisi H2O2 dipercepat. Selain suhu, kecepatan kerja reagen Fenton juga dipengaruhi oleh nilai pH (3–6). Pada kisaran pH tersebut, terjadi perubahan besi dari ion hidrasi besi menjadi senyawa besi koloid untuk menghancurkan bahan organik menjadi asam organik. Sebelumnya, katalis besi (bentuk radikal hidroksil) menguraikan H2O2 menjadi oksigen dan air (Industrial Wastewater 2007).
Keuntungan metode oksidasi menggunakan reagen Fenton adalah murah, siap digunakan, dan produk hasil reaksi tidak berbahaya di lingkungan (berupa air, oksigen, dan CO2). Proses reaksi ini mudah diaplikasikan dan dikontrol. Waktu pengolahan dan proses reaksi cukup cepat. Reagen Fenton tidak menghasilkan senyawa organik atsiri (US Department of Energy 1999).
Analisis Klorida
Analisis kimia ion klorida dapat berupa analisis kualitatif dan analisis kuantitatif. Prinsip analisis klorida secara kualitatif berdasarkan pembentukan endapan AgCl yang berwarna putih. Hal ini dilakukan dengan penambahan asam nitrat pekat dan beberapa tetes larutan AgNO3 0.1 N (Vogel 1959). Analisis klorida secara kuantitatif dapat dilakukan dengan berbagai cara, di antaranya metode argentometri, merkuri(II) nitrat, potensiometri, ferisianida secara otomatis, dan merkuri tiosianat (injeksi alir) (Clesceri et al. 2005).
Prinsip metode merkuri(II) nitrat ialah titrasi klorida menggunakan merkuri(II) nitrat. Difenilkarbazon (DPC) sebagai indikator dapat menunjukkan titik akhir dengan pembentukan kompleks ungu (Clesceri et al. 2005) merkuri-difenilkarbazon (Dorey & Draves 1998). Bahan-bahan yang dapat mengganggu dalam analisis ini ialah kromat, feri, dan ion sulfit jika keberadaannya lebih dari 10 mg/L (Clesceri et
al. 2005).
Reaksi titrasi yang terjadi sebagai berikut:
Hg2+ + 2 Cl- HgCl
2 (3)
Hg2+ + 2 DPC Hg(DPC)
2 (4) Merkuri(II) nitrat sebagai titran akan bereaksi dengan titrat yang mengandung klorida anorganik membentuk merkuri(II) klorida, sesuai dengan persamaan (3). Kelebihan merkuri nitrat akan bereaksi dengan indikator difenilkarbazon membentuk kompleks merkuri-difenilkarbazon yang berwarna ungu, sesuai dengan persamaan (4) (Dorey & Draves 1998).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah
sampel pestisida (p-klorofenol,
p-diklorobenzena, dan 2,4-D), garam FeSO4·7H2O. Alat-alat yang dibutuhkan adalah penangas air, pengaduk magnetik, neraca analitik, lempeng pemanas, dan peralatan kaca.
Metode Penelitian Degradasi Senyawa
Sebanyak 0.1 gram sampel dicampurkan dengan 100 mL akuades di dalam Erlenmeyer, lalu diatur pH-nya menggunakan asam sulfat/NaOH pekat, dengan ragam pH 1, 3, 4, 5, 6, 8, dan 11. Setelah itu, larutan sampel ditambahkan FeSO4·7H2O dan 5 mL H2O2 30% (Lampiran 1) sambil diaduk selama 30 menit pada suhu ruang. Adapun ragam nisbah Fe–H2O2 (b/b) yang dilakukan yaitu 1:10, 1:20, 1:40, 1:80, dan 1:100. Setiap
ragam pH dan nisbah Fe–H2O2 (b/b)
dilakukan secara triplo dan dianalisis klorida secara duplo. Larutan sampel yang telah dioksidasi kemudian diencerkan dengan akuades hingga 250 ml untuk keperluan analisis. Larutan ini disebut larutan A (Lampiran 2).
Dekomposisi Hidrogen Peroksida
Sebanyak 100 ml akuades dimasukkan ke dalam Erlenmeyer 250 ml. Kemudian diatur pH-nya, dengan ragam pH 1 dan 11. Setelah itu, ditambahkan FeSO4·7H2O dan 5 mL H2O2. Adapun ragam nisbah Fe–H2O2 (b/b) yang dilakukan yaitu 1:10 dan 1:100. Reaksi dijalankan selama 30 menit pada suhu ruang. Selanjutnya, larutan diencerkan dalam labu takar 250 mL dan ditera dengan akuades. Larutan ini disebut larutan B. Sebanyak 25 (VA) mL larutan B diencerkan lagi dalam labu
takar 100 (VB) mL. Larutan ini disebut larutan
5
peroksida. Setiap ragam pH dan nisbah Fe– H2O2 (b/b) dilakukan secara triplo dan dianalisis H2O2 secara triplo.
Analisis Klorida
Analisis klorida secara kualitatif dilakukan dengan cara, sedikit filtrat larutan A dimasukkan ke dalam tabung reaksi, ditambahkan dengan HNO3 pekat dan beberapa tetes larutan AgNO3 0.1 N (Lampiran 1). Klorin dideteksi secara kualitatif dengan terbentuknya endapan AgCl yang berwarna putih (Vogel 1959). Analisis klorida juga dilakukan untuk blangko (akuades).
Analisis klorida secara kuantitatif dilakukan dengan cara 10 mL larutan A ditambahkan 8 tetes larutan indikator campuran (Lampiran 1) hingga larutan berwarna ungu, lalu ditambahkan 1–2 tetes asam nitrat pekat hingga larutan berwarna kuning. Setelah itu, larutan dititrasi dengan merkuri nitrat 0.0141 N (Lampiran 3) sampai berwarna ungu. Analisis klorida dilakukan triplo dan juga untuk blangko (air bebas ion) (Clesceri et al. 2005).
Analisis Hidrogen Peroksida
Sebanyak 10 (VC) mL larutan contoh
perhidrol (H2O2) 30 % dimasukkan ke dalam labu takar 1000 (VL) mL, lalu diencerkan
dengan air akuades hingga tanda tera. Larutan ini disebut larutan C. Sebanyak 25 (V1) mL
larutan C dimasukkan ke dalam Erlenmeyer 250 mL, lalu ditambahkan 100 mL akuades dan 20 mL larutan H2SO4 6 N. Setelah itu, larutan dititrasi dengan KMnO4 0.1 N (Lampiran 3) sampai berwarna merah muda (Basset et al. 1978). Analisis ini dilakukan triplo.
Analisis Pengolahan Data
Data persen degradasi masing-masing sampel dianalisis menggunakan uji statistik ANOVA (analysis of variance) dua faktorial, faktor A dan faktor B. Sebelumnya, ditentukan hipotesis nol (Ho) dan hipotesis tandingan (H1) dari penelitian ini. Peluang kesalahan (taraf nyata; α) yang digunakan ialah 0.05 dengan tingkat kepercayaan (1- α ) 95%. Statistik uji Fhitung mengikuti sebaran F dengan derajat bebas (db) pembilang masing-masing faktor, n-1, dan db penyebut hasil kali db pembilang kedua faktor. Jika hasil Fhitung > Ftabel (0.05,db1,db2) dan peluang nyata (P) < α, berarti data mendukung untuk menolak Ho. Dengan kata lain, faktor A, faktor B, dan interaksi kedua faktor saling mempengaruhi atau data persen degradasi sampel berbeda nyata (Mattjik, Sumertajaya 2002).
Data persen degradasi juga diolah dengan program Umetric modde 5. Pada program ini
data yang tersedia diambil secara acak dan diolah dengan rancangan RSM (model respon permukaan), kemudian dianalisis dengan PLS (partial least square). Rancangan RSM digunakan untuk membuat pendekatan respon dengan model polinomial kuadratik. Langkah ini bertujuan mengetahui lebih detail faktor yang dapat mempengaruhi respon dan membuat prediksi, optimasi, serta kisaran pengerjaan. Analisis PLS digunakan bila respon yang akan diukur cukup banyak (lebih dari 3) dan/atau bila ada data yang hilang, serta faktor yang tidak terkontrol. Pengolahan data ini ditampilkan dengan persamaan model serta kurva 3 dimensi dan kontur (Umetric 1999).
HASIL DAN PEMBAHASAN
Penelitian ini menggunakan 3 macam pestisida organoklorin (klorofenol, p-diklorobenzena, dan asam 2,4-diklorofenoksi-asetat) dan melibatkan 2 faktor yang me-mengaruhi hasil degradasi pestisida organo-klorin yaitu faktor nisbah FeSO4·7H2O–H2O2 (b/b) dan faktor pH. Ragam nisbah yang digunakan yaitu 1:10, 1:20, 1:40, 1:80, dan 1:100. Ragam pH yang digunakan yaitu pH 1, 3, 4, 5, 6, 8, dan 11.
Degradasi Senyawa p-Klorofenol
Rerata persen degradasi p-klorofenol 84.32
−
94.66% (Tabel 2). Perubahan persen degradasi p-klorofenol terhadap faktor nisbah tidak terlalu terlihat. Persebaran angka merata di semua kondisi nisbah. Perubahan nisbah tidak berpengaruh secara nyata terhadap persen degradasi p-klorofenol dengan α 5% (Lampiran 4). Oleh karena itu, nisbah yang disarankan untuk degradasi p-klorofenol adalah 1:100.Tabel 2 Rerata persen degradasi
p-klorofenol Nisbah FeSO4·7H20–H2O2 (b/b) pH 1:10 1:20 1:40 1:80 1:100 1 94.15 94.66 90.66 92.59 92.51 3 91.11 89.04 87.69 91.40 91.02 4 89.78 90.62 90.42 92.06 90.02 5 91.43 89.26 90.61 91.47 88.49 6 91.52 90.54 92.41 90.83 92.41 8 91.95 90.82 91.26 92.27 92.41 11 92.22 90.73 92.76 88.50 84.32
5
Perubahan pH berpengaruh secara nyata terhadap persen degradasi p-klorofenol dengan α 5% (Lampiran 4). Pengaruh pH ini dapat lebih jelas terlihat melalui kurva tiga dimensi dan kontur (Gambar 2 dan 3). Kurva tersebut diolah berdasarkan data degradasi p-klorofenol yang diambil secara acak dan diolah dengan program Umetrics Modde 5. Kurva tersebut menunjukkan bahwa kondisi asam lebih efektif
mendegradasi p-klorofenol dibandingkan
dengan kondisi basa. Pengaruh interaksi antara kedua faktor nisbah dan pH tidak berpengaruh secara nyata terhadap persen degradasi p-klorofenol dengan α 5% (Lampiran 4).
Gambar 2 Kurva tiga dimensi rerata persen degradasi p-klorofenol.
Gambar 3 Kurva kontur rerata persen degradasi
p-klorofenol.
Pola persen degradasi p-klorofenol dapat
dinyatakan ke dalam persamaan berikut:
Y = 91.6354 – 1.55954 X1 – 1.19947 X2 –
1.0205 X12 – 1.73493 X1X2, dengan regresi (R2)
sebesar 29.2% Keterangan:
X1 : faktor nisbah FeSO4·7H2O–H2O2
X2 : faktor pH
Y : persen degradasi
Degradasi Senyawa p-Diklorobenzena
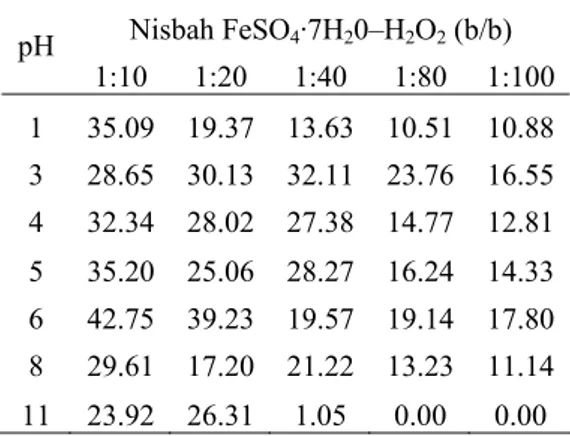
Rerata persen degradasi p-diklorobenzena (p-DCB) berkisar antara 0–42.75% (Tabel 3). Persen degradasi tertinggi diperoleh pada pH 6 dengan nisbah 1:10, sedangkan terendah
diperoleh pada pH 11 dengan nisbah 1:80 dan 1:100.
Peningkatan nisbah katalis besi dan hidrogen peroksida memengaruhi persen degradasi senyawa ini. Umumnya, semakin besar nisbah maka persen degradasi p-DCB pun akan semakin meningkat. Hal ini menunjukkan bahwa semakin meningkatnya konsentrasi katalis Fe maka proses pembentukan radikal hidroksil akan semakin cepat, sehingga p-DCB pun akan lebih cepat terurai. Faktor nisbah berpengaruh secara nyata terhadap persen degradasi p-DCB dengan α 5% (Lampiran 4).
Tabel 3 Rerata persen degradasi senyawa
p-diklorobenzena Nisbah FeSO4·7H20–H2O2 (b/b) pH 1:10 1:20 1:40 1:80 1:100 1 35.09 19.37 13.63 10.51 10.88 3 28.65 30.13 32.11 23.76 16.55 4 32.34 28.02 27.38 14.77 12.81 5 35.20 25.06 28.27 16.24 14.33 6 42.75 39.23 19.57 19.14 17.80 8 29.61 17.20 21.22 13.23 11.14 11 23.92 26.31 1.05 0.00 0.00 Persen degradasi ini cenderung lebih tinggi pada pH asam dibandingkan basa. Hal ini dapat disebabkan adanya perbedaan jenis ion besi. Pada pH asam, besi cenderung berbentuk ion fero (Fe2+), sedangkan pada pH basa cenderung berbentuk ion feri (Fe3+) (Industrial Waste-water 2007). Ion fero mengkatalisis pembentukan radikal hidroksil secara langsung dengan kecepatan reaksi yang tinggi, sedangkan ion feri harus melalui perubahan bentuk menjadi ion fero terlebih dahulu untuk menghasilkan radikal hidroksil (Munter 2001). Hal ini menyebabkan penggunaan ion feri kurang dianjurkan, terlebih untuk penggunaan konsentrasi katalis besi yang rendah (Industrial Wastewater 2007). Faktor pH berpengaruh secara nyata terhadap persen degradasi p-DCB dengan α 5% (Lampiran 4).
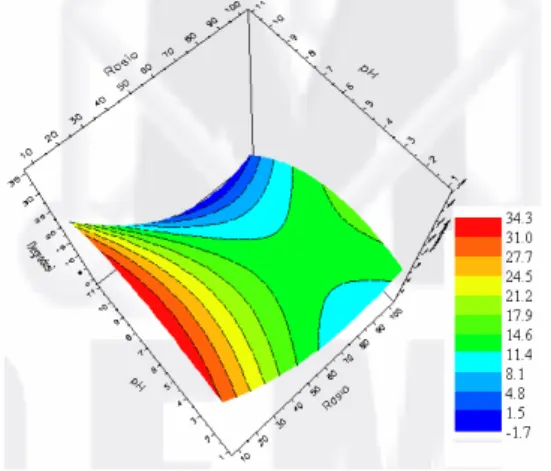
Analisa data persen degradasi p-DCB diperjelas melalui tampilan kurva tiga dimensi dan kontur (Gambar 4 dan 5). Kurva tersebut memperlihatkan bahwa persen degradasi p-DCB dipengaruhi baik oleh faktor pH maupun nisbah. Pada nisbah 1:40 sampai 1:10, peningkatan nisbah diikuti oleh peningkatan persen degradasi pada semua pH. Akan tetapi, pada nisbah 1:100 sampai
7
1:40, peningkatannya tidak selalu diikuti oleh peningkatan persen degradasi pada pH basa. Hal ini membuktikan bahwa adanya interaksi antara faktor pH dan faktor nisbah. Interaksi faktor pH dan nisbah berpengaruh secara nyata terhadap persen degradasi p-DCB dengan α 5% (Lampiran 4).
Gambar 4 Kurva tiga dimensi rerata persen degradasi p-DCB.
Gambar 5 Kurva kontur rerata persen degradasi
p-DCB.
Pola persen degradasi p-DCB dapat dinyatakan ke dalam persamaan berikut:
Y = 13.4481 – 9.44942 X1 – 5.33237 X2 +
10.5695 X12 – 7.57238 X22 – 0.375013 X1X2,
dengan nilai regresi (R2) sebesar 84.4%
Degradasi Senyawa Asam 2,4-Diklorofenoksi Asetat
Beberapa data persen degradasi senyawa asam 2,4-diklorofenoksi asetat (2,4-D) tidak dapat digunakan karena nilainya melebihi 100%. Hal ini dapat terjadi karena adanya kemungkinan kondisi sampel tidak murni. Kehadiran pengotor dapat menyebabkan bobot teoritis atom klorida pada sampel sulit ditentukan. Berdasarkan data yang dapat digunakan, rerata persen degradasi 2,4-D berkisar antara 17.06–99.87% (Tabel 4). Persen degradasi tertinggi diperoleh pada pH 4 dengan
nisbah 1:100, sedangkan terendah diperoleh pada pH 11 dengan nisbah 1:100.
Tabel 4 Rerata persen degradasi asam 2,4-diklorofenoksi asetat Nisbah FeSO4·7H20–H2O2 (b/b) pH 1:10 1:20 1:80 1:100 1 90.57 96.65 96.30 97.04 3 74.81 96.12 98.87 99.44 4 81.64 91.73 97.60 99.87 8 88.61 96.15 96.52 89.05 11 97.39 98.05 84.85 17.06 Secara umum, perolehan persen degradasi senyawa 2,4-D tergolong cukup tinggi. Namun bila dianalisa lebih rinci, maka akan diperoleh beberapa perbedaan dari dua senyawa sebelumnya. Umumnya, besar nisbah berbanding lurus dengan persen degradasi. Semakin tinggi nisbah maka semakin tinggi pula persen degradasinya. Hal ini dapat diterima karena semakin tinggi nisbah maka akan semakin banyak pula ion besi yang dapat mengkatalisis pembentukan radikal hidroksil. Namun, persen degradasi 2,4-D tertinggi justru diperoleh dari nisbah 1:100 pada pH 4. Bila ditinjau dari kondisi keasaman, pH 4 memang termasuk pH yang baik digunakan untuk oksidasi Fenton. Industrial Wastewater (2007) menyebutkan bahwa pH 3–6 merupakan kisaran pH yang baik untuk kondisi oksidasi Fenton.
Penyimpangan juga terlihat dari penyebaran persen degradasi yang bernilai di atas 96%. Angka ini tersebar di berbagai kondisi pH dan nisbah. Sebagian besar berada pada nisbah antara 1:20 hingga 1:100 dan hanya satu nilai yang berada pada nisbah 1:10 (pH 11). Hal ini diduga karena adanya reaksi samping yang belum dapat ditelusuri melalui penelitian ini.
Fenomena lain yang perlu dicermati adalah pola degradasi pada pH 11. Seperti yang telah dibahas sebelumnya, bahwa reaksi oksidasi Fenton pada pH basa membutuhkan waktu yang lebih lama karena katalis besi cenderung membentuk ion fero. Namun, data menun-jukkan bahwa degradasi pada pH 11 pun mampu menghasilkan persen degradasi yang tinggi yaitu pada nisbah 1:10 dan 1:20. Bahkan, kedua angka ini merupakan angka tertinggi dibandingkan angka lain pada nisbah yang sama.
Analisa data persen degradasi 2,4-D ini dapat diperjelas melalui tampilan kurva tiga
dimensi dan kontur (Gambar 6 dan 7). Kurva ini memperlihatkan bahwa kisaran tinggi berada di daerah tengah dan cenderung ke nisbah besar dan pH asam. Walaupun pada Tabel 4 menunjukkan persen tertinggi diperoleh pada nisbah rendah.
Gambar 6 Kurva tiga dimensi rerata persen degradasi 2,4-D.
Gambar 7 Kurva kontur rerata persen degradasi 2,4-D.
Perubahan nisbah, pH, serta interaksi antara faktor nisbah dan pH berpengaruh secara nyata terhadap persen degradasi 2,4-D dengan α 5% (Lampiran 4). Pola persen degradasi 2,4-D dapat dinyatakan ke dalam persamaan berikut:
Y = 108.475 – 8.73672 X1 – 10.1863 X2 –
19.0836 X12 – 10.1306 X22 – 16.4345 X1X2 ,
dengan nilai regresi (R2) sebesar 65.1%.
Secara rerata, persen degradasi senyawa 2,4-D paling tinggi dibandingkan dua sampel lainnya. Senyawa p-klorofenol menempati posisi kedua, dan terendah adalah p-diklorobenzena. Hal ini tidak sesuai dengan teori bahwa struktur p-klorofenol lebih menunjang penyerangan radikal hidroksil dibandingkan struktur sampel lainnya. Adanya gugus alkohol dapat meningkatkan kereaktifan struktur benzena sehingga mempermudah
penyerangan radikal hidroksil. Kehadiran gugus eter pada senyawa 2,4-D sebenarnya pun dapat membantu penyerangan radikal hidroksil, namun senyawa tersebut disubstitusi oleh dua gugus klorida yang merupakan gugus pendeaktivasi benzena (Strukul 1992). Ketidaksesuaian antara teori dan hasil penelitian ini dapat disebabkan adanya ketidakmurnian sampel 2,4-D, sehingga persen degradasi yang terukur melebihi dari yang sebenarnya.
Dekomposisi Hidrogen Peroksida
Degradasi ketiga pestisida organoklorin memberikan respon yang berbeda pada setiap perlakuan dan memiliki pola degradasi yang beragam. Hal ini menyebabkan adanya kesulitan untuk memperkirakan pengaruh pH dan nisbah terhadap kinerja reagen Fenton dalam reaksi degradasi pestisida organoklorin.
Dekomposisi hidrogen peroksida memberikan gambaran mengenai pengaruh pH dan katalis Fe terhadap dekomposisi senyawa ini. Besarnya dekomposisi H2O2 yang dikatalisis oleh Fe diasumsikan sebanding dengan banyaknya radikal hidroksil yang terbentuk. Semakin banyak radikal hidroksil yang dihasilkan, maka diharapkan akan semakin tinggi pula persen degradasi pestisida organoklorin.
Tabel 5 Rerata persen dekomposisi hidrogen peroksida pH Nisbah FeSO4·7H20–H2O2 (b/b) Dekomposisi H2O2 (%) 1 0 0.19 1:10 91.59 1:100 4.65 11 0 1.80 1:10 98.22 1:100 7.71
Data ini menunjukkan bahwa semakin tinggi nisbah, maka semakin tinggi pula persen dekomposisi H2O2. Sementara, pengaruh pH menunjukkan bahwa pada kondisi basa dihasilkan persen dekomposisi H2O2 yang lebih tinggi. Hal ini tidak sesuai dengan laporan yang dikeluarkan oleh Industrial Wastewater (2007) bahwa pH 3–6 merupakan kisaran pH yang efektif untuk oksidasi-Fenton.
Hal ini disebabkan kondisi basa dapat mendekomposisi H2O2 walaupun tanpa kehadiran Fe (Tabel 5). Selain itu, dekomposisi H2O2 pada kondisi basa lebih
9
cepat dibandingkan kondisi asam. Hal ini dapat dilihat dari kondisi larutan setelah direaksikan selama 30 menit, larutan asam masih terlihat aktif bereaksi. Kondisi ini ditandai dengan banyaknya gelembung udara yang terus menerus dihasilkan. Hal ini menunjukkan bahwa dekomposisi H2O2 pada kondisi asam membutuhkan waktu yang lebih lama dibandingkan pada kondisi basa.
Data dekomposisi H2O2 ini sesuai dengan degradasi 2,4-D. Pada senyawa tersebut, kondisi basa sering kali menghasilkan angka persen degradasi yang tinggi dibandingkan pada kondisi asam. Begitu pula pada p-klorofenol, beberapa perlakuan basa dapat menghasilkan angka persen degradasi yang tinggi. Namun, data ini tidak sesuai dengan pola persen degradasi p-DCB. Kondisi pH basa memberikan persen degradasi yang rendah pada semua nisbah. Fenomena ini menunjukkan bahwa peningkatan persen dekomposisi H2O2 tidak selalu diikuti oleh peningkatan persen degradasi pestisida organoklorin.
SIMPULAN DAN SARAN
Simpulan
Rerata persen degradasi p-klorofenol berkisar antara 84.32–94.66%. Nilai tertinggi diperoleh pada pH 1 dengan nisbah 1:20 dan terendah pada pH 11 dengan nisbah 1:100. Rerata persen degradasi p-DCB berkisar antara 0–42.75%. Persen degradasi tertinggi diperoleh pada pH 6 dengan nisbah 1:10, sedangkan terendah diperoleh pada pH 11 dengan nisbah 1:80 dan 1:100. Rerata persen degradasi 2,4-D berkisar antara 17.06–99.87%. Persen degradasi tertinggi diperoleh pada pH 4 dengan nisbah 1:100, sedangkan terendah diperoleh pada pH 11 dengan nisbah 1:100. Persen degradasi ketiga pestisida organoklorin menunjukkan pola yang berbeda sehingga sulit ditentukan kisaran pH dan nisbah yang masih baik digunakan untuk degradasi senyawa organoklorin. Peningkatan persen dekomposisi H2O2 tidak selalu diikuti oleh peningkatan persen degradasi pestisida organoklorin.
Saran
Data dekomposisi H2O2 belum dapat menggambarkan hubungan antara tingkat dekomposisi H2O2 dan degradasi pestisida organoklorin, sehingga diperlukan penelitian tentang dekomposisi H2O2 pada berbagai kondisi pH dan nisbah FeSO4·7H20–H2O2. Nilai persen dekomposisi H2O2 tersebut
kemudian dibandingkan dengan persen degradasi sampel pada kondisi yang sama
DAFTAR PUSTAKA
Arokor Holding Inc. 2007.
p-Dichlorobenzene. http://www.chemical- land21.com/industrialchem/organic/p-CHLOROPHENOL. htm. [4 Jun 2007]. [ATSDR] Agency for toxic substances and
disease registry. 1999a. ToxFAQs™ for chlorophenols. http://www.atsdr.cdc.gov/ tfacts107.html. [25 Sep 2007].
[ATSDR] Agency for toxic substances and disease registry. 1999b. Chlorophenol: production, import/export, use, and disposal. http://www.atsdr.cdc.gov/tox-profiles/tp107-c4.pdf. [25 Sep 2007]. Basset J et al. 1978. Vogel’s Textbook Of
Quantitative Inorganic Analysis, Including Elementary Instrumental Analysis. Ed ke-4. London: The ELBS &
Longman. Hlm: 348-354, 355.
Clesceri LS et al. 2005. Standard Methods
for The Environment of The Water and Wastewater. Ed ke-21. Washington DC:
APHA.
Desmurs JR et al. 1999. Chlorophenols. Di dalam: Kroschwitz JI and Howe-Grant M, editor. Kirk-Othmer Encyclopedia of Chemical. Technology. Ed ke-5, Vol 24. New York: John Wiley.
Dorey, Draves. 1998. Chloride determination by titration with mercury. Conway: University of Central Arkansas. http://chemistry.uca.edu/Projects/Quant9 8/chloride-hg-titrn-98.pdf. [13 Jun 2008].
[Industrial Wastewater]. 2007. Fenton’s reagent: iron-Catalyzed hydrogen peroxide. http://www.h2o2.com/appli-cations/industrialwastewater/Fentonsreag ent.html. [7 Jun 2007].
[IPEN] International POPs Elimination Network. 2005. A living document – adding new POPs to the Stockholm convention on persistent organic pollutans. http://www.oztoxics.org/ poprc/CANDIDATE POPS_1.html. [7 Sep 2007].
Kolthoff IM et al. 1969. Quantitative
Chemical Analysis. Ed ke-4. London: The
Macmillan. hlm: 816–817, 825–827, 834-835.
US Department of Energy. 1999. Innovative technology: summary report. http://apps. em.doe.gov/OST/pubs/itsrs/itsr2161.pdf. [24 Jul 2007].
Krishnamurti R. 1999. Chlorobenzenes. Di dalam: Kroschwitz JI and Howe-Grant M, editor. Kirk-Othmer Encyclopedia of Chemical. Technology. Ed ke-5, Vol 24. New York: John Wiley.
[US EPA] United States Environmental Protection Agency. 2006. Consumer factsheet on: para-dichlorobenzene (p-DCB). http://www.epa.gov/safewater/ contaminants/dw_contamfs/p-dichlo. html. [15 Mei 2007].
Mattjik AA, Sumertajaya IM. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid 1. Ed ke-2. Bogor: IPB Press.
[US EPA] United States Environmental Protection Agency. 2006. Consumer factsheet on: 2,4-D. http://www.epa.gov/ safewater/contaminants/dw_contamfs/24 -d.html. [6 Sep 2007].
McDowald R et al. 2004. Review of emerging, innovative technologies for the destruction and decontamination of POPs and the identification of promising technologies for use in developing countries. Auckland.
Vogel AI. 1959. Practical Organic
Chemistry. Ed ke-3. London: Longmans
Bagian XI.3, Qualitative Analysis for the Elements; hlm 1038, 1044-1045. Metcalf, Eddy. 2003. Wastewater Engeneering
Treatment and Reuse/ Ed ke-4. Mc Graw-Hill.
Munter R. 2001. Advanced oxidations processes-current status and prospects. Sci
Chem. 50(2): 59-80.
Nugrohati S. 2004. Naskah akademik ratifikasi dan implementasi konvensi Stockholm. Asdep Urusan pertanian dan kehutanan, Deputi Bidang Pengendalian Pencemaran Dampak Lingkungan Sumber Institusi, Kementrian Lingkungan Hidup. Jakarta.
Papp R. 1996. Organochlorine Waste Management. Pure & Appl Chem. 68(9):1801 -1 808.
Rahuman M et al. 2000. Destruction technologies for polychlorinated biphenyls (PCBs). Pure & Appl Chem.
[Sierra Club of Canada]. 2007. Pesticide Fact Sheet: 2,4-D Dichlorophenoxyacetic Acid. http://www.sierraclub.ca/national/program/ health-environment/pesticides/ 2,4-d.html. [6 Sep 2007].
Strukul G. 1992. Catalytic Oxidation with
Hydrogen Peroxide as Oxidant. The
Netherland: Kluwer.
Umetric AB. 1999. User’s guide to modde 5.0. Sweden: Umetric AB
Lampiran 1 Prosedur pembuatan pereaksi
1. Pembuatan Larutan H2O2 30 %
Sebanyak 15 mL larutan stok perhidrol (H2O2) 50 % dimasukkan ke dalam labu takar 25 mL, kemudian larutan ditera dengan air bebas ion.
2. Pembuatan Larutan AgNO3 0.1 N
Sebanyak 0.85 gram serbuk AgNO3 dilarutkan dengan akuades dalam gelas piala, kemudian larutan ditera dalam labu takar 25 mL.
3. Pembuatan Larutan Indikator Campuran
Sebanyak 0.5 gram difenilkarbazon dan 0.05 gram bromfenol biru dilarutkan dengan 75 mL etil/isopropil alkohol, kemudian larutan ditera dalam labu takar 100 mL dengan pelarut yang sama.
13
Lampiran 2 Diagram alir penelitian
Destruksi Senyawa
0.1 g Sampel Pestisida
* Dimasukkan ke dalam Erlenmeyer 250 mL + 100 mL akuades
* Diatur pH dengan H2SO4 atau NaOH pekat + Garam FeSO4.7H2O
+ 5 mL H2O2
* Diaduk dengan pengaduk magnetik selama 30 menit Larutan Hasil Oksidasi
* Dipindahkan ke dalam labu takar 250 mL * Ditera dengan akuades
Dekomposisi Hidrogen Peroksida
Analisis Klorida Kualitatif (Vogel 1959)
Analisis Klorida Larutan A
100 mL Akuades
Sedikit Larutan A
Endapan AgCl (putih)
* Dimasukkan ke dalam tabung reaksi + Beberapa tetes HNO3 pekat
+ Beberapa tetes AgNO3 0.1 N Larutan Hasil Oksidasi
Analisis Hidrogen Proksida Larutan B
* Dimasukkan ke dalam Erlenmeyer 250 mL * Diatur pH dengan H2SO4 atau NaOH pekat + Garam FeSO4.7H2O
+ 5 mL H2O2
* Diaduk dengan pengaduk magnetik selama 30 menit
* Dipindahkan ke dalam labu takar 250 mL * Ditera dengan akuades
* Dipipet 25 (VA) mL larutan B
* Dimasukkan ke dalam labu takar 100 (VB) mL B
* Ditera dengan akuades Larutan C
Analisis Klorida Kuantitatif (Clesceri et al 2005)
10 mL Larutan A
* Dimasukkan ke dalam Erlenmeyer 50 mL
+ 8 tetes larutan indikator campuran hingga berwarna ungu + 1-2 tetes larutan HNO3 pekat hingga berwarna kuning Titrasi dengan Merkuri Nitrat 0.0141 N
(telah distandardisasi) hingga ungu Rumus perhitungan analisis klorida:
sampel BM % 100 x Cl BA x n teoritis Cl Kadar = sampel W % 100 x Cl BE x 2 ) 3 NO ( Hg N x 2 ) 3 NO ( Hg V x p f terurai Cl Kadar = % 100 x teoritis Cl Kadar terurai Cl Kadar radasi deg (%) Persen =
Analisis Hidrogen peroksida (Basset et al 1978)
10 (VC) mL Larutan H2O2 30 %
* Dimasukkan ke dalam labu takar 1000 (VL) mL * Ditera dengan akuades
Titrasi dengan KMnO4 0.1 N (telah distandardisasi) hingga merah muda
Larutan C
* Dipipet 25 (V1) mL Larutan C
* Dimasukkan ke dalam Erlenmeyer 250 mL + 100 mL akuades
+ 20 mL H2SO4 6 N
Rumus perhitungan analisis hidrogen peroksida:
mL 100 / 2 O 2 H g 100 x 1 V 100 x C V L V x 2 O 2 H BE x 4 KMnO N x 4 KMnO V 2 O 2 H % = mL 100 / 2 O 2 H g 100 x 1 V 100 x C V L V x 0073 . 17 x 4 KMnO N x ) blanko sampel ( T V 2 O 2 H % − =
Rumus perhitungan dekomposisi hidrogen peroksida:
mL 100 / 2 O 2 H g 100 x 1 V 100 x A V B V x 2 O 2 H BE x 4 KMnO N x ) blanko sampel ( T V 2 O 2 H % − =
15
Lampiran 3 Prosedur analisis dan standardisasi
A. Standardisasi Merkuri Nitrat (Clesceri et al 2005)
Sebanyak 10 mL larutan NaCl 0.0141 N ditambahkan 8 tetes larutan indikator campuran hingga larutan berwarna ungu, lalu ditambahkan 1-2 tetes asam nitrat pekat hingga larutan berwarna kuning. Setelah itu, larutan dititrasi dengan merkuri nitrat 0.0141 N sampai berwarna ungu. Standardisasi dilakukan triplo. Rumus perhitungannya sebagai berikut:
2 ) 3 NO ( Hg V NaCl N x NaCl V 2 ) 3 NO ( Hg N =
B. Standardisasi Kalium Permanganat (Kolthoff et al 1969)
Sebanyak 0.147 g H2C2O4.2H2O dilarutkan dengan 100 mL akuades ke dalam Erlenmeyer 250 mL, lalu ditambahkan 20 mL H2SO4 6 N. Setelah itu, larutan dipanaskan hingga suhu larutan 55-60 oC, kemudian larutan dititrasi dalam suasana hangat dengan KMnO
4 0.1 N sampai berwarna merah muda. Analisis ini dilakukan triplo. Rumus perhitungannya sebagai berikut:
S V x 2 ) COOH ( BE 1000 x 2 ) COOH ( W 4 KMnO N =
15
Lampiran 4 Data perhitungan statistik ANOVA
Data perhitungan statistik p-klorofenol
Source of
Variation SS df MS F P-value F crit
Sample 669.613095 4 167.403274 2.84682758 0.03017034 2.50265646
Columns 1895.10397 6 315.850661 5.37129503 0.00013078 2.23119242
Interaction 3301.15056 24 137.54794 2.33911357 0.0031585 1.67382927
Within 4116.24127 70 58.8034467
Total 9982.10889 104
Data perhitungan statistik p-diklorobenzena
Source of
Variation SS df MS F P-value F crit
Sample 6187.39907 4 1546.84977 42.9110569 3.8011E-18 2.50265646
Columns 3239.088 6 539.847999 14.9758876 6.1641E-11 2.23119242
Interaction 1995.36876 24 83.1403648 2.30639135 0.00363187 1.67382927
Within 2523.34693 70 36.0478133
Total 13945.2028 104
Data perhitungan statistik 2,4-diklorofenoksi asetat
Source of
Variation SS df MS F P-value F crit
Sample 3043.31606 3 1014.43869 11.8891876 1.0516E-05 2.83874541
Columns 4502.26748 4 1125.56687 13.1916062 6.109E-07 2.60597495
Interaction 13161.7215 12 1096.81012 12.8545781 3.3549E-10 2.0034594
Within 3412.979 40 85.324475