DEGRADASI PELARUT ORGANOKLORIN DENGAN
METODE OKSIDASI-FENTON
CHARINA AGUSTINE
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
CHARINA AGUSTINE. Degradasi Pelarut Organoklorin dengan Metode Oksidasi-Fenton. Dibimbing oleh MUHAMMAD FARID dan ZAINAL ALIM MAS’UD.
Organoklorin tergolong senyawa klorokarbon yang memiliki ciri khusus dan banyak digunakan dalam bidang industri, contohnya diklorometana, kloroform, dan karbon tetraklorida. Akan tetapi, keberadaannya dapat menimbulkan dampak buruk bagi lingkungan karena sangat beracun, persisten, dan bioakumulatif. Oleh karena itu, diperlukan manajemen pengolahan limbah untuk meminimalkan dampak tersebut. Metode oksidasi-Fenton dapat digunakan untuk pengolahan berbagai limbah industri. Metode ini menggunakan oksidator H2O2 dan katalis besi (FeSO4) sehingga dihasilkan radikal hidroksil (gugus reaktif). Penelitian ini bertujuan menentukan pengaruh pH dan nisbah FeSO4·7H2O–H2O2 (b/b) dalam reaksi oksidasi-Fenton. Kisaran pH yang dicobakan adalah 1–11 dan kisaran nisbahnya 1:10–1:100 (b/b). Banyaknya klorida anorganik yang terurai dianalisis secara kualitatif dan kuantitatif. Metode oksidasi-Fenton efektif bekerja pada pH 3–8 dengan nisbah 1:10 sampai 1:40 (b/b). Kisaran nilai degradasi diklorometana dengan metode oksidasi-Fenton sebesar 0.00–45.11% dan kloroform sebesar 0.31–13.76%. Sementara, karbon tetraklorida tidak dapat terdegradasi menggunakan metode ini. Pengaruh pH dan nisbah pun diteliti melalui dekomposisi H2O2 pada pH 1 dan 11, serta nisbah FeSO4·7H2O–H2O2 yaitu 1:10 dan 1:100 (b/b). Nilai persen dekomposisi H2O2 lebih tinggi pada kondisi basa dibandingkan kondisi asam. Percobaan dekomposisi H2O2 belum dapat memberi gambaran secara menyeluruh mengenai pengaruhnya terhadap degradasi pelarut organoklorin.
ABSTRACT
CHARINA AGUSTINE. Degradation Organochlorine Solvents using Oxidation-Fenton Method. Supervised by MUHAMMAD FARID and ZAINAL ALIM MAS’UD.
DEGRADASI PELARUT ORGANOKLORIN DENGAN
METODE OKSIDASI-FENTON
CHARINA AGUSTINE
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Degradasi Pelarut Organoklorin dengan Metode Oksidasi-Fenton
Nama : Charina Agustine
NRP : G44202040
Menyetujui:
Drs. Muhammad Farid
Dr. Zainal Alim Mas’ud, DEA
NIP 132 002 064
NIP 131 578 815
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131 578 806
5
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas kasih dan pernyertaanNya, penulis dapat menyelesaikan karya ilmiah ini. Judul penelitian ini adalah Degradasi Pelarut Organoklorin dengan Metode Oksidasi-Fenton, yang dilaksanakan sejak bulan Maret 2007 sampai bulan Januari 2008, di Laboratorium Terpadu dan Laboratorium Kimia Organik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Penulis mengucapkan terima kasih kepada Bapak Muhammad Farid dan Bapak Zainal Alim Mas’ud selaku pembimbing I dan II; kepada Bapak Ahmad Sjahriza atas bimbingannya dalam mengolah data dengan program Umetrics modde 5. Ungkapan terima kasih juga disampaikan kepada Mas Khotib beserta para laboran dan pekerja Lab. Terpadu atas diskusi dan fasilitas yang diberikan selama penelitian. Begitupun juga kepada Bapak Sobur, Ibu Yeni, Ibu Aah, dan teman-teman peneliti di Lab. Kimia Organik dan Lab. Terpadu atas bantuan, diskusi, dan kebersamaannya. Ungkapan terima kasih juga kepada teman-teman kimia 39 (khususnya Hasna, Mirah, Rellang, Seri, Dewe, Steven, Joko, dan Budhi), adik-adik kelas, atas kebersamaan, canda tawa selama penulis menempuh studi dan menjalankan penelitian. Di samping itu, penulis juga mengucapkan terima kasih kepada kedua orangtua dan adikku tercinta, serta seluruh keluarga atas segala doa dan kasih sayangnya. Terakhir kepada Mas Heri atas segala bantuan dan motivasinya kepada penulis. Semoga karya ilmiah ini dapat bermanfaat dan memberi kontribusi bagi yang lainnya.
Bogor, Juni 2008
Charina Agustine
6
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 26 Agustus 1984 dari Bapak Suherman dan Ibu Corriana. Penulis merupakan anak pertama dari dua bersaudara.
Tahun 2002, penulis lulus dari SMU Negeri 3 Bogor dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Tahun 2005, penulis menjalankan kegiatan praktik lapangan di Laboratorium Pemastian Mutu (QC), PT Bristol Myers Squibb (BMS) Indonesia, Tbk, Cibinong dengan judul Analisis Kadar Klorida, pH, dan Identifikasi Gugus Fungsi pada Resin Colestiramin.
Selama menjalani perkuliahan, penulis pernah menjadi asisten praktikum mata kuliah Kimia Bahan dan Alat D3 Analisis Kimia dan Manajemen Laboratorium D3 Analisis Kimia tahun ajaran 2007/2008.
vi
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Ekolabel ... 1
Penggolongan Organoklorin ... 2
Pelarut Organoklorin ... 2
Degradasi Organoklorin ... 2
Reagen Fenton ... .... 3
Analisis Klorida ... 4
BAHAN DAN METODE Bahan dan Alat ... 4
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN Degradasi Diklorometana ... 5
Degradasi Kloroform ... 6
Degradasi Karbon Tetraklorida ... 7
Dekomposisi Hidrogen Peroksida ... 8
SIMPULAN DAN SARAN Simpulan ... 8
Saran ... 8
DAFTAR PUSTAKA ... 8
LAMPIRAN ... 11
vii
DAFTAR TABEL
Halaman
1 Kekuatan oksidasi relatif dari gugus reaktif ... 3
2 Data rerata persen degradasi diklorometana ... 5
3 Data rerata persen degradasi kloroform ... 6
4 Data rerata persen degradasi karbon tetraklorida ... 7
5 Data rerata persen dekomposisi hidrogen peroksida ... 8
DAFTAR GAMBAR
Halaman
1 Grafik data penggunaan senyawa klorometana
... 12
Kurva tiga dimensi rerata persen degradasi diklorometana ... 63 Kurva kontur rerata persen degradasi diklorometana ... 6
4 Kurva tiga dimensi rerata persen degradasi kloroform ... 7
5 Kurva kontur rerata persen degradasi kloroform ... 7
6 Kurva tiga dimensi rerata persen degradasi karbon tetraklorida ... 7
7 Kurva kontur rerata persen degradasi karbon tetraklorida ... 7
DAFTAR LAMPIRAN
Halaman
1
Prosedur pembuatan pereaksi ... 122 Diagram alir penelitian ... 13
3 Prosedur analisis dan standardisasi ... 15
4. Data perhitungan statistik ANOVA ... 16
5 Nilai pendekatan bilangan oksidasi ... 17
PENDAHULUAN
Organoklorin tergolong senyawa kloro-karbon yang memiliki ciri khusus dan berperan dalam bidang industri. Sir James Young Simpson pertama kali menggunakan kloroform pada tahun 1847 sebagai anastetik (obat bius) untuk menggantikan eter. Namun pada akhirnya, penggunaannya sebagai anastetik mulai dihentikan karena dapat menimbulkan penyakit liver (Belding 2006). Walaupun demikian, kloroform masih berperan sebagai pelarut dalam industri farmasi (Department of the Environment and Water Resources 2005). Pada bidang industri, penggunaan kloroform semakin meningkat, terutama untuk produksi polimer fluoro.
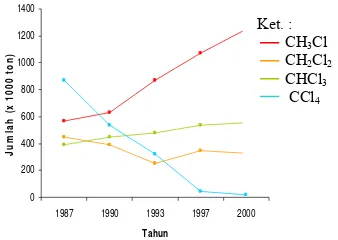
Penggunaan senyawa klorometana semakin meningkat, kecuali penggunaan karbon tetraklorida. Menurut The Kyoto Protocol, sejak tahun 1986 karbon tetraklorida diidentifikasi sebagai senyawa yang dapat merusak lapisan ozon stratosfer (Thompson 2004). Hal ini dapat dilihat dari data penggunaan klorometana ditampilkan pada Gambar 1. 0 200 400 600 800 1000 1200 1400
1987 1990 1993 1997 2000
Tahun Ju m lah ( x 1 00 0 to n )
Gambar 1 Penggunaan senyawa klorometana (Marshall 2007)
Keberadaan pelarut organoklorin dapat menimbulkan dampak buruk bagi lingkungan karena sangat beracun (menyerang sistem saraf pusat), persisten, bioakumulatif, dan dapat menimbulkan penyakit kanker pada manusia (karsinogenik) (Azman 1995). Sebagian besar negara maju memang telah mengurangi, bahkan melarang produksi dan penggunaan senyawa ini melalui program ekolabel. Namun, hal ini masih sulit dilaksanakan di negara berkembang karena dibutuhkan kesiapan dari pemerintah dan produsen di negara tersebut. Oleh karena itu, diperlukan kesiapan langkah untuk meminimalkan dampak limbah organoklorin, terutama bagi negara yang belum menghentikan penggunaan senyawa tersebut.
Salah satu langkah awal yang dibutuhkan ialah manajemen pengolahan limbah.
Oksidasi-Fenton merupakan metode oksidasi yang menggunakan hidrogen peroksida (H2O2) sebagai pengoksidasinya
dan besi sebagai katalis. Metode ini telah diterapkan untuk pengolahan berbagai macam limbah industri yang mengandung senyawaan organik toksik, seperti fenol dan limbah kompleks dari pestisida, cat, maupun zat aditif plastik (US Department of Energy 1999). Gugus reaktif yang berperan dalam metode ini adalah radikal hidroksil yang dihasilkan dari reaksi antara H2O2 dan Fe2+.
Namun, pembentukan radikal hidroksil ini membutuhkan kondisi pH tertentu karena pada kondisi pH yang tidak sesuai, bentuk ion fero (Fe2+) dapat berubah menjadi bentuk koloid ion feri (Fe3+). Selain itu, kondisi ini pun dapat menyebabkan katalisis dekomposisi H2O2 oleh ion besi tanpa
menghasilkan radikal hidroksil (Industrial Wastewater 2007).
Salah satu segi yang perlu diperhatikan dalam memilih suatu metode pengolahan limbah ialah kandungan residu akhir. Walaupun residu dari proses pengolahan limbah sangat sulit dihindari, akan tetapi diperlukan upaya untuk meminimumkan dampak dari residu tersebut. Salah satu residu yang perlu diminimumkan pada metode oksidasi-Fenton ialah besi. Oleh karena itu, dibutuhkan data mengenai pengaruh pH dan nisbah FeSO4·7H2O–H2O2 (b/b) terhadap
kinerja reagen Fenton.
Ket. :
CH3Cl
CH2Cl2
CHCl3
CCl4
Penelitian ini bertujuan menentukan besarnya pengaruh pH dan nisbah
FeSO4·7H2O–H2O2 (b/b) dalam reaksi
oksidasi-Fenton untuk pendegradasian pelarut organoklorin.
TINJAUAN PUSTAKA
Ekolabel
Menurut FEA (1999), ekolabel adalah label atau tanda dari produsen dalam memberikan informasi kepada konsumen mengenai dampak lingkungan yang terdapat pada suatu produk tertentu. Program ekolabel pertama di dunia dibentuk di Jerman pada tahun 1977, yang diberi nama Blue Angel. Saat ini, ada 27 program ekolabel di berbagai negara.
2
memiliki pengakuan ramah lingkungan dalam proses produksi dari hulu hingga hilir. Tim skema ekolabel Indonesia baru berhasil menyusun kriteria ekolabel untuk lima jenis produk manufaktur, yaitu serbuk detergen sintetik, tekstil dan produk tekstil, kertas cetak, produk kulit jadi, dan sepatu kulit (Hendra 2005).
Penggolongan Organoklorin
Organoklorin merupakan senyawa hidrokarbon terklorinasi, minimal ada satu posisi atom hidrogen pada hidrokarbon yang digantikan oleh atom klor. Berdasarkan sifat kelembaman atau persistensinya, organoklorin dibagi menjadi tiga kelompok yaitu senyawa POP (polutan organik persisten), kandidat POP, dan non-POP. Berdasarkan konvensi Stockholm, senyawa POP dapat dikla-sifikasikan ke dalam 3 golongan, yaitu pesti-sida organoklor, bahan industri organoklor, dan golongan POP yang terbentuk secara tidak sengaja dari sumber antropogenik. (Nugrohati 2004).
Kandidat POP merupakan kelompok senyawa yang memiliki ciri seperti senyawa POP. Kelompok senyawa ini belum tercantum dalam daftar senyawa POP, namun termasuk senyawa yang dinominasikan menjadi senyawa POP. Program ini ditangani oleh sebuah komite peninjau POP, POPRC (persistent organic pollutants review committee) yang disepakati pula dalam konvensi Stockholm. Sementara, senyawa organohalogen yang tidak tergolong dalam kedua kelompok tersebut dikenal dengan non-POP (IPEN 2005).
Pelarut Organoklorin
Metilena klorida atau diklorometana, CH2Cl2, CAS number [75-09-2], merupakan
senyawa toksik dan karsinogenik dengan bobot molekul 84.93 g/mol dan berat jenis 1.32 g/mL (Stevens 2001). Senyawa ini bersifat volatil dan sedikit larut dalam air (2 g/100 mL pada 20 °C), tetapi larut dalam pelarut organik seperti etanol, eter, fenol, aldehida, dan keton (WHO Regional Office for Europe 2000).
Metilena klorida digunakan sebagai pelarut cat, formula tinta, pembersih logam, dan sebagai aerosol. Lembaga CHIP (chemical hazard information and packaging) menyatakan diklorometana sebagai bahaya karsinogenik sehingga beberapa produk yang mengandung diklorometana harus diberi label dengan peringatan harmfull (Stevens 2001).
Kloroform atau triklorometana, CHCl3,
CAS number [67-66-3], merupakan senyawa toksik dengan bobot molekul 119.38 g/mol dan
berat jenis 1.498 g/mL. Senyawa ini bersifat volatil dan sedikit larut dalam air, tetapi dapat juga bercampur dengan alkohol, benzena, petroleum eter, karbon tetraklorida, karbon disulfida, dan minyak (Belding 2006).
Kloroform digunakan sebagai pelarut ekstraksi (lemak, minyak, karet, lilin, pernis dan getah), pembuatan cat, pembuatan obat-obatan dan pestisida, produksi plastik (khususnya vinil klorida), reagen pembersih untuk menghilangkan noda, dan produksi pendingin seperti kloro fluoro karbon (CFC) (Department of the Environment and Water Resources 2005).
Berdasarkan Protokol Montreal, karbon tetraklorida dan kloroform digolongkan sebagai bahan perusak lapisan ozon (Sibarani 2002). Oleh karena itu, berdasarkan Keppres Nomor 96/2000 jo.118/2000, sektor industri dan perdagangan menutup investasi bagi salah satu industri yang menghasilkan bahan kimia berbahaya bagi lingkungan, seperti karbon tetraklorida dan kloroform (Badan Koordinasi Penanaman Modal 2007).
Karbon tetraklorida, CCl4, CAS number
[56-23-5], merupakan senyawa toksik dan karsinogenik dengan bobot molekul 158.82 g/mol dan berat jenis 1.59 g/mL. Senyawa ini bersifat tidak larut dalam air, tidak mudah terbakar, dan memiliki bau yang khas. Senyawa ini digunakan sebagai herbidisida padi dan senyawa intermediet dalam produksi pendingin (refrigerants) (Tripp & Liu 2006). Semakin banyak penggunaan karbon tetraklorida ternyata memberikan efek negatif sebagai polutan lingkungan. Lembaga internasional EPA (environmental protection agency) juga menggolongkan karbon tetraklorida sebagai penyebab karsinogenik pada manusia (ATSDR 1994).
Degradasi Organoklorin
Dahulu, limbah POP dan senyawa lain yang sulit dihancurkan diolah dengan teknologi remediasi sederhana, yaitu metode
landfill cap system dan deep well injection, dengan penimbunan pada lahan yang telah dilengkapi lapisan pembatas dan drainase. Akan tetapi, ternyata teknologi ini sangat tidak efektif untuk senyawa persisten, bahkan dapat membahayakan lingkungan. Per-kembangan teknologi selanjutnya ialah pembakaran bersuhu tinggi (870–1200 °C) dan tanur semen (1100–1450 °C) dalam suasana pH tinggi. Ternyata teknologi ini juga berdampak buruk bagi lingkungan dan kesehatan manusia, serta membutuhkan infrastruktur yang memadai serta manajemen
DEGRADASI PELARUT ORGANOKLORIN DENGAN
METODE OKSIDASI-FENTON
CHARINA AGUSTINE
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
CHARINA AGUSTINE. Degradasi Pelarut Organoklorin dengan Metode Oksidasi-Fenton. Dibimbing oleh MUHAMMAD FARID dan ZAINAL ALIM MAS’UD.
Organoklorin tergolong senyawa klorokarbon yang memiliki ciri khusus dan banyak digunakan dalam bidang industri, contohnya diklorometana, kloroform, dan karbon tetraklorida. Akan tetapi, keberadaannya dapat menimbulkan dampak buruk bagi lingkungan karena sangat beracun, persisten, dan bioakumulatif. Oleh karena itu, diperlukan manajemen pengolahan limbah untuk meminimalkan dampak tersebut. Metode oksidasi-Fenton dapat digunakan untuk pengolahan berbagai limbah industri. Metode ini menggunakan oksidator H2O2 dan katalis besi (FeSO4) sehingga dihasilkan radikal hidroksil (gugus reaktif). Penelitian ini bertujuan menentukan pengaruh pH dan nisbah FeSO4·7H2O–H2O2 (b/b) dalam reaksi oksidasi-Fenton. Kisaran pH yang dicobakan adalah 1–11 dan kisaran nisbahnya 1:10–1:100 (b/b). Banyaknya klorida anorganik yang terurai dianalisis secara kualitatif dan kuantitatif. Metode oksidasi-Fenton efektif bekerja pada pH 3–8 dengan nisbah 1:10 sampai 1:40 (b/b). Kisaran nilai degradasi diklorometana dengan metode oksidasi-Fenton sebesar 0.00–45.11% dan kloroform sebesar 0.31–13.76%. Sementara, karbon tetraklorida tidak dapat terdegradasi menggunakan metode ini. Pengaruh pH dan nisbah pun diteliti melalui dekomposisi H2O2 pada pH 1 dan 11, serta nisbah FeSO4·7H2O–H2O2 yaitu 1:10 dan 1:100 (b/b). Nilai persen dekomposisi H2O2 lebih tinggi pada kondisi basa dibandingkan kondisi asam. Percobaan dekomposisi H2O2 belum dapat memberi gambaran secara menyeluruh mengenai pengaruhnya terhadap degradasi pelarut organoklorin.
ABSTRACT
CHARINA AGUSTINE. Degradation Organochlorine Solvents using Oxidation-Fenton Method. Supervised by MUHAMMAD FARID and ZAINAL ALIM MAS’UD.
DEGRADASI PELARUT ORGANOKLORIN DENGAN
METODE OKSIDASI-FENTON
CHARINA AGUSTINE
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Degradasi Pelarut Organoklorin dengan Metode Oksidasi-Fenton
Nama : Charina Agustine
NRP : G44202040
Menyetujui:
Drs. Muhammad Farid
Dr. Zainal Alim Mas’ud, DEA
NIP 132 002 064
NIP 131 578 815
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131 578 806
5
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas kasih dan pernyertaanNya, penulis dapat menyelesaikan karya ilmiah ini. Judul penelitian ini adalah Degradasi Pelarut Organoklorin dengan Metode Oksidasi-Fenton, yang dilaksanakan sejak bulan Maret 2007 sampai bulan Januari 2008, di Laboratorium Terpadu dan Laboratorium Kimia Organik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Penulis mengucapkan terima kasih kepada Bapak Muhammad Farid dan Bapak Zainal Alim Mas’ud selaku pembimbing I dan II; kepada Bapak Ahmad Sjahriza atas bimbingannya dalam mengolah data dengan program Umetrics modde 5. Ungkapan terima kasih juga disampaikan kepada Mas Khotib beserta para laboran dan pekerja Lab. Terpadu atas diskusi dan fasilitas yang diberikan selama penelitian. Begitupun juga kepada Bapak Sobur, Ibu Yeni, Ibu Aah, dan teman-teman peneliti di Lab. Kimia Organik dan Lab. Terpadu atas bantuan, diskusi, dan kebersamaannya. Ungkapan terima kasih juga kepada teman-teman kimia 39 (khususnya Hasna, Mirah, Rellang, Seri, Dewe, Steven, Joko, dan Budhi), adik-adik kelas, atas kebersamaan, canda tawa selama penulis menempuh studi dan menjalankan penelitian. Di samping itu, penulis juga mengucapkan terima kasih kepada kedua orangtua dan adikku tercinta, serta seluruh keluarga atas segala doa dan kasih sayangnya. Terakhir kepada Mas Heri atas segala bantuan dan motivasinya kepada penulis. Semoga karya ilmiah ini dapat bermanfaat dan memberi kontribusi bagi yang lainnya.
Bogor, Juni 2008
Charina Agustine
6
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 26 Agustus 1984 dari Bapak Suherman dan Ibu Corriana. Penulis merupakan anak pertama dari dua bersaudara.
Tahun 2002, penulis lulus dari SMU Negeri 3 Bogor dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Tahun 2005, penulis menjalankan kegiatan praktik lapangan di Laboratorium Pemastian Mutu (QC), PT Bristol Myers Squibb (BMS) Indonesia, Tbk, Cibinong dengan judul Analisis Kadar Klorida, pH, dan Identifikasi Gugus Fungsi pada Resin Colestiramin.
Selama menjalani perkuliahan, penulis pernah menjadi asisten praktikum mata kuliah Kimia Bahan dan Alat D3 Analisis Kimia dan Manajemen Laboratorium D3 Analisis Kimia tahun ajaran 2007/2008.
vi
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Ekolabel ... 1
Penggolongan Organoklorin ... 2
Pelarut Organoklorin ... 2
Degradasi Organoklorin ... 2
Reagen Fenton ... .... 3
Analisis Klorida ... 4
BAHAN DAN METODE Bahan dan Alat ... 4
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN Degradasi Diklorometana ... 5
Degradasi Kloroform ... 6
Degradasi Karbon Tetraklorida ... 7
Dekomposisi Hidrogen Peroksida ... 8
SIMPULAN DAN SARAN Simpulan ... 8
Saran ... 8
DAFTAR PUSTAKA ... 8
LAMPIRAN ... 11
vii
DAFTAR TABEL
Halaman
1 Kekuatan oksidasi relatif dari gugus reaktif ... 3
2 Data rerata persen degradasi diklorometana ... 5
3 Data rerata persen degradasi kloroform ... 6
4 Data rerata persen degradasi karbon tetraklorida ... 7
5 Data rerata persen dekomposisi hidrogen peroksida ... 8
DAFTAR GAMBAR
Halaman
1 Grafik data penggunaan senyawa klorometana
... 12
Kurva tiga dimensi rerata persen degradasi diklorometana ... 63 Kurva kontur rerata persen degradasi diklorometana ... 6
4 Kurva tiga dimensi rerata persen degradasi kloroform ... 7
5 Kurva kontur rerata persen degradasi kloroform ... 7
6 Kurva tiga dimensi rerata persen degradasi karbon tetraklorida ... 7
7 Kurva kontur rerata persen degradasi karbon tetraklorida ... 7
DAFTAR LAMPIRAN
Halaman
1
Prosedur pembuatan pereaksi ... 122 Diagram alir penelitian ... 13
3 Prosedur analisis dan standardisasi ... 15
4. Data perhitungan statistik ANOVA ... 16
5 Nilai pendekatan bilangan oksidasi ... 17
PENDAHULUAN
Organoklorin tergolong senyawa kloro-karbon yang memiliki ciri khusus dan berperan dalam bidang industri. Sir James Young Simpson pertama kali menggunakan kloroform pada tahun 1847 sebagai anastetik (obat bius) untuk menggantikan eter. Namun pada akhirnya, penggunaannya sebagai anastetik mulai dihentikan karena dapat menimbulkan penyakit liver (Belding 2006). Walaupun demikian, kloroform masih berperan sebagai pelarut dalam industri farmasi (Department of the Environment and Water Resources 2005). Pada bidang industri, penggunaan kloroform semakin meningkat, terutama untuk produksi polimer fluoro.
Penggunaan senyawa klorometana semakin meningkat, kecuali penggunaan karbon tetraklorida. Menurut The Kyoto Protocol, sejak tahun 1986 karbon tetraklorida diidentifikasi sebagai senyawa yang dapat merusak lapisan ozon stratosfer (Thompson 2004). Hal ini dapat dilihat dari data penggunaan klorometana ditampilkan pada Gambar 1. 0 200 400 600 800 1000 1200 1400
1987 1990 1993 1997 2000
Tahun Ju m lah ( x 1 00 0 to n )
Gambar 1 Penggunaan senyawa klorometana (Marshall 2007)
Keberadaan pelarut organoklorin dapat menimbulkan dampak buruk bagi lingkungan karena sangat beracun (menyerang sistem saraf pusat), persisten, bioakumulatif, dan dapat menimbulkan penyakit kanker pada manusia (karsinogenik) (Azman 1995). Sebagian besar negara maju memang telah mengurangi, bahkan melarang produksi dan penggunaan senyawa ini melalui program ekolabel. Namun, hal ini masih sulit dilaksanakan di negara berkembang karena dibutuhkan kesiapan dari pemerintah dan produsen di negara tersebut. Oleh karena itu, diperlukan kesiapan langkah untuk meminimalkan dampak limbah organoklorin, terutama bagi negara yang belum menghentikan penggunaan senyawa tersebut.
Salah satu langkah awal yang dibutuhkan ialah manajemen pengolahan limbah.
Oksidasi-Fenton merupakan metode oksidasi yang menggunakan hidrogen peroksida (H2O2) sebagai pengoksidasinya
dan besi sebagai katalis. Metode ini telah diterapkan untuk pengolahan berbagai macam limbah industri yang mengandung senyawaan organik toksik, seperti fenol dan limbah kompleks dari pestisida, cat, maupun zat aditif plastik (US Department of Energy 1999). Gugus reaktif yang berperan dalam metode ini adalah radikal hidroksil yang dihasilkan dari reaksi antara H2O2 dan Fe2+.
Namun, pembentukan radikal hidroksil ini membutuhkan kondisi pH tertentu karena pada kondisi pH yang tidak sesuai, bentuk ion fero (Fe2+) dapat berubah menjadi bentuk koloid ion feri (Fe3+). Selain itu, kondisi ini pun dapat menyebabkan katalisis dekomposisi H2O2 oleh ion besi tanpa
menghasilkan radikal hidroksil (Industrial Wastewater 2007).
Salah satu segi yang perlu diperhatikan dalam memilih suatu metode pengolahan limbah ialah kandungan residu akhir. Walaupun residu dari proses pengolahan limbah sangat sulit dihindari, akan tetapi diperlukan upaya untuk meminimumkan dampak dari residu tersebut. Salah satu residu yang perlu diminimumkan pada metode oksidasi-Fenton ialah besi. Oleh karena itu, dibutuhkan data mengenai pengaruh pH dan nisbah FeSO4·7H2O–H2O2 (b/b) terhadap
kinerja reagen Fenton.
Ket. :
CH3Cl
CH2Cl2
CHCl3
CCl4
Penelitian ini bertujuan menentukan besarnya pengaruh pH dan nisbah
FeSO4·7H2O–H2O2 (b/b) dalam reaksi
oksidasi-Fenton untuk pendegradasian pelarut organoklorin.
TINJAUAN PUSTAKA
Ekolabel
Menurut FEA (1999), ekolabel adalah label atau tanda dari produsen dalam memberikan informasi kepada konsumen mengenai dampak lingkungan yang terdapat pada suatu produk tertentu. Program ekolabel pertama di dunia dibentuk di Jerman pada tahun 1977, yang diberi nama Blue Angel. Saat ini, ada 27 program ekolabel di berbagai negara.
2
memiliki pengakuan ramah lingkungan dalam proses produksi dari hulu hingga hilir. Tim skema ekolabel Indonesia baru berhasil menyusun kriteria ekolabel untuk lima jenis produk manufaktur, yaitu serbuk detergen sintetik, tekstil dan produk tekstil, kertas cetak, produk kulit jadi, dan sepatu kulit (Hendra 2005).
Penggolongan Organoklorin
Organoklorin merupakan senyawa hidrokarbon terklorinasi, minimal ada satu posisi atom hidrogen pada hidrokarbon yang digantikan oleh atom klor. Berdasarkan sifat kelembaman atau persistensinya, organoklorin dibagi menjadi tiga kelompok yaitu senyawa POP (polutan organik persisten), kandidat POP, dan non-POP. Berdasarkan konvensi Stockholm, senyawa POP dapat dikla-sifikasikan ke dalam 3 golongan, yaitu pesti-sida organoklor, bahan industri organoklor, dan golongan POP yang terbentuk secara tidak sengaja dari sumber antropogenik. (Nugrohati 2004).
Kandidat POP merupakan kelompok senyawa yang memiliki ciri seperti senyawa POP. Kelompok senyawa ini belum tercantum dalam daftar senyawa POP, namun termasuk senyawa yang dinominasikan menjadi senyawa POP. Program ini ditangani oleh sebuah komite peninjau POP, POPRC (persistent organic pollutants review committee) yang disepakati pula dalam konvensi Stockholm. Sementara, senyawa organohalogen yang tidak tergolong dalam kedua kelompok tersebut dikenal dengan non-POP (IPEN 2005).
Pelarut Organoklorin
Metilena klorida atau diklorometana, CH2Cl2, CAS number [75-09-2], merupakan
senyawa toksik dan karsinogenik dengan bobot molekul 84.93 g/mol dan berat jenis 1.32 g/mL (Stevens 2001). Senyawa ini bersifat volatil dan sedikit larut dalam air (2 g/100 mL pada 20 °C), tetapi larut dalam pelarut organik seperti etanol, eter, fenol, aldehida, dan keton (WHO Regional Office for Europe 2000).
Metilena klorida digunakan sebagai pelarut cat, formula tinta, pembersih logam, dan sebagai aerosol. Lembaga CHIP (chemical hazard information and packaging) menyatakan diklorometana sebagai bahaya karsinogenik sehingga beberapa produk yang mengandung diklorometana harus diberi label dengan peringatan harmfull (Stevens 2001).
Kloroform atau triklorometana, CHCl3,
CAS number [67-66-3], merupakan senyawa toksik dengan bobot molekul 119.38 g/mol dan
berat jenis 1.498 g/mL. Senyawa ini bersifat volatil dan sedikit larut dalam air, tetapi dapat juga bercampur dengan alkohol, benzena, petroleum eter, karbon tetraklorida, karbon disulfida, dan minyak (Belding 2006).
Kloroform digunakan sebagai pelarut ekstraksi (lemak, minyak, karet, lilin, pernis dan getah), pembuatan cat, pembuatan obat-obatan dan pestisida, produksi plastik (khususnya vinil klorida), reagen pembersih untuk menghilangkan noda, dan produksi pendingin seperti kloro fluoro karbon (CFC) (Department of the Environment and Water Resources 2005).
Berdasarkan Protokol Montreal, karbon tetraklorida dan kloroform digolongkan sebagai bahan perusak lapisan ozon (Sibarani 2002). Oleh karena itu, berdasarkan Keppres Nomor 96/2000 jo.118/2000, sektor industri dan perdagangan menutup investasi bagi salah satu industri yang menghasilkan bahan kimia berbahaya bagi lingkungan, seperti karbon tetraklorida dan kloroform (Badan Koordinasi Penanaman Modal 2007).
Karbon tetraklorida, CCl4, CAS number
[56-23-5], merupakan senyawa toksik dan karsinogenik dengan bobot molekul 158.82 g/mol dan berat jenis 1.59 g/mL. Senyawa ini bersifat tidak larut dalam air, tidak mudah terbakar, dan memiliki bau yang khas. Senyawa ini digunakan sebagai herbidisida padi dan senyawa intermediet dalam produksi pendingin (refrigerants) (Tripp & Liu 2006). Semakin banyak penggunaan karbon tetraklorida ternyata memberikan efek negatif sebagai polutan lingkungan. Lembaga internasional EPA (environmental protection agency) juga menggolongkan karbon tetraklorida sebagai penyebab karsinogenik pada manusia (ATSDR 1994).
Degradasi Organoklorin
Dahulu, limbah POP dan senyawa lain yang sulit dihancurkan diolah dengan teknologi remediasi sederhana, yaitu metode
landfill cap system dan deep well injection, dengan penimbunan pada lahan yang telah dilengkapi lapisan pembatas dan drainase. Akan tetapi, ternyata teknologi ini sangat tidak efektif untuk senyawa persisten, bahkan dapat membahayakan lingkungan. Per-kembangan teknologi selanjutnya ialah pembakaran bersuhu tinggi (870–1200 °C) dan tanur semen (1100–1450 °C) dalam suasana pH tinggi. Ternyata teknologi ini juga berdampak buruk bagi lingkungan dan kesehatan manusia, serta membutuhkan infrastruktur yang memadai serta manajemen
3
emisi udara dan residu lainnya (Rahuman et al.
2000).
Dampak negatif dari teknologi pembakaran mendorong banyak ilmuwan dunia untuk merancang berbagai teknologi tanpa pembakaran. Beberapa teknologi tanpa pembakaran yang telah dikomersilkan yaitu GPCR (gas phase chemical reduction), BCD (base catalysed decomposition), SCWO (super-critical water oxidation), PLASCON (plasma arc), Reduksi Natrium, dan Pirolisis (McDowald et al. 2004).
Pengolahan limbah selain kelompok POP, umumnya lebih sederhana. Beberapa metode yang sudah digunakan untuk pengolahan limbah tersebut ialah biodegradasi dan degradasi secara kimia. Menurut Papp (1996), senyawa 2,4-diklorofenol dan diklorometana dapat didegradasi dengan metode biodegradasi inheren (membutuhkan mikrob yang sesuai). Sementara, senyawa trikloroetilena, tetra-kloroetilena, pestisida, dan hidrokarbon petro-leum dapat didegradasi secara kimia melalui metode oksidasi-Fenton (US Department of Energy 1999).
Reagen Fenton
Reagen antara hidrogen peroksida (H2O2)
dengan katalis besi disebut juga reagen Fenton. Hidrogen peroksida merupakan salah satu oksidator yang lazim digunakan. Oksidator ini memiliki kandungan oksigen aktif yang tinggi. Kandungan oksigen aktif ini berpengaruh pada penekanan biaya proses (Strukul 1992).
Hidrogen peroksida mudah sekali terdekomposisi menjadi oksigen dan air. Faktor-faktor yang dapat memengaruhi dekomposisi hidrogen peroksida ialah suhu dan pH (Strukul 1992). Reaksi hidrogen peroksida sangat lambat sehingga membutuhkan katalis. Katalis yang umum digunakan adalah besi sulfat (FeSO4) (Eckenfelder 2000).
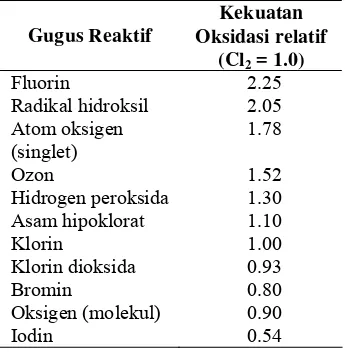
Reagen Fenton menggunakan radikal hidroksil sebagai gugus reaktif dan besi sebagai katalis pembentukan radikal hidroksil tersebut (Eckenfelder 2000). Radikal hidroksil merupakan salah satu gugus yang sangat reaktif yang telah diketahui saat ini, bahkan gugus ini menempati posisi kedua setelah fluorin. Hal ini dapat dilihat dari Tabel 1 (Industrial Wastewater 2007 ).
Reaksi pembentukan radikal hidroksil sebagai berikut:
Fe 2+ + H2O2 Fe 3+ + OH - + · OH (1)
Fe 3+ + H2O2 Fe 2+ + · OOH + H+ (2)
Reaksi tersebut menghasilkan radikal bebas ·OH, serta pembentukan kembali Fe2+
(Eckenfelder 2000). Besi feri dapat berubah kembali menjadi besi fero pada reaksi selanjutnya dengan kelebihan molekul H2O2
(US Department of Energy 1999).
Tabel 1 Kekuatan oksidasi relatif dari gugus reaktif (Metcalf & Eddy 2003)
Gugus Reaktif
Kekuatan Oksidasi relatif
(Cl2 = 1.0)
Fluorin 2.25 Radikal hidroksil 2.05
Atom oksigen (singlet)
1.78
Ozon 1.52 Hidrogen peroksida 1.30
Asam hipoklorat 1.10
Klorin 1.00 Klorin dioksida 0.93
Bromin 0.80 Oksigen (molekul) 0.90
Iodin 0.54
Tahap oksidasi-Fenton meliputi pe-ngaturan pH limbah cairan 3–6, penambahan katalis besi sebagai larutan FeSO4, dan
penambahan perlahan-lahan H2O2. Jika pH
limbah cairan terlalu tinggi, maka besi lebih cepat teroksidasi berubah menjadi Fe(OH)3
dan terjadi dekomposisi H2O2 (US
Department of Energy 1999).
Berdasarkan parameter COD (kebutuhan oksigen kimia), nisbah Fe–H2O2 adalah 1:5–
1:10 (b/b) dengan konsentrasi besi < 25–50 mg/L dapat bereaksi selama 10–24 jam. Produk oksidasinya (asam organik) terpisah dari besi. Reagen Fenton ini cukup efektif sebagai pengolahan pendahuluan untuk limbah dengan nilai COD > 500 mg/L (Industrial Wastewater 2007).
Katalis besi dapat digunakan baik dalam bentuk garam fero (Fe2+) maupun feri (Fe3+). Hal ini dikarenakan sirkulasi perubahan kedua ion tersebut sangat cepat. Akan tetapi, jika konsentrasi reagen Fenton yang digunakan rendah (< 10–25 ppm H2O2), maka
lebih baik menggunakan garam fero (Industrial Wastewater 2007).
Kecepatan reaksi reagen Fenton meningkat dengan peningkatan suhu (20–40 °C). Namun, jika suhu reaksi > 40–50 °C, peranan H2O2 sebagai pengoksidasi semakin
berkurang karena dekomposisi H2O2
dipercepat. Selain suhu, kecepatan kerja reagen Fenton juga dipengaruhi oleh nilai pH (3–6) (Industrial Wastewater 2007).
Reagen Fenton digunakan untuk pengolahan berbagai limbah industri (cairan,
4
lumpur, dan kontaminan tanah) yang mengandung senyawa organik toksik. Keuntungan metode oksidasi menggunakan reagen Fenton adalah murah, siap digunakan, dan produk hasil reaksi tidak berbahaya di lingkungan (berupa air, oksigen, dan CO2).
Proses reaksi ini mudah diaplikasikan dan dikontrol. Waktu pengolahan dan proses reaksi cukup cepat. Reagen Fenton tidak menghasilkan senyawa organik atsiri (US Department of Energy 1999).
Analisis Klorida
Analisis kimia ion klorida dapat berupa analisis kualitatif dan analisis kuantitatif. Prinsip analisis klorida secara kualitatif berdasarkan pembentukan endapan AgCl yang berwarna putih. Hal ini dilakukan dengan penambahan asam nitrat pekat dan beberapa tetes larutan AgNO3 0.1 N (Vogel 1959).
Analisis klorida secara kuantitatif dapat dilakukan dengan berbagai cara, di antaranya metode argentometri, merkuri(II) nitrat, poten-siometri, ferisianida secara otomatis, dan merkuri tiosianat (injeksi alir) (Clesceri et al.
2005).
Prinsip metode merkuri nitrat ialah titrasi klorida menggunakan merkuri(II) nitrat. Difenilkarbazon (DPC) sebagai indikator dapat menunjukkan titik akhir dengan pembentukan kompleks ungu (Clesceri et al. 2005) merkuri-difenilkarbazon (Dorey & Draves 1998). Bahan-bahan yang dapat mengganggu dalam analisis ini ialah kromat, feri, dan ion sulfit jika keberadaannya lebih dari 10 mg/L (Clesceri et al. 2005).
Reaksi titrasi yang terjadi sebagai berikut:
Hg2+ + 2 Cl- HgCl2 (3)
Hg2+ + 2 DPC Hg(DPC)2 (4)
Merkuri(II) nitrat sebagai titran akan bereaksi dengan titrat yang mengandung klorida anorganik membentuk merkuri(II) klorida, sesuai dengan persamaan (3). Kelebihan merkuri nitrat akan bereaksi dengan indikator difenilkarbazon membentuk kompleks merkuri-difenilkarbazon yang berwarna ungu, sesuai dengan persamaan (4) (Dorey & Draves 1998).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah sampel pelarut (diklorometana, kloroform, dan karbon tetraklorida), garam FeSO4·7H2O.
Alat-alat yang dibutuhkan adalah penangas air, pengaduk magnetik, neraca analitik, lempeng pemanas, dan peralatan kaca.
Metode Penelitian Degradasi Senyawa
Sebanyak 0.1 mL sampel dicampurkan dengan 100 mL akuades di dalam Erlenmeyer, lalu diatur pH-nya menggunakan asam sulfat/NaOH pekat dengan ragam pH 1, 3, 4, 5, 6, 8, dan 11. Setelah itu, larutan sampel ditambahkan FeSO4·7H2O dan 5 mL
H2O2 30% (Lampiran 1) sambil diaduk
selama 30 menit. Selanjutnya, larutan dipindahkan ke dalam labu takar 250 mL dan ditera dengan akua-des. Larutan ini disebut larutan A, kemudian dilakukan analisis klorida duplo. Adapun ragam nisbah Fe–H2O2 (b/b) yang diamati yaitu 1:10, 1:20,
1:40, 1:80, dan 1:100. Setiap ragam dilakukan triplo (Lampiran 2).
Dekomposisi Hidrogen Peroksida
Sebanyak 100 mL akuades dimasukkan ke dalam Erlenmeyer 250 mL. Kemudian diatur pH-nya, dengan ragam pH 1 dan 11. Setelah itu, ditambahkan FeSO4·7H2O dan 5
mL H2O2 sambil diaduk selama 30 menit.
Adapun ragam nisbah Fe–H2O2 (b/b) yang
diamati ialah 1:10 dan 1:100. Selanjutnya, larutan diencerkan dalam labu takar 250 mL dan ditera dengan akuades. Larutan ini disebut larutan B. Sebanyak 25 mL (VA)
larutan B diencerkan lagi dalam labu takar 100 mL (VB). Larutan ini disebut larutan C
yang akan dilakukan analisis hidrogen peroksida. Setiap ragam pH dan nisbah Fe– H2O2 (b/b) dilakukan triplo dan dianalisis
H2O2 triplo.
Analisis Klorida
Analisis klorida secara kualitatif dilakukan dengan cara sedikit filtrat larutan A dimasuk-kan ke dalam tabung reaksi, ditambahkan HNO3 pekat dan beberapa tetes
larutan AgNO3 0.1 N (Lampiran 1). Klorin
dideteksi secara kualitatif dengan terbentuknya endapan AgCl yang berwarna putih (Vogel 1959). Analisis klorida juga dilakukan untuk blangko (akuades).
Analisis klorida secara kuantitatif dilakukan dengan cara 10 mL larutan A ditambahkan 8 tetes larutan indikator campuran (Lampiran 1) hingga larutan berwarna ungu, lalu ditambahkan 1–2 tetes HNO3 pekat hingga larutan berwarna kuning.
Setelah itu, larutan dititrasi dengan merkuri nitrat 0.0141 N (Lampiran 3) sampai berwarna ungu (Clesceri et al. 2005). Analisis klorida juga dilakukan untuk blangko (air bebas ion). Setiap analisis dilakukan triplo.
5
Analisis Hidrogen Peroksida
Sebanyak 10 mL (VC) larutan contoh
perhidrol (H2O2) 30 % dimasukkan ke dalam
labu takar 1000 mL (VL) dan diencerkan
dengan air akuades hingga tanda tera. Larutan ini disebut larutan C. Sebanyak 25 mL (V1)
larutan C dimasukkan ke dalam Erlenmeyer 250 mL serta ditambahkan 100 mL akuades dan 20 mL larutan H2SO4 6 N. Setelah itu,
larutan dititrasi dengan KMnO4 0.1 N
(Lampiran 3) sampai berwarna merah muda (Basset et al. 1978). Analisis ini dilakukan triplo.
Analisis Pengolahan Data
Data persen degradasi masing-masing sampel dianalisis menggunakan uji statistik ANOVA (analysis of variance) dua faktorial, faktor A dan faktor B. Sebelumnya, diten-tukan hipotesis nol (Ho) dan hipotesis tandingan (H1)
dari penelitian ini. Peluang kesalahan (taraf nyata; α) yang digunakan ialah 0.05 dengan tingkat kepercayaan (1- α ) 95%. Statistik uji
Fhitung mengikuti sebaran F dengan derajat
bebas (db) pembilang masing-masing faktor, n-1, dan db penyebut hasil kali db pembilang kedua faktor. Jika hasil Fhitung > Ftabel
(0.05,db1,db2) dan peluang nyata (P) < α,
berarti data mendukung untuk menolak Ho. Dengan kata lain, faktor A, faktor B, dan interaksi kedua faktor saling memengaruhi atau data persen degradasi sampel berbeda nyata (Mattjik, Sumertajaya 2002).
Data persen degradasi juga diolah dengan program Umetric modde 5. Pada program ini data yang tersedia diambil secara acak dan diolah dengan rancangan RSM (model respon permukaan), kemudian dianalisis dengan PLS (partial least square). Rancangan RSM digunakan untuk membuat pendekatan respon dengan model polinomial kuadratik. Langkah ini bertujuan mengetahui lebih detail faktor yang dapat memengaruhi respon dan membuat prediksi, optimasi, serta kisaran pengerjaan. Analisis PLS digunakan bila respon yang akan diukur cukup banyak (lebih dari 3) dan/atau bila ada data yang hilang, serta faktor yang tidak terkontrol. Pengolahan data ini ditampilkan dengan persamaan model serta kurva 3 dimensi dan kontur (Umetric 1999).
HASIL DAN PEMBAHASAN
Penelitian ini menggunakan 3 macam pelarut organoklorin (diklorometana, kloro-form, dan karbon tetraklorida) dengan me-libatkan 2 faktor yang memengaruhi hasil degradasi pelarut organoklorin ialah faktor
nisbah FeSO4·7H2O–H2O2 (b/b)dan faktor pH.
Ragam nisbah yang digunakan yaitu 1:10, 1:20, 1:40, 1:80, dan 1:100.
Ragam
pH yang digunakan yaitu pH 1, 3, 4, 5, 6, 8, dan 11.Degradasi Diklorometana
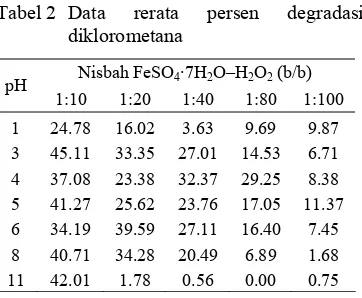
Data titrasi digunakan untuk menghitung persen degradasi sampel. Rerata persen (%) degradasi diklorometana 0.00–45.11 (Tabel 2). Rerata persen degradasi diklorometana semakin meningkat dari nisbah 1:100 ke nisbah 1:10. Nilai degradasi diklorometana tertinggi terjadi pada pH 3 dengan nisbah 1:10 yaitu 45.11%. Sementara, nilai degradasi diklorometana rendah umumnya terjadi pada pH 11 dengan ragam nisbah yang dilakukan. Bahkan, pada pH 11 dengan nisbah 1:80, diklorometana tidak dapat didegradasi.
Tabel 2 Data rerata persen degradasi diklorometana
Nisbah FeSO4·7H2O–H2O2 (b/b) pH
1:10 1:20 1:40 1:80 1:100
1 24.78 16.02 3.63 9.69 9.87 3 45.11 33.35 27.01 14.53 6.71 4 37.08 23.38 32.37 29.25 8.38 5 41.27 25.62 23.76 17.05 11.37 6 34.19 39.59 27.11 16.40 7.45 8 40.71 34.28 20.49 6.89 1.68 11 42.01 1.78 0.56 0.00 0.75
Faktor nisbah memberikan pengaruh nyata terhadap nilai persen degradasi diklorometana dengan α 5% (Lampiran 4). Peningkatan nisbah FeSO4·7H2O–H2O2 (b/b)
mempercepat pembentukan radikal hidroksil sehingga degradasi diklorometana menjadi lebih cepat.
Diklorometana cukup baik terdegradasi pada pH 3–8. Bahkan, pada nisbah 1:10 dengan kondisi asam maupun basa sama besarnya. Hal ini menyimpang dari pernyataan Industrial Wastewater (2007) bahwa pH 3–6 merupakan kisaran pH yang baik untuk oksidasi Fenton. Faktor pH berpengaruh nyata terhadap persen degradasi diklorometana dengan α 5% (Lampiran 4).
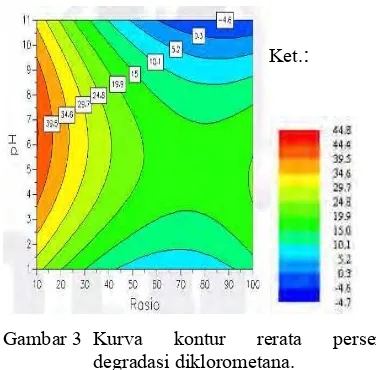
Persen degradasi juga diolah dengan program Umetrics Modde 5 sehingga diperoleh tampilan kurva tiga dimensi dan kontur (Gambar 2 dan 3). Berdasarkan kurva tersebut, dijelaskan bahwa persen degradasi diklorometana juga dipengaruhi baik oleh faktor pH maupun nisbah. Pada nisbah besar, perubahan pH tidak terlalu memengaruhi
6
nilai persen degradasi, namun pada nisbah kecil, perubahan pH berpengaruh.
Adanya pengaruh interaksi kedua faktor didukung dengan hasil perhitungan statistik ANOVA yang menunjukkan bahwa interaksi kedua faktor berpengaruh nyata terhadap persen degradasi diklorometana dengan α 5% (Lampiran 4). Pola persen degradasi diklorometana dapat dinyatakan ke dalam persamaan berikut:
Y = 20.0627 - 10.6738 x1- 1.5934 x2+ 7.9660
x12 - 10.3352 x22- 3.9221 x1x2, dengan regresi
(R2) sebesar 77.7%. Keterangan:
x1= faktor nisbah
x2= faktor pH
Y = persen degradasi
Gambar 2 Kurva tiga dimensi rerata persen degradasi diklorometana.
Gambar 3 Kurva kontur rerata persen degradasi diklorometana.
Degradasi Kloroform
Rerata persen degradasi kloroform 0.31– 13.76 (Tabel 3). Nilai degradasi kloroform tertinggi terjadi pada pH 1 dengan nisbah 1:10 ialah 13.76%. Sementara, nilai degradasi kloroform terendah terjadi pada pH 11 dengan nisbah 1:40, ialah 0.31%. Pada pH 11,
umumnya menghasilkan persen degradasi kloroform yang rendah. Berdasarkan Tabel 3, nisbah sangat berpengaruh secara nyata terhadap hasil degradasi kloroform dengan α 5% (Lampiran 4).
Tabel 3 Data rerata persen degradasi kloroform
Nisbah FeSO4·7H2O–H2O2 (b/b) pH
1:10 1:20 1:40 1:80 1:100
1 13.76 10.91 7.91 4.61 6.30 3 13.52 12.22 9.99 9.07 7.07 4 10.45 10.29 10.76 6.30 5.22 5 12.99 11.68 13.22 5.84 4.30 6 12.91 13.06 10.76 7.23 7.07 8 11.68 12.76 11.68 7.23 6.45 11 8.15 1.23 0.31 1.69 0.69
Kloroform dapat terdegradasi pada kisaran pH 1–8. Hal ini dapat disebabkan adanya perbedaan jenis besi. Pada pH asam, besi cenderung berbentuk ion fero (Fe2+), sedangkan pada pH basa cenderung berbentuk ion feri (Fe3+) (Industrial Wastewater 2007). Ion fero dapat mengkatalisis pembentukan radikal hidroksil secara cepat melalui dekomposisi H2O2,
sedangkan ion feri harus melalui perubahan bentuk menjadi ion fero terlebih dahulu (Munter 2001). Hal ini menyebabkan penggunaan ion feri kurang dianjurkan terlebih untuk penggunaan konsentrasi katalis yang rendah (Industrial Wastewater 2007). Faktor pH berpengaruh nyata terhadap persen degradasi kloroform dengan α 5% (Lampiran 4).
Ket.:
Ket.
:
Tampilan kurva tiga dimensi dan kontur pelarut kloroform diperoleh dengan pengolahan program Umetrics Modde 5 (Gambar 4 dan 5). Berdasarkan kurva tersebut, dijelaskan bahwa persen degradasi kloroform juga dipengaruhi baik oleh faktor pH maupun nisbah. Perubahan pH pada nisbah besar tidak terlalu memengaruhi nilai persen degradasi, namun berbeda pada nisbah kecil, perubahan pH sangat berpengaruh. Interaksi kedua faktor berpengaruh nyata terhadap persen degradasi kloroform dengan
α 5% (Lampiran 4).
Pola persen degradasi kloroform dapat dinyatakan ke dalam persamaan berikut:
Y = 7.7516-2.3912 x1- 2.4074 x2 + 1.7086 x12
- 2.7534 x22 + 0.4608 x1x2, dengan regresi (R2)
sebesar 83.2%.
7
Gambar 4 Kurva tiga dimensi rerata persen degradasi kloroform.
Gambar 5 Kurva kontur rerata persen degradasi kloroform.
Degradasi Karbon Tetraklorida Rerata persen degradasi karbon tetraklorida 0.00-1.40 (Tabel 4). Berdasarkan data yang diperoleh, karbon tetraklorida tidak dapat didegradasi menggunakan metode oksidasi-Fenton. Pada umumnya, rerata persen degradasi karbon tetraklorida kecil pada semua nisbah, bahkan banyak di antaranya yang bernilai 0%. Nilai degradasi karbon tetraklorida tertinggi hanya 1.40% yaitu pada pH 5 dengan nisbah 1:10.
Tabel 4 Data rerata persen degradasi karbon tetraklorida
Nisbah FeSO4·7H2O–H2O2 (b/b)
pH
1:10 1:20 1:40 1:80 1:100 1 0.42 0.42 0.42 0.42 0.63 3 0.42 0.42 0.70 0.42 0.56 4 0.42 0.00 0.00 0.00 0.00 5 1.40 0.63 0.56 0.00 0.00 6 0.42 0.51 0.63 0.56 0.21 8 0.42 0.00 0.00 0.00 0.00 11 0.42 0.00 0.14 0.00 0.00
Hal ini dikarenakan senyawa karbon tetraklorida hanya dibangun dari ikatan C-Cl. Ikatan C-Cl merupakan salah satu jenis ikatan yang sulit dioksidasi. Kondisi oksidasi atom karbon suatu molekul di dalam reaksi organik, dapat ditentukan dari atom yang diikatnya dan bilangan oksidasi yang diperoleh dari nilai pendekatan (Lampiran 5) (Smith et al. 2001). Data persen degradasi karbon tetraklorida juga diperjelas dengan tampilan kurva tiga dimensi dan kontur (Gambar 6 dan 7).
Ket.
:
Ket.
:
Ket.
:
Gambar 6 Kurva tiga dimensi rerata persen degradasi karbon tetraklorida.
Ket.
:
Gambar 7 Kurva kontur rerata persen degradasi karbon tetraklorida.
Pola persen degradasi karbon tetraklorida dapat dinyatakan ke dalam persamaan berikut:
Y = 0.2605 - 0.1014 x1- 0.1196 x2+ 0.0331
x12 + 0.0131 x22 - 0.0944 x1x2, dengan regresi
(R2) sebesar 50.1%.
Berdasarkan kurva tersebut, dijelaskan bahwa persen degradasi karbon tetraklorida dipengaruhi oleh pH maupun nisbah
FeSO4·7H2O–H2O2 (b/b). Akan tetapi, pengaruh
yang diberikan sangat kecil, sehingga perlu adanya perlakuan khusus (tahap awal)
8
sebelum proses degradasi karbon tetraklorida dilakukan.
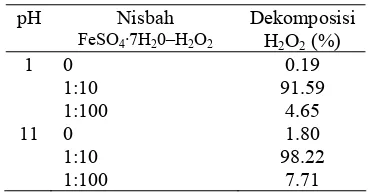
Dekomposisi Hidrogen Peroksida Umumnya, pH basa cenderung meng-hasilkan nilai persen degradasi yang rendah, kecuali pada nisbah 1:10. Perbedaan nilai persen degradasi pada nisbah 1:10 baik di kondisi asam maupun basa tidak terlalu terlihat (sama besarnya). Hal ini berbeda dengan laporan yang dikeluarkan Industrial Wastewater (2007), yaitu pH 3−6 merupakan kisaran pH yang baik untuk oksidasi Fenton.
Oleh karena itu, dilakukan percobaan dekomposisi H2O2. Besarnya dekomposisi
H2O2 yang dikatalisis oleh Fe diasumsikan
sebanding dengan banyaknya radikal hidroksil yang terbentuk, maka diharapkan pelarut organoklorin yang terdegradasi semakin tinggi. Dekomposisi hidrogen peroksida dilakukan pada pH 1 dan 11 dengan nisbah 1:10 dan 1:100.
Tabel 5 Data rerata persen dekomposisi hidrogen peroksida
pH Nisbah
FeSO4·7H20–H2O2
Dekomposisi H2O2 (%)
1 0 0.19
1:10 91.59 1:100 4.65
11 0 1.80
1:10 98.22 1:100 7.71
Dekomposisi H2O2 pada nisbah 1:10 lebih
tinggi dibandingkan dengan nisbah 1:100, baik pada kondisi asam maupun basa (Tabel 5). Hal ini sesuai dengan data persen degradasi ketiga pelarut organoklorin yang menyatakan bahwa pada nisbah 1:10 lebih tinggi dibandingkan dengan nisbah 1:100. Hal ini dikarenakan semakin banyak katalis besi yang digunakan, maka akan semakin banyak radikal hidroksil yang terbentuk. Jika katalis besi yang digunakan sedikit dapat menyebabkan H2O2
belum habis bereaksi dan kelebihan H2O2 dapat
terdekomposisi tanpa melalui pembentukan radikal hidroksil.
Dekomposisi H2O2 pada kondisi basa lebih
tinggi daripada kondisi asam di nisbah 1:10, 1:100, dan tanpa menggunakan katalis besi. Hal ini tidak sesuai dengan data persen degradasi ketiga pelarut organoklorin yang menyatakan bahwa pada kondisi asam lebih tinggi daripada kondisi basa. Tingginya dekomposisi H2O2 pada kondisi basa dapat
dikarenakan adanya kemungkinan proses dekomposisi H2O2 tanpa melalui pem-bentukan
radikal hidroksil. Hal ini juga memperkuat laporan US Department of Energy (1999) yang menyatakan bahwa pH yang terlalu tinggi dapat menyebabkan dekomposisi H2O2.
Percobaan dekomposisi H2O2 belum dapat
memberi gambaran secara menyeluruh mengenai pengaruh dekomposisi H2O2
terhadap degradasi pelarut organoklorin.
SIMPULAN DAN SARAN
Simpulan
Metode oksidasi-Fenton efektif bekerja pada pH 3–8 dengan nisbah 1:10 sampai 1:40. Kisaran nilai degradasi dari dikloro-metana sebesar 0.00–45.11% dan kloroform sebesar 0.31–13.76 %. Sementara, karbon tetraklorida tidak dapat terdegradasi dengan metode ini. Dekomposisi hidrogen peroksida lebih tinggi pada kondisi basa. Akan tetapi, percobaan dekomposisi H2O2 belum dapat
memberi gambaran secara menyeluruh mengenai pengaruh dekomposisi H2O2
terhadap degradasi pelarut organoklorin.
Saran
Tahap degradasi pelarut organoklorin memerlukan perlakuan (hidrolisis) terlebih dahulu sebelum dioksidasi dengan metode Fenton. Penelitian lanjutan perlu dilakukan mengenai dekomposisi H2O2 pada ragam
nisbah dan pH yang dicobakan sebelum dilakukan degradasi sampel menggunakan metode tersebut.
DAFTAR PUSTAKA
[ATSDR] Agency for toxic substances and disease registry. 1994. Toxicological profile for carbon tetrachloride(Update). Atlanta: Public Health Service, U.S. Department of Health and Human Services. http://www.atsdr.cdc.gov/tox-profiles.pdf. [19 Sep 2007].
Azman WZ. 1995. Racun organoklorin bahayakan kesehatan. http://www.prn2. usm.my/mainsite/bulletin/racun/1995/rm p3.html. [6 Agu 2007].
Badan Koordinasi Penanaman Modal. 2007. Daftar investasi negatif berdasarkan keppres no.96/2000 jo.118/2000. Sulawesi Tengah. [19 Sep 2007].
9
Basset J et al. 1978. Vogel’s Textbook Of Quantitative Inorganic Analysis, Including Elementary Instrumental Analysis. Ed ke-4. London: The ELBS & Longman. Hlm: 348-354, 355.
Belding S. 2006. Chloroform: the molecule lifesaver. University of Oxford. www.chm.bris.ac.uk/motm/chloroform/chl oroformv.htm. [19 Sep 2007].
Clesceri LS et al. 2005. Standard Methods for The Eximination of Water and Wastewater. Ed ke-21. Washington DC: APHA.
Department of the Environment and Water Resources. 2005. Chloroform (trichloromethane) fact sheet. Australia. http://www.npi.gov.au/database/substance-info/profiles/23.html. [19 Sep 2007].
Dorey, Draves. 1998. Chloride determination by titration with mercury. Conway: University of Central Arkansas. http://chemistry.uca.edu/projects/quant 98/chloride-hg-titrn-98.pdf. [13 Jun 2008]
Eckenfelder WW, Jr. 2000. Industrial Water Pollution Control. Ed ke-3. The McGraw-Hill. Hlm: 470-474.
[FEA] Federal Environmental Agency. 1999. Classification of subtances and mixtures into water hazard classes according to the administrative regulation on the classification of subtances hazardous to waters. Jerman: FEA.
Hendra. 3 Juni 2005. Sertifikat Ekolabel Belum Teraplikasi. Kompas, rubrik berita. http://air.Bappenas.go.id. [7 Sep 2006].
[Industrial Wastewater]. 2007. Fenton’s reagent: iron-catalyzed hydrogen peroxide. http://www.h2o2.com/applications/industri alwastewater/Fentonsreagent.html. [7 Jun 2007].
[IPEN] International POPs Elimination Network. 2005. A living document – adding new POPs to the Stockholm convention on persistent organic pollutans. http://www.oztoxics.org/poprc/CANDIDA TE-POPS_1.html. [7 Sep 2007].
Kolthoff IM et al. 1969. Quantitative Chemical Analysis. Ed ke-4. London: The
Macmillan. hlm: 816–817, 825–827, 834-835.
Marshall KA. 2007. Chlorocarbons and chlorohydrocarbons. di dalam: Kroschwitz JI and Howe-Grant M, editor. Kirk-Othmer Encyclopedia of
Chemical. Technology. Ed ke-5, Vol 6. New York: John Wiley.
Mattjik AA, Sumertajaya IM. 2002.
Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Jilid 1. Ed ke-2. Bogor: IPB Press.
McDowald R et al. 2004. Review of emerging, innovative technologies for the destruction and decontamination of POPs and the identification of promising technologies for use in developing countries. Auckland.
Metcalf, Eddy. 2003. Wastewater Engineering Treatment and Reuse. Ed ke-4. The Mc Graw-Hill.
Munter R. 2001. Advanced oxidations processes-current status and prospects.
Sci Chem. 50(2): 59-80.
Nugrohati S. 2004. Naskah akademik ratifikasi dan implementasi konvensi Stockholm. Asdep Urusan pertanian dan kehutanan, Deputi Bidang Pengendalian Pencemaran Dampak Lingkungan Sumber Institusi, Kementrian Lingkungan Hidup. Jakarta.
Papp R. 1996. Organochlorine Waste Management. Pure & Appl Chem. 68(9):1801 -1 808.
Rahuman M et al. 2000. Destruction technologies for polychlorinated biphenyls (PCBs). Pure & Appl Chem.
Sibarani JP. 27 September 2002. Selamatkan Lapisan Ozon Mulai dari Diri Sendiri.
Kompas, rubrik berita. http:/www.kom-pas.com/kompas-cetak/0209/27/iptek/ sela45.htm. [19 Sep 2007].
Smith et al. 2001. March’s Advanced Organic Chemistry: Reactions, Mechanism, and Structure. Ed ke-5. New York: John Wiley.
10
Stevens G. 2001. Dealing with dichloromethane before the damage is done. Durham. http:/www.theworks-works.com/press/dealing%20with%20Dic hloromethane.pdf. [19 Sep 2007].
Strukul G. 1992. Catalytic Oxidations with Hidrogen Peroxide as Oxidant. The Netherlands: Kluwer.
Thompson RC. 2004. Carbon Tetrachloride Marine Risk Assessment with Special Reference to the OSPARCOM region: North Sea. Environmental Monitoring and Assessment. 97(1-3): 23-38. [19 Sep 2007].
Tripp JT, Liu J. 2006. Carbon tetrachloride pathway map (anaerobic). University of Minnesota. http:/umbbd.msi.umn.edu/ ctc/ctc_map.html. [19 Sep 2007].
Umetric AB. 1999. User’s guide to modde 5.0. Sweden: Umetric AB
US Department of Energy. 1999. Innovative technology: summary report. http://apps. em.doe.gov/OST/pubs/itsrs/itsr2161.pdf. [24 Jul 2007].
Vogel AI. 1959. Practical Organic Chemistry. Ed ke-3. Bagian XI.3, Qualitative analysis for the elements; hlm 1038, 1044-1045. London: Longmans
WHO Regional Office for Europe. 2000.
Dichloromethane. Copenhagen. http:/www.euro.who.int/document/aiq/5_7
dichloromethane.pdf. [19 Sep 2007].
12
Lampiran 1 Prosedur pembuatan pereaksi
1. Pembuatan Larutan H2O2 30 %
Sebanyak 15 mL larutan stok perhidrol (H2O2) 50 % dimasukkan ke dalam labu takar
25 mL, kemudian larutan ditera dengan air bebas ion.
2. Pembuatan Larutan AgNO3 0.1 N
Sebanyak 0.85 gram serbuk AgNO3 dilarutkan dengan akuades dalam gelas piala,
kemudian larutan ditera dalam labu takar 25 mL.
3. Pembuatan Larutan Indikator Campuran
Sebanyak 0.5 gram difenilkarbazon dan 0.05 gram bromfenol biru dilarutkan dengan 75 mL etil/isopropil alkohol, kemudian larutan ditera dalam labu takar 100 mL dengan pelarut yang sama.
13
Lampiran 2 Diagram alir penelitian
Destruksi Senyawa
0,1 mL Sampel
* Dimasukkan ke dalam Erlenmeyer 250 mL + 100 mL akuades
* Diatur pH dengan H2SO4 atau NaOH pekat
+ Garam FeSO4.7H2O
+ 5 mL H2O2
* Diaduk dengan pengaduk magnetik selama 30 menit
Larutan Hasil Oksidasi
* Dipindahkan ke dalam labu takar 250 mL * Ditera dengan akuades
Dekomposisi Hidrogen Peroksida
Analisis Klorida Kualitatif (Vogel 1959)
Larutan A Analisis Klorida
100 mL Akuades
* Dimasukkan ke dalam Erlenmeyer 250 mL * Diatur pH dengan H2SO4 atau NaOH pekat
+ Garam FeSO4.7H2O
+ 5 mL H2O2
* Diaduk dengan pengaduk magnetik selama 30 menit
Larutan Hasil Oksidasi
* Dipindahkan ke dalam labu takar 250 mL * Ditera dengan akuades
Larutan B
* Dipipet 25 (VA) mL larutan B
* Dimasukkan ke dalam labu takar 100 (VB) mL B
* Ditera dengan akuades
Sedikit Larutan A
Endapan AgCl (putih)
* Dimasukkan ke dalam tabung reaksi + Beberapa tetes HNO3 pekat
+ Beberapa tetes AgNO3 0.1 N
Larutan C Analisis Hidrogen Proksida
14
Analisis Klorida Kuantitatif (Clesceri et al 2005)
10 mL Larutan A
* Dimasukkan ke dalam Erlenmeyer 50 mL
+ 8 tetes larutan indikator campuran hingga berwarna ungu + 1-2 tetes larutan HNO3 pekat hingga berwarna kuning
Titrasi dengan Merkuri Nitrat 0.0141 N (telah distandardisasi) hingga ungu
Rumus perhitungan analisis klorida:
sampel BM % 100 x Cl BA x n teoritis Cl Kadar = sampel W % 100 x Cl BE x 2 ) 3 NO ( Hg N x 2 ) 3 NO ( Hg V x p f terurai Cl Kadar = % 100 x teoritis Cl Kadar terurai Cl Kadar radasi deg (%) Persen =
Analisis Hidrogen peroksida (Basset et al 1978)
10 (VC) mL Larutan H2O2 30 %
* Dimasukkan ke dalam labu takar 1000 (VL) mL
* Ditera dengan akuades
* Dipipet 25 (V1) mL Larutan C
* Dimasukkan ke dalam Erlenmeyer 250 mL + 100 mL akuades
+ 20 mL H2SO4 6 N
Larutan C
Titrasi dengan KMnO4 0.1 N
(telah distandardisasi) hingga merah muda
Rumus perhitungan analisis hidrogen peroksida:
mL 100 / 2 O 2 H g 100 x 1 V 100 x C V L V x 2 O 2 H BE x 4 KMnO N x 4 KMnO V 2 O 2 H % = mL 100 / 2 O 2 H g 100 x 1 V 100 x C V L V x 0073 . 17 x 4 KMnO N x ) blanko sampel ( T V 2 O 2 H % − =
Rumus perhitungan dekomposisi hidrogen peroksida:
15
Lampiran 3 Prosedur analisis dan standardisasi
A. Standardisasi Merkuri Nitrat (Clesceri et al 2005)
Sebanyak 10 mL larutan NaCl 0.0141 N ditambahkan 8 tetes larutan indikator campuran hingga larutan berwarna ungu, lalu ditambahkan 1-2 tetes asam nitrat pekat hingga larutan berwarna kuning. Setelah itu, larutan dititrasi dengan merkuri nitrat 0.0141 N sampai berwarna ungu. Standardisasi dilakukan triplo. Rumus perhitungannya sebagai berikut:
2 ) 3 NO ( Hg V
NaCl N x NaCl V 2 ) 3 NO ( Hg
N =
B. Standardisasi Kalium Permanganat (Kolthoff et al 1969)
Sebanyak 0.147 g H2C2O4.2H2O dilarutkan dengan 100 mL akuades ke dalam Erlenmeyer
250 mL, lalu ditambahkan 20 mL H2SO4 6 N. Setelah itu, larutan dipanaskan hingga suhu larutan
55-60 oC, kemudian larutan dititrasi dalam suasana hangat dengan KMnO4 0.1 N sampai berwarna
merah muda. Analisis ini dilakukan triplo. Rumus perhitungannya sebagai berikut:
S V x 2 ) COOH ( BE
1000 x 2 ) COOH ( W 4 KMnO
N =
16
Lampiran 4 Data perhitungan statistik ANOVA
Data perhitungan statistik diklorometana
Source of Variation SS df MS F P-value F crit
Ratio 11887.18 4 2971.7961 325.47953 2.024E-44 2.502659 pH 4149.448 6 691.57464 75.743213 1.234E-28 2.231189
Interaction (Ratio * pH) 4196.648 24 174.86031 19.151197 5.105E-22 1.673829
Error 639.1361 70 9.1305162
Total 20872.42 104
Data perhitungan statistik kloroform
Source of Variation SS df MS F P-value F crit
Sample 672.1905 4 168.04763 121.71434 9.486E-31 2.502656
Columns 703.0516 6 117.17527 84.868269 3.927E-30 2.231192 Interaction (Ratio * pH) 193.5702 24 8.0654241 5.841664 3.524E-09 1.673829
Within 96.64707 70 1.3806724
Total 1665.459 104
Data perhitungan statistik karbon tetraklorida
Source of Variation SS df MS F P-value F crit Sample 1.861347 4 0.4653367 19.175962 1.093E-10 2.502656
Columns 4.04068 6 0.6734467 27.751923 1.053E-16 2.231192 Interaction (Ratio * pH) 3.98272 24 0.1659467 6.8384615 1.367E-10 1.673829
Within 1.698667 70 0.0242667
Total 11.58341 104
17
Lampiran 5 Nilai pendekatan bilangan oksidasi
Pendekatan Bilangan Oksidasi
-4 -2 0 -2 +4
R H
C C
C C
O H O
R
CO
2R OH
R R
O
CCl
4R Cl
C NH2
R NH2
O
C C
C l l
Cl
C C
Cl l
C C
Cl Cl
C C
OH OH