KATA PENGANTAR
Tingkat kesehatan manusia mempengaruhi aktivitas hidup seseorang dan pola makan juga polusi lingkungan mampu mempengaruhi keseimbangan jasmani-rohani. Radikal bebas merupakan salah satu faktor yang dapat mengancam daya tahan tubuh baik dari luar atau dalam tubuh sendiri. Dampak radikal bebas berkontribusi ke berbagai penyakit kronis dan penyakit degeratif seperti serangan jantung, alzheimer, stroke dan kanker.
Ada 2 sumber radikal bebas berada di tubuh manusia yakni endogen (dari dalam) dan eksogen. Berasal dari luar tubuh (eksogen) seperti polusi udara, radiasi UV, sinar-X, pestisida dan asap rokok, sedangkan endogen adalah radikal bebas berasal dari dalam tubuh sendiri seperti autooksidasi, oksidasi enzimatik dan respiratory burst. Radikal bebas merupakan suatu atom molekul atau senyawa dengan satu atau lebih elektron tidak berpasangan sehingga sangat reaktif, dan dapat terbentuk dalam tubuh saat bernafas sebagai hasil samping proses oksidasi atau pembakaran, olahraga berlebihan, ketika terjadi peradangan, terpapar polusi lingkungan seperti dari asap rokok, kendaraan bermotor, radiasi, dan sebagainya.
Pada saat terjadi infeksi, radikal diperlukan untuk membunuh mikroorganisme penyebab infeksi. Namun, paparan radikal bebas (bersifat reaktif) berlebihan dan secara terus- menerus dapat menyebabkan kerusakan sel, mengurangi kemampuan sel untuk beradaptasi terhadap lingkungannya sehingga timbul gangguan kesehatan atau penyakit, dan pada akhirnya dapat menyebabkan kematian sel (meninggalnya seseorang). Ada 10 jenis radikal bebas yang cukup berbahaya, yaitu asap rokok, polusi udara (asap kendaraan bermotor, industri, dll), radiasi UV, pestisida, obat-obatan, dampak olah raga berlebihan, radioterapi, autooksidasi, oksidasi enzimatik dan respiratory burst.
Kita dapat melakukan pencegahan terhadap dampak negative radikal bebas ini, dengan beberapa hal yaitu pola hidup
sehat dan cerdas, berolah raga dengan dosis tepat (frekuensi 3 - 5 kali dalam satu minggu dan lama berolah raga 45 - 60 menit), dan konsumsi sayur dan buah. Antioksidan ditemukan cukup banyak pada bahan pangan, seperti vitamin E, vitamin C, flavonoid dan karotenoid. Khususnya flavonoid yang berada di dalam tanaman masih belum berbentuk molekul bebas, sehingga pada penelitian kami di Fakultas Farmasi, UGM menghidrolisis baik dengan asam maupun basa untuk membuat flavonoid bebas sehingga meningkat aktivitas antioksidannya (IC50 cukup rendah).
Dengan selesainya penulisan buku ini, bukan berarti tidak ada proses lebih lanjut secara ilmiah dan teknologinya. Walaupun masih jauh dari sempurna, semoga informasi ilmiah dalam buku ini dapat bermanfaat bagi mahasiswa dan masyarakat pada umumnya. Akhir kata, kami bersyukur pada Allah SWT yang telah melimpahkan karunianya untuk menerbitkan buku ini dan mengucapkan banyak terimakasih kepada semua pihak pada kontribusi dalam penulisan buku ini terutama Frau Prof. Dr.
Ulrike Holzgrabe di Universitas Wuerzburg, Frau Dr. Isolde Friederick di Loerrach, Frau Dr. Carola Uffinger di Wuerzburg, Bapak Prof. Dr. Subagus Wahyuono, Bapak Prof. Dr. Agung Endro Nugroho, Ibu Dr. Andayana Puspitasari, Bapak Prof.Dr.
Achmad Mursyidi, Ibu Dr. Ritmaleni, dan Deutscher Akademischer Austauschdienst (DAAD)-Bonn-Jakarta.
Yogyakarta, 17 Oktober 2017 Tim Penulis
DAFTAR ISI
KATA PENGANTAR ... ii
DAFTAR ISI ... iv
DAFTAR GAMBAR ... vii
DAFTAR TABEL ... xi
DAFTAR SINGKATAN ... xii
BAB I OKSIDAN ... 1
1. 1. Pengertian Oksidan ... 1
1. 2. Pengertian Radikal Bebas ... 3
1. 3. Sumber Radikal Bebas ... 7
1.3.1. Anion Superoksida ... 10
1.3.2. Radikal Hidroksil ... 12
1.3.3. Hidrogen Peroksida ... 13
1.3.4. Oksigen Singlet ... 14
1.3.5. Radikal endogen ... 16
1.3.6. Radikal eksogen ... 17
1. 4. Tahapan Reaksi Pembentukan Radikal Bebas ... 18
1.4.1. Tahap inisiasi ... 18
1.4.2. Tahap propagasi ... 19
1.4.3. Tahap terminasi ... 20
1. 5. Efek Radikal Bebas ... 20
1.5.1. Efek Negatif Radikal Bebas ... 20
1.5.2. Efek Positif Radikal Bebas... 26
BAB II ANTIOKSIDAN DAN JENISNYA... 29
2.1. Pengertian Antioksidan ... 29
2.2. Jenis Antioksidan ... 31
2.2.1. Antioksidan alami ... 31
2.2.2. Antioksidan sintetik ... 48
BAB III UJI AKTIVITAS ANTIOKSIDAN ... 56
3.1.Uji Aktivitas Antioksidan secara in vitro ... 56
3.1.1. Menggunakan bahan kimia... 56
3.1.1.1. Uji DPPH ... 56
3.1.1.2. Pengukuran diena terkonjugasi ... 61
3.1.1.3. Pengukuran bilangan para−anisidin ... 62
3.1.2. Menggunakan materi biologis ... 73
3.2. Uji Aktivitas Antioksidan secara in vivo ... 74
3.2.1. Glutation peroksidase (Gpx) ... 74
3.2.2. Uji Enzim Katalase ... 76
3.2.3. Penentuan Kadar Malonaldehid (MDA) Plasma... 88
BAB IV PENELITIAN MENGENAI ANTIOKSIDAN ... 92
4.1. Uji Aktivitas Antioksidan dan Deteksi Senyawa Buah Talok (Muntingia calabura L.) ... 92
4.2. Uji Aktivitas Penangkapan Radikal dan Deteksi Golongan Senyawa Ekstrak Etanolik Terpurifikasi Batang Brotowali Tinospora crispa (L.)Miers ... 107
4.3. Perbandingan Inhibisi Ekstrak Air Buah Mahkota Dewa (Phaleria macrocarpa, (Scheff). Boerl.) dan Vitamin C Terhadap Fotodegradasi Tirosin... 123
4.4. Uji Penangkapan Radikal oleh Fraksi−fraksi Ekstrak Bunga Kecombrang (Nicola speciosa (BI.) Horan) dan Buah
Talok (Muntingia calabura, L.) Menggunakan DPPH ... 124
DAFTAR PUSTAKA ... 128
BAB I ... 128
BAB II ... 132
BAB III ... 137
BAB IV ... 148
DAFTAR GAMBAR
Gambar 1. Pembentukan radikal bebas ... 4
Gambar 2. Pengaruh ROS terhadap tubuh ... 9
Gambar 3. Beberapa spesies ROS ... 10
Gambar 4. Sumber radikal eksogen ... 18
Gambar 5. Atherosklerosis ... 21
Gambar 6. Kerusakan DNA akibat radikal bebas ... 22
Gambar 7. Mekanisme kerusakan lipid peroksidasi ... 23
Gambar 8. Tahapan terjadinya kerusakan lipid peroksidasi ... 25
Gambar 9. Efek radikal nitrit oksida untuk tubuh ... 27
Gambar 10. Efek radikal bebas jenis ROS dalam menghambat bakteri ... 28
Gambar 11. Antioksidan melindungi tubuh dari radikal bebas .. 30
Gambar 12. Sumber antioksidan alami ... 32
Gambar 13. Struktur kimia −tokoferol ... 33
Gambar 14. Struktur kimia asam askorbat ... 35
Gambar 15. Struktur substitusi flavonoid dengan aktivitas antioksidan ... 39
Gambar 16. Struktur kimia beberapa jenis flavonoid ... 40
Gambar 17. Struktur flavonoid dengan aktivitas antioksidan tinggi ... 43
Gambar 18. Struktur kimia Genistin, Glistin dan Daidzin ... 44
Gambar 19. Struktur kimia vitamin A... 46
Gambar 20. Antosianin dapat mencegah penuaan dini ... 48
Gambar 21. Struktur kimia BHA ... 51
Gambar 22. Struktur kimia BHT ... 53
Gambar 23. Struktur kimia TBHQ ... 55
Gambar 24. Rumus struktur DPPH ... 57
Gambar 25. Mekanisme reaksi DPPH dengan antioksidan ... 60
Gambar 26. Reaksi resonansi pada radikal DPPH ... 60
Gambar 27. Reaksi antara radikal ABTS dan antioksidan ... 67
Gambar 28. Reaksi antara antioksidan dengan reagen FRAP... 71
Gambar 29. Mekanisme penangkapan endogen peroksida seluler ... 79
Gambar 30. Kerja enzim dalam menghambat radikal bebas dalam tubuh ... 80
Gambar 31. Sisi aktif Cu−Zn−SOD ... 81
Gambar 32. Struktur kimia tipe Cu−Zn−SOD ... 81
Gambar 33. Struktur SOD berbentuk tetramer ... 82
Gambar 34. Struktur kimia tipe Fe SOD / Mn SOD domain alpha−hairpin ... 83
Gambar 35. Prinsip penentuan aktivitas SOD... 87
Gambar 36. Reaksi perubahan TMP menjadi MDA ... 91
Gambar 37. Hubungan kadar senyawa uji dengan % penangkapan radikal DPPH fraksi air ... 95
Gambar 38. Hubungan kadarsenyawa uji dengan % penangkapan radikal DPPH fraksi air terhidrolisis 1 jam ... 95
Gambar 39. Hubungan kadarsenyawa uji dengan % penangkapan radikal DPPH fraksi air terhidrolisis 3 jam ... 96
Gambar 40. Hubungan kadarsenyawa uji dengan % penangkapan radikal DPPH fraksi air terhidrolisis basa 1 jam ... 96
Gambar 41. Hubungan kadarsenyawa uji dengan % penangkapan radikal DPPH fraksi air terhidrolisis basa 3 jam ... 96 Gambar 42. Hubungan kadarsenyawa uji dengan % penangkapan radikal DPPH kuersetin ... 97 Gambar 43. Hubungan kadarsenyawa uji dengan % penangkapan radikal DPPH fraksi air terhidrolisis 1 jam ... 97 Gambar 44. Kromatogram hasil pemisahan senyawa ekstrak buah talok beserta fraksi buah talok... 101 Gambar 45. Kromatogram fraksi air dan fraksi air terhidrolisis buah talok ... 103 Gambar 46. Kromatogram fraksi air sebelum dan sesudah hidrolisis buah talok ... 104 Gambar 47. Kromatogram fraksi air sebelum dan sesudah hidrolisis buah talok ... 105 Gambar 48. Kromatogram fraksi air terhidrolisis asam buah talok ... 106 Gambar 49. Morfologi batang brotowali ... 108 Gambar 50. Kromatogram pemisahan senyawa ekstrak batang brotowali ... 111 Gambar 51. Kromatogram ekstrak etanolik batang brotowali dan fraksinya ... 114 Gambar 52. Kromatogram ekstrak etanolik batang brotowali dan fraksinya ... 116 Gambar 53. Profil kromatogram ekstrak batang brotowali setelah disemprot pereaksi DPPH ... 117 Gambar 54. Morfologi daun mengkudu ... 118 Gambar 55. Profil kromatogram ekstrak etanolik daun mengkudu dan fraksinya ... 119
Gambar 56. Profil kromatogram fraksi air terhidrolisis ekstrak
daun mengkudu dengan pembanding kuersetin ... 120
Gambar 57. Profil kromatogram ekstrak daun mengkudu dengan penyemprotan DPPH ... 121
Gambar 58. Perbandingan aktivitas penangkapan radikal oleh ekstrak daun mengkudu... 122
Gambar 59. Morfologi buah mahkota dewa ... 123
Gambar 60. Morfologi bunga kecombrang ... 125
Gambar 61. Morfologi buah talok ... 126
Gambar 62. Kromatogram fraksi etil asetat dari ekstrak etanolik bunga kecombrang ... 127
Gambar 63. Kromatogram fraksi etil asetat buah talok ... 127
DAFTAR TABEL
Tabel 1. Radikal Bebas Biologis (Endogen) ... 8 Tabel 2. Spesies Oksigen Reaktif... 16 Tabel 3. Beberapa substitusi flavonoid dengan aktivitas antioksidan ... 38 Tabel 4. Kadar Antosianin dalam beberapa bahan pangan ... 47 Tabel 5. Antioksidan yang diizinkan digunakan dalam makanan
... 49 Tabel 6. Aturan penggunaan BHA dalam sediaan farmasi dan makanan ... 51 Tabel 7. Penggunaan BHT sebagai antioksidan ... 53 Tabel 8. Penggolongan Uji Antioksidan ... 58 Tabel 9. Tingkat kerusakan antioksidan dengan metode DPPH . 61 Tabel 10. Pengaruh ekstrak air buah mahkota dewa dibandingkan dengan vitamin C terhadap fotodegradasi tirosin ... 124
DAFTAR SINGKATAN
BHA : Butil Hidroksi Anisol BHT : Butil Hidroksi Toluen CAT : Katalase
CUPRAC : Cupric Ion Reducing Antioxidant Capacity= DNA : Deoxyribonnucleotide Acid
DPPH : 1,1−diphenyl−picrylhidrazil
EDRF : Endothelial derived Relaxing Factor EDTA : Ethylene diamine tetraacetic acid FRAP : Ferric Reducing Ability of Plasma GSH : Reduced Glutathione
GSSG : Glutathione Disulfide IC50 : Inhibition Concentration 50 LDL : Low Density Lipopolisacharide MDA : Malonaldehid
NADP : Nicotinamide Adenine Dinucleotide Phosphate NBT : Nitro Blue Tetrazolium
ORAC : Oxygen Radical Absorbance PRX : Peroxiredoksin
ROS : Radikal Oksigen Singlet SNR : Senyawa Nitrogen Reaktif SOD : Superoxide Dismutase SOR : Senyawa Oksigen Reaktif TBA : Tersier Butil
TBARS : Thiobarbituric Acid Reactive Substances UV : Ultraviolet
BAB I OKSIDAN 1. 1. Pengertian Oksidan
Secara biokimia, oksidasi merupakan proses pelepasan elektron dari suatu senyawa. Senyawa yang dapat menarik atau menerima elektron disebut oksidan atau oksidator (Winarsi, 2007). Dalam ilmu kimia, pengertian oksidan adalah senyawa penerima elektron yaitu senyawa penarik elektron misalnya ion ferri (Fe2+).
Pengertian oksidan dan radikal bebas (free radicals) sering dibaurkan karena keduanya memiliki kemiripan sifat.
Aktivitas kedua jenis senyawa ini sering menghasilkan akibat sama walaupun prosesnya berbeda. Sebagai contoh perhatikan dampak H2O2 (hidrogen peroksida) dan radikal bebas OH (radikal hidroksil) terhadap glutation (GSH) : H2O2 : GSH + H2O2
GSSG + 2H2OOH :GSH + OH
H2O + GS (radikal glutation)GS + GS
GSSGWalaupun ada kemiripan dalam sifat-sifatnya namun dipandang dari sudut ilmu kimia, keduanya harus dibedakan.
Oksidan, dalam pengertian ilmu kimia, adalah senyawa penerima elektron, (electron acceptor), yaitu senyawa- senyawa yang dapat menarik elektron. Ion ferri (Fe3+), misalnya, adalah suatu oksidan :
Fe3+ + e-
Fe2+Sebaliknya, dalam pengertian ilmu kimia, radikal bebas adalah atom atau molekul (kumpulan atom) yang memiliki elektron yang tak berpasangan (unpaired electron). Sebagai contoh marilah kita perhatikan molekul air (H2O). Ikatan atom oksigen dengan hidrogen merupakan ikatan kovalen, yaitu ikatan kimia yang timbul karena sepasang elektron dimiliki bersama (share) oleh dua atom.
Atom hidrogen : H
Atom oksigen : O dan H2O
Bila terdapat sumber energi yang cukup besar, misalnya radiasi, molekul air dapat mengalami pembelahan homolitik (homolytical cleavage ) :
H:O:H
H + OH
atom H radikal hidroksi
Atom H ( H) memiliki elektron yang tak berpasangan sehingga dapat pula dianggap sebagai radikal.. Molekul air dapat pula mengalami pembelahan jenis lain, yaitu pembelahan heterolitik (heterolytical cleavage )
H:O:H
H+ + :O H
ion H ion hidroksil
Dalam hal ini, yang terbentuk bukanlah radikal tetapi ion-ion, sehingga proses tersebut dinamakan ionisasi. Untuk ionisasi
molekul air tak diperlukan masukan energi yang besar, sehingga dalam keadaan “biasa” air mengalami ionisasi.
Elektron yang tak berpasangan cenderung untuk membentuk pasangan, dan ini terjadi dengan menarik elektron dari senyawa lain sehingga terbentuk radikal baru :
X:H + OH
X + HOHradikal hidroksil radikal baru
Sifat radikal bebas yang mirip dengan oksidan terletak pada kecenderungannya untuk menarik elektron. Jadi sama halnya dengan oksidan, radikal bebas adalah penerima elektron.
Namun perlu diingat bahwa radikal bebas adalah oksidan tetapi tidak setiap oksidan adalah radikal bebas.
Radikal bebas lebih berbahaya dibanding dengan oksidan yang bukan radikal. Hal ini disebabkan oleh kedua sifat radikal bebas yaitu reaktifitas yang tinggi dan kecenderungannya membentuk radikal baru, yang pada gilirannya apabila menjumpai molekul lain akan membentuk radikal baru lagi, sehingga terjadilah rantai reaksi (chain reaction) Reaksi rantai tersebut baru berhenti apabila radikal bebas tersebut dapat diredam (quenched).
1. 2. Pengertian Radikal Bebas
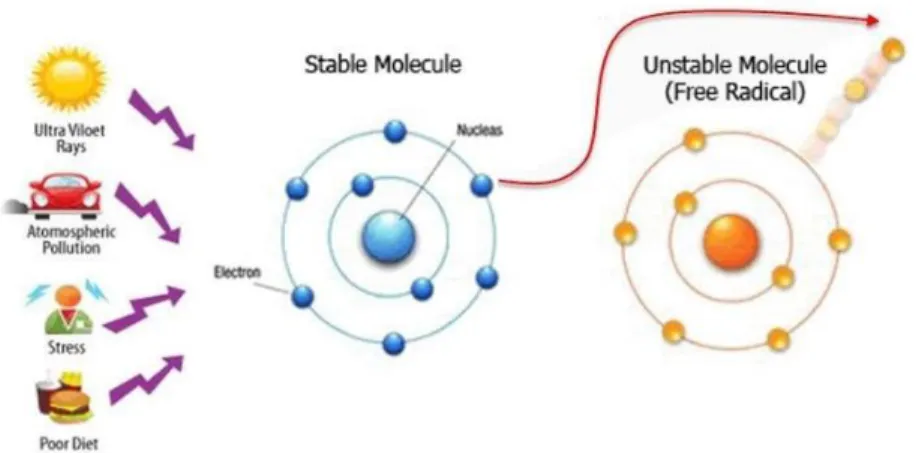
Radikal bebas adalah atom atau molekul tidak stabil dan sangat reaktif karena mengandung satu atau lebih elektron tidak berpasangan pada orbital terluarnya (Pangkahila, 2007).
Untuk mencapai kestabilan atom atau molekul, radikal bebas akan bereaksi dengan molekul di sekitarnya untuk
memperoleh pasangan elektron (Rohman, 2006). Adanya elektron tidak berpasangan ini menyebabkan radikal bebas secara kimiawi menjadi sangat aktif. Radikal bebas dapat bermuatan positif (kation), negative (anion) atau tidak bermuatan (netral). Skema pembentukan radikal bebas seperti terlihat pada Gambar 1.
Gambar 1. Pembentukan radikal bebas
Tubuh manusia mengandung molekul oksigen stabil dan tidak stabil. Molekul oksigen stabil penting untuk memelihara kehidupan sel. Dalam jumlah tertentu radikal bebas diperlukan untuk kesehatan akan tetapi radikal bebas bersifat merusak dan sangat berbahaya. Fungsi radikal bebas dalam tubuh adalah untuk melawan radang, membunuh bakteri dan mengatur tonus otot polos dalam organ maupun pembuluh darah (Giriwijoyo, 2004). Jika reaksi ini berlangsung terus menerus dalam tubuh manusia dan bila tidak berhenti akan menimbulkan penyakit seperti kanker, jantung, penuaan dini dan menurunnya sistem imun tubuh (Kikuzaki, et al., 2002).
Symbol dari radikal bebas adalah sebuah titik dimana titik tersebut menggambarkan elektron tidak berpasangan (Fessenden, 1986).
Menurut Kumar et al. (2005) radikal bebas menyebabkan kerusakan sel dengan 3 cara:
Peroksidasi komponen lipid dari membrane sitosol
Menyebabkan serangkaian reduksi asam lemak (autokatalisis) mengakibatkan kerusakan membrane dan organel sel.
Kerusakan DNA
Kerusakan DNA ini dapat mengakibatkan mutasi DNA bahkan dapat menimbulkan kerusakan sel.
Modifikasi protein teroksidasi karena cross linking protein, melalui mediator sulfidril atas beberapa asam amino labil seperti sistein, metionin, lisin dan histidin.
Ada berbagai radikal bebas turunan dari C dan N, akan tetapi yang paling banyak diketahui adalah radikal oksigen. Radikal bebas bisa terbentuk ketika komponen makanan diubah menjadi bentuk energi melalui proses metabolisme. Pada proses metabolisme ini, sering kali terjadi kebocoran elektron.
Dalam kondisi ini, mudah sekali terbentuk radikal bebas seperti anion superoksida, hidroksil dan lain-lain. Radikal bebas juga dapat terbentuk dari senyawa lain yang sebenarnya bukan radikal bebas, tetapi mudah berubah menjadi radikal bebas misalnya H2O2 (Kikuzaki, et al., 2002).
Pembentukan radikal bebas terjadi secara terus menerus di dalam tubuh. Hal ini terjadi melalui proses metabolisme sel normal, inflamasi, kekurangan nutrisi maupun sebagai respon adanya radiasi sinar gama, UV, polusi lingkungan dan asap
rokok (Wijaya, 1996). Menurut Mohammed et al. (2009), radikal bebas dapat menyebabkan kerusakan. Radikal bebas bersifat reaktif dan jika tidak diinaktifkan akan dapat merusak makromolekul pembentuk sel yaitu protein, karbohidrat, lemak dan asam nukleat.
Radikal bebas di dalam tubuh merupakan bahan yang sangat berbahaya. Bahan radikal bebas tersebut sebenarnya merupakan senyawa atau molekul dengan satu atau lebih elektron tidak berpasangan pada orbital luarnya. Elektron terus mencari pasangannya dan beberapa senyawa diikat oleh radikal bebas pada umumnya molekul besar seperti lipid, protein maupun DNA. Apabila hal tersebut terjadi maka akan mengakibatkan kerusakan sel atau pertumbuhan tidak bisa dikendalikan (Wijaya, 1996).
Radikal bebas bereaksi dengan komponen biologis akan menghasilkan senyawa teroksidasi yang dapat digunakan sebagai penanda kerusakan oksidatif (Lampe, 1999). Radikal bebas dapat dibentuk melalui jalur enzimatik atau metabolic.
Proses perubahan dari asam arakhidonat menjadi prostaglandin dan prostasiklin dipicu oleh enzim lipoksigenase dan siklooksigenase. Hasilnya adalah senyawa oksigen reaktif berupa peroksida dan epoksida serta oksidase berbentuk aldehid oksidase dan selanjutnya akan membentuk radikal anion superoksida (Wijaya, 1996).
Radikal bebas memiliki reaktivitas sangat tinggi. Hal ini ditunjukkan oleh sifatnya sangat menarik atau menyerang
elektron di sekelilingnya. Senyawa radikal bebas juga dapat mengubah suatu molekul menjadi suatu radikal. Kemiripan sifat antara radikal bebas dan oksigen terletak pada agresivitas untuk menarik elektron di sekelilingnya. Berdasarkan sifat ini, radikal bebas dianggap sama dengan oksidan. Akan tetapi, tidak setiap oksidan adalah radikal bebas. Radikal bebas lebih berbahaya dibandingkan dengan senyawa oksidan non radikal. Hal ini berkaitan dengan tingginya reaktivitas senyawa radikal bebas tersebut kemudian mendorong untuk terbentuknya radikal bebas baru. Bila senyawa radikal baru bertemu dengan molekul lain akan terbentuk baru lagi dan seterusnya proses itu berlangsung. Reaksi ini akan terus berlangsung dan akan berhenti jika reaktivitasnya diredam oleh senyawa bersifat antioksidan (Meydani, 2000).
Cara terbentuknya radikal bebas adalah secara in vivo dan in vitro dengan tahapan proses yakni pemecahan satu molekul normal secara homolitik menjadi dua dimana hal ini memerlukan tenaga tinggi dari sinar UV, panas dan radiasi ion. Kemudian dilanjutkan pada kehilangan satu elektron dari molekul normal dan penambahan elektron pada molekul normal (Gordon, 2001).
1. 3. Sumber Radikal Bebas
Sumber radikal bebas bisa berasal dari proses metabolisme dalam tubuh (endogen) dan dapat berasal dari luar tubuh (eksogen). Dari dalam tubuh mencakup superoksida (O2), hidroksil (OH), peroksil (ROO), hidrogen peroksida
(H2O2), singlet oksigen (O2), oksida nitrit (NO), dan peroksinitrit (ONOO). Secara endogen, sebagai respon normal dari rantai peristiwa biokimia dalam tubuh, radikal bebas terbentuk akan mempengaruhi ekstrasel dan intrasel.
Radikal endogen dapat terbentuk sebagai sisa proses metabolism (proses pembakaran) protein, karbohidrat dan lemak pada mitokondria, proses peradangan atau inflamasi, reaksi antara besi logam dan transisi dalam tubuh, fagosit, xantin oksidase, peroksisom maupun pada kondisi iskemia.
Mekanisme timbulnya radikal endogen yakni autooksidasi, aktivitas oksidasi siklooksigenase, lipooksigenase, dehidrogenase dan peroksidase serta pada sistem transport elektron (Muchtadi, 2013). Sedangkan radikal eksogen antara lain berasal dari: asap rokok, polusi, radiasi, sinar UV, obat, pestisida, limbah industri, dan ozon (Wolf, 2002). Adapun beberapa jenis radikal bebas endogen dapat dilihat dalam Tabel 1.
Tabel 1. Radikal Bebas Biologis (Endogen)
Kelompok Oksigen Reaktif O2* Radikal superoksida
OH* Radikal hidroksil ROO* Radikal peroksil H2O2 Hidrogen peroksida
1O2* Oksigen singlet NO* Nitrit oksida HOCl Asam hipoklor
Tipe radikal bebas turunan oksigen reaktif sangat signifikan dalam tubuh. Oksigen reaktif ini mencakup hidroksil (OH), peroksil (ROO), hidrogen peroksida (H2O2), oksigen singlet
(O2), oksida nitrit (NO) dan asam hipoklorit (HOCl).
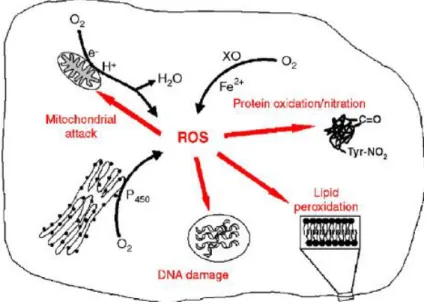
Spesies oksigen reaktif (ROS) dibagi menjadi 2 kelas yakni Oxygen centered non radicals dan Oxygen centered radicals.
Oxygen centered radicals meliputi beberapa jenis yakni anion superoksida (O2), radikal hidroksil (OH), radikal alkoksil (RO) dan radikal peroksil (ROO). Sedangkan Oxygen centered non radicals meliputi hidrogen peroksida (H2O2) dan oksigen singlet (1O2). Efek ditimbulkan oleh ROS ditunjukkan pada Gambar 2.
Gambar 2. Pengaruh ROS terhadap tubuh
ROS dalam sistem biologis berkorelasi dengan radikal bebas walaupun ROS tidak tergolong radikal bebas seperti oksigen tunggal dan hidrogen peroksida. Radikal bebas dan ROS dapat dibentuk oleh sistem enzim prooksidaif, oksidasi lipid, iradiasi, inflamasi, merokok dan polusi udara (Halliwel, 1994;
Muchtadi, 2013). Beberapa spesies ROS dapat terlihat pada Gambar 3.
Gambar 3. Beberapa spesies ROS
Adapun beberapa penjelasan mengenai radikal tersebut yakni:
1.3.1. Anion Superoksida
Anion ini terbentuk melalui beberapa cara di antaranya:
Hasil reaksi samping senyawa yang melibatkan Fe2+ seperti proses fosforilasi, oksigenasi Hemoglobin, hidroksilasi oleh enzim mono oksigenase dan pembebasan ion Fe.
Fe2+ + O2 → Fe3+ + O2−
Reaksi dikatalisis oleh NADH/ NADPH oksidase di dalam mitokondria dan granulosit.
NADH (NADPH) + O2 → NAD+ (NADP+) + H+ + O*2−
Reaksi dikatalisis oleh enzim xantin oksidase XH + 2O2 + H2O → X−OH + 2 O*2− + H+
Enzim xantin oksidase dalam keadaan normal tak terdapat di dalam sel mamalia. Enzim xantin oksidase terbentuk dari enzim lain yaitu xantin dehidrogenase.
XH + NAD+ + H2O → X−OH + NADH + H+ (xantin) (asam urat)
Dalam keadaan iskemia atau hipoksemia, XD berubah menjadi XO melalui proses proteolisis : XD XO + peptide
Perubahan ini tak reversibel. Sebagai akibatnya, apabila kemudian pasokan oksigen kembali normal, terbentuklah ion superoksida yang justru dapat merusak jaringan (reperfusion injury)
Ion superoksida sendiri sebenarnya tak terlalu reaktif.
Bentuk reaktifnya ialah radikal peroksida yang terbentuk melalui reaksi sebagai berikut :
O2 + H OOH Radikal peroksil
Seperti halnya radikal lain, radikal inipun sangat reaktif dan akan membentuk radikal baru serta H2O2: XH + OOH X + H2O2
Dari reaksi diatas kiranya jelas bahwa radikal peroksil jauh lebih berbahaya dibandingkan dengan H2O2 . Ion superoksida akan sangat berbahaya apabila terdapat bersamaan dengan H2O2 karena akan membentuk radikal hidroksil (OH) :
O2 + H2O2 O2 + OH + OH
(Reaksi Haber – Weiss)
Reaksi ini memerlukan ion Fe+++ atau Cu++ dan diperkirakan terjadi melalui dua tahap, yaitu :
Fe+++ / Cu++ + O2 Fe++ / Cu+ + O2
Fe++ / Cu+ + H2O2 Fe+++ / Cu++ + OH + OH Diantara senyawa-senyawa oksigen reaktif, radikal hidroksil adalah yang paling reaktif, oleh karena itu paling berbahaya. Namun radikal hidroksil bukan merupakan produk primer proses biologik, tetapi berasal dari H2O2 dan O2.
Oksigen teraktivasi dapat menyebabkan terbentuknya radikal bebas oksigen. Senyawa radikal ini akan membentuk kompleks dengan senyawa organik secara in vitro. Penyebab terbentuknya kompleks senyawa adalah sifat permukaan membrane, muatan listrik, sifat pengikatan makromolekul dan bagian enzim, substrat serta katalisator (Belleville and Nabet, 1996). Radikal anion superoksida bersumber dari beberapa tempat dimana terjadi proses transport elekron (Lestariana, 2003).
1.3.2. Radikal Hidroksil
Senyawa H2O2 dapat berbahaya apabila bereaksi dengan ion superoksida karena dapat menghasilkan radikal hidroksil (OH) melalui reaksi Haber –Weiss berikut:
O2 + H2O2 O2 + OH + OH
Reaksi ini memerlukan ion Fe+++ atau Cu++ dan diperkirakan terjadi melalui dua tahap, yaitu :
Fe3+ /Cu2+ + O2 Fe2+ / Cu+ + O2
Fe2+ /Cu+ + H2O2 Fe3+ / Cu2++ OH+ OH Dari berbagai bentuk senyawa oksigen reaktif tersebut, radikal hidroksil adalah senyawa paling reaktif dan berbahaya. Radikal hidroksil bukan merupakan produk primer proses biologis melainkan berasal dari H2O2 dan O2− (Raharjo, 2006).
1.3.3. Hidrogen Peroksida
Hidrogen peroksida adalah salah satu senyawa oksigen reaktif berbentuk non radikal. Senyawa ini terbentuk apabila terjadi reaksi oksidasi terkatalisis oleh oksidase di dalam reticulum endoplasmik khususnya di peroksisom. Hidrogen peroksida merupakan oksidan sangat kuat dan dapat mengoksidasi banyak senyawa terdapat dalam glutation.
Selain bersifat oksidator, hidrogen peroksida juga dapat membentuk radikal bebas apabila bereaksi dengan logam transisi seperti Fe2+ dan Cu dalam reaksi Fenton.
Fe2+ + H2O2 → Fe3+ + OH− + OH
Menurut Liochev dan Fridovich (1999) dalam Muchtadi (2012), dismutasi anion superoksida akan
menghasilkan hidrogen peroksida kemudian dapat direduksi menjadi air atau menjadi radikal hidroksil.
1.3.4. Oksigen Singlet
Oksigen singlet terbentuk melalui penyinaran sinar matahari (UV) dan radiasi ionisasi. Oksigen singlet adalah bentuk oksigen memiliki reaktivitas lebih tinggi jika dibandingkan dengan oksigen bentuk ground state. Oksigen di atmosfer merupakan sumber oksigen dalam bentuk reaksi oksidasi. Keadaan dasar oksigen di atmosfer berbentuk triplet (3O2). Akan tetapi oksigen triplet bisa tereksitasi membentuk oksigen singlet (1O2) dan dalam keadaan gas, oksigen singlet ini cukup stabil. Menurut Grossweiner (2000), oksigen singlet dalam keadaan gas mempunyai waktu hidup 45 menit. Oksigen singlet lebih reaktif dibandingkan oksigen triplet karena berada dalam keadaan tereksitasi. Oksigen singlet dapat mempercepat reaksi oksidasi dalam makanan walaupun pada suhu rendah (Min and Boff, 2002;
Herawati dan Syafsir, 2006).
Oksigen singlet dapat terbentuk oleh reaksi fotokimia terhadap oksigen triplet dengan adanya fotosensitisizer. Senyawa alam bersifat fotosensitisizer di antaranya klorofil, porpirin, riboflavin dan mioglobin. Senyawa−senyawa tersebut dapat menyerap energi dari cahaya dan
memindahkannya ke oksigen triplet untuk membentuk oksigen singlet (Liedias and Hansberg, 2000).
Oksigen singlet terbentuk pada reaksi terkatalisis enzim tertentu, di antaranya:
Enzim monooksigenase menggunakan sitokrom p450, apabila enzim tersebut menggunakan peroksida sebagai substrat.
2 ROOH → 2 ROH + O2
Enzim prostaglandin endoperoksida sintetase, enzim berperan dalam pembentukan prostaglandin dari asam arakhidonat.
2 PPG2 → 2 PGH2 + O2
Enzim mieloperoksidase apabila ion hipoklorit bereaksi dengan H2O2.
2H2O2 → 2 H2O2 + O2
Radikal bebas seperti superoksida, nitrit oksida diproduksi in vivo secara kontinyu (Halliwel dan Gutteridge, 1989).
Sedangkan superoksida diproduksi akibat terjadinya kebocoran dari rantai elektron antara mitokondria dan sistem mikrosom p450 (Fridovich, 1983). Beberapa tipe oksigen reaktif terlihat dalam Tabel 2.
Tabel 2. Spesies Oksigen Reaktif
No Radikal
1 O2superoksida HOCl hipoklorit
2 HOhidroksil Fe=O Kompleks
besi oksigen 3 HO2 hidrokperoksil LOOH lipid
hidroperoksida 4 NO2 nitrogen dioksida LO2lipid peroksil 5 NOnitrit oksida LO lipid alkoksil 6 H2O2 hidrogen peroksida
7 1O2singlet oksigen Sumber: Gordon, et al., 2001
1.3.5. Radikal endogen
Radikal bebas pada organism aerobic berasal dari 1−5% terjadi kebocoran elektron. Elektron akan bereaksi dengan oksigen membentuk radikal superoksida, reduksi O2 menjadi superoksida pada fagositosis, pada peristiwa iskemia, reaksi Fenton dan Haber−Weiss dan metabolisme eicosanoid. Sumber radikal bebas endogen berasal dari proses metabolik normal pada tubuh manusia. Proses metabolik dapat menghasilkan 90% oksigen di antaranya melalui :
Proses oksidasi makanan dalam menghasilkan energy di mitokondria disebut electron transport chain akan memproduksi radikal bebas anion superoksida.
Sel darah putih seperti neutrofil secara khusus memproduksi radikal bebas untuk pertahanan tubuh melawan pathogen.
Sejumlah obat memiliki efek oksidasi pada sel dan menyebabkan produksi radikal bebas.
Proses oksidasi xantin yakni senyawa berada pada sebagian besar jaringan tubuh dan cairan yang bertindak sebagai enzim katalisator perubahan hipoksantin menjadi xantin hingga menjadi asam urat kemudian menghasilkan hidrogen peroksida.
Reaksi melibatkan besi dan logam lain.
Olahraga dengan latihan lebih lama dan intensif maka akan mengkonsumsi oksigen lebih banyak.
(Halliwel, 2004) 1.3.6. Radikal eksogen
Secara eksogen, radikal bebas didapat dari polusi berasal dari luar, bereaksi di dalam tubuh melalui inhalasi, digesti, injeksi dan melalui penyerapan kulit.
Radikal bebas eksogen berasal dari pencemaran lingkungan, asap kendaraan, bahan tambahan makanan dan rokok (Halliwel, 2004). Bagi perokok, menghisap radikal bebas sendiri dari rokoknya sehingga memiliki resiko tinggi mengidap kanker dan berbagai macam penyakit. Beberapa sumber radikal bebas eksogen dapat terlihat pada Gambar 4.
Gambar 4. Sumber radikal eksogen
1. 4. Tahapan Reaksi Pembentukan Radikal Bebas
Reaksi pembentukan radikal bebas yakni melalui 3 tahapan yakni inisiasi, propagasi dan terminasi dengan mekanisme sebagai berikut (Gordon, et al., 1990; Cuppett, 1997):
1.4.1. Tahap inisiasi
Tahap awal pembentukan radikal bebas ini, produksi radikal bebas melalui beberapa proses. Suhu tinggi, proses ekstrusi dan tekanan pada pemotongan polimer menimbulkan radikal alkil. Setelah oksidasi dimulai, konsentrasi hidroperoksida meningkat. kemudian dekomposisi hidroperoksida menjadi sumber utama inisiator radikal. Penyerapan sinar UV menghasilkan radikal yang disebabkan oleh hidroperoksida dan senyawa karbonil. Degradasi polimer disebabkan oleh penyerapan cahaya UV dari autooksidasi radikal.
Substrat oksidatif dapat bereaksi secara langsung
dengan oksigen khususnya pada temperatur tinggi sehingga menghasilkan radikal.
RH → radikal bebas R, ROO, RO, HO ROOH → RO + OH
2ROOH → RO + ROO + H2O ROOR → 2RO
1.4.2. Tahap propagasi
Tahap ini merupakan awal pemanjangan rantai radikal atau pemanjangan reaksi dimana radikal bebas akan diubah menjadi radikal bebas lain. Pada tahap propagasi, dapat terjadi oksigenasi lemak (R) membentuk radikal peroksida (ROO). Proses oksigenasi terjadi sangat cepat dengan aktivitas energi hampir mendekati nol (0). Keadaan tersebut mengakibatkan konsentrasi ROO terbentuk lebih besar.
Reaksi propagasi dapat terjadi beberapa kali sebelum terjadi pemutusan oleh radikal peroksi ke non radikal.
Dekomposisi homolitik hidroperoksida dihasilkan oleh reaksi propagasi sehingga meningkatkan tingkat inisiasi oleh produksi radikal. Laju reaksi dari molekul oksigen dengan radikal alkil membentuk peroksi radikal jauh lebih tinggi dibandingkan laju reaksi radikal peroksi dengan atom hidrogen dari substrat.
R + 3O2 → ROO
ROO + RH → ROOH + R
1.4.3. Tahap terminasi
Senyawa radikal akan bereaksi dengan radikal lain sehingga potensi propagasinya rendah. Konversi radikal peroksi dan alkil ke non radikal mengakhiri reaksi propagasi, sehingga mengurangi perpanjangan rantai kinetik. Reaksi terminasi signifikan terjadi ketika konsentrasi oksigen sangat rendah. Kombinasi radikal alkil menyebabkan cross linking mengakibatkan peningkatan viskositas dan berat molekul.
R + R’ → RR
R + ROO → ROOR
ROO + ROO → ROOR + O2
Pada tahap terminasi, akan terbentuk spesies non radikal karena radikal bebas bereaksi satu sama lain.
Sedangkan hidroperoksida akan terdekomposisi menjadi produk alkohol, asam keton dan substrat lain yang lebih stabil.
1. 5. Efek Radikal Bebas
1.5.1. Efek Negatif Radikal Bebas
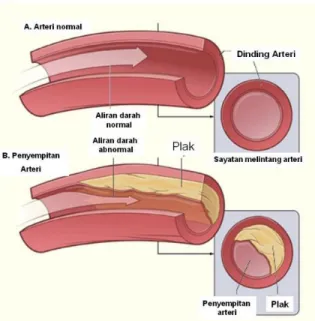
Radikal bebas bersifat destruktif, sangat reaktif dan mampu bereaksi dengan makromolekul sel seperti protein, lipid, atau DNA. Salah satu kerugian akibat radikal bebas yakni timbulnya arterosklerosis, dapat dilihat pada Gambar 5.
Gambar 5. Atherosklerosis (National Heart and Lung Institute, 2015)
Menurut Langseth (1995), reaksi antara radikal bebas dan molekul normal akan menimbulkan penyakit di antaranya:
1.5.1.1.Kerusakan DNA pada inti sel
Radikal bebas dapat menimbulkan berbagai perubahan pada DNA yang antara lain berupa hidroksilasi basa timin dan sitosin, pembukaan inti purin dan pirimidin serta terputusnya rantai fosfodiester DNA.
Bila kerusakan tak terlalu parah, maka masih bisa diperbaiki oleh sistem perbaikan DNA (DNA repair system ). Namun apabila kerusakan terlalu parah, misalnya rantai DNA terputus-putus diberbagai tempat, maka kerusakan tersebut tak dapat diperbaiki dan replikasi sel akan terganggu. Susahnya, perbaikan
DNA ini sering justru menimbulkan mutasi, karena dalam memperbaiki DNA tersebut sistem perbaikan DNA cenderung membuat kesalahan (error prone ), dan apabila mutasi ini mengenai gen-gen tertentu yang disebut onkogen, maka mutasi tersebut dapat menimbulkan kanker (Reynertson, 2007). Sel mengandung DNA rusak tersebut bila membelah sebelum diperbaiki, akan mengakibatkan perubahan genetic secara permanen. Hal tersebut merupakan langkah awal dalam proses karsinogenesis. Oksidasi DNA oleh senyawa radikal bebas dapat menginisiasi terjadinya kanker (Langseth, 1995). Kerusakan DNA akibat radikal bebas dapat dilihat pada Gambar 6.
Gambar 6. Kerusakan DNA akibat radikal bebas
1.5.1.2.Kerusakan protein
Oksidan dapat merusak protein karena dapat mengadakan reaksi dengan asam-asam amino yang menyusun protein tersebut. Diantara asam-asam amino penyusun protein yang paling rawan adalah sistein. Sistein mengandung gugusan sulfidril (SH)
dan justru gugusan inilah yang paling peka terhadap serangan radikal bebas seperti radikal hidroksil :
RSH + OH RS + H2O RS + RS RSSR Pembentukan ikatan disulfida (-S-S-) menimbulkan ikatan intra atau antar molekul protein tersebut kehilangan fungsi biologisnya (misalnya enzim kehilangan aktivitasnya).
1.5.1.3.Kerusakan lipid peroksida
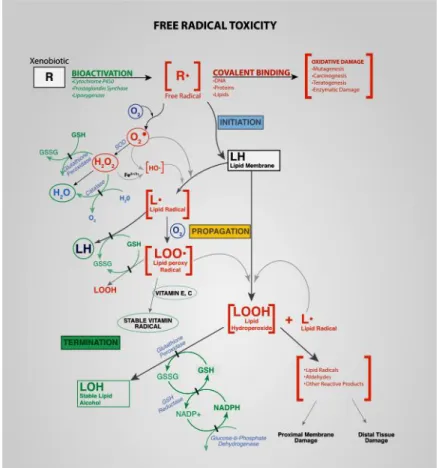
Radikal bebas dapat menyebabkan kerusakan oksidatif pada ikatan lemak tak jenuh dalam membran fosfolipid (Soleas, et al., 2002). Peroksidasi lipid pada mebran merusak struktur membran dan menyebabkan hilangnya fungsi dari organel sel.
Mekanisme peroksidasi lipid dapat terlihat pada Gambar 7.
Gambar 7. Mekanisme kerusakan lipid peroksidasi
Komponen terpenting membran sel adalah fosfolipid, glikolipid dan kolesterol. Dua komponen pertama mengandung asam lemak tak jenuh. Justru asam lemak tak jenuh ini (asam-asam linoleat, linolenat dan arakidonat) sangat rawan terhadap serangan- serangan radikal, terutama radikal hidroksil. Radikal hidroksil dapat menimbulkan reaksi rantai yang dikenal dengan nama peroksidasi lipid
LH + OH L + H2O
Asam lemak Radikal lipid
L + O2 LOO
Radikal peroksilipid
LOO + RH L + LOOH dan seterusnya.
Akibat akhir dari rantai reaksi ini adalah terputusnya rantai asam lemak menjadi berbagai senyawa yang bersifat toksik terhadap sel, antara lain berbagai macam aldehida, seperti malondialdehida, 9-hidroksi- nonenal serta bermacam-macam hidrokarbon seperti etana (C2H6) dan pentana (C5H12). Tahapan kerusakan lipid peroksidasi hingga membentuk senyawa toksik ditunjukkan pada Gambar 8.
Gambar 8. Tahapan terjadinya kerusakan lipid peroksidasi
Dapat pula terjadi ikatan silang (cross-linking) antara dua rantai asam lemak atau antara asam lemak dan rantai peptida (protein) yang timbul karena reaksi dua radikal :
R1 + R2 R1R2 Semuanya itu menyebabkan kerusakan kerusakan parah membran sel sehingga membahayakan kehidupan sel.
1.5.2. Efek Positif Radikal Bebas
Oksidan menimbulkan banyak kerugian, tetapi justru dampak negatif ini dimanfaatkan oleh tubuh untuk melawan serbuan organisma patogen. Untuk menghadapi “serangan dari luar ini”, Sang Pencipta telah menyediakan sel-sel khusus yang disebut sel-sel radang (inflamatory cells ) seperti granulosit, monosit dan makrofag, yang dapat menghasilkan oksidan seperti H2O2, O2, OH, ClO dan O2.
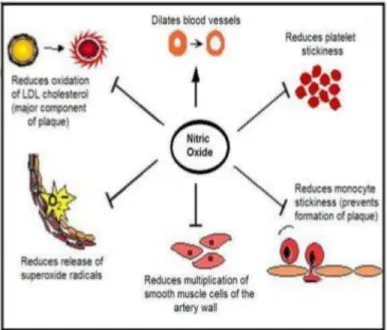
Ketidakseimbangan antara jumlah radikal bebas dan antioksidan akan menyebabkan stress oksidatif atau kerusakan oksidatif. Peranan radikal bebas secara fisiologis sebagai regulator dalam metabolism senyawa nitrogen reaktif (SNR) adalah radikal NO. Radikal tersebut akan mengubah endothelial derived relaxing factor (EDRF) menjadi modulator neuronal.
Sedangkan H2O2 berperan dalam agregasi platelet dan anion superoksida berperan dalam kemotaksis bakteri (Winarsi, 2007). Efek radikal nitrit oksida dapat dilihat pada Gambar 9.
Gambar 9. Efek radikal nitrit oksida untuk tubuh
Beberapa efek positif radikal bebas di antaranya:
Senyawa oksigen reaktif berperan dalam proses bakterisidal dan bakteriolisis normal. SOR disintesis sel fagosit melalui jalur NADP oksidase seperti radikal anion superoksida dan H2O2 sebagai bakterisidal. Efek ini dapat dilihat pada Gambar 10.
Radikal anion superoksida mempunyai sifat vasokontriktor pada otot halus atau dalam fibroblast.
Senyawa oksigen reaktif berperan dalam kapasitas spermatozoid sehingga keberadaannya berfunugsi dalam fertilisasi.
Senyawa oksigen reaktif secara in vitro bersifat mitogenik pada berbagai sel.
Berperan dalam sintesis DNA karena aktivitas ribonukleotida reduktase sangat tergantung SOR.
Berperan dalam aktivitas spermatozoa.
Gambar 10. Efek radikal bebas jenis ROS dalam menghambat bakteri
BAB II
ANTIOKSIDAN DAN JENISNYA
2.1.Pengertian Antioksidan
Indonesia sebagai negara berkembang mempunyai keterbatasan dalam penanggulangan masalah kesehatan, dimana penyakit infeksi masih tinggi, tetapi prevalensi penyakit degeneratif makin meningkat. berdasarkan riset kesehatan dasar oleh Badan Litbangkes tahun 2007, penyebab kematian utama adalah stroke (15,4%) diikuti tuberkulosis, hipertensi dan cidera serta diabetes mellitus dan tumor. Penyakit degenerative seperti kanker, diabetes mellitus dan komplikasinya, stroke dan aterosklerosis disebabkan karena stress oksidatif. Antioksidan sangat diperukan oleh tubuh untuk mengatasi dan mencegah stress oksidatif.
Senyawa fitokimia adalah zat alami terdapat dalam tanaman yang dapat memberikan citarasa, aroma dan warna khas pada tanaman tersebut. Salah satu khasiat fitokimia dapat digunakan sebagai antioksidan. Adapun khasiat lainnya yakni dapat meningkatkan sistem kekebalan, mengatur tekanan darah, menurunkan kadar kolesterol dan mengatur kadar gula darah.
Senyawa antioksidan menurut pengertian kimiawi adalah senyawa donor elektron. Namun dalam arti biologis, pengertian antioksidan lebih luas yaitu senyawa yang dapat meredam dampak negatif oksidan, termasuk
enzim-enzim dan protein-protein pengikat logam.
Antioksidan bekerja dengan mendonorkan satu elektronnya kepada senyawa oksidan sehingga ada aktivitas penghambatan oksidan tersebut (Winarti, 2010).
Tubuh memerlukan antioksidan untuk melindungi dari serangan radikal bebas. Antioksidan adalah suatu senyawa pada konsentrasi rendah secara signifikan dapat menghambat atau mencegah oksidasi substrat dalam reaksi rantai (Halliwell dan Whitemann, 2004; Leong dan Shui, 2002). Antioksidan dapat melindungi sel-sel dari kerusakan karena molekul tidak stabil atau radikal bebas.
Antioksidan dapat mendonorkan elektronnya kepada molekul radikal bebas, sehingga dapat menstabilkan radikal bebas dan menghentikan reaksi berantai (Sies, 1997). Antioksidan dapat mencegah terbentuknya radikal bebas dalam tubuh, seperti terlihat pada Gambar 11.
Gambar 11. Antioksidan melindungi tubuh dari radikal bebas
Salah satu bentuk senyawa oksigen reaktif atau oksidan adalah radikal bebas, senyawa ini terbentuk di dalam tubuh dan dipicu oleh bermacam-macam faktor
(Winarsi, 2007). Menurut Sadikin (2001) bahwa serangan radikal bebas terhadap molekul sekelilingnya akan menyebabkan terjadinya reaksi berantai, kemudian dapat menghasilkan senyawa radikal baru. Dampak reaktivitas senyawa radikal bebas mulai dari kerusakan sel atau jaringan, penyakit autoimun, penyakit degeneratif, hingga kanker. Oleh karena itu tubuh memerlukan substansi penting, yakni antioksidan dimana antioksidan dapat membantu melindungi tubuh dari serangan radikal bebas dengan meredam dampak negatif senyawa radikal bebas tersebut (Karyadi, 1997).
2.2. Jenis Antioksidan
Antioksidan dapat dikelompokkan menjadi dua bagian, yaitu antioksidan alami dan antioksidan sintetik.
2.2.1. Antioksidan alami
Secara alami beberapa jenis tumbuhan merupakan sumber antioksidan, hal ini dapat ditemukan pada beberapa jenis sayuran, buah-buahan segar, beberapa jenis tumbuhan dan rempah-rempah (Kuncahyo, 2007). Beberapa sumber antioksidan alami ditunjukkan oleh Gambar 12.
Gambar 12. Sumber antioksidan alami (www.mindpowerglobal.au)
Antioksidan alami dapat diisolasi dari bahan alam.
Antioksidan ini memiliki bobot molekul sekitar 200−400. Semua antioksidan alami mudah diserap oleh usus dan didistribusikan ke seluruh tubuh (Niwa, 1997). Fungsi dari antioksidan alami antara lain adalah sebagai reduktor, peredam pembentukan oksigen singlet, penangkap radikal bebas dan pengkhelat logam (Sidik, 1997). Antioksidan alami digolongkan menjadi enzim dan vitamin.
Antioksidan berupa enzim yang dihasilkan oleh tubuh berupa superoxide dismutase (SOD), glutation peroxidase, dan katalase. Sedangkan antioksidan vitamin umumnya beta karoten (vitamin A), alfatokoferol (vitamin E) dan asam askorbat (vitamin C) (Zeng dan Wang, 2001). Antioksidan dari
tumbuhan adalah senyawa polifenol atau fenolik, golongan flavonoid, turunan asam sinamat, kumarin, tokoferol dan asam organik (Madhavi, et al., 1996).
2.1.1.1.−Tokoferol
−Tokoferol tersimpan terutama dalam jaringan adiposa, hati dan otot. Senyawa ini berfungsi sebagai antioksidan utama dan bersifat larut lemak atau membran (Evans, 1991). −Tokoferol mencegah proses peroksidasi lipid dimana perannya sebagai pereduksi memecah reaksi rantai oksidatif atau menangkap radikal peroksil sebelum dapat merusak sel. Tokoferol memiliki aktivitas paling tinggi terhadap radikal peroksil. Gugus fenol pada hidroksil cincin C6 adalah gugus berperan dalam aktivitas antioksidan dan sistem cincin kromanol untuk enstabilkan elektron tidak berpasangan (Bagchi, 1998). Struktur kimia −tokoferol dapat dilihat pada Gambar 13.
Gambar 13. Struktur kimia −tokoferol
Efek antioksidan in vivo melibatkan oksidasi tokoferol menjadi tokoferilquinon melalui senyawa
antara radikal tokoferoksil. Asam askorbat telah terbukti secara in vitro mereduksi tokoferoksi menjadi tokoferol kembali dan teroksidasi menjadi asam dehidroaskorbat selama proses. −Tokoferol banyak ditemukan dalam minyak tumbuhan seperti minyak bunga matahari, minyak zaitun, kacang kacangan, biji gandum dan sayuran berwarna hijau (Combs, 1992).
−Tokoferol bekerja sebagai antioksidan karena mudah teroksidasi. Dengan demikian dapat melindungi senyawa lain dari oksidasi. −Tokoferol dapat menghentikan reaksi berantai dari radikal bebas. Pada sel membrane, −Tokoferol akan mencegah oksidasi lemak khususnya Poly Unsaturated Fatty Acid dan vitamin A. −Tokoferol pada mitokondria sel akan melindungi bagian metabolic yang akan mentransformasi bahan bakar energy ke dalam ATP. Di dalam jaringan lemak tubuh, antioksidan dari −Tokoferol menyerang lipid peroksida (hasil reaksi antara lipid dan radikal bebas). Lipid peroksida dianggap berbahaya karena diduga dapat menyebabkan penyakit degenerative (Lamid, 1995).
2.1.1.2.Asam askorbat
Asam askorbat berperan dalam sintesis kolagen, membantu menjaga kesehatan pembuluh kapiler, gigi dan gusi, meningkatkan penyerapan zat besi dalam tubuh. Asam askorbat juga dapat
meningkatkan HDL, menurunkan kolesterol dalam darah dan mengurangi peningkatan karsinogen pada DNA serta memperlambat pembentukan sel tumor pada model hewan (Evans, 1991).
Asam askorbat merupakan antioksidan larut air yang utama dalam plasma darah dan sitosol. Aasam askorbat menangkap oksigen singlet dan bereaksi secara cepat dengan radikal hidroksil dan hidrogen peroksida. Aktivitas asam askorbat berada pada gugus 2,3−enediol yang daoat teroksidasi maupun tereduksi.
Asam askorbat terdapat dalam 2 bentuk di alam yaitu L-askorbat dan L-dehidro askorbat (bentuk teroksidasi). Struktur kimia asam askorbat seperti dapat dilihat pada Gambar 14.
Gambar 14. Struktur kimia asam askorbat
Asam askorbat dioksidasi secara in vivo membentuk radikal askorbil (reversible) dan dapat dioksidasi lebih lanjut menjadi asam dehidroaskorbat.
Asam dehidroaskorbat dengan cepat dan ireversibel diuraikan melalui pembentukan hidrolitik cincin lakton. Asam dehidroaskorbat bersifat relatif tidak
stabil dan mengalami hidrolisis menjadi asam 2,3−diketogulonat. Reaksi ini terjadi dengan adanya oksigen, ion logam serta meningkat dengan panas, kondisi netral, hingga basa. Asam askorbat dapat diperoleh kembali dari asam dehidroaskorbat dengan adanya enzim dehidroaskorbat reduktase (Combs, 1992).
2.1.1.3.Polifenol
Kandungan polifenol dapat dijadikan karakteristik antioksidan terkandung dalam bahan makanan. Polifenol merupakan salah satu kelompok antioksidan paling banyak terdapat dalam tanaman pangan, dengan lebih dari 8000 struktur fenolik (Harborne, 1993). Menurut Aulia (2009) senyawa polifenol bersifat multifungsional dimana beberapa kegunaannya di antaranya dapat sebagai pereduksi atau donor elektron, penangkap radikal bebas, pengkhelat logam dan peredam terbentuknya oksigen singlet. Turunan polifenol sebagai antioksidan dapat menstabilkan radikal bebas dengan melengkapi kekurangan elektron radikal bebas dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas (Hattenschwiller dan Vitousek, 2000).
Senyawa polifenol merupakan salah satu kelas antioksidan berada dalam tumbuhan. Kandungannya sering diketahui sebagai terminator radikal bebas dan pada umumnya kandungan senyawa ini berkorelasi
positif terhadap aktivitas antiradikal (Marinova and Batcharov, 2001).
2.1.1.4.Flavonoid
Flavonoid merupakan kelompok antioksidan penting untuk tubuh manusia. Flavonoid dibagi menjadi 13 kelas dengan lebih dari 4000 senyawa ditemukan hingga tahun 1990. Flavonoid merupakan senyawaan fenol pada sebagian besar tumbuhan hijau.
Beberapa fungsi flavonoid yang terkandung pada tumbuhan ialah pengaturan tumbuh, pengaturan fotosintesis, kerja antimikroba dan antivirus. Efek flavonoid terhadap berbagai macam organisme sangat banyak macamnya dan dapat menjelaskan mengapa tumbuhan yang mengandung flavonoid dipakai dalam pengobatan tradisional. Flavonoid dapat bekerja sebagai inhibitor kuat pernapasan, juga sebagai senyawa pereduksi yang baik, menghambat banyak reaksi oksidasi, baik secara enzim maupun non−enzim. Flavonoid bertindak sebagai penampung yang baik radikal hidroksi dan superoksida dan melindungi membran lipid terhadap reaksi yang merusak ( Robinson, 1995).
Flavonoid diketahui berfungsi sebagai antimutagenik dan antikarsinogenik. Selain itu memiliki sifat sebagai antioksidan, anti inflamasi, anti alergi dan menghambat oksidasi LDL (Harborne, 1993).
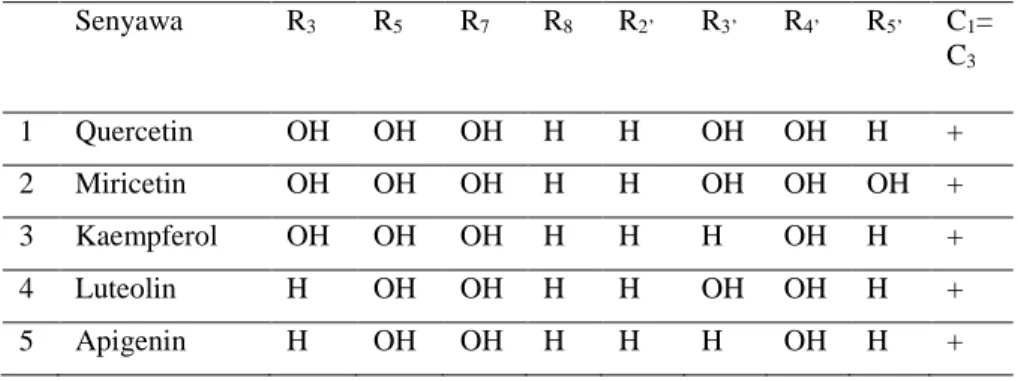
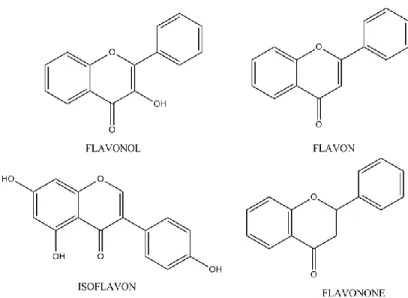
Senyawa flavonoid yang paling banyak terdapat di alam adalah flavonol, flavon, flavon−3−ol, isoflavon, flavanon, antosianidin dan proantosianidin (Bravo, 1998). Beragam kombinasi dari gugus hidroksil, gula, oksigen dan metil pada strukturnya menjadi dasar pembagian golongan flavonoid menjadi flavonol, flavanon, flavon, flavon−3−ol (katekin), antosianidin, bioflavonoid dan isoflavon (Markham, 1998). Tabel 3 menunjukkan bentuk substitusi flavonoid dengan aktivitas antioksidan.
Kemudian, struktur kimia dari substitusi dapat ditunjukkan pada Gambar 15.
Tabel 3. Beberapa substitusi flavonoid dengan aktivitas antioksidan Senyawa R3 R5 R7 R8 R2’ R3’ R4’ R5’ C1=
C3
1 Quercetin OH OH OH H H OH OH H + 2 Miricetin OH OH OH H H OH OH OH + 3 Kaempferol OH OH OH H H H OH H +
4 Luteolin H OH OH H H OH OH H +
5 Apigenin H OH OH H H H OH H +
Gambar 15. Struktur substitusi flavonoid dengan aktivitas antioksidan
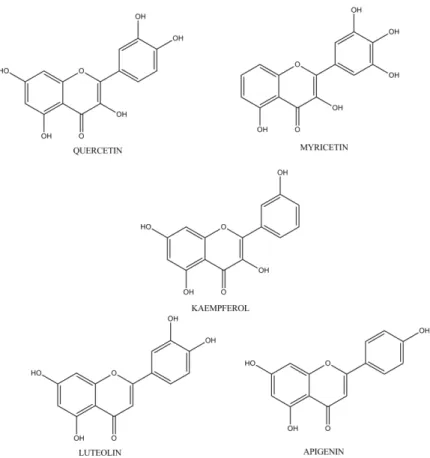
Flavonoid biasanya terdapat sebagai flavonoid O glikosida, pada senyawa tersebut satu gugus hidroksil flavonoid terikat pada satu atau lebih gula dengan ikatan hemiasetal tidak tahan asam. Pengaruh glikosilasi menyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam air, sehingga sifat ini memungkinkan flavonoid disimpan dalam vakuola sel (Markham, 1998). Beberapa struktur flavonoid ditunjukkan pada Gambar 16.
Gambar 16. Struktur kimia beberapa jenis flavonoid (Apak, et al., 2007)
Flavonoid terdapat pada seluruh bagian tanaman, termasuk pada buah, tepung sari, dan akar.
Flavonoid biasanya terdapat sebagai O-glikosida;
pada senyawa tersebut satu gugus hidroksil flavonoid atau lebih terikat pada satu gula atau lebih dengan ikatan hemiasetal. Gula dapat juga terikat pada atom karbon flavonoid dan dalam hal ini gula tersebut terikat langsung pada inti benzene dengan suatu ikatan karbon-karbon yang tahan asam atau disebut C-glikosida (Markham, 1988).
Kegunaan bagi tumbuhan yaitu untuk menarik serangga, yang membantu proses penyerbukan, untuk menarik perhatian binatang yang membantu penyebaran biji. Bagi manusia dosis kecil, flavon bekerja sebagai stimulant pada jantung, hisperidin mempengaruhi pemburuh darah kapiler, flavon
terhidroksilasi bekerja sebagai diuretik dan sebagai antioksidan pada lemak ( Sirait, 2007).
Flavonoid mempunyai sejumlah fungsi penting bagi tumbuhan, diantaranya sebagai pigmen warna, pelindung tanaman dari sinar UV-B, dan antimikroba.
Delfinidin, salah satu jenis flavonoid, memberikan warna biru pada kelopak bunga. Salah satu resistensi tanaman dari sinar UV-B di antaranya terletak pada peranan flavonoid yang diketahui secara umum terdapat pada daun-daun berwarna hijau. Flavonoid dapat berperan sebagai penapis sinar UV-B karena flavonoid dapat menyerap sinar pada panjang gelombang 280-315 nm. Sebagai antimikroba, flavonoid mempunyai kemampuan untuk menghambat pengecambahan spora patogen pada tanaman (Harborne& Williams, 2000).
Selain memegang peran penting pada tumbuhan, flavonoid juga memiliki beberapa fungsi medis pada manusia, yaitu aktivitas antioksidan, antiinflamasi, mengurangi resiko penyakit jantung koroner, sejumlah aktivitas pada vaskular, oestrogenik, sitotoksik antitumor, antispasmolitik, hepatoprotektif, antijamur, antiansietas, dan pencegahan terhadap malaria (Harborne& Williams, 2000).
Sebagai antioksidan, flavonoid dapat menangkap sejumlah ion oksidatif, di antaranya
anion superperoksida, radikal hidroksil atau radikal peroksi. Flavonoid juga dapat memadamkan oksigen singlet. Berdasarkan penelitian, ada beberapa mekanisme dalam aktivitas antioksidan oleh flavonoid ini. Menurut Tournaire dkk. (1993), keberadaan katekol pada cincin B berperan utama dalam mengontrol pemadaman 1O2 dan keberadaan gugus hidroksil pada posisi 3 sebagian besar menentukan efisiensi reaktivitas kimia flavonoid dengan 1O2. Sedangkan berdasarkan penelitian Das &
Pereira (1990), gugus karbonil pada C-4 dan ikatan rangkap antara C-2 dan C-3 pada flavonoid juga berperan pada aktivitas antioksidan yang tinggi.
Kemungkinan mekanisme lain yaitu kemampuan flavonoid dalam menstabilkan membran dengan cara mengurangi fluiditas membran (Arora dkk., 2000).
Aktivitas flavonoid sebagai antioksidan terutama ditentukan oleh posisi dan tingkat hidrooksilasinya. Gugus orto−dihidroksi dalam cincin B berkontribusi terhadap aktivitas antioksidan.
Struktur p−quinol pada cincin B memberikan aktivitas lebih besar dibandingkan dengan struktur o−quinol. Sementara konfigurasi meta tidak memiliki efek antioksidan. Semua flavonoid dengan konfigurasi 3’, 4’−dihidroksilasi memiliki aktivitas sebagai antioksidan (Amic, et al., 2002). Adapun
struktur flavonoid dengan aktivitas antioksidan tinggi dapat dilihat pada Gambar 17.
Gambar 17. Struktur flavonoid dengan aktivitas antioksidan tinggi
Salah satu flavonoid dengan aktivitas antioksidan adalah senyawa isoflavon merupakan senyawa metabolit sekunder yang banyak disintesis oleh tanaman. Namun, tidak seperti senyawa metabolit sekunder lain, senyawa ini tidak disintesis oleh mikroorganisme (Anderson, 1997 dalam Pawiroharsono, 2001). Dengan demikian, mikroorganisme tidak mempunyai kandungan senyawa ini. Oleh karena itu, tanaman merupakan sumber utama senyawa isoflavon di alam.
Dari beberapa jenis tanaman, kandungan isoflavon yang lebih tinggi terdapat pada tanaman Leguminoceae, khususnya pada tanaman kedelai.
Isoflavon dominan pada kedelai terdapat dalam bentuk glikosida, sedangkan yang dominan pada produk kedelai yang mengalami fermentasi adalah aglikon (Coward et al., 1993). Bentuk glikosida
dipertahankan oleh tanaman sebagai bentuk inaktif sehingga dibutuhkan sebagai antioksidan. Bentuk aktif glikosida adalah aglikon, yang dihasilkan dari pelepasan glukosa dan glikosida (Anderson et al., 1998). Jenis senyawa isoflavon ini terutama adalah genistin, daidzin, dan glisitin (Pradana, 2008).
Struktur kimia isoflavon pada kedelai dapat ditunjukkan pada Gambar 18.
Gambar 18. Struktur kimia Genistin, Glistin dan Daidzin (Ariani dan Hastuti, 2009)
Isoflavon kedelai dapat menurunkan resiko penyakit jantung dengan membantu menurunkan kadar kolesterol darah, menghambat perkembangan sel-sel kanker dan angiogenesis, membantu menurunkan osteoporosis dan dapat membantu
pengobatan simptom menopause (Koswara, 2006).
Ketiga jenis isoflavon yaitu daidzein, glisitein, dan genistein mempunyai sifat antioksidan paling kuat dibandingkan dengan isoflavon dalam kedelai (Pawiroharsono, 1996).
2.1.1.5.Vitamin A
Vitamin A diperlukan untuk pertumbuhan dan perkembangan fungsi sistem imun serta proses penglihatan. Fungsi betakaroten sebagai precursor vitamin A. Secara enzimatis, betakaroten akan berubah menjadi retinol, zat aktif vitamin A dalam tubuh. Menurut Astawan dan Kasih (2008) betakaroten mempunyai peran penting dalam menstabilkan radikal berinti karbon sehingga mengurangi resiko terjadinya kanker. Salah satu keunikan sifat antioksidan ini adalah efektif pada konsentrasi rendan oksigen sehingga mampu melengkapi sifat antioksidan vitamin E (efektif pada konsentrasi tinggi oksigen). Betakaroten juga dapat meningkatkan daya tahan tubuh. Kandungan betakaroten pada bahan pangan alami dapat mengurangi resiko terjadiya stroke. Hal tersebut akibat aktivitas betakaroten sebagai pencegah terbentuknya plak atau timbunan kolesterol dalam pembuluh darah. Struktur kimia vitamin A dapat terlihat pada Gambar 19.
Gambar 19. Struktur kimia vitamin A
2.1.1.6.Antosianin
Antosianin merupakan glikosida antosianidin yaitu garam polihidroksiflavillium. Senyawa ini merupakan turunan garam flavillium atau benzilflavillium. Antosianin memiliki sifat mudah larut dalam air (Markakis, 1982). Antosianin tersusun atas gugusan glikon dan aglikon, dimana gugus glikon jika dihilangkan melalui hidrolisis maka dihasilkan antosianidin. Gugus gula berikatan dengan antosianidin pada umumnya adalah glukosa, galaktosa, xilosa, arabinosa dan rhamnosa.
Antosianidin akan berwarna merah di lingkungan asam, biru di basa dan warna ungu di lingkungan netral (Francis, 2000). Kadar antosianin dalam beberapa bahan pangan dapat dilihat pada Tabel 4.
Tabel 4. Kadar Antosianin dalam beberapa bahan pangan
Bahan pangan Kadar Antosianin (mg/100g)
Blackberries 353 Blueberries
kebun
529 Blueberries liar 705 Kismis hitam 533
Murbei 1993
Anggur 192
Plum 250
Black raspberry
845 Red raspberry 116 Strawberry 69 Kubis merah 113
Terong 35
Bawang merah 39
Sumber: Astawan dan Kasih, 2008
Antosianin mempunyai efek anti inflamasi, antibaktei dan pencegahan penyakit diabetes mellitus (Astawan dan Kasih, 2008). Antosianin memiliki fungsi fisiologis sebagai antioksidan dan melindungi sel hepar. Antosianin juga mampu menghalangi laju pengrusakan sel radikal bebas akibat nikotin, polusi udara dan bahan kimia lain. Antosianin berperan dalam mencegah penuaan (Gambar ), penurunan daya ingat dan kepikunan, polip, asam urat dan mencegah kenaikan asam lambung serta mampu menurunkan kadar gula darah (Kumalaningsih dan Suprayogi, 2006).