DIKTAT PRAKTIKUM ANALISIS INSTRUMEN
OLEH
TIM ANALITIK
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS RIAU
PEKANBARU
2022
KATA PENGANTAR
Diktat ini disusun demi mendukung mata kuliah praktikum kimia analisis instrumen.
Kimia analisis instrumen merupakan bagian dari ilmu kimia analisis yang difokuskan perhatiannya pada metode-metode analisis yang menggunakan peralatan-peralatan yang banyak diterapkan untuk memecahkan permasalahan dalam metode analisis.
Diharapkan mahasiswa yang telah mengambil mata kuliah Praktikum Kimia Analisis Instrumen dapat memahami dan mengerti setiap prosedur yang disusun dan dapat diterapkan pada masalah yang ada di sekitarnya.
Setiap saat selalu muncul prosedur analisis baru yang ditawarkan oleh ahli kimia dan peralatan analisis baru yang banyak diperkenalkan. Dalam buku penuntun ini diberikan beberapa contoh analisis kimia yang menggunakan instrumentasi yang akan membekali dan memotivasi mahasiswa untuk dapat mandiri dalam menggunakan instrumentasi kimia dan senantiasa mengikuti perkembangan kimia analitik instrumentasi.
Pekanbaru, April 2022
Tim Kimia Analitik
DAFTAR ISI
KATA PENGANTAR ... 1
DAFTAR ISI ... 2
PENDAHULUAN ... 3
FORMAT LAPORAN AKHIR ... 10
PERCOBAAN I ... 11
PERCOBAAN II ... 15
PERCOBAAN III ... 23
PERCOBAAN IV ... 29
PERCOBAAN V ... 31
PENDAHULUAN
Pada zaman modern ini banyak sekali metode analisis yang dapat dipergunakan dalam memecahkan berbgaia masalah analitik. Hal ini dapat membingungkan dalam mengambil keputusan penggunaan metode analisis, maka dirasa perlu bagi mahasiswa untuk meninjau kembali tahapan yang harus dilalui sebelum mengambil keputusan.
Penggunaan instrumentasi adalah bagian yang mengeasyikkan dan menarik dalam analisis kimia. instrumentasi berinteraksi dengan semua bidang kimia. instrumentasi berinteraksi dengan semua bidang kimia dan dengan bidang ilmu lain, baik ilmu dasar maupun terapan. Sering terjadi diperlukan beberapa teknik instrumental untuk mendapat informasi yang dibutuhkan dalam memecahkan permasalahan.
Instrumentasi analitik memegang peranan penting dalam produksi dan evaluasi produk-produk baru dan dalam melindungi konsumen dan lingkungan. instrumentasi menyajikan batas oemantauan yang lebih sensitif untuk menjamin keselamatan makanan, obat-obatan, air dan udara. Pembuatan material yang komposisinya harus diketahui dengan tepat, seperti bahan-bahan yang digunakan untuk minyak mesin, dimonitor dengan instrumen analitik. Analisis sejumlah besar sampel dapat dengan mudah diselesaikan oleh instrumentasi otomatis. Hal ini sangat membantu mahasiswa yang biasanya harus menghadapi tugas rumit dalam analisis kimia. sehingga mahasiswa mempunyai waktu luang untuk menguji komponen sistem analisis, seperti metode sampling, perlakuan data, dan evaluasi hasil.
Berbicara mengenai instrumentasi kimia akan banyak sekali ragamnya. Ada instrumentasi untuk tujuan kualitatif, kuantitatif, dan preparatif. Begitu pula ada untuk analisis senyawa anorganik seperti spektrofotometer serapan atom (SSA) dan yang hanya untuk analisis senyawa organik seperti spektrofotometer massa (MS) yang berguna untuk menganalisis kualitatif, kuantitatif tetapi juga bisa menampung substratnya dalam bentuk murni dari suatu campuran. Misalnya Kromatografi gas (GC) dan High Performance Liquid Chromatography (HPLC). Kedua instrumen ini dasarnya absorbsi dengan perbedaan kepolaran dari senyawa-senyawa yang dianalisis.
Penggunaan Alat Kimia
Instrumentasi kimia selain digunakan untuk pendidikan dan penelitian di perguruan Tinggi, banyak pula digunakan oleh industri dan instansi non pendidikan untuk quality control dan penelitian antara lain:
Bidang Pertanian
Spektrofotometer serapan atom dapat digunakan untuk menganalisis unsur yang terdapat dalam tanah dan yang dibutuhkan oleh tanaman sebagai zat hara. Karena SSA ini selain dapat menganalisis secara kualitatif tetapi juga dapat menentukan secara kuantitatif yang konsentrasinya ditentukan berdasarkan besarnya nilai Absorbansi (A). Absorbansi mempunyai hubungan dengan Transmitan (T) yang dinyatakan dengan rumus:
Selain untuk pertanian, SSA dapat dipergunakan pada industri semen, pupuk, makanan ternak, kedokteran, industri obat, dan pertambangan batu bara.
Prinsip SSA yang mengikuti hukum Lambert-Beer sama dengan UV- Spektrofotometer. SSA dapat menganalisis unsur dalam tingkat part per billion (ppb), sedangkan UV hanya dapat menganalisis sampai part per million (ppm).
Pengembangan dari UV-Spektrofotometer untuk menentukan analisis kualitatif dari senyawa organik yang mempunyai sistem butadien dan α,β-keton dan aldehid tak jenuh. Hal ini berkat percobaan-percobaan yang gemilang dari prof. Wood Ward. Dari hasil percobaan didapat data-data untuk perhitungan sehingga hasil observasi yang diperoleh dapat dikonfirmasikan dengan hasil perhitungan. Contohnya spektrofotometer UV dapat membedakan antara senyawa:
A
C: 234 nm; O: 235 nm
B
C:273 nm; O: 275 nm Hal ini baik secara kalkulasi maupun observasi, panjang gelombangnya berbeda.
Dalam pertanian, selain SSA digunakan pula alat HPLC. Alat ini dapat digunakan untuk menentukan pestisida, selain itu bisa juga digunakan untuk analisis lainnya.
Bidang Kesehatan
Proton dan Carbon Nuclear Magnetic Resonance dapat digunakan untuk mendeteksi penyakit kanker otak. Prinsip dari alat ini adalah kalau senyawa mempunyai inti proton
(1HNMR) dan inti karbon (13C-NMR) maka akan memberika respon pada proton dan karbon spektrometer serta berada pada pergeseran kimia tertentu sesuai dengan lingkungannya.
Begitu pula senyawa yang mempunyai karbon, maka akan memberikan respon pada 13CNMR spektrometer. Besarnya pergeseran kimia dinyatakan sebagai:
Indutri Minyak Atsiri dan Minyak Bumi
Perusahaan minyak atsiri dan minyak bumi banyak menggunakan alat kromatografi gas untuk menganalisis senyawa-senyawa yang terkandung dalam minyak atsiri dan minyak bumi. Untuk perusahaan yang besar terkadang GC dikombinasikan dengan alat spektrometer massa (MS). Analisa cara ini didasarkan pada waktu retensi (Rt) dari GC dan pola fragmentasi dari MS, maka dapat ditentukan satu persatu senyawa yang terkandung pada minyak atsiri dan minyak bumi. Selain itu GC-MS dapat digunakan untuk menentukan kematangan dari minyak bumi, sehingga bisa diketahui apakah minyak bumi sudah layak diambil atau belum. Untuk senyawa yang belum dikenal atau tidak mempunyai autentik sampelnya, maka selain alat GC dan MS dapat dibantu dengan spektrofotometer Infra Red (IR). Pengukuran alat ini didasarkan pada besarnya vibrasi dan kuatnya ikatan antara atomatom.
Pita-pita yang berguna pada IR adalah gugus fungsi dan sidik jari dari senyawa, dengan membandingkan spektrum dari senyawa yang tidak diketahui dan spektrum IR. Tidak ada spektrum yang sama, maka senyawa dapat kita ketahui. Sekarang ini MS dilengkapi dengan Library Search. Ratusan ribu senyawa kimia sudah diketahui pola fragmentasinya.
Dengan membandingkan derajat kemiripan spektrumnya makan senyawa dapat ditentukan rumus molekul dan strukturnya. Untuk senyawa yang mengandung gugus gula (glikosida) dilakukan pengukuran dengan sistem FAB (Fast Atomic Bombartion) dengan menambahkan HCl dan KCl, karena kalau tanpa sistem FAB maka tidak akan terlihat berat molekul sesungguhnya atau hanya terlihat berat molekul aglikonnya (tanpa gugus gula). Selain itu, MS dapat juga digunakan untuk menentukan berapa jumlah masing-masing unsur dalam senyawa organik CxHyOzNk dengan mengunakan high resolution mass spectrometer. SSA dapat digunakan untuk menentukan trace element pada minyak bumi, dan pada perusahaan LPG terkandung uap Hg, dan SSA dapat digunakan untuk menentukan kabarnya.
Industri Obat
Dalam industri obat yang besar dan selalu mencari obat baru, apakah obat alam dan sintetik maka peralatan kimia sangat diperlukan. Beberapa tahun lalu ditemukan senyawa taxol dari kulit batang tanaman Taxus spesies. Senyawa ini mempunyai khasiat dapat menyembuhkan kanker payudara dan rahim. Karena tanaman taxus ini terbatas jumlahnya dan bila diambil kulitnya terus menerus akan habis, maka dicari bagaimana mensintesis senyawa tersebut. Untuk maksud tersebut, tahapan dari sintesa senyawa tersebut dimonitor dengan alat proton dan karbon-NMR serta MS. Relatif konfigurasinya dapat ditentukan dengan alat difraksi sinar X. Preparasi pengukuran dengan sinar X diperlukan senyawasenyawa dalam bentuk kristal tunggal. Prinsipnya adalah pengukuran panjang ikatan dalam Amstrong dan sudut-sudut atom yang mengikatnya. SSA dapat digunakan dalam industri obat untuk mengukur kadar unsur Zn, Co, Ca, dan lain-lain.
TATA KERJA DI LABORATORIUM
Sebelum masuk Laboratorium:
1. Praktikan harus menyiapkan Jurnal Praktikum sesuai dengan jadwal percobaan yang dilakukan pada hari itu, yang disiapkan di rumah dan apa-apa yang akan dilakukan di Laboratorium ditulis dalam jurnal tersebut
2. Memakai jas lab dengan rapi untuk melindungi pakaian dari tumpahan zat-zat kimia 3. Menggunakan sepatu tertutup, untuk melindungi kaki dari zat-zat kimia dan pecahan
gelas. Tidak diperkenankan memakai sandal atau sepatu sandal 4. Telah menyerahkan laporan praktikum sebelumnya
5. Telah siap 15 menit sebelum praktikum dimulai. Bagi yang terlambat tidak diperkenankan masuk Laboratorium.
Setelah memasuki Laboratorium:
1. Mengisi daftar hadir yang telah disiapkan
2. Mengikuti respon dengan materi sesuai praktikum yang akan dilakukan pada hari tersebut. Mahasiswa baru diperbolehkan menjalankan praktikum setelah responsi dengan nilai minimal 60, jika kurang dari nilai tersebut makan praktikan diperkenankan mengikuti praktikum setelah lulus respon lisan oleh Dosen koordinator.
Selama praktikum berlangsung:
Ketentuan umum:
1. Sebelum memulai percobaan-percobaan bacalah dengan teliti petunjuk materi praktikum yang bersangkutan dan renungkan mengapa segala sesuatu harus dilakukan demikian pada waktu dilakukan percobaan, amati apa yang terjadi. Hasil pengamatan ini langsung ditulis pada buku jurnal dan tulislah kesimpulan-kesimpulan dari percobaa yang saudara amati setelah percobaan selesai
2. Bekerja dengan sungguh-sungguh, teliti, teratur (sistematik) dan bersih.
3. Memelihara suasana persaudaraan antar mahasiswa. Perlu disadari bahwa laboratorium adalah untuk kepentingan bersama karena itu jangan bersifat mementingkan diri sendiri
4. Menjaga kebersihan meja kerja saudara, susunlah alat-alat yang akan dipergunakan untuk percobaan hari itu dengan rapi (alat yang sering digunakan diletakkan di
sebelah depan, sedangkan alat-alat yang jarang digunakan diletakkan di belakang, dan dipergunakan alata-alat secara efisien
5. Kotoran padata (kertas tisu, kertas saring dan sebagainya) dibuang di tempat sampah yang telah disediakan.
Penggunaan reagensia:
1. Dilarang mengembalikan reagensia yang berlebih ke dalam botol
2. Untuk mengambil zat padat sebaiknya digunakan sendok zat yang telah dibersihkan dan kering
3. Untuk mengambil larutan pereaksi digunakan pipet yang telah disediakan 4. Botol pereaksi untuk umum tidak boleh dibawa ke tempatnya sendiri
5. Zat-zat yang tidak diketahui dengan pasti lebih baik jangan digunakan atau dibuang saja
6. Pada waktu membuang zat ke dalam bak pencuci, bukalah kran air, terutama bila zatnya asam. Siram sisa zat tersebut sampai habis.
Keamanan bekerja dalam Laboratorium:
1. Semua mahasiswa bertanggung jawab atas perlengkapan/alat yang dipinjam.
Laporkan perlengkapan alat yang kurang (disesuaikan dengan daftar alat pada meja saudara) pada laboran/analis sebelum memulai praktikum
2. Jangan melakukan percobaan yang belum diketahui dengan pasti
3. Bila terjadi kecelakaan (meskipun kecil) segera laporkan ke Asisten/Laboran/Dosen yang bertugas
Setelah praktikum selesai:
1. Setelah praktikum selesai, alat dibersihkan dahulu dengan air kran dan dibilas dengan air suling (akuades). Gunakanlah akuades secukupnya dan jangan terlalu boros.
Disamping itu jangan menyimpan alat dalam keadaan kotor, karena kotoran yang masih basah jauh lebih mudah dibersihkan daripada kotoran yang telah kering.
Kembalikan peralatan yang digunakan ke dalam lemari masing-masing atau tempatnya semula
2. Membuat laporan sementara pada kertas terpisah dan mengumpulkannya pada masing-masing asisten
3. Memeriksa meja, lantai atau lemari, tidak boleh ada basah atau sampah yang tercecer
4. Praktikan wajib menyerahkan laporan resmi sesuia dengan bentuk yang telah ditentukan, selambat-lambatnya satu minggu setelah menyelesaikan praktikum yang bersangkutan.
Kehadiran:
1. Semua rangkaian praktikum wajib diiukuti oleh praktikan mulai dari pengarahan, maupun praktikum yang dilaksanakan
2. Jika tidak hadir pada saat pengarahan, maka wajib menghadap Dosen koordinator 3. Bagi praktikan yang berhalangan mengikuti praktikum karena sakit atau hal lainnya
wajib menyerahkan surat keterangan tertulis atau keterangan dokter yang selambatlambatnya diserahkan sebelum tugas praktikum berikutnya dimulai.
FORMAT LAPORAN AKHIR
1. Lembar judul : judul percobaan, nama, tanggal percobaan, dan tanggal dibuatnya laporan
2. Pendahuluan : menampilkan deskripsi parameter yang akan dianalisis dan pendekatan umum terhadap permasalahan yang ada. Sebaiknya menampilkan deskripsi teknik analisis yang melibatkan konsep yang ada. Bagian ini sebaiknya juga menampilkan tujuan dari percobaan
3. Metodologi penelitian:
a. Alat dan bahan yang digunakan
b. Prosedur analitik: deskripsi mengenai bagaimana percobaan dilakukan. Jangan menulis ulang prosedu yang terdapat di diktat praktikum, tetapi tulis menggunakan bahasa sendiri terhadap apa-apa yang telah dikerjakan
c. Data mentah: tampilkan data yang diperoleh pada saat perrcobaan, dan lampirkan lembar pengamatan sementara yang dibuat pada saat praktikum
4. Hasil: menampilkan data dalam bentuk tabel atau grafik, serta perhitungan analisis data. Semua grafik, tabel dan bagian hasil harus memiliki judul yang akan dirujuk pada bagian laporan.
5. Diskusi dan kesimpulan: mohon dibuat pembahasan mengenai hasil yang telah diperoleh, dibuat perbandingan dengan merujuk berdasarkan penelitian sebelumnya melalui jurnal atau publikasi ilmiah lainnya. Beri saran terhadap percobaan yang telah dilakukan dan buatlah kesimpulan.
6. Referensi: menampilkan daftar referensi yang dibuat mengikuti peraturan cara pembuatan daftar pustaka. Sebagai contoh:
Davis, A. P., Shokouhian, M., Sharma, H., Minami, C., & Winogradoff, D. (2003).
Water quality improvement through bioretention: lead, copper, and zinc removal.
Water Environment Research : A Research Publication of the Water Environment Federation, 75, 73–82. doi:10.2175/106143003X140854
Namasivayam, C., & Kavitha, D. (2002). Removal of Congo Red from water by adsorption onto activated carbon prepared from coir pith, an agricultural solid waste.
Dyes and Pigments, 54, 47–58. doi:10.1016/S0143-7208(02)00025-6
PERCOBAAN I
ANALISIS KANDUNGAN BESI DALAM AIR MINUM MENGGUNAKAN SPEKTROSKOPI SERAPAN ATOM
Pendahuluan
Spektroskopi atom digunakan untuk mengidentifikasi dan menentukan (kualitatif dan kuantitatif) logam-logam dalam tingkat ‘trace’ dalam semua jenis materi dan larutan.
Pengukuran dalam spektroskopi serapan atom (SSA) berdasarkan radiasi yang diserap oleh atom dalam keadaan dasar. Dalam spektroskopi emisi, pengukuran berdasarkan energi yang diemisikan ketika atom-atom dalam keadaan terkesitasi kembali ke keadaan dasar.
Spektroskopi Emisi Nyala (SEN) adalah suatu spektroskopi emisi dari daerah khusus yang mana atom dieksitasi dengan menggunakan nyala.
Teknik serapan dan emisi nyala biasanya disertai pemasukan suatu larutan sampel bentuk aerosol dalam nyala. Evaporasi pelarut dan penguapan garam ke dalam atom-atom gas yang bebas. Pada suhu nyala udara-asetilen (±2300oC) atom dari sejumlah banyak unsur berada dalam keadaan dasar. Jika seberkas energi radiasi yang terdiri dari spektrum emisi untuk unsur tertentu yang akan ditentukan dilewatkan melalui nyala ini, sejumlah atom dalam keadaan dasar akan menyerap energi dari panjang gelombang yang khas (garis resonansi) dan mencapai keadaan energi yang lebih tinggi.
Jumlah energi radiasi yang diserap sebagai suatu fungsi konsentrasi unsur dalam nyala merupakan dasar spektroskopi serapan atom. Untuk beberapa unsur seperti logam alkali (Na, K, dan Li), nyala udara-asetilen cukup panas, tidak hanya menghasilkan atom-atom dalam keadaan dasar tetapi juga menaikkan sejumlah atom ke keadaan elektronik tereksitasi.
Energi radiasi dipancarkan (diemisikan) jika atom-atom kembali ke keadaan dasar yang sebanding dengan konsentrasi dan ini merupakan dasar spektroskopi emisi nyala.
Suatu sampel pertama-tama harus dilarutkan, proses pelarutan dikenal dengan istilah destruksi, yang bertujuan untuk membuat unsur logam menjadi ion logam yang bebas.
Terdapat dua cara destruksi, yaitu:
1. Destruksi basah : sampel ditambahkan asam-asam oksidator, jika perlu dibatu dengan pemanasan
2. Destruksi kering : sampel langsung dipanaskan untuk diabukan
Hasil destruksi baik cara basah maupun cara kering kemudian dilarutkan. Larutan sampel dimasukkan ke dalam nyala dalam bentuk aerosol yang selanjutnya akan membentuk
atom-atom. Serapan akan terjadi dari radiasi suatu sumber sinar yang sesuai dengan atom yang ditentukan. Sebagai sumber emisi sinar adalah lampu katoda berongga yang mempunyai garis spektra yang tajam. Metode analisis ini bersifat cepat, selektif, sensitif, dan mempunyai akurasi yang tinggi serta dapat digunakan secara rutin. Diagram peralatan SSA dapat dilihat pada Gambar 1.
Gambar 1. Diagram SSA
(http://www.fisica.unam.mx/liquids/images/tutorials/atomic_abspectro01.gif)
Prinsip
Prinsip operasi metode ini yaitu diperlukan sumber cahaya dari luar yang memancarkan sinar dengan panjang gelombang tertentu, yang sesuai dengan energi yang diperlukan untuk mengubah tingkat elektronik dari tingkat dasar ke tingkat eksitasi suatu unsur.
Sinar dengan panjang gelombang yang diperlukan ini dilewatkan nyala yang mengandung unsur yang akan ditentukan. Perbedaan antara instensitas sinar mula-mula dengan intensitas sinar yang diteruskan diukur dan perbedaan ini dibaca sebagai nilai absorbansi dan besarnya berbanding lurus dengan konsentrasi unsur yang mengabsorpsi sinar tersebut.
Besi dapat ditentukan dalam nyala udara-asetilen. Nyala ini memberikan suhu yang sesuai dengan suhu yang diperlukan untuk atomisasi logam Fe. Untuk menentukan
kandungan logam Fe dalam air minum, diperlukan perlakuan yang sama antara larutan standar logam dengan sampel.
Metodologi:
Peralatan yang digunakan:
- Labu ukur
- Spektrofotometer Perkin Elmer 3110 - Corong
- Pipet ukur
- Kertas saring whatman No. 42
Bahan kimia yang digunakan:
- HNO3 pekat - HCl pekat
Cara kerja:
Preparasi larutan standar
Dibuat larutan induk Fe 1000 ppm, dari larutan tersebut buatlah seri larutan standar 0,1 hingga 5 ppm. Pada pembuatan larutan standar tambahkan HNO3 pekat beberapa tetes atau HCl pekat. Selanjutnya diencerkan sampai tanda batas (gunakan labu ukur 100 mL).
Persiapan sampel
Diambil sejumlah volume air minum, saring dengan kertas saring Whatman No 42, beri beberapa tetes HNO3 pekat, ditempatkan dalam labu ukur 100 mL.
Cara pengukuran
- Perhatikan prosedur pengoperasian alat SSA
- Tentukan dan ukur absorbansi masing-masing larutan standar
- dibuat grafik kurva kalibrasi dan dicari persamaan regeresi liniernya dan ditentukan harga koefisien korelasi
- dihitung besarnya kandungan Fe dalam air buangan atau air minum
Tugas dalam laporan:
1. Gambarkan komponen utama SSA
2. Kenapa logam besi bagus digunakan dalam pembuatan larutan standar dibandingkan besi dalam bentuk garamnya?
3. Dapatkah untuk analisis logam Fe dipakai nyala N2O-asetilen? Terangkan jawaban saudara!
4. Kenapa ditambahkan HNO3 ke dalam larutan standar dan larutan sampel?
5. Kenapa dirasa perlu menganalisis kandungan Fe dalam air minum?
Pemeliharaan
Untuk mendapatkan hasil pengukuran yang optimum perlu dilakukan hal-hal sebagai berikut:
1. Gunakan pelarut (akuades) yang mempunyai daya hantar listrik (DHL) <2,0 µmhos/cm)
2. Bilamana sumber tegangan listrik tidak rata, gunakan stabilizer
3. Cek semua sambungan pipa gas pembakar (asetilen) dan udara tidak ada kebocoran 4. Atur kecepatan aliran gas asetilen pada skala 2 dan kecepatan aliran udara pada skala 6 5. Lakukan penyaringan sampel bila mengandung partikel-partikel pengotor
6. Burner harus dibersihkan sebelum flame dinyalakan
7. Cek pipa kapiler ke nebulizer, bila mampat harus dibersihkan
8. Bila akan mematikan lampu katoda berongga (HCL) harus dilakukan melalui program parameter entry
9. Catat semua aktivitas dalam buku log. Setelah alat dimatikan, tutup kran gas pembakar dan buang udara yang ada dalam kompresor, serta mastikan pompa penghisap buangan gas (exhaust pump)
PERCOBAAN II
PENENTUAN KANDUNGAN KAFEIN DALAM PRODUK MINUMAN MENGGUNAKAN HIGH PERFORMANCE LIQUID CHROMATOGRAPHY
PENDAHULUAN
Kromatografi merupakan teknik analisis yang telah banyak dilakukan, mulai dari kromatografi gas sampai pada kromatografi cair yang dimulai dengan cara cukup sederhana seperti kromatografi kertas, kromatografi lapis tipis, kromatografi permeasi gel dan filtrasi gel. Semuanya telah menunjukkan hasil yang baik dalam suatu sistem pemisahan, walaupun efisiensinya kecil dan memerlukan waktu yang cukup lama dalam pengerjaannya.
Bermacam-macam nama yang bervariasi digunakan untuk menggambarkan pemakaian sistem baru dalam kromatografi cair seperti:
- High speed liquid chromatography (HSLC) - High efficiency liquid chromatography (HELC) - High pressure liquid chromatography (HPLC)
Ketiga sistem ini kemudian digabungkan ke dalam sistem yang lebih modern yaitu High Performance Liquid Chromatography. Sistem ini dibuat mirip dengan kromatografi gas yang terdiri dari fasa stasioner dengan permukaan aktifnya berupa padatan, larutan, resin penukar ion atau polimer berpori. Fasa stasioner ini ditempatkan pada kolom serta dialiri fassa gerak cair dengan aliran yang diatur oleh suatu pompa.
Sejumlah senyawa organik yang tidak stabil dan mudah menguap dapat dianalisis oleh HPLC dengan hasil yang baik tanpa kesulitan. Analisa dengan HPLC dilakukan pada temperatur rendah serta adanya kompetisi 2 fasa (gerak dan diam) dibandingkan dengan GC yang hanya satu fasa (fasa diam), maka HPLC dapat melakukan pemisahan yang tidak mungkin dilakukan oleh GC. Selain itu, adanya berbagai macam detektor yang dapat dipilih sesuai dengan jenis dan sifat senyawa dapat menambah selektivitas HPLC.
Keunggulan kolom HPLC dari kromatografi cair lainnya adalah:
- Kolom HPLC dapat dipakai berulang kali tanpa diregenerasi - Tercapainya pemisahan yang memuaskan pada kolom - Dapat dioperasikan secara otomatis dan kualitatif - Waktu analisis yang relatif singkat
- Untuk keperluan preparatif yang dapat dilakukan dalam skala besar
Teori
Kromatografi merupakan cara pemisahan komponen campuran yang berdasarkan pada adanya perbedaan sifat campuran yang berdasarkan pada adanya perbedaan sifat dalam distribusi kesetimbangan (K) dari dua komponen yang berbeda fasanya, yaitu fasa gerak dan fasa diam. Jika Cs dan Cm adalah konsentrasi fasa diam dan konsentrasi fasa gerak, maka perbandingan distribusi dari komponen di dalam dua fasa tersebut dapat dirumuskan sebagai berikut:
Migrasi dari molekul komponen akan terjadi bila molekul tersebut berada pada fasa gerak.
Kecepatan migrasi komponen sebanding dengan koefisien distribusinya, komponen dengan distribusi tinggi pada fasa stasioner akan bergerak lebih perlahan di dalam kolom, sehingga dapat terpisah dari komponen yang distribusinya rendah. Hal-hal yang mempengaruhi perbedaan migrasi adalah komposisi fasa gerak, temperatur dan fasa stasioner. Pengaruh tekanan pada kolom dapat diabaikan sebab tekanan digunakan untuk mengatur aliran fasa gerak.
Penahanan atau retensi akan terjadi bila suatu komponen bergerak di dalam kolom dengan kecepatan lebih rendah dari kecepatan fasa geraknya. Perbandingan dari kedua kecepatan tersebut dirumuskan sebagai faktor retensi (Rf)
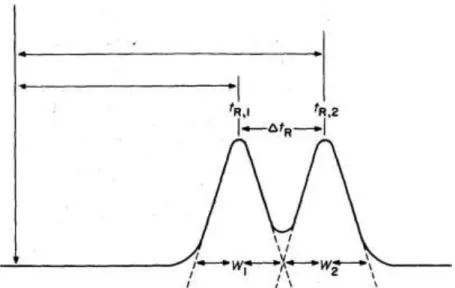
Waktu elusi dari suatu puncak disebut waktu retensi (tr) yang dapat dihubungkan dengan koefisien distribusi. Gambar 2 memperlihatkan pemisahan sederhana dari campuran 2 komponen yang terelusi dengan waktu retensi tr1 dan tr2. Waktu elusi adalah suatu fungsi dari kecepatan fasa gerak dan volume fasa gerak yang diperlukan untu mengelusi sebuah komponen dari dalam kolom.
Waktu retensi dirumuskan sebagai berikut:
, dimana F: volume aliran fasa gerak
Gambar 2. Kromatogram 2 komponen (zat A dan zat B) http://www.academic.marist.edu/~jfjp/Image23.gif Peralatan
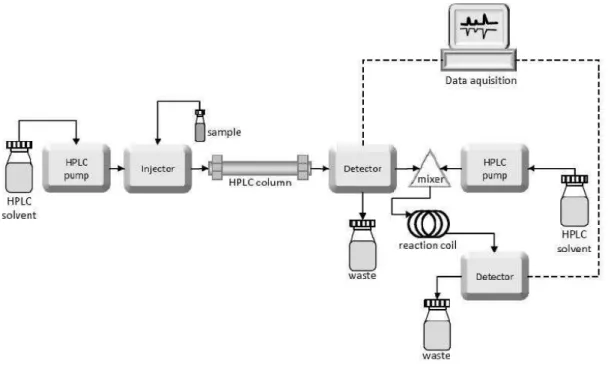
Peralatan HPLC secara prinsip terdiri dari tempat pelarut, pompa, tempat injeksi sampel, kolom, detektor, dan rekorder. Seluruh peralatan ini pada umumnya dapat dikendalikan oleh sistem pengatur, yang memungkinkan alat dapat bekerja dengan sendirinya. Bahkan pada beberapa alat HPLC sering pula dilengkapi dengan auto sampler sehingga injeksi sampel dapat dilakukan alat secara otomatis sesuai dengan yang diinginkan.
Gambar 3 menunjukkan skema alat HPLC.
Gambar 3. Skema Paralatan HPLC
http://www.intechopen.com/source/html/44034/media/image7_w.jpg
1. Fasa gerak (pelarut)
Pengukuran dengan HPLC membutuhkan banyak pelarut, sebelum pelarut digunakan harus dilakukan degassing untuk mengeluarkan gas terlarut yang tidak diinginkan. Adanya gas dalam pelarut kemungkinan dapat bereaksi dengan fasa gerak atau fasa diamnya, selain itu dapat mengganggu kerja detektor.
2. Sistem pompa
Perkembangan sistem pompa merupakan satu faktor utama dalam sistem kromatografi modern, dan merupakan komponen yang terpenting. Ada dua jenis pompa yang mendasari pemakaiannya yaitu: tekanan tetap dan volume tetap. Pada pompa dengan tekanan tetap, tekanan dilakukan dengan memberikan gas inert, sehingga fasa gerak dapat mengalir dengan tekanan yang konstan. Hal ini berakibat pada volume aliran fasa gerak yang melewati kolom tidak tetap sehingga agak sulit untuk memperoleh hasil yang akurat dan pengulangannya rendah.
Pada aliran fasa gerak dengan volume tetap terjadi perubahan perrmeabilitas pada sistem karena perubahan viskositas pada fasa gerak (perubahan temperatur atau perubahan komposisi) dapat dihilangkan dengan adanya volume aliran yang selalu tetap. Perubahan aliran dapat berakibat buruk pada waktu retensi, resolusi, dan memberi ‘base line’ yang tidak stabil.
3. Pengendalian aliran (flow controller)
Pengendalian aliran dapat menstabilkan aliran fasa gerak akibat adanya perubahan tekanan gas, temperatur, dan perubahan viskositas.
4. Kolom
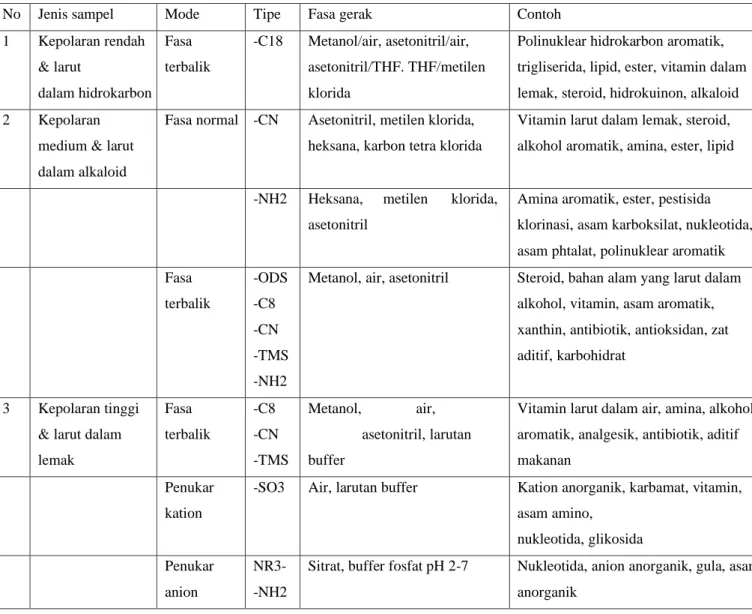
Kolom HPLC tidak memerlukan temperatur yang tinggi, karena sifat ikatan kimia terhadap fasa diam sangat sensitif terhadap temperatur tinggi. Pemilihan kolom berdasarkan jenis fasa gerak dan sifat-sifat sampel dapat dilihat pada Tabel 1.
5. Detektor
Perkembangan yang sangat menyolok pada efisiensi HPLC adalah karena detektor yang dapat bekerja terus menerus tanpa henti. Ada dua jenis yang mendasari pemilihan detektor dalam kromatografi cair:
a. Perbedaan pengukuran dari sifat yang mendasar antara sampel dan fasa gerak
b. Pengukuran ditujukan pada sifat yang sangat spesifik terhadap sampel dengan atau tanpa perubahan fasa gerak sebelum deteksi.
Karakteristik detektor untuk HPLC adalah:
1. Sensitivitas yang tinggi yaitu lebih dari 0,1 mg sampel dalam 1 mL fasa gerak.
2. Respon yang menyeluruh terhadap sampel atau mempunyai sifat yang sangat sensitif 3. Mempunyai respon yang linier pada setiap konsentrasi
4. Memiliki ‘dead’ volume rendah 5. Tidak merusak sampel (non destruktif)
6. Tidak sensitif terhadap perubahan temperatur dan perubahan kecepatan aliran fasa gerak
7. Dapat beroperasi secara terus menerus
Tabel 1. Pemilihan kolom
No Jenis sampel Mode Tipe Fasa gerak Contoh
1 Kepolaran rendah
& larut
dalam hidrokarbon Fasa terbalik
-C18 Metanol/air, asetonitril/air, asetonitril/THF. THF/metilen klorida
Polinuklear hidrokarbon aromatik, trigliserida, lipid, ester, vitamin dalam lemak, steroid, hidrokuinon, alkaloid 2 Kepolaran
medium & larut dalam alkaloid
Fasa normal -CN Asetonitril, metilen klorida, heksana, karbon tetra klorida
Vitamin larut dalam lemak, steroid, alkohol aromatik, amina, ester, lipid
-NH2 Heksana, metilen klorida, asetonitril
Amina aromatik, ester, pestisida klorinasi, asam karboksilat, nukleotida, asam phtalat, polinuklear aromatik Fasa
terbalik
-ODS -C8 -CN -TMS -NH2
Metanol, air, asetonitril Steroid, bahan alam yang larut dalam alkohol, vitamin, asam aromatik, xanthin, antibiotik, antioksidan, zat aditif, karbohidrat
3 Kepolaran tinggi
& larut dalam lemak
Fasa terbalik
-C8 -CN -TMS
Metanol, air, asetonitril, larutan buffer
Vitamin larut dalam air, amina, alkohol aromatik, analgesik, antibiotik, aditif makanan
Penukar kation
-SO3 Air, larutan buffer Kation anorganik, karbamat, vitamin, asam amino,
nukleotida, glikosida Penukar
anion
NR3- -NH2
Sitrat, buffer fosfat pH 2-7 Nukleotida, anion anorganik, gula, asam anorganik
PENENTUAN KAFEIN DALAM BERBAGAI MINUMAN
Prinsip
Pada metode tradisional, untuk menentukan kadar kafein dapat dilakukan melalui ekstraksi selanjutnya ditentukan dengan spektrofotometri. Sistem kromatografi cair dapat memberikan pemisahan kafein dengan cepat dan mudah dari senyawa-senyawa lain seperti asam tannat, asam kafeinat, dan sukrosa yang dapat ditemukan pada minuman-minuman tersebut. Dengan menyuntikkan lima macam konsentrasi larutan standar kafein dan selanjutnya penyuntikan berbagai macam sampel minuman ke dalam HPLC, maka akan diperoleh masing-masing kromatogramnya. Dari kromatogram yang dihasilkan, maka waktu retensi (tr) dan luas puncak dapat ditentukan. Jika kecepatan aliran serta tekanan pompa tetap konstan selama berlangsungnya eksperimen, maka tr dapat digunakan sebagai ukuran untuk tujuan kualitatif dan luas peak untuk tujuan kuantitatif. Kurva kalibrasi antara luas peak dengan konsentrasi larutan standar kafein selanjutnya dapat digunakan untuk menentukan konsentrasi kafein dalam berbagai minuman di atas.
Tujuan: penentuan kadar kafein di dalam berbagai minuman seperti kopi, teh, coca cola, pepsi cola, dan sejenisnya dengan menggunakan HPLC fasa terbalik.
Metodologi:
Peralatan yang digunakan:
- HPLC dengan detektor UV 254 nm - Kolom C18 fasa terbalik
- Syringe 50 µL - Pipet 1 dan 2 mL
- Labu ukur 25 mL (4 buah) - Labu ukur 100 mL (5 buah)
Bahan yang digunakan:
- larutan standar kafein
- pelarut campuran metanol:air (20:80%) 1 liter - minuman teh, kopi, coca cola, pepsi cola
Cara kerja :
Persiapan larutan standar kafein
1. Ke dalam 5 buah labu ukur 100 mL dimasukkan kafein yang telah ditimbang secara seksama, berturut-turut 2,5; 7,5; 10; dan 12,5 mg
2. Diencerkan sampai tanda batas dengan pelarut metanol-air (20:80), diatur sampai pH 3,5 dengan penambahan HCl
3. Dikocok kafein sampai larut semua, dibiarkan lima menit sebelum diinjeksikan ke HPLC
4. Dihidupkan pompa dan detektor, diatur kecepatan aliran pompa sebesar 2,3 mL/menit dan sensitivitas detektor pada 0,08 AUFS (absorbance unit full scale). Dihidupkan rekorder dan diatur kecepatannya pada ‘the low speed rate’. Diinjeksikan larutan standar ke dalam kolom, dibiarkan fasa gerak melewati kolom selama 5-10 menit.
Diamati rekaman dari respon detektor untuk meyakinkan apakah kolom sudah bersih 5. Dengan menggunakan syringe, diinjeksikan cairan larutan standar dengan konsentrasi
terkecil ke dalam HPLC pada posisi LOAD
6. Selanjutnya diputar katup pada tempat injeksi dari posisi LOAD ke posisi INJECT secara serentak (bersamaan ) sambil menekan tombol RUN pada rekorder
7. Setelah kromotogram dari larutan standar tersebut keluar semua (ada 3 kromatogram) injeksi dilanjutkan untuk larutan standar yang lainnya (kosentrasi terkecil) dengan prosedur yang sama seperti di atas
8. Untuk setiap larutan standar akan diperoleh 3 kromatogram sehingga dari keseluruhan larutan standar akan diperoleh sebanyak 15 kromatogram
9. Dari ke 15 kromatogram yang diperoleh akan didapatkan kurva regresi dari larutan standar kafein
Persiapan larutan sampel Sampel Coca Cola
1. Dituangkan 10-15 mL sampel coca cola ke dalam beaker. Dilakukan dekarbonasi (menghilangkan CO2) dengan memindah tuangkan minuman tersebut ke dalam beaker yang lain
2. Dipipet 10 mL minuman tersebut ke dalam labu takar 25 mL, diencerkan sampai tanda batas dengan pelarut metanol-air (20:80) dan diatur pH 3,5
3. Dilakukan pula dengan cara yang sama untuk minuman lainnya
4. Dengan menggunakan syringe, diinjeksikan cairan sampel ke dalam HPLC pada posisi LOAD
5. Selanjutnya diputar katup pada tempat injeksi dari posisi LOAD ke posisi INJECT secara bersamaan sambil menekan tombol RUN pada rekorder.
Perhatian : setelah seluruh larutan standar dan sampel diperoleh kromatogramnya, kolom harus dibilas dengan 50 mL pelarut metanol-air (20:80%)
Perlakuan data:
1. Ditentukan tr dari masing-masing kafein dalam seluruh larutan, baik larutan standar maupun larutan sampel minuman
2. Dibuatlah kurva korelasi antara luas kromatogram kafein dengan konsentrasi kafein dalam larutan standar, kemudian tentukan kadar kafein dalam sampel minuman tersebut.
Tugas dalam laporan:
1. Data yang terdiri dari konsentrasi masing-masing sampel, waktu retensi, luas puncak dan tinggi puncak ditampilkan dalam bentuk tabel
2. Jelaskan kenapa pada analisis cafein dalam produk minuman digunakan kolom C18 fasa terbalik!
3. Apa tujuan mengatur pH pada 3,5? Jelaskan!
4. Bisakan kolom penukar ion digunakan untuk menentukan kandungan kafein dalam produk minuman?
PERCOBAAN III
PENENTUAN KONSENTRASI Fe(II) DALAM AIR MENGGUNAKAN SPEKTROFOTOMETRI VISIBLE
Pendahuluan
Semua molekul dapat menyerap energi pada daerah ultra violet dan tampak yang menghasilkan transisi elektron diantara tingkat-tingkat energi elektronik molekul tersebut.
Hubungan antara energi yang diserap dalam tansisi elektronik adalah :
Dimana h adalah tetapan Planck, c adalah kecepatan cahaya, dan λ adalah panjang gelombang (nm). Energi yang diserap tergantung pada perbedaan energi antara tingkat dasar dan tingkat tereksitasi.
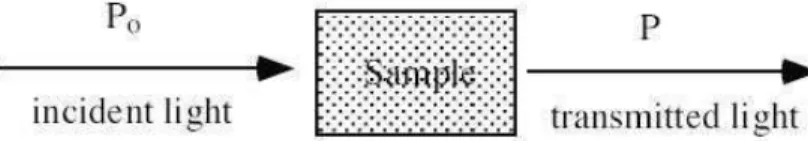
Gambar 1. Pengurangan Kekuatan sinar oleh larutan pengabsorbsi http://www.tadjhizyaran.org/Portals/0/s1.JPG
Gambar 1. memperlihatkan kekuatan sinar sebelum (Po) dan sesudah (P) melewati larutan dengan ketebalan b cm dan konsentrasi zat penyerap sinar c. Sebagai akibat interaksi antara cahaya dan partikel-partikel penyerap (pengabsorbsi) adalah berkurangnya sesatan sinar dari Po ke P. Transmitansi larutan T merupakan bagian dari cahaya yang diteruskan melalui larutan. Jadi:
Transmitansi sering dinyatakan sebagai persentase (%T). Absorbansi (A) suatu larutan dinyatakan dengan persamaan:
Berbeda dengan tarnsmitansi, absorbansi larutan bertambah dengan pengurangan kekuatan sinar. Bila ketebalan benda atau konsentrasi materi yang dilewati cahaya bertambah, maka cahaya akan lebih banyak diserap. Jadi absorbansi berbanding lurus dengan ketebalan b dan konsentrasi c,
Dimana a adalah konstanta absorptivitas. Nilai a bergantung pada satuan yang digunakan pada b dan c. Bila konsentrasi dinyatakan dalam mol/Liter dan panjang sel dalam cm, maka absorptivitas disebut sebagai absorptivitas molar dan diberi simbol ε, jadi:
= *
Dimana ε mempunyai satuan Lcm-1 mol-1. Beberapa spektrofotometer manual dilengkapi dengan sistem pembacaan yang mempunyai skala pembacaan linear dari 0 sampai 100%, seperti pada spektronik 20. Titik 100% pada transmitansi sama dengan titik 0 pada absorbansi, sedangkan titik 50% pada transmitansi sama dengan titik 0,3 pada absorbansi karena
= − log = log 100 − log 50 = 0,3
Pengaturan 0% T dilakukan dengan menghalangi detektor dari sumber cahaya, sedangkan pengaturan 100% T dilakukan dengan membuka penghalang sumber cahaya dan melewatkan cahaya melalui pelarut. Persamaan * disebut sebagai hukum Beer, yang digunakan untuk campuran zat pengabsorbsi yang saling tidak memberikan interaksi diantara zat-zat tersebut.
Syarat-syarat penggunaan hukum ini adalah:
1. Syarat konsentrasi
Hukum Beer sangat baik untuk larutan yang encer. Pada konsentrasi tinggi (0,01 M), jarak rata-rata diantara zat pengabsorpsi menjadi kecil sehingga masing-masing zat mempengaruhi distribusi muatan tetangganya. Ini dapat mengubah kemampuan untuk mengabsorpsi cahaya pada panjang gelombang yang diberikan.
2. Syarat kimia
Zat pengabsorpsi tidak boleh terdisosiasi, berasosiasi atau berinteraksi dengan pelarut menghasilkan suatu produk pengabsorpsi spektrum yang berbeda dengan zat yang dianalisa. Jadi zat yang diukur harus stabil
3. Syarat cahaya
Hukum Beer hanya berlaku untuk cahaya yang betul-betul monokromatis 4. Syarat kejernihan
Kekeruhan larutan yang disebabkan oleh partikel-partikel koloid misalnya menyebabkan penyimpangan hukum Beer. Sebagian cahaya akan dihambur oleh partikel-partikel koloid akibatnya kekuatan cahaya yang diabsorpsi berkurang dari yang seharusnya.
Penentuan Besi/ Fe (II) dalam air minum dengan metode Phenantroline
Prinsip
Sampel air didinginkan dengan asam dan hidroksilamin untuk mengubah besi menjadi ferro. Kemudian ditambah dengan 1,10 fenantrolin pada pH 3,2-3,3 hingga terbentuk warna merah jingga. Setiap atom besi diikat dengan 3 molekul fenantrolin. Zat pengoksidasi kuat, sianida, nitrit, fosfat, krom, seng dalam kadar lebih dari 10 kali kadar besi dapat mengganggu metode ini. Demikian pula kobalt, tembaga >5 ppm dan nikel >2 ppm.
Bismut, kadmium, merkuri, molibdat, dan perak dapat mengendapkan fenantrolin.
Pendidihan pertama dengan asam akan mengubah polifosfat menjadi ortofosfat dan menghilangkan sianida serta nitrit yang dapat mengganggu. Penambahan hidroksilamin berlebihan akan menghilangkan kesalahan yang disebabkan oleh kadar reagen pengoksidasi kuat yang berlebihan.
Kadar besi total, terlarut atau besi ferro antara 0,02 dan 4,0 mg/L dapat ditentukan langsung, sedangkan kadar lebih tinggi dapat ditentukan dengan memperkecil volume atau diencerkan. Jumlah minimum yang dapat ditentukan dengan alat spektrofotometer (λ 510 nm) dengan sel 1 cm adalah 50 µg/mL = 1 mg/L.
Metodologi
Peralatan yang digunakan:
- Spektrofotometer UV-Vis Agilent - Pipet volume, pipet ukur
- Labu erlenmeyer - Labu ukur
Bahan kimia yang digunakan:
- Akuades bebas besi
- HCl pekat (kadar Fe < 0,00005%) - Larutan hidroksilamin
- Larutan buffer amonium asetat : 250 g CH3COONH4 dilarutkan dalam 150 mL akuades dan ditambahkan 700 mL asam asetat glasial (larutan harus dibuat baru) - Larutan natrium asetat : 200 g CH3COONa. 3H2O dilarutkan dalam 800 mL akuades - Larutan fenantrolin : 100 mg 1,10 Fenantrolin monohidrat, C12H8N2.H2O dilarutkan
dalam 100 mL akuades dengan diaduk dan dipanaskan sampai 80Oc (tidak sampai
mendidih). Larutan dibuang bila warnanya menjadi gelap. Pemanasan tidak perlu dilakukan bila ke dalam akuades ditambahkan 2 tetes HCl pekat
- Larutan induk besi:Ditambahkan perlahan-lahan 20 mL H2SO4 pekat ke dalam 50 mL akuades dan dilarutkna 1,404 g ferro amonium sulfat, Fe(NH4)2(SO4)2.6H2O.
Ditambahkan tetes demi tetes 0,1 N KMnO4 sampai terbentuk warna merah muda.
Diencerkan sampai 1000 mL dengan akuades. 1,00 = 200 µg Fe
- Larutan standar besi (selalu dibuat baru):50 mL larutan induk diambil dengan pipet dan dimasukkan ke dalam labu ukur 1 L. Diencerkan sampai tanda batas dengan akuades. 1,00 mL = 10 µg=0,01 mg Fe.
Cara kerja:
Persiapan larutan standar:
Penenetuan λmaks dan Penentuan waktu kestabilan warna
Semua alat-alat gelas dicuci dengan HCl pekat dan dibilas dengan akuades untuk menghilangkan lapisann tipis dari besi oksida yang menempel pada gelas tersebut.
Pembuatan kurva kalibrasi
LARUTAN Labu ukur 50 m L
I II III IV V VI VII VIII
Standar Fe (mL) 0 1 2 3 4 5 6 7
Hidroksilamin 1 1 1 1 1 1 1 1
CH3COONa 1 1 1 1 1 1 1 1
Akuades 30 30 30 30 30 30 30 30
Fenantrolin 10 10 10 10 10 10 10 10
Diencerkan masing-masing campuran di dalam labu ukur sampai tanda batas. Dikocok sampai homogen, ditunggu 10 menit sampai pembentukan warna sempurna. Dibaca absorbansi masing-masing larutan dengan spektrofotometer pada panjang gelombang 510 nm.
Larutan blanko akuades dikerjakan bersama-sama dengan larutan standar di atas. Dibuat kurva kalibrasi menggunakan program Microsoft Excel atau kertas grafik.
Catatan:
Konsentrasi Fe pada labu ukur I = 0 mL = 0,0 ppm Konsentrasi Fe pada labu ukur II = 1 mL = 0,2 ppm Konsentrasi Fe pada labu ukur III = 2 mL = 0,4 ppm Konsentrasi Fe pada labu ukur IV = 3 mL = 0,6 ppm Konsentrasi Fe pada labu ukur V = 4 mL = 0,8 ppm Konsentrasi Fe pada labu ukur VI = 5 mL = 1,0 ppm Konsentrasi Fe pada labu ukur VII = 6 mL = 1,2 ppm Konsentrasi Fe pada labu ukur VIII = 7 mL = 1,4 ppm
Persiapan sampel
- Diukur 50 mL sampel, dimasukkan ke dalam labu erlenmeyer 125 mL. Apabila sampel mengandung lebih dari 2 mg/L Fe, diencerkan dengan tepat sehingga mengandung tidak lebih dari 100 µg/50 mL
- Ditambahkan 2 mL HCl pekat, 1 mL hidroksilamin
- Ditambahkann beberapa buah batu didih dan dipanaskan sampai sisa larutan lebih kurang 15-20 mL, kemudian didinginkan pada suhu kamar
- Dipindahkan ke dalam labu ukur 50 mL secara kuantitatif
- Ditambahkan 10 mL larutan buffer amonium asetat, dan 2 mL larutan fenantrolin, dikocok. Kemudian ditambahkan akuades hingga tanda batas, dikocok.
- Didiamkan 10-15 menit (sampai pembentukan kompleks yang stabil)
- Dibaca absorbansi larutan dengan spektrofotometer pada panjang gelombang 510 nm - Dihitung konsentrasi larutan sampel menggunakan persamaan regresi yang diperoleh
dari kurva kalibrasi
- Dilakukan pengerjaan blanko dengan akuades seperti pada pengerjaan terhadap sampel.
Tugas dalam laporan:
1. Apa yang dimaksud dengan panjang gelombang optimum?
2. Kenapa harus dicari waktu kestabilan warna?
PERCOBAAN IV KROMATOGRAFI GAS
Pendahuluan
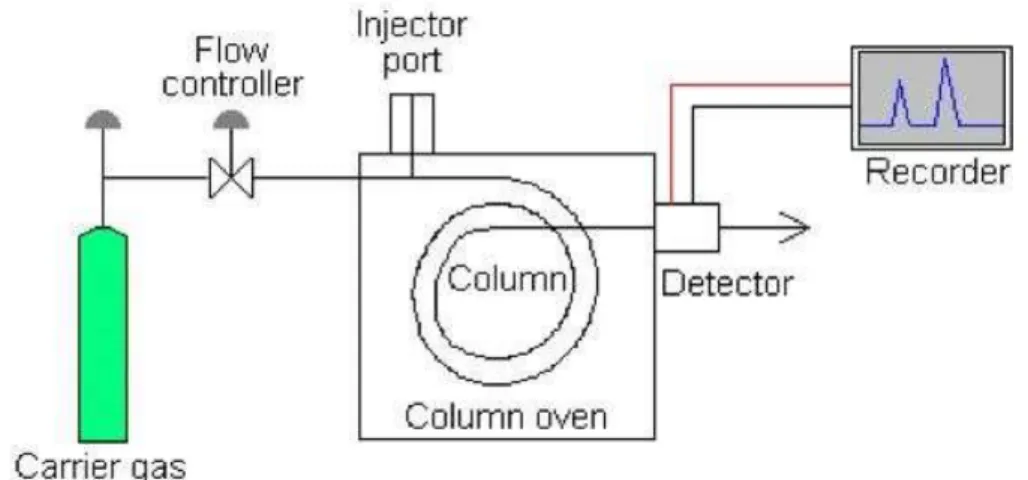
Kromatografi gas berfungsi sebagai alat pemisah atau pemurni, misalnya untuk pemisahan senyawa kompleks, senyawa organometalik, minyak atsiri dan lain-lain. Semua alat kromatografi gas harus mempunyai gas pembawa yang bertindak sebagai fassa gerak.
Disamping itu, terdapat kolom yang biasanya terletak di dalam oven. Sedangkan sampel dimasukkan ke dalam aliran gas melalui sistem injeksi dan komponen-komponen yang telah dipisahkan dideteksi oleh detektor yang digabungkan dengan rekorder. Secara sederhana, peralatan kromatografi gas dapat dilihat pada Gambar 7.
Gambar 7. Instrumen GC
http://faculty.virginia.edu/analyticalchemistry/GC%20VOC%20Final/instrumentation.jpg
GC sebagai alat analisis
GC mempunyai beberapa keunggulan yaitu dapat digunakan untuk menganalisis hampir berbagai jenis senyawa organik, terutama yang mudah menguap, waktu analisis cepat dan sensitivitasnya tinggi. Dalam bidang analisis lingkungan, kegunaan GC untuk penentuan kadar polutan di udara, gas buang kendaraan bermotor dan industri, analisis residu pestisida dan bahan-bahan berbahaya lainnya. dalam industri makanan: penentuan kandungan aditif makanan, kandungan lemak dan bahan-bahan nutrien lainnya. dalam bidang industri, obat dan farmasi: kontrol kualitas produk dan bahan baku, dalam bidang industri gas dan minyak bumi. Analisis GC terdiri dari analisis kualitatif dan kuantitatif.
Analisis kualitatif dengan GC
Analisis kualitatif dilakukan dengan melihat waktu retensi sampel. Waktu retensi suatu senyawa ditentukan oleh kesetimbangan distribusi antara fasa diam dan fasa gerak.
Waktu retensi suatu komponen besifat khas. Mungkin saja waktu retensi beberapa senyawa sama, tetapi dengan mengetahui asal dari sampel dan data-data lainnya kita dapat mengidentifikasi komponen yang ada di dalam campuran.
Analisis kuantitatif dengan GC
Analisis kuantitatif dari suatu campuran dapat dilakukan dengan cara menghitung luas area menggunakan standar addisi dan standar internal. Persiapan yang perlu dilakukan jika menganalisis dengan GC
Agar analisis dapat berhasil dengan baik dan penentuan kondisi operasi optimum cepat didapatkan, maka harus dilakukan:
1. Pemilihan teknis standar yang digunakan, misalnya teknik internal standar atau standar addisi
2. Pemilihan kolom yang akan digunakan, fasa diamnya, panjang kolom 3. Pemilihan jenis detektor yang digunakan, misalnya FID, TCD, dll
4. Penentuan kecepatan aliran gas pendorong, temperatur kolom, temperatur ruang injeksi, dan detektor
5. Menyesuaikan parameter dalam detektor dan integrator/rekorder, misalnya chart speed, attenuation, sensitivity, range, dll Prosedur kerja
1. Dibuat variasi konsentrasi larutan standar etanol 1; 5; 10; 15; 20; dan 25%
2. Disediakan larutan sampel
3. Masing-masing larutan sampel dan larutan standar diinjeksikan ke dalam injektor, sehingga akan diperoleh kurva regresi liniernya
4. Dihitung kosentrasi sampel menggunakan persamaan regresinya
Pertanyaan
1. Apa syarat gas yang dapat digunakan sebagai gas pembawa?
2. Apakah dalam GC volume sampel mempengaruhi resolusi?
3. Apa usahanya jika diperoleh konsentrasi sampel melebihi konsentrasi standar?
4. Ada berapa jenis kolom yang saudara ketahui? Apa kelebihan dari masing-masing kolom tersebut?
PERCOBAAN V
ANALISIS GUGUS FUNGSI PADA BIOSORBEN DARI BIJI ALPUKAT
(Persea americana Mill)
MENGGUNAKAN SPEKTROSKOPI FOURIER TRANSFORM INFRARED (FTIR)1. Tujuan Praktikum
1. Mengetahui prinsip kerja dari instrument FTIR spekrofotometer
2. Mengetahui dan terampil cara pengoperasian alat instrument FTIR spekrofotometer 3. Mampu mengidentifikasi gugus fungsional senyawa organic dari biosorben biji
alpukat hasil analisa FTIR.
2. Pendahuluan
Spektrofotometer adalah alat untuk mengukur transmitan atau absorban suatu sampel sebagai fungsi panjang gelombang. Sedangkan pengukuran menggunakan spektrofotometer ini, metoda yang digunakan sering disebut dengan spektrofotometri. (Basset,1994).
Spektrofotometri dapat dianggap sebagai perluasan suatu pemeriksaan visual dengan studi yang lebih mendalam dari absorbsi energi. Absorbsi radiasi oleh suatu sampel diukur pada berbagai panjang gelombangdan dialirkan oleh suatu perekam untuk menghasilkan spektrum tertentu yang khas untuk komponen yang berbeda . (Khopkar, 2003)
Salah satu peralatan spekrofortometer adalah Fourier Transform Infra Red (FTIR) yang merupakan suatu alat yang digunakan untuk analisis senyawa kimia. Spektra inframerah suatu senyawa dapat memberikan gambaran dan struktur molekul senyawa tersebut. Spektra IR dapat dihasilkan dengan mengukur absorbsi radiasi, refleksi atau emisis di daerah IR.
Daerah inframerah pada spektrum gelombang elektromagnetik mencakup bilangan gelombang 1400 cm-1 hingga 10 cm-1( Nurul 2016).
Spektroskopi inframerah adalah suatu metode analisis yang didasarkan pada penyerapan sinar inframerah. Fungsi utama spektroskopi inframerah adalah untuk mengenal struktur molekul (gugus fungsional). Spektroskopi inframerah grafik dari persentasi transmitansi dengan panjang gelombang atau penurunan frekuensi. Tiap lekukan yang disebut gelombang atau puncak menunjukkan adsorbsi dari radiasi inframerah oleh cuplikan pada frekuensi tersebut (Iskandar, 2007). Teknik spektroskopi IR digunakan untuk mengetahui gugus fungsional mengidentifikasi senyawa, menentukan struktur molekul, mengetahui kemurnian dan mempelajari reaksi yang sedang berjalan. Kegunaan paling penting dari
spektroskopi inframerah pada praktikum ini adalah untuk identifikasi gugus fungsi senyawa organik, karena spektrumnya sangat kompleks dan terdiri dari banyak puncak-puncak.
Spektrum inframerah mempunyai sifat fisik dan karakteristik yang khas yang artinya senyawa yang berbeda akan mempunyai spektrum yang berbeda (Hayati, 2007). Selain itu, masing-masing kelompok fungsional menyerap sinar inframerah pada frekuensi yang unik.
Sebagai contoh, sebuah gugus karbonil, C = O, selalu menyerap sinar inframerah pada 1670- 1780 cm-1 meregangkan (Silverstein, 2002).
Cahaya tampak terdiri dari beberapa range frekuensi elektromagnetik yang berbeda dimana setiap frekuensi bisa dilihat sebagai warna yang berbeda. Radiasi inframerah juga mengandung beberapa range frekuensi tetapi tidak dapat dilihat oleh mata. Pengukuran pada spektrum inframerah dilakukan pada daerah cahaya inframerah tengah (mid-infrared) yaitu pada panjang gelombang 2.5 - 50 μm atau bilangan gelombang 4000 - 200 cmˉ¹. Energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul. Pita absorbsi inframerah sangat khas dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi.
Metoda ini sangat berguna untuk mengidentifikasi senyawa organik dan organometalik (Dachriyanus, 2004).
Adapun prinsip kerja dari FTIR adalah cahaya dari sumber cahaya akan dipecah oleh sistem cermin menjadi dua berkas cahaya, satu berkas untuk rujukan dan lainnya untuk contoh. Setelah masing-masing melewati rujukan dan contoh maka kedua berkas ini digabung kembali dalam alat pemenggal (chopper, berupa cermin) dan selanjutnya diarahkan secara bergantian masuk dan didifraksi oleh suatu kisi sehingga berkas tersebut terpecah menurut panjang gelombang. Kemudian oleh alat detector, beda intensitas antara kedua berkas tadi diukur pada masing-masing panjang gelombangnya, dan terakhir informasi ini diteruskan ke alat perekam yang menghasilkan spectrum berwujud gambar/grafik (Sari, 2010).
3. Metodelogi
a. Peralatan yang digunakan
- Lumpang dan alu
- FTIR (IR prestige-21 shimadzu)
- Spatula
- Penyaring/ayakan 100-200 mesh - Oven
b. Bahan kimia yang digunakan
- Bubuk biosorben biji apukat - Kristal KBr
- Alkohol atau chloroform untuk pembersih - Aquades
c. Cara kerja
1) Preparasi sampel
1. Biji alpukat dipisahkan dari daging buah dan dibersihkan menggunakan air kran.
2. Kulit ari pada biji alpukat dibuang dan dicuci dengan akuades.
3. Biji alpukat ditumbuk kasar menjadi beberapa bagian dan dikeringkan di bawah sinar matahari selama seminggu.
4. Biji alpukat yang telah kering, digerus hingga menjadi bubuk dan diayak menggunakan ayakan lolos 100 dan tertahan pada 200 mesh.
5. Bubuk yang tertahan pada ayakan 200 mesh dimasukkan ke dalam beaker dan dicuci dengan larutan NaHCO3 1%.
6. Bubuk dikeringkan dalam oven pada suhu 115℃, setelah kering digerus kembali menggunakan lumpang dan alu.
7.
Bubuk diayak menggunakan ayakan 100 dan 200 mesh. Bubuk biji alpukat yang tertahan pada ayakan 200 mesh disimpan di dalam desikator.2) Penggunaan alat
1. Dihidupkan alat instrumen FTIR dengan menekan tombol on/off. Kemudian buka software FTIR “IR Solution” yang tersedia pada komputer,lalu dklik kiri pada opsi Measure pilih Measurement lalu pilih Initialize.
2. Ditunggu 20 detik hingga muncul tiga lampu hijau di komputer.
3. Dilakukan background dengan mengklik icon BKG disudut kanan pada computer dan ditunggu selama 45 detik.
4. Kemudian sampel dimasukkan ke dalam sample cell dan perangkat IR siap digunakan
3) Analisis sampel
1. Sediankan sampel biosorben biji alpukat digerus dengan KBr dengan perbandingan 1:100 sampai tercampur dengan baik
2. kemudian hidupkan instrumen FTIR dan diukur absorbansi blanko awal yaitu bubuk KBr
3. kemudian sampel dimasukkan ke alat dengan tempat sampel yang khusus untuk sampel padatan dan bubuk dengan spatula.
4. Sampel di ukur dan akan terbaca oleh spektrum yang akan diterjemahkan sebagai gugus fungsi yang berada pada biosorben biji alpukat.