PENGUKURAN ARUS PADA SENYAWA K
PENGUKURAN ARUS PADA SENYAWA K 33Fe(CN)Fe(CN)66 MENGGUNAKAN METODE
MENGGUNAKAN METODE VOLTAMETRI SIKLIKVOLTAMETRI SIKLIK
Shofi Fajriah Ilmi
Shofi Fajriah Ilmi
11, Ika Rachmawati
, Ika Rachmawati
22, Zulhan Arif M.Si
, Zulhan Arif M.Si
33Departemen Kimia, Fakultas Matematika da
Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan n Ilmu Pengetahuan AlamAlam Institut Pertanian Bogor, Kampu
Institut Pertanian Bogor, Kampus IPB Dramaga-Indonesias IPB Dramaga-Indonesia Abstrak
Abstrak
Elektroda
Elektroda pasta pasta karbon karbon telah telah banyak banyak digunakan digunakan dalam dalam pengukuran pengukuran kadar kadar suatusuatu sampel
sampel dalam dalam larutan larutan dengan dengan menggunakan menggunakan voltametri. voltametri. Pada Pada percobaan percobaan ini ini telah telah dibuatdibuat elektroda pasta karbon untuk pengukuran larutan K
elektroda pasta karbon untuk pengukuran larutan K 33 Fe(CN) Fe(CN)66menggunakan teknik voltametrimenggunakan teknik voltametri siklik,
siklik, digunakan digunakan larutan larutan elektrolit elektrolit KCl. KCl. Dari Dari percobaan percobaan diperoleh diperoleh parameter parameter yang yang baikbaik untuk pengukuran volatmetri siklik ini yaitu daerah pemayaran -0,5-1 V, kecepatan untuk pengukuran volatmetri siklik ini yaitu daerah pemayaran -0,5-1 V, kecepatan pemayaran pada kecepatan
pemayaran pada kecepatan 100 mV/s, dan konsentrasi ana100 mV/s, dan konsentrasi analat sebesar 0,1000 M lat sebesar 0,1000 M ..
Pendahuluan Pendahuluan
Metode yang digunakan untuk menganalisis sampel saat ini sangat beragam. Hal ini Metode yang digunakan untuk menganalisis sampel saat ini sangat beragam. Hal ini dilakukan untuk memperoleh informasi mengenai sampel yang diteliti. Dalam elektroanalisis dilakukan untuk memperoleh informasi mengenai sampel yang diteliti. Dalam elektroanalisis dipelajari cara-cara analisis sampel dengan metode pendekatan menggunakan teknik elektro. dipelajari cara-cara analisis sampel dengan metode pendekatan menggunakan teknik elektro. Salah satu metode yang ada di dalamnya ialah metode voltametri. Voltametri adalah metode Salah satu metode yang ada di dalamnya ialah metode voltametri. Voltametri adalah metode elektrokimia yang mengamati kelakuakn arus- potensial. Potensial divariasi secara sistematis elektrokimia yang mengamati kelakuakn arus- potensial. Potensial divariasi secara sistematis dari spesi kimia yang mengalami oksidasi- reduksi di permukaan elektroda. Arus yang dari spesi kimia yang mengalami oksidasi- reduksi di permukaan elektroda. Arus yang dihasilkan sebanding dengan konsentrasi spesi kimia di dalam larutan. Semua unsur yang dihasilkan sebanding dengan konsentrasi spesi kimia di dalam larutan. Semua unsur yang dapat mengalami oksidasi reduksi di permukaan elektroda dapat dianalisis
dapat mengalami oksidasi reduksi di permukaan elektroda dapat dianalisis secara voltametri.secara voltametri. Keunggulan voltametri dibandingkan metode lainnya adalah penyediaan cuplikan Keunggulan voltametri dibandingkan metode lainnya adalah penyediaan cuplikan yang sederhana dan waktu analisis yang cepat. Penyediaan cuplikan yang diperlukan yang sederhana dan waktu analisis yang cepat. Penyediaan cuplikan yang diperlukan biasanya han
biasanya hanya pelarutaya pelarutan tn tanpa pemekatan anpa pemekatan dan pemidan pemisahan unsursahan unsur- - unsur unsur mayornya, sehinggamayornya, sehingga mengurangi sumber kesalahan dengan batas deteksi sampai 0,1 µg/L dengan peralatan yang mengurangi sumber kesalahan dengan batas deteksi sampai 0,1 µg/L dengan peralatan yang tidak begitu mahal (Adrian 1995). Namun tetap saja ada kekurangan yaitu dalam analisis tidak begitu mahal (Adrian 1995). Namun tetap saja ada kekurangan yaitu dalam analisis biasanya
biasanya analisis analisis voltametri voltametri berasal berasal dari dari dekomposisi dekomposisi tidak tidak sempurna sempurna sehingga sehingga masih masih adaada ion- ion yang tidak dalam keadaan bebas, masih terikat dengan matriks sehingga tidak dapat ion- ion yang tidak dalam keadaan bebas, masih terikat dengan matriks sehingga tidak dapat terdeteksi. Pelarutan dan dekomposisi bahan biasa dilakukan dengan campuran asam kuat terdeteksi. Pelarutan dan dekomposisi bahan biasa dilakukan dengan campuran asam kuat dengan hidrogen peroksida (Iswani 2002)
dengan hidrogen peroksida (Iswani 2002)
Sel voltametri terdiri dari elektroda kerja, elektroda pembantu, dan elektroda Sel voltametri terdiri dari elektroda kerja, elektroda pembantu, dan elektroda pembanding
pembanding dimana dimana ketiganya ketiganya tercelup tercelup dalam dalam sel sel voltametri voltametri yang yang berisi berisi larutan larutan sampelsampel seperti ditunjukkan pada Gambar 1.
Gambar 1 Skema sel voltametri
Potensial luar (V) diberikan antara elektroda kerja dan elektroda pembanding. Bila ada reaksi oksidasi maupun reduksi pada elektroda kerja, arus yang dihasilkan dilewatkan ke elektroda pembantu, sehingga reaksi yang terjadi pada elektroda pembantu akan berlawanan dengan
reaksi yang terjadi pada elektroda kerja.
Voltametri siklik adalah teknik yang digunakan untuk memperoleh informasi kualitatif tentang reaksi elektrokimia. Voltametri siklik merupakan suatu metode pengukuran elektrokimia potensiodinamik. Bentuk gelombang potensial yang digunakan pada analisis elektrokimia merupakan bentuk gelombang linear, yaitu potensial yang secara kontinyu diubah sebagi fungsi linear terhadap waktu. Volatmetri siklik dilakukan dengan memayar potensial dari V1 ke V2 dan mengembalikannya ke V1 pada kecepatan payar tertentu.
Gambar 2 Profil waktu vs tegangan pada voltametri siklik
Hasil pengukuran voltametri siklik dapat digunakan untuk menentukan sifat termodinamika proses redoks, sifat kinetik reaksi transfer elektron dan reaksi adsorpsi. Scan potensial dan kurva yang dihasilkan pada voltametri siklik ditunjukkan pada Gambar 3.
Elektroda pasta karbon merupakan elektroda murah yang permukaannya dapat diperbaharui sehingga modifikasi elektroda pasta karbon banyak dipilih sebagai elektroda pengganti raksa Elektroda pasta karbon dapat dimodifikasi dengan mencampurkan modifier sebagai salah satu bahan elektroda (bulk modified ) maupun dengan melapisi permukaan elektroda dengan film tipis dari modifier/ surface modifier (Widodo dkk 2006).
Prosedur percobaan Alat dan Bahan
Alat yang digunakan pada percobaan ini adalah software E-Chem, labu takar, gelas piala, dan seperangkat alat gelas. Bahan yang digunakan meliputi grafit, parafin, lempeng
tembaga, elektroda reference, elektroda pembantu, KCl 1 M dan K 3Fe(CN)6.
Metode
Pembuatan elektrode pasta karbon
Ditimbang grafit sebanyak 70 mg dan dicampurkan dengan parafin cair 30 mg dalam wadah kecil, lalu dipindahkan ke dalam mortar dan digerus hingga membentuk pasta yang homogen (penggerusan dilakukan selama kurang lebih 30 menit). Sebuah tabung kaca dengan diameter 2.5 mm digunakan sebagai badan elektrode. Kawat tembaga digunakan sebagai penghubung elektrode ke sumber listrik dimasukkan ke dalam tabung hingga tersisa ruang kosong sekitar 3 mm pada ujung tabung (untuk merekatkan kawat dengan tabung digunakan lem lilin). Kemudian pasta dimasukkan ke ujung tabung tersebut hingga penuh dan padat. Permukaan elektrode kemudian digosok menggunakan kertas minyak.
Penentuan jendela potensial
Larutan K 3Fe(CN)6 dimasukkan ke dalam sel pengukuran. Elektrode kerja karbon
dihubungkan ke penjepit buaya berwarna hijau, elektrode pembanding Ag/AgCl ke penjepit berwarna kuning, dan elektroda platina dihubungkan ke penjepit berwarna merah. Elektrode dicelupkan ke dalam larutan dalam sel pengukuran Potensiostat dipastikan telah menyala dan program Echem dibuka dan dipilih teknik voltametri siklik. Teknik pengukuran diatur
sehingga laju alir menjadi 100 mV/s, jendela potensial diatur dari 0 Volt hingga 1 Volt. Pengaruh kecepatan payar terhadap arus puncak
Teknik pengukuran diatur dan laju payar divariasikan pada 100 mV/s, 150 mV/s, 200 mV/s, dan 250 mV/s pada jendela potensial yang telah ditentukan pada langkah sebelumnya. Pengukuran dilakukan 3 kali ulangan.
Pengaruh konsentrasi analat terhadap arus puncak
Larutan analat dibuat berbagai macam konsentrasi, yaitu 1 mM, 5 mM, dan 8 mM dari larutan induk 1 mM K 3Fe(CN)6 dengan pelarut KCl 1 M. Pengukuran dilakukan pada
jendela potensial dan kecepatan payar yang sesuai. Pengukuran masing-masing konsentrasi dilakukan 3 kali ulangan. Hasil yang diperoleh diolah dan ditentukan nilai arus oksidasi dan reduksinya. Selanjutnya voltamogram yang didapatkan diolah dalam software Origin.
Pembahasan
Percobaan ini menggunakan senyawa Fe(CN)63- dengan larutan KCl sebagai larutan
elektrolit. Larutan elektrolit berfungsi sebagai medium penghantar dengan transfer muatan melalui pergerakan ion-ion elektrolit tersebut. Elektroda yang digunakan pada pengukuran ini adalah elektroda karbon sebagai elektoda kerja, elektroda Ag/AgCl sebagai elektroda pembanding, dan elektroda platina sebagai elektroda pembantu. Elektroda karbon yang digunakan dibuat seteliti mungkin agar memperoleh voltamogram yang baik. Elektroda pembantu yang digunakan adalah platina (Pt). elektroda padat Pt ini memiliki kelebihan yaitu dapat digunakan pada daerah potensial yang lebih luas. Platina dapat digunakan pada +1,2 V
–
(-0,2) Volt (vs EKJ) dalam suasana asam dan +0,7 V–
0,1 V dalam suasana basa.Faktor-faktor yang memengaruhi pengukuran ion dengan metode voltametri siklik ini adalah scan rate, waktu akumulasi, elektroda tidakreproducible, sampling rate dannoise.
Percobaan ini akan menentukan jendela potensial, kecepatan payar, dan konsentrasi analat terhadap arus puncak. Cara kerja dari voltameter pada percobaan ini adalah dialirkan gas nitrogen ke dalam larutan selama beberapa saat. Hal ini dilakukan untuk membebaskan larutan dari oksigen terlarut. Adanya oksigen terlarut dalam larutan akan menyebabkan reaksi redoks pada permukaan elektroda sehingga akan terlihat puncak-puncak oksigen pada voltamogram. Puncak- puncak oksigen tersebut akan mengganggu analisis jika memberikan puncak pada potensial yang mirip dengan potensial analit.
Pengujian awal dilakukan untuk menentukan jendela potensial yang baik pada proses pengukuran. Penentuan jendela potensial dilakukan untuk mengetahui kisaran jendela potensial yang cocok untuk pengukuran analit sampel dengan kecepatan payar tertentu. Jika voltamogram dengan jendela potensial yang telah ditentukan menghasilkan voltamogram yang terpotong atau tidak membentuk siklik yang baik, maka jendela potensial yang dipakai tidak cocok (Fatimah & Endarko 2013). Senyawa yang dianalisis adalah Fe(CN)63- dalam
larutan elektrolit KCl dan diperoleh jendela potensial yang baik pada daerah pemayaran -0,5-1,0 V ditunujukkan pada Gambar 4.
Gambar 4 Voltamogram siklik jendela potensial -0,5-1,0 V larutan KCl 0,1 M
I (µA)
Selanjutanya penentuan kecepatan yang baik pada analisis ini. Digunakan pengujian kecepatan payar 50 mV/s, 100 mV/s, dan 200 mV/s dan diperoleh kecepatan payar yang paling baik adalah 100 mV/s. Pengaruh kecepatan payar terhadap arus oksidasi maupun arus reduksi dapat dilihat dengan seberapa besar arus yang dihasilkan. Kecepatan payar tinggi akan menghasilkan arus oksidasi dan arus reduksi yang semakin meningkat dan sebanding dengan jendela potensial yang digunakan pada analisis.
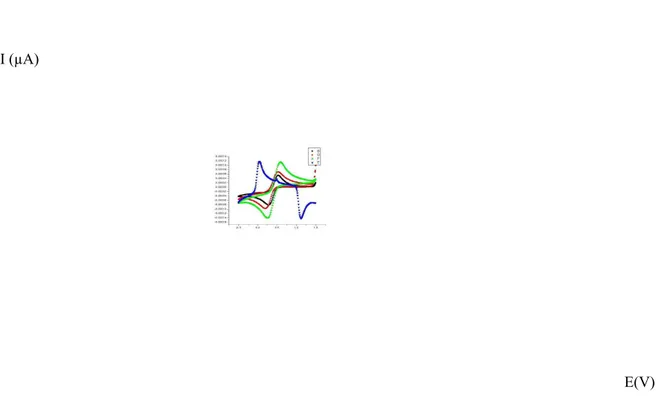
Gambar 5 Voltamogram siklik Fe(CN)63- pengaruh kecepatan payar terhadap arus puncak (B) 50 mV/s (D) 100 mV/s (E) 200 mV/s
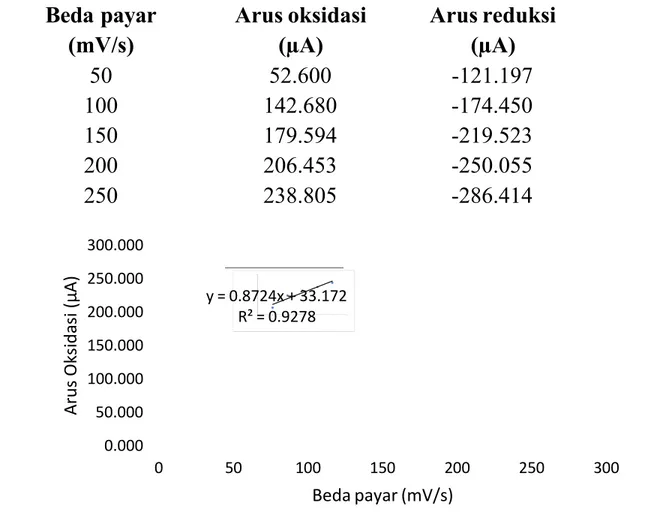
Tabel 1 Data arus oksidasi dan arus reduksi pada konsentrasi Fe(CN)63-0,02 M terhadap perbedaan laju payar.
Gambar 6 Data arus oksidasi dan arus reduksi pada konsetrasi K 3Fe(CN)60,02 M terhadap perbedaan laju payar.
Beda payar (mV/s) Arus oksidasi (µA) Arus reduksi (µA) 50 52.600 -121.197 100 142.680 -174.450 150 179.594 -219.523 200 206.453 -250.055 250 238.805 -286.414 I A E V y = 0.8724x + 33.172 R² = 0.9278 0.000 50.000 100.000 150.000 200.000 250.000 300.000 0 50 100 150 200 250 300 A r u s O k s i d a s i ( µ A ) Beda payar (mV/s)
Selanjutnya pengaruh konsentrasi analit terhadap arus puncak dapat juga diamati secara voltametri siklik pada gambar 7. Perilaku redoks pada senyawa Fe(CN)63- ini diuji
dengan melihat pengaruh konsentrasi analit terhadap arus oksidasi dan arus reduksi senyawa tersebut. Arus yang diukur pada analisis voltametri terjadi akibat adanya reaksi redoks pada permukaan elektroda. Arus oksidasi terbentuk saat potensial dipayar ke nilai yang lebih positif dan terjadi reaksi oksidasi. Arus oksidasi biasanya bernilai sama dengan arus reduksinya, pengaruh konsentrasi berbanding lurus terhadap arus reduksi dan arus oksidasinya. Semakin tinggi konsentrasi senyawa analit maka arus oksidasi dan arus reduksi semakin tinggi (Taufik 2013).
Gambar 7 Voltamogram pengaruh konsentrasi analit terhadap arus (B) Konsentrasi 0,02 M (D) Konsentrasi 0.04 M (F) Konsentrasi 0,06 M (H) Konsentrasi0,08 M (J) Konsentrasi 0,10 M
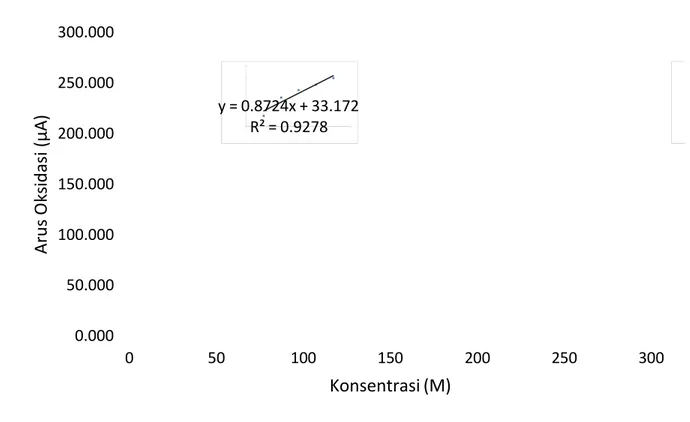
Tabel 2 Data arus oksidasi dan arus reduksi pada kecepata n payar 100 mV/s [K 3Fe(CN)6] (M) Arus oksidasi (µA) Arus reduksi (µA) 0.0200 102.420 -124.640 0.0400 294.359 -379.358 0.0600 319.200 -513.200 0.0800 456.000 -652.000 0.1000 597.600 -836.200 I (µA) E(V)
Gambar 8 Kurva hubungan konsentrasi K 3Fe(CN)6terhadap arus oksidasi pada kecepatan
payar 100 mV/s
Faktor kesalahan yang mungkin terjadi dalam percobaan adalah ketidak homogenan pencampuran antara pasta karbon dengan parafin, pengisian pasta karbon ke dalam batang
kaca yang tidak rapat dan merata, ketidakstabilan arus listrik yang mengalir pada voltameter sehingga menghasilkan noise saat pemayaran, dan kontaminasi zat lain pada analat.
Simpulan
Perilaku redoks senyawa K 3Fe(CN)6 dapat diamati menggunakan metode voltametri.
Perilaku reaksi redoks senyawa K 3Fe(CN)6 terhadap arus puncak diamati dengan variasi
kecepatan payar, dan konsentrasi analat. Berdasarkan data yang diperoleh dapat disimpulkan bahwa kecepatan payar dan konsentrasi analit berbanding lurus dengan tingginya arus puncak
yang dihasilkan pada anode dan katode. Daftar Pustaka
Adrian W Bott. 1995. Voltammetry determination of trace concentration of metals in the environment.Current Spearation 14(1):1-4.
Fatimah I, Endarko.2013.Fabrikasi dan karakterisasi elektroda untuk system capasitive deionization (CDI) pada proses desalinasi larutan NaCl dengan metode Freezing-thawing Jurnal Teori Dan Aplikasi Fisika1(02): 137-144.
Iswani. 2002. Preparasi Contoh Lingkungan dan Makanan untuk Mendukung Deteksi Logam Berat secara Elektrokimia Pelarutan Kembali. Prosiding Pertemuan dan Presentasi Ilmiah Penelitian Dasar dan Teknologi nuklir, P3TM-BATAN.
Taufik M. 2013. Elektrode Pasta Karbon Termodifikasi Kuersetin untuk Analisis Ion Tembaga(II) Secara Voltammetri. Bogor (ID): Fakultas Matematika Dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
y = 0.8724x + 33.172 R² = 0.9278 0.000 50.000 100.000 150.000 200.000 250.000 300.000 0 50 100 150 200 250 300 A r u s O k s i d a s i ( µ A ) Konsentrasi (M)
Widodo D.S, Kuncaka A, dan Siswanta D. 2006. Sintesis organik dengan pendekatan elektrokimia : reduksi kurkumin. Jurnal Semnas Kimia.2(1):13-15.

![Tabel 2 Data arus oksidasi dan arus reduksi pada kecepata n payar 100 mV/s [K 3 Fe(CN) 6 ] (M) Arus oksidasi](https://thumb-ap.123doks.com/thumbv2/123dok/2499121.2766857/6.1167.211.766.1107.1316/tabel-data-oksidasi-reduksi-kecepata-payar-arus-oksidasi.webp)