1 LAPORAN PENELITIAN MANDIRI
KAJIAN KADAR FENOLIK DAN FLAVONOID TOTAL BEBERAPA EKSTRAK DAUN KATUK (Sauropus androgynus)
Tim Pengusul
Ketua Peneliti (Ni Putu Ermi Hikmawanti, M.Farm.) Anggota Peneliti (Sofia Fatmawati, M.Farm., Apt.)
PROGRAM STUDI FARMASI FAKULTAS FARMASI DAN SAINS
UNIVERSITAS MUHAMMADIYAH PROF. DR. HAMKA 2019
iii ABSTRAK
Indonesia dengan kekayaan keanekaragaman hayatinya, mempunyai potensi yang sangat besar untuk menyediakan obat alami, mengingat banyak tumbuhan obat yang tumbuh dengan baik, salah satunya Sauropus androgynus (L.) Merr. yang biasa disebut katuk. Bagian yang sering digunakan pada katuk adalah daunnya.
Berdasarkan pengalaman empiris, daun katuk memiliki khasiat memperlancar produksi susu. Kandungan senyawa kimia daun katuk dapat berbeda tergantung pada pelarut, jenis ekstraksi, waktu panen dan tempat tumbuh. Proses pengeringan simplisia juga dapat menyebabkan perubahan kuantitatif dalam komposisi senyawa fitokimia pada tanaman tersebut. Penelitian ini bertujuan untuk mengetahui kadar fenolik dan flavonoid total dari beberapa ekstrak daun katuk, yaitu perbedaan pengeringan, ukuran partikel, konsentrasi pelarut, metode ekstraksi, dan maserasi bertingkat. Berdasarkan uji yang dilakukan kadar fenolik total tertinggi terdapat pada ekstrak dengan perbedaan pengeringan yaitu oven dengan kadar 47,08 mgGAE/g. Sedangkan kadar flavonoid total tertinggi terdapat pada ekstrak bertingkat pelarut etil asetat dengan kadar 88,79 mgQE/g.
Kata kunci: Sauropus androgynus, fenolik, flavonoid
iv DAFTAR ISI
HALAMAN PENGESAHAN ABSTRAK
DAFTAR ISI DAFTAR TABEL
DAFTAR GAMBAR
BAB 1. PENDAHULUAN Latar Belakang Masalah Masalah Penelitian Tujuan Penelitian
BAB 2. TINJAUAN PUSTAKA Roadmap penelitian
BAB 3. METODE PENELITIAN Alur Penelitian
Lokasi Penelitian Alat dan Bahan Prosedur kerja Analisis Data
BAB 4. HASIL DAN PEMBAHASAN BAB 5. SIMPULAN
DAFTAR PUSTAKA
v
DAFTAR TABEL
Halaman Tabel 1. Hasil Ekstraksi Daun Katuk Perbedaan Pengeringan 10 Tabel 2. Hasil Ekstraksi Daun Katuk Perbedaan Ukuran Partikel 10 Tabel 3. Hasil Ekstraksi Daun Katuk Perbedaan Konsentrasi Pelarut 11 Tabel 4. Hasil Ekstraksi Daun Katuk Dengan Metode Ultrasonik 11 Tabel 5. Hasil Ekstraksi Daun Katuk Metode Ekstraksi Bertingkat 11 Tabel 6. Hasil karakteristik perbedaan pengeringan 12 Tabel 7. Hasil Karakteristik perbedaan ukuran partikel 12 Tabel 8. Hasil Karakteristik perbedaan konsentrasi pelarut 12 Tabel 9. Hasil Karakteristik metode ekstraksi ultrasonik 13 Tabel 10. Hasil Karakteristik Ekstrak Bertingkat Daun Katuk 13 Tabel 11. Hasil Penapisan Fitokimia Ekstrak Bertingkat 15 Tabel 12. Hasil Penapisan Fitokimia Pengaruh Pengeringan 15 Tabel 13. Hasil Penapisan Fitokimia Variasi Konsentrasi Etanol 15 Tabel 14. Hasil Penapisan Fitokimia Variasi Ukuran Partikel 16 Tabel 15. Hasil Penapisan Fitokimia Metode Ultrasonik 16
Tabel 16. Hasil Absorbansi Asam Galat 17
Tabel 17. Hasil Absorbansi Kuersetin 19
vi
DAFTAR GAMBAR
Halaman
Gambar 1. Kurva Kalibrasi Asam Galat 17
Gambar 2. Diagram hasil kadar fenolik total ekstrak perbedaan
pengeringan, ukuran partikel, dan konsentrasi pelarut 18 Gambar 3. Diagram hasil kadar fenolik total ekstrak ekstraksi ultrasonik
dan maserasi bertingkat 19
Gambar 4. Kurva Kalibrasi Kuersetin 20
Gambar 5. Diagram hasil kadar flavonoid total ekstrak perbedaan
pengeringan, ukuran partikel, dan konsentrasi pelarut 21 Gambar 6. Diagram hasil kadar flavonoid total ekstrak ekstraksi
ultrasonik dan maserasi bertingkat 21
1
BAB 1. PENDAHULUAN A. Latar Belakang Masalah
Indonesia dengan kekayaan keanekaragaman hayatinya, mempunyai potensi yang sangat besar untuk menyediakan obat alami, mengingat banyak tumbuhan obat yang tumbuh dengan baik, salah satunya Sauropus androgynus (L.) Merr.
yang biasa disebut katuk. Bagian yang sering digunakan pada katuk adalah daunnya. Berdasarkan pengalaman empiris, daun katuk memiliki khasiat memperlancar produksi susu (Santoso 2013). Pada hasil penelitian ilmiah daun katuk juga mempunyai banyak manfaat lain salah satunya adalah antioksidan.
Dalam beberapa penelitian telah diketahui bahwa daun katuk mengandung senyawa flavonoid yang berkorelasi dengan aktivitas antioksidan (Bunawan et al.
2015). Kandungan senyawa kimia daun katuk dapat berbeda tergantung pada pelarut, jenis ekstraksi, waktu panen dan tempat tumbuh. Proses pengeringan simplisia juga dapat menyebabkan perubahan kuantitatif dalam komposisi senyawa fitokimia pada tanaman tersebut (Bernard et al. 2014).
Proses pengeringan diperlukan untuk mempertahankan kualitas simplisia serta mengurangi risiko kontaminasi bakteri atau jamur selama penyimpanan (Bernard et al. 2014). Pada dasarnya pengeringan simplisia dapat dilakukan dengan pengeringan secara alamiah dan dengan alat pengering. Pengeringan alamiah dapat menggunakan sinar matahari langsung, tidak langsung dan di angin-angin, sedangkan pengeringan buatan dapat menggunakan lemari pengering atau oven. Suhu pengeringan tergantung pada bahan dan cara pengeringan, bahan dapat dikeringkan pada suhu 30º-90ºC tapi suhu terbaik tidak melebihi 60ºC (Depkes 2008).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut. Terdapat dua macam metode ekstraksi yaitu metode konvensional dan non konvesional. Metode konvesional antara lain maserasi, perkolasi, reperkolasi, sokletasi sedangkan metode non konvensional salah satunya yaitu Ultrasound Assited Extraction (UAE). Untuk mendapatkan ekstrak dengan kadar terbaik diperlukan pemilihan ukuran partikel simplisia yang baik. Ukuran partikel berpengaruh terhadap kelarutan ekstrak dan kandungan dari senyawa simplisia tersebut. Pada penelitian Zhu (2011) menunjukan bahwa perbedaan ukuran partikel berpengaruh pada kadar isoflavon yang didapat. Selain itu pada penelitian lain, perbedaan ukuran partikel beras hitam mempengaruhi rendemen ekstrak dan kandungan total antosianin hasil maserasi (Maulida dan Guntarti 2015).
Fenolik merupakan senyawa yang memiliki ciri adanya cincin aromatik dapat berjumlah satu atau dua gugus hidroksil. Fenolik merupakan senyawa metabolit sekunder yang terdapat pada banyak tumbuhan, fungsi senyawa fenol yang sudah diketahui adalah sebagai pembangun dinding sel, pigmen bunga dan enzim.
Senyawa fenol yang memiliki gugus hidroksil lebih dari dua disebut dengan senyawa polifenol. Contoh dari senyawa polifenol yaitu tanin, flavonoid, melanin, dan lignin (Hanani 2015). Dalam penelitian sebelumnya ekstrak etanol 95% daun katuk memiliki kadar senyawa fenolik yang cukup besar dengan 1,49 mg GAE/g berat segar dan 8,71 mg GAE/g berat kering (Andarwulan et al. 2010).
2
Flavonoid merupakan salah satu senyawa alam yang hadir hampir di sebagian besar tanaman. Umum nya kelompok flavonoid yang terdapat dalam tanaman terdiri dari flavon, flavan, flavonol, katekin dan antosianidin (Amić et al. 2003).
Sejumlah tanaman obat yang mengandung flavonoid telah dilaporkan memiliki aktivitas antioksidan, antibakteri, antivirus, antiradang, antialergi dan antikanker (Miller 2016). Efek antioksidan senyawa ini disebabkan oleh penangkapan radikal bebas melalui donor atom hidrogen dari gugus hidroksil flavonoid. Beberapa penyakit seperti arterosklerosis, kanker, diabetes, parkinson, alzheimer, dan penurunan kekebalan tubuh telah diketahui dipengaruhi oleh radikal bebas dalam tubuh (Amić et al. 2003). Salah satu cara efektif untuk menangkap radikal bebas yang terdapat dalam tubuh tersebut adalah penggunaan antioksidan (Sarastani et al. 2002).
B. Masalah Penelitian
Berdasarkan uraian diatas dapat dirumuskan masalah yaitu : berapakah kadar fenolik dan flavonoid total dari beberapa ekstrak daun katuk ?
C. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kadar fenolik dan flavonoid total dari beberapa ekstrak daun katuk.
3
BAB 2. ROADMAP PENELITIAN
fitokimia daun katuk yakni alkaloid, terpenoid, saponin, tanin, polifenol, glikosida dan flavonoid (Susanti dkk.
2003).
Fenolik dan flavonoid sebagai sumber antioksidan
Penentuan kadar fenolik dan flavonoid dengan metode kolorimetri
dapat diukur dengan metode spektrofotometri
Variasi pengeringan simplisia, konsentrasi pelarut, metode ekstraksi, ukuran partikel, ekstrak bertingkat mempengaruhi perolehan
hasil ekstraksi
4
BAB 3. METODE PENELITIAN A. Alur Penelitian
1. Pengumpulan Bahan 2. Determinasi Tanaman
3. Pembuatan Simplisia Daun Katuk 4. Pembuatan Ekstrak Daun Katuk 5. Pemeriksaan Karakteristik Ekstrak 6. Penetapan Kadar Fenolik Total 7. Penetapan Kadar Flavonoid Total B. Lokasi Penelitian
Penelitian dilakukan di Laboratorium Fitokimia, Laboratorium Kimia Terpadu Jurusan Farmasi dan Sains Universitas Muhammadiyah Prof. Dr.
HAMKA Jakarta Timur.
C. Alat dan Bahan
Alat – alat yang digunakan dalam penelitian ini meliputi, neraca analitik, beaker glass, gelas ukur, erlenmeyer, ultrasonik, oven, ayakan, waterbath, rotary evaporator, moisture balance, spektrofotometer UV-Vis, labu ukur, spatel, mikropipet, dan peralatan gelas lainnya.
Bahan yang digunakan dalam penelitian ini meliputi, daun katuk, etanol 50%, etanol 70%, etanol 96%, n-heksan, etil asetat, Na2CO3 7,5%, asam galat, pereaksi Folin-Ciocalteau, aqua destilata, FeCl3, Pereaksi Bouchardat, Dragendroff, Mayer, HCl pekat, serbuk Mg, asam asetat anhidrat (AAA), H2SO4, Kuersetin, AlCl3, Metanol, Natrium Asetat, DPPH.
D. Prosedur kerja 1. Pengumpulan Bahan
Bahan yang digunakan untuk penelitian ini adalah daun katuk yang didapatkan dari Institut Pertanian Bogor.
2. Determinasi Tanaman
Determinasi tanaman dilakukan pada Pusat Studi Biofarmaka Tropika Institut Pertanian Bogor.
3. Pembuatan Simplisia Daun Katuk
Daun katuk disortasi basah, selanjutnya dicuci dengan air bersih dan mengalir. Selanjutnya dilakukan perajangan dan kemudian dibagi menjadi 3 bagian untuk masing-masing dikeringkan dengan cara diangin-anginkan pada suhu ruang, pada sinar matahari langsung, dan dengan oven pada suhu 50ºC.
Setelah pengeringan, dilakukan sortasi kering. Simplisia yang sudah kering selanjutnya diserbuk dengan cara ditumbuk dan diayak mesh 40. Serbuk yang diperoleh kemudian ditimbang (Depkes RI 1985).
4. Pembuatan Ekstrak Daun Katuk
Serbuk simplisia daun katuk direndam dengan pelarut sebanyak 1,5 liter (1:10) dalam maserator. Kemudian dibuat 5 replikasi dengan 150,0 gram serbuk tiap replikasi. Rendam selama 6 jam pertama sambil sekali-sekali diaduk, kemudian diamkan selama 24 jam. Sebanyak 150,0 g serbuk daun katuk dimasukan kedalam beaker glass tambahkan pelarut sebanyak 1,5 L (1:10) b/v
5
kemudian dimasukan kedalam ultrasonik dilakukan ekstraksi pada waktu 5, 15, dan 45 menit. Untuk masing-masing waktu ekstraksi dibuat 5 kali replikasi.
Ekstraksi berbantuan gelombang ultrasonik dilakukan dengan menggunakan ultrasonic cleaner model 14H dengan frekuensi 50/60 Hz. Setelah itu dilakukan penyaringan dengan menggunakan kain flanel dan kertas saring. Kemudian diulang metode yang sama sampai diperoleh ampas yang hasilnya negatif terhadap pereaksi tetes fenolik dan flavonoid serta larutan ekstrak yang relatif jernih. Ekstrak etanol yang diperoleh diuapkan pelarutnya dengan menggunakan vacuum rotary evaporator pada suhu 40oC-50oC, dan dilanjutkan dengan menggunakan waterbath sehingga diperoleh ekstrak yang kental. Perhitungan rendemen dari ekstrak etanol dihitung dengan cara menghitung jumlah ekstrak yang didapat dibagi dengan serbuk kering kemudian dikalikan 100% (Depkes RI 2008).
Rendemen Ekstrak (%) = Berat ekstrak kental
Berat Simplisia yang diekstraksi× 100%...(2) 5. Pemeriksaan Karakteristik Ekstrak
a. Uji Organoleptis
Pemeriksaan organoleptis terhadap ekstrak daun katuk meliputi pemeriksaan bau, bentuk, rasa dan warna.
b. Penetapan Kadar Abu
Ekstrak etanol ditimbang seksama sebanyak 2 gram, kemudian dimasukan kedalam krus silikat yang telah ditara, dipijarkan didalam tanur dan suhu dinaikan secara bertahap hingga 600°C (selisih suhu kurang lebih 25°C) sampai bebas karbon. Selanjutnya, didinginkan dalam desikator kemudian ditimbang. Kadar abu total dihitung terhadap berat bahan uji dan dinyatakan dalam % b/b (Dekpes RI 2008).
Kadar abu total(%)= Berat abu (gram)
Berat ekstrak (gram) ×100% ……... (3) c. Susut Pengeringan
Sebanyak1,0 gram ekstrak diletakan dalam wadah moisture content balance yang sebelumnya telah ditara dan dilihat bobot awal ekstrak. Lalu ekstrak dikeringkan pada suhu 105° C pada moisture content balance sampai diperoleh nilai bobot ekstrak yang konstan, kemudian dilihat bobot akhir ekstrak. Hasil dilihat sebagai nilai % MC (Arista 2013).
d. Penapisan fitokimia ekstrak daun katuk 1) Identifikasi Alkaloid
Sebanyak 50,0 mg ditambahkan HCl kemudian larutan dibagi menjadi
kedalam tiga tabung reaksi. Masing-masing tabung tersebut ditambahkan 2-3 tetes perekasi Mayer positif endapan putih, 2-3 tetes Dragendorff positif endapan jingga, dan 2-3 tetes Bouchardat positif endapan berwarna coklat sampai hitam (Marlinda et al. 2012).
6 2) Identifikasi Fenolik
Ekstrak sebanyak 50,0 mg didihkan selama 3 menit dalam air suling 10 ml setelah itu di dinginkan lalu disaring. Filtrat diencerkan hingga hampir tidak berwarna, lalu ditambahkan 1-2 tetes pereaksi FeCl3 jika jadi warna hijau sampai biru hitam menunjukkan adanya senyawa fenolik (Hanani 2015).
3) Identifikasi Flavonoid
Sebanyak 50,0 mg ekstrak ditambahkan 5 ml etanol dan dipanaskan selama 5 menit didalam tabung reaksi. Selanjutnya ditambah beberapa tetes HCl pekat.
Kemudian ditambahkan 0,2 g serbuk Mg. Hasil positif ditunjukkan dengan timbulnya warna merah tua selama 3 menit (Marlinda et al. 2012).
4) Identifikasi Saponin
Sampel 50,0 mg ekstrak kental ditambahkan 10 ml air panas, dinginkan dan kemudian kocok kuat-kuat selama 10 detik. Terbentuk buih yang stabil tidak kurang dari 10 menit setinggi 1 cm sampai 10 cm. Pada penambahan 1 tetes HCl 2N, buih tidak hilang maka positif menunjukkan adanya saponin (Depkes RI 1995).
5) Identifikasi Tanin
Sampel 50,0 mg ekstrak kental ditambahkan 1 ml air, dipanaskan pada suhu 100˚C selama 5 menit kemudian didinginkan dan saring. Filtrat ditambahkan 3 tetes larutan garam gelatin 10%. Hasil positif ditandai dengan adanya endapan putih menunjukkan adanya tanin (Hanani 2015).
6) Identifikasi Triterpenoid dan Steroid
Sebanyak 50,0 mg ekstrak ditambahkan asam asetat anhidrat hingga semua sampel terendam, lalu biarkan 15 menit kemudian ambil 6 tetes larutan lalu pindahkan kedalam tabung reaksi dan tambahkan 1-2 tetes HCl pekat. Terbentuk cincin kecoklatan atau violet positif triterpenoid dan terbentuk warna hijau positif steroid (Habibi et al. 2018).
6. Penetapan Kadar Fenolik Total a. Pembuatan Larutan Uji Konsentrasi
Ditimbang 50,0 mg ekstrak etanol daun katuk, kemudian dimasukan ke dalam labu ukur 25 ml, volume dicukupkan dengan etanol : air (1:1) hingga tanda batas.
b. Pembuatan Larutan Na2CO3 7,5%
Sebanyak 7,5 g Na2CO3 ditambah 80 ml air suling, kemudian didihkan sampai serbuk Na2CO3 larut sempurna. Setelah itu diamkan selama 24 jam, disaring dan diencerkan dengan air suling sampai volume 100 ml (Alfian dan Susanti 2012).
c. Pembuatan Larutan Asam Galat
Sebanyak 10,0 mg asam galat dilarutkan dalam 0,1 ml etanol, kemudian diencerkan dengan air suling sampai volume 100,0 ml (Alfian dan Susanti 2012).
7
d. Penentuan Panjang Gelombang Maksimum Asam Galat
Sebanyak 300 µL larutan asam galat konsentrasi 30 µg/ml ditambah 1,5 ml pereaksi Folin Ciocalteu (1:10), kemudian dikocok dan didiamkan selama 3 menit ke dalam larutan tersebut ditambah 1,2 ml larutan Na2CO3 7,5%, dikocok homogen dan diamkan pada suhu ruang kamar kemudian absorbansinya diukur pada panjang gelombang 600-850 nm (Alfian dan Susanti 2012).
e. Penentuan Operating Time
Sebanyak 300 µL larutan asam galat konsentrasi 30 µg/ml ditambah 1,5 ml reagen Folin Ciocalteu, kemudian dikocok dan didiamkan selama 3 menit.
Kedalam larutan tersebut ditambah 1,2 ml larutan Na2CO3 7,5%, dikocok homogen, dan diukur absorbansinya dalam rentang waktu 0-60 menit pada panjang gelombang maksimum (Alfian dan Susanti 2012).
f. Pembuatan Kurva Kalibrasi Asam Galat
Diambil sebanyak 300 µL larutan asam galat dari 5 konsentrasi yaitu 18, 30, 42, 54, dan 66 μg/ml menggunakan mikropipet dimasukkan dalam tabung reaksi, kemudian pada masing-masing konsentrasi ditambah 1,5 ml reagen Folin Ciocalteu (1:10) menggunakan mikropipet. Setelah didiamkan selama 3 menit, masing-masing larutan ditambah 1,2 ml larutan Na2CO3 7,5% menggunakan mikropipet dikocok homogen, dan didiamkan pada range operating time pada suhu kamar. Semua larutan diukur absorbansinya pada panjang gelombang 765,5 nm, kemudian dibuat kurva kalibrasi hubungan antara konsentrasi asam galat (μg/ml) dengan absorbansi.
g. Penentuan Kandungan Fenolik Total
Sebanyak 50,0 mg ekstrak etanol daun katuk dari masing-masing sampel dilarutkan sampai volume 25 ml di labu ukur yang berbeda dengan campuran etanol : aquadest (1:1) hingga diperoleh konsentrasi 2000 ppm. Larutan ekstrak yang diperoleh dipipet 300 μL dan ditambah 1,5 ml reagen Folin Ciocalteu dan dikocok. Didiamkan selama 3 menit, ditambah 1,2 ml larutan Na2CO3 7,5% dan didiamkan lagi pada waktu 60 menit. Absorbansi larutan ekstrak diukur dengan spektrofotometer UV-Vis pada panjang gelombang 756,5 nm. Dilakukan 3 kali pengulangan (Murtijaya dan Lim 2007).
7. Penetapan Kadar Flavonoid Total a. Pembuatan Larutan Kuersetin
Sebanyak 10,0 mg kuersetin kemudian dilarutkan dengan 10 ml metanol dalam labu ukur 10 ml sehingga diperoleh 1000 ppm. Dipipet 1 ml dan dilarutkan dengan metanol dalam labu ukur 10 ml sehingga diperoleh konsentrasi 100 ppm (Wahdaningsih et al. 2017).
b. Pembuatan Larutan Uji Konsentrasi
Sebanyak 100,0 mg ekstrak etanol daun katuk dari masing-masing perbandingan dilarutkan dengan metanol, kemudian dimasukan ke dalam labu ukur 10 ml, volume dicukupkan dengan metanol hingga tanda batas. Dipipet 7,5 ml ke dalam labu ukur 10 ml kemudian dicukupkan hingga tanda batas dengan metanol.
8 c. Penentuan Panjang Gelombang Maksimum
Diambil sebanyak 0,5 ml larutan kuersetin induk dipipet dimasukkan kedalam labu ukur, tambahkan dengan 1,5 ml metanol kemudian ditambahkan 0,1 ml AlCl3 10%, 0,1 ml natrium asetat (1M) (timbang sebanyak 2,0507 gram kemudian dilarutkan dengan aquadest 25 ml) dan dicukupkan dengan aquadest sampai 2,8 ml kemudian dikocok lalu didiamkan selama 30 menit. Lakukan pembacaan dengan Spektrofotometri UV-Vis pada panjang gelombang 400-600 nm (Wahdaningsih et al. 2017).
d. Penentuan Operating Time
Dari larutan induk kuersetin 1000 μg/ml dipipet 0,5 ml dimasukkan ke dalam labu ukur, tambahkan dengan 1,5 ml metanol dan ditambahkan pereaksi 0,1 ml AlCl3 10% , 0,1 ml natrium asetat (1M) dan 2,8 ml aquadest kemudian dibaca absorbansinya pada panjang gelombang maksimum pada waktu 60 menit sampai diperoleh absorbansi yang relatif konstan.
e. Pembuatan Kurva Standar Kuersetin
Dari larutan induk kuersetin 1000 ppm dibuat beberapa konsentrasi yaitu 33, 57, 81, 105 dan 129 ppm. Sebanyak 0,5 ml larutan kuersetin dari beberapa konsentrasi dipipet kemudian tambahkan dengan 1,5 ml metanol dan ditambahkan pereaksi 0,1 ml AlCl3 10%, 0,1 ml natrium asetat (1M) dan 2,8 ml aqua dest.
Selanjutnya larutan dikocok dan dibiarkan selama 60 menit pada suhu ruangan.
Ukur absorbansinya pada panjang gelombang maksimumyang diperoleh yakni 434 nm. Hingga diperoleh persamaan flavonoid total dihitung sebagai µg kuersetin per ml yg dihitung dengan persamaan y = bx ± a, dimana y adalah absorbansi sampel pada panjang gelombang 434 nm dan x adalah jumlah ekuivalen kuersetin (µg/ml) (Purwaningsih 2018).
f. Penetapan Kadar Flavonoid Total Dalam Ekstrak
Dipipet masing-masing konsentrasi 0,5 ml larutan uji ditambahkan dengan 1,5 ml metanol dan ditambahkan pereaksi 0,1 ml AlCl3 10% 0,1 ml natrium asetat (1M) dan aquadest 2,8 ml kemudian dibiarkan bereaksi selama 60 menit pada suhu ruangan. Ukur serapan pada panjang gelombang 434 nm. Lakukan sebanyak 3 kali pengulangan (Wahdaningsih et al. 2017).
E. Analisis Data
1. Kadar fenolik total dapat dihitung dengan rumus : F
=
C×v×Fpm
...(4)
Keterangan :
F = Kadar Total Fenolik
C = Konsentrasi asam galat (µm/ml) v = Volume total ekstrak
Fp = Faktor pengenceran m = Berat sampel (gram)
2. Kadar flavonoid total dapat dihitung dengan rumus:
F
=
C×v×Fpm
...(5)
9 Keterangan :
F = Kadar total flavonoid
C = Konsentrasi kuersetin (µm/ml) v = Volume total ekstrak
Fp = Faktor pengenceran m = Berat sampel (gram)
10
BAB 4. HASIL DAN PEMBAHASAN A. Determinasi
Determinasi merupakan tahap awal pada penelitian ini, yang bertujuan untuk mengdapatkan identitas yang benar dari tanaman yang akan diuji. Hasil dari determinasi menunjukkan bahwa tanaman yang diteliti adalah benar daun katuk (Sauropus androgynus (L.) Merr), yang berasal dari keluarga Phyllanthaceae.
Bahan aktif dalam daun katuk berupa senyawa flavonoid (kuersetin dan kaemferol), fenol, betakaroten, dan antosianin (Magdalena dkk 2015).
B. Hasil Ekstraksi
Sebanyak 150,0 gram serbuk daun katuk diekstraksi menggunakan metode maserasi. Metode maserasi dipilih agar kerusakan atau degradasi metabolit dapat diminimalkan (Hanani 2015). Metode maserasi cocok untuk bahan-bahan yang bersifat tidak tahan panas. Proses ekstraksi dilakukan menggunakan pelarut etanol 70%. Etanol 70% mengandung air sebesar 30%, sehingga dapat meningkatkan polaritas etanol. Selain itu, etanol lebih mudah menembus membran seluler sehingga dapat mengekstraksi bahan intraseluler dari tanaman yang digunakan (Tiwari et al. 2011). Maserasi dilakukan dengan membuat 5 replikasi dari setiap metode pengeringan, dan dilakukan pengulangan selama 2 kali berturut-turut dengan jumlah pelarut yang sama. Pengulangan dilakukan agar mendapatkan bobot ekstrak yang cukup, dan dapat menarik senyawa yang tertinggal pada pengulangan sebelumnya.
Pemekatan menggunakan vacuum rotary evaporator dilakukan pada suhu 50º C yang dibantu dengan alat vakum udara sehingga titik didih pelarut lebih rendah, penguapan berlangsung cepat sehingga dapat menghindari penguraian senyawa yang bersifat tidak tahan panas. Setelah itu pemekatan dilanjutkan dengan menggunakan waterbath pada suhu 50º C. Pemekatan bertujuan untuk memperoleh konsentrasi senyawa yang lebih besar dan memudahkan dalam penyimpanan (Hanani 2015). Hasil perhitungan rendemen menunjukan jumlah senyawa kimia yang terkandung dalam ekstrak.
Tabel 1. Hasil Ekstraksi Daun Katuk Perbedaan Pengeringan Pengeringan Berat ekstrak (g)
(Rata-rata ± SD)
Rendemen ekstrak (%) (Rata-rata ± SD)
Oven 46,89 ± 3,62 31,25 ± 2,41
Sinar Matahari Langsung 38,09 ± 3,31 25,39 ± 2,21
Angin-angin 54,40 ± 5,07 36,26 ± 3,38
Tabel 2. Hasil Ekstraksi Daun Katuk Perbedaan Ukuran Partikel Serbuk Simplisia Berat Ekstrak (g)
(Rata-rata ± SD)
Rendemen Ekstrak (%) (Rata-rata ± SD)
Tanpa Pengayakan 53,99 ± 5,11 35,99 ± 3,41
Dengan Pengayakan 54,08 ± 1,13 36,06 ± 0,75
11
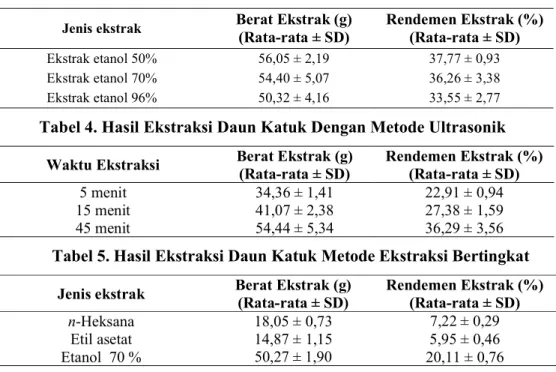
Tabel 3. Hasil Ekstraksi Daun Katuk Perbedaan Konsentrasi Pelarut Jenis ekstrak Berat Ekstrak (g)
(Rata-rata ± SD)
Rendemen Ekstrak (%) (Rata-rata ± SD)
Ekstrak etanol 50% 56,05 ± 2,19 37,77 ± 0,93
Ekstrak etanol 70% 54,40 ± 5,07 36,26 ± 3,38
Ekstrak etanol 96% 50,32 ± 4,16 33,55 ± 2,77
Tabel 4. Hasil Ekstraksi Daun Katuk Dengan Metode Ultrasonik Waktu Ekstraksi Berat Ekstrak (g)
(Rata-rata ± SD)
Rendemen Ekstrak (%) (Rata-rata ± SD)
5 menit 34,36 ± 1,41 22,91 ± 0,94
15 menit 41,07 ± 2,38 27,38 ± 1,59
45 menit 54,44 ± 5,34 36,29 ± 3,56
Tabel 5. Hasil Ekstraksi Daun Katuk Metode Ekstraksi Bertingkat Jenis ekstrak Berat Ekstrak (g)
(Rata-rata ± SD)
Rendemen Ekstrak (%) (Rata-rata ± SD) n-Heksana 18,05 ± 0,73 7,22 ± 0,29
Etil asetat 14,87 ± 1,15 5,95 ± 0,46
Etanol 70 % 50,27 ± 1,90 20,11 ± 0,76
C. Karakteristik Ekstrak a. Organoleptis ekstrak
Organolepstis ekstrak terdiri dari warna, bau, rasa dan bentuk, dengan menggunakan panca indera.
b. Kadar abu ekstrak
Penetapan kadar abu total dilakukan dengan tujuan untuk menunjukan kandungan senyawa organik dan anorganik dari tumbuhan seperti logam alkali, logam alkali tanah dan logam berat dan memberikan gambaran kandungan mineral internal dan eksternal yang berasal dari proses awal sampai terbentuknya ekstrak (Depkes 2000). Selain itu, penetapan kadar abu dimaksudkan untuk mengontrol jumlah pengotor seperti tanah dan pasir yang terdapat dalam bahan uji (Azizah dan Salamah 2013). Berdasarkan hasil, kadar abu total dari ekstrak daun katuk sudah sesuai dengan standar ekstrak yang ditentukan yaitu kadar abu tidak lebih dari 12 % (Depkes RI 1989).
c. Susut pengeringan ekstrak
Parameter susut pengeringan adalah pengukuran sisa ekstrak zat setelah dilakukan pengeringan pada temperatur 105o C selama 30 menit atau sampai beratnya konstan, dinyatakan dengan nilai persen. Susut pengeringan bertujuan untuk memberikan batasan maksimal tentang besarnya senyawa yang hilang pada proses pengeringan (Depkes RI 2000). Nilai susut pengeringan menunjukkan banyaknya senyawa yang mudah menguap yang terkandung dalam ekstrak (Suhendi et al. 2011). Berdasarkan hasil, susut pengeringan dari ekstrak daun katuk sudah sesuai dengan standar susut pengeringan simplisia secara umum yaitu tidak lebih dari 10% (Depkes RI 2000).
12
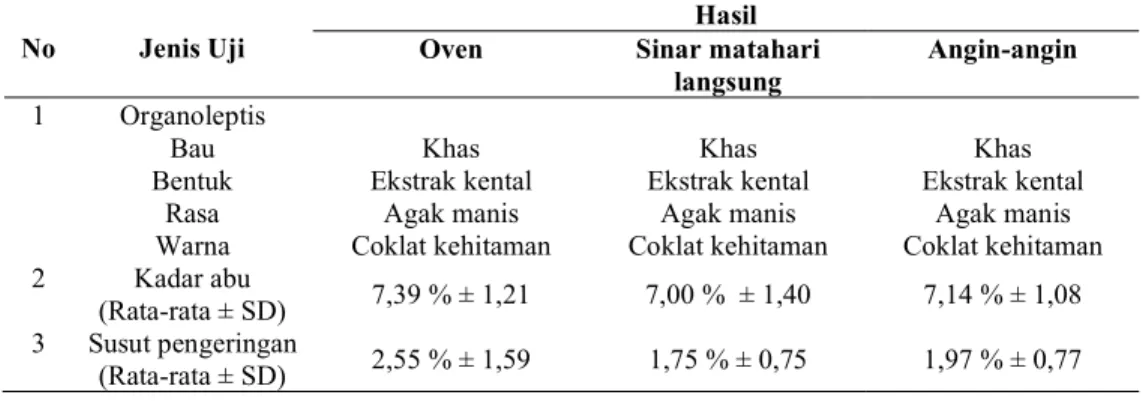
Tabel 6. Hasil karakteristik perbedaan pengeringan No Jenis Uji
Hasil
Oven Sinar matahari
langsung
Angin-angin 1 Organoleptis
Bau Khas Khas Khas
Bentuk Ekstrak kental Ekstrak kental Ekstrak kental
Rasa Agak manis Agak manis Agak manis
Warna Coklat kehitaman Coklat kehitaman Coklat kehitaman 2 Kadar abu
(Rata-rata ± SD) 7,39 % ± 1,21 7,00 % ± 1,40 7,14 % ± 1,08 3 Susut pengeringan
(Rata-rata ± SD) 2,55 % ± 1,59 1,75 % ± 0,75 1,97 % ± 0,77 Tabel 7. Hasil Karakteristik perbedaan ukuran partikel
Parameter Jenis Ekstrak
Tanpa Pengayakan Dengan Pengayakan Organoleptis
- Bentuk
- Bau
- Rasa - Warna
Ekstrak kental Khas Agak Manis Coklat Kehijauan
Ekstrak Kental Khas Agak Manis Coklat Kehijauan
Kadar Abu (Rerata* ± SD) 7,51% ± 1,07 7,94% ± 1,3
Susut Pengeringan (Rerata*± SD) 1,88% ± 0,71 1,97% ± 0,56 Tabel 8. Hasil Karakteristik perbedaan konsentrasi pelarut
No Jenis uji Hasil
Etanol 50% Etanol 70% Etanol 96%
1 Organoleptis
Bau Khas Khas Khas
Bentuk Ekstrak kental Ekstrak kental Ekstrak kental
Rasa Agak manis Agak manis Agak manis
Warna Coklat
tua
Coklat Tua
Coklat kehitaman
2 Kadar abu
(Rerata±SD) 5,74% ± 0,48 7,13% ± 1,08 8,23% ± 0,61 3 Susut pengeringan
(Rerata±SD) 4,96% ± 1,19 1,96% ± 0,75 4,06% ± 0,82
13
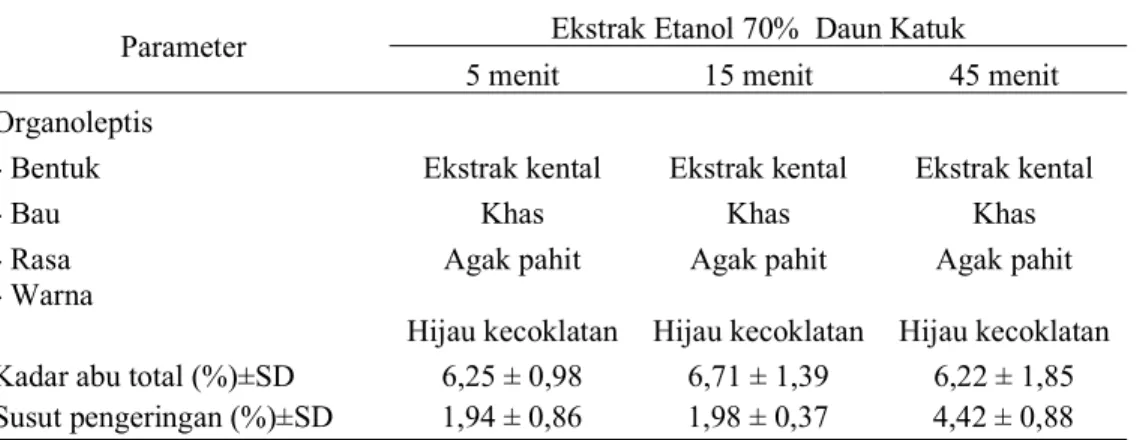
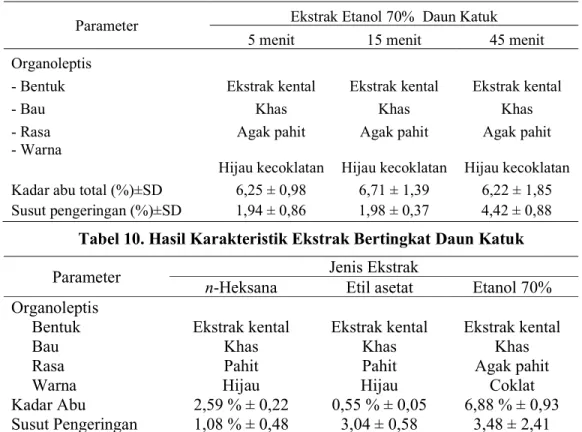
Tabel 9. Hasil Karakteristik metode ekstraksi ultrasonik Parameter Ekstrak Etanol 70% Daun Katuk
5 menit 15 menit 45 menit
Organoleptis
- Bentuk Ekstrak kental Ekstrak kental Ekstrak kental
- Bau Khas Khas Khas
- Rasa Agak pahit Agak pahit Agak pahit
- Warna
Hijau kecoklatan Hijau kecoklatan Hijau kecoklatan Kadar abu total (%)±SD 6,25 ± 0,98 6,71 ± 1,39 6,22 ± 1,85 Susut pengeringan (%)±SD 1,94 ± 0,86 1,98 ± 0,37 4,42 ± 0,88
Tabel 10. Hasil Karakteristik Ekstrak Bertingkat Daun Katuk
Parameter Jenis Ekstrak
n-Heksana Etil asetat Etanol 70%
Organoleptis Bentuk Bau Rasa Warna
Ekstrak kental Khas Pahit Hijau
Ekstrak kental Khas Pahit Hijau
Ekstrak kental Khas Agak pahit
Coklat Kadar Abu 2,59 % ± 0,22 0,55 % ± 0,05 6,88 % ± 0,93 Susut Pengeringan 1,08 % ± 0,48 3,04 ± 0,58 3,48 ± 2,41 D. Hasil Penapisan Fitokimia
Pemeriksaan alkaloid dilakukan dengan penambahan pereaksi Mayer, pereaksi Bouchardat dan pereaksi Dragendorff yang sebelumnya telah ditambahkan HCI.
Tujuan penambahan HCI adalah karena alkaloid bersifat basa sehingga biasanya diekstrak dengan pelarut yang mengandung asam (Harborne 1987). Pada pengujian ekstrak daun katuk dengan pengaruh pengeringan, variasi konsentrasi etanol, variasi ukuran partikel, dan variasi waktu metode ultrasonik dan ekstrak bertingkat identifikasi menggunakan pereaksi Mayer didapatkan hasil yang positif ditandai dengan terbentuknya endapan putih. Pada uji alkaloid dengan pereaksi Mayer, nitrogen pada alkaloid akan bereaksi dengan ion logam K+ dari kalium tetraiodomerkurat (II) membentuk kompleks kalium alkaloid yang mengendap.
Identifikasi alkaloid selanjutnya menggunakan reagen Dragendorff. Hasil positif reaksi ini ditandai dengan terbentuknya endapan jingga kecokelatan. Pada uji alkaloid menggunakan pereaksi Dragendorff, nitrogen digunakan unuk membentuk ikatan kovalen koordinat dengan K+ yang merupakan ion logam, sehingga memberikan hasil berupa endapan kalium-alkaloid dengan warna oranye. Identifikasi alkaloid selanjutnya menggunakan reagen Bouchardat. Pada uji ini hasil positif dengan ditandai terbentuknya endapan cokelat hingga kehitaman. Warna tersebut terbentuk karena nitrogen dari alkaloid membentuk kompleks dengan ion K+ dan ion I3- sehingga membentuk warna cokelat (Ergina dkk. 2014). Hasil positif didapatkan pada parameter yang menggunakan pelarut
14
etanol, yaitu pengaruh pengeringan, variasi konsentrasi etanol, variasi ukuran partikel, dan variasi waktu metaode ultrasonik, sedangkan pada ekstrak bertingkat, hasil positif ditunjukkan pada ekstrak etanol 70%, pada ekstrak n-heksana dan etil asetat menunjukan hasil negatif pada bouchardat dan dragendorf, hal ini dikarenakan sifat kelarutan alkaloid hanya sedikit pada bentuk basa sehingga alkaloid sedikit larut pada pelarut yang kurang polar (Hanani 2015).
Pemeriksaan flavonoid dilakukan dengan penambahan HCl pekat dan dilanjutkan dengan penambahan Mg. Penambahan logam Mg dan asam klorida pekat bertujuan untuk mereduksi inti benzopiron sehingga terbentuk garam flavilium berwarna merah dimana proses reduksi tersebut dilakukan dalam suasana asam dengan penambahan HCI pekat (Ergina dkk. 2014). Dari hasil pengujian tersebut terbentuknya perubahan warna intensif (Depkes RI 1989). Pada pengujian flavonoid kelima parameter ekstrak daun katuk terbentuk reaksi positif dengan ditandai warna merah.
Hasil positif juga terdapat pada uji fenolik ekstrak dengan menambahkan FeCl3 yang menghasilkan warna hijau kehitaman. Terbentuknya warna hijau kehitaman pada ekstrak setelah ditambahkan FeCl3 karena fenol akan membentuk kompleks dengan ion Fe3+ (Sulistyani 2011). Pada uji tanin dilakukan dengan penambahan NaCI dan larutan gelatin. Perubahan warna ini terjadi ketika penambahan NaCI dan gelatin ekstrak daun katuk menghasilkan endapan putih yang menunjukan mengandung senyawa tanin. Berdasarkan hasil yang didapatkan menunjukan bahwa ekstrak daun katuk memiliki tanin dengan ditandainya endapan putih.
Saponin umumnya berada dalam bentuk glikosida sehingga umumnya bersifat polar dan merupakan senyawa aktif pemukaan yang dapat menimbulkan busa jika dikocok dalam air. Busa pada uji terjadi karena saponin memiliki gugus polar dan non polar yang akan membentuk misel. Misel menyebabkan gugus polar akan menghadap ke luar dan gugus non polar menghadap ke dalam dan keadaan inilah yang tampak seperti busa (Harborne 1987). Pada penambahan HCI pekat beberapa ekstrak daun katuk dan dilakukan pengocokan menunjukan terbentuknya buih pada permukaan. Berdasarkan hasil yang didapatkan menunjukan bahwa beberapa ekstrak daun katuk memiliki saponin dengan ditandainya buih pada permukaan.
Identifikasi terpenoid dan steroid menggunakan pereaksi Lieberman-Bouchard (asam asetat anhidrat-H2SO4) menunjukkan hasil positif terpenoid pada ekstrak ditandai dengan terbentuknya cincin berwarna kecoklatan dan warna kehijauan yang menunjukan adanya steroid. Terbentuknya warna tersebut karena kemampuan senyawa steroid membentuk warna oleh H2SO4 dalam pelarut asam asetat anhidrid (Habibi dkk. 2018). Hasil yang diperoleh menunjukkan negatif pada uji triterpenoid tidak terbentuknya cincin dan hasil positif warna hijau pada uji steroid.
15
Tabel 11. Hasil Penapisan Fitokimia Ekstrak Bertingkat Senyawa yang di
deteksi
Jenis ekstrak
n – heksana Etil asetat Etanol 70%
Alkaloid
- Dragendorf - - +
- Bouchardat - - +
- Mayer + + +
Fenolik + + +
Flavonoid + + +
Saponin + + +
Tanin + + +
Terpenoid - - -
Steroid + + +
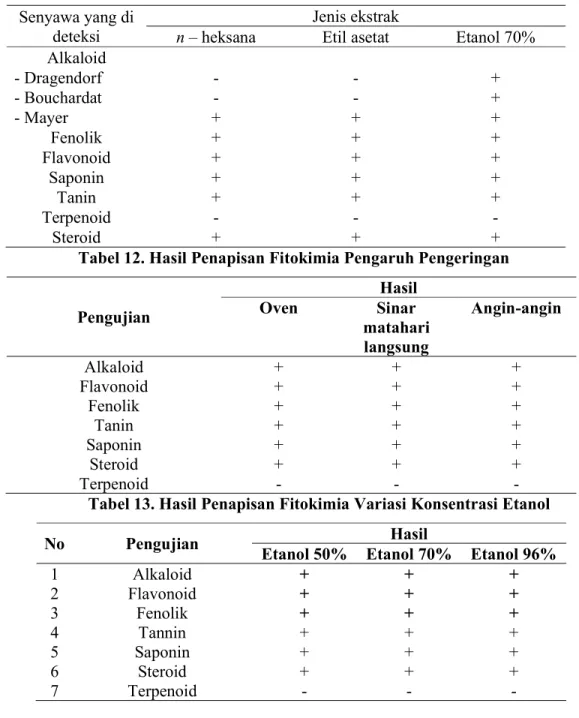
Tabel 12. Hasil Penapisan Fitokimia Pengaruh Pengeringan
Pengujian
Hasil
Oven Sinar
matahari langsung
Angin-angin
Alkaloid + + +
Flavonoid + + +
Fenolik + + +
Tanin + + +
Saponin + + +
Steroid + + +
Terpenoid - - -
Tabel 13. Hasil Penapisan Fitokimia Variasi Konsentrasi Etanol
No Pengujian Hasil
Etanol 50% Etanol 70% Etanol 96%
1 Alkaloid + + +
2 Flavonoid + + +
3 Fenolik + + +
4 Tannin + + +
5 Saponin + + +
6 Steroid + + +
7 Terpenoid - - -
16
Tabel 14. Hasil Penapisan Fitokimia Variasi Ukuran Partikel Senyawa Yang
Dideteksi
Hasil Ekstrak Tanpa
Pengayakan Dengan Pengayakan Mesh 40
Alkaloid + +
Fenolik + +
Flavonoid + +
Sanponin + +
Steroid + +
Terpenoid - -
Tanin + +
Tabel 15. Hasil Penapisan Fitokimia Metode Ultrasonik
Keterangan : (+) = ada senyawa, (-) = tidak ada senyawa E. Penetapan Kadar Fenolik Total
Untuk uji penetapan kadar fenolik total pada ekstrak etanol 70% daun katuk yang merujuk pada prosedur Chun et al. (2003) menggunakan metode Folin Ciocalteu. Metode ini merupakan metode yang paling umum digunakan untuk menentukan kandungan fenolik total dalam tanaman dengan pertimbangan bahwa dengan teknik ini pengerjaannya lebih sederhana dan reagen Folin Ciocalteu digunakan karena senyawa fenolik dapat bereaksi dengan Folin membentuk larutan yang dapat diukur absorbansinya.
Sebagai larutan standar atau pembanding digunakan asam galat yang merupakan salah satu senyawa fenolik alami dan stabil. Menurut Viranda (2009) asam galat merupakan termasuk senyawa fenolik turunan asam hidroksibenzoat yang tergolong asam fenolik yang tergolong asam fenolik sederhana. Asam galat yang direaksikan dengan Folin Ciocalteu menghasilkan warna kuning menandakan bahwa sampel mengandung fenolik, lalu ditambahkan dengan Na2CO3 7,5% sebagai pemberi suasana basa. Selama reaksi berlangsung, gugus hidroksil pada senyawa fenolik bereaksi dengan Folin, yang membentuk kompleks molibdenum-tungsten berwarna biru dengan struktur yang belum diketahui dan dapat dideteksi dengan spektrofotometer. Warna biru yang terbentuk akan semakin pekat, setara dengan konsentrasi ion fenolak yang terbentuk, artinya semakin besar konsentrasi senyawa fenolik maka semakin banyak ion fenolak yang akan mereduksin asam heteropoli (fosfomolibdat-
No Metabolit
Sekunder
Ekstrak etanol 70% daun katuk Menit 5 Menit 15 Menit 45
1. Alkaloid + + +
2. Flavonoid + + +
3. Fenol + + +
4. Saponin + + +
5. Tanin + + +
6. Terpenoid - - -
7. Steroid + + +
17
fosfotungstat) menjadi kompleks molibdenum-tungsten sehingga warna yang dihasilkan semakin pekat (Alfian dan Susanti 2012).
Untuk menentukan kadar fenolik total, terlebih dahulu dilakukan running panjang gelombang larutan standar asam galat dari range 400-800 nm menggunakan spektrofotometri UV-Vis. Panjang gelombang maksimal yang diperoleh yaitu 756,5 nm dan hasil operating time pada menit ke 60 menunjukkan waktu yang stabil sehingga saat preparasi didiamkan selama 60 menit.
Selanjutnya dilakukan pengukuran absorbansi larutan standar asam galat dari beberapa konsentrasi yang diukur pada panjang gelombang maksimal yang diperoleh. Pada panjang gelombang 756,5 nm asam galat mempunyai nilai absorbansi yaitu 0,3445 sehingga pada tahap selanjutnya panjang gelombang tersebut dipakai untuk mendapat hasil yang optimum. Hasil pengukuran absorbansi larutan standar asam galat dibuat kurva kalibrasi, hubungan antara konsentrasi dengan absorbansi diperoleh persamaan garis linear. Pembuatan kurva kalibrasi bertujuan untuk memperoleh persamaan regresi linear dan mengetahui linearitas metode analisis yang telah digunakan. Nilai r yang mendekati 1 menandakan bahwa persamaan regreasi tersebut telah linier dan simpangan baku yang kecil menunjukan ketepatan yang tinggi (Andayani et al. 2008).
Tabel 16. Hasil Absorbansi Asam Galat
Konsentrasi (ppm) Absorbansi
18 0,335
30 0,483
42 0,571
54 0,683
66 0,793
Gambar 1. Kurva Kalibrasi Asam Galat
Dari hasil percobaan ekstrak daun katuk dengan metode pengeringan oven memiliki kadar fenolik terbanyak dan terendah pada pengeringan angin-angin.
Kadar fenolik total yang rendah dari proses pengeringan angin-angin dapat dikarenakan faktor lamanya waktu pengeringan (21 hari) sehingga dikhawatirkan terjadinya penguraian senyawa fenolat oleh bantuan enzim fenolase yang terdapat dalam tumbuhan (Rivai et al. 2010). Ekstrak dengan ukuran partikel yang seragam memiliki hasil rerata kadar fenolik yang lebih tinggi sedangkan pada ekstrak yang tanpa pengayakan mendapatkan hasil rerata rendah. Semakin halus
y = 0,0093x + 0,1824 R² = 0,9944
r = 0,9972
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
0 10 20 30 40 50 60 70
Absorbansi
Konsentrasi (ppm)
18
ukuran partikel maka semakin banyak senyawa fenol yang tertarik. Pada perbedaan konsentrasi pelarut kadar fenolik terbanyak terdapat pada etanol 50%
dan terendah pada etanol 96%. Ini artinya bahwa kadar senyawa fenolik yang paling tinggi pada perbandingan konsentrasi pelarut ekstrak daun katuk sesuai dengan tingkat kepolaran dari pelarut, semakin tinggi kepolaran larutan maka senyawa fenolik akan semakin banyak terlarut, ini disebabkan karena senyawa fenolik memiliki kelarutan yang baik dalam air (Rivai dkk. 2013). Pada metode ekstraksi ultrasonik waktu 45 menit memiliki kadar fenolik terbanyak dari pada menit 15 menit dan 5 menit, sedangkan pada maserasi bertingkat kadar fenolik lebih besar terdapat pada pelarut etanol 70% dibandingkan n-heksan dan etil asetat. Berdasarkan hasil statistik, uji normalitas penetapan kadar fenolik total diperoleh nilai sig. > 0,05 sehingga data yang diperoleh terdistribusi normal. Hasil uji homogenitas diperoleh nilai sig. > 0,05. Hasil ini menunjukan data homogen.
Hasil uji ANOVA satu arah diperoleh nilai sig. < 0,05 , sehingga terdapat perbedaan bermakna antar perbedaan kelompok yang digunakan. Hasil uji Tukey terdapat perbedaan bermakna dengan nilai sig. (p < 0,05). Hal ini berarti pada setiap kelompok yang diuji terdapat perbedaan satu sama lain.
Gambar 2. Diagram hasil kadar fenolik total ekstrak perbedaan pengeringan, ukuran partikel, dan konsentrasi pelarut 47,08
32,95 25,32
45,11
25,27
42,18
25,33
16,25
0 5 10 15 20 25 30 35 40 45 50
Pengeringan Ukuran partikel Konsentrasi pelarut
Oven
Sinar matahari langsung Angin-angin
Diayak
Tanpa pengayakan Etanol 50%
Etanol 70%
Etanol 96%
19
Gambar 3. Diagram hasil kadar fenolik total ekstrak ekstraksi ultrasonik dan maserasi bertingkat
F. Penetapan Kadar Flavonoid Total
Analisis kuantitatif senyawa flavonoid total dengan menggunakan spektrofotometri UV-Vis dilakukan untuk mengetahui seberapa besar kadar flavonoid total yang terkandung pada ekstrak etanol 70% daun katuk. Penetapan kadar flavonoid ekstrak etanol 70% daun katuk menggunakan metode Chang (2002) yang menggunakan pembanding baku standar kuersetin. Digunakan kuersetin sebagai larutan standar karena kuersetin merupakan flavonoid golongan flavonol yang mempunyai gugus keto pada C-4 dan memiliki gugus hidroksil pada atom C-3 atau C-5 yang bertetangga dari flavon dan flavonol (Azizah 2014).
Untuk menentukan kadar flavonoid total, terlebih dahulu dilakukan penetapan panjang gelombang larutan standar kuersetin dari range 400-800 nm menggunakan spektrofotometri UV-Vis. Hasil penetapan menunjukkan panjang gelombang maksimum standar baku kuarsetin berada pada panjang gelombang 434 nm, hal ini dikarenakan reaksi kompleks AlCl3 yang menyebabkan pergeseran gelombang menjadi visible (tampak) yang ditandai dengan larutan menjadi kuning dan penambahan natrium asetat untuk mempertahankan panjang gelombang (Chang 2002). Panjang gelombang maksimum tersebut yang digunakan untuk mengukur serapan dari sampel.
Setelah didapat panjang gelombang maksimum, selanjutnya dilakukan operating time. Tujuan dilakukan operating time ini adalah mengetahui waktu yang stabil untuk senyawa bereaksi, hasil operating time menunjukan pada menit 60 menunjukkan waktu yang stabil sehingga saat preparasi didiamkan selama 60 menit. Selanjutnya dilakukan pengukuran absorbansi larutan standar kuersetin dari beberapa konsentrasi yang diukur pada panjang gelombang maksimal. Hasil pengukuran larutan standar kuersetin didapat nilai absorbansi 0,6124 pada panjang gelombang 434 nm. Selanjutnya dibuat persamaan kurva standar yang diperoleh dari regresi linear antara kadar kuersetin pada sumbu x dan absorbansi pada sumbu y. Berdasarkan hasil pengukuran absorbansi larutan standar pada
43,07
24,54 19,81
0,57 2,95
16,71
0 5 10 15 20 25 30 35 40 45 50
Ultrasonik Maserasi bertingkat
Menit 45 Menit 15 Menit 5 n-heksan Etil asetat etanol 70%
20
berbagai konsentrasi maka kurva standar kuersetin diperoleh hubungan linear antara absorbansi dengan konsentrasi dengan persamaan regresi linear y = 0,0042 x ± 0,1897 dan nilai koefisien relasi (r) = 0,9965. Persamaan ini digunakan dalam penetapan kadar flavonoid total dari hasil pembacaan nilai absorbansi larutan sampel. Saat pembuatan kurva kalibrasi penting untuk diperhatikan agar absorban yang diperoleh berada dalam rentang 0,2-0,8 pada panjang gelombang 434,0 nm.
Tabel 17. Hasil Absorbansi Kuersetin
Konsentrasi (ppm) Absorbansi
33 0,319
57 0,447
81 0,527
105 0,615
129 0,738
Gambar 4. Kurva Kalibrasi Kuersetin
Dari hasil penetapan kadar flavonoid, kadar flavonoid total tertinggi terdapat pada ekstrak pengeringan angin-angin dan yang rendah terdapat pada pengeringan oven. Pengeringan sinar matahari langsung dan oven mengandung senyawa flavonoid rendah dapat dikarenakan oleh beberapa faktor salah satunya adalah suhu, suhu yang tinggi selama proses pengeringan dapat merusak sel sebagai akibat lepasnya air (Molyneux 2004). Hasil rata- rata kadar flavonoid dari tiap kelompok ekstrak menunjukan hasil bahwa kadar flavonoid pada ekstrak yang mempunyai ukuran partikel serbuk simplisia yang diayak lebih banyak menyari senyawa flavonoid dibanding ukuran partikel simplisia yang tidak diayak. Selain berpengaruh terhadap proses penyarian untuk mendapatkan rendemen terbaik, penyeragaman serbuk simplisia juga berpengaruh dalam mendapatkan kadar maksimal dalam ekstrak etanol 70% daun katuk. Pada ekstrak perbedaan konsentrasi pelarut kadar flavonoid tertinggi adalah pada konsentrasi etanol 50% dan yang terendah adalah konsentrasi etanol 96%. Hal ini dikarenakan perbedaan konsentrasi etanol dapat mengakibatkan perubahan polaritas pelarut sehingga mempengaruhi kelarutan senyawa bioaktif salah satunya ialah flavonoid (Zhang ddk 2009). Kadar flavonoid total tertinggi pada ekstrak dengan ekstraksi menggunakan ultrasonik diperoleh pada menit ke-45. Dikarenakan semakin lama waktu ekstraksi semakin tinggi pula kadar flavonoid yang didapat. Pada penelitian ini etil asetat memiliki kadar terbesar, hal ini dikarenakan kandungan senyawa
y = 0,0042x + 0,1897 R² = 0,9931
r = 0,9965
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
0 20 40 60 80 100 120 140
Absorbansi
Konsentrasi (ppm)
21
flavonoid yang terkandung pada daun katuk memiliki tingkat polaritas rendah yaitu dalam bentuk aglikon atau biasa disebut flavonoid aglikon, flavonoid aglikon memiliki sifat yang kurang polar, cenderung lebih mudah larut terhadap kloroform dan eter (Hanani 2015). Dari hasil statistik data yang diuji adalah normal karena nilai sig. yang didapat > 0,05 yang berarti data terdistribusi normal, data yang di analisis juga homogen karena nilai sig. > 0,05. Hasil uji Tukey terdapat perbedaan bermakna dengan nilai sig. (p < 0,05). Hal ini berarti pada setiap kelompok yang diuji terdapat perbedaan yang bermakna satu sama lain.
Gambar 5. Diagram hasil kadar flavonoid total ekstrak perbedaan pengeringan, ukuran partikel, dan konsentrasi pelarut
Gambar 6. Diagram hasil kadar flavonoid total ekstrak ekstraksi ultrasonik dan maserasi bertingkat
8,87
6,23 4,48
12,98
8,93
11,18 8,87
5,68
0 2 4 6 8 10 12 14
Pengeringan Ukuran
partikel Konsentrasi pelarut
Angin-angin
Sinar matahari langsung Oven
Diayak
Tanpa pengayakan Etanol 50%
Etanol 70%
Etanol 96%
14,12 11,15
7,43
55,57 88,79
6,23 0
10 20 30 40 50 60 70 80 90 100
Ultrasonik Maserasi bertingkat
menit 45 menit 15 menit 5 n-heksan etil asetat etanol 70%
22
BAB 5. SIMPULAN
A. Simpulan
Berdasarkan hasil penelitian ekstrak daun katuk dari perbedaan metode pengeringan, ukuran partikel, kensentrasi pelarut, metode ultrasonik dan maserasi bertingkat. Berdasarkan hasil statistik yang digunakan dapat disimpulkan bahwa terdapat adanya perbedaan yang bermakna pada kadar fenolik dan flavonoid total dari berbagai kelompok atau metode yang digunakan.
23
DAFTAR PUSTAKA
Alfian R., Susanti H. 2012. Penetapan Kadar Fenolik Total Ekstrak Metanol Kelopak Bunga Rosella Merah (Hibiscus sabdariffa Linn) Dengan Variasi Tempat Tumbuh secara Spektrofotometri. Pharmaciana, 2(1).
https://doi.org/10.12928/pharmaciana.v2i1.655.
Andarwulan N., Batari R., Agustini D., Bolling B., dan Wijaya H. 2010.
Flavonoid Content and Antioxidant Activity of Vegetables From Indonesia.
Food Chemistry, 121(4), 1231–1235.
https://doi.org/10.1016/j.foodchem.2010.01.033.
Andayani R, Yovita L, Maimunah. 2008. Penentuan Aktivitas Antioksidan, Kadar Fenolat Total dan Likopen pada Buah Tomat (Solanum Lycopersicum L).
Dalam : Jurnal Sains Dan Teknologi Farmasi. Vol 13 (1). Hlm. 31-37 Arista M. 2013. Aktivitas Antioksidan Ekstrak Etanol 80% dan 90% Daun Katuk
(Sauropus androgynus (L.) Merr.). Dalam : Jurnal Ilmiah Universitas Surabaya 2 (2): 1-16
Azizah B dan Salamah N. 2013. Standarisasi Parameter Non Spesifik dan Perbandingan Kadar Kurkumin Ekstrak Etanol dan Ekstrak Terpurifikasi Rimpang Kunyit. Dalam: Jurnal Ilmiah Kefarmasian Vol. 3, No. 1. Hlm.
21-30.
Azizah, D.N. dan Faramayuda, F., 2014. Penetapan Kadar Flavonoid Metode AlCl3 Pada Ekstrak Metanol Kulit Buah Kakao (Theobroma Cacao L.).
Jurnal Ilmiah Farmasi, 2(2).
Bernard D., Sandra A., Elom S., Osei O., Daniel G., and Kwabena, A. 2014. The Effect of Different Drying Methods on the Phytochemicals and Radical Scavenging Activity of Ceylon Cinnamon (Cinnamomum zeylanicum) Plant Parts. European Journal of Medicinal Plants, 4(11), 1324–1335.
https://doi.org/10.9734/ejmp/2014/11990.
Bunawan H., Bunawan S. N., Baharum S. N., and Noor N. M. 2015. Sauropus androgynus (L.) Merr.. Induced Bronchiolitis Obliterans: From Botanical Studies to Toxicology . Evidence-Based Complementary and Alternative Medicine, 2015, 1–7. https://doi.org/10.1155/2015/714158.
Chang C. Yang M, Wen Hand Chern J. 2002. Estimation of Total Flavonoid Content in Propolis by Two Complementary Colorimetric Methods. Dalam Journal Of Food And Drug Analysis, Vol. 10 No. 3. Hlm. 178-182
Chun, O.K., Kim, D.O., and Lee, C.Y., 2003, Superoxide Radical Scavenging Activity of The Major Polyphenols in Fresh Plums. Journal Of Agricultural and Food Chemistry, 51, 8067-8072.
Depkes RI. 1985. Cara Pembuatan Simplisia. Jakarta : Departemen Kesehatan Republik Indonesia. Hlm. 1-8.
Depkes RI. 1989. Material Mediaka Indonesia Edisi V. Direktorat Jenderal Pengawasan Obat Dan Makanan.Jakarta.Hlm xvii.
24
Depkes RI. 1995. Materia Medica Indonesia Jilid VI. Direktorat Jendral Pengawasan Obat dan Makanan. Jakarta. Hlm. 321-337.
Depkes RI. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta : Direktorat Jendral Pengawasan Obat dan Makanan. Hlm. 10-15.
Depkes RI. 2008. Farmakope Herbal Indenesia. Jakarta : Departemen Kesehatan Republik Indonesia. Hlm. 10.
Ergina, Nuryanti S, Pursitasari ID. 2014. Uji Kualitatif Senyawa Metabolit Sekunder Pada Daun Palado (Agave angustidolia) Yang Diekstraksi Dengan Pelarut Air dan Etanol. Dalam: Jurnal Akademika kimia. 3(3) Hlm. 165-172 Habibi AI, Firmansyah RA, Setyawati SM.2018. Skrining Fitokimia Ekstrak n- Heksan Korteks Batang Salam (Syzygium polyanthum). Dalam: Indonesia Journal of Chemiscal Science. 7(1). Hlm: 1-4
Hanani E. 2015. Analisis Fitokimia. EGC, Jakarta. Hlm 116.
Magdalena S, Yuwono B, Wulan A. 2015. Pengaruh Daun Katuk (Sauropus androgynus (L.) Merr.) Terhadap Waktu Perdarahan ( Bleeding Time) Pada Tikus Wistar Jantan Sebagai Alternative Obat Antitrombotik. Pustaka Kesehatan 3(2): 212-216
Marlinda M, Sangi MS, Wuntu AD. 2012. Analisis Senyawa Metabolit Sekunder dan Uji Toksisitas Ekstrak Etanol Biji Buah Alpukat (Persea americana Mill.). Dalam: Jurnal MIPA UNSRAT Online 1. Manado. Hlm.24-28.
Maulida R, Guntarti A. 2015. Pengaruh Ukuran Partikel Beras Hitam (Oryza sativa L.) Terhadap Rendemen Ekstrak Dan Kandungan Total Antosianin.
Pharmaciana 5(1): 9-16
Miller A. L. 2016. Antioxidant Flavonoids : Structure , Function and Clinical Usage.
Molyneux P. 2004. The use of the stable free radical diphenylpicryl- hydrazyl (DPPH) for estimating antioxidant activity. Journal of Science and Technology, 26(2), 211–219. https://doi.org/10.1287/isre.6.2.144.
Murtijaya J. Lim YY. 2007. Antioxidant Properties of Phyllanthus amarus Extracts as Affected by Different Drying Methods. LWT-Food Sci.Technol, 40 : 1664-1669.
Purwaningsih Y, Diyan W, Erwin I. 2018. Kandungan Total Fenolik dan Aktivitas Antioksidan Ekstrak Etanol Kulit Labu Kuning (Cucurbita moschata).
Dalam: Jurnal Ilmiah Cendikia Eksakta. Stifar “Yayasan Pharmasi Semarang”. Semarang. Hlm 30-35.
Rivai H., dan Andalas U. 2017. Pengaruh Cara Pengeringan Dengan Oven , Kering Angin dan Cahaya Matahari Langsung Terhadap Mutu Simplisia Sambiloto. Jurnal Farmasi Higea. Vol. 6, No. 2 Hal. 126-132.
Rivai, H., Nurdin, H., Suyani, H., dan Bakhtiar,A., 2010, Pengaruh cara pengeringan terhadap perolehan ekstraktif, kadar senyawa fenolat dan aktivitas antioksidan dari Daun Dewa (Gynura pseudochina (L.) DC.), Majalah Obat Tradisional, 15(1), 26-33.
25
Santoso U. 2013. Katuk, Tumbuhan Multi Khasiat. Universitas Bengkulu.
Bengkulu.
Sarastani D., Soekarto S. T., Muchtadi T. R., Fardiaz D., dan Apriyantono, A.
2002. Aktivitas Antioksidan Ekstrak dan Fraksi Ekstrak Biji Atung ( Parinarium glaberrimum Hassk .). Jurnal. Teknol. Dan Industri Pangan, XIII(2), 149–156.
Suhendi A, Nurcahyanti, Muhtadi, Sutrisna EM. 2011. Aktivitas Antihiperurisemia Ekstrak Air Jinten Hitam (Coleus ambonicus Lour) Pada Mencit Jantan Galur Balb-C dan Standarisasinya. Dalam: Majalah Farmasi Indonesia. 22(2), 77-84.
Sulistyani N, Marliana E. 2011. Aktivitas Antifungi Ekstrak Etanol Batang Binahong (Anredera Cardifolia (Tenoe) Steen) terhadap Candida albicans serta Skrining Fitokimia. Dalam : Jurnal Ilmiah Kefarmasian Universitas Ahmad Dahlan Yogyakarta. Hlm. 51-62
Tiwari P, Kumar B, Kaur M, Kaur G, Kaur H. 2011. Phytochemical Screening and Extraction: A Review. Dalam: International Pharmaceutica Sciencia.
Vol.1, Issue 1.
Viranda P.M, 2009, Pengujian kandungan Senyawa yang terdapat dalam Tomat, Jurnal Fakultas Kedokteran. Universitas Indonesia.
Wahdaningsih S, Subagus W, Sugeng R, Retno M. 2017. Penetapan Kadar Fenolik Total dan Flavonoid Total Ekstrak Metanol dan Fraksi Asetat Kulit Buah Naga Merah (Hylocereus polyrhizus (F.A.C.WEBWER) Britton dan Rose). Dalam : Jurnal Ilmiah Farmasi Universitas Sam Ratulangi 6 (3):
295-301.
Zhang, L. Y Shan, K Tang, R Putheti. 2009. Ultrasound-assited extraction flavonoid of lotus (Nelumbo nuficera Gaertn) leaf and evaluation of its anti- fatigue activity. International of Phisical Scinece 4(8):418-422.
Zhu X, Lin H, Xie J, Chen S, dan Wang P. 2011. Homogenate Extraction of Isoflavones from soybean Meal by Orthogonal Design. Journal of Science and Industrial Research 70(6): 455-460