Untuk mengetahui zat pencemar yang terkandung di dalam air, analisis juga dapat dilakukan dengan menggunakan metode ini. Kelarutan secara kualitatif didefinisikan sebagai interaksi spontan dua atau lebih zat untuk membentuk dispersi molekul yang homogen, dan secara kuantitatif didefinisikan sebagai konsentrasi zat terlarut dalam larutan jenuh pada suhu tertentu. Faktor-faktor yang dapat mempengaruhi kelarutan suatu zat adalah suhu, pH, sifat pelarut dan juga keberadaan ion-ion lain dalam larutan.
Konstanta hasil kali kelarutan (Ksp) adalah hasil kali konsentrasi ion dalam larutan jenuh, dipangkatkan dengan masing-masing koefisien reaksi. Nilai hasil kali kelarutan (Ksp) suatu senyawa ionik yang sulit larut dapat memberikan informasi mengenai kelarutan senyawa tersebut dalam air. Reaksi pengendapan adalah reaksi yang membentuk endapan dalam larutan atau padatan lain selama reaksi kimia.
Kelarutan (endapan) garam yang mengandung anion asam lemah dipengaruhi oleh pH larutan, hal ini disebabkan adanya kombinasi proton dengan anion endapan. Garam anorganik lebih larut dalam air dibandingkan pelarut organik seperti alkohol atau asam asetat. Kelarutan endapan dalam air berkurang jika dilarutkan dalam larutan yang mengandung ion serupa (salah satu ion penyusun endapan) dibandingkan dengan air saja.
Semakin kecil koefisien aktivitas dua ion, semakin besar hasil kali konsentrasi molar ion-ion yang dihasilkan.
INDIKATOR
PENGENDAPAN
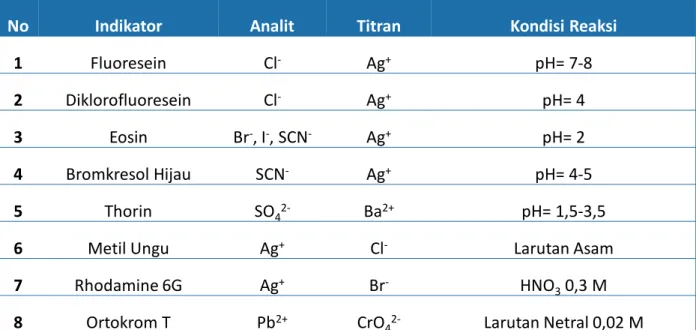
Ada beberapa jenis indikator kimia yang digunakan pada proses titrasi pengendapan berdasarkan metode titrasi. Metode Volhard: menggunakan ion Fe3+ untuk membentuk kompleks berwarna dengan ion tiosianat, SCN-. Cara kerja indikator adsorpsi adalah indikator ini merupakan asam lemah atau basa organik lemah yang dapat membentuk endapan dengan perak.
Penyerapan terjadi di permukaan. Dalam titrasi ini tujuannya adalah untuk memastikan permukaan endapan selebar mungkin agar perubahan warnanya terlihat sejelas mungkin, sehingga endapan harus berukuran koloid. Semakin jauh titrasi dilakukan, semakin sedikit kelebihan ion X; Pada titik ekuivalen, semua X- terikat oleh Ag+ sehingga koloidnya netral. Setetes titran menghasilkan ion Ag+ berlebih sehingga menyebabkan koloid menjadi positif dan menarik ion Fl- sehingga menyebabkan warna endapan tiba-tiba berubah menjadi merah muda.
Titik akhir titrasi ini diketahui berdasarkan tiga macam perubahan, yaitu (i) endapan yang semula berwarna putih berubah menjadi merah muda dan endapan tampak menggumpal, (ii) larutan yang semula keruh menjadi lebih jernih dan (iii)) larutan , yang awalnya berwarna kuning kehijauan, hampir tidak berwarna. Masalah dalam penggunaan indikator adsorpsi adalah banyaknya pewarna yang membuat endapan perak sensitif terhadap cahaya (fotosensitisasi) dan menyebabkan endapan terurai. Indikator yang digunakan adalah K2CrO4 yang bereaksi dengan larutan titran pada titik akhir titrasi sehingga membentuk endapan berwarna merah bata.
Pada penggunaan sebenarnya konsentrasi 0,0072 M terlalu besar karena warna K2CrO4 terlalu kuning sehingga perubahan warna pada titik akhir titrasi sulit terlihat. Pada saat pH rendah, sebagian ion CrO42- berubah menjadi Cr2O72- akibat disosiasi asam yang melepaskan ion H+ yang dapat menurunkan konsentrasi indikator dan menyebabkan tidak terbentuknya endapan atau melebih-lebihkan titik akhir titrasi. Pada titrasi Argentometri ini kadar I- dan SCN- tidak dapat ditentukan dengan cara tersebut, karena endapan AgI dan AgSCN sangat kuat dalam menyerap kromat sehingga hasilnya kurang memuaskan.
Gangguan dalam penggunaan indikator ini adalah adanya ion Pb+ dan Ba+ yang mengendapkan ion CrO42- dalam endapan berwarna kuning yang tidak larut dalam ion Ag+ berupa PbCrO4 dan BaCrO4 yang dapat mereduksi dan mengganggu titik akhir titrasi. Indikator ini bekerja berdasarkan pembentukan kompleks terlarut antara ion Fe3+ dan SCN- sehingga membentuk ion kompleks yang mempunyai warna merah sangat kuat. Konsentrasi indikator dalam titrasi Volhard tidak bisa sembarangan, karena titran bereaksi baik dengan titrasi maupun indikator, sehingga kedua reaksi tersebut saling mempengaruhi.
Selain itu, jika konsentrasi indikator lebih besar dari 0,2 M maka warna asli kuning cukup jernih sehingga sulit untuk mengamati warna kompleks Fe(SCN)2+. Dalam prakteknya konsentrasi indikator bisa lebih kecil lagi, karena ternyata tidak menyebabkan kesalahan titrasi yang tidak terlalu besar.
TITRASI
- Jelaskan prinsip dasar dari titrasi argentometri
- Sebutkan beberapa analit yang dapat ditentukan dengan metode titrasi
- Sebutkan dan jelaskan indikator yang dapat digunakan dalam titrasi argentometri
- Berdasarkan jenis indikatornya, titrasi argentometri dibagi menjadi beberapa jenis
- Jelaskan beberapa sumber kesalahan pada metode Mohr
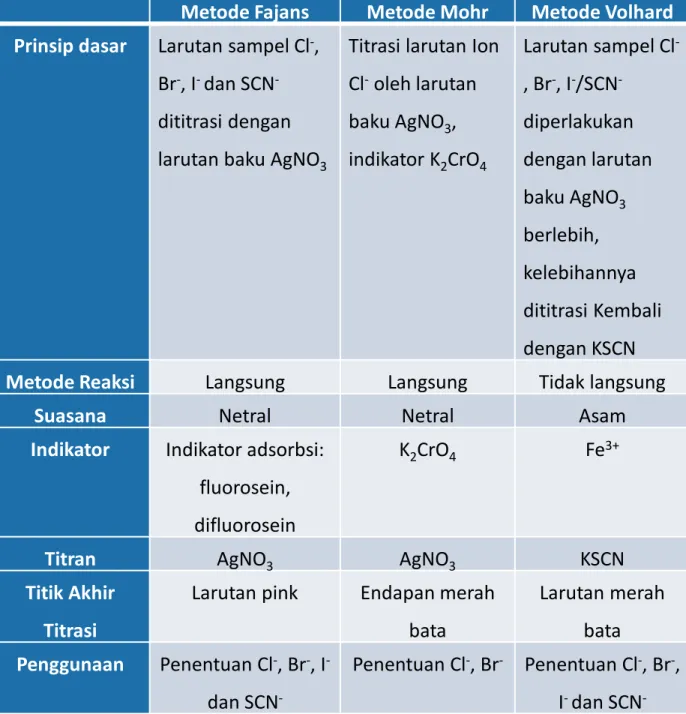
Titrasi presipitasi merupakan salah satu golongan titrasi yang hasil reaksi titrasinya berupa endapan atau garam yang sulit larut. Prinsip dasarnya adalah reaksi pengendapan cepat mencapai kesetimbangan pada setiap penambahan titran, tidak ada pengotor yang mengganggu, dan diperlukan indikator untuk melihat titik akhir titrasi. Titrasi argentometri didasarkan pada terjadinya pengendapan kuantitatif, yang dilakukan dengan menambahkan larutan pengukur yang konsentrasinya diketahui ke dalam larutan senyawa yang akan dititrasi.
Argentometri adalah metode umum untuk menentukan kadar halida dan senyawa lain yang membentuk endapan dengan perak nitrat (AgNO3) dalam kondisi tertentu. Metode argentometri disebut juga dengan metode pengendapan karena argentometri memerlukan pembentukan senyawa atau endapan yang relatif tidak larut. Fajans adalah metode yang menggunakan indikator adsorpsi, karena pada titik ekivalen indikator tersebut teradsorpsi oleh endapan.
Pada metode ini digunakan indikator adsorpsi, dimana pada titik ekivalen indikator tersebut diadsorpsi oleh endapan. Ketika senyawa organik berwarna diadsorpsi pada permukaan endapan, dapat terjadi perubahan struktur organik dan warnanya dapat berubah drastis dan menjadi lebih jernih. Selain itu juga digunakan untuk mengetahui kadar klorida dan bromida di atmosfer netral, misalnya pada sampel air sungai, air laut, air limbah, dll.
Larutan baku (titran) yang digunakan adalah AgNO3 (perak nitrat) dan indikator yang digunakan adalah larutan kalium kromat. Dalam lingkungan asam, perak kromat larut membentuk dikromat, dan dalam lingkungan basa, terbentuk endapan perak hidroksida. Metode Mohr dapat diterapkan untuk mentitrasi bromin dengan ion perak dan juga ion sianida dalam larutan yang sedikit basa.
Metode Volhard adalah metode yang digunakan untuk menentukan kadar klorida, bromida, dan iodida dalam lingkungan asam. Metode ini didasarkan pada pengendapan perak tiosianat dalam larutan asam nitrat, menggunakan ion besi untuk memeriksa kelebihan ion tiosianat. Metode ini dapat digunakan untuk titrasi langsung perak dari larutan standar tiosianat atau untuk titrasi tidak langsung ion klorida.
Metode Volhard banyak digunakan untuk perak dan klorida karena titrasi ini dapat dilakukan dalam larutan asam. Perak dapat ditentukan secara akurat dalam lingkungan asam dengan larutan standar kalium atau amonium tiosianat, yang memiliki hasil kelarutan 7,1 × 1013.