KIMIA ORGANIK 1 Prodi Farmasi
Fakultas Farmasi dan Sains
BENZENA AROMATIS TERSUBTITUSI Pertemuan 14
Firman Allah SWT: Qs. Az-Zariyat: 49)
BENZENA TERSUBTITUSI
• Cincin Benzen mengalami reaksi Subtitusi Elekrofilik Aromatis (SEA).
• Subtituen yang menggantikan satu atom H pada cincin
benzen mempengaruhi electron density pada inti benzen → ↑ electron density (electron donating) atau ↓ electron density (electron withdrawing) → Inductive effects
• Peningkatan atau penurunan electron density pada inti benzen mempengaruhi kemampuan inti benzen pada reaksi SEA
berikutnya.
4
EFEK INDUKSI
Subtituen gugus NH2 → withdraws electron density Subtituen gugus CH3 → donates electron density
5
Pengaruh resonansi pada subtituen memiliki PEB atau bonds → ↑ muatan (-) pada inti benzen
Pengaruh Resonansi electron-donating → pada atom Z yg memiliki PEB→ directly bonded to a benzene ring.
EFEK RESONANSI
6
• Pengaruh Resonansi electron-withdrawing pada benzun tersubtitusi yang memiliki rumus umun C6H5-Y=Z, dimana Z lebih elektronegatif daripada Y.
• Pada Benzaldehyde (C6H5CHO) → 7 struktur resonansi → 3 struktur inti benzen bermuatan positif → gugus CHO (karbaldehid) → withdrawing electrons karena pengaruh resonansi
7
• Dalam memprediksi benzen tersubtitusi → lebih atau kurang s electron rich daripada inti benzen benzene → perlu mempertimbangkan → efek induksi dan resonansi
• Contoh: alkyl groups merupakan electron donating karena efek induksi → tidak ada efek induksi → karena tidak memiliki pasangan elektron tidak terika atau bonds → Benzen tersubtitsi alkil → lebih kaya elektron daripada inti benzen
8
• Efek induksi dan resonansi umumnya terjadi pada senyawa dengan struktur umum → C6H5- Y=Z (Z more electronegative than Y) → senyawa electron withdrawing.
9
• Senyawa berikut menggambarkan sifat struktur umum sebagai subtituen → electron-donating & electron withdrawing.
10
Subtitusi Elektrofilik Aromatik (SEA) & Benzen Tersubtitusi
• SEA merupakan reaksi umum yang terjadi pada semua senyawa aromatis sepertipolycyclic aromatic hydrocarbons, heterocycles, and substituted benzene derivatives.
• Adanya subtituen mempengaruhi dua faktor pada reaksi SEA yaitu:
1. Laju reaksi — Benzen tersubtitusi bereaksi lebih cepat atau lebih lambat dari inti benzen.
2. Arah subtituen — Gugus baru akan masuk pada posisi ortho, meta, atau para dari subtituen awal. Identitas substituen pertama menentukan posisi substituen masuk kedua
11
• Toluen (metilbenzen) → bereaksi lebih cepat daripada inti benzen pada semua reaksi subtitusi
• Gugus CH3 (electron-donating) lebih mengaktifkan (aktivator) cincin benzen pada serangan elektrofilik.
• Produk Ortho & para mendominasi→Gugus CH3 disebut gugus pengarah ortho, para.
12
• Nitrobenzen → bereaksi lebih lambat daripada inti benzen pada semua reaksi subtitusi
• Gugus NO2 (electron-withdrawing) kurang mengaktifkan (deaktivator) cincin benzen pada serangan elektrofilik.
• Produk meta mendominasi→Gugus NO2 disebut gugus pengarah meta.
13
Jenis Subtituen pada Benzen Aromatis dibagi menjadi 3 tipe :
15
• Subtituen gugus Halogen mempunyai kelas tersendiri.
• Catatn Penting:
16
• Untuk memahami bagaimana substituen mengaktifkan atau menonaktifkan cincin, kita harus mempertimbangkan langkah pertama dalam substitusi aromatik elektrofilik.
• Langkah pertama melibatkan penambahan elektrofil (E+) untuk membentuk karbokation stabil resonansi.
• Postulat Hammond memungkinkan untuk memprediksi laju relatif reaksi dengan melihat stabilitas intermediet karbokation
17
• Prinsip inductive effects and resonance effects → prediksi kestabilan karbokation
18
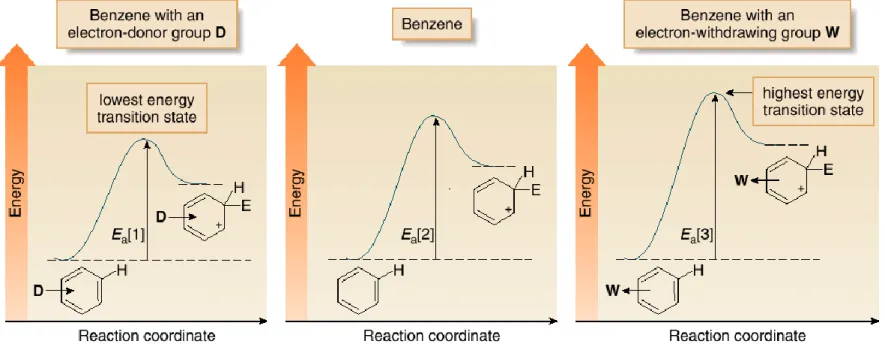
Gambar Diagram Energi → Pengaruh electron-withdrawing & electron-donating groups pada energi transition state → laju penentu reaksi.
Figure 18.6 Energy diagrams comparing the rate of
electrophilic substitution of
substituted benzenes
GUGUS
AKTIVATOR-
DEAKTIVATOR
INTI BENZEN
20
Efek Orientasi pada Benzene Tersubtitusi
◼ Ada dua tipe umum pengarah ortho, para dan satu tipe umum pengarah meta.
◼ Semua pengarah orto, para adalah gugus R atau memiliki pasangan elektron tidak terikat (PEB) pada atom yang terikat pada cincin benzena.
◼ Semua pengarah meta memiliki muatan positif penuh atau sebagian pada atom yang terikat pada cincin benzena.
21
Untuk mengevaluasi efek dari substituen yang diberikan, kita dapat menggunakan prosedur bertahap berikut:
22
• Gugus CH3 mengarahkan serangan elektrofilik orto dan para ke dirinya sendiri karena efek induktif pendonor elektron menstabilkan intermediet karbokation
Gugus NH2 mengarahkan serangan elektrofilik orto dan para ke dirinya sendiri karena intermediet karbokation memiliki stabilisasi resonansi tambahan.
24
Pada gugus NO2 (pengarah meta) serangan meta terjadi karena serangan pada posisi orto dan para memberikan perantara karbokation yang tidak stabil.
25 Figure 18.7
The reactivity and directing effects of common substituted benezenes
Kesimpulan:
1. Semua gugus pengarah orto, para kecuali gugus Halogen mengaktifkan cincin benzen
2. Semua gugus pengarah meta mendeaktivkan cincin benzen
3. Gugus Halogen
mendeaktivkan cincin benzen
26
Keterbatasan pada
Electrophilic Aromatic Substitutions (EAS)
• Cincin benzena yang diaktivasi oleh gugus pendonor elektron yang kuat—OH, NH2, dan turunannya (OR, NHR, dan
NR2) → mengalami
polihalogenasi ketika diberi perlakuan dengan X2 dan FeX3.
27
• Cincin benzena yang dinonaktifkan oleh gugus penarik elektron yang kuat (yaitu, salah satu direktur meta) tidak cukup kaya elektron untuk menjalani reaksi Friedel-Crafts
• Reaksi Friedel-Crafts juga tidak terjadi dengan gugus NH2 karena kompleks yang terbentuk antara gugus NH2 dan katalis AlCl3 menonaktifkan cincin menuju reaksi Friedel-Crafts.
28
• Perlakuan benzena dengan alkil halida dan AlCl3 menempatkan gugus R donor elektron pada cincin. Karena gugus R mengaktifkan cincin, produk teralkilasi (C6H5R) sekarang lebih reaktif daripada benzena itu sendiri menuju substitusi lebih lanjut, dan bereaksi lagi dengan RCl untuk menghasilkan produk polialkilasi.
• Polisubstitusi tidak terjadi dengan asilasi Friedel-Crafts.
29
Benzen Terdisubtitusi
1. Ketika efek pengarah dari dua kelompok diperkuat, substituen baru terletak pada posisi yang diarahkan oleh kedua gugus pengarah.
30
2. Jika efek pegarahan dari dua gugus saling bertentangan → aktivator yang lebih kuat “menang”.
31
3. Tidak ada substitusi yang terjadi antara dua substituen meta karena crowding
32
SINTESIS TURUNAN BENZEN
Dalam benzena tersubstitusi, efek pengarah menunjukkan substituen mana yang harus ditambahkan ke cincin terlebih dahulu.
Mari kita pertimbangkan konsekuensi dari brominasi pertama diikuti oleh nitrasi, dan nitrasi pertama, diikuti oleh brominasi.
Jalur I → di mana
brominasi mendahului nitrasi, menghasilkan produk yang
diinginkan. Jalur II →
isomer meta yang tidak
diinginkan.
34
Halogenasi pada Alkyl Benzenes
Ikatan C-H benzilik lebih lemah daripada kebanyakan ikatan C-H hibridisasi sp3 lainnya, karena homolisis membentuk radikal benzilik yang distabilkan resonansi.
Akibatnya, alkil benzena mengalami brominasi selektif pada ikatan C-H benzilik lemah di bawah kondisi radikal untuk membentuk halida benzilik.
35
Reaksi
Brominasi pada
gugus Benzilik
36
Alkil benzena mengalami dua reaksi yang berbeda tergantung pada kondisi reaksi :
◼ Dengan Br2 dan FeBr3 (kondisi ionik), substitusi aromatik elektrofilik terjadi, menghasilkan penggantian H oleh Br pada cincin aromatik untuk membentuk isomer orto dan para.
◼ Dengan Br2 dan cahaya atau panas (kondisi radikal), substitusi H oleh Br terjadi pada karbon benzilik dari gugus alkil.
37
Reaksi Oksidasi & Reduksi pada Benzen tersubtitusi
Arenes yang mengandung setidaknya satu ikatan C-H benzilik dioksidasi dengan KMnO4 menjadi asam benzoat.
Substrat dengan lebih dari satu gugus alkil dioksidasi menjadi asam dikarboksilat. Senyawa tanpa hidrogen benzilik bersifat inert terhadap oksidasi.
38
Gugus Keton yang terbentuk sebagai produk asilasi Friedel-Crafts dapat direduksi menjadi alkil benzena dengan dua metode berbeda:
1. Reduksi Clemmensen → menggunakan seng dan merkuri dengan adanya asam kuat.
2. Reduksi Wolff-Kishner → menggunakan hidrazin (NH2NH2) dan basa kuat (KOH).
39
Ada 2 cara berbeda memasukkan gugus Alkil pada cincin Benzen :
1. Metode satu langkah
menggunakan alkilasi Friedel- Crafts.
2. Metode dua langkah
menggunakan asilasi Friedel- Crafts untuk membentuk keton,
diikuti dengan reduksi. Figure 18.8 Two methods to prepare an alkyl benzene
40
Meskipun metode dua langkah tampak lebih bundar, metode ini harus
digunakan untuk
mensintesis alkil benzena tertentu yang tidak dapat dibuat dengan alkilasi Friedel-Crafts satu langkah karena penataan ulang.
41
Gugus nitro (NO2) yang telah dimasukkan pada cincin benzena melalui nitrasi dengan asam kuat dapat dengan mudah direduksi menjadi gugus amino (NH2) dalam berbagai kondisi.
www.uhamka.ac.id (021)73944451 uhamkaid Uhamka 42 @UhamkaID
Tahapan Reaksi Sintesis Turunan Benzen
43
Reaksi Sandmeyer & Reaksi terkait ion Benzendiazonium
Sandmeyer reaction: promoted by Cu(I) salts Manfaat zat antara garam
aril diazonium →
Menghasilkan substituen aril yang tidak dapat diakses, seperti -OH, -F, dan -CN.
www.uhamka.ac.id (021)73944451 uhamkaid Uhamka @UhamkaID
RINGKASAN REAKSI PADA BENZEN
AROMATIK
www.uhamka.ac.id (021)73944451 uhamkaid Uhamka @UhamkaID
(R-CO)2O
RINGKASAN REAKSI PADA BENZEN
AROMATIK
www.uhamka.ac.id (021)73944451 uhamkaid Uhamka @UhamkaID
SOAL LATIHAN
1. Rancanglah sintesis untuk senyawa berikut dari benzena:
a. m-chloro benzene sulfonate acid b. p-nitro toluene
c. o-hidroxy benzoate acid d. 2-bromo-4-chloro-aniline e. m-nitro toluene
f. p-methyl aniline
2. Prediksikan produk brominasi utama dari senyawa berikut:
a. p-amino phenol b. m-ethyl benzoate c. O-chloro aniline
d. m-nitro benzene sulfonate acid
3. Prediksi hasil utama dari reaksi berikut:
a. Nitration of bromo benzene b. Chlorination of phenol
c. Bromination of aniline