LAPORAN PRAKTIKUM BIOPROSES
Disusun oleh :
Nama : Farhan Rif’at Mauludani NIM : 2141420044
Kelas : 1D D4
PROGRAM STUDI TEKNOLOGI KIMIA INDUSTRI JURUSAN TEKNIK KIMIA
POLITEKNIK NEGERI MALANG
2021
I. STERILISASI
1.1 Tujuan Sterilisasi
1. Menerapkan prinsip sterilisasi alat dan media di bidang ilmu Bioproses.
2. Menggunakan autoclave konvensional, autoclave Hirayama, serta oven dengan baik dan benar sesuai SOP autoclave.
1.2 ALAT DAN BAHAN
Cawan petri
Tabung reaksi beserta rak
Pipet ukur 10 mL
Labu takar 1000 mL
Batang pengaduk
Cawan arloji
Kertas pembungkus
Kain kassa
Kapas berlemak
Tali kasur
Hot plate
Gunting
Oven
Autoclave Hirayam
Neraca Analitik
Nutrient Agar Bubuk (NA)
Aquades
1.3 PROSEDUR PERCOBAAN A. Sterilisasi Alat
.
B. Sterilisasi Media NA
Dibungkus peralatan (cawan petri,pipet ukur) dan ditutupi plastik (erlenmeyer berisi media NA, botol aquades, botol tip mikropipet) Dimasukkan dalam autoclave pada suhu 121℃, selama 30 menit
Setelah selesai disterilisasi, disimpan alat dalam oven bersuhu 80℃
selama 24 jam.
Dilarutkan dengan aquades 100 mL dalam erlenmeyer, lalu dipanaskan diatas penangas sambil diaduk.
Ditimbang 2 gram Nutrient Agar (NA) bubuk
Disterilisasi dalam autoclave pada suhu 121℃ selama 30 menit Dicuci alat yang digunakan dengan air sabun hingga tidak terasa berminyak, bilas dengan air mengalir kemudian dengan aquades atau
alkohol. Tiriskan hingga kering
Untuk tabung reaksi dan peralatan berleher disumbat dengan kapas berbungkus kain kassa steril. Sumbatan harus padat dibagian luar agar
dapat menahan debu dan kotoran.
1.4 HASIL PENGAMATAN
1. PERSIAPAN
Mencuci peralatan sampai bersih
Mengeringkan alat sampai kering didalam oven
Membuat sumbat tabung reaksi, erlenmeyer dan botol aquades
Membungkus cawan petri
Mengisi botol aquades pada tabung reaksi
Mengisi botol aquades ½ botol
Yang sudah berisi aquades disumbat dan ditutup dengan plastik dan masukkan keranjang
2. PELAKSANAAN
Ketika OFF dilarang membuka autoclave
Jika airnya sudah memenuhi batas, masukkan keranjang ke autoclave
Tutup autoclave dan klik mode LIQ
Atur suhu 121℃ dengan waktu 30 menit
Pilih program 1 (otomatis)
Tekan tombol START
Lampu Standby menyala yang artinya adalah melakukan pengaturan
Lampu Heating berkedip artinya proses sterilisasi sedang dimulai (kenaikan suhu dan tekanan)
Lampu Sterilisasi berkedip berkedip artinya proses berlangsung
Lampu Exhaust berkedip artinya penurunan tekanan
Lampu Warming berkedip artinya penurunan suhu
Lampu Complete berkedip artinya proses selesai
3. PENYELESAIAN
Tekan tombol “STOP” apabila suhu sudah mencapai 96℃
Pada suhu 70℃ autoclave baru boleh dibuka
Buka kunci autoclave sampai menutupi kata (UNLOCK)
Lalu buka atau ambil alat dan media yang disterilkan (kondisi basah)
Tekan tombol “OFF”
Stop kontak dicabut
Lalu keringkan alat dan media yang sudah disterilkan dalam oven pada suhu 105℃ selama 2 jam
1.5 PEMBAHASAN
Sterilisasi adalah proses penghilangan semua jenis organisme hidup, dalam hal ini adalah mikroorganisme (fungi, virus, bakteri dan protozoa) yang terdapat dalam suatu benda. Sedangkan steril adalah keadaan dimana suatu bahan atau alat terbebas dari mikroorganisme baik bentuk vegetatif maupun sporanya. Sterilisasi adalah langkah awal dalam pembuatan sediaan steril. Dalam praktikum ini penggunaan alat dan media sangat berperan penting dalam sterilisasi. Pada proses sterilisasi alat dan media kali ini kita menggunakan alat Autoclave Hirayama. Peralatan yang biasanya disterilisasi biasanya terbuat dari gelas atau kaca, plastik dan besi. Dalam melakukan sterilisasi perlu diketahui mana alat yang terbuat dari bahan yang tahan dan tidak tahan panas maupun bahan yang memiliki batas panas maksimal yang mampu diterimanya. Hal ini bertujuan agar peralatan yang disterilkan tidak rusak, misalnya saja untuk mensterilkan peralatan plastik dengan menggunakan sterilisasi panas kering, sudah tentu yang terjadi adalah hal-hal yang tidak diinginkan seperti rusaknya perlatan.
1.6 KESIMPULAN
1. Sterilisasi merupakan suatu usaha untuk mensterilkan alat agar tidak terkontaminasi dengan mikroba atau mikroorganisme lainnya.
2. Alat-alat yang digunakan dalam pembuatan media dan praktikum isolasi mikroorganisme metode cawan tuang, cawan gores dan agar miring harus memperhatikan kontrol kualitasnya dan sterilisasinya sebagai pendukung pembuatan media yang steril dan aseptik.
3. Prinsip kerja autoclave adalah penggunaan uap air jenuh pada tekanan diatas tekanan atmosfer dan digunakan untuk memanaskan isi autoclave.
II. METODE CAWAN TUANG
2.1 Tujuan Cawan Tuang
1. Menerapkan prinsip isolasi mikroorganisme metode cawan tuang dengan baik dan benar.
2. Menggunakan pipet mikro, vortex mixer dengan baik dan benar.
3. Membuat pengenceran biakan secara aseptik dengan baik dan benar.
4. Memindahkan biakan ke dalam cawan petri steril secara aseptic dengan baik dan benar.
5. Mengisolasi mikroorganisme dengan metode cawan tuang dengan baik dan benar.
2.2 ALAT DAN BAHAN
Cawan petri steril
Tabung reaksi steril
Pembakar spiritus
Korek api
Pipet mikro 100-1000 µL
Tip pipet mikro steril
Pipet ukur steril 10 mL
Ball pipet
Vortex mixer
Inkubator oven
Autoclave
Air steril
Etanol 70%
Media NA
Biakan mikroorganisme campuran
2.3 PROSEDUR PERCOBAAN
Disiapkan alat dan bahan (6 tabung reaksi yang berisi 9 mL air steril, letakkan rak dan beri nomor)
Dikocok tabung reaksi yang berisi suspensi campuran bakteri
Diambil 1 mL campuran biakan aseptik pindahkan ke tabung reaksi(kocok)
Diambil 1 mL dari tabung reaksi 1 campuran biakan aseptik dan pindah ke tabung reaksi 2
Dari masing-masing tabung reaksi, dipindahkan 1 mL campuran biakan secara aseptik ke 5 cawan petri (memberi penomoran dengan
pengenceran sesuai dengan asal biakan) Variasi pengenceran adalah 10-2, 10-4, dan 10-6
Ditambahkan agar cair dengan keadaan masih hangat-hangat kuku. Lalu diputar searah jarum jam sebanyak 5 kali, berawanan arah jarum jam 5
kali dan membentuk angka 8 sebanyak 5 kali.
Dibiarkan hingga beku
Dibungkus cawan petri menggunakan kertas pembungkus
Diinkubasi selama 2x24 jam pada suhu 37℃
Diamati koloni, warna dan bentuknya.
2.4 HASIL PENGAMATAN
Pengenceran 10-2
Bentuk, Tepian, Elevasi
Bentuk : - Tepian : - Elevasi : -
Kontaminan : Ada Jumlah koloni : -
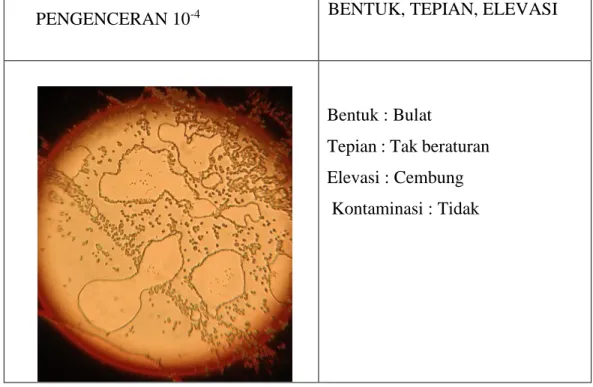
Pengenceran 10-4
Bentuk, Tepian, Elevasi
Bentuk : Bulat
Tepian : Tak beraturan Elevasi : Cembung Kontaminan : Tidak
Pengenceran 10-6
Bentuk, Tepian, Elevasi
Bentuk : Bulat Tepian : Tak braturan Elevasi : Cembung Kontaminan : Tidak ada
REFERENSI KOLONI Monococcus (mikroskop)
GAMBAR REFERENSI MIKROBA
PENGENCERAN 10-4 BENTUK, TEPIAN, ELEVASI
Bentuk : Bulat
Tepian : Tak beraturan Elevasi : Cembung Kontaminasi : Tidak
Bakteri yang berbentuk bulat tunggal. Yaitu Monococcus
2.5 PEMBAHASAN
Cawan Tuang adalah teknik lain yang dapat digunakan untuk mendapatkan koloni murni mikroorganisme. Isolasi menggunakan cawan tuang ini memiliki tujuan tertentu salah satunya adalah untuk mendapatkan isolasi tunggal dari mikroorganisme tertentu. Pada praktikum ini, biakan yang digunakan adalah dari yoghurt kin dan didapati sampel yang mengandung bakteri Monococcus yang berbentuk bulat tunggal seperti pada gambar referensi yang didapatkan. Sebenarnya pada pengamatan mikroskop juga didapatkan vakteri yang berbentuk Streptococcus, tetapi tidak sebanyak bakteri yang berbentuk bulat tunggal. Sebelum melakukan isolasi, sampel diencerkan hingga 10-6 dengan tujuan mendapatkan isolasi tunggal yang diinginkan dan memperkecil jumlah koloni saat diinkubasi.
Semakin encer biakan maka semakin sedikit jumlah koloninya, begitupun sebaliknya. Pada praktikum kali ini 1 mL biakan diencerkan dengan 9 mL aquadest steril dengan menggunakan pengenceran 10-2,10-4, dan 10-
6.Biakan dipindahkan ke dalam cawan petri menggunakan mikropipet lalu dituangkan media NA cair yang suhunya hangat-hangat kuku agar bakterinya tidak mati. Setelah dituangi media maka diputar searah jarum jam sebanyak 5 kali, berlawanan arah jarum jam 5 kali dan membentuk angka 8 sebanyak 5 kali. Jumlah koloni akan terlihat setelah di inkubasi selama 2x24 jam dengan suhu kurang lebih 30℃, karena pada suhu tersebut pertumbuhan bakteri akan lebih cepat. Hal ini dikarenakan suhu tersebut merupakan suhu optimal bakteri untuk berkembang. Permukaan NA atau media akan tumbuh koloni berwarna putih dan rata-rata berbentuk lingkaran. Diwaktu yang sama, jika tumbuh bercak berwarna lain berarti cawan petri terkontaminasi karena praktikum yang dilakukan tidak secara aseptik. Dalam satu koloni belum tentu hanya ada satu jenis bakteri. Hal itu yang menyebabkan kita harus melakukan pengecekan menggunakan mikroskop. Saat mengambil sampel untuk preparat, kita harus mengambil koloni yang letaknya paling jauh untuk bisa melihat isolasi tunggal. Pada pengenceran 10-2, 10-4, 10-6 koloni berbentuk bulat, tepiannya tak beraturan dan elevasinya cembung. Pada pengenceran 10-2 terdapat kontaminasi dan
tidak tumbuh mikroba sama sekali, pada pengenceran 10-4 tidak terdapat kontaminasi, dan pada pengenceran 10-6 tidak terdapat kontaminasi.
2.6 KESIMPULAN
1. Prinsip isolasi mikroorganisme metode cawan tuang adalah
memisahkan satu jenis mikroba dengan mikroba jenis lainnya yang berasal dari macam-macam jenis mikroba. Isolasi memisahkan bakteri yang diinginkan dari gabungan bakteri untuk mendapatkan biakan murni.
2. Kesalahan teknik pengenceran dapat menyebabkan bakteri tidak dapat hidup pada cawan petri.
3. Pada pengenceran 10-2, 10-4, 10-6 koloni berbentuk bulat, tepiannya tak beraturan, dan elevasinya cembung.
4. Pada pengenceran 10-2 terdapat kontaminasi, pada pengenceran10-4 tidak terdapat kontaminasi dan pada pengenceran 10-6 juga tidak terkontaminasi.
III. METODE CAWAN GORES
3.1 TUJUAN
1. Menerapkan prinsip isolasi mikroorganisme metode cawan gores dengan baik dan benar.
2. Memindahkan biakan ke dalam cawan petri steril secara aseptik dengan baik dan benar
3. Mengisolasi mikroorganisme dengan metode cawan gores dengan baik dan benar.
3.2 ALAT DAN BAHAN
Cawan petri steril
Lup inokulasi
Pembakar spiritus
Media agar NA steril
Suspensi campuran bakteri 10-4 (Yogurt dengan starter kin)
3.3 PROSEDUR PERCOBAAN
Disiapkan cawan petri kering dan steril.
Dinyalakan pembakar spirtus, dikerjakan pada radius 30 cm maksimal dari api
Dipanaskan bibir cawan petri beberapa kali pada api spirtus
Diletakkan dimeja dan buka tutup cawan petri. Jangan terlalu lebar, cukup
untuk menuangkan media akar 1/3 bagian dari kedalaman cawan petri.
Tunggu hingga membeku.
Dibuat sketsa area penggoresan dengan menggunakan spidol
Diletakkan cawan petri di atas meja dengan posisi tutup terletak disisi atas sektor 0 disisi kiri.
Digunakan biakan yang sudah dibuat pada isolasi cawan tuang. Pilih koloni yang bukan kontaminan.
Dipijarkan kawat ose dan biarkan dingin
Digoreskan lup ke sektor 0 satu sampai 3 kali dan susul goresan ke arah tepi luar sektor 1. Lanjutkan dengan goresan zig zag padas sektor 1 dan
tidak tumpang tindih.
Diputar cawan petri hingga sektor 1 terletak disisi kiri, ulangi untuk mengencerkan biakan dari sektor 1 ke sektor 2.
Dipanaskan bibir cawan petri dengan pembakar spiritus kemudian bungkus rapi.
Inkubasi cawan petri terbalik dalam inkubator oven pada suhu 30 derajat celcius selama 2x24 jam.
Diamati diameter (mm), warna, ketinggian koloni dan bentuk.
Dengan menggunakan lup inokulasi, pindahkan secara aseptik satu lup penuh biakan mikroba pada sektor 0 dan goreskan membentuk pola zig-
zag. Perhatikan agar tutup cawan petri tidak terbuka terlalu lebar.
Karena permukaan agar dapat terlukai oleh lup, maka goresan dilakukan tanpa tekanan berlebih.
3.4 HASIL PENGAMATAN
Koloni Monococcus Pengenceran
10-4
Bentuk, Tepian, Elevasi
Bentuk : Bulat
Tepian : Tak beraturan Elevasi : Cembung Kontaminasi : Tidak
Mikroba tumbuh pada sektor 0,1,2, dan 3. Mikoba paling banyak tumbuh pada sektor 0 dan yang paling sedikit pada sektor 3
Gambar referensi cawan gores
Bentuk, Tepian, Elevasi
Mikroba tumbuh pada sektor 0,1,2, dan 3. Mikoba paling banyak tumbuh pada sektor 0 dan yang paling sedikit pada sektor 3
3.5 PEMBAHASAN
Cawan Gores adalah isolasi bakteri yang bertujuan untuk membuat garis sebanyak mungkin pada permukaan medium biakan menggunakan kawat ose atau lup inokulasi. Inokulasi merupakan salah satu metode yang ada di dalam bioproses untuk memindahkan biakan mikroorganisme dari suatu media ke media lain secara aseptik. Tujuan dari inokulasi adalah untuk mendapatkan isolasi tunggal dari biakan yang diamati. Namun koloni yang tumbuh pada media tidak selalu satu jenis sehingga kita perlu melakukan pengamatan menggunakan mikroskop terlebih dahulu. Pada praktikum kali ini, yang digunakan adalah cawan gores untuk menginokulasi biakan hasil cawan tuang dan didapat bakteri Monococcus. Suhu inokulasi kurang lebih 30℃ karena pada suhu tersebut bakteri bisa berkembang dengan baik. Waktu untuk inkubasi adalah 2x24 jam. Koloni akan tumbuh sesuai dengan bentuk zig zag yang telah digoreskan. Jika ada atau tumbuh warna lain selain putih bisa jadi cawan petri terkontaminasi untuk koloni yang diambil adalah koloni yang paling ujung (peta 3) dan jauh dari koloni lain.
Penggoresan media yang baik dan benar akan terlihat hasil biakan bakteri murni pada satu titik koloni pada sektor tiga. Pada praktikum ini berhasil didapatkan koloni tunggal pada sektor 3 yang berwarna putih.
Pada sektor nol, satu, dan dua didapatkan tumpukan koloni bakteri yang sangat banyak. Hal ini sesuai dengan referensi pada data pengamatan jika sektor 3 hanya akan terbentuk koloni tunggal, yang membedakan antara hasil praktikum dengan hasil referensi adalah untuk praktikum terbentuk koloni berwarna putih yang berbentuk zig-zag tapi melebar sedangkan pada referensi terbentuk koloni berwarna kuning dengan bentuk zig-zag, tetapi garis halus. Hal ini dapat diidentifikasi jika hasil praktikum telah mengalami penumpukan koloni sehingga bentuknya melebar
3.6 KESIMPULAN
1. Prinsip isolasi mikroorganisme metode cawan tuang adalah memisahkan satu jenis mikroba dengan mikroba jenis lainnya yang berasal dari macam-macam jenis mikroba. Isolasi memisahkan bakteri yang diinginkan dari gabungan bakteri untuk mendapatkan biakan murni.
2. Koloni yang terbentuk dalam cawan gores adala Monococcus 3. Pada percobaan kali ini koloni berbentuk bulat, tepiannya tak beraturan elevasi cembung, tidak terkontaminasi, dan berhasil mendapatkan koloni tunggal pada sektor tiga.
IV. MEDIA AGAR MIRING
4.1 TUJUAN
1. Membuat agar miring di tabung reaksi
2. Menginokulasi biakan secara aseptik ke agar miring dengan baik dan benar
4.2 ALAT DAN BAHAN
Tabung reaksi steril
Rak tabung reaksi steril
Batang penyangga
Lup inokulasi
Pembakar spiritus
4.3 PROSEDUR PERCOBAAN
Disiapkan tabung reaksi kering lengkap dengan sumbat kapasnya
Dituangkan media agar NA yang belum disterilisasi hingga 1/3 tinggi tabung reaksi
Dituangkan media agar NA yang belum disterilisasi hingga 1/3 tinggi tabung reaksi
Ditutup tabung reaksi dengan sumbat kapas yang sudah dibuat
Disterilisasi tabung reaksi yang berisi media dengan menggunakan autoclave
Setelah proses sterililisasi selesai, disimpan dalam posisi miring, atur sedemikian rupa hingga media adar didasar tabung tidak terlalu tebal
dan ujung agar miring cukup jauh kurang lebih 8 cm dari lubang
Agar miring dinyatakan jadi bila tidak ada embun didalam tabung
Diletakkan pembakar spiritus pada jarak kurang lebih 30 cm dari kita
Dibersihkan meja kerja dan tangan dengan menyemprot etanol 70%
Pegang cawan petri berisi isolat dengan tangan kiri dan lup inokulasi di tangan kanan. Pijarkan lup inokulasi hingga memerah, kemudian
panaskan bibir cawan petri dalam beberapa putaran
Gerakkan ibu jari tangan kiri ke arah atas sedemikian hingga tutup cawan petri terangkat sedikit dan tahan dengan telunjuk dan jari tengah
tangan kiri.
Pegang tabung reaksi dengan tangan kiri dan lup inokulasi ditangan kanan. Buka tutup kapasnya dengan kelingking tangan kanan dan
jepitkan ke telapak tangan kanan.
Dipanaskan bibir tabung reaksi dalam beberapa putaran, lalu masukkan lup inokulasi dan goreskan ke agar miring dalam tabung reaksi degan
pola zig-zag.
Lup inokulasi harus dipijarkan sebelum disimpan
Diambil satu lup biakan isolat 10-3 dan cepat tutup cawan petri. Dan panaskan lagi bibir cawan petri.
Dipanaskan bibir tabung reaksi sebelum kapasnya ditutupkan lagi. Lalu inokulasi selama 2x24 jam dalam inkubator oven pada suhu yang sesuai.
4.4 HASIL PENGAMATAN Koloni Monococcus
Tabung ke 1 Keterangan
Ditumbuhi koloni pada hasil dari penggoresan.
REFERENSI GAMBAR AGAR MIRING
REFERENSI Keterangan
Ditumbuhi koloni pada hasil dari penggoresan.
4.5 PEMBAHASAN
Medium agar miring yang digunakan pada praktikum ini terdiri dari suatu campuran nutrisi yang dipakai untuk menumbuhkan mikroba dan dibuat dalam tabung reaksi yang diletakkan miring pada waktu pendinginan. Selain itu medium juga bisa digunakan untuk isolasi memperbanyak, pengujian sifat fisiologi dan perhitungan mikroba.
Dalam praktikum kali ini, media yang digunakan adalah media Nutrient Agar (NA). Medium ini digunakan sebagai sumber makanan bagi mikroba. NA sendiri merupakan suatu medum padat yang merupakan perpaduan antara bahan alamiah. Kesesuaian suhu atau temperatur, pH, kecukupan nutrient pada media merupakan beberapa syarat agar mikroba tumbuh dan berkembang dengan baik (Stainer, 2011) pembuatan media untuk berbagai macam organisme harus menggunakan bahan yang mengandung banyak protein dengan bebagai konsentrasinya sehingga dapat menumbuhkan bakteri. Setiap perlakuan yang diinginkan dilakukan secara aseptis didekat api bunsen berfungsi agar saat inokulasi bahan serta alatyang digunakan tetap steril.
Digoreskan dengan menggunakan metode zig zag agar bentuk koloni merata dan tidak bertumpuk. Hasil cawan gores disimpan dalam inkubator selama 2x24 jam pada suhu kurang lebih 37℃. Apabila terjadi kesalahan penggoresan menyebabkan bakteri tidak hidup dalam tabung reaksi yang berisi media tersebut . Pada media agar miring saya tidak ada kontaminan sama sekali dan setelah diinokulasikan bakteri pada agar miring tumbuh koloni yang sangat banyak dan bertumpuk, hal ini dikarenakan waktu yang dibutuhkan dalam inkubasi melebihi batas waktu, beda dengan gambar referensi yang didapatkan hasil kembangbiakan bakteri pada agar miring terlihat zig-zag dan tidak bertumpuk.
4.6 KESIMPULAN
1. Prinsip isolasi mikroorganisme metode cawan tuang adalah
memisahkan satu jenis mikroba dengan mikroba jenis lainnya yang berasal dari macam-macam jenis mikroba. Isolasi memisahkan bakteri yang diinginkan dari gabungan bakteri untuk mendapatkan biakan murni.
2. Memindahkan biakan kedalam cawan petri dan inokulasi secara aseptik didekat api bunsen untuk mendapatkan media agar miring yang baik dan benar.
3. Pada hasil percobaan kali ini agar miring ditumbuhi koloni pada hasil percobaan.
V. PERHITUNGAN MIKROBA DENGAN COLONY COUNTER
5.1 TUJUAN
1. Mengetahui jumlah mikroorganisme dengan menggunakan metode yang sesuai.
2. Mengoperasikan colony counter dengan baik dan benar.
3. Menentukan jumlah mikroorganisme dengan menggunakan colony counter.
5.2 ALAT DAN BAHAN
Cawan petri yang berisi biakan mikroba pengenceran 10-4.
Alat colony counter.
Spidol
5.3 PROSEDUR PERCOBAAN
Disiapkan cawan petri hasil isolasi dengan metode cawan tuang.
Perhatikan faktor pengencerannya
Dihidupkan colony counter, letakkan cawan petri di wadah yang sudah disediakan dengan posisi tutup dibawah
Ditunjuk tiap titik koloni dengan spidol permanen hingga tercatat angka yang menunjukkan jumlah koloni yang ada dalam cawan petri tersebut.
Angka yang diperoleh dikalikan dengan faktor pengencernya.
Jumlah koloni adalah perkalian dari hasil perhitungan dengan angka pengencerannya. (cfu/mL)
5.4 HASIL PENGAMATAN
Pengenceran 10-4 Hasil
perhitungan colony counter
210 sel
SPC
210 x 104 = 2,10 x 106 Maka jumlah koloninya adalah 2,10 x 106 cfu/ml
5.5 PEMBAHASAN
Pada praktikum dengan metode perhitungan cawan, kali ini menggunakan alat yang namanya colony counter. Colony counter merupakan alat yang digunakan di Laboratorium Mikrobiologi. Alat ini digunakan untuk menghitung jumlah koloni bakteri atau
mikroorganisme yang ditumbuhkan di media yang disimpan dalam cawan petri. Prinsip kerjanya yang sangat simple secara otomatis dengan bantuan spidol dan tombol hitung. Pada praktikum kali ini menggunakan pengenceran 10-4. Jumlah koloninya juga berbeda- beda pada setiap pengenceran. Pada perhitungan colony counter terdapat jumlah sah, yaitu antara 30-300, apabila >300 maka dianggap tidak sah dihitung dan kemungkinan kesalahan perhitungan sangat besar, apabila <30 jumlah koloni sangat sedikit. Pada perhitungan
pengenceran 10-4 jumlah sel yang dihitung terdapat 210 koloni sehingga memenuhi syarat, lalu dikalikan dengan faktor pengeceran 104 sehingga jumlah koloni dalam pengenceran ini adalah 2,10 x 106 cfu/ml.
5.6 KESIMPULAN
1. Perhitungan mikroba menggunakan colony counter merupakan perhitungan yang sangat mudah dan sangat simple karena hanya menggunakan spidol dan tombol hitung.
2. Pada hasil pengamatan pengenceran 10-4 terdapat 210 sel.
3. Perhitungan jumlah koloni (SPC) pada pengenceram 10-4 terdapat 2,10 x 106 cfu/ml.
VI. PERHITUNGAN MIKROBA DENGAN HAEMOCYTOMETER
6.1 TUJUAN
1. Menggunakan hemasitometer dengan baik dan benar 2. Menentukan jumlah mikroorganisme dengan menggunakan
hemasitometer
6.2 ALAT DAN BAHAN
Biakan hasil isolasi metode cawan tuang
Pipet mikro
Tip pipet mikro steril
Pembakar spiritus
Hemasitometer
Mikroskop binokuler
6.3 PROSEDUR PERCOBAAN
Dibersihkan permukaan hitung hemasitometer dengan secarik tissue dan setetes etanol 70%. Jangan digosok terlalu kuat karena kaca
Diletakkan kaca tutup hemasitometer diatas permukaan hitung hemasitometer diatas permukaan hitung hemasitometer
Dibuat pengenceran 10-2 untuk suspensi biakan mikroba hasil isolasi metode cawan gores atau cawan tuang.
Dengan cermat menaruh ujung pipet mikro pada tepi kaca tutup hemasitometer dan biarkan ruang hitung terpenuhi suspensi secara
kapiler. Dan tutup dengan deeglass
Diletakkan hemasitometer diatas pentas mikroskop dengan hati-hati.
Mengamati dengan lensa obyektif berkekuatan rendah (40x) dan hitunglah jumlah sel yang terdapat pada 80 buah kotak kecil yang
terletak didalam kotak bagian tengah yang berukuran 1mm2
Pembagian ruang hitung hemasitometer. Seluruhnya ada sembilan area, masing-masing berukuran 1 mm2 . Kotak yang di tengah , yang kesemua
sisinya dibatasi garis ganda juga berukuran sama, dibagi menjadi 25 kotak besar. Setiap kotak besar ini dibagi lagi menjadi 16 kotak kecil.
Sehingga di dalam kotak tengah tersebut seluruhnya terdapat 25 x 16 kotak atau 400 kotak kecil yang merupakan ruang hitung.
Kotak yang merupakan tempat sampling hitungan adalah 4 kotak besar di ujung dan I kotak besar di tengah. Tiap kotak ini terdiri atas 16 kotak
kecil, hingga totalnya adalah 80 kotak kecil
Bila ditemukan sel mikroba tepat di garis batas, maka yang boleh dihitung HANYALAH yang tcrletak di sudut kiri atas kotak.
6.4 HASIL PENGAMATAN
PENGENCERAN 10-4 PADA PERBESARAN 100X
PERBESARAN 100X
PENGENCERAN 10-4 PADA PERBESARAN 400X
GAMBAR KETERANGAN
Sektor 1
20 sel
Sektor 2
18 sel
Sektor 3
33 sel
HASIL PERHITUNGAN DENGAN HAEMACYTOMETER
a) Perhitungan 25 kotak besar seluruhnya
Jumlah sel seluruhnya= 187 sel
Kedalaman hemasitometer= 0,1 mm3
Jumlah dalam 1 mm2 adalah 187 sel : 0,1 mm3= 1870 sel/mm2
Dalam 1 cm3 terdapat
1870 sel/mm3 x 1000mm3/cm3= 1.870.000 sel/cm3 atau 1,87 x 106 sel/cm3
Sektor 4
30 sel
Sektor 5
24 sel
b) Perhitungan menggunakan sampling
• Jumlah sel dalam 5 sektor Sektor 1 : 20 sel Sektor 2 :18 sel Sektor 3 :33 sel Sektor 4 :30 sel Sektor 5 :24 sel
Sektor total : 125 sel
• 5 kotak besar = 80 kotak kecil = 125 sel
• Sehingga setiap 1 mm2 terdapat 125 x 5 = 625 sel
• Kedalaman hemasitometer 0,1 mm3 Sehingga dalam 1 mm2 terdapat 0,1 mm3 / 625 sel = 6250 sel/mm3
• Jumlah per cm3 adalah
6250 sel/mm3 x 1000mm3/cm3
= 6,25x 106 sel/cm3
6.5 PEMBAHASAN
Pada praktikum perhitungan mikroba selanjutnya menggunakan Hemasitometer. Sebelum digunakan sebaiknya Hemasitometer disemprot dengan etanol 70% terlebih dahulu dan lap dengan tissue akan tetapi jangan terlalu ditekan karena permukaan Hemasitometer mudah tergores. Setelah itu ambil pengenceran 10-2 menggunakan mikropipet dan letakkan disalah satu ruang hitung Hemasitometer. Lalu tutup dengan deeglass dan amati menggunakan mikroskop. Pada
pengamatan menggunakan mikroskop harus dengan hati-hati dan penuh ketelitian. Penggunaan mikroskop pada perbesaran 100x dan 400x.
Harus teliti untuk mencari sektor yang akan dihitung dengan bantuan
mikroskop dan agar tidak tertukar dengan sektor lainnya. Apabila sektor sudah ditemukan jangan lupa untuk difoto dan diamati dihitung berapa jumlah mikrobanya. Sektor yang dipilih dalam hemasitometer adalah sektor 1 (pojok kiri atas) terdapat 20 sel, sektor 2 (pojok kanan atas) terdapat 18 sel, sektor 3 (pojok kanan bawah) terdapat 33 sel, sektor 4 (pojok kiri bawah) terdapat 30 sel, dan sektor 5 (tengah- tengah) terdapat 24 sel. Total dari semua sector adalah 125 sel. Jumlah dalam 1 cm3 adalah 6,25 X 106 sel/cm3. Pada setiap sektor terdiri dari 16 kotak kecil untuk diamati. Sedangkan secara keseluruhan langsung dihitung 25 kotak besar maka akan didapatkan hasil jumlah mikroba sebesar 1.87 x 106 sel/cm3. Pada perhitungan secara keseluruhan dan sampling memiliki perbedaan di jumlah bakterinya, tetapi perubahan yang terjadi tidak terlalu besar karena masih tetap pada 106. Kesalahan yang terjadi adalah 4,36 x 106 sel/cm3 hal ini disebabkan oleh
perhitungan yang kurang teliti.
6.6 KESIMPULAN
1. Hemasitometer adalah alat yang digunakan untuk menghitung mikroba dengan bantuan mikroskop.
2. Kelebihan dari hemasitometer adalah dapat menghitung jumlah sel yang hidup maupun yang mati, tergantung juga dari pewarna yang digunakan.
3. Pada sektor 1 terdapat 20 sel, sektor 2 terdapat 18 sel, pada sektor 3 terdapat 33 sel, pada sektor 4 terdapat 30 sel dan pada sektor 5 terdapat 24 sel.
4. Jumlah total semua sektor adalah 125 sel.
5. Jumlah total secara keseluruhan adalah 187 sel
6. Dengan melakukan perhitungan yang sesuai, didapatkan total sel untul setiap 1 cm3 secara sampling adalah 6,25 x 106 sel/cm3 dan untuk setiap 1 cm3 secara keseluruhan adalah 1,87 x 106 sel/cm3
DAFTAR PUSTAKA
Yanty Maryanty, Dwi Moentamaria, Sri Rulianah, Nanik Hendrawati, Khalimatus Sa'diyah, Mutia Devi Hidayati, Noor Isnaini Azkiya, & Dyah Ratna Wulan. (2020). Buku Ajar Praktikum BIOPROSES. Malang:
POLINEMA PRESS
Halimatus sadiyah. 2017. Laporan Praktikum Mikrobiologi. Magelang
Andra Hermawan. Lilis. 2019. Laporan Isolasi Mikroba dalam berbagai Metode. 2015. ITB: BandunG
Anonim. 2020. Laporan Teknik Sterilisasi. Web di akses 16 Desember 2021