Perkembangan Tabel Periodik Unsur
Pengelompokan unsur-unsur berdasarkan kemiripan sifat mengalami perkembangan dari yang paling sederhana hingga modern.
Pada awalnya, unsur hanya digolongkan menjadi logam dan nonlogam. Dua puluh unsur yang dikenal pada masa itu mempunyai sifat yang berbeda satu dengan yang lainnya. Setelah John Dalton mengemukakan teori atom, maka terdapat perkembangan yang cukup berarti dalam pengelompokan unsur-unsur. Penelitian Dalton tentang atom menjelaskan bahwa setiap unsur mempunyai atom-atom dengan sifat tertentu yang berbeda dari atom unsur lain. Hal yang membedakan diantara unsur adalah massanya.
Sebelumnya, massa atom individu belum bisa ditentukan karena atom mempunyai massa yang amat kecil sehingga digunakan massa atom relatif yaitu perbandingan massa antar-atom. Berzelius pada tahun 1814 dan P. Dulong & A. Petit pada tahun 1819 melakukan penentuan massa atom relatif berdasarkan kalor jenis unsur. Massa atom relatif termasuk sifat khas atom karena setiap unsur mempunyai massa atom relatif tertentu yang berbeda dari unsur lainnya. Penelitian selanjutnya melibatkan Dobereiner, Newlands, mendeleev dan Lothar Meyer yang mengelompokkan unsur berdasarkan massa atom relatif.
A. Perkembangan Dasar Pengelompokan Unsur-Unsur
1.Pengelompokan Unsur atas Logam dan Nonlogam
tersebut belum didasarkan pada kemiripan sifat maupun kenaikan nomor atom. Pengelompokan unsur logam dan nonlogam ini dilakukan dengan melalui pengamatan terhadap ciri-ciri fisiknya.
Ciri-ciri fisik tersebuh adalah:
Keterangan : Unsur-unsur logam umumnya mempunyai fase padat pada suhu udara normal. Akan tetapi logam merkuri (Hg) mempunyai fase cair pada suhu normal. Merkuri meleleh pada suhu -38,9˚ C.
Lavoisier berhasil mengelompokkan 16 unsur logam seperti emas, tembaga, timah, seng, antimon, besi, molibdenum, wolfram, kobalt, mangan, perak, nikel, timbal, platina, bismut, dan raksa dan 7 unsur bukan logam seperti belerang, arsen, karbon, hidrogen, fosfor, oksigen, dan nitrogen.
Kelebihan Kekurangan
Menjadi dasar pengelompokan unsur
yang selanjutnya.
Pengelompokan masih terlalu sederhana sehingga
belum terlihat adanya kemiripan unsur.
Pada tahun 1829, Johan Wolfgang Dobereiner menjelaskan tentang hasil penelitiannya yang menemukan kenyataan bahwa massa atom relatif stronsium berdekatan dengan massa rata-rata dua unsur lain yang mirip dengan stronsium yaitu kalsium dan barium. Hasil penelitiannya juga menunjukkan adanya kecenderungan yang sama pada beberapa unsur.
Dobereiner yang melihat kemiripan sifat di antara beberapa unsur, lalu mengelompokkannya menurut kemiripan sifat yang ada. Ternyata tiap kelompok terdiri atas tiga unsur, sehingga disebut Triade. Jika unsur-unsur dalam satu triade tersebut disusun menurut kenaikan massa atom-atomnya, ternyata massa atom maupun sifat-sifat unsur yang kedua merupakan rata-rata dari massa atom unsur pertama dan ketiga.
Massa atom 7,0 23,00 39
2. Triad
Bunyi hukum Triade adalah "Massa atom maupun sifat-sifat unsur yang kedua merupakan rata-rata dari massa atom unsur pertama dan ketiga.”
Ada hubungan antara massa atom suatu unsur
dengan sifat dari suatu unsur.
Ada 3 unsur yang memenuhi bunyi dari hukum triade akan tetapi
sifat-sifatnya berbeda.
Adanya keteraturan dari bunyi hukum triade itu
sendiri.
Ada lebih dari 3 unsur yang memiliki sifat yang mirip
tetapi tidak memenuhi bunyi dari hukum triade.
3. Hukum Oktaf Newlands
Pada tahun 1864, A.R. Newlands mengumumkan penemuannya yang disebut hukum Oktaf. Unsur-unsur tersebut disusun berdasarkan kenaikan massa atom relatifnya. Ternyata unsur-unsur yang berselisih 1 oktaf (unsur nomor 1 dengan 8, unsur nomor 2 dengan 9, dst.) menunjukkan kemiripan sifat atau bisa dikatakan terjadi perubahan sifat unsur yang teratur.
Bunyi hukum Oktaf Newland adalah “Jika unsur-unsur disusun berdasarkan kenaikan massa atom maka sifat unsur tersebut akan berulang setelah unsur kedelapan.”
Ternyata pengelompokan ini hanya sesuai untuk unsur-unsur ringan (Ar rendah), kira-kira sampai dengan kalisum (Ar = 40). Jika diteruskan, kemiripan sifat terlalu dipaksakan. Pada saat daftar Oktaf Newlands disusun, unsur-unsur gas mulia belum ditemukan.
Kelebihan Kekurangan
Massa atom suatu unsur diketahui sebagai dasar
untuk klasifikasi unsur.
Klasifikasi tidak dapat diperpanjang dengan benar setelah melampaui kalsium.
Periodisitas atau pengulangan dari sifat unsur yang merupakan
landasan unsur-unsur diketahui untuk pertama
kalinya.
Klasifikasi ini tidak memberikan tempat khusus
untuk hidrogen.
Bila tabel diperpanjang melalui kalsium diperoleh
transisi.
4. Hukum Mendeleev
Tahun 1869, Dmitri Ivanovich Mendeleev berdasarkan pengamatannya terhadap 63 unsur yang sudah dikenal saat itu, menyimpulkan bahwa “sifat-sifat unsur adalah fungsi periodik dari massa atom relatifnya.” Hal itu berarti jika unsur-unsur disusun menurut kenaikan massa atom relatifnya, sifat-sifat tertentu akan berulang secara periodik.
Mendeleev juga membuat suatu daftar periodik unsur. Unsur-unsur yang mempunyai persamaan sifat dan memiliki nomor elektron valensi yang sama ditempatkan dalam satu lajur vertikal yang disebut golongan. Mendeleev juga menempatkan unsur-unsur dengan berdasarkan kenaikan massa atom relatifnya dalam satu lajur horizontal, yang disebut periode.
Dalam periode, sifat dari unsur-unsur secara bertahap berubah dari logam ke nonlogam, sedangkan perpindahan logam ke nonlogam dalam golongan adalah dari kiri ke kanan.
Dalam mengelompokkan unsur-unsur, Mendeleev lebih menekankan pada persamaan sifat unsur dibandingkan dengan kenaikan massa atom
relatifnya, sehingga terdapat tempat-tempat kosong dalam tabel periodik
tersebut. Tempat-tempat kosong ini yang kemudian diramalkan akan diisi
unsur-unsur yang waktu itu belum ditemukan. Di kemudian hari
ramalan sifat
Kelebihan Kekurangan
Dapat meramalkan adanya unsur yang hilang atau
belum ditemukan.
Pasangan Anomali : Penempatan unsur yang
tidak sesuai dengan kenaikan massa atom
relatifnya karena
mempertahankan kemiripan sifat unsur dalam satu
golongannya. Dapat meramalkan lebih
rinci bagaimana sifat fisik dan kimiawi unsur yang
belum diketahui.
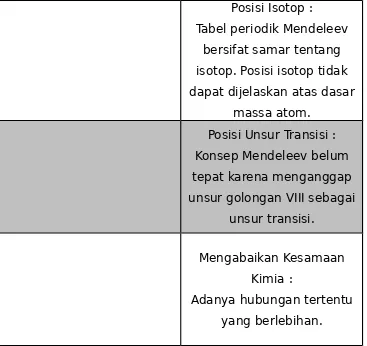
Posisi Hidrogen : Hidrogen tidak diberikan
posisi yang pasti.
Posisi Unsur Lantanida dan Aktinida :
Posisi Isotop :
Tabel periodik Mendeleev bersifat samar tentang isotop. Posisi isotop tidak dapat dijelaskan atas dasar
massa atom. Posisi Unsur Transisi : Konsep Mendeleev belum tepat karena menganggap unsur golongan VIII sebagai
unsur transisi.
Mengabaikan Kesamaan Kimia :
Adanya hubungan tertentu yang berlebihan.
5. Sistem Periodik Modern dari Henry G. Moseley
Tahun 1913, Henry G. J. Moseley menunjukkan bahwa analisis sinar-X dapat mengetahui “nomor atom yang merupakan sifat mendasar untuk suatu unsur daripada massa atomnya.” Sehingga, Moseley sedikit mengubah hukum periodik Mendeleev dan menggantikan kata massa atom dengan nomor atom.
Tabel periodik modern yang disebut juga tabel periodik bentuk panjang, disusun menurut kenaikan nomor atom dan kemiripan sifat. Tabel periodik modern ini dapat dikatakan sebagai penyempurnaan Tabel Periodik Mendeleyev.
disusun menurut kemiripan sifat dan lajur horizontal (periode) yang disusun
berdasarkan kenaikan nomor atomnya.
Unsur golongan A disebut golongan utama, sedangkan golongan B disebut golongan transisi. Golongan dapat diberi tanda nomor 1 sampai 18 berurutan dari kiri ke kanan. Berdasarkan penomoran ini, golongan transisi mempunyai nomor 3 sampai 12.
Sistem periodik modern tersusun atas 7 periode dan 18 golongan yang terbagi menjadi 8 golongan utama atau golongan A dan 8 golongan transisi atau golongan B.
a. Lajur vertikal (golongan) ditulis dengan angka Romawi terdiri atas 18
golongan.
1) Golongan A (Golongan Utama)
Gol. IA : Alkali
Gol. IIA : Alkali Tanah Gol. IIIA : Aluminium
Gol. IVA: Karbon Gol. VA : Nitrogen Gol. VIA : Kalkogen Gol. VIIA : Halogen Gol. VIIIA (0): Gas Mulia
2) Golongan Transisi/Golongan Tambahan (Golongan B)
3) Golongan Transisi Dalam, ada dua deret yaitu :
Deret Lantanida (unsur dalam deret ini mempunyai kemiripan sifat dengan 57La).Deret Aktinida (unsur dalam deret ini mempunyai kemiripan sifat dengan 89Ac).
Pada periode 6 golongan IIIB terdapat 14 unsur yang sangat mirip sifatnya, yaitu unsur-unsur Lantanida. Demikian juga pada periode 7 yaitu unsur-unsur Aktinida. Supaya tabel tidak terlalu panjang, unsur-unsur tersebut ditempatkan tersendiri pada bagian bawah sistem periodik.
4) Golongan B terletak di antara Golongan IIA dan IIIA
Golongan IA dan IIA adalah unsur logam kuat dan berada di sisi kiri unsur transisi. Sedangkan, unsur nonlogam ditempatkan disebelah kanan dari unsur transisi.
b. Lajur Horizontal (Periode) ditulis dengan angka Arab terdiri atas 7 periode.
1) Periode 1 berisi 2 unsur.
2) Periode 2 berisi 8 unsur.
3) Periode 3 berisi 8 unsur.
4) Periode 4 berisi 18 unsur.
5) Periode 5 berisi 18 unsur.
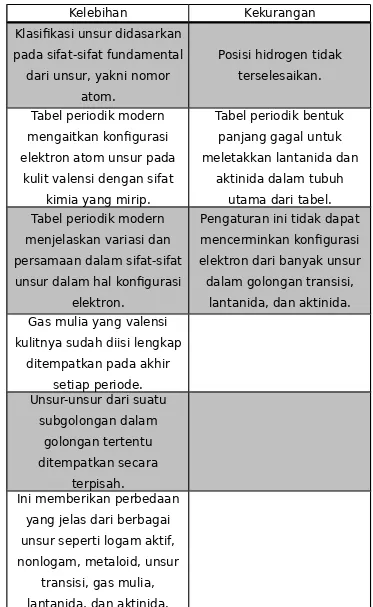
Kelebihan Kekurangan Klasifikasi unsur didasarkan
pada sifat-sifat fundamental dari unsur, yakni nomor
atom.
Posisi hidrogen tidak terselesaikan.
Tabel periodik modern mengaitkan konfigurasi elektron atom unsur pada
kulit valensi dengan sifat kimia yang mirip. unsur dalam hal konfigurasi
elektron.
Pengaturan ini tidak dapat mencerminkan konfigurasi elektron dari banyak unsur dalam golongan transisi,
lantanida, dan aktinida. Gas mulia yang valensi
kulitnya sudah diisi lengkap ditempatkan pada akhir yang jelas dari berbagai unsur seperti logam aktif, nonlogam, metaloid, unsur