TESIS
FORMULASI TABLET IBUPROFEN DENGAN SISTEM
DISPERSI PADAT DIUJI SECARA
IN VITRO DAN IN SITU
OLEH:
ANTETTI TAMPUBOLON
NIM 097014004
PROGRAM STUDI MAGISTER FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
FORMULASI TABLET IBUPROFEN DENGAN SISTEM
DISPERSI PADAT DIUJI SECARA
IN VITRO DAN IN SITU
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Magister dalam Ilmu Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ANTETTI TAMPUBOLON
NIM 097014004
PROGRAM STUDI MAGISTER FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN TESIS
Nama Mahasiswa : Antetti Tampubolon
No. Induk Mahasiswa : 097014004
Program Studi : Magister Farmasi
Judul Tesis : Formulasi Tablet Ibuprofen Dengan
Sistem Dispersi Padat Diuji Secara In
Vitro dan In Situ
Tempat dan Tanggal Ujian Lisan Tesis : Medan, 24 Januari 2012
Menyetujui:
Komisi Pembimbing,
Prof. Dr. M. T. Simanjuntak, M.Sc., Apt. NIP 195212041980021001
Ketua
Prof. Dr. Karsono, Apt.
NIP 195409091982011001
Anggota
Medan, 17 Pebruari 2012 Ketua Program Studi, Dekan,
PENGESAHAN TESIS
Nama Mahasiswa : Antetti Tampubolon
No. Induk Mahasiswa : 097014004
Program Studi : Magister Farmasi
Judul Tesis : Formulasi Tablet Ibuprofen dengan
Sistem Dispersi Padat Diuji Secara In
Vitro dan In Situ
Telah diuji dan dinyatakan LULUS di depan Tim Penguji Tesis pada hari Selasa tanggal dua puluh empat bulan Januari tahun dua ribu dua belas
Mengesahkan:
Tim Penguji Tesis
Ketua Tim Penguji : Prof. Dr. M. T. Simanjuntak, M.Sc., Apt.
Anggota Tim Penguji : Prof. Dr. Karsono, Apt.
Dr. Edy Suwarso, S.U., Apt.
FORMULASI TABLET IBUPROFEN DENGAN SISTEM DISPERSI PADAT DIUJI SECARA IN VITRO DAN IN SITU
Abstrak
Tablet merupakan sediaan yang banyak mengalami perkembangan dari segi formulasi. Pengembangan formulasi ditujukan agar diperoleh sediaan yang cepat larut dengan sistem dispersi padat. Teknik dispersi padat dibuat dengan tujuan memperkecil ukuran partikel, meningkatkan laju disolusi dan absorpsi obat yang tidak larut air. Sistem dispersi padat dalam penelitian ini menggunakan ibuprofen sebagai bahan aktif yang praktis tidak larut air, merupakan analgesik antiinflamasi non steroid yang membutuhkan onset kerja yang cepat.
Untuk membuat dispersi padat digunakan ibuprofen sebagai bahan aktif dan PEG 6000 sebagai pembawa, untuk mempercepat waktu hancur tablet ditambahkan superdesintegrant natrium kroskarmelosa dan krospovidon. Dispersi padat dibuat dengan metode peleburan dalam beberapa perbandingan berat antara ibuprofen dan PEG 6000 yaitu: 1 : 0,25; 1 : 0,5; 1 : 0,75; 1 : 1; 1 : 1,25 dan 1 : 1,5 sebagai pembanding dibuat campuran fisik dengan perbandingan yang sama. Serbuk dispersi padat yang terbentuk dikarakterisasi sifat fisiko kimia meliputi : penetapan kadar zat aktif, pola difraksi sinar –X, SEM, DTA, IR dan uji laju disolusi. Dispersi padat 1 : 0,5 kemudian diformulasi menjadi tablet dengan komposisi superdesintegrant natrium kroskarmelosa dan krospovidon dengan perbandingan : 3% : 0 (A1); 5% : 0 (A2); 7% : 0 (A3); 0 : 3% (A4); 0 : 5% (A5); 0 : 7% (A6) dan 0 : 0 (A7). Tablet dikarakterisasi meliputi : kadar zat berkhasiat, kekerasan, kerengasan, waktu hancur, keseragaman sediaan dan dissolusi. Tablet dispersi padat A2 digunakan untuk pengujian absorpsi secara in situ teknik perfusi single pass yang dibandingkan dengan serbuk ibuprofen dan tablet generik.
Hasil penelitian menunjukkan dispersi padat 1 : 0,5 memperlihatkan persen kumulatif pelepasan obat paling baik yang berbeda signifikan (p<0,05) dengan formula dispersi padat dan campuran fisik lain. Hasil evaluasi dari tujuh formula tablet dispersi padat menunjukkan tablet A2 merupakan formula terbaik ditinjau dari waktu hancur dan persen kumulatif pelepasan obat yang berbeda signifikan (p<0,05) dari formula tablet yang lain. Pengujian absorpsi secara in situ teknik perfusi single pass menunjukkan tablet A2 paling banyak diabsorpsi dibandingkan tablet generik dan bahan baku tetapi tidak berbeda signifikan (p>0,05) pada menit ke 20, 30, 45, 60 dan 90.
IBUPROFEN TABLET FORMULATION WITH SOLID DISPERSION SYSTEM TESTED IN VITRO AND IN SITU
Abstract
Tablet is the most developed pharmaceutical dosage form. Formulation development was purposed to achieve solvable dosage form using solid dispersion system. Solid dispersion technique is made to reduced the particle size, increased the dissolution rate, and water-insoluble drug absoption. Solid dispersion system in this research was using ibuprofen as the active ingredient that practically not solvable in water, ibuprofen was an on non-steroid antiinflammation analgesic that needed a rapid on set of action.
Ibuprofen was used as active ingredients while PEG 6000 as an inert vehicle in making the solid dispersion, sodium crosskarmelose and crosspovidone, two superdesintegrants added to fasten the dissolution rate. The solid dispersion was made using melting method at diffrent ratios between ibuprofen and PEG 6000 included: 1 : 0.25; 1: 0.5; 1 : 0.75; 1 : 1; 1 : 1.25 and 1 : 1.5, as comparing, the physical mixture was made with the same ratio. The solid dispersion powder formed was characterized for its physicochemical properties included : active ingredient determination, X-ray diffraction pattern, SEM, DTA, IR, and dissolution rate test. The ratio 1 : 0.5 of solid dispersion was formulated to tablet with composition of sodium crosskarmelose superdisintegrant and crosspovidone with ratio of: 3% : 0% (A1); 5% : 0% (A2); 7% : 0% (A3); 0% : 3% (A4); 0% : 5% (A5); 0% : 7% (A6) and 0% : 0% (A7). The tablet was characterized for: the active ingredient content, friability, disintegration time, uniformity of dosage unit, and dissolution rate. A2 solid dispersion tablet was used for in situ absorption test using single pass perfusion technique that compared with ibuprofen standardized materiall and its generic tablet.
The result was ratio 1 : 0.5 of solid dispersion showed the drug release cumulative percentage which significantly different in statistic calculation (p<0.05) with solid dispersion formulation and other physical mixture. The evaluation result showed that of the seven solid dispersion formulation tablets, the A2 tablet was the best formula assessed from disintegration time and showed the best cumulative percentage in drug release that significantly different in statistical calculation (p<0.05) compared to the other tablet formula. The result of in situ absorption test using single pass perfusion technique, A2 solid dispersion tablet was the most absorbed compared to generic tablet and standarized material. The result showed that there was no significant difference in statistic calculation (p<0.05) at 20, 30, 45, 60 and 90 minutes.
KATA PENGANTAR
Puji dan syukur saya panjatkan kepada Tuhan Yang Maha Esa karena kasih
dan karuniaNya penulis dapat menyelesaikan tesis ini dengan judul Formulasi Tablet
Ibuprofen Dengan Sistem Dispersi Padat Diuji Secara In Vitro dan In Situ sebagai
salah satu syarat untuk mencapai gelar Magister Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara.
Selama menyelesaikan penelitian dan penulisan tesis ini, penulis telah banyak
mendapatkan bantuan dan dorongan dari berbagai pihak baik moril maupun materil.
Untuk itu penulis ingin menghaturkan penghargaan dan terimakasih yang tiada
terhingga kepada :
1. Rektor Universitas Sumatera Utara, Bapak Prof. Dr. dr. Syahril Pasaribu,
DTM&H., M.Sc., (CTM)., Sp.A(K)., atas kesempatan dan fasilitas yang
diberikan kepada penulis untuk mengikuti dan menyelesaikan program Magister.
2. Dekan Fakultas Farmasi Universitas Sumatera Utara, Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., yang telah menyediakan fasilitas dan kesempatan bagi
penulis menjadi mahasiswa Program Studi Magister Farmasi Fakultas Farmasi.
3. Ketua Program Studi Magister Farmasi Fakultas Farmasi Universitas Sumatera
Utara, Bapak Prof. Dr. Karsono, Apt., dan juga selaku pembimbing II yang
memberikan dorongan dan semangat sehingga penulis terpacu untuk
menyelesaikan pendidikan Program Magister Farmasi.
4. Bapak Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt., selaku pembimbing I dan
juga selaku Kepala Laboratorium Biofarmasetika dan Farmakokinetika yang telah
membimbing, mengarahkan dan memberikan dorongan dengan penuh kesabaran
5. Bapak Dr. Edy Suwarso, S.U., Apt., dan Bapak Dr. Kasmirul Ramlan Sinaga,
MS., Apt., sebagai penguji.
6. Bapak Dr. Nurul Taufiqu Rochman, Kepala Laboratorium Penelitian Fisika LIPI
beserta staf.
7. Ibu Dra. Fat Aminah, M.Sc., Apt., Kepala Laboratorium Formulasi Tablet beserta
staf.
8. Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, S.U., Apt., Kepala Laboratorium
Penelitian beserta staf.
Serta semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah
banyak membantu dalam penelitian tesis ini. Kiranya Tuhan Yang Maha Esa
memberikan balasan yang berlipat ganda atas kebaikan dan bantuan yang telah
diberikan kepada penulis.
Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan, sehingga
penulis mengharapkan kritik dan saran yang bersifat membangun. Akhir kata semoga
tulisan ini dapat menjadi sumbangan yang berarti bagi ilmu pengetahuan khususnya
bidang farmasi.
Medan, Pebruari 2012 Penulis
DAFTAR ISI
Halaman
JUDUL ………... i
LEMBAR PENGESAHAN ………... iii
ABSTRAK ... v
ABSTRACK ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Kerangka Pikir Penelitian ... 4
1.3 Perumusan Masalah ... 6
1.4 Hipotesis Penelitian ... 6
1.5 Tujuan Penelitian ... 6
1.6 Manfaat Penelitian ... 7
BAB II TINJAUAN PUSTAKA ... 8
2.1 Dispersi Padat ... 8
2.1.1 Latar Belakang Sejarah ... 8
2.1.2 Definisi dan Metode Persiapan Dispersi Padat .. 9
2.1.2.1 Definisi ... 9
2.1.2.2.1 Metode Pelelehan ... 9
2.1.2.2.2 Metode Pelarutan ... 10
2.1.2.2.3 Metode Pelarutan-Pelelehan 10
2.1.3 Klasifikasi dan Mekanisme Lepas Cepat ... 11
2.1.4 Pembawa Dispersi Padat ... 13
2.1.5 Metode Pembuatan Tablet ... 14
2.2 Ibuprofen ... 15
2.2.1 Sifat Fisikokimia ... 15
2.2.2 Farmakokinetik ... 16
2.2.3 Farmakodinamik ... 16
2.2.4 Indikasi dan Dosis Terapi ... 17
2.3 Absorpsi ... 17
2.3.1 Membran Sel ... 18
2.3.2 Transpor Molekul melalui Membran ... 19
2.3.3 Metode Absorpsi In Situ ... 21
2.3.3.1 Metode Perfusi Intestinal... 21
2.3.3.2 Metode Perfusi Intestinal Loop Terbuka atau Teknik Perfusi Single Pass ... 22
2.4 Usus Halus ... 23
BAB III METODE PENELITIAN ... 25
3.1 Rancangan Penelitian ... 25
3.2 Tempat dan Waktu Penelitian ... 26
3.3 Bahan dan Alat ... 26
3.3.1 Bahan ... 26
3.4 Hewan Percobaan ... 27
3.5 Prosedur Kerja ... 27
3.5.1 Pembuatan Pereaksi ... 27
3.5.1.1 Air Bebas Karbondioksida ... 27
3.5.1.2 Natrium Hidroksida 0,1 N... 27
3.5.1.3 Natrium Hidroksida 0,2 N ... 27
3.5.1.4 Kalium Fosfat Monobasa 0,2 M ... 27
3.5.1.5 Dapar Fosfat pH 5,9 isotonis ... 28
3.5.1.6 Dapar Fosfat pH 7,2 ... 28
3.5.1.7 Larutan Fisiologis NaCl 0,9 % ... 28
3.5.2 Pembuatan Kurva Serapan Ibuprofen ... 28
3.5.2.1 Dalam Medium NaOH 0,1 N ... 28
3.5.2.2 Dalam Medium Dapar Fosfat pH 5,9 Isotonis ... 29
3.5.2.3 Dalam Medium Dapar Fosfat pH 7,2 ... 29
3.5.3 Pembuatan Kurva Kalibrasi Ibuprofen ... 29
3.5.3.1 Dalam Medium NaOH 0,1 N ... 29
3.5.3.2 Dalam Medium Dapar Fosfat pH 5,9 Isotonis ... 30
3.5.3.3 Dalam Medium Dapar Fosfat pH 7,2 ... 30
3.5.3.4 Pembuatan Dispersi Padat dan Campuran Fisik ... 31
3.5.4 Karakterisasi Serbuk Dispersi Padat ... 31
3.5.4.1 Uji perolehan kembali zat aktif dalam sistem dilakukan dengan penetapan kadar zat berkhasiat dalam serbuk dispersi padat dan campuran fisik ... 31
3.5.4.3 Scanning Elektron Mikroskop (SEM) ... 32
3.5.4.4 Diffrensial Thermal Analyzer (DTA) ... 32
3.5.4.5 Spectra Fourier-Transform IR …………... 33
3.5.4.6 Uji Disolusi ……… 33
3.5.5 Pembuatan Tablet Ibuprofen Sistem Dispersi Padat 34
3.5.6 Uji Praformulasi ... 34
3.5.6.1 Sudut Diam ... 34
3.5.6.2 Waktu Alir Granul ... 35
3.5.6.3 Indeks Tap ... 35
3.5.7 Karakterisasi Tablet Ibuprofen Sistem Dispersi Padat ... 36
3.5.7.1 Penetapan kadar Zat berkhasiat ... 36
3.5.7.2 Uji Kekerasan ... 36
3.5.7.3 Uji Kerengasan ... 37
3.5.7.4 Keseragaman Sediaan ... 37
3.5.7.5 Uji Waktu Hancur ... 38
3.5.7.6 Uji Disolusi ... 38
3.5.7 Absorbsi Secara In Situ dalam Duodenum Tikus ... 39
3.5.8.1 Pembedahan ... 39
3.5.8.2 Pengujian Absorbsi secara In Situ Teknik Perfusi Single Pass ... 39
3.6 Analisa Data ... 41
BAB IV HASIL DAN PEMBAHASAN ... 42
4.1 Karakterisasi Dispersi Padat ... 42
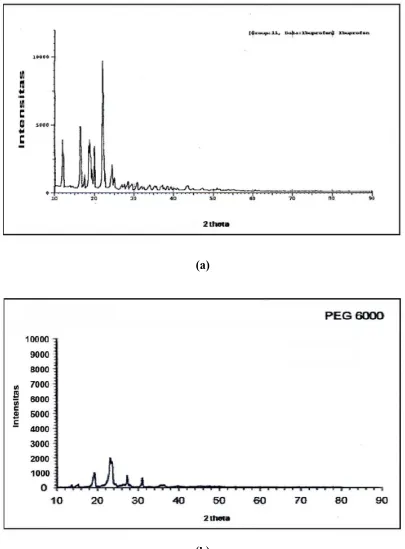
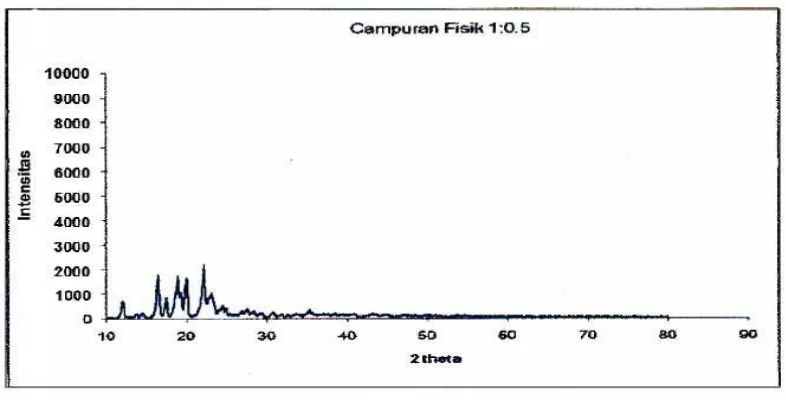
4.1.1 Difraksi sinar - X (X.R.D) ... 42
4.1.3 Scanning Elektron Microscopy (SEM) ... 48
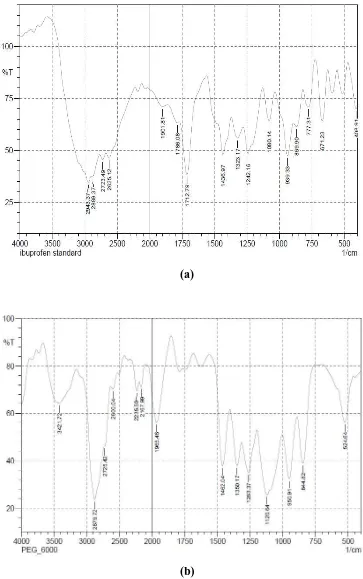
4.1.4 Spektra Fourier Transform Infra Merah ... 51
4.1.5 Uji Perolehan kembali Zat Aktif ... 55
4.1.6 Uji Pelepasan Obat ... 55
4.2 Pembuatan Tablet Ibuprofen sistem Dispersi Padat ... 58
4.3 Karakterisasi Tablet Ibuprofen Sistem Dispersi Padat ... 59
4.3.1 Penetapan Zat Berkhasiat ... 59
4.3.2 Uji Kekerasan ... 59
4.3.3 Uji Kerengasan ... 60
4.3.4 Uji Waktu Hancur ... 61
4.3.5 Keseragaman Sediaan ... 62
4.3.6 Uji Pelepasan Obat secara In Vitro ... ... 63
4.4. Pengujian Absorpsi secara In Situ Teknik Perfusi Single Pass ... 65
BAB V KESIMPULAN DAN SARAN ... 70
5.1 Kesimpulan ... 70
5.2 Saran ... 70
DAFTAR TABEL
Halaman
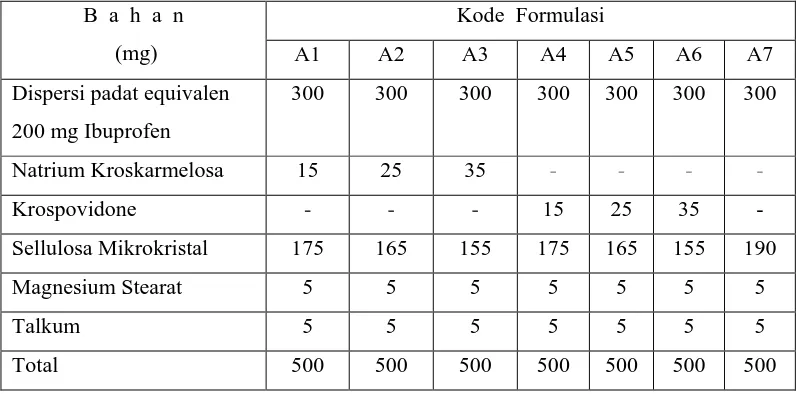
Tabel 3.1 Formula Tablet Ibuprofen Sistem Dispersi Padat dengan
Variasi Komposisi Superdisintegrant ... 34
Tabel 4.1 Hasil Penetapan Kadar Ibuprofen dalam berbagai Formula
Dispersi Padat dan Campuran Fisik ... 55
Tabel 4.2 Hasil Uji Pra Formulasi berbagai Formula Tablet Ibuprofen
Sistem Dispersi Padat ... 58
Tabel 4.3 Hasil Penetapan Kadar Ibuprofen dalam berbagai Formula
Tablet Sistem Dispersi Padat ... 59
Tabel 4.4 Hasil Uji Kekerasan dari berbagai Formula Tablet Ibuprofen Sistem Dispersi Padat ... 60
Tabel 4.5 Hasil Uji Friabilitas dari berbagai Formula Tablet Ibuprofen Sistem Dispersi Padat ... 60
Tabel 4.6 Hasil Uji Waktu Hancur berbagai Formula Tablet Ibuprofen Sistem Dispersi Padat ... 61
Tabel 4.7 Hasil Uji Keragaman Bobot berbagai Formula Tablet IbuprofenSistem Dispersi Padat ... 62
DAFTAR GAMBAR
Halaman
Gambar 1.1 Kerangka Pikir Penelitian ……….... 5
Gambar 2.1 Fase Diagram Sistem Eutetik ... 12
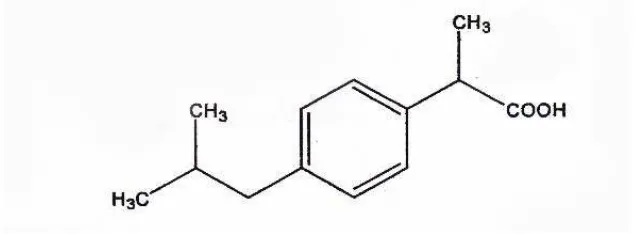
Gambar 2.2 Rumus Bangun Ibuprofen ... 16
Gambar 4.1 Grafik hasil Difraksi Sinar- X dari: (a) Ibuprofen (b) PEG 6000 (c) Dispersi Padat 1 : 0,5 (d) Dispersi Padat 1 : 1 (e) Campuran Fisik 1 : 0,5 dan (f)
Campuran Fisik 1 : 1 ... 45
Gambar 4.2 Grafik yang menggambarkan Diffrential Thermal Analyzer dari: (a) Ibuprofen (b) PEG 6000 (c) Dispersi Padat 1 : 0,5 (d) Dispersi Padat 1 : 1 (e)
Campuran Fisik 1 : 0,5 dan (f) Campuran Fisik 1 : 1 ... 47
Gambar 4.3 Ukuran partikel dilihat menggunakan SEM dari: (a) Ibuprofen (b) PEG 6000 (c) Dispersi Padat 1 : 0,5 (d) Dispersi Padat 1 : 1 (e) Campuran Fisik 1 : 0,5
dan (f) Campuran Fisik 1 : 1 ... 51
Gambar 4.4 Grafik Spektrum Fourier-Transform Infra Red dari: (a) Ibuprofen (b) PEG 6000 (c) Dispersi Padat 1 : 0,5 (d) Dispersi Padat 1 : 1 (e) Campuran Fisik 1 : 0,5 dan
(e) Campuran Fisik 1 : 1 ... 54
Gambar 4.5 Profil disolusi dari: (a) Ibuprofen, berbagai formula Dispers i padat dan campuran fisik (b) Ibuprofen dan berbagai formula dispersi padat dan (c)
Ibuprofen dan berbagai Formula campuran fisik ... 58
Gambar 4.6 Profil disolusi dari: (a) Berbagai formula tablet dispersi Padat (b) Tablet dispersi padat dengan superdesinteg- rant natrium kroskarmelosa dan (c) Tablet dispersi
padat dengan superdesintegrant Krospovidon ... 65
Gambar 4.7 Tablet Dispersi Padat dalam berbagai Formula ... 66
Gambar 4.8 Grafik Ibuprofen yang tidak terabsorpsi ... 67
Gambar 4.9 Grafik Ibuprofen yang terabsorpsi ... 67
Gambar 4.10 Grafik Ibuprofen yang terabsorpsi dengan persamaan
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Kurva Absorpsi Ibuprofen dalam NaOH 0,1N ……… 76
Lampiran 2 Kurva Kalibrasi Ibuprofen dalam NaOH 0,1N ……… 77
Lampiran 3 Kurva Absorpsi Ibuprofen dalam Dapar Fosfat pH 7,2 78
Lampiran 4 Kurva Kalibrasi Ibuprofen dalam Dapar Fosfat pH 7,2 . 79
Lampiran 5 Kurva Absorpsi Ibuprofen pada Duodenum Tikus secara In Situ dalam Dapar Fosfat pH 5,9
Isotonis ... ... 80
Lampiran 6 Kurva Kalibrasi Ibuprofen dalam Dapar Fosfat
pH 5,9 Isotonis ... 81
Lampiran 7 Data Uji Penetapan Kadar Ibuprofen dalam
Dispersi Padat dan Campuran Fisik ... 82
Lampiran 8 Data Uji Pelepasan Obat In Vitro Menggunakan Dissolution Tester dari Ibuprofen, Dispersi Padat
dan Campuran Fisik... 88
Lampiran 9 Data Uji Penetapan Kadar Tablet Ibuprofen Sistem
Dispersi Padat ... 127
Lampiran 10 Perhitungan Keragaman Bobot ………... 131
Lampiran 11 Data Uji Keragaman Bobot Tablet Ibuprofen Sistem
Dispersi Padat ……… 135
Lampiran 12 Data Uji Pelepasan Obat In Vitro Menggunakan Dissolution Tester dari Tablet Ibuprofen Sistem
Dispersi Padat ... 142
Lampiran 13 Contoh Perhitungan Konsentrasi Larutan Obat
Ibuprofen 0,9977 mmol ... 163
Lampiran 14 Contoh Perhitungan Konsentrasi Ibuprofen yang Terabsorbsi dari Ibuprofen secara In Situ dalam
Duodenum Tikus Jantan Galur Wistar ... 164
Duodenum Tikus Jantan Galur Wistar ... 166
Lampiran 16 Data Uji Ibuprofen yang Terabsorbsi dari Ibuprofen, Tablet Dispersi Padat dan Tablet Generik secara In Situ dalam Duodenum Tikus
Jantan Galur Wistar ... 167
Lampiran 17 Penentuan Persamaan Regresi Ibuprofen yang Terabsorpsi secara In Situ dalam Duodenum Tikus
Jantan Galur Wistar ... 168
Lampiran 18 Hasil Uji Anova dan Duncan Pelepasan Obat Secara in vitro dari Ibuprofen, dan berbagai
Formula Dispersi Padat serta Campuran Fisik ... 170
Lampiran 19 Hasil Uji Anova dan Duncan Pelepasan Obat Secara In Vitro dari Berbagai Formula Tablet
Sistem Dispersi Padat ... . 178
Lampiran 20 Hasil Uji Anova dan Duncan Ibuprofen yang Terabsorpsi dari Sediaan Ibuprofen, Tablet Dispersi Padat dan Generik secara In Situ ... 185
Lampiran 21 Sertifikat Analisa Bahan Baku Ibuprofen ... 188
Lampiran 22 Sertifikat Hewan Percobaan …………... 189
Lampiran 23 Gambar Percobaan Absorpsi secara In Situ
Teknik Perfusi Single Pass ... 190
FORMULASI TABLET IBUPROFEN DENGAN SISTEM DISPERSI PADAT DIUJI SECARA IN VITRO DAN IN SITU
Abstrak
Tablet merupakan sediaan yang banyak mengalami perkembangan dari segi formulasi. Pengembangan formulasi ditujukan agar diperoleh sediaan yang cepat larut dengan sistem dispersi padat. Teknik dispersi padat dibuat dengan tujuan memperkecil ukuran partikel, meningkatkan laju disolusi dan absorpsi obat yang tidak larut air. Sistem dispersi padat dalam penelitian ini menggunakan ibuprofen sebagai bahan aktif yang praktis tidak larut air, merupakan analgesik antiinflamasi non steroid yang membutuhkan onset kerja yang cepat.
Untuk membuat dispersi padat digunakan ibuprofen sebagai bahan aktif dan PEG 6000 sebagai pembawa, untuk mempercepat waktu hancur tablet ditambahkan superdesintegrant natrium kroskarmelosa dan krospovidon. Dispersi padat dibuat dengan metode peleburan dalam beberapa perbandingan berat antara ibuprofen dan PEG 6000 yaitu: 1 : 0,25; 1 : 0,5; 1 : 0,75; 1 : 1; 1 : 1,25 dan 1 : 1,5 sebagai pembanding dibuat campuran fisik dengan perbandingan yang sama. Serbuk dispersi padat yang terbentuk dikarakterisasi sifat fisiko kimia meliputi : penetapan kadar zat aktif, pola difraksi sinar –X, SEM, DTA, IR dan uji laju disolusi. Dispersi padat 1 : 0,5 kemudian diformulasi menjadi tablet dengan komposisi superdesintegrant natrium kroskarmelosa dan krospovidon dengan perbandingan : 3% : 0 (A1); 5% : 0 (A2); 7% : 0 (A3); 0 : 3% (A4); 0 : 5% (A5); 0 : 7% (A6) dan 0 : 0 (A7). Tablet dikarakterisasi meliputi : kadar zat berkhasiat, kekerasan, kerengasan, waktu hancur, keseragaman sediaan dan dissolusi. Tablet dispersi padat A2 digunakan untuk pengujian absorpsi secara in situ teknik perfusi single pass yang dibandingkan dengan serbuk ibuprofen dan tablet generik.
Hasil penelitian menunjukkan dispersi padat 1 : 0,5 memperlihatkan persen kumulatif pelepasan obat paling baik yang berbeda signifikan (p<0,05) dengan formula dispersi padat dan campuran fisik lain. Hasil evaluasi dari tujuh formula tablet dispersi padat menunjukkan tablet A2 merupakan formula terbaik ditinjau dari waktu hancur dan persen kumulatif pelepasan obat yang berbeda signifikan (p<0,05) dari formula tablet yang lain. Pengujian absorpsi secara in situ teknik perfusi single pass menunjukkan tablet A2 paling banyak diabsorpsi dibandingkan tablet generik dan bahan baku tetapi tidak berbeda signifikan (p>0,05) pada menit ke 20, 30, 45, 60 dan 90.
IBUPROFEN TABLET FORMULATION WITH SOLID DISPERSION SYSTEM TESTED IN VITRO AND IN SITU
Abstract
Tablet is the most developed pharmaceutical dosage form. Formulation development was purposed to achieve solvable dosage form using solid dispersion system. Solid dispersion technique is made to reduced the particle size, increased the dissolution rate, and water-insoluble drug absoption. Solid dispersion system in this research was using ibuprofen as the active ingredient that practically not solvable in water, ibuprofen was an on non-steroid antiinflammation analgesic that needed a rapid on set of action.
Ibuprofen was used as active ingredients while PEG 6000 as an inert vehicle in making the solid dispersion, sodium crosskarmelose and crosspovidone, two superdesintegrants added to fasten the dissolution rate. The solid dispersion was made using melting method at diffrent ratios between ibuprofen and PEG 6000 included: 1 : 0.25; 1: 0.5; 1 : 0.75; 1 : 1; 1 : 1.25 and 1 : 1.5, as comparing, the physical mixture was made with the same ratio. The solid dispersion powder formed was characterized for its physicochemical properties included : active ingredient determination, X-ray diffraction pattern, SEM, DTA, IR, and dissolution rate test. The ratio 1 : 0.5 of solid dispersion was formulated to tablet with composition of sodium crosskarmelose superdisintegrant and crosspovidone with ratio of: 3% : 0% (A1); 5% : 0% (A2); 7% : 0% (A3); 0% : 3% (A4); 0% : 5% (A5); 0% : 7% (A6) and 0% : 0% (A7). The tablet was characterized for: the active ingredient content, friability, disintegration time, uniformity of dosage unit, and dissolution rate. A2 solid dispersion tablet was used for in situ absorption test using single pass perfusion technique that compared with ibuprofen standardized materiall and its generic tablet.
The result was ratio 1 : 0.5 of solid dispersion showed the drug release cumulative percentage which significantly different in statistic calculation (p<0.05) with solid dispersion formulation and other physical mixture. The evaluation result showed that of the seven solid dispersion formulation tablets, the A2 tablet was the best formula assessed from disintegration time and showed the best cumulative percentage in drug release that significantly different in statistical calculation (p<0.05) compared to the other tablet formula. The result of in situ absorption test using single pass perfusion technique, A2 solid dispersion tablet was the most absorbed compared to generic tablet and standarized material. The result showed that there was no significant difference in statistic calculation (p<0.05) at 20, 30, 45, 60 and 90 minutes.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Pemberian oral adalah rute terapi yang paling umum dan nyaman (Griffin, et
al., 2005). Hampir 80% obat-obatan diberikan melalui oral diantaranya adalah
sediaan tablet. Tablet merupakan salah satu sediaan yang banyak mengalami
perkembangan dari segi formulasi. Pengembangan formulasi ditujukan agar
diperoleh sediaan yang lebih cepat larut sehingga dapat meningkatkan laju absorpsi
dan bioavailabilitas obat (Aiache, 1982). Pengembangan formula dimaksud adalah
tablet dengan sistem dispersi padat.
Dispersi padat adalah dispersi satu atau lebih bahan aktif dalam suatu pembawa
inert atau matriks dalam bentuk padat yang dibuat dengan metode peleburan,
pelarutan atau pelarutan-peleburan. Teknik dispersi padat pertama kali diperkenalkan
oleh Sekiguchi dan Obi tahun 1961 dengan pembawa yang mudah larut diantaranya:
polivinilpirolidon, polietilen glikol, dan urea dengan tujuan untuk memperkecil
ukuran partikel, meningkatkan laju dissolusi dan absorpsi obat yang tidak larut dalam
air (Chiou dan Riegelman, 1971).
Laju disolusi atau kecepatan melarut obat yang relatif tidak larut dalam air telah
lama menjadi masalah pada industri farmasi. Ibuprofen termasuk pada senyawa
model biopharmaceutical classifikasi system (BCS) II, permeabilitas tinggi kelarutan
rendah (Daham dan Amidon, 2009). Untuk obat yang mempunyai kelarutan rendah
laju disolusi merupakan tahap penentu pada proses absorpsi obat (Shargel dan Yu,
Pembentukan sistem dispersi padat dalam pembawa yang mudah larut telah luas
digunakan diantaranya adalah polietilen glikol (PEG). Umumnya, PEG dengan bobot
molekul 1500 - 20.000 yang digunakan untuk pembuatan dispersi padat. PEG dengan
bobot molekul 4000 - 6000 paling sering digunakan untuk pembuatan dispersi padat.
Umumnya proses pembuatan dispersi padat dengan PEG 6000 menggunakan metode
peleburan karena lebih sederhana dan murah (Leuner dan Dressman, 2000).
Sistem dispersi padat menggunakan ibuprofen sebagai bahan aktif yang praktis
tidak larut dalam air dan polietilen glikol 6000 digunakan sebagai pembawa inert
yang mudah larut dalam air. Ibuprofen merupakan golongan obat anti-inflamasi non
steroid derivat asam propionat yang mempunyai aktivitas anti radang dan analgesik
yang tinggi, terutama digunakan untuk mengurangi rasa nyeri akibat peradangan
pada kondisi rematik dan arthritis (Trevor, et al., 2005). Terapi demikian umumnya
membutuhkan pelepasan obat yang cepat dan segera mendapatkan respon
farmakologi yang diinginkan, sehingga ibuprofen sesuai dibuat dengan sistem
dispersi padat.
Hasil penelitian melaporkan bahwa sistem dispersi padat dapat meningkatkan
kelarutan dan bioavailabilitas dari ibuprofen dengan menggunakan PEG 8000 (Newa,
et al., 2008a). Demikian pula halnya, dapat terjadi peningkatan kelarutan ibuprofen
dengan menggunakan PEG 4000 (Newa, et al., 2008b). Beberapa penelitian
sebelumnya melaporkan bahwa terjadi pembentukan kompleks dan interaksi antara
ibuprofen dengan polivinilasetat ftalat dan polivinilpirolidon serta interaksi antara
ibuprofen dengan eudragit RL 100 dalam sistem dispersi yang dibuat dengan tehnik
pelarutan (Kumar dan Yang 2001; Pignatello, et al., 2004). Pembentukan campuran
eutektik ibuprofen dengan setil alkohol terjadi selama proses penyalutan tablet
Sistem dispersi padat dengan obat ibuprofen digunakan untuk pengembangan
formula tablet. Tablet diformulasi dengan metode cetak langsung karena metode ini
lebih mudah dan murah (Lieberman, et al., 1990). Untuk mempercepat desintegrasi
tablet ditambahkan superdesintegrant (bahan penghancur). Bahan penghancur akan
membantu hancurnya tablet menjadi granul, selanjutnya menjadi partikel penyusun,
sehingga akan meningkatkan kecepatan disolusi tablet. Pemilihan jenis dan jumlah
superdesintegrant yang tepat sangat penting dalam pengembangan formula tablet.
Untuk mempercepat hancurnya tablet sistem dispersi padat dipilih krospovidon dan
natrium kroskarmelosa sebagai superdesintegrant, karena bahan ini mempunyai
mekanisme aksi kapiler (wicking) dan mengembang (swelling) (Rowe, et al., 2003).
Menurut Ansel (1989) obat yang diberikan secara oral harus menembus
membran lambung usus (lambung-usus halus dan usus besar). Absorpsi obat melalui
saluran cerna pada umumnya terjadi secara difusi pasif. Absorpsi obat di usus halus
selalu lebih cepat dibandingkan di lambung karena permukaan epitel usus halus jauh
lebih luas dibandingkan epitel lambung (Ganiswara, 1995).
Banyak variasi metode yang digunakan untuk meneliti absorpsi obat di usus,
diantaranya adalah metode in situ. Metode ini adalah metode yang paling dekat
dengan sistem in vivo. Metode in situ memiliki kelebihan dibandingkan metode in
vitro, meskipun hewan telah dianastesi dan dimanipulasi secara pembedahan aliran
darah mesentrik masih tetap utuh (Griffin dan Driscol, 2006).
Dari uraian tersebut diatas, maka perlu dilakukan suatu penelitian tentang
formulasi tablet ibuprofen dengan sistem dispersi padat yang diuji secara in vitro dan
1.2 Kerangka Pikir Penelitian
Berdasarkan latar belakang diatas, maka diharapkan sistem dispersi padat dapat
meningkatkan laju disolusi ibuprofen yang kemudian dikembangkan menjadi tablet
cepat larut dengan menggunakan superdesintegrant. Pengamatan dimulai dari
pembuatan dispersi padat dan karakterisasinya, pembuatan sediaan tablet,
karakterisasi fisik, pelepasan secara in vitro dan absorpsi in situ pada usus halus
tikus. Parameter yang diukur dalam penelitian ini adalah : 1) untuk dispersi padat
adalah uji perolehan kembali zat aktif, pola difraksi sinar X, SEM, DTA, IR serta
disolusi, dan 2) untuk tablet dispersi padat, antara lain: kadar zat aktif, kekerasan,
kerengasan, keragaman bobot, waktu hancur, disolusi, dan absorpsi secara in situ.
Secara skematis kerangka pikir penelitian ini ditunjukkan pada Gambar 1.1.
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Kerangka Pikir Penelitian PEG
6000
Ibuprofen
Dispersi padat
Karakterisasi
Pola difraksi sinar
S E M
Uji perolehan kembali zat aktif
Karakterisasi Fisik
Kekerasan
Kerengasan
Keseragaman bobot
Waktu hancur
Profil pelepasan
in vitro
Super Desintegrant
Tablet dispersi
padat
Absorpsi secara
in situ
D.T.A
I.R
Disolusi
Kadar zat berkhasiat
Disolusi Uji
Praformulasi
Sudut Diam
Waktu Alir Granul
1.3 Perumusan Masalah
Dari uraian diatas, rumusan masalah dalam penelitian ini adalah sebagai
berikut:
a) Apakah perbedaan jumlah PEG 6000 dan ibuprofen dalam sistem dispersi padat
mempengaruhi laju disolusi ibuprofen?
b) Apakah superdesintegrant natrium kroskarmelosa dan krospovidon dalam tablet
sistem dispersi padat akan mempengaruhi laju disolusi tablet ibuprofen?
c) Apakah tablet ibuprofen sistem dispersi padat dapat diabsorpsi secara in situ pada
usus halus tikus?
1.4 Hipotesis Penelitian
Berdasarkan perumusan masalah penelitian diatas, maka dapat diambil
hipotesis sebagai berikut:
a) Perbedaan jumlah PEG 6000 dan ibuprofen dalam sistem dispersi padat
mempengaruhi laju disolusi ibuprofen.
b) Perbedaan superdesintegrant natrium kroskarmelosa dan krospovidon dalam
tablet sistem dispersi padat mempengaruhi laju disolusi tablet ibuprofen.
c) Tablet ibuprofen sistem dispersi padat dapat diabsorpsi secara in situ pada usus
halus tikus.
1.5 Tujuan Penelitian
a) Untuk mengetahui perbedaan jumlah PEG 6000 dan ibuprofen dalam sistem
dispersi padat mempengaruhi laju disolusi ibuprofen.
b) Untuk mengetahui perbedaan superdesintegrant natrium kroskarmelosa dan
krospovidon dalam tablet sistem dispersi padat mempengaruhi laju disolusi
c) Untuk mengetahui tablet ibuprofen sistem dispersi padat dapat diabsorpsi
secara in situ pada usus halus tikus.
1.6 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat bermanfaat untuk pengembangan ilmu
pengetahuan dan teknologi formulasi pada industri farmasi dalam memformulasi
BAB II
TINJAUAN PUSTAKA
2.1 Dispersi Padat
2.1.1 Latar Belakang Sejarah
Pengaruh ukuran partikel obat terhadap laju disolusi dan bioavailabitas ditinjau
ulang secara komprehensif memperlihatkan bahwa obat-obat yang laju absorpsi pada
saluran pencernaan dibatasi oleh disolusi, pengurangan ukuran partikelnya umumnya
meningkatkan laju absorpsi dan bioavailabilitas total. Hal ini umum terjadi pada obat
yang sukar larut dalam air. Sebagai contoh, dosis terapi griseofulvin menurun sampai
50% dengan mikronisasi (Chiou dan Riegelman, 1971), dan juga menghasilkan level
darah yang lebih konstan dan tepat. Dosis komersial spironolakton juga menurun
sampai setengahnya hanya dengan sedikit pengurangan ukuran partikel (Levy, 1963).
Menurut Chiou dan Riegelman (1971) pengurangan ukuran partikel dapat
dilakukan dengan: a) triturasi konvensional dan pengerusan, b) bola-bola penggiling
(balmilling), c) mikronisasi energi cairan, d) pengendapan terkontrol dengan
perubahan pelarut atau suhu, aplikasi gelombang ultrasonik, dan semprot kering
(spray drying), e) pemberian cairan ketika dilusi dengan cairan lambung, dan f)
pemberian garam yang larut air dari senyawa yang sukar larut sehingga bentuk netral
akan mengendap dalam bentuk yang sangat halus dalam cairan saluran pencernaan.
2.1.2 Definisi dan Metode Persiapan Dispersi Padat
Dispersi padat adalah dispersi satu atau lebih bahan aktif dalam pembawa inert
atau matris pada keadaan padat yang dilakukan dengan pelelehan, pelarutan, atau
pelelehan-pelarutan (Chiou dan Riegelman, 1971).
2.1.2.2 Metode Persiapan Dispersi Padat
2.1.2.2.1 Metode Pelelehan
Metode ini pertama kali diusulkan Sekiguchi dan Obi tahun 1961. Untuk
membuat bentuk sediaan dispersi padat. Campuran obat dan pembawa yang larut air
dilebur secara langsung sampai meleleh. Campuran tersebut didinginkan dan
dibekukan pada penangas berisi es (ice bath) dengan pengadukan kuat. Masa padat
dihancurkan, diserbuk dan diayak (Goldberg, et al., 1966). Massa padat tersebut
biasanya membutuhkan penyimpanan satu hari atau lebih dalam desikator pada suhu
kamar untuk pengerasan dan kemudahan diserbuk (Levy, 1963).
Keuntungan utama metode ini adalah sederhana dan ekonomis. Sebagai
tambahan dapat dicapai supersaturasi zat terlarut atau obat pada sistem dengan
mengkristalkan lelehan langsung secara cepat dari temperatur tinggi Dibawah
kondisi seperti itu, molekul zat terlarut tertahan pada matriks pelarut dengan proses
pemadatan langsung. Sehingga didapat dispersi kristalit yang lebih halus dari sistem
campuran eutetis sederhana bila metode ini digunakan. Kekurangannya adalah
banyak zat baik obat atau pembawa, dapat terurai atau menguap selama proses
2.1.2.2.2 Metode Pelarutan
Metode ini telah lama digunakan dalam pembuatan dispersi padat atau kristal
campuran senyawa organik dan anorganik (Chiou dan Riegelman, 1971). Dispersi
padat dibuat dengan melarutkan campuran dua komponen padat dalam suatu pelarut
umum, diikuti dengan penguapan pelarut. Metode ini digunakan untuk membuat
dispersi padat ß- karoten-polivinilpirolidon (Tachibana dan Nakamura, 1965),
sulfathiazol-polivinilpirolidon (Simonelli, et al., 1969). Salah satu syarat penting
untuk pembuatan dispersi padat dengan metode pelarutan adalah bahwa obat dan
pembawa cukup larut dalam pelarut. Suhu yang digunakan untuk penguapan pelarut
biasanya terletak pada kisaran 23-65º C (Leuner dan Dressman, 2000). Keuntungan
utama dari metode ini adalah penguraian obat atau pembawa dapat dicegah karena
penguapan pelarut terjadi pada suhu rendah. Kekurangannya adalah biaya mahal,
kesukaran memisahkan pelarut secara sempurna, kemungkinan efek merugikan dari
pelarut yang jumlahnya dapat diabaikan terhadap stabilitas obat, pemilihan pelarut
umum yang mudah menguap, dan kesukaran menghasilkan kembali bentuk kristal
(Chiou dan Riegelman, 1971).
2.1.2.2.3 Metode Pelarutan-Pelelehan
Sistem dispersi padat dibuat dengan melarutkan dahulu obat dalam pelarut yang
sesuai dan mencampurnya dengan lelehan polietilen glikol, dapat dicapai dibawah
2.1.3 Klasifikasi dan Mekanisme Lepas Cepat
Sistem dispersi padat dapat digolongkan berdasarkan mekanisme lepas
cepatnya. Sistem ini dapat digolongkan menjadi enam kelompok sebagai berikut
(Chiou dan Riegelman, 1971; Leuner dan Dressman, 2000);
1. Campuran eutetik sederhana.
2. Larutan padat.
3. Larutan kaca dan suspensi kaca.
4. Endapat amorf obat dalam pembawa kristal.
5. Pembentukan senyawa atau kompleks antara obat dan pembawa.
6. Berbagai kombinasi dari kelompok 1 sampai 5.
Campuran Eutetik Sederhana
Campuran ini dibuat dengan pemadatan cepat dari cairan yang melebur dari dua
komponen yang menunjukkan ketercampuran cairan sempurna dan kelarutan
padat-padat yang dapat diabaikan (Chiou dan Riegelman, 1971). Sifat ini dapat dilihat pada
Gambar 2.1.
Ketika eutetis yang terdiri dari obat yang sukar larut terpapar pada air atau
cairan saluran pencernaan, obat dapat dilepas ke dalam medium cairan dalam bentuk
kristal halus (Sekiguchi dan Obi, 1961). Hal ini berdasarkan asumsi bahwa kedua
komponen dapat terkristalisasi menjadi ukuran partikel kecil secara bersamaan
(Chiou dan Riegelman, 1971). Peningkatan area spesifik karena pengurangan ukuran
partikel ini, meningkatkan laju disolusi dan absorpsi oral dari obat yang sukar larut.
Sebagai tambahan atas pengurangan ukuran partikel, faktor berikut dapat membantu
Gambar 2.1 Fase Diagram Sistem Eutetik
1. Peningkatan kelarutan obat dapat terjadi jika sebagian obat kristalnya sangat
kecil (Martin, et al., 1969).
2. Efek pelarutan oleh pembawa mungkin terjadi pada lapisan difusi yang
menyelubungi partikel obat pada tahap awal disolusi karena pembawa larut
sempurna dalam waktu yang singkat (Goldberg, et al., 1966)
3. Tidak adanya agregasi dan aglomerasi antara kristal halus obat hidrofobik
murni, memainkan peranan penting dalam peningkatan laju disolusi dan
absorpsi (Chiou dan Riegelman, 1971).
4. Keterbasahan dan dispersibilitas obat dari sistem eutetik atau sistem dispersi
padat lain yang dibuat dari matriks yang larut air menghasilkan peningkatan
laju disolusi obat dalam media cair. Hal ini dikarenakan setiap kristal obat
dikelilingi oleh pembawa larut yang siap larut dan menyebabkan air
bersentuhan dan membasahi partikel obat (Sekiguchi dan Obi, 1961).
5. Peningkatan laju disolusi dan juga dapat terjadi jika obat terkristalisasi
dalam bentuk metastabil setelah pemadatan larutan. Bentuk metastabil
memiliki kelarutan yang lebih tinggi sehingga laju disolusi menjadi lebih
Eutetik dibentuk oleh interaksi atom atau molekuler yang longgar yang tidak
terlibat dalam pembentukan ikatan kimia.
2.1.4 Pembawa Dispersi Padat
Pembentukan sistem dispersi padat dalam pembawa yang mudah larut telah
luas digunakan diantaranya: polivinilpirolidon (PVP), polietilen glikol (PEG),
polivinilalkohol (PVA), derivat selulosa, poliakrilat dan polimethakrilat, urea, gula,
poliol dan polimernya, dan emulsifier (Leuner dan Dressman, 2000).
Polietilen glikol (PEG) disebut juga makrogol, merupakan polimer tambahan
dari etilen oksida dengan rumus struktur H(OCH2CH2)nOH, dimana n adalah jumlah
rata-rata gusus oksietilen (Ditjen POM, 1995). PEG umumnya mempunyai bobot
melekul antara 200-300.000, konsistensinya sangat dipengaruhi oleh berat
molekulnya. PEG dengan bobot molekul 200-600 berbentuk cair, PEG dengan bobot
molekul 800-1500 konsistensinya seperti vaselin, PEG dengan bobot molekul
2000-6000 menyerupai lilin dan bobot molekul diatas 20.000 berbentuk kristal keras dan
kaku pada temperatur kamar (Leuner dan Dressman, 2000). Umumnya PEG dengan
bobot molekul 1500-20.000 digunakan untuk pembuatan dispersi padat. PEG dengan
bobot molekul 4000-6000 paling sering digunakan untuk pembuatan sistem dispersi
padat. Titik lebur PEG untuk setiap tipenya dibawah 65º C (misalnya PEG 1000
mempunyai titik lebur 30-40º C, PEG 4000 mempunyai titik lebur 50-58º C dan PEG
20.000 mempunyai titik lebur 60-63º C). Titik lebur yang relatif rendah
menguntungkan untuk pembuatan dispersi padat dengan metode peleburan (Price,
2.1.5 Metode Pembuatan Tablet
Secara umum cara pembuatan tablet adalah dengan metode granulasi basah,
granulasi kering dan cetak langsung (Ditjen POM, 1995). Sistem dispersi padat
dengan obat ibuprofen digunakan untuk pengembangan formula tablet. Tablet
diformulasi dengan metode cetak langsung karena metode ini lebih mudah dan murah
(Lieberman, et al., 1990). Metode cetak langsung juga merupakan pilihan utama
untuk membuat tablet dengan kandungan zat aktif yang termolabil dan sensitif
terhadap kelembaban (Goel, et al., 2008). Cara ini hanya dilakukan untuk
bahan-bahan tertentu saja, yang berbentuk kristal/butir-butir granul yang mempunyai
sifat-sifat yang diperlukan untuk membuat tablet yang baik, dan dapat mengalami
peristiwa deformasi plastis pada saat pencetakan. Bahan-bahan ini mempunyai sifat
free-flowing, sehingga memungkinkan untuk dicetak langsung dan mempunyai
kohesifitas dan kekompakan yang baik (Lachman, et al., 1994). Tablet yang dibuat
cetak langsung mempunyai waktu hancur tablet yang relatif lebih cepat. Bahan
tambahan yang digunakan agar tablet cepat hancur adalah bahan penghancur
(desintegrant).
Menurut Dobetti (2000) beberapa non-effervescent desintegrant yang dapat
digunakan antara lain:
a. Amilum dan amilum termodifikasi (modified amylum). Kelompok ini meliputi
amilum alamiah (seperti amilum jagung dan amilum kentang), amilum cetak
langsung (seperti starch 1500), amilum termodifikasi (seperti
carboxymethylstarches dan natrium amilum glikolat/sodium starch glokolate) dan
turunan amilum (seperti amilosa)
c. Selulosa termodifikasi seperti natrium CMC serkait silang (cross-linked sodium
carboxymethylcellulose)
d. Asam alginat dan natrium alginat
e. Selulosa mikrokristal (microcrystaline cellulose)
f. Garam kopolimer asam metakrilat-divinilbenzene (methacrylic
acid-devinylbenzene copolymer salts).
Selulose termodifikasi (modified cellulose) merupakan bahan yang sangat
penting dalam sistem disintegrasi oral karena bahan ini menghasilkan desintegrasi
yang cepat sehingga disebut juga superdesintegrant (Goel, et al., 2008). Natrium
kroskarmelosa merupakan garam natrium terkait silang dari karboksimetil selulosa,
yang memiliki kapasitas mengembang yang besar serta digunakan pada konsentrasi
antara 0,5 – 5,0% (Rowe, et al., 2003).
Krospovidon merupakan turunan polivinilpirolidon yang tak larut dalam air,
menunjukkan aktivitas kapiler yang tinggi dan meningkatkan kapasitas hidrasi,
dengan kecenderungan yang kecil untuk membentuk gel. Konsentrasi efektifnya
dicapai pada 2,0 – 5,0% (Rowe, et al., 2003).
2.2 Ibuprofen
2.2.1 Sifat Fisikokimia
Ibuprofen
(
(±)-2-(p-isobutilfenil) asam propionat)
dengan rumus molekulC13H18O2 dan berat molekul 206,28. Rumus bangun ibuprofen seperti yang
Gambar 2.2 Rumus Bangun Ibuprofen
Ibuprofen berupa serbuk hablur, putih hingga hampir putih, berbau khas lemah.
Ibuprofen praktis tidak larut dalam air, sangat mudah larut dalam etanol, metanol,
aseton dan dalam kloroform, sukar larut dalam etil asetat (Ditjen POM, 1995). Larut
dalam larutan alkali hidroksida dan karbonat (Reynolds, 1989). Senyawa ini
mempunyai titik lebur 75-77º C dengan pKa 4,4 ; 5,2 dan log P (oktanol/air) 4,0
(Moffat, et al., 2005).
2.2.2 Farmakokinetik
Ibuprofen diabsorpsi dengan cepat melalui saluran pencernaan dengan
bioavailabilitas lebih besar dari 80%. Puncak konsentrasi plasma dapat dicapai
setelah 1-2 jam. Ibuprofen menunjukkan pengikatan (99%) yang menyeluruh dengan
protein plasma (Anderson, 2002). Pada manusia sehat volume distribusi relatif
rendah yaitu (0,15 ± 0,02 L/kg). Waktu paruh plasma berkisar antara 2-4 jam.
Kira-kira 90% dari dosis yang diabsorpsi akan dieksresi melalui urin sebagai metabolit
atau konyugatnya. Metabolit utama merupakan hasil hidroksilasi dan karboksilasi
(Stoelting, 2006; Katzung, 1995; Sinatra, et al., 1992).
2.2.3 Farmakodinamik
Mekanisme kerja ibuprofen melalui inhibisi sintesa prostaglandin dan
tidak seperti aspirin hambatan yang diakibatkan olehnya bersifat reversibel. Dalam
pengobatan dengan ibuprofen, terjadi penurunan pelepasan mediator dari granulosit,
basofil dan sel mast, terjadi penurunan kepekaan terhadap bradikinin dan histamin,
mempengaruhi produksi limfokin dan limfosit T, melawan vasodilatasi dan
menghambat agregasi platelet (Stoelting, 2006).
2.2.4 Indikasi dan Dosis Terapi
Ibuprofen dapat digunakan untuk mengurangi nyeri yang ringan hingga sedang,
khususnya nyeri oleh karena inflamasi seperti yang terdapat pada arthritis dan gout
(Trevor, et al., 2005; Anderson, et al., 2002). Untuk mengurangi nyeri ringan hingga
sedang dosis dewasa penggunaan ibuprofen per oral adalah 200-400 mg, untuk nyeri
haid 400 mg per oral kalau perlu. Untuk arthritis rheumatoid 400-800 mg. Untuk
demam pada anak-anak 5 mg/ kg berat badan, untuk nyeri pada anak-anak 10 mg/ kg
berat badan, untuk arthritis juvenil 30-40 mg/ kg berat badan/hari (Anderson, et al.,
2002).
2.3 Absorpsi
Yang dimaksud dengan absorpsi atau penyerapan suatu zat aktif adalah
masuknya molekul-molekul obat ke dalam tubuh atau menuju peredaran darah tubuh
setelah melewati sawar biologik.
Untuk dapat diserap, semua zat aktif harus terlarut lebih dahulu. Oleh sebab itu
laju penyerapan merupakan fungsi dari laju pelarutan zat aktif didalam cairan tubuh
(saluran cerna misalnya) dan laju difusi molekul-molekul yang terlarut dalam cairan
tersebut melintasi membran seluler, sesuai dengan skema sebagai berikut:
Zat aktif Penyerapan
Proses penyerapan tersebut berkaitan dengan prinsip yang diungkapkan oleh Bennet :
sebelum melintasi membran biologik, zat aktif harus terlarut lebih dahulu didalam
cairan disekitar membran.
Bila zat aktif berada dalam suatu bentuk sediaan, maka sebelum melarut zat
aktif harus terlepas dari sediaan, dan selanjutnya berdifusi dan diserap menurut
tahapan sebagai berikut;
Pelepasan Pelarutan Difusi
Bila proses pelepasan terjadi sangat lambat, maka pelepasan akan
mempengaruhi seluruh waktu dan tahapan proses pelarutan, difusi dan penyerapan
zat aktif. Jadi tahapan yang paling lambat dari rangkaian predisposisi zat aktif
sediaan obat didalam tubuh merupakan tahap penentu.
Dengan demikian, penyerapan zat aktif akan bergantung pada : laju pelarutan
zat aktif dalam cairan biologik disekitar membran, karakter fisikokimia yang dapat
mempengaruhi proses penyerapan (pKa, koefisien partisi, stabilitas, dan lain-lain)
(Aiache, 1982).
2.3.1 Membran Sel
Membran sel merupakan bagian sel yang mengandung komponen-komponen
yang terorganisasi dan dapat berinteraksi dengan mikromolekul secara khas. Struktur
membran biologis sangat kompleks dan dapat mempengaruhi intensitas dan masa
kerja obat. Sesudah pemberian secara oral, obat harus melewati sel epitel saluran
cerna, membran sistem peredaran tertentu, melewati membran kapiler menuju sel-sel
organ atau reseptor obat.
Obat (Zat aktif +pembawa)
Zat Aktif terlepas
Zat Aktif terlarut
Menurut Siswandono dan Soekarjo (2000) membran sel terdiri dari
komponen-komponen yang terorganisasi, yaitu:
1. Lapisan lemak bimolekul.
Tebal lapisan lemak bimolekul ± 35 Ǻ, mengandung kolesterol netral dan
fosfolipid terionkan, yang terdiri dari fosfatidiletanolamin, fosfatidilkolin,
fosfatidilserin dan spingomielin. Berdasarkan sifat kepolarannya lapisan lemak
bimolekul dibagi menjadi dua bagian yaitu bagian non polar, terdiri dari rantai
hidrokarbon, dan bagian polar yang terdiri dari gugus hidroksil kolesterol dan
gugus gliserilfosfat fosfolipid.
2. Protein
Bentuk protein bervariasi, ada yang besar, berat molekulnya ± 300.000 dan ada
pula yang sangat kecil. Protein bersifat ampivil karena mengandung gugus
hidrofil dan hidrofob.
3. Mukopolisakarida
Jumlah mukopolisakarida pada membran biologis kecil dan strukturnya tidak
dalam keadaan bebas tetapi dalam bentuk kombinasi dengan lemak, seperti
glikolipilid, atau dengan protein, seperti glikoprotein.
2.3.2 Transpor Molekul melalui Membran
Proses transpor melewati membran terjadi melalui beberapa mekanisme
(Simanjuntak, 1991; Shargel dan Yu, 2005) yaitu;
1. Transpor Pasif
Transpor pasif terdiri dari :
Dimana proses difusi dapat berlangsung apabila ada perbedaan konsentrasi
antara kedua sisi membran. Molekul berdifusi dari daerah dengan konsentrasi
tinggi ke daerah dengan konsentrasi rendah.
b) Teori pH – Partisi Hipotesis
Hipotesa ini berdasarkan pemikiran bahwa elektrolit lemah akan terpermeasi
melalui membran hanya dalam bentuk tidak terionkan.
c) Difusi Ionik
Pada proses ini, molekul berpindah dalam bentuk ion dan kecepatan transpor
melalui membran ditentukan oleh perbedaan potensial kimia atau listrik.
d) Difusi yang difasilitasi
Berbeda dengan difusi sederhana, difusi yang difasilitasi berlangsung melalui
pembawa (carrier) protein yang mempunyai kemampuan berikatan dengan
bahan yang spesifik dan sistem ini dapat mengalami penjenuhan.
2. Transpor Aktif
Molekul dipindahkan melawan perbedaan konsentrasi misal, dari daerah
konsentrasi rendah ke daerah konsentrasi tinggi. Oleh karena itu, proses ini
memerlukan energi. Transpor aktif memerlukan pembawa atau carrier yang
mengikat obat membentuk kompleks obat – pembawa.
3. Pinositosis
Pinositosis merupakan suatu proses perlintasan membran oleh molekul-molekul
besar dan terutama oleh molekul yang tidak larut. Perlintasan terjadi dengan
pembentukan vesikula (bintil) yang melewati membran. Mekanisme ini mirip
2.3.3 Metode Absorpsi In Situ
Banyak variasi metode perfusi usus yang digunakan sebagai model . Metode
in-situ memiliki kelebihan dibandingkan metode in-vitro. Walaupun hewan percobaan
sudah dianastesi dan dimanipulasi dengan pembedahan, suplai darah mesentris,
neural, endokrin, dan limpatik masih utuh sehingga mekanisme transpor seperti yang
terdapat pada mahluk hidup masih fungsional. Sebagai hasilnya, laju dari metode ini
lebih realistik dibandingkan dengan hasil yang diperoleh dengan metode in-vitro
(Griffin dan Driscol, 2006).
2.3.3.1 Metode Perfusi Intestinal
Pengembangan preparat usus halus yang diperfusi secara vaskular dan stabil
merupakan alat penelitian untuk melihat transpor dan metabolisme obat intestinal.
Metode ini telah digunakan secara luas karena relatif sederhana, teknik pembedahan
yang relatif mudah dan murah (Schanker, et al., 1958). Pada pendekatan ini rongga
perut hewan yang telah dibius dibuka dengan laparotomy. Sejumlah modifikasi
metode ini telah dikembangkan, pada eksperimen loop tertutup oleh Doluisio, et al.,
(1969) larutan obat diletakkan pada bagian usus yang diisolasi, sedangkan pada
metode perfusi loop terbuka dipertahankan aliran cairan secara terus menerus
menuruni usus, dan permiabilitas intestinal diperkirakan melalui perbedaan
konsentrasi perfusat masuk dan keluar pada keadaan steady (Ho dan Higuchi, 1974).
Pertimbangan tambahan jika menggunakan teknik in situ adalah volume laruran
obat seiring absorpsi selama perfusi mungkin menyebabkan kesalahan pada
perhitungan absorpsi. Berbagai metode koreksi fluks air telah dikemukakan termasuk
dapat diaplikasikan dengan persamaan yaitu :
Dimana
\
adalah konsentrasi keluar yang dikoreksi
2.3.3.2 Metode Perfusi Intestinal Loop Terbuka atau Teknik Perfusi Usus
Single Pass
Untuk perkiraan kuantitatif parameter absorpsi, metode Doluisio memiliki
kelemahan, yaitu obat menyebar luas ke seluruh permukaan usus sehingga tidak
mencerminkan in vivo yang sebenarnya. Model perfusi single pass yang diusulkan
oleh Higuchi (1974) dirancang untuk memperkirakan sifat dengan aliran cairan
secara terus menerus melalui usus. Metode ini lebih baik daripada metode Doluisio
karena menghasilkan kontrol hidrodinamik yang lebih baik dan meningkatkan luas
permukaan (Ho, et al., 1983a ; Stewart, et al., 1997). Metode single pass memberikan
laju yang lebih reproduksibel dan variasi yang lebih kecil dalam penelitian
(Schurger, et al., 1986). Pada penelitian ini larutan obat diperfusi terus menerus
menuruni panjang usus yang telah diatur melalui kanula duodenum dan perfusat
dikumpulkan dari kanula ileum dengan laju alir antara 0,1 dan 0,3 ml/menit. Sampel
yang dikumpulkan dari aliran keluar diuji kandungan obatnya. Perkiraan
permiabilitas usus efektif dilakukan dengan menghitung perbedaan antara cairan
yang masuk dan keluar, ketika keadaan steady telah tercapai (ketika konsentrasi
keluar telah stabil).
2.4 Usus Halus
Usus halus merupakan lanjutan lambung yang terdiri atas tiga bagian yaitu;
duodenum, jejunum dan illeum yang bebas bergerak. Diameter usus halus beragam
Panjang tersebut akan berkurang oleh gerakan regangan otot yang melingkari
peritonium (Aiache, et al., 1982). Duodenum dengan panjang sekitar 25 cm, terikat
erat pada dinding dorsal abdomen, dan sebagian besar terletak retroperitoneal.
Jalannya berbentuk –C, mengitari kepala pankreas dan ujung distalnya menyatu
dengan jejenum, yang terikat pada dinding dorsal rongga melalui mesenterium.
Jejenum dapat digerakkan bebas pada mesenteriumnya dan merupakan 2/5 bagian
proksimal usus halus, sedangkan ileum merupakan sisa 3/5 nya. Kelokan-kelokan
jejenum menempati bagian pusat abdomen, sedangkan ileum menempati bagian
bawah rongga (Fawcett, 1994). Mukosa usus halus, kecuali yang terletak pada bagian
atas duodenum berbentuk lipatan-lipatan atau disebut juga valvula conniventes.
Lipatan-lipatan inilah yang berfungsi sebagai permukaan penyerapan dan penuh
dengan villi yang tingginya 0,75 – 1,00 mm dan selalu bergerak. Adanya villi ini
lebih memperluas permukaan mukosa penyerapan hingga 40 – 50 m2
Bahan obat dari lambung masuk ke duodenum, fungsi utama duodenum dan
bagian pertama jejenum adalah untuk sekresi, sedangkan fungsi bagian kedua dari
jejenum dan illeum ialah untuk absorpsi. pH usus halus meningkat dari duodenum
4-6, jejenum 6-7, illeum 7-8. pH dalam usus halus berperan besar dalam hal absorpsi
BAB III
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah penelitian eksperimental
(experimental research). Penelitian dimaksudkan untuk mengetahui pengaruh atau
hubungan antara variabel bebas dengan variabel terikat. Dalam penelitian ini yang
termasuk variabel bebas adalah: ibuprofen, PEG 6000 dan superdesintegrant.
Sedangkan variabel terikat adalah karakterisasi dispersi padat, tablet sistem dispersi
padat dan absorpsi secara in situ.
3.1 Rancangan Penelitian
Penelitian ini dilakukan meliputi pembuatan dispersi padat, campuran fisik dan
karakterisasinya. Kemudian dilanjutkan dengan membuat formula tablet dispersi
padat, dan evaluasinya meliputi pemeriksaan karakterisasi fisik dan profil pelepasan
obat secara in vitro. Dalam penelitian ini juga dilakukan absorpsi tablet sistem
dispersi padat secara in situ pada usus halus tikus jantan dari galur wistar.
Hewan terbagi dalam tiga kelompok dan tiap kelompok terdiri dari enam
hewan uji dengan uraian sebagai berikut:
1. Kelompok pertama diberi ibuprofen yang dilarutkan dalam larutan buffer fosfat
pH 5,9 isotonis dengan konsentrasi 1 mmol.
2. Kelompok kedua diberi tablet ibuprofen sistem dispersi padat yang dilarutkan
dalam buffer fosfat pH 5,9 isotonis dengan konsentrasi 1 mmol.
3. Kelompok ketiga diberi tablet generik yang dilarutkan dalam buffer fosfat pH 5,9
3.2. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di LIPI (Lembaga Ilmu Pengetahuan Indonesia)
kawasan Pusat Penelitian Ilmu Pengetahuan dan Teknologi (PUSPITEK), Tangerang,
Provinsi Banten dan Laboratorium Farmasi, Fakultas Farmasi, Universitas Sumatera
Utara, Medan, Provinsi Sumatera Utara, Indonesia.
3.3 Bahan dan Alat
3.3.1 Bahan
Bahan baku ibuprofen (Hubei Granules-Biocause Pharmaceutical, Co. Ltd),
polietilen glikol 6000 (E. Merck), krospovidon, natrium kroskarmelosa (Ac-Di-Sol®,
FMC BIO Polymer), Sellulosa mikrokristal (Ceolus ®, Asahi Kasei Chemicals
Corp.), talkum dan magnesium stearat (PT. Brataco), NaOH p.a (E. Merck), kalium
fosfat mono basa p.a (E.Merck), natrium dihidrogen fosfat p.a (E. Merck), dinatrium
hidrogen fosfat p.a (E. Merck), NaCl p.a (E.Merck).
3.3.2 Alat
Alat yang digunakan dalam penelitian ini meliputi : neraca analitik (Vibra),
mesin cetak tablet (Ateliers), strong cobb hardness tester (Erweka), desintegration
tester (Erweka), roche friabilator (Erweka), disolution tester (Erweka),
spektrofotometer ultra violet-visible (Shimadzu mini 1240), ayakan (mesh 40),
difraktometer sinar -X, scanning electron mikroskop, diffrential thermal analyzer,
fourier-transform IR, timbangan hewan, thermometer, satu rangkaian alat infus,
kanul, three way, statip, benang, satu set alat bedah, sarung tangan, stop watch,
penangas air listrik, gelas ukur, pipet volume, maat pipet, pH meter, labu tentukur,
3.4 Hewan Percobaan
Hewan yang digunakan adalah tikus jantan galur wistar berat 250-300 gram.
Hewan dikondisikan di laboratorium selama lebih kurang satu minggu sebelum
percobaan. Selama pemeliharaan tikus diberi makanan dan minuman yang sesuai
dengan kebutuhannya.
3.5 Prosedur Kerja
3.5.1 Pembuatan Pereaksi
3.5.1.1 Air bebas Karbondioksida
Air suling yang telah dididihkan selama 5 menit atau lebih dan didiamkan
sampai dingin dan tidak boleh menyerap karbondioksida dari udara (Ditjen POM,
1995).
3.5.1.2 Natrium Hidroksida 0,1 N
Dilarutkan 4 gram natrium hidroksida P dalam air bebas karbondioksida
secukupnya hingga 1000 ml (Ditjen POM, 1979).
3.5.1.3 Natrium Hidroksida 0,2 N
Dilarutkan 8 gram natrium hidroksida P dalam air bebas karbondioksida
secukupnya hingga 1000 ml (Ditjen POM, 1979).
3.5.1.4 Kalium Fosfat Monobasa 0,2 M
Dilarutkan 27,22 gram kalium fosfat monobasa P dalam air suling dan
3.5.1.5 Dapar Fosfat pH 5,9 Isotonis
Dicampur 90 ml natrium dihidrogenfosfat 0,8% dengan 10 ml dinatrium
hidrogenfosfat 0,947% dan ditambahkan dengan 0,52 gram/100 ml natrium klorida
((Ditjen POM, 1979).
3.5.1.6 Dapar Fosfat pH 7,2
Dimasukkan 50 ml kalium fosfat monobasa 0,2 M ke dalam labu tentukur 200
ml, kemudian ditambahkan NaOH 0,2 M sebanyak 34, 7 ml dicukupkan dengan air
suling sampai garis tanda (Ditjen POM, 1995).
3.5.1.7 Larutan Fisiologis NaCl 0,9 %
Dilarutkan sebanyak 9 gram NaCl dalam air suling hingga 1000 ml ((Ditjen
POM, 1995).
3.5.2 Pembuatan Kurva Serapan Ibuprofen
3.5.2.1 Dalam Medium NaOH 0,1 N
Ditimbang seksama 50 mg ibuprofen dimasukkan ke dalam labu tentukur 100
ml kemudian ditambahkan NaOH 0,1 N sampai garis tanda. Dari larutan tersebut di
pipet 11,5 ml, dimasukkan ke dalam labu tentukur 25 ml dan ditambahkan NaOH 0,1
N sampai garis tanda. Maka diperoleh larutan dengan konsentrasi 230 ppm. Serapan
diukur pada panjang gelombang 200-400 nm dengan menggunakan spektrofotometer
UV. Panjang gelombang yang dipilih adalah panjang gelombang dimana ibuprofen
3.5.2.2 Dalam Medium Dapar Fosfat pH 5,9 Isotonis
Ditimbang seksama 50 mg ibuprofen dimasukkan ke dalam labu tentukur 250
ml kemudian ditambahkan dapar fosfat pH 5,9 isotonis sampai garis tanda. Di pipet 1
ml kemudian dimasukkan ke dalam labu tentukur 25 ml, lalu ditambahkan dapar
fosfat pH 5,9 isotonis sampai garis tanda. Maka diperoleh larutan dengan konsentrasi
8 ppm. Serapan diukur pada panjang gelombang 200-400 nm dengan menggunakan
spektrofotometer UV. Panjang gelombang yang dipilih adalah panjang gelombang
dimana ibuprofen memperlihatkan serapan paling tinggi.
3.5.2.3 Dalam Medium Dapar Fosfat pH 7,2
Ditimbang seksama 50 mg ibuprofen dimasukkan ke dalam labu tentukur 100
ml kemudian ditambahkan dapar fosfat pH 7,2 sampai garis tanda. Di pipet 0,4 ml
kemudian dimasukkan ke dalam labu tentukur 25 ml, lalu ditambahkan dapar fosfat
pH 7,2 sampai garis tanda. Maka diperoleh larutan dengan konsentrasi 8 ppm.
Serapan diukur pada panjang gelombang 200-400 nm dengan menggunakan
spektrofotometer UV. Panjang gelombang yang dipilih adalah panjang gelombang
dimana Ibuprofen memperlihatkan serapan paling tinggi.
3.5.3 Pembuatan Kurva Kalibrasi Ibuprofen
3.5.3.1 Dalam Medium NaOH 0,1 N
Ditimbang seksama 50 mg ibuprofen dimasukkan ke dalam labu tentukur 100
ml kemudian ditambahkan NaOH 0,1 N sampai garis tanda. Dari larutan tersebut di
pipet masing-masing 7,5 ml, 9,5 ml, 11,5 ml, 13,5 ml dan 15,5 ml. Dimasukkan ke
dalam labu tentukur 25 ml kemudian diencerkan dengan larutan NaOH 0,1 N sampai
garis tanda. Serapan diukur pada panjang gelombang maksimum yang diperoleh dari
digunakan NaOH 0,1 N. Kurva kalibrasi antara jumlah serapan dan konsentrasi
dibuat dari data yang diperoleh, lalu dihitung persamaan regresi dan koefisien
korelasinya.
3.5.3.2 Dalam Medium Dapar Fosfat pH 5,9 Isotonis
Ditimbang seksama 50 mg ibuprofen dimasukkan ke dalam labu tentukur 250
ml kemudian ditambahkan larutan dapar fosfat pH 5,9 isotonis sampai garis tanda.
Dari larutan tersebut di pipet 0,2 ml, 0,4 ml, 0,6 ml, 0,8 ml, 1 ml, 1,2 ml, 1,4 ml, 1,6
ml dan 1,8 ml. Dimasukkan ke dalam labu tentukur 25 ml, kemudian masing-masing
diencerkan dengan larutan dapar fosfat pH 5,9 isotonis sampai garis tanda. Serapan
diukur pada panjang gelombang maksimum yang diperoleh dari kurva serapan
ibuprofen menggunakan spektrofotometer UV dan sebagai blanko digunakan dapar
fosfat pH 5,9 isotonis. Kurva kalibrasi antara jumlah serapan dan konsentrasi dibuat
dari data yang diperoleh, lalu dihitung persamaan regresi dan koefisien korelasinya.
3.5.3.3 Dalam Medium Dapar Fosfat pH 7,2
Ditimbang seksama 50 mg ibuprofen dimasukkan ke dalam labu tentukur 100
ml kemudian ditambahkan larutan dapar fosfat pH 7,2 sampai garis tanda. Dari
larutan tersebut di pipet 0,2 ml, 0,3 ml, 0,4 ml, 0,5 ml, 0,6 ml, 0,7 ml dan 0,8 ml
dimasukkan ke dalam labu tentukur 25 ml, kemudian masing-masing diencerkan
dengan larutan dapar fosfat pH 7,2 sampai garis tanda. Serapan diukur pada panjang
gelombang maksimum yang diperoleh dari kurva serapan ibuprofen menggunakan
spektrofotometer UV dan sebagai blanko digunakan dapar fosfat pH 7,2. Kurva
kalibrasi antara jumlah serapan dan konsentrasi dibuat dari data yang diperoleh, lalu
3.4.3.4 Pembuatan Dispersi Padat dan Campuran Fisik
Sistem dispersi padat dibuat dengan metode peleburan dengan berbagai
perbandingan berat ibuprofen dan PEG 6000 adalah 1 : 0,25; 1 : 0,5; 1 : 0,75; 1 : 1; 1
: 1,25 dan 1 : 1,5. Ditimbang masing zat sesuai perbandingan dan
masing-masing dilebur diatas penangas air sambil diaduk. Hasil leburan dicampur,
didinginkan dan dipadatkan dengan cepat dalam rendaman es dengan pengadukan
keras. Setelah memadat, simpan dalam desikator selama 24 jam. Padatan yang
dihasilkan diserbukkan dan dilewatkan pada ayakan ukuran 40 mesh. Sebagai
pembanding dibuat campuran fisik antara ibuprofen dan PEG 6000 dengan
perbandingan 1 : 0,25; 1 : 0,5; 1 : 0,75; 1 : 1; 1 : 1,25 dan 1 : 1,5. Masing-masing
bahan dihaluskan, campur dan dihomogenkan selama 10 menit, lalu lewatkan pada
ayakan ukuran 40 mesh.
3.5.4 Karakterisasi Serbuk Dispersi Padat
3.5.4.1 Uji perolehan kembali zat aktif dalam sistem dilakukan dengan penetapan kadar zat berkhasiat dalam serbuk dispersi padat dan campuran fisik
Ditimbang sejumlah serbuk setara dengan 50 mg ibuprofen dimasukkan ke
dalam labu tentukur 100 ml dilarutkan dengan NaOH 0,1 N dicukupkan sampai garis
tanda. Dari larutan tersebut dipipet 11,5 ml dimasukkan ke dalam labu tentukur 25 ml
dan ditambahkan dengan NaOH 0,1 N sampai garis tanda. Selanjutnya diukur secara
spektrofotoneter UV pada panjang gelombang maksimum. Dihitung kadar ibuprofen.
Menurut Farmakope Indonesia Edisi IV Ibuprofen mengandung tidak kurang