SKRIPSI
POTENSI MEMBRAN NANOFILTRASI DAN OSMOSA BALIK DALAM PROSES PEMEKATAN KONSENTRAT KACANG HIJAU (Phaseolus
radiatus L.) TERFERMENTASI SEBAGAI BAHAN TAMBAHAN MAKANAN BERPROBIOTIK (Probiotic Ingredient)
Oleh :
DIANA WANGSAMULIA F24101087
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOBOR
POTENSI MEMBRAN NANOFILTRASI DAN OSMOSA BALIK DALAM PROSES PEMEKATAN KONSENTRAT KACANG HIJAU (Phaseolus
radiatus L.) TERFERMENTASI SEBAGAI BAHAN TAMBAHAN MAKANAN BERPROBIOTIK (Probiotic Ingredient)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
DIANA WANGSAMULIA F24101087
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
POTENSI MEMBRAN NANOFILTRASI DAN OSMOSA BALIK DALAM PROSES PEMEKATAN KONSENTRAT KACANG HIJAU (Phaseolus
radiatus L.) TERFERMENTASI SEBAGAI BAHAN TAMBAHAN MAKANAN BERPROBIOTIK (Probiotic Ingredient)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
DIANA WANGSAMULIA F24101087
Dilahirkan pada tanggal 20 Desember 1982 Di Tangerang, Banten
Tanggal lulus : 19 Januari 2006
Menyetujui. Bogor, Januari 2006
Prof. Dr. Ir. Rizal Syarief, DESS Ir. Agustine Susilowati, MM Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
BIODATA PENULIS
Penulis dilahirkan di Tangerang pada tanggal 20 Desember 1982 dari pasangan Heryanto Wangsamulia dan Loa Tjeng Nio sebagai anak pertama kembar dari empat bersaudara. Pendidikan TK diselesaikan penulis di TK Dewi Sartika I Tangerang kemudian penulis melanjutkan pendidikan tingkat SD di SD Strada Santa Maria I Tangerang. Tingkat pendidikan SLTP diselesaikan penulis di SLTP Santa Ursula II BSD dan melanjutkan pendidikan di SMU Santa Ursula II BSD. Penulis diterima sebagai mahasiswa Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor pada tahun 2001 lewat jalur UMPTN.
Diana Wangsamulia. F24101087. Potensi Membran Nanofiltrasi dan Osmosa Balik dalam Proses Pemekatan Konsentrat Kacang Hijau (Phaseolus radiatus L.) Terfermentasi sebagai Bahan Tambahan Makanan Berprobiotik (Probiotic Ingredient). Di bawah bimbingan Rizal Syarief dan Agustine Susilowati. 2006
RINGKASAN
Konsentrat kacang hijau (Phaseolus radiatus L.) terfermentasi berpotensi untuk dikembangkan menjadi bahan tambahan makanan berprobiotik (probiotic ingredient) untuk menghasilkan produk pangan bersumber protein nabati dengan cita rasa dasar umami. Penelitian ini bertujuan untuk mempelajari optimasi kinerja membran nanofiltrasi dan osmosa balik pada proses pemekatan konsentrat kacang hijau terfermentasi sehingga diperoleh retentat sebagai bahan tambahan makanan berprobiotik dengan jumlah bakteri asam laktat yang tinggi. Proses pembuatan prosuk dilakukan melalui fermentasi menggunakan kultur campuran Lactobacillus sp. dan Streptococcus thermophillus-IN dengan konsentrasi 15% (b/b), penambahan sukrosa 12% (b/b) dan susu skim sehingga kadar protein substrat mencapai 3% kemudian produk diinkubasi pada 40 oC selama 48 jam. Produk kemudian dipekatkan menggunakan membran nanofiltrasi dan osmosa balik selama 180 menit dan pengamatan dilakukan tiap 30 menit. Proses pemekatan dengan menggunakan membran nanofiltrasi dilakukan pada tekanan 2500 kPa (25 bar) sedangkan membran osmosa balik menggunakan tekanan sebesar 3500 kPa(35 bar) pada suhu proses dan frekuensi motor yang sama, yaitu 25 oC dan 20 Hz. Analisa dilakukan terhadap jumlah mikroba, total solid, total soluble solid (TSS), total asam, total protein terlarut , total gula pereduksi, kadar garam dan fluks permeat. Rancangan percobaan pada penelitian ini adalah Rancangan Acak Lengkap dengan enam waktu pemekatan (W), yaitu 30 menit (w1), 60 menit (w2), 90 menit (w3), 120 menit (w4), 150 menit (w5) dan 180 menit (w6) dan dua jenis membran (M), yaitu nanofiltrasi (m1) dan osmosa balik (m2) dengan masing-masing dua kali ulangan.
KATA PENGANTAR
Terima kasih kepada Yang Maha Esa atas berkatNya sehingga penulis dapat menyelesaikan pendidikannya di Institut Pertanian Bogor. Penulis juga hendak mengucapkan terima kasih kepada pihak-pihak yang telah banyak membantu dan mendukung penulis dalam penyelesaian skripsi ini.
1. Prof. Dr. Ir. Rizal Syarief, DESS dan Ir. Agustine Susilowati, MM selaku dosen pembimbing atas kesabarannya membimbing penulis
2. Dr. Ir. Budiatman Satiawihardja, M.Sc. selaku dosen penguji atas masukan yang diberikan
3. Pak Aspiyanto, Pak Hanafi dan seluruh staf P2K KIMIA LIPI PUSPIPTEK yang telah banyak membantu
4. Papi, Mami, Delia, Martin dan Dianita serta segenap keluarga 5. Nancy, teman seperjuangan
6. Teh Yati, Teh Hani, Teh Fathia yang selalu direpotkan selama penelitian 7. Ko Asin, yang selalu bersedia menampung keluh kesah
8. Amanda, Devi, Endi, Fajar, Hana, Fanny, Mohung, Astri dan semua TPG 38 yang tidak dapat disebutkan satu persatu
9. Bunga, Daniel, Sara dan semua Perwira 12 Member Semoga hasil penelitian ini berguna bagi yang membutuhkan.
Bogor, 23 Januari 2006
DAFTAR ISI
Halaman
KATA PENGANTAR ...iii
DAFTAR ISI ...iv
DAFTAR TABEL ...vi
DAFTAR GAMBAR ...vii
DAFTAR LAMPIRAN ...x
I. PENDAHULUAN ...1
A. LATAR BELAKANG...1
B. TUJUAN ...2
II. TINJAUAN PUSTAKA ...3
A. PROBIOTIK ...2
B. BAKTERI ASAM LAKTAT ...3
a. Lactobacillus sp. ...5
b. Streptococcus thermophillus ...5
C. KACANG HIJAU TERFERMENTASI ...6
1. Pembuatan Inokulum Kacang Hijau Terfermentasi ...6
2. Pembuatan Kacang Hijau Terfermentasi ...7
3. Pembuatan Ekstrak Kacang Hijau Terfermentasi dan Pemisahan Ekstrak Kacang Hijau Terfermentasi Menggunakan Teknik Membran Mikrofiltrasi ...9
D. TEKNOLOGI MEMBRAN ...12
1. Definisi Membran ...12
2. Klasifikasi Membran ...13
3. Proses Pemisahan dengan Membran ...14
E. BAHAN TAMBAHAN MAKANAN ...18
III. BAHAN DAN METODE ...20
A. ALAT DAN BAHAN ...20
1. Bahan ...20
b. Bahan analisa kimia ...20
c. Penentuan kondisi dan waktu fermentasi optimum dalam pembuatan biomassa asam laktat ...23
IV. HASIL DAN PEMBAHASAN ...33
A. PENELITIAN PENDAHULUAN ...33
1. Karakteristik Konsentrat Kacang Hijau Terfermentasi ...33
2. Karakteristik Inokulum Bakteri Asam Laktat ...33
3. Pengaruh Waktu dan Kondisi Fermentasi Optimum terhadap Komposisi Biomassa ...33
B. PENELITIAN UTAMA ...37
1. Kondisi Proses Pemekatan ...38
3. Hubungan Waktu Pemekatan terhadap Total Solid ...44
4. Hubungan Waktu Pemekatan terhadap Total Asam ...46
5. Hubungan Waktu Pemekatan terhadap Total Soluble Solid ...49
6. Hubungan Waktu Pemekatan terhadap Protein Terlarut ...51
7. Hubungan Waktu Pemekatan terhadap Gula Pereduksi ...54
8. Hubungan Waktu Pemekatan terhadap Kadar Garam ...57
V. KESIMPULAN DAN SARAN ...58
A. KESIMPULAN ...58
B. SARAN ...59
DAFTAR PUSTAKA ...60
DAFTAR TABEL
DAFTAR GAMBAR
Halaman
Gambar 1. Diagram Alir Pembuatan Kacang Hijau Terfermentasi ...8
Gambar 2. Kacang Hijau Terfermentasi (Crude Kaldu) ...9
Gambar 3. Diagram Alir Pembuatan Ekstrak Kacang Hijau Terfermentasi dan Pemisahan Menggunakan Membran Mikrofiltrasi ...11
Gambar 4. Konsentrat Kacang Hijau Terfermentasi ...12
Gambar 5. Klasifikasi Membran ...13
Gambar 6. Sistem Cross Flow Filtration ...15
Gambar 7. Faktor-faktor yang Mempengaruhi Fluks ...16
Gambar 8. Skema Terjadinya Fouling ...17
Gambar 9. Starter Campuran Lactobacillus sp. dan Streptococcus thermophillus-IN ...20
Gambar 10. Modul Lab Stak M-20 DSS dengan Sistem Aliran Cross Flow Filtration ...21
Gambar 11. Diagram Alir Pembuata Inokulum Bakteri Asam Laktat ...23
Gambar 12. Penentuan Waktu dan Kondisi Fermentasi Optimum ...24
Gambar 13. Diagram Alir Proses Pemekatan dengan Sistem Membran ...25
Gambar 14.Refraktometer ...30
Gambar 15. Konduktivitimeter ...30
Gambar 16. Hubungan Waktu Fermentasi terhadap pH Produk ...34
Gambar 17. Hubungan Waktu Fermentasi terhadap Total Asam Produk ...36
Gambar 18. Hubungan Waktu Pemekatan terhadap Fluks Membran ...39
Gambar 19. Hubungan Waktu Pemekatan terhadap Jumlah Mikroba Retentat ...41
Gambar 20. Hubungan Waktu Pemekatan terhadap Jumlah Mikroba Permeat ...42
Gambar 21. Produk Hasil Pemekatan dengan Jumlah Bakteri Asam Laktat Tertinggi ...44
Gambar 22. Hubungan Waktu Pemekatan terhadap Total Solid Produk ...45
Gambar 23. Hubungan Waktu Pemekatan terhadap Total Asam Produk ...47
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Contoh Perhitungan Penentuan Jumlah Skim ...64
Lampiran 2. Data Analisa pH Penelitian Pendahuluan ...65
Lampiran 3. Data Analisa Total Asam Tertitrasi Penelitian Pendahuluan ...66
Lampiran 4. Data Pengamatan Proses Pemekatan menggunakan Sistem Membran .67 Lampiran 5. Data Hasil Perhitungan Jumlah Mikroba selama Proses Pemekatan ...68
Lampiran 6. Hasil Pengolahan Statistik terhadap Jumlah Mikroba ...69
Lampiran 7. Data Hasil Perhitungan Total Solid selama Proses Pemekatan ...72
Lampiran 8. Hasil Pengolahan Statistik terhadap Total Solid ...73
Lampiran 9. Data Hasil Perhitungan Total Asam selama Proses Pemekatan ...76
Lampiran 10. Hasil Pengolahan Statistik terhadap Total Asam ...77
Lampiran 11. Data Total Soluble Solid selama Proses Pemekatan ...82
Lampiran 12. Hasil Pengolahan Statistik terhadap Total Soluble Solid ...83
Lampiran 13. Data Hasil Perhitungan Protein Terlarut selama Proses Pemekatan ...88
Lampiran 14. Hasil Pengolahan Statistik terhadap Protein Terlarut ...89
Lampiran 15. Data Hasil Perhitungan Gula Pereduksi selama Proses Pemekatan ....92
Lampiran 16. Hasil Pengolahan Statistik terhadap Total Gula Pereduksi ...93
Lampiran 17. Data Hasil Analisa Kadar Garam selama Proses Pemekatan ...97
I. PENDAHULUAN
A. LATAR BELAKANG
Makanan berfungsi sebagai sumber energi dan zat gizi. Saat ini, efek fisiologis dari makanan dan pengaruhnya terhadap kesehatan banyak mendapat perhatian masyarakat. Tuntutan masyarakat akan makanan tidak hanya lezat, namun juga menyehatkan tubuh. Makanan yang dapat memberikan manfaat kesehatan bagi tubuh disebut pangan fungsional. Pangan fungsional yang saat ini banyak mendapat perhatian masyarakan adalah probiotik. Probiotik adalah suplemen makanan yang berisi mikroba hidup yang menguntungkan bagi inangnya karena dapat menjaga keseimbangan mikroflora usus (Fuller,1989). Fungsi probiotik dalam meningkatkan kesehatan saluran pencernaan adalah dengan meningkatkan keseimbangan mikroflora usus, menekan pertumbuhan mikroba patogen, mensintesis vitamin dan protein, membantu penyerapan zat gizi, mengatasi maldigestion terhadap laktosa, serta merangsang fungsi kekebalan tubuh (Yukuguchi et al., 1992).
Konsentrat kacang hijau (Phaseolus radiatus L.) terfermentasi dapat ditingkatkan nilainya menjadi pangan fungsional melalui proses fermentasi bakteri asam laktat dan pememekatan menggunakan membran. Produk fermentasi ini berpotensi sebagai agensia probiotik untuk produk-produk pangan nabati dengan cita rasa dasar umami, seperti mayonaise, saus, condiment, ataupun bahan coating berbumbu untuk makanan ringan. Fermentasi bakteri asam laktat dengan substrat konsentrat kacang hijau terfermentasi memungkinkan diperolehnya produk fermentasi dengan cita rasa campuran umami disertai keasaman analog salad dressing atau jenis makanan tambahan berbumbu yang langsung disantap atau ditambahkan tampa pemanasan. Produk ini lebih aman dikonsumsi karena tidak mengandung kolesterol ataupun komponen pemicu penyakit degeneratif (Aspiyanto dan Susilowati, 2005b).
membran memiliki beberapa keunggulan, di antaranya adalah tidak dilibatkannya perubahan fase sehingga energi yang digunakan lebih rendah, tidak melibatkan panas sehingga baik diaplikasikan untuk produk dengan komponen yang rentan terhadap susu, misalnya protein dan bakteri asam laktat. Jenis membran serta waktu pemekatan akan berpengaruh terhadap produk yang dihasilkan (Aspiyanto,2002).
B. TUJUAN
III. BAHAN DAN METODE
A. ALAT DAN BAHAN 1. Bahan
Bahan yang digunakan pada penelitian ini meliputi bahan baku, bahan penolong dan bahan untuk analisa kimia.
a. Bahan baku
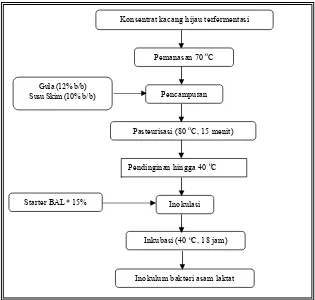
Bahan baku yang digunakan berupa konsentrat kacang hijau terfermentasi dan starter campuran Lactobacillus sp. dan Streptococcus thermophillus-IN yang diperoleh dari Laboratorium Pangan Pusat Penelitian Kimia (P2K) LIPI PUSPIPTEK, Serpong,Tangerang, susu skim dan susu full cream komersial. Pada Gambar 9 diperlihatkan starter campuran campuran Lactobacillus sp. dan Streptococcus thermophillus-IN.
Gambar 9. Starter Campuran Lactobacillus sp. dan Streptococcus thermophillus-IN
b. Bahan analisis kimia
Na-K-Tartarat, Folin, akuades, standar protein albumin, Na2CO3 anhidrat atau Na2CO3.4H2O, NaHCO3, CuSO4.5H2O, H2SO4 pekat, (NH4)6.Mo7O24.4H2O, NaHASO4.7H2O, standar glukosa, MRSA(deMan, Rogosa and Sharpe Agar) dan NaCl murni.
2. Alat
Alat-alat yang dibutuhkan dalam penelitian ini adalah Modul Lab Stak M-20 DSS dengan menggunakan membran komposit nanofiltrasi dan osmosa balik dan sistem aliran cross flow filtration yang terdapat di Laboratorium Membran Pusat Penelitian Kimia PUSPIPTEK LIPI Serpong, alat-alat pengolahan seperti kompor, baskom, homogenizer, alat-alat fermentasi skala labroratorium (autoclave, inkubator, termometer, pipet ependorf, pembakar spiritus dan lain sebagainya), alat-alat analisa fisika (oven, timbangan, refraktometer, konduktivitimeter dan sebagainya), alat-alat analisa kimia (spektrofotometer, buret, labu Kjehdal, dekstruksi protein, alat destilasi, soxlet, dan alat-alat gelas seperti labu takar, gelas piala, gelas ukur, labu erlenmeyer, pipet volumetrik, corong, tabung reaksi).
B. METODE PENELITIAN 1. Penelitian Pendahuluan
Penelitian pendahuluan terdiri atas beberapa tahapan penelitian, yaitu analisa bahan baku yang berupa konsentrat kacang hijau terfermentasi, pembuatan inokulum bakteri asam laktat dari konsentrat kacang hijau terfermentasi, penentuan waktu fermentasi bakteri asam laktat dan kondisi optimum dalam pembuatan biomassa.
a. Analisa bahan baku (konsentrat kacang hijau terfermentasi)
Konsentrat kacang hijau terfermentasi dari ekstrak kacang hijau terfermentasi menggunakan inokulum Rhizopus sp. C1 yang didapatkan dari Laboratorium Pangan Pusat Penelitian Kimia (P2K) PUSPIPTEK, Serpong dianalisa komposisinya, meliputi kadar air, total solid, Total Soluble Solid, protein terlarut dan total proteinnya.
b. Pembuatan inokulum bakteri asam laktat dari konsentrat kacang hijau terfermentasi
Keterangan : *) kultur campuran Lactobacillus sp. dan Streptococcus thermophillus
Gambar 11. Diagram Alir Pembuatan Inokulum Bakteri Asam Laktat
c. Penentuan kondisi dan waktu optimum fermentasi bakteri asam laktat dalam pembuatan biomassa
Setelah didapatkan inokulum bakteri asam laktat, dilakukan pembuatan biomassa dari konsentrat kacang hijau terfermentasi melalui proses fermentasi bakteri asam laktat. Kondisi fermentasi yang digunakan adalah konsentrasi inokulum bakteri asam laktat sebesar 15, 20 dan 25% dan suhu inkubasi pada suhu kamar dan 40 oC. Proses fermentasi berlangsung selama 48 jam dengan selang pengamatan setiap enam jam. Kondisi dan waktu fermentasi optimum akan ditentukan berdasarkan pH dan total asam produk. Pada tahapan ini susu skim berfungsi sebagai pendukung pertumbuhan bakteri asam laktat sehingga penambahan susu skim dilakukan hingga kadar protein
Konsentrat kacang hijau terfermentasi
Pemanasan 70 oC
Pencampuran Gula (12% b/b)
Susu Skim (10% b/b)
Pasteurisasi (80 oC, 15 menit)
Pendinginan hingga 40 oC
Inokulasi Starter BAL* 15%
Inkubasi (40 oC, 18 jam)
akhir bahan sebesar 3 % (b/b protein). Contoh perhitungan penentuan jumlah susu skim yang ditambahkan diperlihatkan pada Lampiran 1. Metode penentuan waktu dan kondisi fermentasi optimum diperlihatkan pada Gambar 12.
Gambar 12. Diagram Alir Penentuan Waktu dan Kondisi Fermentasi Optimum
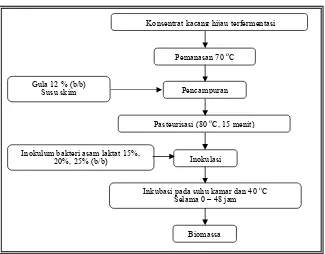
2. Penelitian Utama
Penelitian utama terdiri atas dua tahapan, yaitu analisa karakteristik biomassa setelah fermentasi kemudian dilanjutkan dengan proses pemekatan menggunakan memran nanofiltrasi dan osmosa balik. Analisa karakteristik biomassa awal meliputi jumlah mikroba, total padatan, total padatan terlarut (TSS), total asam tertitrasi, kadar protein terlarut, total gula pereduksi dan kadar garam. Proses pemekatan yang dilakukan menggunakan dua jenis membran, yaitu nanofiltrasi dan osmosa balik. Proses pemekatan dengan menggunakan sistem membran diperlihatkan pada Gambar 13.
Konsentrat kacang hijau terfermentasi
Pemanasan 70 oC
Pencampuran Gula 12 % (b/b)
Susu skim
Pasteurisasi (80 oC, 15 menit)
Inokulum bakteri asam laktat 15%,
20%, 25% (b/b) Inokulasi
Inkubasi pada suhu kamar dan 40 oC Selama 0 – 48 jam
Keterangan: *) Kondisi operasi nanofiltrasi : Tekanan 2500 kPa (25 Bar), frekuensi motor pompa 20 Hz, suhu operasi 25 oC
**) Kondisi operasi osmosa balik : Tekanan 3500 kPa (35 Bar), frekuensi motor pompa 20 Hz, suhu operasi 25 oC
Gambar 13. Diagram Alir Poses Pemekatan dengan Sistem Membran
3. Rancangan Percobaan
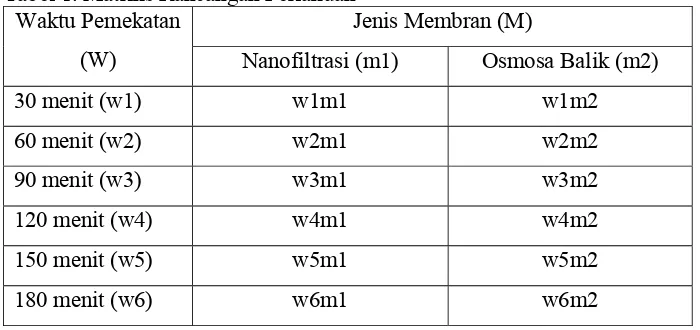
Rancangan percobaan yang digunakan pada penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan 6 waktu pemekatan (W) dan 2 jenis membran (M) dan masing-masing 2 kali ulangan. Faktor W memiliki 6 taraf, yaitu :
w1 (30 menit) w2 (60 menit) w3 (90 menit) w4 (120 menit) w5 (150 menit) w6 (180 menit)
Sedangkan faktor M memiliki 2 taraf, yaitu :
m1 (Membran nanofiltrasi) m2 (membran osmosa balik)
Model matematika untuk rancangan tersebut :
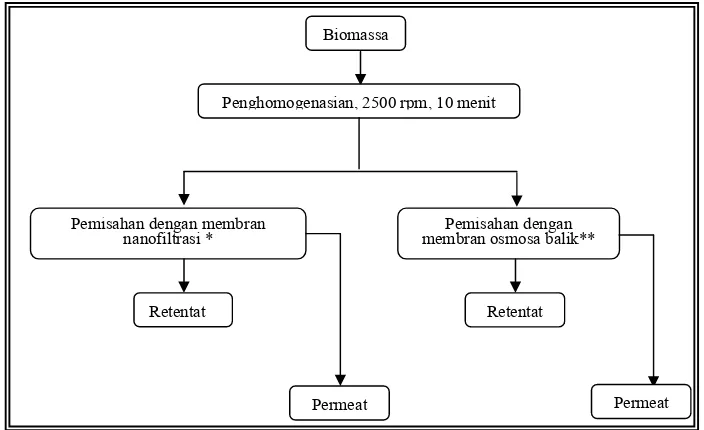
Yijk = μ + Wi + Mj + (WM)ij + εijk Biomassa
Penghomogenasian, 2500 rpm, 10 menit
Pemisahan dengan membran
nanofiltrasi * membran osmosa balik** Pemisahan dengan
Retentat
Permeat Permeat
Di mana :
Yijk = nilai pengamatan (respon) dari kelompok ke-1, yang memperoleh taraf ke- i dari faktor W dan taraf ke- j dari faktor M
μ = nilai rata - rata sesungguhnya
Wi = pengaruh waktu pemekatann pada taraf ke- i Mj = pengaruh jenis membran pada taraf ke- j
(WM)ij = pengaruh interaksi taraf ke- i faktor waktu pemekatan dan taraf ke- j faktor jenis membran
εijk = pengaruh galat percobaan pada kelompok ke- 1 yang akan memperoleh taraf ke- i faktor W dan taraf ke- j faktor M
Jika hasil yang diperoleh pada uji Fhitung berbeda nyata, maka keragaman perlakuan terhadap variabel respon diuji dengan menggunakan Uji Perbandingan Berganda Duncan (Duncan Multiple Range Test, DMRT) pada taraf 5%. Uji lanjut digunakan untuk menguji perbedaan di antara pasangan perlakuan yang mungkin tanpa memperhatikan jumlah perlakuan yang ada dari percobaan tersebut serta masih dapat mempertahankan tingkat nyata yang ditetapkan. Pada Tabel 1 diperlihatkan perlakuan yang diberikan selama penelitian.
Tabel 1. Matriks Rancangan Perlakuan Waktu Pemekatan
(W)
Jenis Membran (M)
Nanofiltrasi (m1) Osmosa Balik (m2)
30 menit (w1) w1m1 w1m2
60 menit (w2) w2m1 w2m2
90 menit (w3) w3m1 w3m2
120 menit (w4) w4m1 w4m2
150 menit (w5) w5m1 w5m2
4. Rancangan Respon
a. Analisa kadar air (Metode Gravimetri, AOAC 1980)
Prinsip : Sampel dikeringkan dalam oven 100 – 105 oC hingga diperoleh berat tetap
Cara Kerja : Cawan yang akan digunakan dipanaskan pada suhu 105 oC kemudian didinginkan dalam desikator. Setelah itu ditimbang hingga diperoleh berat konstan. Sampel ditimbang ke dalam cawan yang telah diketahui beratnya. Dimasukkan dalam oven 105 oC selama ± 3 jam. Didinginkan dalam desikator hingga diperoleh berat kontan kemudian ditimbang
Kadar air = − ker ×100%
b. Analisa Total Solid (Metode Gravimetri, AOAC 1980)
Prinsip : Sampel dikeringkan dalam oven 100 – 105 oC hingga semua air dalam sampel menguap
Cara Kerja : Cawan yang akan digunakan dipanaskan pada suhu 105 oC kemudian didinginkan dalam desikator. Setelah itu ditimbang hingga diperoleh berat konstan. Sampel ditimbang ke dalam cawan yang telah diketahui beratnya. Dimasukkan dalam oven 105 oC selama ± 3 jam. Didinginkan dalam desikator hingga diperoleh berat kontan kemudian ditimbang
Total solid = − ×100%
c. Analisa Total Asam Tertitrasi (SNI 01-2981-1992)
berdasarkan jumlah larutan basa yang dibutuhkan untuk mengubah warna sampel
Cara Kerja : Sampel ditimbang sebanyak ± 20 gram kemudian dilarutkan dalam akuades sebanyak 2 kali volumenya. Ditambahkan 2 tetes indikator phenolphtalien 0,1% kemudian ditritasi dengan NaOH 0,1 N yang telah distandarisasi hingga berwarna merah muda.
Total Asam = × ×90×100% a
c b
a = bobot sampel (mg)
b = volume larutan NaOH (ml)
c = normalitas NaOH (N)
d. Analisa Total Protein Terlarut (Metode Lowry, AOAC 1990)
Prinsip : Reaksi antara Cu2+ dengan ikatan peptida dan reduksi asam fosfomolibdat dan asam fosfotungstat dari tirosin dan triptofan
(merupakan residu protein) akan menghasilkan warna biru.
Cara Kerja :
Pembuatan kurva standar
Protein standar dimasukkan ke dalam tabung reaksi sebanyak : 0
(blanko), 0,1, 0,2, 0,4, 0,6, 0,8 dan 1 ml. Akuades ditambahkan hingga
volume total masing-masing 4 ml. Ke dalam masing-masing tabung
reaksi ditambahkan 5,5 ml pereaksi pereaksi campuran fresh Na2CO3 2%
dalam NaOH 0,1 N dengan CuSO4 0,5% dalam Na-K-tartat 1% dengan
perbandingan 50 : 1. Campuran tersebut divorteks kemudian dibiarkan
selama 15 menit. Setelah 15 menit ditambahkan pereaksi follin yang
telah diencerkan 1: 1 dengan akuades. Divorteks kemudian didiamkan 30
menit hingga timbul warna biru. Absorbansinya diukur pada panjang
Penetapan sampel
Dipipet 1 ml sampel masukkan dalam labu takar 10 ml (untuk
sampel padat, ditimbang 1 gram sampel kemudian dimasukkan dalam
labutakar 10 ml kemudian disaring). Dari labu takar dipipet 0.1 ml ke
dalam tabung reaksi dan ditambahkan akuades hingga volumenya 4 ml.
Ditambahkan 5.5 ml pereaksi campuran fresh Na2CO3 2% dalam NaOH
0,1 N dengan CuSO4 0,5% dalam Na-K-tartat 1% dengan perbandingan
50 : 1. Campuran tersebut divorteks kemudian dibiarkan selama 15
menit. Setelah 15 menit ditambahkan pereaksi follin yang telah
diencerkan 1: 1 dengan akuades. Divorteks kemudian didiamkan 30
menit hingga timbul warna biru. Absorbansinya diukur pada panjang
gelombang 650 nm. Konsentrasi sampel didapatkan dari persamaan kurva
standar.
Protein Terlarut (mg/ml ) = konsentrasi X faktor pengenceran
e. Analisa Total Gula Pereduksi (Metode Somogy Nelson, AOAC 1990)
Ke dalam tabung reaksi bertutup dimasukkan 1 ml sampel
ataupun standar yang telah diencerkan. Masing-masing tabung
ditambahkan reagen Nelson sebanyak 1 ml kemudian divorteks dan
ditutup. Disimpan dalam penangas air selama 20 menit dari mendidih.
Setelah 20 menit, diangkat dari penangas dan didinginkan. Ditambahkan
1 ml reagen Arsenomolibdat. Divorteks kemudian diencerkan dengan
akuades hingga volume akhir menjadi 10 ml. Kocok kembali dengan
vorteks kemudian dibaca absorbansinya pada panjang gelombang 520 nm
dengan spektrofotometer. Konsentrasi sampel / standar didapatkan dari
persamaan kurva standar.
Total Gula pereduksi = konsentrasi X pengenceran
f. Analisa Total Padatan Terlarut (Metode Refraktometer, AOAC 1990)
Permukaan hand refraktometer dibersihkan menggunakan kapas
total padatan terlarut dapat dilihat skala. Pada Gambar 14 diperlihatkan
refraktometer yang digunakan.
Gambar 14. Refraktometer
g. Analisa Kadar Garam (AOAC,1990)
Sampel diletakkan pada gelas. Elektroda yang telah dibilas
dengan akuades dicelupkan hingga batas atasnya. Didiamkan selama
beberapa detik hingga angka stabil. Angka yang tertera pada layar adalah
nilai kadar garam sampel. Pada Gambar 15 diperlihatkan
konduktivitimeter yang digunakan untuk mengukur kadar garam.
Gambar 15. Konduktivitimeter
h. Analisa Jumlah Mikroba (Fardiaz, 1989)
Retentat kacang hijau terfermentasi yang telah diinkubasi setelah
diinokulasikan bakteri asam laktat dipipet sebanyak 10 ml. kemudian
dimasukkan ke dalam 90 ml NaCl fisiologis . Pengenceran kemudian
dilakukan hingga 10-7 dan pemupukan dilakukan dari pengenceran 10-5 sampai 10-8 dengan media MRSA dalam cawan Petri. Setelah pemupukan, cawan petri diinkubasi terbalik pada suhu 37 oC. Dilakukan duplo untuk tiap pengenceran. Inkubasi dilakukan selama 24 – 48 jam.
i. Penetapan kadar protein total (Metode Kjeldhal, AOAC 1990)
Prinsip : Oksidasi bahan – bahan berkarbon dan konversi menjadi
amonia. Selanjutnya amonia bereaksi dengan kelebihan
asam membentuk ammonia sulfat. Larutan dibuat mejadi
basa dan amonia untuk kemudian diserap dalam larutan
asam borat. Nitrogen yang terkandung dapat ditentukan
berdasarkan titrasi menggunakan HCl 0,02 N.
Cara kerja : Sampel ditimbang sejumlah kecil ke dalam labu dekstusi.
Ditambahkan 1.9 ± 0,1 g K2SO4, 40 ± 10 mg HgO dan 2,0 ± 0,1 ml H2SO4. Ditambahkan beberapa butir batu didih kemudian diletakan dalam alat dekstrusi selama
beberapa jam sehingga didapatkan cairan berwarna jernih.
Setelah didinginkan, sejumlah akuades ditambahkan. Isi
labu ke dalam alat destilasi. Erlenmeyer 125 ml yang
berisi 5 ml larutan H3BO3 dab 2-4 tetes indikator
(campuran 2 bagian metil merah 0,2% dalam alkohol dan
1 bagian metilen blue 0,2% dalam alkohol) di bawah
kondensor. Ujing tabung kondensor harus terendam dalam
laruten H3BO3. Tambahkan 8-10 ml larutan
NaOH-Na2S2O3, kemudian dilakukan destilasi hingga 15 ml
destilat dalam erlenmeyer. Bilas tabung kondensor dengan
air, air bilasan ditampung dalam erlenmeyer. Isi
erlenmeyer diencerkan hingga 50 ml kemudian dititrasi
dengan HCl o,02N hingga terjadi perubahan warna.
Lakukan juga untuk blanko.
j. Pengukuran nilai pH dengan metode standar (Apriyantono et al., 1989) Sebelum digunakan, pH meter dinyalakan hingga 15 – 30 menit. Sebelum digunakan elektroda dibilas dengan akuades kemudian dikeringkan dengan tissue. pH meter distandarisasi dengan larutan buffer fosfat pH 4 dan 7. Saat pengecekan pH elektroda dicelupkan dalam sampel kemudian dibiarkan hingga stabil.
k. Fluks (Cheryan, 1986)
Permeat yang keluar pada suatu selang waktu tertentu ditampung dalam gelas ukur. Nilai fluks ditentukan dengan rumus berikut :
Fluks =
l. Rejeksi (Cheryan, 1986)
Nilai rejeksi menyatakan kemampuan suatu membran menahan suatu komponen agar tidak melewati membran. Nilai rejeksi dihitung dengan rumus berikut :
Rejeksi = 1 ⎟⎟×100%
IV. HASIL DAN PEMBAHASAN
A. PENELITIAN PENDAHULUAN
1. Karakteristik Konsentrat Kacang Hijau Terfermentasi
Konsentrat Kacang Hijau terfermentasi yang didapatkan dari Laboratorium Pangan Pusat Penelitian Kimia (P2K) PUSPIPTEK, Serpong dianalisa komposisinya meliputi kadar air, total solid, total padatan terlarut (TSS), protein terlarut dan total proteinnya. Hasil analisa tersebut diperlihatkan pada Tabel 2.
Tabel 2. Karakteristik Konsentrat Kacang Hijau Terfermentasi
Komposisi Jumlah
Kadar Air (% bb) 93,688
Total Solid (% bb) 6,313
TSS (oBrix) 5,544
Kadar Garam (% bb) 2,150
Protein-Terlarut (mg/ml) 4,600 Total Protein (% bk) 12,089
2. Karakteristik Inokulum Bakteri Asam Laktat
Pembuatan inokulum bakteri asam laktat bertujuan untuk mengadaptasikan bakteri asam laktat dengan kondisi substrat yang berbeda dengan kondisi media sebelumnya. Diharapkan setelah diadaptasikan pada substrat, aktivitas dan jumlah bakteri asam laktat optimum pada inokulum sehingga dapat melakukan fermentasi dengan baik. Jumlah bakteri asam laktat pada inokulum bakteri asam laktat yang dihasilkan adalah 5,6 x 109 cfu/ml.
3. Pengaruh waktu dan kondisi fermentasi optimum terhadap komposisi biomassa
faktor penting dalam pembuatan suatu produk fermentasi. Pada penelitian ini starter bakteri asam laktat yang digunakan berupa starter basah yang telah diinkubasikan pada susu full cream. Sebelum digunakan untuk fermentasi biomassa, starter ini diadaptasikan pada konsentrat kacang hijau terfermentasi terlebih dahulu karena kondisi bahan baku yang berbeda dengan susu full cream.
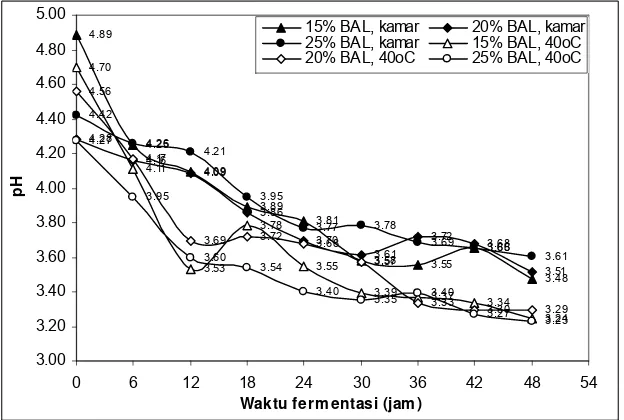
Beberapa faktor yang berpengaruh terhadap penentuan waktu dan kondisi fermentasi optimum adalah suhu inkubasi, konsentrasi inokulum dan waktu inkubasi. Suhu inkubasi yang digunakan adalah suhu kamar dan 40 oC. Konsentrasi inokulum yang diinkubasikan bervariasi yaitu 15, 20 dan 25%. Sedangkan waktu inkubasi yang digunakan adalah 0 – 48 jam dengan selang pengamatan setiap 6 jam. Dilakukan analisa pH dan total asam tertitrasi untuk menentukan kondisi fermentasi terbaik. Pada Gambar 13 diperlihatkan penurunan pH selama waktu inkubasi. Data pengukuran pH selama selama waktu inkubasi secara lebih lengkap diperlihatkan pada Lampiran 2.
Waktu ferm entasi (jam )
pH
15% BAL, kamar 20% BAL, kamar
25% BAL, kamar 15% BAL, 40oC
20% BAL, 40oC 25% BAL, 40oC
Gambar 16. Hubungan Waktu Fermentasi dengan pH Produk
mengetahui perubahan keasaman produk. Berdasarkan grafik di atas dapat dilihat bahwa nilai kisaran pH tertinggi diperoleh saat sebelum inkubasi atau inkubasi 0 jam. Hal tersebut karena bakteri asam laktat yang ditambahkan belum melakukan fermentasi. Nilai pH awal tertinggi diperoleh oleh produk dengan penambahan 15% inokulum bakteri asam laktat pada suhu ruang yaitu 4,89. Sedangkan pH awal terendah diperoleh dari penambahan 25% inokulum pada suhu 40 oC yaitu 4,27. Nilai pH akan mengalami penurunan selama proses fermentasi karena bakteri asam laktat akan menguraikan gula dalam bahan dan memproduksi asam laktat. Semakin lama waktu inkubasi maka asam yang terbentuk akan semakin besar karena terakumulasi. Pada titik tertentu, pertumbuhan bakteri asam laktat tersebut akan terhambat oleh asam yang telah terbentuk. Nilai pH terendah umumnya didapat pada saat inkubasi 48 jam. Nilai pH akhir fermentasi terendah dicapai oleh penambahan inokulum sebesar 25% pada suhu 40 oC yaitu 3,23. Sedangkan pH akhir fermentasi tertinggi dicapai oleh penambahan inokulum sebesar 25% pada suhu kamar yaitu sebesar 3,61. Nilai pH akhir fermentasi pada berbagai tingkat penambahan inokulum dengan suhu inkubasi 40 oC berada pada kisaran yang dekat. Nilai tersebut berturut-turut 3,24, 3,29 dan 3,23 untuk penambahan inokulum 15%, 20 % dan 25%.
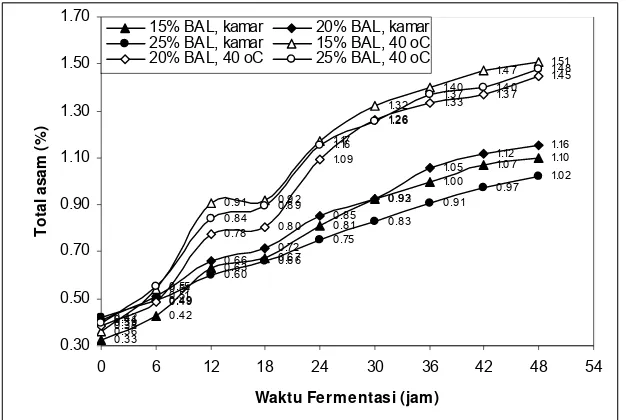
terdapatnya jenis asam lain hasil dari fermentasi bakteri asam laktat. Grafik peningkatan total asam tertitrasi selama proses fermentasi dapat dilihat pada Gambar 17. Nilai data total asam tertitrasi selama proses inkubasi secara lebih lengkap diperlihatkan pada Lampiran 3.
0.33
Waktu Ferm entasi (jam )
T
15% BAL, kamar 20% BAL, kamar
25% BAL, kamar 15% BAL, 40 oC
20% BAL, 40 oC 25% BAL, 40 oC
Gambar 17. Hubungan Waktu Fermentasi dengan Total Asam Produk Berdasarkan SNI 01-2981-1992, nilai total asam berkisar 0,5 – 2% dihitung sebagai asam laktat. Semakin lama waktu fermentasi maka total asam tertitrasi semakin tinggi karena waktu untuk fermentasi gula-gula tersebut semakin panjang.
suhu inkubasi 40 oC dengan nilai total asam sebesar 1,508%. Hal tersebut mungkin karena disebabkan semakin tinggi jumlah mikroba dalam suatu bahan makan kompetisi akan semakin besar. Pada penambahan 15% bakteri asam laktat, kompetisi lebih rendah karena sumber gula mencukupi untuk aktivitas sebagian besar mikroba sehingga total asam yang terbentuk lebih tinggi. Dari data ini, dapat ditetapkan kondisi fermentasi optimum adalah pada suhu inkubasi 40 oC dengan penambahan inokulum sebanyak 15%. Keputusan diambil berdasarkan kondisi dengan total asam tertinggi dan pH yang rendah dalam selang waktu fermentasi tersebut.
B. PENELITIAN UTAMA
Setelah tahapan fermentasi selesai, dilakukan analisa komposisi untuk mengetahui karakteristik bahan. Analisa yang dilakukan adalah analisa jumlah mikroba, total solid, total asam tertitrasi, total soluble solid, protein terlarut, gula pereduksi, dan kadar garam. Data hasil analisa komposisi diperlihatkan pada Tabel 3.
Tabel 3. Data Hasil Analisa Karakteristik Bahan setelah Fermentasi Komposisi Satuan Jenis Membran
Nanofiltrasi Osmosa Balik Total Mikroba cfu/ml 1,2 x 109 3,7 x 109
Total Solid % 14,078 19,319
Total Asam % 1, 375 1,518
TSS oBrix 14,500 16,00
Protein terlarut mg/ml 3,425 3,850
Gula pereduksi mg/ml 137,500 143,750
Garam % 0,600 0,600
membran nanofiltrasi yang dilanjutkan memban osmosa balik dengan kondisi sama, yaitu 2500 kPa atau 25 bar pada suhu 30 oC . Sedangkan untuk kondisi membran osmosa balik didasarkan pada ukuran pori membran yang lebih kecil dibandingkan ukuran pori membran nanofiltrasi sehingga dibutuhkan tekanan yang lebih besar agar proses pemisahan dapat berlangsung. Kebanyakan produk pangan memiliki tekanan osmosis yang tinggi sehingga dalam proses pemisahan menggunakan membran dibutuhkan tekanan yang lebih tinggi untuk menghasilkan efek pemisahan. Misalnya pada sari buah, tekanan osmosisnya adalah (6-10) x 105 Pa (Fellow, 1992). Tekanan berpengaruh terhadap nilai fluks sedangkan nilai frekuensi berpengaruh terhadap nilai laju alir bahan. Umumnya laju alir berkorelasi positif dengan fluks, sehingga semakin tinggi laju alir, biasanya nilai fluks juga akan semakin besar. Laju alir menyatakan kecepatan aliran umpan pada proses filtrasi.
1. Kondisi proses pemekatan
Proses pemekatan dilakukan dengan sistem operasi membran crossflow, biomassa bakteri asam laktat disirkulasikan ke dalam sistem modul selama 3 jam. Sampling dilakukan setiap setengah jam. Sistem crossflow dipilih karena diharapkan dapat mengurangi terjadinya fouling sehingga penurunan nilai fluks dapat diminimalisasi. Fluks biomassa bakteri asam laktat diukur untuk mengetahui kemampuan membran menahan biomassa bakteri asam laktat dan melewatkan komponen lain seperti air, sehingga terjadi peningkatan kepekatan biomassa. Proses pemisahan yang efektif akan memberikan nilai fluks yang tinggi. Semakin tinggi nilai fluks proses pemekatan akan berjalan semain cepat.
13.71
Waktu pem ekatan (m enit)
F
Gambar 18. Hubungan Waktu Pemekatan dengan Fluks Membran
membran sehingga akan menghambat laju permeasi air (pelarut murni) melalui membran (Aspiyanto dan Susilowati, 2005b). Data pengamatan proses pemekatan dengan menggunakan sistem membran secara lebih lengkap dapat dilihat pada Lampiran 4.
2. Pengaruh Waktu Pemekatan terhadap Jumlah Mikroba Produk
2.1E+10 2.3E+10 2.3E+10 2.4E+10 2.4E+10 2.2E+10
Retentat NF Retentat RO
Gambar 19. Hubungan Waktu Pemekatan dengan Jumlah Mikroba pada Retentat
1.3E+07
0.0E+00 0.0E+00 0.0E+00 0.0E+00 0.0E+00 0.0E+00
0.0E+00
Permeat NF Permeat RO
Gambar 20. Hubungan Waktu Pemekatan dengan Jumlah Mikroba pada Permeat
adalah berturut-turut 99,94 %, 99,97 %, 99,99 %, 99,98 %, 99,98 % dan 99,99 % untuk selang waktu pemekatan 30 hingga 180 menit. Sedangkan rejeksi mikroba untuk proses pemekatan dengan menggunakan membran osmosa balik adalah 100% untuk semua waktu pemekatan, yang berarti tidak ada mikroba yang lolos.
Berdasarkan uji ANOVA pada selang kepercayaan 95% yang dilakukan terhadap nilai jumlah mikroba di retentat didapatkan bahwa faktor waktu berpengaruh terhadap jumlah mikroba di retentat. Sedangkan terhadap faktor jenis membran serta interaksi membran dan waktu tidak berbeda nyata. Uji lanjut Duncan dilakukan terhadap jumlah mikroba pada retentat terhadap faktor waktu. Berdasarkan uji lanjut Duncan, jumlah mikroba pada retentat terletak pada kelompok yang sama, sehingga berarti waktu pemekatan tidak berbeda nyata dalam menentukan jumlah mikroba pada retentat.
Gambar 21. Produk Hasil Pemekatan dengan Jumlah Bakteri Asam Laktat Tertinggi
3. Pengaruh Waktu Pemekatan terhadap Total Solid Produk
Selama proses pemekatan, air akan keluar sehingga padatan akan semakin terakumulasi pada retentat karena tidak dapat melewati pori membran. Total solid juga merupakan salah satu parameter proses pemekatan dengan membran yang maksimal. Menurut Fellows (1992), kemampuan membran memekatkan hanya sampai 30% total padatan. Dari Gambar 24 terlihat bahwa kandungan padatan total dalam retentat akan meningkat seiring bertambahnya waktu pemekatan. Kandungan padatan total dalam retentat hasil pemekatan konsentrat kacang hijau terfermentasi menggunakan membran nanofiltrasi selama 30, 60, 90, 120, 150 dan 180 menit masing-masing adalah 18,43, 19,32, 19,39, 19,56, 19,68 dan 22,08 %. Sedangkan kandungan padatan total dalam permeat pada waktu 30, 60, 90, 120, 150 dan 180 menit masing-masing adalah 2,21, 1,90, 2,19, 2,00, 1,75 dan 1,28 %. Kandungan padatan total dalam retentat hasil pemekatan konsentrat kacang hijau terfermentasi menggunakan membran osmosa balik selama 30, 60, 90, 120, 150 dan 180 menit masing-masing adalah 19,88, 19,87, 19,17, 20,29, 20,51 dan 21,00 %. Sementara kandungan padatan total dalam permeat pada waktu 30, 60, 90, 120, 150 dan 180 menit masing-masing adalah 0,20, 0,21, 0,18, 0,55, 0,31 dan 0,49 %. Peningkatan kandungan padatan total dalam retentat terjadi karena adanya perpindahan massa pelarut dari sisi retentat menuju sisi permeat baik pada membran
nanofiltrasi maupun pada membran osmosa balik sehingga kekentalan fluida menjadi meningkat dengan demikian kandungan padatan total dalam retentat meningkat. Karena ukuran pori-pori membran nanofiltrasi lebih besar daripada membran osmosa balik maka kandungan padatan total dalam permeat pada membran nanofiltrasi lebih tinggi apabila dibandingkan dengan kandungan padatan total dalam permeat pada membran osmosa balik. Dengan kata lain bahwa membran osmosa balik berfungsi lebih efektif daripada nanofiltrasi melalui proses pemisahan komponen padatan total pada konsentrat kacang hijau terfermentasi. Data analisa total solid produk secara lebih lengkap dapat dilihat pada Lampiran 7. Pada Gambar 22 berikut ini diperlihatkan hubungan total solid produk dengan waktu pemekatan.
18.43 19.32 19.39 19.56 19.68
22.08
19.89 19.87 19.17 20.29 20.51 21.00
2.21 1.90 2.19 2.00 1.75 1.28
0.20 0.21 0.18 0.55 0.31 0.49
0.00
Retentat NF Retentat RO Permeat NF Permeat RO
Gambar 22. Hubungan Waktu Pemekatan dengan Total Solid Produk
lebih besar dibandingkan ukuran pori osmosa balik. Dari hasil analisa uji lanjut Duncan terhadap total solid permeat didapatkan bahwa jenis membran berbeda nyata dalam menentukan nilai total solid produk. Hasil pengolahan statistik terhadap total solid produk dapat dilihat pada Lampiran 8.
4. Pengaruh Waktu Pemekatan terhadap Total Asam Produk
Menurut Mäyrä-Mäkinen dan Bigret (1993), Lactobacillus termasuk ke dalam kelompok bakteri asam laktat termofilik. Kelompok Lactobacillus memiliki lebih dari 50 jenis baik yang homofermentatif maupun heterofermentatif. Total asam tertitrasi dalam sampel dihitung sebagai asam laktat. Pertumbuhan bakteri asam laktat sangat dipengaruhi oleh kondisi medium. Metabolisme utama bakteri asam laktat adalah proses fermentasi, dalam hal ini susu skim yang mengandung sekitar 74% laktosa akan difermentasi menjadi asam, terutama asam laktat. Penambahan susu skim pada beberapa medium bertujuan untuk menstimulasi pertumbuhan bakteri asam laktat, yang belum siap untuk memanfaatkan karbohidrat yang terdapat dalam medium.
Dalam proses fermentasinya, bakteri asam laktat umumnya memanfaatkan karbohidrat seperti glukosa, fruktosa dan sukrosa. Salminen dan Von Wright (1998), menyatakan bahwa bahan pangan nabati umumnya mengandung maltosa dan fruktosa yang disukai oleh bakteri asam laktat untuk digunakan sebagai nutrisi. Pada bakteri homofermentatif, glukosa akan dikonversi menjadi asam laktat sedangkan pada bakteri heterofermentatif, glukosa akan diubah menjadi asam laktat, karbondioksida, etanol atau asam asetat.
tertitrasi lebih tinggi dibandingkan total asam tertitrasi pada retentat nanofiltrasi karena asam terakumulasi pada retentat. Data lengkap analisa total asam dapat dilihat pada Lampiran 9. Pada Gambar 23 diperlihatkan perubahan total asam tertitrasi sampel selama proses pemekatan.
1.29 1.29 1.33 1.32 1.34 1.33
1.46 1.49
1.54 1.56 1.58 1.59
1.17 1.16
Retentat NF Retentat RO
Permeat NF Permeat RO
Gambar 23. Hubungan Waktu Pemekatan dengan Total Asam Tertitrasi Produk
1,49, 1,54, 1,56, 1,58 dan 1,59 %. Sementara kandungan total asam dalam permeat pada waktu 30, 60, 90, 120, 150 dan 180 menit masing-masing adalah 0,30, 0,33, 0,38, 0,38, 0,43 dan 0,45, Nilai rejeksi asam dari membran nanofiltrasi adalah berturut-turut 9,62, 9,40, 5,53, 10,47, 6,33 dan 9,31 % untuk masing-masing waktu pemekatan. Nilai rejeksi asam membran osmosa balik adalah 79,70, 78,05, 75,50, 75,49, 72,98 dan 71,40 %. Seiring peningkatan waktu pemekatan rejeksi asam membran osmosa balik semakin kecil. Hal ini disebabkan karena semakin tingginya konsentrasi asam pada umpan sehingga kemungkinan asam lolos semakin besar.
(m1). Hasil Pengolahan statistik terhadap total asam dapat dilperlihatkan pada Lampiran 10.
5. Hubungan Waktu Pemekatan terhadap Total Soluble Solid Produk Total padatan terlarut atau Total soluble solid (TSS) diukur dengan menggunakan refraktometer. Yang terukur adalah indeks bias sampel. Indeks bias ini biasanya dipengaruhi oleh kandungan bahan dalam sampel tersebut. Data analisa TSS dapat dilihat pada Lampiran 11. Grafik hubungan waktu pemekatan dengan total soluble solid diperlihatkan pada Gambar 24 di bawah ini.
16.00 15.75 16.50
18.00 18.50
19.00
15.50 16.00
17.00 17.00 17.00 17.00
2.00
1.50
1.00 1.00 1.00 1.00 0.00 0.00 0.00 0.00 0.00 0.00
0
Retentat NF Retentat RO Permeat NF Permeat RO
Gambar 24. Hubungan Waktu Pemekatan dengan Total Soluble Solid Produk
o
Brix. Sedangkan kandungan total padatan terlarut dalam permeat pada waktu pemekatan 30, 60, 90, 120, 150 dan 180 menit masing-masing adalah 2,00, 1,50, 1,00, 1,00, 1,00, 1,00 oBrix. Kandungan padatan total dalam retentat hasil pemekatan konsentrat kacang hijau terfermentasi menggunakan membran osmosa balik selama 30, 60, 90, 120, 150 dan 180 menit masing-masing adalah 16,00, 15,50, 16,00, 17,00, 17,00, 17,00, 17,00 oBrix. Sementara kandungan total padatan terlarut dalam permeat membran osmosa balik semuanya bernilai 0,00 untuk semua selang waktu pemekatan. Peningkatan kandungan total padatan terlarut dalam retentat terjadi karena adanya perpindahan massa pelarut murni dari sisi retentat menuju sisi permeat baik pada membran nanofiltrasi maupun pada membran osmosa balik sehingga kekentalan fluida menjadi meningkat dengan demikian kandungan padatan total dalam retentat meningkat. Karena ukuran pori-pori membran nanofiltrasi lebih besar daripada membran osmosa balik maka kandungan total padatan terlarut dalam permeat pada membran nanofiltrasi lebih tinggi apabila dibandingkan dengan kandungan total padatan terlarut dalam permeat pada membran osmosa balik. Peningkatan nilai TSS pada retentat osmosa balik berhenti setelah pemekatan 90 menit. Hal tersebut dimungkinkan karena fluks yang semakin rendah sehingga semakin sedikit pelarut yang dapat dipisahkan. Jika pelarut yang terpisahkan sedikit, efek pemisahan akan bernilai kecil.
Duncan faktor interaksi waktu pemekatan dan jenis membran terhadap total padatan terlarut menunjukan bahwa interaksi w1m2 (30 menit, osmosa balik) dan w2m1 (60 menit, nanofiltrasi) berbeda dengan w1m1 (30 menit, nanofiltrasi), w2m2 (60 menit, osmosa balik), dan w3m1 (90 menit, nanofiltrasi) berbeda dengan w3m2 (90 menit, osmosa balik), w4m2 (120 menit, osmosa balik), w5m2 (150 menit, osmosa balik), dan w6m2 (180 menit, osmosa balik) berbeda dengan w5m1 (150 menit, nanofiltrasi) dan berbeda dengan w6m1 (180 menit, nanofiltrasi). Pada permeat, faktor yang mempengaruhi TSS adalah jenis membran. Berdasarkan uji ANOVA yang dilakukan dapat disimpulkan bahwa jenis membran merupakan faktor yang berpengaruh terhadap TSS permeat. Hasil uji lanjut Duncan terhadap faktor jenis membran permeat adalah jenis membran berpengaruh nyata terhadap nilai total padatan terlarut permeat produk. Hasil pengolahan statistik total soluble solid dapat dilihat pada Lampiran 12.
3.65
Retentat NF Retentat RO
Gambar 25. Hubungan Waktu Pemekatan dengan Protein Terlarut Retentat Produk
0.0078 0.0080 0.0078
Permeat NF Permeat RO
Gambar 26. Hubungan Waktu Pemekatan dengan Protein Terlarut Permeat Produk
membran osmosa balik selama waktu pemekatan secara berturut-turut adalah 100 % untuk waktu pemekatan 90 menit dan 99,98 % untuk waktu pemekatan yang lainnya.
Berdasarkan hasil perhitungan sidik ragam, didapatkan bahwa faktor waktu pemekatan berpengaruh nyata terhadap protein terlarut retentat. Uji lanjut Duncan dilakukan terhadap faktor waktu pemekatan. Berdasarkan uji lanjut Duncan dengan taraf nyata 5% nilai protein terlarut terletak pada satu kelompok yang sama sehingga dapat disimpulkan bahwa waktu pemekatan tidak berbeda nyata satu sama lain. Atau, dapat disimpulkan bahwa kadar protein terlarut hasil pemekatan 30 menit, 60 menit, 90 menit, 120 menit, 150 menit dan 180 menit adalah tidak berbeda menurut statistik. Sedangkan pada permeat faktor waktu pemekatan, jenis membran ataupun interaksi kedua faktor tersebut tidak berpengaruh nyata pada protein terlarut permeat. Hasil pengolahan statistik pengaruh perlakuan terhadap protein terlarut dapat dilihat pada Lampiran 14.
gula pereduksi pada retentat osmosa balik. Data analisa total gula pereduksi diperlihatkan pada Lampiran 15.
97.50
Retentat NF Retentat RO
Gambar 27. Hubungan Waktu Pemekatan dengan Gula Pereduksi Retentat Produk
1.28 1.33
1.43 1.57
1.66
1.97
0.14 0.18 0.18 0.19 0.20
0.76
Permeat NF Permeat RO
Grafik 28. Hubungan Waktu Pemekatan dengan Gula Pereduksi Permeat Produk
selama waktu pemekatan secara berturut-turut adalah 99,92, 99,89, 99,90, 99,89, 99,89 dan 99,57 % untuk waktu pemekatan 30, 60, 90, 120, 150 dan 180 menit.
Berdasarkan hasil perhitungan sidik ragam, didapatkan bahwa faktor waktu pemekatan berpengaruh nyata terhadap total gula pereduksi retentat. Berdasarkan uji lanjut Duncan terhadap pengaruh faktor waktu pemekatan dengan nilai total gula pereduksi menunjukan tidak ada perbedaan antara waktu pemekatan yang satu dengan waktu yang lain karena terletak pada satu kelompok yang sama. Sedangkan pada permeat faktor jenis membran berpengaruh nyata terhadap nilai total gula pereduksi permeat.
Berdasarkan hasil uji Duncan didapatkan bahwa perlakuan jenis membran nanofiltrasi (m1) dan osmosa balik (m2) berbeda terhadap total gula pereduksi permeat. Hasil pengolahan statistik data total gula pereduksi dapat dilihat pada Lampiran 16.
8. Hubungan Waktu Pemekatan dengan Kadar Garam Produk
0.58 0.56 0.59 0.57 0.57 0.57
0.60 0.60 0.61 0.61 0.62 0.61
0.58 0.61 0.58
0.63 0.64 0.67
0.12 0.13 0.13 0.14 0.14 0.14
0.00
Retentat NF Retentat RO
Permeat NF Permeat RO
Gambar 29. Hubungan Waktu Pemektan dengan Kadar Garam Produk
kacang hijau terfermentasi menggunakan membran osmosa balik selama 30, 60, 90, 120, 150 dan 180 menit masing-masing adalah 0,60, 0,60, 0,61, 0,61, 0,62 dan 0,61 %. Sementara kadar garam dalam permeat membran osmosa balik pada waktu pemekatan 30, 60, 90, 120, 150 dan 180 berturut-turut adalah 0,12, 0,13, 0,13, 0,14, 0,14 dan 0,14 %.
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Penelitian pendahuluan dilakukan untuk mengetahui karakteristk konsentrat kacang hijau terfermentasi dan menentukan konsentrasi inokulum, waktu fermentasi dan suhu fermentasi optimum. Waktu fermentasi optimum ditentukan berdasarkan nilai pH yang rendah dan total asam tertitrasi tertinggi. Karakteristik konsentrat kacang hijau terfermentasi yang merupakan bahan baku adalah kadar air 93,688%, total solid 6,313 %, TSS 5,544 oBrix, kadar garam 2,150 %, protein terlarut 4,600 mg/ml dan total protein 12,089 % (bk). Berdasarkan hasil tahapan penentuan kondisi dan waktu fermentasi optimum yang didapatkan dapat disimpulkan bahwa waktu fermentasi optimum adalah 48 jam pada suhu 40 oC dengan konsentrasi starter 15 %.
pemekatan dengan menggunakan membran osmosa balik optimum pada pemekatan 180 menit dengan komposisi : jumlah bakteri asam laktat 8,7 x 1010 cfu/ml, total padatan 21 %, total padatan terlarut 17 oBrix, total asam 1,59 %, total protein terlarut 4,9 mg/ml, total gula pereduksi 178,13 mg/ml, kadar garam 0,61 % NaCl dan fluks permeat 2,32 liter/m2.jam. Pemekatan dengan menggunakan membran osmosa balik memiliki efisiensi yang baik karena hampir semua bahan tertahan pada retentat, namun karena jumlah pelarut yang keluar lebih sedikit dibandingkan pada membran nanofiltrasi.
B. SARAN
Setelah melakukan penelitian, penulis memberikan saran sebagai berikut :
1. Perlu dilakukannya variasi dalam tekanan maupun frekuensi operasi membran untuk meningkatkan efisiensi pemekatan 2. Perlunya dilakukan uji penyimpanan, karena jumlah mikroba
DAFTAR PUSTAKA
Allan, K.S. dan J.C. Sidney. 1980. Soybeans: Chemistry and Technology. Volume 1. AVI Publishing Company, Westport, Connecticut
Anonim. Membrane Technology For Process Industry. PCI Membrane Systems Inc. Milford,USA. http:www.pcims.com/images/TP105.5us.pdf [gambar online],diakses tanggal 9 Mei 2005
AOAC. 1980. Official Methods of Analysis of The Association of Official Analytical Chemistry. AOAC Inc. , Wahington DC
AOAC. 1990. Official Methods of Analysis of The Association of Official Analytical Chemistry. AOAC Inc. , Wahington DC
Apriyantono, A., D. Fardiaz, N.L. Puspitasari, sedarnawati, S. Budiyanto. 1989. Analisis Pangan, IPB Press, Bogor
Aspiyanto. 2002. Penerapan Teknologi Membran di Bidang Pangan, Prosiding Seminar Tantangan Penelitian Kimia. Pusat Penelitian Kimia, Lembaga Penelitian Indonesia
Aspiyanto dan A. Susilowati. 2005. Prosiding Seminar Nasional IV : Aplikasi Kimia dalam Pengelolaan Sumber Daya Alam dan Lingkungan, Lembaga Penelitian Indonesia
Aspiyanto dan A. Susilowati. 2005b. Konsentrat Kacang Hijau
(
Phaseolus radiatus L.)Terfermentasi sebahai Bahan Tambahan Makanan (Food Ingridient) Berprobiotik. Laporan DIPA, Lembaga Penelitian IndonesiaAxelsson, L.T. 1998. Lactic Acid Bacteria: Classification and Physiology. Di dalam Salminen, S. dan A.V. Wright. 1998. Lactic Acid Bacteria: Mycribiologycal Functional Aspects. 2nd ed. Marcel Dekker, New York
Batt, C. A., R. K. Robinson dan P. D. Patel. 1999. Encyclopedia of Food Microbiology. Academic Press, New York
Cheryan, M. 1992. Membrane Technology in Food and Bioprocessing, Di dalam. R.P. Singh dan M.A. Wirakartakusumah (eds). Advanced in Food
Departemen Kesehatan.1992. Peraturan Menteri Kesehatan Republik Indonesia No.722/Menkes/Per/IX/ 88 tentang Bahan Tambahan Makanan.
Departemen Kesehatan RI, Jakarta
De Vuyst, L. dan E. J. Vandamme. 1994. Antimicrobial Potential of Lactic Acid Bacteria. Di dalam. Bacteriosin of Lactic Acid Bacteria. Microbiology Genetics and Application. Blackie Academic and Professional, London Ebine. 1979. Evaluation of Soybean Varieties for Makin Miso. USDA Technical
Report, Agric Library
Fardiaz, S. 1989. Penuntun Praktek Mikrobiologi Pangan, IPB Press, Bogor Fellows, P. J. 1992. Food Processing Technology. Principles and Practices. Ellis
Horwood, New York
Fuller, R. 1989. Probiotics in Man and Animals. Di dalam. Tannock, G.E (ed). Probiotics: A Critical Review, Horizon Scienctific Press,Norflok, England
Frazier, W. dan D. Westhoff. 1988. Food Microbiology. Third Ed. Tata McGraw-Hill Publishing Company, Limited, New Delhi
Gutman, R. G. 1987. Membrane Filtration, Yhe Rheological of Pressure Driven Crossflow Process. IOP Publishing Ltd., England.
Guu, Yuan-Kuang, Chiu-Hsia Chiu dan Jin-Kun Young. !997. Processing of Soybean Soaking Water with NF-RO Membrane System and Lactic Acid Fermentation of Retained Solutes. Di dalam. Journal Agric. Food
Chem.45. 4096-4100
http://www.kochmembranesystems [gambar online], diakses tanggal 18 Mei 2005
Jay, J.M. 2000. Modern Food Microbiology. Sixth Edition. Aspen Publisher Inc., Gaitheaburg, Maryland
Kaseno. 1999. Teknologi Membran : Prinsip Dasar, Pembuatan dan Aplikasinya. Makalah Seminar Pengembangan Teknologi Membran dan Aplikasinya di Indonesia. BPPT, Jakarta.
Mangunwidjaja, D. 1991. Diktat Teknologi Membran Pada Bioproses. Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor.
Mäyra-Makinen dan Bigret. 1993. 1993. Industrial Use and Production of Lactic Acid Bacteria. Di dalam. Salminen , S. dan A.V. Wright. 1993. Lactic Acid Bacteria. Marcel Dekker, New York
Mitsuoka, J. 1989. A Profile of Intestinal Bacteria. Yakult Honsa Co. Ltd, Tokyo
Mulder, M. 1996. Basic Principles of Membrane Technology. Kluwer Academic Publisher, Netherland
Nurmala, R. 2001. Pengaruh Jenis Starter, Waktu Inkubasi dan Lama Fermentasi pada Pembuatan Kaldu Nabati Kacang Merah (Phaseolus vulgaris L.). Skripsi. Fakultas Teknik. Universitas Pasundan, Bandung
Paulson, D. J. 1995. Membranes, the Finest Filtration. By: Introduction to Crossflow Membrane Technology. Published in Filtration News.
http://www.environmental-expert.com/articles/article111/article111.htm [artikel online], diakses tanggal 20 Maret 2005
Ray, Bibek. 2001. Fundamental Food Microbiology. Second ed. CRC Press, Boca Raton, Florida
Salminen, S. dan A.V. Wright. 1998. Lactic Acid Bacteria: Microbiology and Functional Aspects. 2nd edition. Marcel Dekker Inc., New York Scott, K. dan R. Hughes. 1996. Indutrial Membran Separation Technology.
Blackie Academic and Proffesionals, London
SNI 01-2981-1992. Standar Nasional Yoghurt
Stamer, J. R.. 1979. The Lactic Acid Bacteria: Microbes of Diversity. Food Technology, 33 (1) : 60 – 65.
Susilowati, A., A.B. Thelma dan Yati M, 2002. Kaldu sebagai Alternatif Pasta Kaldu dari Kacang-kacangan secara Fermentasi. Prosiding Seminar Tantangan Penelitian Kimia, Pusat Penelitian Komia, Lembaga Ilmu Pengetahuan Indonesia
Tamime, A.Y dan V.M.E. Marshall. 1997. Microbiology and Technology of Fermented Milks. Di dalam . Microbiology and Biochemistry of Cheese and Fermented Milks. Second Ed. Edited by B.A. Law. 1997. Blackie Academic and Professional, London
Tzanetaki, E.L dan N. Tzanetakis. 1999. Fermented Milks. Di dalam. Robinson, R.K, C.A. Batt dan P.D patel. 1999. Encyclopedia of Food Microbiology. Academic Press, New York
Wenten, I.G. 1999. Teknologi Membran Industrial. Teknik Kimia ITB. Tidak dipublikasikan
Woerner, D. L. 2004. Membrane Technology In Textile Operations. Koch Membrane Systems. http://www.p2pays.org/ref/04/03269.pdf [gambar online], diakses tanggal 16 Mei 2005
Wood, B.J.B. 1985. Microbiology of Fermented Foods. Vol. 1. Elsavier Applied Science Publisher, New York
Lampiran 1. Contoh Perhitungan Penentuan Jumlah Susu Skim
Keterangan : konsentrat kacang hijau terfermentasi diencerkan 6 kali dengan air Contoh perhitungan :
Misal : konsentrat kacang hijau terfermentasi = 100 gram Substrat = (100 +6x100) = 700 gram
Konsentrat kacang hijau terfermentasi a gram (kadar protein 0.763 %)
Substrat (a+6a)gram Kadar protein 3%
Perhitungan :
(0.763% x 100 gram) + (30 % x b gram) = (3% x 700 gram) 76.3 + 30 b = 2100
b = 67,46 gram
Lampiran 2. Data Analisa pH Penelitian Pendahuluan
Waktu
Inkubasi
(jam)
Konsentrasi Inokulum
15% 20% 25%
Suhu kamar 40 oC Suhu kamar 40 oC Suhu kamar 40 oC
1 2 Rata2 1 2 Rata2 1 2 Rata2 1 2 Rata2 1 2 Rata2 1 2 Rata2
0 4,81 4,96 4,89 4,52 4,88 4,70 3,96 4,60 4,28 4,35 4,78 4,56 4,24 4,60 4,42 3,88 4,67 4,27
6 3,96 4,54 4,25 3,94 4,28 4,11 4,01 4,32 4,16 3,82 4,51 4,17 4,06 4,46 4,26 3,76 4,14 3,95
12 4,00 4,18 4,09 3,23 3,84 3,53 4,03 4,15 4,09 3,30 4,09 3,69 4,07 4,34 4,21 3,37 3,82 3,60
18 3,61 4,17 3,89 3,72 3,84 3,78 3,59 4,13 3,86 3,40 4,04 3,72 3,56 4,33 3,95 3,29 3,79 3,54
24 3,78 3,84 3,81 3,18 3,92 3,55 3,52 3,88 3,70 3,64 3,72 3,68 3,38 4,16 3,77 3,25 3,55 3,40
30 3,38 3,78 3,58 3,20 3,59 3,39 3,43 3,79 3,61 3,56 3,58 3,57 3,46 4,11 3,78 3,17 3,54 3,35
36 3,38 3,73 3,55 3,21 3,53 3,37 3,69 3,75 3,72 3,11 3,56 3,33 3,36 4,01 3,69 3,32 3,47 3,40
42 3,59 3,71 3,65 3,15 3,52 3,34 3,66 3,70 3,68 3,07 3,53 3,30 3,39 3,92 3,66 3,09 3,45 3,27
Lampiran 3. Data Analisa Total Asam Tertitrasi Penelitian Pendahuluan
Waktu
Inkubasi
(jam)
Konsentrasi Inokulum
15% 20% 25%
Suhu kamar 40 oC Suhu kamar 40 oC Suhu kamar 40 oC
1 2 Rata2 1 2 Rata2 1 2 Rata2 1 2 Rata2 1 2 Rata2 1 2 Rata2
0 0,31 0,34 0,325 0,33 0,38 0,358 0,42 0,41 0,411 0,38 0,38 0,383 0,40 0,44 0,418 0,39 0,40 0,394
6 0,44 0,41 0,425 0,52 0,56 0,538 0,51 0,51 0,510 0,56 0,42 0,489 0,52 0,46 0,494 0,56 0,54 0,551
12 0,66 0,61 0,632 0,94 0,87 0,905 0,68 0,64 0,660 0,92 0,63 0,777 0,69 0,51 0,602 0,93 0,75 0,842
18 0,75 0,60 0,671 0,98 0,86 0,918 0,78 0,65 0,716 0,99 0,62 0,802 0,79 0,53 0,659 0,99 0,80 0,894
24 0,78 0,85 0,812 1,13 1,21 1,171 0,88 0,83 0,854 1,17 1,01 1,091 0,85 0,65 0,749 1,14 1,17 1,155
30 0,91 0,94 0,925 1,29 1,35 1,320 0,97 0,87 0,923 1,31 1,20 1,260 0,96 0,69 0,826 1,29 1,22 1,255
36 0,98 1,02 0,999 1,38 1,41 1,398 1,04 1,07 1,055 1,39 1,27 1,331 1,03 0,79 0,909 1,39 1,35 1,370
42 1,04 1,09 1,067 1,45 1,49 1,469 1,09 1,14 1,117 1,47 1,27 1,371 1,09 0,85 0,970 1,47 1,33 1,400
Lampiran 4. Data Pengamatan Proses Pemekatan dengan Menggunakan Sistem Membran
Jenis Membran Nama
Membran
Chiller Tangki Feed Retentat
Lampiran 5. Data Hasil Perhitungan Jumlah Mikroba selama ProsesPemekatan
Jenis
membran
Waktu
Pemekatan
(menit)
Jumlah Mikroba (cfu/ml)
Rejeksi (%)
Retentat Permeat
1 2 Rata-rata 1 2 Rata-rata
Nano
filtrasi
30 1,8E+10 2,3E+10 2,1E+10 2,5E+07 4,9E+05 1,3E+07 99,94
60 1,7E+10 2,8E+10 2,3E+10 1,2E+07 4,5E+04 6,0E+06 99,97
90 2,2E+10 2,3E+10 2,3E+10 5,5E+06 1,3E+05 2,8E+06 99,99
120 2,1E+10 2,6E+10 2,4E+10 8,1E+06 2,7E+05 4,2E+06 99,98
150 1,9E+10 2,9E+10 2,4E+10 9,9E+06 1,3E+05 5,0E+06 99,98
180 2,4E+10 1,9E+10 2,2E+10 5,4E+06 9,0E+04 2,7E+06 99,99
Osmos
a Bali
k
30 2,6E+10 3,4E+10 3,0E+10 0,0E+00 1,0E+04 5,0E+03 100,00
60 2,9E+10 4,7E+10 3,8E+10 0,0E+00 0,0E+00 0,0E+00 100,00
90 9,3E+09 4,0E+10 2,5E+10 0,0E+00 0,0E+00 0,0E+00 100,00
120 1,2E+10 8,3E+10 4,8E+10 0,0E+00 0,0E+00 0,0E+00 100,00
150 4,2E+10 7,9E+10 6,1E+10 0,0E+00 0,0E+00 0,0E+00 100,00
Lampiran 6. Hasil Pengolahan Statistik terhadap Jumlah Mikroba
1. Retentat
Jenis Membran (M) Waktu Pemekatan (W) Total
30’ 60’ 90’ 120’ 150’ 180’
NANOFILTRASI 1,8E+10 1,7E+10 2,2E+10 2,1E+10 1,9E+10 2,4E+10
2,3E+10 2,8E+10 2,3E+10 2,6E+10 2,9E+10 1,9E+10
Subtotal 4,1E+10 4,5E+10 4,5E+10 4,7E+10 4,8E+10 4,3E+10 2,7E+11
OSMOSA BALIK 2,6E+10 2,9E+10 9,3E+09 1,2E+10 4,2E+10 7,4E+10
3,4E+10 4,7E+10 4,0E+10 8,3E+10 7,9E+10 1,0E+11
Subtotal 6,0E+10 7,6E+10 4,9E+10 9,5E+10 1,2E+11 1,7E+11 5,8E+11
Total 1,0E+11 1,2E+11 9,4E+10 1,4E+11 1,7E+11 2,2E+11 8,4E+11
ANOVA
Sumber Variasi db JK KT F hitung F tabel
Faktor w 1 2,7E+21 2,7E+21 6,8E+00* 4,75
faktor m 5 3,9E+21 7,8E+20 2,0E+00tn 3,11
interaksi wm 5 2,6E+21 5,2E+20 1,3E+00tn 3,11
galat 11 4,4E+21 4,0E+20
total 23 1,4E+22
Keterangan : * : berbeda nyata
tn
Uji Lanjut Duncan Faktor Waktu Pemekatan terhadap Jumlah Mikroba pada Retentat
Ssr 5% Lsr 5% Rata2 perlakuan
Perlakuan Taraf
Nyata 5%
1 2 3 4 5 6
- - w3 2,36E+10 - a
3,11 3,1E+10 w1 2,53E+10 1,68E+09tn - a
3,27 3,3E+10 w2 3,03E+10 6,68E+09tn 5,00E+09tn - a
3,35 3,3E+10 w4 3,55E+10 1,19E+10tn 1,03E+10tn 5,25E+09tn - a
3,39 3,4E+10 w5 4,23E+10 1,87E+10tn 1,70E+10tn 1,20E+10tn 6,75E+09tn - a
3,43 3,4E+10 w6 5,43E+10 3,07E+10tn 2,90E+10tn 2,40E+10tn 1,88E+10tn 1,20E+10tn - a
Keterangan : nilai taraf nyata yang ditandai dengan huruf yang berbeda menunjukan perbedaan nyata pada taraf 5% menurut uji Duncan,
2. Permeat
Jenis Membran (M) Waktu Pemekatan (W) Total
30’ 60’ 90’ 120’ 150’ 180’
NANOFILTRASI 2,5E+07 1,2E+07 5,5E+06 8,1E+06 9,9E+06 5,4E+06
4,9E+05 4,5E+04 1,3E+05 2,7E+05 1,3E+05 9,0E+04
Subtotal 2,5E+07 1,2E+07 5,6E+06 8,4E+06 1,0E+07 5,5E+06 6,7E+07
OSMOSA BALIK 0,0E+00 0,0E+00 0,0E+00 0,0E+00 0,0E+00 0,0E+00
1,0E+04 0,0E+00 0,0E+00 0,0E+00 0,0E+00 0,0E+00
Subtotal 1,0E+04 0,0E+00 0,0E+00 0,0E+00 0,0E+00 0,0E+00 1,0E+04
ANOVA
Sumber Variasi db JK KT F hitung F tabel
Faktor w 1 7,0E+13 7,0E+13 1,6E+00tn 4,75
faktor m 5 1,9E+14 3,7E+13 8,6E-01tn 3,11
interaksi wm 5 6,9E+13 1,4E+13 3,2E-01tn 3,11
galat 11 4,8E+14 4,4E+13
total 23 8,0E+14
Lampiran 7. Data Hasil Perhitungan Total Solid
Jenis
membran
Waktu
Pemekatan
(menit)
Total Solid (%)
Rejeksi (%) Retentat Permeat
1 2 Rata-rata 1 2 Rata-rata
Nano
filtrasi
30 18,55 18,31 18,43 2,26 2,16 2,21 88,01
60 19,56 19,07 19,32 2,27 1,52 1,90 90,19
90 20,02 18,75 19,39 2,35 2,04 2,19 88,69
120 19,87 19,26 19,56 2,21 1,79 2,00 89,78
150 19,30 20,05 19,68 1,67 1,84 1,75 91,09
180 23,48 20,68 22,08 1,74 0,82 1,28 94,21
Osmos
a Bali
k
30 21,97 17,80 19,89 0,40 0,00 0,20 98,99
60 21,57 18,17 19,87 0,42 0,00 0,21 98,94
90 20,21 18,13 19,17 0,35 0,00 0,18 99,08
120 21,88 18,70 20,29 0,77 0,33 0,55 97,29
150 22,10 18,92 20,51 0,33 0,29 0,31 98,49
Lampiran 8. Hasil Uji statistik terhadap Total Solid
1. Retentat
Jenis Membran (M) Waktu Pemekatan (W) Total
30’ 60’ 90’ 120’ 150’ 180’
NANOFILTRASI 18,5544 19,5647 20,0163 19,8684 19,3045 23,4750
18,3111 19,0731 18,7546 19,2600 20,0501 20,6831
Subtotal 36,8655 38,6378 38,7709 39,1284 39,3546 44,1581 236,9153
OSMOSA BALIK 21,9738 21,5670 20,2106 21,8767 22,0991 22,5754
17,8047 18,1672 18,1302 18,6955 18,9206 19,4337
Subtotal 39,7785 39,7342 38,3408 40,5722 41,0197 42,0091 241,4545
Total 76,6440 78,3720 77,1117 79,7006 80,3743 86,1672 478,3698
ANOVA
Sumber Variasi db JK KT F hitung F tabel
Faktor w 1 15,0191 15,0191 4,4667tn 4,75
faktor m 5 0,8585 0,1717 0,0511tn 3,11
interaksi wm 5 3,9785 0,7957 0,2366tn 3,11
galat 11 36,9874 3,3625
total 22 56,8435
Keterangan : * : berbeda nyata
tn
2. Permeat
Jenis Membran (M) Waktu Pemekatan (W) Total
30’ 60’ 90’ 120’ 150’ 180’
NANOFILTRASI 2,2637 2,2695 2,3475 2,2077 1,6665 1,7353
2,1554 1,5209 2,0373 1,7925 1,8409 0,8194
Subtotal 4,4191 3,7905 4,3848 4,0002 3,5074 2,5547 22,6567
OSMOSA BALIK 0,4000 0,4202 0,3521 0,7698 0,3289 0,6645
0,0000 0,0000 0,0000 0,3311 0,2907 0,3165
Subtotal 0,4000 0,4202 0,3521 1,1009 0,6196 0,9809 3,8738
Total 4,8191 4,2106 4,7369 5,1012 4,1271 3,5356 26,5305
ANOVA
Sumber Variasi db JK KT F hitung F tabel
Faktor w 1 0,4089 0,4089 3,6191tn 4,75
faktor m 5 14,7000 2,9400 26,0232* 3,11
interaksi wm 5 1,0492 0,2098 1,8574tn 3,11
galat 11 1,2427 0,1130
total 22 17,4008
Keterangan : * : berbeda nyata
tn
: tidak berbeda nyata
Uji Lanjut Duncan Pengaruh Faktor Jenis Membran terhadap Total Solid Permeat
Ssr 5% Lsr 5% Rata2 perlakuan Perlakuan Taraf Nyata 5%
1 2
- - m2 0,3228 - a
3,11 0,3018 m1 1,8881 1,5653* - b
Lampiran 9. Data Hasil Perhitungan Total Asam Tertitrasi
Jenis
membran
Waktu
Pemekatan
(menit)
Total Asam Tertitrasi (%)
Rejeksi (%) Retentat Permeat
1 2 Rata-rata 1 2 Rata-rata
Nano
filtrasi
30 1,32 1,26 1,29 1,21 1,13 1,17 9,62
60 1,28 1,29 1,29 1,20 1,13 1,16 9,40
90 1,35 1,31 1,33 1,38 1,13 1,26 5,53
120 1,34 1,30 1,32 1,22 1,15 1,18 10,47
150 1,36 1,32 1,34 1,34 1,16 1,25 6,33
180 1,36 1,30 1,33 1,28 1,13 1,20 9,31
Osmos
a Bali
k
30 1,43 1,49 1,46 0,28 0,31 0,30 79,70
60 1,47 1,52 1,49 0,31 0,34 0,33 78,05
90 1,51 1,58 1,54 0,33 0,43 0,38 75,50
120 1,54 1,58 1,56 0,39 0,38 0,38 75,49
150 1,54 1,61 1,58 0,48 0,37 0,43 72,98
Lampiran 10. Hasil Uji Statistik terhadap Total Asam Tertitrasi
1. Retentat
Jenis Membran (M) Waktu Pemekatan (W) Total
30’ 60’ 90’ 120’ 150’ 180’
NANOFILTRASI 1,3180 1,2815 1,3530 1,3410 1,3551 1,3553
1,2634 1,2896 1,3131 1,3042 1,3182 1,3016
Subtotal 2,5814 2,5711 2,6661 2,6452 2,6733 2,6569 15,7940
OSMOSA BALIK 1,4311 1,4693 1,5144 1,5387 1,5404 1,5377
1,4895 1,5182 1,5755 1,5829 1,6134 1,6352
Subtotal 2,9206 2,9875 3,0899 3,1216 3,1538 3,1729 18,4463
Total 5,5020 5,5586 5,7560 5,7668 5,8271 5,8298 34,2403
ANOVA
Sumber Variasi db JK KT F hitung F tabel
Faktor w 1 0,0249 0,0249 14,9719* 4,75
faktor m 5 0,2931 0,0586 35,2740* 3,11
interaksi wm 5 0,0049 0,0010 0,5926tn 3,11
galat 11 0,0183 0,0017
total 22 0,3412
Keterangan : * : berbeda nyata
tn
Uji Lanjut Duncan Faktor Waktu Pemekatan terhadap Total Asam Retentat
Ssr 5% Lsr 5% Rata2 perlakuan
Perlakuan Taraf
Nyata
5%
1 2 3 4 5 6
- - w1 1,3755 - a
3,11 0,0634 w2 1,3897 0,0122tn - ab
3,27 0,0667 w3 1,4390 0,0615tn 0,0493tn - ab
3,35 0,0683 w4 1,4417 0,0642tn 0,0520tn 0,0027tn - ab
3,39 0,0692 w5 1,4568 0,0793* 0,0671tn 0,0178tn 0,0151tn - b
3,43 0,0700 w6 1,4575 0,0800* 0,0678tn 0,0185tn 0,0158tn 0,0007tn - b
Keterangan : nilai taraf nyata yang ditandai dengan huruf yang berbeda menunjukan perbedaan nyata pada taraf 5% menurut uji Duncan
Uji Lanjut Duncan Faktor Jenis Membran terhadap Total Asam Retentat
Ssr 5% Lsr 5% Rata2 perlakuan Perlakuan Taraf Nyata 5%
1 2
- - m1 1,3162 - a
3,11 0,0366 m2 1,5372 0,2210* - b