ISOLASI, KARAKTERISASI, DAN PENAPISAN
SIANOBAKTERIA SEBAGAI PAKAN LARVA Aedes aegypti
Oleh:
Erna Ratna Puri
G 34101062
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ERNA RATNA PURI. Isolasi, Karakterisasi, dan Penapisan Sianobakteria Sebagai Pakan Larva
Aedes aegypti. Dibimbing oleh ARIS TRI WAHYUDI dan EDDY JUSUF.
Sianobakteria adalah organisme prokariot fotosintetik di perairan, beberapa diantaranya diketahui merupakan salah satu pakan larva nyamuk Aedes aegypti. Tujuan penelitian ini adalah untuk mengisolasi, mengkarakterisasi, dan menapis sianobakteria yang dapat digunakan sebagai pakan larva A. aegypti Dalam pelaksanaan kegiatan ini, dilakukan pengambilan sampel air di 20 lokasi perairan di sekitar kota Jakarta, Bekasi, Bogor dan Cianjur. Hasil isolasi secara mikroskopik diperoleh 9 jenis sianobakteria yang tergolong dalam 3 ordo yaitu Chroococcales, Oscillatoriales dan Nostocales. Hanya dua jenis yang dapat dimurnikan yaitu Chroococcus limneticus dan
Oscillatoria rubescens. Uji coba pertumbuhan pada berbagai media menunjukkan bahwa C. limneticus tumbuh baik pada media BG-11 menghasilkan kandungan protein ekstraseluler tertinggi sebesar 13.144 g/ml pada fase eksponensial dan kandungan protein intraseluler tertinggi sebesar 144.020 g/mg pada fase stasioner. Sedangkan O. rubescens tumbuh baik pada media C, namun protein yang terkandung lebih rendah daripada C.limneticus. Pemberian pakan terhadap larva dengan C. limneticus menunjukkan perkembangan larva terbaik yaitu selama 11 hari sesuai seperti perkembangan larva di alam.
ABSTRACT
ERNA RATNA PURI. Isolation, Characterization, and Screening of Cyanobacteria for feeding
Aedes aegypti larva. Supervised by ARIS TRI WAHYUDI and EDDY JUSUF.
ISOLASI, KARAKTERISASI, DAN PENAPISAN SIANOBAKTERIA
SEBAGAI PAKAN LARVA
Aedes aegypti
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
Erna Ratna Puri
G 34101062
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Isolasi, Karakterisasi, dan Penapisan Sianobakteria Sebagai
Pakan Larva Aedes aegypti
Nama
: Erna Ratna Puri
NRP
: G 34101062
Menyetujui :
Pembimbing I,
Pembimbing II,
Dr. Aris Tri Wahyudi, M. Si
Drs. Eddy Jusuf
NIP 131957319
NIP 320002219
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, MS
NIP 131473999
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia yang telah dilimpahkan sehingga karya ilmiah ini berhasil diselesaikan. Karya ilmiah ini berjudul Isolasi,
Karakterisasi, dan Penapisan Sianobakteria sebagai Pakan Larva Aedes aegypti, yang
dilaksanakan pada bulan April 2005 hingga Januari 2006 bertempat di Laboratorium Genetika dan Rekayasa Mikroba, Bidang Biologi Molekuler, Pusat Penelitian Bioteknologi-LIPI, Cibinong dan Laboratorium Entomologi, Fakultas Kedokteran Hewan IPB, Bogor.
Dalam penyusunan karya ilmiah ini penulis banyak memperoleh bantuan, dorongan dan arahan dari berbagai pihak. Oleh karena itu dalam kesempatan ini penulis ingin mengucapkan terima kasih kepada Dr. Aris Tri Wahyudi, M. Si dan Drs. Eddy Jusuf selaku pembimbing dalam penyusunan karya ilmiah ini. Terima kasih pula kepada Dr. drh. F. X. Koesharto selaku ketua Laboratorium Entomologi FKH-IPB dan Dr. drh. Dwi Jayanti Gunandini M. Si atas izin bekerja di insektarium, Laboratorium Entomologi. Di samping itu penulis juga mengucapkan terima kasih kepada Dra. Ni Wayan Sri Agustini, Keluarga Besar Puslit Bioteknologi-LIPI Cibinong, staf Laboratorium Entomologi FKH Institut Pertanian Bogor, dan Dra. Triadiati, M. Si yang telah memberikan saran.
Terima kasih pula penulis ucapkan untuk Eka Sri Handayani, Mba Neneng, Mas Ridwan, Empan, Rika, Henry, Kiki, Budi, Ruly, Made, Wiwit, teman-teman biologi 38 serta Keluarga Besar H-5 atas saran, bantuan dan dorongan semangat dalam penyelesaian laporan karya ilmiah ini. Tak lupa kepada Pak Djoni, Pak Eddi dan Mba Yeni yang selalu direpotkan. Ungkapan terima kasih terbesar untuk Mama, Bapak, Kakak, Adik serta Ilham Setiawan dan Ibu Yuli atas kasih sayang, dorongan semangat, pengertian serta doanya. Semoga Allah SWT membalas kebaikan Anda sekalian.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Mei 2006
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 18 Mei 1983 sebagai putri ketiga dari empat bersaudara, dari pasangan Slamet Triyono dan Suprapti.
Tahun 2001 penulis lulus dari SMU Negeri 37 Jakarta dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui Ujian Masuk Perguruan Tinggi Negeri (UMPTN). Penulis memilih Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA).
PENDAHULUAN
Aedes aegypti adalah jenis nyamuk yang dapat menularkan demam berdarah dengue (DBD) atau dengue hemorrhagic fever. Kasus di Indonesia pertama kali dilaporkan terjadi di Jakarta dan Surabaya pada tahun 1968 (Wuryadi 1994; Nadesul 1998). Di Jawa Barat angka kasus DBD pada bulan Januari-Februari 2005 mencapai 1.590 kasus, sedangkan di DKI Jakarta mencapai 1.379 kasus pada periode yang sama (Kompas 2005).
DBD disebabkan oleh virus dengue yang terdiri dari 4 serotipe yaitu DEN-1, DEN-2, DEN-3, DEN-4. Virus tersebut tergolong anggota virus RNA dari genus Flavivirus, famili Flaviviridae. Virus ini sangat patogen bagi manusia dan cepat menyebar melalui gigitan nyamuk A. aegypti dan A. albopictus
terutama di negara tropis (Soetjipto 2000). Selain manusia, virus dengue memerlukan kedua nyamuk tersebut sebagai tempat hidup dan berkembang biak serta berperan sebagai vektor penyakit.
A. aegypti termasuk ordo Diptera, famili Culicidae, subfamili Culicinae (Borror & White 1970). Memiliki ukuran badan yang lebih kecil daripada nyamuk rumah. Badan dan tungkainya berbintik belang-belang hitam putih (Nadesul 1998). Merupakan serangga yang mengalami metamorfosis sempurna dalam siklus hidupnya, yaitu telur-larva-pupa-dewasa.
Pemberantasan vektor selama ini dilakukan dengan pengasapan insektisida malation untuk memberantas nyamuk dewasa, dan abatisasi dengan temefos untuk membunuh larva. Hal ini tidak dapat dilakukan terus menerus karena mahalnya biaya, mencemari lingkungan serta dapat menimbulkan resistensi vektor terhadap insektisida.
Penggunaan pestisida hayati seperti bakteri
Bacillus thuringiensis dan B. sphaericus
cukup efektif menghambat perkembangan larva A. aegypti. Beberapa galur B. thuringiensis seperti israelensis, morrisoni,
kenyae, canadensis, entomocidus, thomsoni,
malaysiensis, jegathesan dan medelin
dilaporkan sangat efektif dan spesifik membunuh larva A. aegypti, A. stephensis dan
Culex pipiens (Delécluse et al. 1995). Larva nyamuk akan mati bila memakan spora dan protein kristal yang disintesis oleh bakteri. Protein kristal tersebut bersifat toksik spesifik, yaitu hanya membunuh larva serangga Lepidoptera, Coleoptera dan Diptera tanpa efek toksik pada organisme lain (Atlas &
Bartha 1998). Beberapa diantaranya telah dibuat formulasi produk yaitu berupa campuran biomassa spora dan protein kristal. Kendala yang dihadapi adalah biomassa spora dan protein kristal dari mikrob yang diaplikasikan tidak dapat bertahan lama di lapangan, serta menjauhi area pengambilan makanan larva nyamuk (Chungjatupornchai 1990).
Salah satu alternatif dalam usaha memberantas A. aegypti adalah dengan memanfaatkan jenis-jenis bakteri fotosintetik (sianobakteria). Melalui teknik rekayasa genetika, gen penyandi kristal protein (gen
cry) dari beberapa galur B. thuringiensis
ditransfer ke dalam sel sianobakteria sehingga informasi genetik biosintesis protein kristal dalam gen tersebut dapat diekspresikan (Chunjatupornchai 1990, Steven et al. 1994, Liu et al. 1996). Dengan demikian diperoleh sianobakteria rekombinan pembawa gen cry B. thuringiensis yang dapat hidup pada perairan jernih bersama larva A. aegypti. Sianobakteria rekombinan yang mampu mengekspresikan gen cry dapat berperan sebagai pakan yang bersifat letal bagi larva nyamuk.
Sianobakteria merupakan organisme prokariotik fotosintetik yang termasuk dalam bakteri Gram-negatif akuatik yang mempunyai kemampuan berfotosintesis dengan klorofil a dan fikobiliprotein sebagai pigmen utama (Waterbury 1991). Dikenal juga sebagai ganggang hijau biru yang dapat ditemukan pada berbagai lingkungan perairan dengan kisaran temperatur yang luas, selain itu dapat pula ditemukan di tanah dan bebatuan (Bold & Wynne 1985).
Beberapa jenis sianobakteria yang telah diujikan sebagai pakan larva A. aegypti
diantaranya adalah Agmenellum
quadruplicatum, Anabaena flos-aquae, A.
variabilis, Coccochloris elabans, Chlorogloea fritischii dan Nostoc muscorum (Steven et al.
1994). Synechocystis PCC6803
(Chungjatupornchai 1990) dan Asticcacaulis excentricus (Liu et al. 1996) telah direkayasa menjadi pestisida hayati rekombinan.
Untuk menuju ke arah rekayasa genetika sianobakteria, langkah awal yang harus dilakukan adalah mengisolasi berbagai jenis sianobakteria yang dapat hidup pada media sederhana seperti habitat larva nyamuk yang ada di lingkungan sekitar.
maupun genangan air yang dapat digunakan sebagai pakan larva A. aegypti.
Waktu dan Tempat
Penelitian ini dilakukan pada bulan April 2005 hingga Januari 2006 di Laboratorium Genetika dan Rekayasa Mikroba, Bidang Biologi Molekuler, Pusat Penelitian Bioteknologi-LIPI, Cibinong dan Laboratorium Entomologi, Fakultas Kedokteran Hewan IPB, Bogor.
BAHAN DAN METODE
Bahan
Bahan yang digunakan adalah sampel air dari danau, kolam dan genangan air, media pertumbuhan sianobakteria, yaitu BG-11, Allens, C, dan Provasoli (Lampiran 1), BSA,
Reagent Lowry dan Folin-Ciocalteu, serta telur A .aegypti F-43 galur Liverpool koleksi Laboratorium Entomologi FKH-IPB. Alat-alat yang digunakan adalah aerator, lampu, inkubator bergoyang (IKA Labortechnik KS 250 Basic), mikroskop (Nikon Japan 029659 Labophot 2), spektrofotometer (Spectronic 21D Milton Ray dan Shimadzu UV-Visible Recording Spectrophotometer UV 160), alat sentrifugasi (Heraeus Sepatech Biofuge 28RS dan Heraeus instruments Biofuge Fresco), vorteks (Fisons Whirlimixer), indikator universal dan rak pemeliharaan nyamuk.
Metode
Pengambilan Sampel
Bahan yang digunakan adalah sampel air danau, kolam maupun genangan air yang diambil pada beberapa wilayah di Jakarta, Bekasi, Bogor dan Cianjur. Sampel air diambil pada kedalaman 1-1.5 m dan ditampung dalam botol sampel steril. Pengukuran temperatur dan pH air dilakukan di tempat pengambilan sampel dengan menggunakan termometer dan indikator universal.
Isolasi dan Pemurnian Sianobakteria
Isolasi sianobakteria dilakukan dengan teknik pengkayaan pada media BG-11 cair dalam botol aerasi. Sampel diinkubasi selama 21 hari pada suhu 25°C (Kumazawa 2001). Selama inkubasi, sampel diberi paparan cahaya lampu floresen putih dengan interval waktu 14 jam terang dan 10 jam gelap (Waterbury 1991). Isolasi sianobakteria dilakukan berdasarkan perbedaan morfologi.
Pemurnian dilakukan dengan menggores pada media BG-11 padat dan dilakukan sampai diperoleh isolat murni.
Karakterisasi Sianobakteria
Isolat yang telah murni diujikan pada 4 media pertumbuhan (Lampiran 1) untuk mencari media yang sesuai bagi pertumbuhan optimal sianobakteria. Pengukuran pertumbuhan sianobakteria dilakukan melalui pengukuran optical density (OD) pada panjang gelombang 680 nm setiap hari untuk memperoleh kurva pertumbuhan isolat pada setiap media.
Berdasarkan fase pertumbuhannya, setiap isolat disentrifugasi dengan kecepatan 5000 rpm selama 15 menit pada suhu 4°C. Supernatan dan peletnya dipisahkan. Supernatan diukur volumenya dan diletakkan pada cawan petri kemudian dipekatkan dalam inkubator dengan suhu 45°C selama 2 hari. Volume setelah pemekatan dihitung kembali. Pelet digerus dengan N2 cair dan dilarutkan
dengan 500 µl buffer Na-asetat. Homogenat yang dihasilkan disentrifugasi dengan kecepatan 5000 rpm selama 10 menit pada suhu 4°C. Supernatan yang dihasilkan adalah protein intraseluler terlarut. Pelet yang dihasilkan ditambahkan buffer lisis kemudian divorteks dan dipanaskan selama 10 menit pada suhu 95°C, setelah itu disentrifugasi dengan kecepatan 12.000 rpm selama 10 menit pada suhu 4°C. Supernatan yang dihasilkan adalah protein intraseluler tidak terlarut. Masing-masing sampel protein yang dihasilkan, digunakan untuk analisis kuantitas protein menggunakan metode Lowry dengan standar Bovin Serum Albumin (BSA) dengan konsentrasi standar ( g/ml) 0, 10, 25, 50, 100, 200, dan 300 serta diukur pada panjang gelombang 550 nm.
Pengujian terhadap Telur Nyamuk
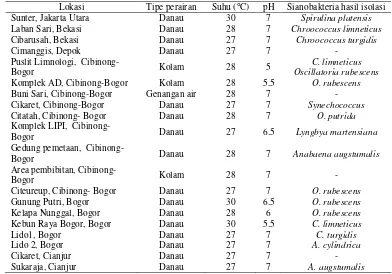
Lokasi Tipe perairan Suhu (°C) pH Sianobakteria hasil isolasi
Sunter, Jakarta Utara Danau 30 7 Spirulina platensis
Laban Sari, Bekasi Danau 28 7 Chroococcus limneticus
Cibarusah, Bekasi Danau 27 7 Chroococcus turgidis
Cimanggis, Depok Danau 27 7 -
Puslit Limnologi,
Cibinong-Bogor Kolam 28 5
C. limneticus Oscillatoria rubescens
Komplek AD, Cibinong-Bogor Kolam 28 5.5 O. rubescens
Buni Sari, Cibinong-Bogor Genangan air 28 7 -
Cikaret, Cibinong-Bogor Danau 27 7 Synechococcus
Citatah, Cibinong- Bogor Danau 28 7 O. putrida
Komplek LIPI, Cibinong-
Bogor Danau 27 6.5 Lyngbya martensiana
Gedung pemetaan, Cibinong-
Bogor Danau 28 7 Anabaena augstumalis
Area pembibitan, Cibinong-
Bogor Kolam 28 7 -
Citeureup, Cibinong- Bogor Danau 27 7 O. rubescens
Gunung Putri, Bogor Danau 30 6.5 O. rubescens
Kelapa Nunggal, Bogor Danau 28 6 O. rubescens
Kebun Raya Bogor, Bogor Danau 30 5.5 C. limneticus
Lido1, Bogor Danau 27 7 C. turgidis
Lido 2, Bogor Danau 27 7 A. cylindrica
Cikaret, Cianjur Danau 27 7 -
Sukaraja, Cianjur Danau 27 7 A. augstumalis
HASIL DAN PEMBAHASAN
Koleksi Sampel
Sampel air danau, kolam atau genangan air diambil pada 20 lokasi di sekitar kota Jakarta, Bekasi, Bogor dan Cianjur. Secara lengkap disajikan pada Tabel 1. Pengambilan sampel air dilakukan pada kedalaman 1-1,5 m. Hal ini berhubungan dengan keberadaan sianobakteria yang lebih banyak terdapat pada permukaan air saat penetrasi cahaya matahari memadai untuk proses metabolisme autotrofik dan produksi oksigen (Atlas & Bartha 1998).
Isolasi dan Pemurnian Sianobakteria
Sianobakteria dibedakan dalam 5 ordo, yaitu Chroococcales, Pleurocapsales, Oscillatoriales, Nostocales dan Stigonematales (Waterbury 1991). Dari 20
lokasi pengambilan sampel air diperoleh sembilan jenis sianobakteria. Sembilan jenis yang dihasilkan termasuk dalam 3 ordo, yaitu Chroococcales, Oscillatoriales dan Nostocales. Sianobakteria hasil isolasi disajikan pada Tabel 1.
Dari sembilan jenis tersebut, dipilih dua jenis yaitu Chroococcus limneticus (Gambar 1) dan Oscillatoria rubescens (Gambar 2) untuk diujikan sebagai pakan larva nyamuk A. aegypti. Kedua jenis tersebut dipilih karena merupakan jenis yang berhasil dimurnikan dan mempunyai penyebaran yang luas, yaitu dapat ditemukan di beberapa lokasi pengambilan sampel air.
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16 0.18
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Hari ke-A b so rb an
10 m 10 m
Gambar 1 Chroococcus limneticus perbesaran 500x.
C. limneticus termasuk dalam ordo Chroococcales, famili Chroococcaceae. Merupakan sianobakteria uniseluler berbentuk kokus tunggal atau kumpulan sel dengan ukuran 0.5-30 µm, bereproduksi dengan pembelahan biner atau tunas. O. rubescens
termasuk dalam ordo Oscillatoriales, famili Oscillatoriaceae, merupakan sianobakteria berfilamen yang pembelahan selnya terjadi secara biner dengan ukuran diameter sel bervariasi dari 0.5-100 µm.
Sianobakteria dapat ditemukan pada lingkungan dengan kisaran temperatur yang berbeda. Suhu air sampel semua lokasi berkisar dari 27-30˚C. C. limneticus diperoleh dari air kolam serta danau pada wilayah Bekasi dan Bogor yang memiliki suhu 28 dan 30˚C. Sedangkan O. rubescens diperoleh dari sampel air kolam dan danau pada wilayah Bogor yang bersuhu 27-30˚C. Kedua jenis sianobakteria tersebut diperoleh pada kisaran suhu untuk pertumbuhan optimal, yaitu antara 20 dan 35 ˚C (Waterbury 1991).
Pada lingkungan air tawar dengan tingkat keasaman yang berbeda terdapat berbagai jenis sianobakteria (Waterbury 1991). Air sampel yang digunakan memiliki kisaran asam sampai netral. C. limneticus dan O. rubescens diperoleh dari sampel air beberapa kolam dan danau dengan pH 5-7.
Karakterisasi Sianobakteria
Pertumbuhan kultur alga biasanya diekspresikan dengan pertumbuhan biomassa, jumlah sel, kandungan protein dan pigmen (Becker 1994). Pengukuran pertumbuhan sianobakteria terpilih, dilakukan dengan menggunakan metode pengukuran kekeruhan atau Optical Density (OD) pada panjang gelombang 680 nm.
Pertumbuhan C. limneticus dan O. rubescens diujikan pada empat media pertumbuhan. Kedua sianobakteria tersebut menunjukkan pertumbuhan yang berbeda
Gambar 2 Oscillatoria rubescens perbesaran 500x.
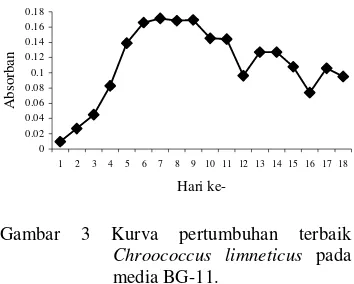
pada media yang berbeda. Pertumbuhan terbaik C. limneticus terjadi pada media BG-11 (Gambar 3). Media ini merupakan media yang telah banyak digunakan untuk isolasi dan pemeliharaan banyak sianobakteria (Waterbury 1991). Oleh karena itu media BG-11 juga digunakan pada saat isolasi dan pengkayaan sianobakteria dari sampel air.
Gambar 3 Kurva pertumbuhan terbaik Chroococcus limneticus pada media BG-11.
Namun demikian O. rubescens kurang menunjukkan pertumbuhan yang baik pada media tersebut. O. rubescens menunjukkan pertumbuhan terbaik pada media C (Gambar 4). Perbedaan ini kemungkinan terjadi karena ada perbedaan komponen yang terkandung di dalam media.
Gambar 4 Kurva pertumbuhan terbaik Oscillatoria rubescens pada media C. 0 0.15 0.3 0.45 0.6
Pada media BG-11 dan C terdapat bahan mineral yang sama, yaitu K2HPO4 dan
MgSO4. Unsur fosfor merupakan nutrisi yang
dibutuhkan dalam pertumbuhan normal seluruh alga, sedangkan unsur magnesium merupakan bagian pada perangkat fotosintesis yaitu sebagai atom pusat molekul klorofil (Becker 1994).
Pada media C yang memberi pertumbuhan terbaik bagi O. rubescens terdapat unsur nitrogen dalam bentuk NO3. Pengaruh dari
perbedaan kandungan nitrogen terhadap pertumbuhan telah dipelajari pada empat sianobakteria yaitu Spirulina platensis,
Anacystis nidulans, Microcyctis aeruginosa
dan Oscillatoria rubescens. Becker(1994) menyatakan bahwa dengan peningkatan kandungan nitrogen akan meningkatkan biomassa serta kandungan protein dan klorofil Pada pertumbuhan selain terdapat perubahan pada populasi total, juga terjadi pertambahan komponen selular seperti RNA, DNA dan protein. Untuk mengetahui kandungan protein keduanya, digunakan metode analisis protein Lowry. Tabel 2 menyajikan hasil analisis kandungan protein kedua sianobakteria.
Tabel 2 Kandungan protein sianobakteria terpilih
Protein
Intraseluler ( g/mg) Fase Ekstraseluler
( g/ml)
TL L
Chroococcus limneticus
Eksponensial
(hari ke-5) 13.144 58.700 43.748 Stasioner
(hari ke-9) 5.205 104.287 39.733
Oscillatoria rubescens
Eksponensial
(hari ke-12) 1.006 3.207 1.324
Stasioner
(hari ke-15) 1.673 3.423 1.303
TL : Protein tidak larut L : Protein terlarut
Kandungan protein intraseluler kedua jenis sianobakteria lebih tinggi daripada protein ekstraseluler. C. limneticus memiliki kandungan protein yang lebih tinggi daripada
O. rubescens. Fase eksponensial, yang diukur pada hari ke-5, kandungan protein ekstraseluler C. limneticus lebih besar daripada saat fase stasioner yaitu sebesar 13.144 g/ml. Namun kandungan protein intraselulernya lebih besar diperoleh saat fase stasioner, yang diukur pada hari ke-9, yaitu
sebesar 144.020 g/mg. Kandungan protein tinggi inilah yang kemungkinan digunakan sebagai sumber pakan oleh larva dalam perkembangannya menjadi pupa.
Kandungan protein O. rubescens pada fase stasioner yang diukur pada hari ke-15, lebih tinggi daripada fase eksponensial yang diukur pada hari ke-12, baik pada protein ekstraseluler maupun intraseluler. Namun bila dibandingkan dengan C. limneticus, kandungan protein O. rubescens lebih rendah. Pada pemberian pakan berupa O. rubescens, walaupun larva memakan sianobakteria ini namun karena protein yang terkandung lebih rendah maka waktu yang diperlukan bagi larva untuk berkembang juga lebih lama.
Pengujian Terhadap Larva Aedes aegypti
Pengujian terhadap larva meliputi kemampuan sianobakteria pilihan dalam perkembangan larva sampai menjadi dewasa. Perkembangan larva terutama dipengaruhi oleh suhu dan makanan di dalam tempat perindukan (Sungkar & Ismid 1994). Pengamatan dilakukan terhadap waktu yang diperlukan oleh larva untuk menjadi dewasa dengan pemberian jenis pakan yang berbeda. Tabel 3 menunjukkan masa perkembangan larva.
Tabel 3 Masa perkembangan larva
T : Telur L : Larva P : Pupa
* : Masa perkembangan larva lebih dari 25 hari
Larva yang tidak diberi pakan (kontrol 1) menunjukkan masa perkembangan lebih dari 25 hari atau melebihi masa perkembangan larva secara alamiah. Setelah telur menetas menjadi larva instar 1 dalam waktu 1-2 hari, selanjutnya akan berkembang menjadi larva instar 2, 3, dan 4 selama 10-12 hari (Service 1986).
Larva yang diberi pakan berupa hati ayam (kontrol 2) menunjukkan masa perkembangan larva selama 5 hari dan masa perkembangan pupa selama 2 hari. Perkembangan larva yang lebih cepat disebabkan karena kebutuhan nutrisi larva sangat terpenuhi dari hati ayam yang dikondisikan di laboratorium.
Perkembangan (hari) Jenis Pakan
T L P
OD 0.01 0.05 0.1 0.5
Kontrol 1 2 *
Kontrol 2 2 5 2
C. limneticus 2 * * 20 11 3
Masa perkembangan larva yang diberi pakan berupa sianobakteria menunjukkan hasil yang berbeda. Larva berkembang masing-masing selama 11 dan 20 hari pada pemberian pakan berupa C. limneticus 0.5 dan 0.1. Sedangkan dengan pemberian O. rubescens 0.5 menunjukkan masa perkembangan larva selama 13 hari dan masa perkembangan melebihi 25 hari pada O. rubescens 0.1. Begitu pula dengan pemberian C. limneticus
dan O. rubescens 0.01 dan 0.05 masa perkembangan melebihi 25 hari sampai dengan menjadi larva instar 2 dan 3. Namun demikian, dapat dikatakan bahwa kedua sianobakteria tersebut dapat membantu perkembangan larva walaupun waktu yang dibutuhkan lebih lama. Sebagai organisme fotosintetik, sianobakteria berperan sebagai salah satu produsen primer pada wilayah perairan. Di alam makanan larva adalah mikroorganisme yang terdapat pada habitatnya seperti alga, protozoa, bakteri, spora jamur (Sungkar & Ismid 1994) atau bahan-bahan kecil lainnya yang berukuran 20-100 m (Putra 1995).
Perkembangan pupa menunjukkan masa yang sama untuk kedua jenis sianobakteria yaitu 3 hari. Pupa merupakan stadia terakhir berada dalam air, namun pupa tidak makan pada saat ini. Masa perkembangan pupa 2-4 hari untuk menjadi nyamuk dewasa yang siap menggigit (Service 1986).
SIMPULAN
Sembilan jenis dari tiga ordo telah diisolasi dari air kolam, danau maupun genangan air. Dua jenis yang berhasil dimurnikan serta digunakan untuk uji terhadap larva adalah C. limneticus dan O. rubescens.
C. limneticus merupakan jenis sianobakteria yang direkomendasikan untuk digunakan sebagai pakan larva A. aegypti karena dapat membantu perkembangan larva selama 11 hari sesuai dengan perkembangan larva di alam.
DAFTAR PUSTAKA
Atlas RM, Bartha R. 1998. Microbial Ecology: Fundamentals and Application. Ed ke-4. California: Benjamin/Cummings Publishing.
Becker EW. 1994. Microalgae: Biotechnology and Microbiology. Cambridge University Press.
Bold HC, Wynne MJ. 1985. Introduction to the Algae, Structure and Reproduction. New Jersey: Prentice Hall.
Borror DJ, White RE. 1970. A Field Guide to Insects America North of Mexico. New York: Houghton Mifflin.
Chungjatupornchai W. 1990. Expression of the mosquitocidal-protein genes of
Bacillus thuringiensis subsp. israelensis
and the herbicide-resistance gene bar in
Synechocyctis PCC6803. Current Microbiol 21: 283-288.
Delécluse A, Rosso ML, Ragni A. 1995. Cloning and expression of novel toxin gen from Bacillus thuringiensis subs.
jagethesan encoding a highly mosquitocidal protein. Appl Environ Microbiol 61: 4230-4235.
Kompas. 5 Feb 2005. Jawa Barat KLB: makin banyak korban terkena DBD. Kompas: 11 (1-4).
Kumuzawa S, Yumura S, Yoshisuji H. 2001. Photoautotrophic growth of a recently isolated N2 fixing marine
non-heterocystous filamentous
cyanobacterium, Symploca sp. J Phycol
37: 482-487.
Liu JW, WH Yap, T Thanabalu, AG Porter. 1996. Efficient synthesis of mosquitocidal tixin in Asticcacaulis excentrus
demonstrates potential of Gram-negative bacteria in mosquito control. Nature Biotechnol 14: 343-347.
Nadesul H. 1998. Demam Berdarah. Jakarta: Puspa Swara.
Putra SE. 1995. Nyamuk Aedes aegypti: Bahaya dan Pengendaliannya. Padang: Universitas Andalas.
Service MW. 1986. Blood-sucking Insects: Vectors of Disease. Liverpool: Edward Arnold.
Indonsia Sebagai Bahan Vaksin Sub Unit. [terhubung berkala]. [15 Mar 2005].
Stevens SE, RC Murphy, WJ Lamoreaux, LB Coon. 1994. A genetically engineered mosquitocidal cyanobacterium. J Appl Phycol 6: 187-197.
Sungkar S, Ismid IS. 1994. Bionomik Aedes aegypti, vektor utama demam berdarah.
Medika 7: 64-69.
Waterbury JB. 1991. The Cyanobacteria-Isolation, Purification and Identification. Di dalam: Balows A, Trüper HG, Dworkin M, Harder W, Schleifer KH, editor. 1991.
The Procaryotes. A Handbook on the Biology of Bacteria:Ecophysiology, Isolation, Identification, Applications. Ed ke-2. Volume 2. New York: Springer-Verlag.
Lampiran 1 Daftar media pertumbuhan sianobakteria yang digunakan.
Media (g/l)
No Nama Bahan
BG-11 Allens C Provasoli
1. NaNO3 1.5 1.5 0.02
2. KNO3 1
3. K2HPO4.3H2O 0.04 0.04 1
4. MgSO4.7H2O 0.075 0.075 0.25
5. Ca(NO3)2. 4H2O 0.025
6. Citric Acid 0.006 0.006
7. Ferric citrate 0.006
8. Ferric ammonium citrate 0.006
9. Na-Citrate.2H2O 0.165
10. Fe2(SO4)3.6H2O 0.004
11. EDTA 0.001 0.001 0.05
12. Na2CO3 0.02 0.02
13. Microelement A5 1 ml
14. Microelement A6 1 ml 1 ml
15. CaCl2.2H2O 0.036 0.036 0.048
16. KH2PO4 0.014
17. KCl 0.01
18. FeCl3 0.0034
19. ZnCl2 0.208
20. MnCl2 0.072
21. (NH4)6Mo7O24 0.0013
22. CoCl2 0.0013
23. CuSO4 0.0015
24. Na-Glutamat 1
25. Na-Acetat 0.4
Microelement A5 : 2.86 g H3BO3, 1.81 MnCl2.4H2O, 0.222 ZnSO4.7H2O, 0.391 Na2MoO4.2H2O
dan 0.079 CuSO4.5H2O.