ANALISIS KERAGAMAN BAKTERI ASAM LAKTAT DARI
SALURAN PENCERNAAN AYAM CEMANI BERDASARKAN
GEN 16S rRNA DAN POTENSI PENGGUNAANNYA
SEBAGAI PROBIOTIK
SITI NUR JANNAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Analisis Keragaman Bakteri Asam Laktat dari Saluran Pencernaan Ayam Cemani Berdasarkan Gen 16S rRNA dan Potensi Penggunaannya Sebagai Probiotik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
Siti Nur Jannah
ACHMAD DINOTO dan KOMANG G. WIRYAWAN.
Di Indonesia terdapat 31 rumpun ayam lokal dengan karakteristik yang berbeda antara satu jenis dengan jenis lainnya. Salah satu jenisnya adalah ayam Cemani, yang mempunyai karakteristik unik dengan warna hitam diseluruh tubuhnya dan ketahanannya terhadap penyakit. Tujuan penelitian ini adalah untuk mendapatkan informasi awal tentang komunitas bakteri asam laktat sebagai penyusun dari mikrobiota saluran pencernaan ayam Cemani dan mendapatkan isolat bakteri asam laktat sebagai probiotik pada ayam.
Analisa keragaman bakteri dengan menggunakan metode T-RFLP dilakukan dengan isolasi DNA genom langsung dari sampel lumen saluran pencernaan ayam (tembolok, ventrikulus, ileum dan sekum), primer yang digunakan adalah primer forward 27F dilabel dengan 6-carboxyfluorescein dan primer reverse spesifik untuk bakteri asam laktat SG-Lab-0677, enzim restriksi yang digunakan HaeIII dan MspI. Selanjutnya ditentukan jumlah filotipe, kelimpahannya (indeks Shannon Wiener) dan indeks kesamaan komunitas (indeks Sorensen). Analisa plate counts dilakukan untuk memperoleh nilai total bakteri asam laktat dan juga untuk memperoleh isolat kandidat probiotik, dengan cara ditumbuhkan pada cawan petri yang berisi media padat MRS dan GYP yang ditambahkan dengan 0.5% CaCO3, diinkubasi secara anaerobik selama 48 jam
pada suhu 37°C. Isolat kandidat probiotik diuji aktivitasnya meliputi uji aktivitas antimikroba terhadap bakteri indikator, uji toleransi terhadap pH dan garam empedu, uji hidrofobisitas pada permukaan sel, uji koagregasi, uji aktivitas enzimatik dan uji sensitivitas terhadap antibiotik. Identifikasi secara molekuler dan fisologis dengan fermentasi gula. Galur probiotik (L. Salivarius) yang diperoleh dienkapsulasi denngan 5% susu skim dan dilakukan pengawetan dengan metode kering beku. Selanjutnya dilakukan aplikasi L. salivarius sebagai probiotik dalam ransum terhadap penampilan dan kesehatan ayam serta komunitas mikrobiota ayam broiler.
jumlah tertingginya ditemukan di bagian tembolok. Dari uji kandidat probiotik didapatkan isolat CSP004, CCM011 dan CVM002 mempunyai aktivitas antimikroba terhadap bakteri patogen, tahan terhadap pH2 dan 0.1% garam empedu, mempunyai hidrofobisitas yang kuat pada permukaan sel dan mucus, mempunyai enzim phytase dan protease, tetapi tidak mempunyai enzim amilase dan lipase, mempunyai koagregasi dengan bakteri asam laktat lainnya tetapi lemah koagregasinya dengan bakteri patogen, dan kesemua isolat tidak ada yang resisten terhadap antibiotik. Ketiga isolat probiotik teridentifikasi sebagai
Lactobacillus salivarius, tetapi dengan menggunakan kit API 50CHL, ketiganya memperlihatkan perbedaan pola dalam fermentasi gula. Penambahan probiotik belum memperbaiki penampilan ayam broiler yang meliputi bobot badan akhir, konsumsi pakan, FCR, persentase karkas, profil darah dan persentase organ limpatik, akan tetapi dengan penambahan probiotik dengan galur tunggal maupun campuran dapat meningkatkan pertambahan bobot badan ayam pada minggu pertama kehidupan ayam. Dari analisa T-RFLP penambahan probiotik galur tunggal terbukti dapat memperbaiki mikrobiota saluran pencernaan broiler pada akhir minggu.
Potential Use as Probiotics. Supervised by IMAN RUSMANA, ACHMAD DINOTO dan KOMANG G. WIRYAWAN.
There are thirty one of native chickens in Indonesia with various genotipic and phenotipic characteristics. Cemani chicken is one of Indonesian native chicken showing unique morphological appearances with black colour concerns the whole body and their resistance to disease. The aims of this study were to obtain preliminary information about the microbial community of lactic acid bacteria (LAB) in the gastrointestinal tract of Cemani chicken and to get candidate probiotics for chickens.
LAB diversity analysis using T-RFLP method performed by isolation of genomic DNA from lumen samples (crop, ventriculus, ileum and cecum) directly. Primers used were 27F forward primer that labeled with 6-carboxyfluorescein and a specific reverse primer for lactic acid bacteria, SG-Lab-0677. PCR products were cutted with HaeIII and MspI restriction enzyme. The lengths of the T-RFs were determined by comparison with size standards using the Peak ScannerTM software. Biodiversity value is determined based on the number of phylotypes, their abundance (Shannon Wiener index) and pairwise similarity index (Sorensen’s index). Analysis of plate counts in petri dishes containing MRS and GYP media conducted to obtain the total number of LAB and probiotic candidates. The probiotic candidates were screened for their probiotic properties. Probiotic strains encapsulated with 5% skim milk by freeze-drying preservation method. Furthermore, the application of probiotics strain (L. salivarius) in the diet on performance, healthy of chickens and microbiota community were conducted.
feed intake, FCR, carcass percentage, profile of the blood and lymphatic organs percentage, but in the first week experiment indicated that chickens fed with probiotics supplemented feed (single or mix cultures of LAB) have higher body weight gain than the control or antibiotic dietary treatments. The supplemented feed with the single-strain probiotic can improved gastrointestinal tract microbiota in the last week treatment.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ANALISIS KERAGAMAN BAKTERI ASAM LAKTAT DARI
SALURAN PENCERNAAN AYAM CEMANI BERDASARKAN
GEN 16S rRNA DAN POTENSI PENGGUNAANNYA
SEBAGAI PROBIOTIK
SITI NUR JANNAH
Disertasi ini
sebagai salah satu syarat untuk memperoleh gelar
Doktor
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Prof Dr Ir Lilis Nuraida, MSc Dr Ir Rita Mutia, MAgr Penguji pada Ujian Terbuka : Dr Ir Yantyati Widyastuti
Judul Disertasi
Nama NIM
:
: :
Analisis Keragaman Bakteri Asam Laktat dari Saluran Pencernaan Ayam Cemani Berdasarkan Gen 16S rRNA dan Potensi Penggunaannya sebagai Probiotik
Siti Nur Jannah G361090011
Disetujui oleh Komisi Pembimbing
Dr Ir Iman Rusmana, MSi Ketua
Dr Achmad Dinoto, MSc Prof Dr Ir Komang G. Wiryawan Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Mikrobiologi
Bismillaahirrahmaanirrahiim
Puji dan syukur penulis panjatkan kehadirat Allah Subhanahu wa Ta’ala
atas segala limpahan rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Disertasi ini ditulis berdasarkan hasil penelitian yang berjudul Analisis Keragaman Bakteri Asam Laktat dari Saluran Pencernaan Ayam Cemani Berdasarkan Gen 16S rRNA dan Potensi Penggunaannya sebagai Probiotik yang dilaksanakan sejak bulan September 2011 hingga Nopember 2013.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak Dr Ir Iman Rusmana, MSi, Dr Achmad Dinoto, MSc dan Prof Dr Ir Komang G. Wiryawan selaku komisi pembimbing yang selalu memberi masukan, motivasi dan semangat kepada penulis sehingga karya ilmiah ini bisa diselesaikan. Ucapan terima kasih juga penulis sampaikan kepada ibu Prof Dr Ir Lilis Nuraida, MSc dan ibu Dr Ir Rita Mutia, MAgr sebagai penguji luar komisi pada ujian tertutup dan kepada Ibu Dr Ir Yantyati Widyastuti dan ibu Dr Ir Sumiati, MSc pada ujian terbuka yang telah memberi masukan dan saran untuk penulisan disertasi ini lebih baik.
Ucapan terima kasih penulis sampaikan berturut-turut kepada Direktorat Pendidikan Tinggi yang telah memberikan dana pendidikan, Rektor Universitas Diponegoro yang telah mengijinkan penulis untuk tugas belajar, Ketua Program Studi dan para dosen Pascasarjana Program Studi Mikrobiologi IPB, seluruh staf peneliti dan teknisi bidang di Lab Mikrobiologi Terapan, Lab Genetika Mikroba, dan Lab Biokimia Mikroba, bidang Mikrobiologi, Puslit Biologi LIPI, dan Teknisi di Lab ilmu nutrisi unggas (ibu Lanjarsih dan pak Arif Darmawan) dan para pekerja di Kandang C yang telah banyak membantu dalam penelitian ini.
Akhirnya sujud sungkem terima kasih penulis haturkan kepada suami tercinta Ir Teguh Suroso, MSi atas doa dan ijinnya dan terima kasih atas doa yang ikhlas dan pendidikan yang diberikan dari Ibunda Asfariyah Faqih dan Ayahanda Drs Moh. Thoha (Alm) dan terima kasih atas doa dari ananda tersayang (Hilmi, Syauqi dan Faruq). Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2014
DAFTAR ISI
Halaman
DAFTAR TABEL ...vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
Kerangka Pemikiran ... 3
Kebaruan ... 4
Hipotesis Penelitian ... 4
Kerangka Penelitian ... 5
TINJAUAN PUSTAKA ... 11
Ayam Cemani ... 11
Ayam Broiler ... 11
Saluran Pencernaan Ayam ... 12
Mikrobiota Saluran Pencernaan Ayam ... 13
Fingerprinting Komunitas ... 14
Probiotik untuk Ayam ... 16
Bakteri Asam Laktat ... 17
METODE ... 19
Waktu dan Tempat Penelitian ... 19
Tahapan Penelitian ... 19
Tahap IV. Efikasi L. salivarius sebagai Probiotik dalam Pakan terhadap Penampilan dan Kesehatan Ayam serta Komunitas
Mikrobiota Ras Pedaging/ Broiler ... 27
HASIL DAN PEMBAHASAN ... 33
Tahap I : Analisis Keragaman BAL dari Saluran Pencernaan Ayam Cemani dengan Menggunakan Metode T-RFLP ... 33
Tahap II : Populasi BAL yang dapat Dikulturkan dari Saluran Pencernaan Ayam Cemani dan Uji Potensi Probiotik... 42
Tahap III : Enkapsulasi Bakteri L. salivarius sebagai Probiotik dengan Teknik Kering Beku / Freeze-drying ... 54
Tahap IV : Aplikasi L. salivarius sebagai Probiotik terhadap Penampilan, kesehatan dan Mikrobiota Saluran Pencernaan Ayam Broiler ... 56
SIMPULAN DAN SARAN Simpulan ... 73
Saran ... 74
DAFTAR PUSTAKA ... 75
LAMPIRAN ... 83
DAFTAR TABEL
Halaman 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20Susunan pakan perlakuan dalam penelitian pada ayam broiler selama pemeliharaan 5 minggu
Kandungan nutrisi pakan perlakuan
Identifikasi filotipe berdasarkan pada database MiCA3 secara
online
Indeks kesamaan pasangan Sorensen (Cs) komunitas BAL dalam saluran pencernaan ayam Cemani
Total bakteri asam laktat yang dapat dikulturkan dan pH dari saluran pencernaan ayam Cemani
Jumlah bakteri asam laktat yang mempunyai aktivitas
antimikroba terhadap E. coli dan S. enteritidis menggunakan uji difusi agar
Aktivitas penghambatan supernatan bebas sel isolat BAL terpilih terhadap E.coli and S. enteritidis
Ketahanan hidup isolat BAL terpilih dengan adanya faktor penghambat
Aktivitas enzimatik isolat bakteri asam laktat kandidat probiotik Diameter zona hambat kerentanan isolat BAL terpilih terhadap berbagai jenis antibiotik (Rerata ± SE) dan status kerentanannya Hasil identifikasi isolat menggunakan API 50 CHL dan sekuen 16S rDNA dari isolat CCM011, CSP004 dan CVM002
Pola fermentasi gula isolat bakteri asam laktat (LAB) menggunakan Kit API 50 CHL
Waktu generasi dan laju pertumbuhan spesifik isolat bakteri asam laktat yang ditumbuhkam pada medium MRS cair pada suhu 36OC selama 36 jam
Viabilitas Lactobacillus salivarius sebelum dan setelah proses
freeze-drying
Pengaruh pemberian pakan probiotik terhadap performa ayam broiler selama 35 hari pemeliharaan (n=50)
Profil darah ayam yang diberi perlakuan probiotik (n=5) Persentase bobot bursa fabrisius dan timus ayam broiler umur 5 minggu (n=5)
Kadar kolesterol serum darah ayam yang diberi perlakuan (n= 5) Energi metabolis semu pakan perlakuan (n=5)
Indeks keragaman Shannon Wiener (H’) dari komunitas bakteri
dalam saluran pencernaan ayam broiler
DAFTAR GAMBAR
Halaman 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18Struktur saluran pencernaan ayam
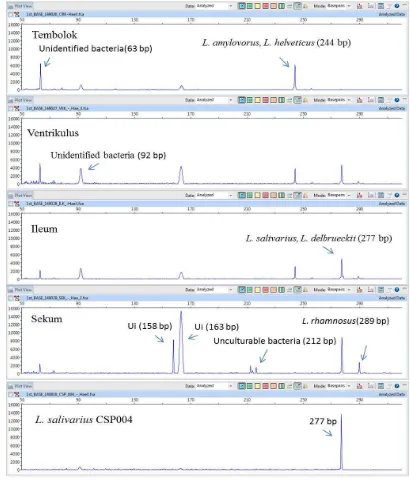
Produk amplifikasi gen 16S rRNA dari saluran pencernaan ayam Cemani menggunakan primer 27F-FAM dan S-G-Lab 0677R Profil T-RF BAL dalam saluran pencernaan ayam Cemani yang teridentifikasi berdasar database MiCA3 dan isolat kandidat probiotik L. salivarius CSP004
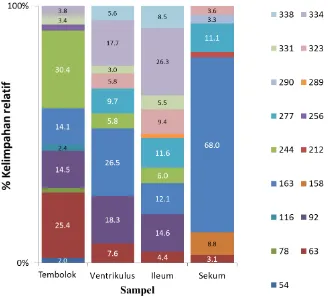
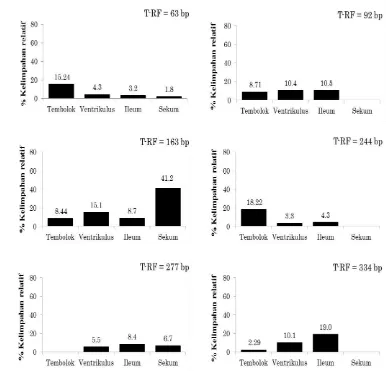
Distribusi kelimpahan relatif masing-masing filotipe BAL yang terdapat pada setiap relung saluran pencernaaan ayam Cemani. Persentase kelimpahan relatif T-RF yang signifikan dari filotipe BAL dalam sekum ayam Cemani.
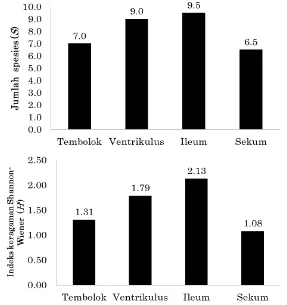
Jumlah filotipe/ spesies dan indeks keragaman Shannon
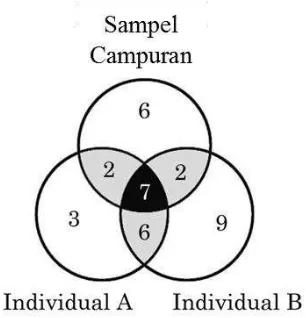
Wiener komunitas BAL pada saluran pencernaan ayam Cemani. Jumlah total T-RF yang mewakili filotipe BAL dalam
saluran pencernaan secara individual dan komposit dari 7 ayam Cemani
Morfologi sel isolat probiotik CCM011, CSP004, dan CVM002 dengan menggunakan mikroskop cahaya
Kemampuan koagregasi antar isolat BAL terpilih (n=3).
Kemampuan koagregasi isolat BAL (n=3) dan bakteri indikator (E. coli and S.enteritidis)
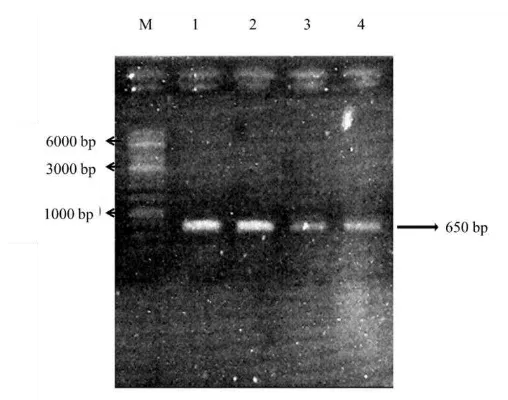
Gell agarosa yang menunjukkan pita potongan dari gen penyandi 16S rRNA hasil amplifikasi PCR
Pohon filogeni yang dihasilkan dari analisa fulllength sekuen 16S rDNA isolat BAL dengan menunjukkan posisi L. salivarius CCM011, CSP004 dan CVM002 diantara sejumlah lactobacilli Kurva Pertumbuhan L. salivarius CSP004, CCM011 dan CVM002 dalam media MRS cair selama 36 jam.
Pertambahan bobot badan mingguan broiler yang diberi perlakuan pakan berbeda
Perbedaan pertambahan bobot badan ayam pada minggu pertama dengan minggu ke lima.
Pengaruh pakan probiotik terhadap populasi koliform dan bakteri asam laktat dalam ileum
Pengaruh pakan probiotik terhadap populasi koliform dan bakteri asam laktat dalam sekum
Profil komunitas bakteri asam laktat yang didapatkan dari sekum ayam broiler yang diberi perlakuan penambahan
19
probiotik (n=5)
Profil komunitas mikrobiota sekum ayam broiler yang diberi perlakuan penambahan probiotik (n=5)
69
70
DAFTAR LAMPIRAN
Halaman
1 Dinamika jumlah dan kelimpahan relatif BAL pada saluran pencernaan ayam Cemani (dengan menggunakan enzim
restriksi Hae III 83
2 Dinamika jumlah dan kelimpahan relatif BAL pada saluran pencernaan ayam Cemani (dengan menggunakan enzim
restriksi MspI 84
3
4
Karakterisasi isolat BAL dari saluran pencernaan ayam Cemani dengan pada media MRSA dan GYPA.
Rerata suhu dan kelembaban udara mingguan di lingkungan kandang ayam
85
PENDAHULUAN
Latar BelakangProduk peternakan unggas, terutama ayam ras pedaging / broiler sangat populer di masyarakat. Broiler dan produknya selain merupakan pangan yang bergizi tinggi, juga harganya lebih murah dibandingkan produk daging lainnya. Produksi broiler di Indonesia mengalami peningkatan tiap tahun seiring dengan peningkatan jumlah penduduk. Pada tahun 2008 produksi broiler di Indonesia sebesar 902 052 000 ekor, dan meningkat 50% pada tahun 2013 menjadi 1 355 288 000 ekor (Ditjennak, 2013). Broiler menyumbang produk peternakan terbesar, sekitar 73.11% dari seluruh populasi ternak unggas (1 853 762 000 ekor) di Indonesia pada tahun 2013. Meningkatnya produk peternakan tersebut menyebabkan peningkatan penggunaan obat-obatan, terutama antibiotik untuk pencegahan terhadap penyakit pada ayam.
Penggunaan antibiotik sebagai faktor pertumbuhan atau Antibiotic Growth Promoters (AGPs), diberikan melalui pakan dalam jumlah sedikit atau tingkat sub-terapeutik dan dalam jangka yang lama. Namun penggunaan AGPs dapat mengganggu kesehatan manusia sebagai konsumennya, karena adanya residu antibiotik dalam bahan pangan dan munculnya galur bakteri zoonotik yang resisten terhadap antibiotik. Hal ini bersifat merugikan karena menurunkan efektivitas terapi antibiotik yang digunakan dalam pengobatan berbagai infeksi pada manusia sebagai konsumennya (Dahiya et al. 2006). Sejak 1 Januari 2006 Uni Eropa melarang penggunaan antibiotik sebagai faktor pertumbuhan pada produk peternakan. Konsekuensi utama pelarangan penggunaan AGPs antara lain meningkatnya biaya pakan sekitar 3% dalam produksi ayam sebagai akibat dari konversi pakan yang kurang menguntungkan dan meningkatnya penyakit
necrotic enteritis pada unggas.
Untuk meningkatkan produksi ayam dan tetap menyediakan produk peternakan yang aman untuk dikonsumsi, perlu diusahakan alternatif penggunaan antibiotik atau obat-obatan dalam industri peternakan. Salah satu cara dengan penggunaan imbuhan pakan berupa probiotik yang berperan menjaga keseimbangan mikrobiota usus, meningkatkan mekanisme pertahanan alami inang sehingga berpengaruh baik terhadap performa dan kesehatan ayam. Probiotik merupakan mikoorganisme hidup yang diberikan dalam jumlah yang cukup yang memberikan efek menguntungkan terhadap kesehatan inang (FAO/WHO 2002). Efek menguntungkan itu antara lain menjaga homeostasis mikrobiota usus, menstabilkan fungsi penghalang saluran gastrointestinal (Salminen et al. 1996), ekspresi bakteriosin, aktivitas enzimatik yang menginduksi absorpsi dan nutrisi (Hooper 2000), efek imunomodulasi, penghambatan enzim prokarsinogenik dan mencegah kemampuan patogen untuk mengkolonisasi pada mukosa (Gill 2003).
secara luas digunakan sebagai kultur starter dalam fermentasi makanan, produk susu dan pakan. Selain itu, BAL telah dikenal berperan penting bagi kesehatan manusia dan hewan. BAL digunakan sebagai probiotik untuk meningkatkan mikrobiota normal usus inangnya karena kemampuannya menghasilkan berbagai zat antimikroba termasuk asam laktat, alkohol, karbondioksida, diasetil, hidrogen peroksida, bakteriosin dan metabolit lainnya ( Gaggia et al. 2010) .
Probiotik komersial telah banyak terdapat di pasaran, akan tetapi potensinya di Indonesia yang beriklim panas belum banyak dikembangkan. Probiotik dengan memanfaatkan isolat lokal yang diisolasi dalam saluran pencernaan ayam lokal berpotensi sebagai probiotik di Indonesia. Di Indonesia, terdapat 31 jenis ayam lokal dengan karakteristik genotipik dan fenotipik yang berbeda antara satu jenis dengan jenis lainnya. Salah satu diantaranya adalah ayam Cemani. Ayam Cemani merupakan salah satu ayam asli (native chicken) Indonesia yang berasal dari Kedu, Kabupaten Temanggung, Provinsi Jawa Tengah. Ayam ini menunjukkan penampilan morfologi unik dengan warna hitam di seluruh tubuh (Ismoyowati et al. 2012). Umumnya, ayam Cemani di Indonesia digunakan untuk produksi telur dan daging ke pasar lokal. Kadang-kadang juga digunakan dalam upacara ritual dan sebagai obat (Nugroho 2013), selain itu ayam ini memiliki ketahanan tinggi terhadap penyakit, terutama terhadap virus dan patogen usus (Sulandari et al. 2009a; Nataamijaya 2010). Kemampuan resistensi terhadap penyakit dan beradaptasi terhadap kondisi lingkungan dapat dipengaruhi oleh keseimbangan mikrobiota usus didalamnya (Lan et al. 2004, Gaggia et al. 2010).
Penelitian tentang sifat telur dan daging ayam Cemani secara intensif telah dipelajari (Lukasiewicz et al. 2009; Wahyuni et al. 2011; Kusumasari et al. 2013), tetapi penelitian keanekaragaman BAL dari saluran pencernaan ayam Cemani di Indonesia belum dilaporkan. Studi tentang fingerprinting suatu komunitas akan membantu memberi pemahaman hubungan antara keragaman mikroba dalam komunitas tersebut dan karakter spesifik yang dihasilkan. Sehingga sangat penting untuk mempelajari keanekaragaman BAL pada ayam Cemani berdasarkan metode
culture-independent agar dapat memahami mekanisme modulasi kesehatan inang oleh adanya mikrobiota saluran pencernaan. Analisis ini dapat menjadi dasar pembuatan probiotik yang efektif pada saluran pencernaan ayam.
3
Tujuan Penelitian
Secara umum penelitian ini bertujuan mendapatkan informasi tentang komunitas dan keragaman bakteri asam laktat (BAL) sebagai penyusun mikrobiota pada saluran pencernaan ayam Cemani dan mendapatkan isolat BAL yang berpotensi sebagai probiotik pada pakan ayam. Untuk mencapai tujuan tersebut maka tujuan khusus penelitian ini adalah :
1. Mendapatkan informasi populasi dan keragaman BAL yang menyusun mikrobiota pada berbagai komunitas pada saluran pencernaan beberapa ayam Cemani menggunakan teknik molekuler berbasis 16S rRNA yaitu dengan metode T-RFLP (Culture-independent method).
2. Mendapatkan isolat BAL yang berpotensi sebagai probiotik dari saluran pencernaan ayam Cemani (culture-dependent method).
3. Mengidentifikasi BAL terpilih yang dikarakterisasi secara morfologi, fisiologis dan molekuler.
4. Mempelajari enkapsulasi kultur probiotik dengan cara kering beku. 5. Aplikasi probiotik terhadap performa dan kesehatan ayam ras/broiler. 6. Mempelajari mikrobiota ayam broiler dengan pemberian probiotik.
Manfaat Penelitian
Penelitian ini memberikan informasi awal berupa database dan fingerprinting tentang keragaman jenis dan komunitas serta peran bakteri asam laktat sebagai penyusun mikrobiota saluran pencernaan ayam Cemani, sehingga bisa bermanfaat dalam menyusun strategi dalam pengembangan peternakan ayam lokal. Isolat bakteri asam laktat yang diperoleh dapat berpotensi sebagai probiotik pada ayam baik itu ayam lokal ataupun ayam broiler yang hidup dengan kondisi yang kurang ideal di daerah tropis, sehingga dapat menjadi salah satu alternatif penggunaan antibiotik pada pakan ayam.
Kerangka Pemikiran
Kebaruan/Novelty
Berdasarkan penelusuran literatur yang telah dilakukan, hingga saat ini belum ada laporan kajian tentang keragaman bakteri asam laktat yang berasal dari saluran pencernaan ayam Cemani dengan menggunakan teknik Terminal restriction fragment length polymorphism (T-RFLP). Demikian juga dalam skrining bakteri asam laktat yang berpotensi sebagai probiotik yang berasal dari saluran pencernaan ayam Cemani. Isolat probiotik yang diperoleh dapat diintroduksikan ke dalam ayam broiler yang mempunyai komunitas mikroba berbeda dengan ayam Cemani dan efikasinya memberikan efek positif dalam menjaga keseimbangan mikrobiota saluran pencernaan ayam broiler.
Hipotesis Penelitian
a. Bakteri asam laktat (BAL) merupakan bagian dari mikrobiota saluran pencernaan (tembolok, ventrikulus, ileum dan sekum) ayam Cemani. b. Metode culture-independent dengan menggunakan gen 16S rRNA dan
analisa T-RFLP dapat digunakan sebagai alat untuk mengungkap keragaman BAL pada saluran pencernaan ayam Cemani.
c. Terdapat perbedaan jumlah spesies, kelimpahan dan keragaman BAL sebagai penyusun mikrobiota tiap relung pada saluran pencernaan ayam Cemani.
d. Dengan metode culture-dependent dapat diperoleh BAL yang beragam yang berasal dari saluran pencernaan ayam Cemani.
e. BAL yang diisolasi dari saluran pencernaan ayam Cemani mempunyai potensi sebagai probiotik pada ayam.
f. BAL yang diperoleh merupakan isolat indigineous saluran pencernaan ayam.
5
Kerangka Penelitian
Tahap-I: Culture-independent method Ayam Cemani
Saluran pencernaan
(Tembolok, ventrikulus, ileum dan sekum)
Tahap-II: Culture-dependent method
Tahap-IV:Aplikasi probiotik pada ayam broiler
Data base saluran pencernaan ayam
Cemani
Probiotik untuk ayam
Tahap I:
Metode Culture-Independent
Ekstraksi DNA
Sampel isi lumen dari tembolok, ventrikulus, ileum dan sekum
Analisis kuantitas dan kualitas DNA (spektofotometer /DNA analyzer)
Amplifikasi
dengan primer dan kondisi PCR yang sesuai untuk BAL
Elektroforesis
untuk visualisasi produk PCR
Purifikasi DNA (dengan kit purifikasi)
Pemotongan DNA
dengan enzim restriksi (Hae III dan Msp I)
7
Tahap II. Metode culture dependent dan isolasi bakteri asam laktat sebagai kandidat probiotik
Isolasi dan penghitungan jumlah BAL
pada media selektif (MRSA dan GYPA), kondisi anaerob
Penentuan isolat BAL
Morfologi koloni Pewarnaan Gram Reaksi peroksida
Uji kemampuan probiotik isolat BAL terpilih
Uji sifat antagonis terhadap bakteri patogen
(Escherichia coli JCM 1649 and Salmonella enteritidis
B2586)
Uji ketahanan terhadap pH rendah dan adanya bile salt
Uji penempelan pada hidrokarbon Uji koagregasi dengan bakteri patogen Uji koagregasi antar BAL
Uji resistensi terhadap antibiotika
Pembuatan Kultur stok
20% (v/v) Gliserol steril Simpan dalam -80oC
Identifikasi isolat BAL terpilih
Berdasar sekuen 16S rDNA
Tahap III: Enkapsulasi dan Formulasi probiotik
Preparasi
Bakteri L. Salivarius sebagai probiotik
Pengukuran kinetika pertumbuhan
Penggandaan skala pada media MRS cair
Enkapsulasi
pelet bakteri pada susu skim
Proses Kering beku
Formulasi probiotik
Probiotik
9
Tahap IV:
Efikasi probiotik L. salivarius terhadap penampilan, kesehatan dan komunitas mikrobiota saluran pencernaan ayam Broiler
Pengujian probiotik pada ayam Broiler secara in vivo
Pakan
PB/kontrol PB + Antibiotik PB + probiotik 1 (isolat tunggal BAL)
PB + probiotik 2 (campuran isolat BAL)
10 ekor 10 ekor 10 ekor 10 ekor
10 ekor 10 ekor 10 ekor 10 ekor
10 ekor 10 ekor 10 ekor 10 ekor
10 ekor 10 ekor 10 ekor 10 ekor
10 ekor 10 ekor 10 ekor 10 ekor
Kesehatan ayam pedaging Penampilan
ayam pedaging
Komunitas mikrobiota
Bobot badan akhir Pertambahan bobot
badan
Konsumsi pakan Konversi pakan Mortalitas
Prosentase karkas
Kolesterol daging Lemak daging Kolesterol darah Profil darah
Prosentase bursa fabrisius
Prosentase thymus
Jumlah koliform Jumlah BAL Deteksi
keberadaan probiotik Analisis
TINJAUAN PUSTAKA Ayam Cemani
Perkembangan ayam lokal dimulai sejak proses domestikasi, sehingga dikenal sebagai ayam asli atau native chicken. Berdasarkan referensi pembagian
clade domestikasi, ayam lokal Indonesia sangat berbeda dengan ayam lokal dari negara Asia lainnya, dan Indonesia merupakan salah satu pusat domestikasi ayam di dunia (Sulandari et al. 2009b). Banyak potensi genetik tertentu pada ayam lokal yang belum dikenal, seperti daya tahan terhadap penyakit dan kemampuan bertahan terhadap iklim tropis yang lebih panas, sehingga mudah dalam pemeliharaannya. Budidaya ayam lokal di daerah berkembang atas dasar kesenangan dan kepercayaan masyarakat tradisional. Menurut Nataamijaya (2010) terdapat 31 rumpun ayam lokal Indonesia yang mempunyai ciri khas yang berbeda, diantaranya ayam Pelung, ayam Kedu, ayam Nunukan, ayam Merawang, ayam Merawas, ayam Sedayu, ayam Sentul, ayam Gaok, ayam Cemani dan lainnya.
Ayam Cemani yang berasal dari daerah Kedu, merupakan plasma nutfah dari Jawa Tengah, mempunyai ciri spesifik yaitu bulu, kulit, ceker, jengger, pial, paruh, lidah, tenggorokan, telak (langit-langit mulut), dan dubur berwarna hitam. Daging dan tulang berwarna kehitam-hitaman. Kata cemani berasal dari bahasa Jawa yang artinya hitam legam. Ayam Cemani adalah ayam Kedu hitam yang diseleksi ke arah pemurnian warna hitam, berasal dari kecamatan Kedu, kabupaten Temanggung, Jawa Tengah. Potensi pemanfaatan ayam ini selain digunakan dalam acara ritual adat, juga sebagai ayam hias yang eksotis, dagingnya dipercaya sebagai obat dan produksi telur yang tinggi. Sistem pemeliharaan dengan pola ransum dan nutrisi pada pemeliharaan ayam Cemani dilakukan oleh peternak secara sederhana dan turun temurun. Umumnya pemeliharaannya masih dilakukan secara tradisional atau umbaran sehingga produktivitasnya tetap bahkan cenderung menurun. Untuk menjaga kualitas dan keaslian ayam Cemani, peternak mengawinkan sesama ayam Cemani secara alami dengan perbandingan maksimal satu ayam jantan dengan empat ayam betina (Nugroho 2013).
Ayam Broiler
seleksi diteruskan hingga dihasilkan ayam broiler seperti sekarang ini Jenis ayam broiler antara lain Cobb, Ross, dan Arbor Arches (Amrullah, 2004).
Karakteristik broiler CP 707 yang dihasilkan PT. Charoen Phokphand antara lain : berat badan umur 5 minggu 2.05 kg, konversi ransum 1.6, pertumbuhan berat badan 83 g/hari/ekor, konsumsi pakan komulatif sebesar 3 297 g, warna kulit kuning dan warna bulu putih. Bila pertumbuhan 7 hari pertama mencapai 175 g/ekor, secara umum akan menghasilkan berat badan yang baik pada masa akhir panen. Kemampuan ayam broiler mengubah ransum menjadi bobot hidup jauh lebih cepat dibandingkan dengan ayam kampung (Charoen Pokphand Indonesia 2006).
Kendala usaha peternakan ayam broiler komersial di daerah tropis, khususnya di Indonesia adalah temperatur harian relatif tinggi, terutama pada musim kemarau, dan temperatur tahunan rata-rata adalah 26.5oC. Stres karena panas dapat memicu neurohormonal sehingga ayam mudah terserang penyakit (Fadilah, 2004).
Saluran Pencernaan Ayam
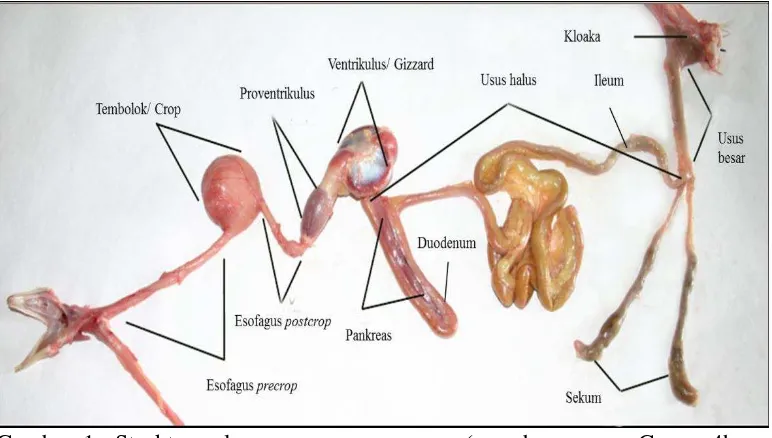
Saluran pencernaan ayam atau dikenal sebagai saluran gastrointestinal merupakan saluran yang memanjang dari mulut sampai kloaka dengan beberapa organ penting diantara keduanya, berfungsi dalam mengubah dan mencerna makanan menjadi nutrisi yang dapat diabsorbsi dan digunakan oleh tubuh/inang. Struktur saluran pencernaan terdiri dari mulut, esofagus, tembolok, proventrikulus, gizzard/ventrikulus, usus halus (duodenum, jejunum & ileum), dan usus besar (sekum, usus besar dan rektum) (Gambar 1). Masing-masing bagian memiliki struktur histologi dan anatomi yang dirancang sesuai fungsi masing-masing dalam proses pencernaan. Masing-masing bagian juga mempunyai pH lingkungan yang berbeda, tembolok dengan pH 5.5, proventrikulus 2.5-3.5,
gizzard/ventrikulus 2.5-3.5, duodenum 5-6, jejenum 6.5-7, ileum 7.0-7.5, sekum 6-7, dan kolon 7-8 (Salanitro et al. 1974 ).
13
adanya vili dan mikrovili yang membantu penyerapan nutrisi makanan. Setelah itu sisa makanan masuk ke usus besar, yang di bagian ini terdapat sepasang sekum. Di sini terjadi reabsorbsi air yang berlebihan dari fekal dan terjadi fermentasi dari sisa makanan yang menghasilkan asam lemak, dan dihasilkan vitamin B seperti Tiamin, riboflavin, niasin, asam pantotenat, piridoksin, biotin, asam folat dan vitamin B12. Usus besar dikenal sebagai kolon, di sini sangat kecil terjadi
penyerapan dan pencernaan, pelet fekal dan asam urat dikeluarkan melalui kloaka (Daghir, 1995; Jacob et al. 2011).
Gambar 1 Struktur saluran pencernaan ayam ( sumber : www.Geauga4h.org/ poultry/chicken_digestion.htm
Mikrobiota Saluran Pencernaan Ayam
[image:31.595.120.506.251.470.2]pada tempat dengan waktu retensi yang cepat. Mikrobiota ayam berasal dari lingkungan saat menetas, pakan dan pekerja yang menangani saat penetasan (Stanley et al. 2013).
Dari metode berbasis pengkulturan, populasi bakteri yang melimpah di tembolok adalah lactobacilli yang melekat pada epitel melalui komponen karbohidrat pada dinding sel bakteri. Bakteri penghuni tembolok ini memfermentasi makanan yang masuk dan menghasilkan asam laktat yang menyebabkan pH lingkungan tembolok turun menjadi pH 5. Kondisi lingkungan dalam proventrikulus sangat asam sehingga merupakan lingkungan yang kurang menyenangkan bagi sebagian besar bakteri. Ventrikulus/gizzard memiliki pH rendah yang dipengaruhi oleh pH proventrikulus, sehingga lingkungan ini didominasi oleh populasi lactobacilli, meskipun masih dibawah 108 cfu/g, selain itu terdapat Enterococcus dan Escherichia coli. Usus halus memiliki daya peristaltik yang tinggi sehingga kurang menguntungkan bagi bakteri untuk berada di lumen. Namun, terdapat lactobacilli dalam jumlah tinggi dan populasi yang stabil setelah usia sekitar dua minggu (Barnes et al. 1972). Lumen usus halus menunjukkan bahwa mayoritas bakteri berupa bakteri fakultatif anaerob, dengan
Lactobacillus sp., Enterococcus sp. dan E. coli ( sekitar 60-90 %) dan juga beberapa bakteri anaerob obligat seperti eubacteria, clostridia, propionibacteria dan fusobacteria. Awalnya sekum didominasi oleh lactobacilli, coliform dan enterococci, namun karena rendahnya tingkat aliran peristaltik, mikrobiota sekum lebih stabil dan kompleks dan dalam usia empat minggu ditemukan anggota bacteroides, eubacteria, bifidobacteria, lactobacilli dan clostridia (Salanitro et al.
1978).
Dari studi molekuler berbasis tanpa pengkulturan, memungkinkan wawasan yang lebih besar tentang mikrobiota usus baik dari karakter maupun kompleksitasnya. Dari berbagai studi dijelaskan bahwa mayoritas bakteri saluran pencernaan ayam dan mamalia tetap uncharacterised, dan menunjukkan hanya 10 % dari spesies mikrobiota yang yang dikenal, 35 % tidak diketahui spesiesnya tetapi dapat dikenal genusnya dan sisanya 55 % adalah bakteri yang benar-benar tidak diketahui. Studi molekuler telah menegaskan bahwa dalam ileum 70 % dari populasi bakteri didominasi lactobacilli dan sisanya 30 % terutama terdiri dari clostridia, streptococci dan enterococci (Bjerrum et al. 2006).
Fingerprinting Komunitas
15
konsekuensinya, tidak sepenuhnya dapat dibuat profil komunitas berbasis pengkulturan. Selain itu, penggunaan media selektif hanya memberi kesempatan tumbuh kelompok bakteri tertentu yang sudah dikenal, sehingga akan memberikan hasil profil komunitas yang bias dan tidak realistis.
Metode culture-independent yang mulai muncul tahun 1980-an memungkinkan ahli mikrobiologi untuk memperoleh pandangan yang lebih akurat tentang mikrobiota saluran pencernaan tanpa perlu pengkulturan terlebih dahulu. Ada banyak teknik yang memanfaatkan teknologi molekuler sebagai sarana untuk memantau populasi mikroba, antara lain microarray DNA, fluorescent in situ hybridisation (FISH), kloning dan sekuencing gen 16S rRNA, quantitative PCR, terminal fragment restriction length polymorphism (T-RFLP),
temperature gradient gel electrophoresis (TGGE), denaturing gradient gel electrophoresis (DGGE) dan lainnya. Teknik culture-independent umumnya melibatkan teknik PCR sehingga penting untuk memperhatikan gen yang menjadi target, dasar analisa serta metode ekstraksi DNAnya. Keterbatasan teknik culture-independent sangat dipengaruhi oleh kemampuan metode ekstraksi DNA yang digunakan. Dalam ekstraksi DNA dari lumen, adanya nuklease maupun inhibitor PCR dapat terekstraksi dari isi lumen sehingga sangat mempengaruhi kualitas DNA hasil ekstraksi (Dunbar et al. 2001, Moeseneder et al. 1999).
T-RFLP (terminal restriction fragment length polymorphism) merupakan metode yang efektif untuk membedakan komunitas bakteri pada berbagai lingkungan. Metode ini merupakan metode yang cepat untuk menemukan perbedaan antara komunitas saluran pencernaan manusia dengan menggunakan sampel berupa feses dari orang yang mempunyai gaya hidup berbeda (Dicksved et al. 2007), komunitas mikroba pada paru-paru orang yang sakit cystic fibrosis
(Roger et al. 2010), mengkarakterisasi komunitas bakterioplankton di laut (Moeseneder et al. 1999). T-RFLP dapat digunakan untuk melihat secara kuantitatif perubahan pada komunitas mikroba karena kelimpahan relatif suatu populasi dalam komunitas dapat dibandingkan antar sampel dengan perlakuan yang berbeda atau diambil pada waktu yang berlainan. Masing-masing T-RF mewakili minimal satu spesies bakteri, terlihat sebagai satu puncak (peak), sementara luas daerah di bawah puncak tersebut menunjukkan kelimpahan relatifnya.
pengkulturan dan penghitungan sel secara langsung tetap dibutuhkan karena dapat saling melengkapi kekurangan masing-masing teknik yang dibutuhkan.
Probiotik untuk Ayam
Penyakit pada saluran pencernaan menjadi perhatian dalam industri unggas karena dapat menurunkan produktivitas, menaikkan mortalitas, berpengaruh terhadap kesehatan unggas dan pada manusia sebagai konsumennya. Pada empat dekade sebelumnya, antibiotik disuplementasikan pada pakan unggas untuk menaikkan performa dan efisiensi pakan serta melindungi unggas dari berbagai pengaruh mikroba usus yang patogen dan non patogen. Penggunaan antibiotik sebagai pemacu pertumbuhan kadarnya sangat kecil, bertujuan untuk melawan infeksi dan diberikan dalam jangka waktu yang lama (beberapa minggu sampai bulan). Pemberian dalam jangka waktu yang lama dan dosis rendah menjadikan mikrobiota terseleksi dan menjadi resisten. Akan tetapi, pelarangan antibiotic growth promoters (AGPs) dalam pakan ternak merupakan faktor penting yang menyebabkan perubahan ekologi mikrobiota dalam saluran pencernaan ayam broiler, sehingga banyak terjadi wabah radang usus nekrotik (necrotic enteristis).
Istilah mikroba yang diberikan secara langsung /direct-fed microbial
(DFM) atau probiotik didefinisikan sebagai suplemen pakan yang berupa mikroba hidup yang memberi efek menguntungkan bagi inang dengan meningkatkan keseimbangan mikrobiota usus (Fuller 1999). Probiotik digunakan pada ayam terutama untuk membantu memelihara status kesehatan dengan menjaga keseimbangan mikrobiota saluran pencernaan, mengurangi potensi bakteri patogen dan memiliki efek meningkatkan kinerja dan produktivitas (pertumbuhan, produksi telur, dan konversi pakan). Gangguan pencernaan pada ayam menjadi perhatian serius oleh adanya sindrom diare yang terpicu pada saat periode sensitif pertumbuhan (hari-hari pertama kehidupan setelah menetas ) atau stres karena faktor makanan (ketidakseimbangan nutrisi), dan adanya bakteri dan kapang dalam jumlah yang tinggi. Probiotik pada ayam untuk mencegah dan melawan gangguan pencernaan melalui competitive exclusion (mengganggu kemampuan pelekatan dan kolonisasi) bakteri patogen (Salmonella enteritidis, Escherichia coli, Clostridium perfringens), menjaga homeostasis dan stabilisasi terhadap fungsi barrier di saluran pencernaan, sekresi antimikroba (bakteriosin), penghambatan enzim prokarsinogen, aktivitas enzim yang menginduksi absorpsi dan nutrisi, stimulasi respon imun inang yang memberikan kontribusi untuk pemeliharaan kesehatan saluran pencernaan (Gaggia et al. 2010). Dari penelitian Stern et al. (2006) menunjukkan bahwa galur Lactobacillus salivarius yang diisolasi dari usus ayam menghasilkan bakteriosin yang mempunyai aktivitas antagonis terhadap bakteri Gram positif dan Campylobacter jejuni.
17
fungsi dan keamanannya melalui uji in vitro yang meliputi : uji aktivitas antimikroba, deteksi viabilitasnya dalam saluran pencernaan, studi penempelan dan sensivitasnya terhadap antibiotik. Dosis, waktu dan durasi pemberian probiotik dapat menjadi faktor yang mempengaruhi keberhasilan / efikasi probiotik. Pada infeksi diare akut, dosis probiotik yang lebih tinggi dengan waktu yang singkat tampaknya lebih efektif dari dosis yang lebih rendah (Sazawal et al.
2006). Pada awal kehidupan ayam, mikrobiota pencernaan belum stabil, sehingga rentan terhadap bakteri patogen yang berasal dari lingkungan. Dengan kolonisasi awal yang baik akan menguntungkan inang/ayam karena bakteri dapat memodulasi ekspresi gen-gen pada sel-sel epitel sehingga menciptakan habitat yang menguntungkan untuk diri mereka sendiri (Siggers et al. 2007).
Bakteri Asam Laktat
Bakteri asam laktat (BAL) adalah kelompok Gram positif, tidak membentuk endospora, bakteri anaerob/ fakultatif anaerob yang menghasilkan asam laktat sebagai produk fermentasi utama dengan substrat karbohidrat yang sesuai. BAL terdiri dari beberapa genus antara lain : Oenococcus, Sporolactobacillus, Teragenococcus, Vagococcus, Lactobacillus, Leuconostoc, Pediococcus, Lactococcus dan Streptococcus, Aerococcus, Carnobacterium, Enterococcus dan Weisella. Beberapa BAL mengkolonisasi di dalam mulut
(Streptococcus), saluran pencernaan (Enterococcus, Lactobacillus) dan mukosa vagina (lactobacilli tertentu) (Mattu & Chauchan 2013).
Lactobacillus merupakan genus dari kelompok bakteri asam laktat yang sering digunakan sebagai probiotik. Lactobacillus sangat bervariasi yang terdiri lebih dari 100 spesies yang berbeda, merupakan bagian penting dari mikrobiota saluran pencernaan normal pada manusia dan hewan, beberapa spesies bertanggung jawab dalam fermentasi pangan dan pakan dan digunakan sebagai probiotik. Sampai saat ini belum dilaporkan adanya masalah dalam keamanan mikroba ini.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan September 2011- Nopember 2013. Penelitian in vitro dilakukan di Laboratorium Bioprospeksi Mikroba, Laboratorium Genetika Mikroba, dan laboratorium Biokimia Mikroba, Pusat Penelitian Biologi LIPI. Penelitian in vivo bertempat di Laboratorium Ilmu Nutrisi Unggas dan Laboratorium lapang C, Departemen Ilmu Nutrisi dan Teknologi pakan (INTP), Fakultas Peternakan, Institut Pertanian Bogor.
Tahapan Penelitian
Tahap I : Analisis Keragaman Bakteri Asam Laktat (BAL) pada Saluran Pencernaan Ayam Cemani dengan Menggunakan Metode Terminal Restriction Fragment Length Polymorphism (T-RFLP)
Tujuan penelitian ini untuk menganalisis pola diversitas komunitas bakteri asam laktat yang terdapat pada berbagai relung sepanjang saluran pencernaan (tembolok, ventrikulus, ileum dan sekum) dengan menggunakan teknik T-RFLP.
Pengambilan sampel
Sampel ayam Cemani diperoleh dari seorang peternak ayam lokal di daerah Kembang Arum, Kecamatan Mranggen, Kabupaten Demak, Jawa Tengah. Tiga ekor ayam Cemani untuk sampel culture-dependentmethod dan 7 ekor ayam Cemani untuk sampel culture-independent method, kondisi ayam sehat, umur 9 – 12 bulan, berat 1.0 – 1.5 kg, ayam diberi pakan alami berupa dedak, jagung, sisa nasi dan makanan rumah tanpa penambahan antibiotik, air minum diberi vitamin. Setelah dilakukan penyembelihan, lumen ayam berupa isi padatan dan cairan dari saluran pencernaan (tembolok, ventrikulus/ampela, ileum dan sekum) diambil secara aseptik. Sampel dimasukkan dalam tabung falcon dan dibawa dengan ice box ke laboratorium untuk segera diproses secara aseptik. Analisis plate counts dilakukan segera untuk memperoleh nilai total bakteri asam laktat dan juga untuk memperoleh isolat kandidat probiotik untuk analisis culture dependent method. Isolasi total genom mikrobiota saluran pencernaan ayam lokal dilakukan untuk analisis culture independent method. Sampel yang diambil segera disimpan di bawah suhu -20 oC sampai dilakukan tahapan penelitian berikutnya / ekstraksi DNA.
Isolasi DNA genom langsung dari sampel
(PhileKorea Technology, INC, Korea) sesuai dengan instruksi perusahaan. Dilakukan juga ekstraksi DNA koloni kultur bakteri kandidat probiotik yang menjadi isolat marker. Pelet DNA yang diperoleh kemudian disuspensi dalam 50 uL bufer TE dan disimpan pada suhu -20°C. Kadar kemurnian hasil isolasi DNA diukur dengan menggunakan DNA analyzer spektrofotometer, Shimadzu.
Amplifikasi gen 16S rRNA
Untuk mengamplifikasi gen 16S rRNA digunakan primer forward 27F yang dilabel dengan 6-carboxyfluorescein (5'-AGAGTTTGATCCTGGCTCAG-3') (Heilig et al. 2002), dan primer reverse spesifik untuk bakteri asam laktat SG-Lab-0677 (5'-CACCGCTACACATGGAG-3') yang tidak berlabel ( Heilig et al. 2002; Dicksved et al. 2007). Campuran reaksi PCR terdiri atas 25 µL GoTaq GreenMaster Mix (Promega, USA), 2 µl dari masing-masing primer (10 pmol), dan destilatedwater sampai volume akhir 50 ml dan 100 ng DNA template dalam konsentrasi akhir. Kondisi PCR dilakukan dengan denaturasi awal pada suhu 94oC selama 5 menit, diikuti dengan 35 siklus dari denaturasi pada suhu 94oC selama 30 detik, suhu annealing 50oC selama 20 detik, dan suhu ekstensi / perpanjangan pada 68oC selama 40 detik, kemudian perpanjangan akhir pada suhu dari 68oC selama 7 menit (Heilig et al. 2002). Sampel diamplifikasi dengan menggunakan Takara PCR Thermal Cycler Dice ® Gradient (TAKARA BIO INC, Jepang). Produk PCR dikonfirmasi dengan elektroforesis dengan menggunakan 1 % gel agarose dalam 1x bufer TAE dan divisualisasikan dengan pewarnaan etidium bromida dengan menggunakan Gel Documentation System (Atto Corporation, Jepang). Produk PCR dimurnikan dengan GeneJetTM PCR Purification Kit (Fermentas, USA) sesuai dengan instruksi perusahaan. DNA yang diperoleh dari pemurnian ditambahkan 40 µL nuclease-free water dan disimpan pada suhu -20°C sampai penggunaan lebih lanjut.
Restriksi / pemotongan produk PCR dengan enzim restriksi
Produk PCR yang telah dimurnikan dipotong dengan enzim restriksi
HaeIII dan MspI (Fermentas, USA) (Dinoto et al. 2006). Setiap reaksi terdiri atas 15 unit enzim restriksi (1,5 µL) dari, 10x bufer restriksi (2 µL, bufer R untuk enzim HaeIII dan bufer Tango untuk MspI) dan 100 ng DNA sampel (10 µL),
nuclease-free water sampai volume akhir 20 µl. Sampel diinkubasi pada suhu 37°C selama 24 jam, dan dinonaktifkan dengan suhu 80° C selama 20 menit dan segera didinginkan dalam ice bath sesuai dengan instruksi dari perusahaan. Produk restriksi dipresipitasi dengan presipitasi etanol dan ditambah 3 µl
nuclease-free water.
Analisis T-RFLP.
Analisis fragmen/ potongan produk PCR dilakukan pada jasa layanan
21
(100:5, vol/vol). Potongan T-RF yang dilabel dianalisa dengan elektroforesis dengan automatic sequence analyzer ( ABI PRISM 3100, Applied Biosystems ) pada mode scan gen, dan panjang dari T-RF ditentukan dengan membandingkan dengan ukuran standar menggunakan Peak ScannerTM software V 1.0 (Applied Biosystems) (Dinoto et al. 2006).
Pengolahan data
Untuk membedakan sinyal fluoresensi dengan noise maka ditetapkan ambang batas (threshold) di mana hanya T-RF lebih besar dari atau sama dengan 50 bp dan persentase area puncak / peak area lebih besar dari atau sama dengan 1 % digunakan untuk analisis lebih lanjut ( Li et al. 2007). Area puncak relatif dari masing-masing T-RF ditentukan dengan membagi setiap area puncak dengan total luas area seluruh puncak. Hasil yang diperoleh dalam bentuk pecahan desimal dan dibulatkan ke nilai terdekat, dan ini menunjukkan nilai persentase. Kemudian dibuat tabel data biner (menunjukkan ada atau tidak adanya T-RF), di mana puncak dengan persentase dari total luas < 1 % dikategorikan sebagai 0 (tidak ada) dan persentase dari total luas ≥ 1 % dikategorikan sebagai 1 (ada) (Chen et al. 2012). Diversitas/keragaman bakteri merupakan kekayaan/ jumlah dan kelimpahan filotipe dari komunitas bakteri (Dicksved et al. 2007). Nilai biodiversitas ditentukan berdasarkan :
1. Jumlah filotipe yang ditemukan dalam sampel (S)
2. Indeks keragaman Shannon-Wiener (H') yang dihitung untuk tiap komunitas dengan rumus sebagai berikut : H'= - Σ pi ln (pi), dimana pi adalah ukuran sampel yang dimiliki filotipe (pi=ni/n)
3. Indeks kesamaan pasangan Sorensen’s (Cs) dihitung untuk setiap pasangan komunitas dengan rumus sebagai berikut : Cs = 2j / (a + b), dimana j adalah jumlah T-RF/ filotipe yang dijumpai di dua komunitas yang dibandingkan, a dan b adalah masing-masing jumlah T-RF/ filotipe setiap komunitas, nilai indeks berkisar mulai 0-1, yang artinya nilai 0 tidak ada filotipe tumpang tindih antara komunitas, nilai 1 adalah terdapat filotipe persis sama ditemukan di kedua komunitas, dan
4. Jumlah filotipe spesifik yang ditemukan pada suatu komunitas.
Tahap II : Isolasi dan Seleksi BAL yang Berpotensi sebagai Probiotik
Tujuan penelitian tahap II ini adalah untuk mengisolasi dan menyeleksi BAL dari saluran pencernaan ayam Cemani yang berpotensi sebagai probiotik pada ayam.
Isolasi BAL dan jumlah total BAL
Sebanyak 0.1 g sampel dilarutkan dalam 0,9 ml larutan garam fisiologis 0.85% (w/v) NaCl steril, kemudian dilakukan pengenceran serial sampai pengenceran 10-8 dan empat pengenceran terakhir ditumbuhkan pada cawan petri yang berisi media padat MRS (de Mann, Rogosa and Sharpe, HiMedia Laboratories, India) (deMan et al, 1960) dan media padat GYP ( Glucose Yeasrt Peptone, yang terdiri atas 10 g glukosa, 10 g ekstrak khamir, 5 g pepton, 2 g ekstrak daging sapi, 1.4 g Na asetat.3H2O, 5 ml salt solution (0.1g MgSO4.7H2O,
0.1g MnSO4.4H2O, 0.1 g FeSO4.7H2O, 0.1 g NaCl, 50 mL akuades) 0.5 mL
tween 80, 20 g agar) yang ditambahkan dengan 0.5% CaCO3 untuk mengetahui
bakteri penghasil asam dan setiap pengenceran dilakukan secara duplo. Kemudian cawan petri diinkubasi selama 48 jam pada suhu 37°C secara anaerobik dalam anaerobic jar dengan memasukkan strip indikator anaerobik dan Anaerocult A (Merck, Germany) atau dalam anaerobic chamber dengan kondisi 10% CO2, 5-10% H2 dan 80-85% Nitrogen. Setelah inkubasi, koloni bakteri yang
tumbuh dan terdapat zona bening di sekelilingnya dihitung dengan rumus sebagai berikut :
Jumlah koloni per gram sampel = Jumlah koloni percawan x 1/ faktor pengenceran.
Setelah dihitung jumlahnya, isolat bakteri asam laktat yang tumbuh diisolasi dengan menggunakan metode cawan gores dan dipurifikasi pada media padat MRS yang ditambahkan CaCO3 sampai 3 kali purifikasi untuk mendapatkan isolat-isolat yang murni/ tunggal. Semua isolat murni yang didapat dilakukan verifikasi untuk menentukan bahwa isolat termasuk kedalam kelompok BAL. Uji yang dilakukan meliputi pengamatan morfologi koloni ( bentuk, warna, diameter, permukaan, konsistensi) dan sel (pewarnaan Gram, bentuk sel), dan uji katalase. Untuk penyimpanannya isolat BAL disimpan dalam 20% (vol/vol) gliserol steril pada suhu −80°C (Guerin-Danan et al. 1999).
Seleksi BAL sebagai Kandidat Probiotik
Uji aktivitas antimikroba terhadap bakteri indikator
Untuk mendeteksi adanya aktivitas antimikroba yang dihasilkan oleh BAL ditentukan dengan metode difusi agar (Taheri et al. 2009, Heravi et al.
23
selama 24 jam untuk mencapai konsentrasi sel 108 CFU/ml. Kultur bakteri, supernatan bebas sel, dan supernatan bebas sel yang dinetralkan (pH 6.8-7.2, ditambah dengan 2M NaOH ) dari isolat BAL ditentukan aktivitas antimikroba terhadap bakteri indikator (Escherichia coli JCM 1649 dan Salmonella enteritidis
B2586 yang yang diperoleh dari Balitvet dan merupakan isolat lokal saluran pencernaan ). Sebanyak 0.1% kultur bakteri indikator dengan kepadatan sel 108 CFU/ ml disuspensikan dalam 100 ml media padat BHI (Brain Heart Infussion), kemudian dituang ke dalam cawan petri, dan setelah padat dibuat sumuran menggunakan pipet pasteur steril. Sebanyak 40 µl kultur sel, supernatan dan supernatan yang dinetralkan dimasukkan dalam sumur. Setelah diinkubasi pada suhu 37 ° C selama 24 jam, dihitung zona hambat di sekitar sumur.
Uji toleransi terhadap pH dan garam empedu
Uji kemampuan isolat BAL terpilih untuk bertahan pada lambung yang mempunyai pH rendah dan adanya garam empedu di intestinum dilakukan menurut metode Taheri et al. (2009). Kultur BAL terpilih umur 24 jam disentrifugasi pada 7 500 × g selama 5 menit dan pellet yang dihasilkan dicuci dua kali dengan Phosphat Buffer Saline steril (PBS : NaCl 8.5 g/L, KH2PO4 0.34 g/L
dan K2HPO4 1.21 g/L, pH 7,0) dengan densitas sel dengan Optical Density (OD)
pada 600 nm sebesar 0.5-0.7 menggunakan spektrofotometer. Untuk uji toleransi terhadap pH, 1 ml suspensi bakteri dimasukkan dalam satu seri tabung reaksi yang berisis 5 ml PBS steril dengan pH 2.0, 4.0, (diatur dengan penambahan HCl) dan 6.5 (kontrol), kemudian diinkubasi pada suhu 37°C selama 90 menit. Sementara itu, untuk uji toleransi terhadap garam empedu, 1 ml suspensi bakteri dimasukkan dalam 5 ml PBS steril yang mengandung 0 (kontrol), 0.05, 0.08, 0.1 dan 0,3 % garam empedu (Sigma) dan diinkubasi pada suhu 37° C selama 5 jam. Sel yang tumbuh dihitung dengan metode cawan hitung dari 0.1 ml suspensi bakteri pada media padat MRS yang diinkubasi secara anaerob pada suhu 37°C selama 48 jam. Viabilitas bakteri dalam kondisi pH dan konsentrasi garam empedu yang berbeda ditentukan oleh selisih log jumlah bakteri dalam media kontrol dengan perlakuan selama periode inkubasi.
Uji hidrofobisitas pada permukaan sel
Hidrofobisitas (%) =
(OD600 sebelum pencampuran - OD600 setelah pencampuran) ×100 OD600 sebelum pencampuran
Uji koagregasi
Uji koagregasi dilakukan untuk menentukan besarnya kemampuan interaksi antar isolat BAL dan juga antara isolat BAL dan bakteri patogen (E. coli
dan S. enteritidis) dalam saluran pencernaan. Masing-masing sel bakteri dipanen dengan cara disentrifugasi pada 7 500 × g selama 5 menit, kemudian dicuci 2 kali dengan PBS. Tiap kultur disuspensikan kembali dalam PBS sehingga mencapai OD pada 600 nm sebesar 0.5-0.7. Kultur berpasangan dicampur dengan volume yang sama (masing-masing 1 mL) dalam satu tabung kemudian dihomogenkan dengan menggunakan Vortex selama 5 menit. OD600 dari campuran bakteri diukur setelah tabung diinkubasi pada 37°C selama 5 jam. Sebagai kontrol tabung berisi 2 mL masing-masing kultur bakteri (Taheri et al. 2009, Heravi et al. 2011). Persentase koagregasi dihitung dengan menggunakan persamaan sebagai berikut :
Koagregasi ( % ) = [ ( Ax + Ay ) / 2 - A ( x + y ) ] x 100
( Ax + Ay ) / 2
Dimana Ax dan Ay merupakan nilai absorbansi pada masing-masing bakteri kontrol (x dan y), dan A(x+ y ) merupakan nilai absorbansi campuran kedua bakteri.
Uji aktivitas enzimatik
25
Uji sensitivitas terhadap antibiotik
Isolat BAL diuji sensivitasnya terhadap 10 jenis antibiotik mewakili kategori agen antimikroba yang umumnya digunakan pada ayam dan manusia. Sensivitas isolat BAL terhadap antibiotik yang dipilih ditentukan dengan menggunakan metode cakram Kirby - Bauer (Taheri et al. 2009). Sebanyak 0,1 ml suspensi sel LAB dituang pada cawan yang berisi media MRS agar. Cakram kertas yang mengandung antibiotik amoksisilin 10 µg, ampisilin 10 µg, kloramfenikol 30 µg, sefadroksil 30 µg, doxycycline 30 µg, eritromisin 15 µg, linkomisin 15 µg, rifampisin 5 µg, spiramisin 30 µg, dan tetrasiklin 30 µg ditempatkan pada permukaan media, kemudian diinkubasi secara anaerob pada suhu 37°C selama 24 jam. Sensitivitas antibiotik ditentukan dengan mengukur diameter zona bening di sekitar cakram (Brock et al. 1994).
Identifikasi Kandidat Probiotik Identifikasi secara molekuler
Identifikasi ini dilakukan berdasarkan kemiripan sekuen 16S rDNA dengan data pada GenBank. DNA genom isolat BAL terpilih diekstraksi menggunakan Xprep Stool DNA Mini Kit ( PhileKorea Technology, INC, Korea ) sesuai dengan rekomendasi perusahaan. Pelet DNA yang diperoleh kemudian disuspensi dalam 50 µL bufer TE (Tris-EDTA) dan disimpan pada suhu -20°C. Amplifikasi PCR untuk 16S rDNA dilakukan dengan menggunakan 2 buah primer umum yaitu 27F (5'-AGAGTTTGATCCTGGCTCAG-3') dan reverse primer 1492R (5'-GTTACGACTTCACCCTCCT-3') (Zhang, et al. 2007). Komponen reaksi PCR untuk total volume 50 µL terdiri atas 25 µL GoTaq GreenMaster Mix (Promega, USA), 2 µl tiap primer (10 pmol), destilated water untuk mencapai volume akhir 50 µL dan DNA cetakan 100 ng pada konsentrasi akhir. Proses amplifikasi menggunakan Takara PCR Thermal Cycler Dice® Gradient (TAKARA BIO INC, Japan) dengan kondisi PCR sebagai berikut : pra pemanasan pada suhu 94oC selama 1.5 menit, diikuti dengan denaturasi pada suhu 95oC selama 30 detik, pelekatan (annealing) pada suhu 50oC selama 30 detik, dan perpanjangan (elongation) pada suhu 72oC selama 1.5 menit, siklus ini diulang sampai 25 kali dan pemanjangan akhir pada suhu 72oC selama 5 menit. Produk PCR dikonfirmasi dengan elektroforesis dengan menggunakan gel agarose 1% dalam 1x bufer TAE (Tris-Acetate-EDTA) dan divisualisasi dengan pewarnaan etidium bromida dengan menggunakan Gel Documentation System (ATTO Corporation, Japan). Purifikasi produk PCR dan sekuensing dilakukan oleh perusahaan penyedia jasa sekuensing. Hasil pengurutan DNA yang berupa urutan basa DNA dibandingkan dengan data gen 16S rRNA yang tersedia di GeneBank
berdasarkan metode neighbour-joining dengan program MEGA versi 4 (Tannock 1999).
Karakterisasi biokimia isolat BAL dengan kit API
Karakterisasi biokimia BAL terpilih dengan melihat pola fermentasi gula dengan menggunakan uji API ® 50 CHL (bioMérieux, France) yang dilakukan sesuai rekomendasi perusahaan. Profil fermentasi isolat ditentukan dengan menggunakan APILAB Plus software versi 3.3.3. dari bioMérieux (Pelinescu et al. 2009).
Tahap III. Enkapsulasi Bakteri L. Salivarius Sebagai Probiotik dengan Teknik Kering Beku
Tujuan penelitian III : Membuat sediaan padat berupa kultur kering probiotik yang berisi L. salivarius sehingga mudah diaplikasikan ke pakan ternak.
Pengukuran kinetika pertumbuhan L. salivarius sebagai probiotik
Bakteri ditumbuhkan di medium MRS cair secara anaerob dengan mengalirkan campuran gas CO2 dan N2O selama 5 menit. Inkubasi pada suhu
37oC selama 48 jam dengan diamati OD nya pada 600 nm tiap 3 jam, menggunakann UV-VIS spektrofotometer, UV mini 1240, Shimadzu. Untuk mendapatkan laju pertumbuhan spesifik (µ) dihitung dengan menggunakan rumus:
µ = Ln (N2/N1) / (t2-t1),
dimana N1= Jumlah sel sebelum dikulturkan, N2= jumlah sel setelah waktu t, t1= waktu sebelum dikulturkan, t2 = waktu setelah dikulturkan.
Inokulasi isolat probiotik pada media MRS cair dan penggandaan skala (scale up)
Metode pengawetan kering beku (freeze-drying) dilakukan terhadap isolat BAL terpilih dilakukan menurut Jalali et al. (2012). Isolat BAL disubkultur dua kali dalam MRS cair tiap 24 jam. Kemudian, 100 ml dari kultur BAL diinokulasikan ke dalam 2 L MRS cair steril dan diinkubasi pada 37oC selama 24 jam. Setelah inkubasi, untuk mengetahui populasi BAL sebelum proses freeze-drying dihitung dengan cara metode hitungan cawan pada media MRSA.
Inokulasi pellet bakteri pada susu skim
Sebanyak 200 mL kultur dimasukkan dalam tabung sentrifugasi 250 mL steril dan sel dalam kultur dipanen dengan sentrifugasi pada 7 500 x g selama 10 menit, suhu 4oC dengan menggunakan Kubota Highspeed Refrigerated Centrifuge
27
dalam larutan susu skim 5 % sebagai media cryoprotective. Suspensi dipindahkan ke dalam tabung erlenmeyer dan dibekukan pada - 20oC.
Proses freeze-dry isolat L. salivarius sebagai probiotik
Tabung erlenmeyer yang berisi media beku dari suspensi bakteri dalam susu skim dipasangkan di freeze-dryer (Eyela, type FDU-1200, Tokyo, Japan) untuk diambil airnya/desikasi dari freeze-dryer dengan kondisi suhu -47.8oC di bawah vakum 1.12 pa selama minimal 12 jam dan bubuk kering beku ditempatkan ke dalam kemasan plastik tahan panas steril dan diklem dengan zipper hot. Viabilitas sel setelah freeze-drying ditentukan dengan metode hitungan cawan pada media padat MRS.
Tahap IV. Efikasi L. salivarius sebagai Probiotik dalam Pakan terhadap Penampilan dan Kesehatan Ayam serta Komunitas Mikrobiota Ras Pedaging/ Broiler
Tujuan penelitian pada tahap IV adalah untuk mengetahui penampilan dan kesehatan ayam pedaging, komunitas mikroba yang diberi perlakuan pakan dengan penambahan probiotik.
Ternak
Dalam penelitian ini digunakan sebanyak 200 ekor Day Old Chick (DOC) galur Cobb dari Charoen Phokphan (CP 707) dengan rata-rata bobot DOC 42.8±0.21 g, dan memilih hanya jantan saja (sexing) supaya diharapkan tidak terjadi banyak variasi data yang timbul.
Kondisi kandang
Kandang terlebih dahulu dibersihkan dan didesinfeksi untuk menjaga kebersihan dan sanitasi terhadap bakteri patogen. Kandang peliharaan yang digunakan adalah 20 kandang koloni ukuran 1x1x1 meter dengan alas litter menggunakan sekam padi. Masing-masing unit terdiri atas 10 ekor ayam. Setiap unit kandang dilengkapi lampu pemanasan/penerangan 40 watt, tempat pakan, tempat minum. Pada minggu pertama sekam ditutup dengan kertas koran, tempat ransum menggunakan nampan (feeder tray). Ruangan kandang dilengkapi dengan 1 kipas angin besar untuk menjaga kondisi temperatur kandang dan mengusir gas-gas beracun seperti amonia
Pakan ayam
pedaging pada fase starter (3 minggu) dan fase finisher (2 minggu) sesuai dengan Leeson & Summers (2008). Pakan diberikan secara ad libitum dalam bentuk
crumble.
Penelitian dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) dengan 4 macam perlakuan dengan masing 5 ulangan, dan masing-masing ulangan terdiri atas 10 ayam :
R0 = pakan kontrol ( pakan basal, tanpa pemberian antibiotik dan probiotik) R1 = pakan dengan pemberian antibiotik (pakan basal + Bambermicin 0,1 %) R2 = pakan dengan pemberian probiotik kultur tunggal (pakan basal + 1 % kultur
kering L. salivarius CSP004)
R3 = pakan dengan pemberian probiotik kultur campuran (pakan basal + 1 % campuran kultur kering L. salivarius CCM011 , CSP004 dan CVM002).
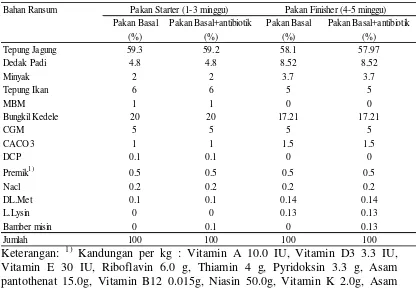
Tabel 1 Susunan pakan perlakuan dalam penelitian pada ayam broiler selama pemeliharaan 5 minggu
Keterangan: 1) Kandungan per kg : Vitamin A 10.0 IU, Vitamin D3 3.3 IU, Vitamin E 30 IU, Riboflavin 6.0 g, Thiamin 4 g, Pyridoksin 3.3 g, Asam pantothenat 15.0g, Vitamin B12 0.015g, Niasin 50.0g, Vitamin K 2.0g, Asam folat 1.0 g, Biotin 0.2g, Mangan 70.0g, Seng 60.0g, Kuprum 8.0 g, Selenium 0.3g, Besi 70.0 g
Bahan Ransum
Pakan Basal Pakan Basal+antibiotik Pakan Basal Pakan Basal+antibiotik
(%) (%) (%) (%)
Tepung Jagung 59.3 59.2 58.1 57.97
Dedak Padi 4.8 4.8 8.52 8.52
Minyak 2 2 3.7 3.7
Tepung Ikan 6 6 5 5
MBM 1 1 0 0
Bungkil Kedele 20 20 17.21 17.21
CGM 5 5 5 5
CACO3 1 1 1.5 1.5
DCP 0.1 0.1 0 0
Premik1) 0.5 0.5 0.5 0.5
Nacl 0.2 0.2 0.2 0.2
DL.Met 0.1 0.1 0.14 0.14
L.Lysin 0 0 0.13 0.13
Bamber misin 0 0.1 0 0.13
Jumlah 100 100 100 100
[image:46.595.84.500.352.642.2]29
Tabel 2 Kandungan nutrisi ransum perlakuan
1)
Hasil analisis Laboratorium
Pelaksanaan penelitian in vivo pada ayam broiler selama 35 hari atau 5 minggu. Pemberian probiotik pada hari ke 1, 2, 3, 7, 14, 21, 28, 35 ( 3 hari pertama dan setelah penimbangan tiap minggunya) dengan jumlah probiotik L. salivarius dalam bubuk kering beku minimal 1.0 x 108 CFU/g dan diberikan 1% dari pakan. Pada perlakuan tanpa probiotik ditambahkan susu skim 5% pada pakannya. Air minum yang diberikan pada semua perlakuan diberi vitamin / vita stress (mengandung 11 vitamin dan 4 elektrolit, non-antibiotic). Berat badan dan pakan konsumsi ayam dicatat mingguan untuk menentukan kinerja ayam dan rasio konversi pakan (FCR). Kematian ayam / mortalitas dicatat setiap hari hingga 5 minggu perlakuan (Amer et al. 2012). Pada minggu ke 5 diambil sampel darahnya untuk ditentukan profil darah dan analisa kolesterol darahnya. Setelah beberapa sampel disembelih juga dilakukan pengambilan sampel untuk penentuan kolesterol dan lemak daging serta analisa organ dalam.
Peubah yang diukur
1. Bobot badan, diperoleh dari penimbangan bobot badan ayam tiap minggu dan dilakukan sampai minggu ke 5
2. Konsumsi pakan, diperoleh dari selisih pakan yang disediakan dengan sisa pakan, dihitung tiap minggu sampai akhir minggu ke 5
3. Konversi pakan, konversi pakan dihitung menggunakan rumus : Nutrisi
P. Basal P. Basal+antibiotik P. Basal P. Basal+antibiotik Pakan starter Pakan Finisher
Berat kering1) 87 88 88 88 -
-Protein kasar1) 19.98 21.2 19.13 21 22 18
Energi bruto (kkal/kg) 1) 4112 4210 4087 4120 -
-Lemak kasar (%) 4.95 4.95 6.64 6.64 -
-Serat kasar (%) 2.87 2.87 3.16 3.16 -
-Ca (%) 0.93 0.93 0.95 0.95 0.95 0.89
P tersedia (%) 0.46 0.46 0.41 0.41 0.45 0.38
Na (%) 0.16 0.16 0.15 0.15 0.22 0.20
Cl (%) 0.21 0.21 0.20 0.20 0.20 0.20
Metionin(%) 0.57 0.57 0.58 0.58 0.50 0.38
Metionin + sistin (%) 0.92 0.92 0.89 0.89 0.95 0.75
Lysin (%) 1.18 1.18 1.15 1.15 1.30 1.00
Asam linoleat 1.98 1.98 2.00 2.00 -
-Pakan Starter (1-3 minggu) Pakan Finisher (4-5 minggu)
Konversi pakan = Rataan konsumsi pakan --- Rataan pertambahan bobot badan
4. Persentase bobot karkas, dihitung dengan menggunakan rumus Persentase karkas (%) = Bobot karkas
--- x 100% Bobot hidup pada akhir penelitian
5. Persentase Mortalitas, dihitung dengan rumus :
Mortalitas (%) = Jumlah ayam yang mati selama penelitian
---x100% Jumlah seluruh ayam pada awal penelitian
6. Profil darah, pengujian dilakukan di Laboratorium Fisiologi, departemen Anatomi, Fisiologi dan Farmakologi, Fak. Kedokteran Hewan – IPB. Pengujian profil hematologi dilakukan dengan metode standard (Jain 1993). Sampel darah diperoleh sebelum pemberian pakan pada pagi hari, diambil dari pembuluh darah vena. Darah dimasukkan ke dalam tabung vakum berheparin. Sampel darah segera dimasukkan ke dalam termos es sebelum dianalisa. Packed cell volume (PCV) dihitung dengan metode
micro hematocrit, konsentrasi hemoglobin (Hb) dengan metode spektrofotometer, Sel darah merah/eritrosit/BDM dan sel darah putih/leukosit/ BDP dihitung dengan metode hematocytometer. Jumlah differensiasi leukosit ditentukan dengan pewarnaan Giemsa pada lapisan tipis dan sel-sel leukosit dihitung dan diklasifikasikan.
7. Analisis kolesterol darah, pengujian dilakukan di Laboratorium Nutrisi dan Ternak Daging dan Kerja, departemen INTP, Fakultas Peternakan, IPB.
8. Analisis kolesterol daging menurut metoda Liebermann-Burchard dilakukan di Laboratorium Terpadu, Depatemen INTP, Fakultas Peternakan, IPB.
9. Analisis lemak daging, pengujian dilakukan di Puslit Sumberdaya hayati