EKSTRAKSI SENYAWA AKTIF ANTIOKSIDAN DARI
LINTAH LAUT (
Discodoris
sp.) ASAL PERAIRAN
KEPULAUAN BELITUNG
Oleh : Rizki Andriyanti
C34050241
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
RINGKASAN
RIZKI ANDRIYANTI. C34050241. Ekstraksi Senyawa Aktif Antioksidan dari Lintah Laut (Discodoris sp.) asal Perairan Kepulauan Belitung. Dibimbing oleh NURJANAH dan ASADATUN ABDULLAH.
Radikal bebas terbentuk secara terus-menerus dalam tubuh manusia, baik melalui pengaruh eksogen maupun endogen. Radikal bebas adalah senyawa kimia yang memiliki satu atau lebih elektron tidak berpasangan di kulit terluar sehingga sangat reaktif dan mampu bereaksi dengan protein, lipid, atau DNA. Reaktivitas radikal bebas ini dapat diredam oleh senyawa antioksidan. Antioksidan sintetik yang berkembang saat ini dikhawatirkan memberi efek samping yang berbahaya bagi kesehatan manusia. Potensi antioksidan alami harus dikembangkan untuk memperoleh antioksidan yang lebih aman dikonsumsi. Salah satu sumber daya perairan yang berpotensi sebagai penghasil antioksidan alami adalah lintah laut (Discodoris sp.).
Tujuan dari penelitian ini adalah mempelajari karakteristik lintah laut dari Perairan Kepulauan Belitung, mempelajari pengaruh perbedaan jenis pelarut terhadap persentase rendemen dan aktivitas antioksidan ekstrak kasar lintah laut, serta menentukan komponen bioaktif yang terdapat pada ekstrak kasar lintah laut. Pada penelitian ini dilakukan (1) pengambilan dan preparasi bahan baku, (2) karakterisasi bahan baku, (3) ekstraksi komponen antioksidan, dan (4) uji ekstrak kasar.
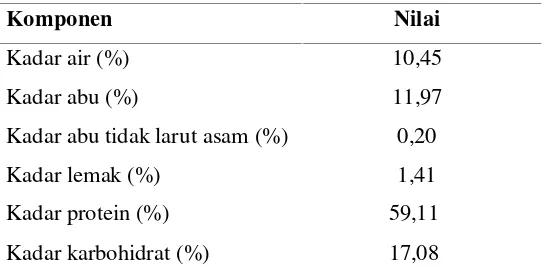
Karakteristik lintah laut (Discodoris sp.) yang berasal dari Perairan Kepulauan Belitung meliputi rendemen daging dan jeroan segar sebesar 41,79 % dan 58,21 %, sedangkan rendemen daging dan jeroan lintah laut kering sebesar 7,20 % dan 8,64 %. Daging lintah laut kering memiliki kadar air (10,45 %), kadar abu (11,97 %), kadar abu tidak larut asam (0,20 %), kadar lemak (1,41 %), kadar protein (59,11 %), dan kadar karbohidrat (17,08 %).Hal ini menunjukkan lintah laut memiliki kandungan gizi yang cukup tinggi.
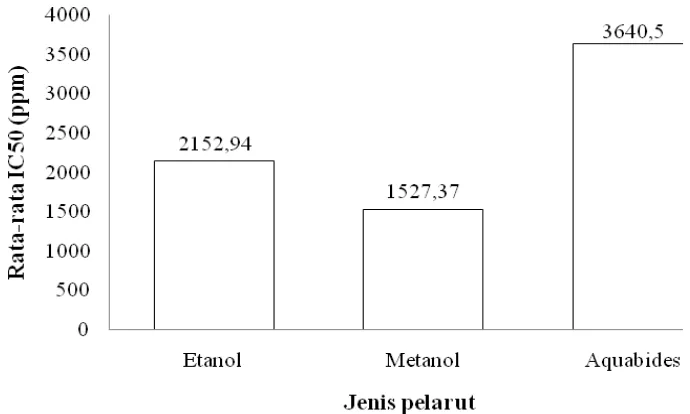
Ekstraksi lintah laut menggunakan tiga pelarut polar (etanol, metanol, dan aquabides) menghasilkan persentase rendemen dan aktivitas antioksidan yang tidak berbeda nyata (P>0,05). Aquabides memiliki keunggulan dari segi keamanannya. Aquabides tidak bersifat toksik dan terbebas dari kontaminan serta garam-garam anorganik sehingga dapat memperkecil peluang ekstrak kasar terkontaminasi bahan lain.
EKSTRAKSI SENYAWA AKTIF ANTIOKSIDAN DARI
LINTAH LAUT (
Discodoris
sp.) ASAL PERAIRAN
KEPULAUAN BELITUNG
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh : Rizki Andriyanti
C34050241
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : EKSTRAKSI SENYAWA AKTIF ANTIOKSIDAN DARI LINTAH LAUT (Discodoris sp.) ASAL PERAIRAN KEPULAUAN BELITUNG
Nama : Rizki Andriyanti
NRP : C34050241
Menyetujui,
Pembimbing I Pembimbing II
Ir. Nurjanah, MS Asadatun Abdullah S.Pi, M.Si NIP : 195910131986012002 NIP : 198304052005012001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Linawati Hardjito, MS NIP : 196205281987032003
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Ekstraksi Senyawa Aktif Antioksidan dari Lintah Laut (Discodoris sp.) asal Perairan Kepulauan Belitung adalah karya sendiri dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2009
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah
melimpahkan Rahmat dan Karunia-Nya, sehingga penulis dapat menyelesaikan
skripsi ini dengan baik.
Skripsi hasil penelitian dengan judul ”Ekstraksi Senyawa Aktif
Antoksidan dari Lintah Laut (Discodoris sp.) asal Perairan Kepulauan Belitung”
merupakan salah satu syarat untuk meraih gelar sarjana di Departemen Teknologi
Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih sebesar-besarnya
kepada pihak-pihak yang telah bersedia membantu dan memberi dukungan,
diantaranya adalah:
1. Ibu Ir. Nurjanah, MS dan Ibu Asadatun Abdullah S.Pi, M.Si sebagai
dosen-dosen pembimbing yang selalu memberikan bimbingan, arahan, saran dan
motivasi kepada penulis dengan penuh kesabaran.
2. Ibu Dr. Tati Nurhayati, S.Pi, M.Si dan Ibu Desniar S.Pi, M.Si sebagai
dosen-dosen penguji yang telah memberi pengarahan dan motivasi agar penulis
dapat menyelasaikan skripsi dengan baik
3. Ibu Dr. Ir. Linawati Hardjito, MS selaku ketua Departemen Teknologi Hasil
Perairan.
4. Bapak Dr. Ir. Agoes M. Jacoeb, Dipl. Biol selaku komisi pendidikan
Departemen Teknologi Hasil Perairan.
5. Bapakku Supratikno dan mama Siti Arifah tersayang, terima kasih untuk doa,
kasih sayang, perhatian, nasihat, restu yang tak terputus, dukungan moral dan
materi sehingga penulis bisa membuktikan kemampuannya.
6. Mbak dan masku (Mbak Nink-Mas Aji, Mbak Yul-Mas Thierry) tercinta yang
selalu memberikan doa, semangat, motivasi, dan materi sehingga penulis
dapat mengembangkan diri selama menempuh ilmu di THP-FPIK, IPB.
7. Windo Sastra yang dan selalu memberikan doa, semangat, nasihat, bantuan,
kasih sayang dan bersedia menemani disaat senang ataupun sedih sehingga
8. Keluarga besar Ibu Wiji Rahayu, S.Pd yang telah memberikan sambutan,
bantuan dan tempat tinggal saat pengambilan sampel di Belitung.
9. Seluruh dosen dan staf Departemen THP, terima kasih atas kerja sama dan
dukungannya.
10. Bu Ema dan Rita, terima kasih atas profesionalisme dan kerjasamanya
sehingga penelitian ini dapat berjalan sesuai harapan.
11. Tyas, Uli, Uut, Pusse’, Prilisa, Seno, Pur, Anne, Vivit, Dewi, Anggi, Tya,
Rodi, Rustam, Micha, Ale, serta temen-teman THP’42 lainnya, terima kasih
atas bantuan, motivasi, pengertian, keceriaan, dan pengalaman berharga
selama ini.
12. Kakak-kakak THP 41 (K’glory, Nichol, Mba’Eka, Mas An’im, K’Yogie,
K’Dhika), serta adik-adik THP 43 dan 44 atas kebersamaan dan semangatnya.
13. Teman-temanku di “aLcaTraZ” (EmBe’, Othel, Windi, Trimi, Mbo’, Asti,
Baki, Mamah, dan Pusse’) beserta alumninya (Putri, Fina dan Yuni) atas
kebersamaan kita selama ini.
14. Terakhir, kepada berbagai pihak yang tidak disebutkan disini, penulis
mengucapkan terima kasih banyak atas bantuan dan kerjasamanya dalam
penulisan skripsi ini.
Penulis menyadari bahwa di dalam penulisan skripsi ini masih terdapat
banyak kekurangan. Oleh karena itu, kritik dan saran yang bersifat membangun
dari semua pihak sangat penulis harapkan demi kemajuan penelitian selanjutnya.
Akhir kata, semoga penulisan skripsi ini dapat bermanfaat dan memberikan
informasi bagi semua pihak yang memerlukan.
Bogor, September 2009
RIWAYAT HIDUP
Penulis dilahirkan di Magelang pada tanggal
6 Maret 1988 sebagai anak terakhir dari tiga bersaudara,
putri pasangan Bapak Supratikno dan Ibu Siti Arifah.
Pendidikan formal penulis dimulai dari TK Mutiara Jakarta
dan lulus pada tahun 1992, kemudian melanjutkan
pendidikan di SDN Kayumanis 01 Pagi Jakarta dan lulus
pada tahun 1999. Pada tahun yang sama, penulis diterima di
SLTPN 7 Jakarta dan lulus pada tahun 2002. Pendidikan selanjutnya ditempuh di
SMUN 31 Jakarta dan lulus pada tahun 2005.
Penulis diterima di Institut Pertanian Bogor pada tahun 2005, Departemen
Teknologi hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan melalui jalur
Undangan Seleksi Masuk IPB (USMI). Selama masa perkuliahan, penulis aktif
menjadi pengurus Himpunan Mahasiswa Teknologi Hasil Perairan
(HIMASILKAN) dan Badan Eksekutif Mahasiswa Fakultas Perikanan dan Ilmu
Kelautan (BEM-C). Penulis juga pernah tercatat sebagai asisten mata kuliah
Pengetahuan Bahan Baku 2008-2009.
Sebagai salah satu syarat meraih gelar sarjana, penulis melakukan
penelitian yang berjudul "Ekstraksi Senyawa Aktif Antioksidan dari Lintah Laut (Discodoris sp.) asal Perairan Kepulauan Belitung". Dibimbing oleh Ibu
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 3
2. TINJAUAN PUSTAKA ... 3
2.1. Lintah Laut (Discodoris sp.) ... 4
2.2. Radikal Bebas ... 6
2.3. Antioksidan ... 8
2.3.1. Fungsi antioksidan ... 8
2.3.2. Sumber antioksidan... 8
2.3.3. Mekanisme kerja antioksidan ... 9
2.4. Ekstraksi senyawa aktif ... 10
2.5. Uji Aktivitas Antioksidan ... 12
2.6. Senyawa Fitokimia ... 13
2.6.1. Alkaloid ... 13
2.6.2. Steroid/Triterpenoid ... 13
2.6.3. Flavonoid ... 14
2.6.4. Saponin... 15
2.6.5. Fenol hidrokuinon ... 15
2.6.6. Karbohidrat ... 16
2.6.7. Gula pereduksi ... 16
2.6.8. Peptida ... 17
2.6.9. Asam amino ... 17
3. METODOLOGI ... 18
3.1. Waktu dan Tempat ... 18
3.2. Bahan dan Alat ... 18
3.3. Metode Penelitian ... 18
3.3.1. Pengambilan dan preparasi bahan baku ... 19
3.3.2. Karakterisasi bahan baku ... 19
3.3.2.2. Uji proksimat ... 19
3.3.3. Ekstraksi komponen antioksidan ... 22
3.3.4. Ekstrak kasar ... 24
3.3.4.1. Uji aktivitas antioksidan (DPPH) ... 24
3.3.4.2. Uji fitokimia ... 24
3.4. Analisis Data ... 26
4. HASIL DAN PEMBAHASAN ... 28
4.1. Karakteristik Bahan Baku ... 28
4.1.1. Rendemen ... 29
4.1.2. Kandungan gizi bahan baku ... 29
4.2. Ekstraksi Komponen Antioksidan... 32
4.3. Ekstrak Kasar ... 35
4.3.1. Aktivitas antioksidan ... 35
4.1.2. Senyawa fitokimia ... 41
5. KESIMPULAN DAN SARAN ... 45
5.1 Kesimpulan ... 45
5.2 Saran ... 45
DAFTAR PUSTAKA ... 46
DAFTAR TABEL
Nomor Teks Halaman
1. Sumber-sumber radikal bebas... 7
2. Beberapa pelarut organik dan sifat fisiknya ... 11
3. Hasil analisis proksimat lintah laut tanpa jeroan kering ... 30
4. Hasil uji aktivitas antioksidan ekstrak kasar lintah laut ... 36
DAFTAR GAMBAR
Nomor Teks Halaman
1. Lintah laut (Discodoris sp.) Perairan Kepulauan Belitung ... 5
2. Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan ... 12
3. Diagram alir ekstraksi dengan pelarut etanol, metanol, dan aquabides ... 23
4. Lintah laut utuh segar, tanpa jeroan kering dan serbuknya ... 28
5. Ekstrak kasar lintah laut ... 34
6. Rendemen ekstrak kasar lintah laut... 34
7. Reaksi radikal bebas DPPH dengan ekstrak kasar lintah laut ... 37
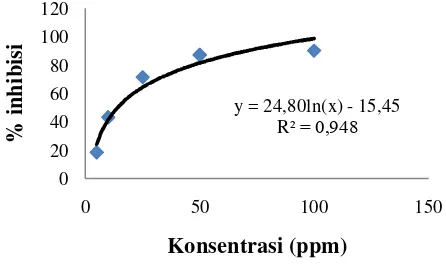
8. Hubungan konsentrasi dengan persentase penghambatan BHT ... 37
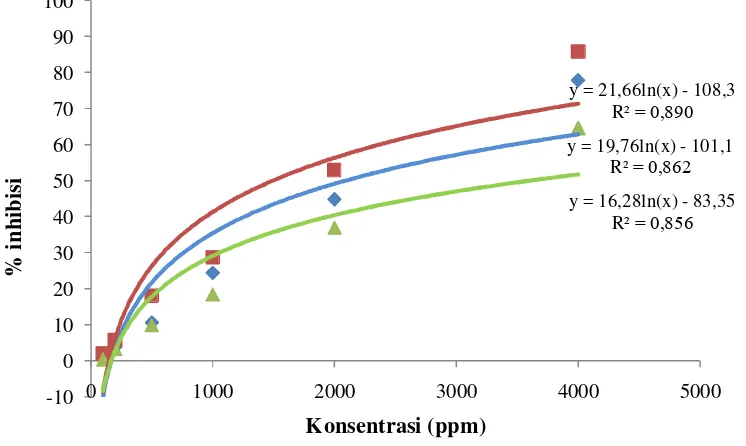
9. Hubungan konsentrasi dengan rata-rata persentase penghambatan ekstrak kasar lintah laut... 38
DAFTAR LAMPIRAN
Nomor Halaman
1. Lokasi pengambilan lintah laut (Discodoris sp.) ... 50
2. Contoh perhitungan hasil proksimat ... 50
3. Data rendemen ekstrak kasar lintah laut... 51
4. Analisis sidik ragam rendemen ekstrak kasar lintah laut berdasarkan jenis pelarut ... 52
5. Contoh perhitungan konsentrasi uji aktivitas antioksidan ... 52
6. Contoh perhitungan nilai IC50 ... 53
7. Hasil uji aktivitas antioksidan ... 54
8. Analisis sidik ragam aktivitas antioksidan ekstrak kasar lintah laut berdasarkan jenis pelarut ... 55
1. PENDAHULUAN
1.1. Latar Belakang
Kondisi dunia yang semakin maju dengan berbagai teknologi telah
mendorong penghuninya menjadi manusia modern. Pola hidup manusia yang
modern memiliki kesadaran yang rendah terhadap pemeliharaan kesehatan dan
lingkungannya, contohnya penggunaan berbagai fasilitas yang dapat
menimbulkan polusi udara. Pencemaran udara kota-kota besar di Indonesia saat
ini telah melebihi standar yang ditetapkan Organisasi Kesehatan Dunia (WHO),
yaitu 50 mikrogram per meter kubik (ìg/m3) (PDPERSI 2009). Pencemaran udara yang telah melebihi standar WHO sangat rawan dalam menimbulkan berbagai
gangguan pada kesehatan.
Sumber polusi dapat berasal dari kendaraan bermotor, industri, asap rokok,
mesin fotocopy, pendingin ruangan maupun kebakaran hutan. Tingkat polusi yang
tinggi dapat menjadi salah satu pemicu terbentuknya radikal bebas sebagai produk
samping dari proses respirasi dan metabolisme normal tubuh. Senyawa radikal
bebas juga dapat terbentuk dalam tubuh melalui proses oksidasi yang berlangsung
pada waktu bernapas, olah raga yang berlebihan maupun peradangan.
Radikal bebas adalah senyawa kimia yang memiliki satu atau lebih
elektron tidak berpasangan di kulit terluar sehingga sangat reaktif dan mampu
bereaksi dengan protein, lipid, atau DNA. Reaksi antara radikal bebas dan
molekul tersebut dapat berujung pada timbulnya suatu penyakit (Sofia 2008).
Radikal bebas pada awalnya diperlukan untuk membunuh mikroorganisme
penyebab infeksi dalam tubuh makhluk hidup. Paparan radikal bebas yang
berlebihan dan secara terus-menerus dapat menyebabkan kerusakan sel,
mengurangi kemampuan sel untuk beradaptasi terhadap lingkungannya, dan pada
akhirnya dapat menyebabkan kematian sel yang memicu terjadinya berbagai jenis
penyakit degeneratif seperti jantung koroner, tekanan darah tinggi, aterosklerosis,
kencing manis dan kanker (PDPERSI 2009). Reaktivitas radikal bebas ini dapat
diredam oleh senyawa antioksidan.
Antioksidan merupakan senyawa yang mampu menghambat oksidasi
elektronnya kepada radikal bebas sehingga dapat menghentikan kerusakan yang
disebabkan oleh radikal bebas. Di dalam tubuh terdapat mekanisme antioksidan
atau antiradikal bebas secara endogenik. Tetapi bila jumlah radikal bebas dalam
tubuh berlebih maka dibutuhkan antioksidan yang berasal dari luar tubuh
(eksogenik) (Pratiwi et al. 2006).
Antioksidan sintetik yang berkembang saat ini dikhawatirkan dapat
memberi efek samping yang berbahaya bagi kesehatan manusia. Tubuh manusia
mempunyai batasan maksimum dalam mentolerir seberapa banyak konsumsi
bahan tambahan makanan setiap hari yang disebut ADI atau Acceptable Daily
Intake. Nilai ADI untuk BHT adalah sebesar 0-0,3 mg/kg bw (WHO 1999;
D’Mello 2003). Kadar maksimum BHT dalam bahan pangan adalah 200 ppm
(Ketaren 1986). Penggunaan antioksidan sintetik pada manusia dalam jangka
panjang dan jumlah berlebihan dapat menyebabkan kerusakan hati
(Ford et al. 1980 diacu dalamNurhikmah 2006). Potensi antioksidan alami harus
dikembangkan untuk memperoleh antioksidan yang lebih aman dikonsumsi. Salah
satu sumber daya perairan yang berpotensi sebagai penghasil antioksidan alami
adalah lintah laut (Discodoris sp.).
Lintah laut merupakan anggota kelompok filum mollusca yang tidak
memiliki cangkang. Fungsi dari cangkang digantikan oleh sistem perlindungan
kimia berupa senyawa aktif dalam tubuhnya (Davies-coleman 2006). Senyawa
aktif ini digunakan lintah laut untuk melindungi diri dari serangan predator
maupun gangguan di lingkungannya.
Masyarakat Bajo di Pulau Buton biasa mengkonsumsi lintah laut sebagai
aprodisiaka dan peningkat stamina tubuh. Penelitian sebelumnya telah dilakukan
terhadap lintah laut yang berasal dari Pulau Buton. Hasil penelitian
Ibrahim (2001) menunjukkan bahwa lintah laut mengandung steroid yang
memiliki aktivitas androgenik dan anabolik. Penelitian Witjaksono (2005)
menunjukkan bahwa ekstrak dan minyak dari lintah laut mengandung sterol, asam
lemak jenuh dan asam lemak tak jenuh. Nurjanah (2009) menambahkan bahwa
lintah laut yang berasal dari perairan Pulau Buton mengandung antioksidan dan
Lintah laut tidak hanya terdapat pada Perairan Pulau Buton. Perairan
Kepulauan Belitung juga memiliki lintah laut yang dikenal dengan nama
“inal-inal”, namun sebagian besar masyarakatnya belum mengetahui akan
keberadaan dan potensi yang dimiliki lintah laut. Hal tersebut mendasari
penelitian ini untuk mengetahui potensi antioksidan yang terdapat dalam lintah
laut dari Perairan Kepulauan Belitung. Hasil penelitian ini diharapkan dapat
memperkaya informasi mengenai kandungan senyawa antioksidan lintah laut yang
dapat bermanfaat untuk bidang pangan, farmasi maupun industri lainnya.
1.2. Tujuan
Tujuan dari penelitian ini adalah (1) mempelajari karakteristik lintah laut
(Discodoris sp.) dari Perairan Kepulauan Belitung, (2) mempelajari pengaruh
perbedaan jenis pelarut terhadap persentase rendemen dan aktivitas antioksidan
ekstrak kasar lintah laut, dan (3) menentukan komponen bioaktif yang terdapat
2. TINJAUAN PUSTAKA
2.1. Lintah Laut (Discodoris sp.)
Lintah laut (Discodoris sp.) merupakan anggota dari kelompok ordo
Nudibranchia. Kata Nudibranch berasal dari Bahasa latin nudus yang berarti
telanjang dan bahasa Yunani brankhia yang berarti insang. Nudibranch tidak
memiliki cangkang, sehingga menggunakan senyawa kimia dalam tubuhnya untuk
mempertahankan diri. Kelompok hewan ini memiliki corak dan warna yang
beraneka ragam, namun beberapa jenis dari hewan ini mempunyai kemampuan
kamuflase yang handal sehingga cukup sulit untuk ditemukan (Sorowako 2008).
Klasifikasi lintah laut secara sistematik menurut Rudman (1999) adalah
sebagai berikut:
Kingdom : Animal
Phylum : Molusca
Kelas : Gastropoda
Sub Kelas : Opistobranchia
Ordo : Nudibranchia
Sub Ordo : Doridina
Famili : Dorididae
Genus : Discodoris sp.
Lintah laut (Discodoris sp.) adalah spesies yang banyak ditemukan di
kepulauan Philipina, Papua New Geunia, Indonesia, Okinawa, Afrika Selatan, dan
Australia. Hewan ini memiliki tubuh yang berwarna coklat kehitam-hitaman
dengan bintik putih dan garis pada bagian atas badannya. Permukaan tubuhnya
licin dan tidak dilindungi oleh lapisan pelindung. Insang-insangnya berjumbaian
di punggung, selain itu hewan ini memiliki kepala bertentakel yang sangat sensitif
terhadap sentuhan, rasa dan bau. Matanya yang kecil hanya bisa melihat sedikit
selain membedakan terang dan gelap (Sorowako 2008). Morfologi lintah laut
Gambar 1. Lintah laut (Discodoris sp.) Perairan Kepulauan Belitung
Lintah laut biasanya terdapat di perairan dangkal berpasir serta terumbu
karang hingga di dasar laut kelam lebih dari satu kilometer dalamnya, nudibranch
berkembang biak baik di perairan hangat maupun dingin dan bahkan di sekeliling
cerobong-cerobong vulkanis yang menyembur di laut dalam (Holland 2009).
Hewan ini hidup dan menempel rapat pada batu-batuan yang berlumpur atau
berpasir dan menghasilkan lendir (mucus) untuk mencegah kekeringan. Bagian
bawahnya dapat bergerak dan menempel pada substrat sehingga gerakannya
lambat (Rudman 1999).
Lintah laut temasuk hewan herbivora, makanannya adalah berbagai alga
baik yang berukuran kecil (fitoplankton/mikroalga) maupun yang berukuran besar
makroalga/rumput laut yang terdiri dari rumput laut coklat (Paeophyceae), merah
(Rodophyceae), dan hijau (Chlorophyceae). Racun yang terdapat pada mangsanya
tidak membahayakan hewan ini, melainkan dapat digunakan sebagai suatu alat
pertahanan terhadap musuh. Banyak nudibranch yang dapat berpindah dari lokasi
pencarian makanan yang satu ke yang lain (Holland 2009).
Kelompok hewan Nudibranch lebih suka menyendiri, dengan kebiasaan
nokturnal serta wilayah pengembaraan yang sempit. Nudibranch dapat melakukan
kamuflase mulai dari warna kusam hingga cemerlang, bukan warna-warna
kontras. Pigmen warnanya mirip spons dipengaruhi oleh substrat edibel tempat
mereka berdiam hewan ini mencium, mengecap, dan merasakan dunia dengan
menggunakan tonjolan-tonjolan sensor di kepala yang disebut rhinophore dan
tentakel-tentakel oral. Sinyal-sinyal kimia digunakan untuk membantu
Nudibranch temasuk hewan hermaprodit, yaitu hewan yang memiliki
organ jantan maupun betina dalam satu individu serta membuahi sesamanya.
Tergantung spesies, pasangan nudibranch meletakkan telurnya dalam bentuk
spiral, pita, atau rumpun kusut, berjumlah dua juta sekali bertelur, namun tidak
semua pembuahannya berhasil (Holland 2009). Ketika organisme ini siap untuk
kawin akan bermigrasi ke daerah pantai yang berbatu dan ditumbuhi subur oleh
tanaman alga atau rumput laut dan menyemprotkan telur dan sperma sekaligus di
sekitar bebatuan tersebut. Telur-telur tersebut akan dibiarkan melayang di sekitar
bebatuan agar terhindar dari predator dan dibiarkan menetas sendiri
(Rudman 1983 diacu dalamWitjaksono 2005).
2.2. Radikal Bebas
Radikal bebas adalah atom atau gugus atom yang memiliki satu atau lebih
elektron tak berpasangan. Adanya elektron tidak berpasangan menyebabkan
senyawa tersebut sangat reaktif mencari pasangan. Radikal ini akan merebut
elektron dari molekul lain yang ada disekitarnya untuk menstabilkan diri,
sehingga senyawa kimia ini sering dihubungkan dengan terjadinya kerusakan sel,
kerusakan jaringan, dan proses penuaan (Fessenden dan Fessenden 1986).
Radikal bebas memiliki reaktivitas yang sangat tinggi. hal ini ditunjukkan
oleh sifatnya yang segera menarik atau menyerang elektron di sekelilingnya.
Reaktivitas radikal bebas merupakan upaya untuk mencari pasangan elektron.
Sebagai dampak dari kerja radikal bebas tersebut, akan terbentuk radikal bebas
baru yang berasal dari atom atau molekul yang elektronnya diambil untuk
berpasangan dengan radikal sebelumnya. Namun, bila dua senyawa radikal
bertemu, elektron-elektron yang tidak berpasangan dari kedua senyawa tersebut
akan bergabung dan membentuk ikatan kovalen yang stabil. Sebaliknya, bila
senyawa radikal bebas bertemu dengan senyawa yang bukan radikal bebas akan
terjadi tiga kemungkinan, yaitu (1) radikal bebas akan memberikan elektron yang
tidak berpasangan (reduktor) kepada senyawa bukan radikal bebas, (2) radikal
bebas menerima elektron (oksidator) dari senyawa bukan radikal bebas,
(3) radikal bebas bergabung dengan senyawa bukan radikal bebas (Winarsi 2007).
Mekanisme reaksi radikal bebas digambarkan sebagai suatu deret
awal radikal bebas (inisiasi), lalu perambatan atau terbentuknya radikal baru
(propagasi), dan tahap terakhir (terminasi), yaitu pemusnahan atau pengubahan
menjadi radikal bebas stabil dan tak reaktif (Fessenden dan Fessenden1986).
Radikal bebas dapat terbentuk melalui dua cara, yaitu secara endogen
(sebagai respon normal proses biokimia internal maupun eksternal) dan secara
eksogen (berasal dari polusi, makanan, serta injeksi ataupun absorpsi melalui
injeksi) (Winarsi 2007). Radikal bebas juga dapat terbentuk dari senyawa lain
yang sebenarnya bukan radikal bebas, tetapi mudah berubah menjadi radikal
bebas. Sumber-sumber radikal bebas yang berasal dari faktor endogen maupun
eksogen dapat dilihat pada Tabel 1.
Tabel 1. Sumber-sumber radikal bebas
Sumber endogen Sumber eksogen
Mitokondria
Fagosit
Xantin oksidase
Reaksi yang melibatkan logam transisi
Jalur arakhidonat
Peroksisom
Olahraga
Peradangan
Iskemia/reperfusi
Rokok
Polutan lingkungan
Radiasi
Obat-obatan tertentu, pestisida
dan anestesi dan larutan industri
Ozon
Sumber: Tuminah (2000)
Radikal bebas dalam jumlah berlebih di dalam tubuh sangat berbahaya
karena menyebabkan kerusakan sel, asam nukleat, protein dan jaringan lemak.
Radikal bebas terbentuk di dalam tubuh akibat produk sampingan proses
metabolisme ataupun karena terdapat radikal bebas dalam tubuh melalui
pernapasan (Dalimarta dan Soedibyo 1998 diacu dalamPratiwi et al. 2006). Akan
tetapi, radikal bebas tidak selalu merugikan. Misalnya, radikal bebas berperan
dalam pencegahan penyakit yang disebabkan karena mikrobia melalui sel-sel
2.3. Antioksidan
Dalam pengertian kimia, senyawa antioksidan adalah senyawa pemberi
elektron (electron donor). Secara biologis, pengertian antioksidan adalah senyawa
yang mampu menangkal atau meredam dampak negatif oksidan dalam tubuh.
Antioksidan bekerja dengan cara mendonorkan satu elektronnya kepada senyawa
yang bersifat oksidan sehingga aktivitas senyawa oksidan tersebut bisa dihambat
(Winarsi 2007).
2.3.1. Fungsi antioksidan
Antioksidan berfungsi untuk menetralisasi radikal bebas, sehingga atom
dan elektron yang tidak berpasangan mendapatkan pasangan elektron dan menjadi
stabil. Keberadaan antioksidan dapat melindungi tubuh dari berbagai macam
penyakit degeneratif dan kanker. Selain itu antioksidan juga membantu menekan
proses penuaan/antiaging (Tapan 2005).
2.3.2. Sumber antioksidan
Sumber-sumber antioksidan dapat dikelompokkan menjadi dua kelompok,
yaitu antioksidan alami (antioksidan hasil ekstraksi bahan alami) dan antioksidan
sintetik (antioksidan yang diperoleh dari hasil sintesa reaksi kimia).
Senyawa-senyawa yang umumnya terkandung dalam antioksidan alami adalah fenol,
polifenol, dan yang paling umum adalah flavonoid (flavonol, isoflavon, flavon,
katekin, flavonon), turunan asam sinamat, tokoferol, dan asam organik polifungsi.
Saat ini tokoferol sudah diproduksi secara sintetik untuk tujuan komersil (Pratt
dan Hudson 1990).
Antioksidan sintetik ditambahkan ke dalam bahan pangan untuk mencegah
ketengikan. Antioksidan sintetik yang banyak digunakan sekarang adalah
senyawa-senyawa fenol yang biasanya agak beracun. Oleh karena itu penambahan
antioksidan ini harus memenuhi beberapa persyaratan, misalnya tidak berbahaya
bagi kesehatan, tidak menimbulkan warna yang tidak diinginkan, efektif pada
konsentrasi rendah, larut dalam lemak, mudah didapat, dan ekonomis. Empat
macam antioksidan sintetik yang sering digunakan adalah Butylated
hydroxyanisole (BHA), Butylated hydroxytoluene (BHT), Propylgallate (PG), dan
2.3.3. Mekanisme kerja antioksidan
Aktivitas penghambatan antioksidan dalam reaksi oksidasi berdasarkan
keseimbangan reaksi keseimbangan reaksi oksidasi reduksi. Molekul antioksidan
akan bereaksi dengan radikal bebas (R*) dan membentuk molekul yang tidak
reaktif (RH) dan dengan demikian reaksi berantai pembentukan radikal bebas
dapat dihentikan (Belitz dan Grosch 1999).
Antioksidan yang baik akan bereaksi dengan radikal bebas segera setelah
senyawa tersebut terbentuk. Mekanisme antioksidan dalam menghambat oksidasi
atau menghentikan reaksi berantai pada radikal bebas dari lemak yang teroksidasi,
dapat disebabkan oleh 4 macam mekanisme reaksi (Ketaren 1986), yaitu
(1) pelepasan hidrogen dari antioksidan, (2) pelepasan elektron dari antioksidan,
(3) addisi lemak ke dalam cincin aromatik pada antioksidan, dan (4) pembentukan
senyawa kompleks antara lemak dan cincin aromatik dari antioksidan.
Berdasarkan mekanisme kerjanya, antioksidan digolongkan menjadi tiga
kelompok, yaitu antioksidan primer, sekunder, dan tersier. Antioksidan primer
disebut juga antioksidan endogenus atau enzimatis. Suatu senyawa dikatakan
sebagai antioksidan primer apabila dapat memberikan atom hidrogen secara cepat
kepada senyawa radikal, kemudian radikal antioksidan yang terbentuk segera
berubah menjadi senyawa yang lebih stabil. Antioksidan primer meliputi enzim
superoksida dismutase (SOD), katalase, dan glutation peroksidase. Sebagai
antioksidan, enzim-enzim tersebut menghambat pembentukan radikal bebas
dengan cara memutus reaksi berantai (polimerisasi), kemudian mengubahnya
menjadi produk yang lebih stabil (Winarsi 2007).
Antioksidan sekunder disebut juga antioksidan eksogenus atau
non-enzimatis. Antioksidan kelompok ini juga disebut sistem pertahanan preventif
dimana terbentuknya senyawa oksigen reaktif dihambat dengan cara pengkelatan
metal, atau dirusak pembentukannya. Kerja antioksidan sekunder yaitu dengan
cara memotong reaksi oksidasi berantai dari radikal bebas atau dengan cara
menangkapnya. Antioksidan sekunder meliputi vitamin e, vitamin C, -karoten,
flavonoid, asam urat, bilirubin, dan albumin (Winarsi 2007).
Kelompok antioksidan tersier meliputi sistem enzim DNA-repair dan
biomolekuler yang rusak akibat reaktivitas radikal bebas. Kerusakan DNA yang
terinduksi senyawa radikal bebas dicirikan oleh rusaknya single dan double stand,
baik gugus basa maupun non-basa (Winarsi 2007).
Dari berbagai jenis antioksidan yang ada, mekanisme kerja serta
kemampuannya sebagai antioksidan sangat bervariasi. Seringkali, kombinasi
beberap jenis antioksidan memberikan perlindungan yang lebih baik (sinergisme)
terhadap oksidasi dibandingkan dengan satu jenis antioksidan saja (Siagian 2002).
2.4. Ekstraksi Senyawa Aktif
Ekstraksi adalah suatu cara untuk memisahkan campuran beberapa
zat menjadi komponen-komponen yang terpisah (Winarno et al. 1973).
Harbone (1987) menambahkan bahwa ekstraksi adalah proses penarikan
komponen atau zat aktif suatu simplisia dengan menggunakan pelarut tertentu.
Proses ekstraksi bertujuan mendapatkan bagian-bagian tertentu dari bahan yang
mengandung komponen-komponen aktif.
Metode ekstraksi yang digunakan tergantung dari beberapa faktor, antara
lain tujuan ekstraksi, skala ekstraksi, sifat-sifat komponen yang akan diekstrak
dan sifat-sifat pelarut yang digunakan. Metode umum ekstraksi yang dapat
dilakukan terdiri dari ekstraksi dengan pelarut, destilasi, supercritical fluid
extraction (SFE), pengepresan mekanik dan sublimasi. Diantara metode-metode
yang telah dilakukan, metode yang banyak digunakan adalah destilasi dan
ekstraksi menggunakan pelarut (Houghton dan Raman 1998).
Ekstraksi menggunakan pelarut dapat dilakukan dengan dua cara, yaitu
aqueous phase dan organic phase. Ekstraksi aqueous phase dilakukan dengan
menggunakan pelarut air, sedangkan organic phase menggunakan pelarut organik
(Winarno et al. 1973). Prinsip metode ekstraksi menggunakan pelarut organik
adalah bahan yang akan diekstrak kontak langsung dengan pelarut pada waktu
tertentu kemudian diikuti dengan pemisahan dari bahan yang telah diekstrak
(Houghton dan Raman 1998).
Suatu senyawa menunjukkan kelarutan yang berbeda-beda dalam pelarut
yang berbeda. Bahan dan senyawa kimia akan mudah larut pada pelarut yang
relatif sama kepolarannya. Derajat polaritas tergantung pada tahapan dielektrik,
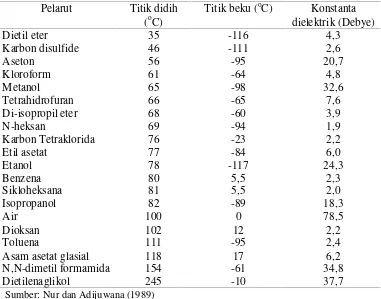
Adijuwana 1989). Beberapa pelarut organik dan sifat fisiknya dapat dilihat pada
Tabel 2.
Tabel 2. Beberapa pelarut organik dan sifat fisiknya
Pelarut Titik didih
Sumber: Nur dan Adijuwana (1989)
Pelarut yang bersifat polar, mampu mengekstrak senyawa alkaloid
kuartener, komponen fenolik, karotenoid, tannin, gula, asam amino, dan glikosida
(Harborne 1987). Hasil ekstrak yang diperoleh akan tergantung pada beberapa
faktor antara lain kondisi alamiah senyawa tersebut, metode ekstraksi yang
digunakan, ukuran partikel sampel, kondisi dan waktu penyimpanan, lama
waktu ekstraksi, dan perbandingan jumlah pelarut terhadap jumlah sampel
(Darusman et al. 1995).
Jenis dan mutu pelarut yang digunakan menentukan keberhasilan proses
ekstraksi. Pelarut yang digunakan harus dapat melarutkan zat yang diinginkannya,
mempunyai titik didih yang rendah, murah, tidak toksik, dan mudah terbakar
(Ketaren 1986). Selain itu, keberhasilan ekstraksi juga tergantung pada banyaknya
berulang-ulang dengan jumlah pelarut yang sedikit-sedikit. Efisiensi ekstraksi
dapat ditingkatkan dengan menggunakan luas kontak yang besar (Khopkar 2003).
2.5. Uji Aktivitas Antioksidan
Metode yang umum digunakan untuk menguji aktivitas antioksidan suatu
bahan adalah dengan menggunakan radikal bebas diphenylpicrylhydrazyl (DPPH).
DPPH adalah radikal bebas yang bersifat stabil dan beraktivitas dengan cara
mendelokasi elektron bebas pada suatu molekul, sehingga molekul tersebut tidak
reaktif sebagaimana radikal bebas yang lain. Proses delokalisasi ini ditunjukkan
dengan adanya warna ungu (violet) pekat yang dapat dikarakterisasi pada
pita absorbansi (Molyneux 2004).
Pengukuran aktivitas antioksidan dengan metode DPPH menggunakan
prinsip spektrofotometri. Senyawa DPPH (dalam metanol) berwarna ungu tua
terdeteksi pada panjang gelombang sinar tampak sekitar 517 nm. Suatu senyawa
dapat dikatakan memiliki aktivitas antioksidan apabila senyawa tersebut mampu
mendonorkan atom hidrogennya untuk berikatan dengan DPPH membentuk
DPPH tereduksi, ditandai dengan semakin hilangnya warna ungu (menjadi kuning
pucat) (Molyneux 2004). Prinsip penurunan nilai absorbansi digunakan untuk
mengetahui kapasitas antioksidan suatu senyawa. Struktur DPPH dan DPPH
tereduksi hasil reaksi dengan antioksidan dapat dilihat pada Gambar 2.
Diphenylpicrylhydrazyl (radikal bebas) Diphenylpicrylhydrazine (non radikal)
Gambar 2. Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan
Parameter untuk menginterpretasikan hasil pengujian dengan metode
DPPH adalah IC50 (inhibition concentration). IC50 merupakan konsentrasi larutan
substrata atau sampel yang akan menyebabkan reduksi terhadap aktivitas DPPH
sebesar 50 % (Molyneux 2004). Semakin kecil nilai IC50 berarti semakin tinggi
sangat kuat jika nilai IC50 kurang dari 0,05 mg/ml, kuat untuk IC50 antara
0,05-0,1 mg/ml, sedang jika IC50 bernilai 0,101-0,150 mg/ml, dan lemah jika IC50
bernilai 0,150-0,200 mg/ml.
2.6. Senyawa Fitokimia
Fitokimia adalah cabang ilmu yang mempelajari senyawa organik yang
dibentuk dan ditimbun oleh tumbuhan, yaitu mencakup struktur kimia, biosintesis,
perubahan serta metabolisme, penyebaran secara alami, dan fungsi biologis.
Senyawa fitokimia bukanlah zat gizi, namun kehadirannya dalam tubuh dapat
membuat tubuh lebih sehat, lebih kuat dan lebih bugar (Astawan dan Kasih 2008).
Senyawa fitokimia berpotensi mencegah bebagai penyakit seperti penyakit
degeneratif dan kardiovaskuler (Harborne 1987).
2.6.1. Alkaloid
Alkaloid adalah senyawa kimia tanaman hasil metabolit sekunder yang
terbentuk berdasarkan prinsip pembentukan campuran (Sirait 2007). Pada
umumnya alkaloid merupakan senyawa yang bersifat basa (adanya gugus amino)
yang mengandung satu atau lebih atom nitrogen dalam bentuk gabungan sebagai
bagian dari sistem siklik (Harborne 1987).
Kelompok senyawa alkaloid terdiri dari alkaloid sesungguhnya,
protoalkaloid, dan pseudoalkaloid. Alkaloid sesungguhnya adalah racun, senyawa
tersebut menunjukkan aktivitas phisiologi yang luas, hampir tanpa terkecuali
bersifat basa, lazim mengandung nitrogen dalam cincin heterosiklis, diturunkan
dari asam amino, dan biasanya terdapat dalam tanaman sebagai garam asam
organik. Protoalkaloid merupakan amin yang relatif sederhana dimana dalam
nitrogen asam amino tidak terdapat cincin heterosiklis, dan diperoleh berdasarkan
biosintesis dari asam amino yang bersifat basa. Pseudoalkaloid tidak diturunkan
dari prekursor asam amino, dan biasanya senyawa ini bersifat basa
(Sastrohamidjojo 1996).
2.6.2. Steroid/Triterpenoid
Triterpenoid adalah senyawa dengan kerangka karbon yang disusun dari
6 unit isoprena dan dibuat secara biosintesis dari skualen, suatu C30 hidrokarbon
siklik. Senyawa tersebut tidak berwarna, kristalin, sering mempunyai titik lebur
Triterpenoid dapat dibagi menjadi empat kelompok senyawa, yaitu triterpen
sebenarnya, steroid, saponin, dan glikosida jantung (cardiac glycoside). Beberapa
triterpen dikenal dengan rasanya, terutama rasa pahit (Sirait 2007).
Steroid merupakan golongan dari senyawa triterpenoid. Hormon steroid
dalam mamalia dibiosintesis dari kolesterol. Steroid berupa padatan kristal yang
berwarna putih dan dapat berbentuk jarum kecil, lembaran, lempengan atau
partikel amorf tergantung pelarut yang digunakan dalam kristalisasi. Steroid
mempunyai 17 atom karbon atau lebih sehingga golongan senyawa ini cenderung
tidak larut dalam air (Wilson dan Gisvold 1982).
2.6.3. Flavonoid
Senyawa flavonoid adalah senyawa yang mengandung C15 terdiri atas dua
inti fenolat yang dihubungkan dengan tiga satuan karbon. Cincin A memiliki
karakteristik bentuk hidroksilasi phloroglusinol atau resorsinol, dan cincin B
biasanya 4-,3,4-, atau 3,4,5-terhidroksilasi (Sastrohamidjojo 1996).
Flavonoid terdapat dalam tumbuhan, terikat pada gula sebagai glikosida
dan aglikon flavonoid. Penggolongan jenis flavonoid dalam jaringan tumbuhan
mula-mula didasarkan pada telaah sifat kelarutan dan reaksi warna
(Harbone 1987). Flavonoid dapat diklasifikasikan menjadi flavon, flavonol,
flavonon, flavononon, isoflavon, calkon, dihidrokalkon, auron, antosianidin,
katekin, dan flavan-3,4-diol (Sirait 2007).
Flavonoid memberikan konstribusi keindahan dan kesemarakan pada
buah-buahan di alam. Flavon memberikan warna kuning atau jingga, antosianin
memberikan warna merah, ungu atau biru, yaitu semua warna yang terdapat pada
pelangi kecuali warna hijau (Sastrohamidjojo 1996). Flavonoid pada tumbuhan
berfungsi dalam pengaturan tumbuh, pengaturan fotosintesis, kerja antimikroba
dan antivirus, dan kerja terhadap serangga (Robinson 1995).
Kegunaan flavonoid juga ditemukan dalam kehidupan manusia. Flavon
bekerja sebagai stimulan pada jantung, hesperidin mempengaruhi pembuluh darah
kapiler. Flavon terhidroksilasi bekerja sebagai diuretik dan sebagai antioksidan
2.6.4. Saponin
Saponin adalah senyawa aktif permukaan kuat yang menimbulkan busa
jika dikocok dalam air dan pada konsentrasi rendah sering menyebabkan
hemolisis sel darah merah (Robinson 1995). Sifatnya sebagai senyawa aktif
permukaan disebabkan adanya kombinasi antara aglikon lipofilik dengan gula
yang bersifat hidrofilik (Houghton dan Raman 1998).
Terdapat dua jenis saponin, yaitu glikosida triterpenoid alkohol dan
glikosida struktur steroid tertentu yang mempunyai rantai samping spiroketal.
Kedua jenis ini larut dalam air dan etanol tetapi tidak larut dalam eter. Aglikonnya
yang disebut sapogenin diperoleh dengan hidrolisis dalam suasana asam atau
hidrolisis memakai enzim, dan tanpa bagian gula ciri kelarutannya sama dengan
ciri sterol lain (Robinson 1995).
Saponin menyebabkan stimulasi pada jaringan tertentu misalnya, pada
epitel hidung, bronkus, ginjal, dan sebagainya. Stimulasi pada ginjal diperkirakan
menimbulkan efek diuretika. Sifat menurunkan tegangan muka yang ditimbulkan
oleh saponin dapat dihubungkan dengan daya ekspektoransia. Dengan sifat ini
lendir akan dilunakkan atau dicairkan. Saponin bisa juga sebagai prekursor
hormon steroid (Sirait 2007).
2.6.5. Fenol hidrokuinon
Fenol meliputi berbagai senyawa yang berasal dari tumbuhan dan
mempunyai ciri sama yaitu cincin aromatik yang mengandung satu atau dua gugus
hidroksil. Flavonoid merupakan golongan fenol yang terbesar, selain itu juga
terdapat fenol monosiklik sederhana, fenilpropanoid, dan kuinon fenolik
(Harborne 1987).
Kuinon adalah senyawa berwarna dan mempunyai kromofor dasar, seperti
kromofor pada benzokuinon, yang terdiri atas dua gugus karbonil yang
berkonjugasi dengan dua ikatan rangkap karbon-karbon. Untuk tujuan identifikasi,
kuinon dapat dibagi menjadi empat kelompok, yaitu benzokuinon, naftokuinon,
antrakuinon dan kuinon isoprenoid. Tiga kelompok pertama biasanya
terhidroksilasi dan bersifat senyawa fenol (Harborne 1987).
Polifenol memiliki kemampuan untuk berikatan dengan metabolit lain
sehingga menghambat mutagenesis dan karsinogenesis. Selain itu, polifenol
memiliki sifat antioksidatif dan antitumor (Mukhopadhiay 2000).
2.6.6. Karbohidrat
Karbohidrat merupakan sumber energi utama bagi manusia dan hewan
yang berasal dari tumbuh-tumbuhan. Melalui proses fotosintesis, klorofil tanaman
dengan sinar matahari mampu membentuk karbohidrat dari karbon dioksida (CO2)
yang berasal dari udara dan air dari tanah. Proses fotosintesis menghasilkan
karbohidrat sederhana glukosa dan oksigen yang dilepas di udara
(Almatsier 2006).
Karbohidrat dapat dikelompokkan menjadi monosakarida, oligosakarida
serta polisakarida. Monosakarida merupakan suatu molekul yang dapat terdiri dari
lima atau enam atom C, sedangkan oligosakarida merupakan polimer dari 2-10
monosakarida, dan pada umumnya polisakarida merupakan polimer yang terdiri
lebih dari 10 monomer monosakarida (Winarno 1997).
Karbohidrat mempunyai peranan penting untuk mencegah pemecahan
protein tubuh yang berlebihan yang berakibat kepada penurunan fungsi protein
sebagai enzim dan fungsi antibodi, timbulnya ketosis, kehilangan mineral dan
berguna untuk membantu metabolisme lemak dan protein (Budiyanto 2002).
2.6.7. Gula pereduksi
Sifat pereduksi dari suatu molekul gula ditentukan oleh ada atau tidaknya
gugus hidroksil (OH) bebas yang reaktif. Gugus hidroksil yang reaktif pada
glukosa (aldosa) biasanya terletak pada karbon nomor satu (anomerik), sedangkan
pada fruktosa (ketosa) terletak pada karbon nomor dua. Sukrosa tidak mempunyai
gugus OH bebas yang reaktif karena keduanya sudah saling terikat, sedangkan
laktosa mempunyai OH bebas pada atom C nomor satu pada gugus glukosanya
(Winarno 1997).
Sifat sebagai reduktor pada monosakarida dan beberapa disakarida
disebabkan oleh adanya gugus aldehida atau keton bebas dalam molekul
karbohidrat. Sifat ini dapat digunakan untuk keperluan identifikasi karbohidrat
maupun analisis kuantitatif. Pereaksi Benedict berupa larutan yang mengandung
kuprisulfat, natrium karbonat dan natrium sitrat. Glukosa dapat mereduksi ion
Adanya natrium karbonat dan natrium sitrat membuat pereaksi Benedict bersifat
basa lemah. Endapan yang terbentuk dapat berwarna hijau, kuning atau merah
bata. Warna endapan ini tergantung pada konsentrasi karbohidrat yang diperiksa
(Poedjiadi 1994).
2.6.8. Peptida
Peptida merupakan hasil polikondensasi asam amino. Gugus karbonil dari
satu asam amino berikatan dengan gugus asam amino lain membentuk ikatan
amida atau ikatan peptida. Pengertian peptida biasanya untuk menyatakan polimer
yang memiliki berat molekul lebih rendah dari 5000. Peptida dapat dihidrolisis
sebagian menjadi protein, juga senyawa yang mengandung asam amino
non-protein (Sastrohamidjojo 1996).
Dipeptida diturunkan dari dua asam amino tripeptida dari tiga asam amino,
dan seterusnya. Siklisasi dipeptida menghasilkan 2,5-dioksopi-perazin dan
senyawa sejenisnya sering disintesis oleh mikroorganisme (Sastrohamidjojo
1996). Dipeptida masih mempunyai gugus amino dan karboksil bebas sehingga
dapat bereaksi dengan dipeptida-dipeptida lain membentuk polipeptida dan
akhirnya membentuk molekul protein (Winarno 1997).
2.6.9. Asam amino
Asam amino adalah asam karboksilat yang mempunyai
sekurang-kurangnya satu gugus amino. Kebanyakan asam amino alam mempunyai rumus
umum RCH(NH3+)CO2- (Robinson 1995). Semua asam amino berkonfigurasi á
dan mempunyai konfigurasi L kecuali glisin yang tidak mempunyai atom C
asimetrik. Hanya asam amino L yang merupakan komponen protein
(Winarno 1997).
Sebagian besar sifat fisika asam amino ditentukan oleh struktur ion
dwikutub. Kelompok asam amino lebih mudah larut dalam air daripada dalam
pelarut organik. Asam amino membentuk garam dengan asam atau basa karena
bersifat amfoter (Robinson 1995). Derajat ionisasi dari asam amino sangat
dipengaruhi oleh pH. Pada pH yang rendah misalnya pada pH 1,0 gugus
karboksilnya tidak terdisosiasi, sedang gugus aminonya menjadi ion. Pada pH
yang tinggi misalnya pada pH 11,0 karboksilnya terdisosiasi sedang gugusan
3. METODOLOGI
3.1. Waktu dan Tempat
Penelitian ini dilakukan pada bulan April sampai Juli 2009. Lintah laut
diambil dari perairan Tanjung Binga Kepulauan Belitung. Analisis lintah laut
bertempat di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi
Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Biologi
Hewan, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi-LPPM, serta
Laboratorium Basah Pusat Studi Biofarmaka, Institut Pertanian Bogor.
3.2. Alat dan Bahan
Alat-alat yang digunakan antara lain pisau, timbangan digital, timbangan
analitik, cawan porselin, oven, desikator, tanur pengabuan, labu Kjeldahl,
kondensor, erlenmeyer, kapas, alat soxhlet, water bath shaker, kertas saring
whatman 42, evaporator vakum putar Buchi Rotavapor R-205, botol ekstrak,
freezer, tabung reaksi, pipet tetes, pipet volumetrik, kompor listrik, pipet mikro,
inkubator, spektrofotometer UV-VIS Hitachi U-2800.
Bahan yang digunakan terdiri dari bahan utama dan bahan pembantu.
Bahan utama yang digunakan pada penelitian ini adalah lintah laut (Discodoris
sp.) segar yang telah dikeringkan dengan panas matahari. Bahan pembantu yang
digunakan antara lain air, aquades, H2SO4, selenium, NaOH 40 %, H3BO3, methyl
red, brom creosol green, HCl 0,1 %, pelarut lemak, asam klorida 2 N,
metanol p.a, etanol p.a, aquabides, radikal bebas DPPH (1,1-difenil
-2-pikrilhidrazil), BHT (Butylated Hydroxytoluena) sebagai antioksidan
pembanding, kloroform p.a, anhidrat asetat, asam sulfat pekat, pereaksi
Dragendorff, pereaksi wagner, pereaksi Meyer, serbuk magnesium, HCl 37 %,
etanol 70 %, FeCl3 5 %, pereaksi molisch, pereaksi benedict, pereaksi biuret, dan
larutan ninhidrin 0,1 %.
3.3. Metode Penelitian
Penelitian ini dilakukan melalui empat tahap, yaitu (1) pengambilan dan
preparasi bahan baku, (2) karakterisasi bahan baku, (3) ekstraksi komponen
3.3.1. Pengambilan dan preparasi bahan baku
Bahan baku lintah laut (Discodoris sp.) diambil dari Perairan Tanjung
Binga Kepulauan Belitung. Lintah laut ditemukan di pinggir pantai yang terdapat
pasir dan karang-karang mati. Lintah laut diambil pada pagi hari sekitar pukul
9.00-11.00 wib saat air laut surut. Pengambilan lintah laut dilakukan saat air laut
surut karena saat air pasang sangat sulit untuk menemukan keberadaan lintah laut.
Ukuran panjang lintah laut yang digunakan berkisar 3-6 cm.
Daging lintah laut dipisahkan dari jeroannya kemudian dicuci dengan air
bersih untuk menghilangkan benda-benda asing yang masih menempel seperti
pasir, kerikil dan kotoran lainnya. Setelah bersih, daging lintah laut dikeringkan di
bawah sinar matahari selama 2-3 hari. Lintah laut ditimbang berat utuhnya serta
berat sebelum dan sesudah pengeringan untuk mengetahui rendemennya.
Lintah laut tanpa jeroan yang telah kering dihancurkan dengan
menggunakan mortar dan blender sehingga diperoleh bentuk serbuk. Serbuk lintah
laut tanpa jeroan inilah yang akan digunakan dalam analisis proksimat dan proses
ekstraksi dengan pelarut polar.
3.3.2. Karakterisasi bahan baku
Karakterisasi lintah laut dilakukan melalui perhitungan rendemen dan uji
proksimat.
3.3.2.1. Rendemen
Perhitungan rendemen digunakan untuk mengetahui persentase rendemen
daging dan jeroan lintah laut baik segar ataupun kering. Adapun perumusan
matematiknya adalah sebagai berikut:
3.3.2.2. Uji proksimat
Analisis proksimat dilakukan terhadap lintah laut yang telah dibuang
jeroannya dan dikeringkan menggunakan sinar matahari, kemudian dihaluskan
menggunakan mortar dan blender sehingga diperoleh sampel dalam bentuk
serbuk. Analisis proksimat yang dilakukan adalah: % 100 utuh laut lintah bobot
daging bobot (%)
1) Kadar air (AOAC 1995)
Tahap pertama yang dilakukan untuk menganalisis kadar air adalah
mengeringkan cawa porselen dalam oven pada suhu 102-105 oC selama 30 menit.
Cawan tersebut diletakkan dalam desikator (kurang lebih 30 menit) hingga dingin
kemudian ditimbang hingga beratnya konstan, kemudian cawan dan daging lintah
laut sebanyak 1-2 gram ditimbang setelah terlebih dahulu dihomogenkan. Cawan
tersebut dimasukkan ke dalam oven dengan suhu 102-105 oC selama 6 jam.
Cawan tersebut didinginkan dalam desikator dan kemudian ditimbang.
Kadar air ditentukan dengan rumus:
2) Kadar abu (AOAC 1995)
Cawan abu porselen dimasukkan dalam tungku pengabuan selama kurang
lebih 1 jam. Setelah itu cawan abu porselen tersebut didinginkan dalam desikator
dan ditimbang berat kosongnya. Daging lintah laut sebanyak 1-2 gram
dimasukkan ke dalam cawan abu porselen, kemudian diletakkan dalam tungku
pengabuan hingga suhu 600 oC. Proses pengabuan dilakukan sampai diperoleh
abu berwarna abu-abu. Setelah itu cawan abu porselen didinginkan selama
30 menit dan ditimbang beratnya.
Kadar abu ditentukan dengan rumus:
3) Analisis abu tidak larut asam (FMC Corp. 1977)
Abu yang diperoleh dari penetapan kadar abu total dididihkan dengan
25 ml HCl 10 % selama lima menit. Bahan-bahan yang tidak terlarut disaring
menggunakan kertas saring tak berabu, lalu didinginkan dalam desikator untuk
4) Kadar protein (AOAC 1995)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap
yaitu destruksi, destilasi, dan titrasi.
(1)Tahap destruksi
Daging lintah laut ditimbang sebanyak 0,1 gram, kemudian
dimasukkan ke dalam tabung kjeltac. Selanjutnya ditambahkan selenium
dan 3 ml H2SO4 ke dalam tabung tersebut. Tabung yang berisi larutan
tersebut dimasukkan ke dalam alat pemanas dengan suhu 410 oC. Proses
destruksi dilakukan sampai larutan berwarna bening.
(2)Tahap destilasi
Isi labu dituangkan ke dalam labu destilasi, lalu ditambahkan
dengan aquades 50 ml. Air bilasan juga dimasukkan ke dalam alat
destilasi dan ditambahkan larutan NaOH 40 % sebanyak 20 ml.
Cairan dalam ujung tabung kondensor ditampung dalam
erlenmeyer 125 ml berisi larutan H3BO3 dan 3 tetes indikator (cairan
methyl red dan brom creosol green) yang ada di bawah kondensor.
Destilasi dilakukan sampai diperoleh 200 ml destilat yang bercampur
dengan H3BO3 dan indikator dalam erlenmeyer.
(3)Tahap titrasi
Titrasi dilakukan dengan menggunakan HCl 0,1 N sampai warna
larutan erlenmeyer berubah warna menjadi pink.
Kadar protein ditentukan dengan rumus:
5) Kadar lemak (AOAC 1995)
Penentuan kadar lemak dilakukan dengan menggunakan metode ekstraksi
soxhlet. Daging lintah laut sebanyak 2 gram dimasukkan ke dalam kertas saring
dan dimasukkan ke dalam selongsong lemak, kemudian dimasukkan ke dalam
labu lemak yang sudah ditimbang berat tetapnya dan disambungkan dengan (ml HCl - ml HCl blanko) 0,1 N HCl 14,007
% N 100 %
mg sampel
Kadar protein % N 6,25
tabung soxhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung
soxhlet dan disiram dengan pelarut lemak. Tabung ekstraksi dipasang pada alat
destilasi soxhlet, lalau dipanaskan pada suhu 40 oC dengan menggunakan
pemanas listrik selama 16 jam. Pelarut lemak yang ada dalam labu lemak
didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan
tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke
dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105
o
C, setelah itu labu didinginkan dalam desikator sampai beratnya konstan.
Kadar lemak ditentukan dengan rumus:
3.3.3. Ekstraksi komponen antioksidan
Ekstraksi dilakukan untuk menghasilkan ekstrak kasar lintah laut dengan
menggunakan pelarut. Komponen antioksidan pada lintah laut diperoleh melalui
ekstraksi tunggal dengan menggunakan tiga pelarut polar yang berbeda, yaitu
metanol, etanol dan aquabides.
Lintah laut tanpa jeroan kering yang telah dihancurkan ditimbang beratnya
50 gram, kemudian dimasukkan dalam erlenmeyer. Masing-masing pelarut
metanol dan etanol ditambahkan sampai sampel terendam dengan perbandingan
bahan dan pelarut 1:3 (w/v). Erlenmeyer ditutup dengan kapas dan aluminium foil
untuk mencegah penguapan dari pelarut. Sampel dimaserasi menggunakan shaker
LED Orbitselama 5x24 jam. Setiap 24 jam, hasil maserasi disaring dengan kertas
saring whatman 42 untuk memisahkan filtrat dengan ampasnya.
Ekstraksi dengan pelarut aquabides dilakukan dengan memanaskan
aquabides sebanyak 750 ml dalam panci kaca hingga suhu 100 oC. Lintah laut
tanpa jeroan kering yang telah dihancurkan ditambahkan ke dalam panci kaca
sebanyak 50 gr sehingga diperoleh perbandingan bahan dan pelarut 1:15 (w/v).
Sampel dan pelarut dipanaskan selama 20 menit dengan selalu diaduk. Setelah
dingin, sampel disaring dengan menggunakan kain katun dilanjutkan dengan
kertas saring whatman 42 untuk memisahkan filtrat dengan ampasnya.
Filtrat dari masing-masing pelarut dimasukkan dalam erlenmeyer dan
maserasi menggunakan pelarut etanol dan metanol dilakukan dengan evaporator
vakum putar Buchi Rotavator R-205 pada suhu 37 oC, sedangkan filtrat aquabides
dievaporasi pada suhu 54 oC sehingga diperoleh ekstrak kasar. Ekstrak kasar ini
dimasukkan dalam botol ekstrak untuk dilakukan uji aktivitas antioksidan dengan
metode DPPH (Blois 1958 diacu dalam Molyneux 2004) dan uji fitokimia secara
kualitatif (Harborne 1987). Diagram alir proses ekstraksi komponen antioksidan
menggunakan pelarut etanol, metanol, dan aquabides dapat dilihat pada Gambar 3.
Gambar 3. Diagram alir ekstraksi dengan pelarut etanol, metanol (Pramadhany 2006 yang dimodifikasi*), dan aquabides (Anesini et al. 2005 yang dimodifikasi*)
3.3.4. Ekstrak kasar
Analisis yang dilakukan terhadap ekstrak kasar menggunakan dua uji,
yaitu uji aktivitas antioksidan (DPPH) untuk mengetahui aktivitas antioksidan dari
ekstrak masing-masing pelarut, dan uji fitokimia untuk mengetahui senyawa
kimia yang terdapat dalam ekstrak lintah laut.
Lintah laut tanpa jeroan
Penimbangan (50 g)*
Maserasi 5x24 jam
dengan etanol
150 ml (m/v)*
Penyaringan
Filtrat Residu
Evaporasi
Ekstrak kasar
Pemanasan selama 20 menit
dalam pelarutaquabides
750 ml (m/v)* suhu 100 oC
Maserasi 5x24 jam
dengan metanol
3.3.4.1. Uji aktivitas antioksidan (DPPH) (Blois 1959 diacu dalam Molyneux 2004)
Ekstrak kasar lintah laut yang diperoleh dari proses ekstraksi dengan
metanol p.a, etanol p.a, dan aquabides dilarutkan dalam metanol p.a dengan
konsentrasi 100, 200, 500, 1000, 2000 dan 4000 ppm. Antioksidan sintetik BHT
digunakan sebagai pembanding dengan konsentrasi 5, 10, 25, 50, da 100 ppm.
Larutan pereaksi DPPH yang digunakan dibuat dengan melarutkan DPPH dalam
metanol p.a dengan konsentrasi 1 mM, yang dibuat segar dan dijaga pada suhu
rendah serta terlindung dari cahaya. Sebanyak 4 ml larutan uji atau pembanding
direaksikan dengan 1 ml larutan DPPH dalam tabung reaksi. Campuran tersebut
diinkubasi pada suhu 37 oC selama 30 menit, kemudian diukur absorbansinya
dengan menggunakan spektrofotometri UV-VIS Hitachi U-2800 pada panjang
gelombang 517 nm. Larutan standar dibuat dengan mencampur 4 ml metanol p.a
dengan 1 ml DPPH. Aktivitas antioksidan masing-masing sampel dan BHT
dinyatakan dengan persentase penghambatan radikal bebas yang dihitung dengan
rumus:
Nilai konsentrasi dan hambatan ekstrak diplot masing-masing pada sumbu
x dan y. Persamaan garis yang diperoleh dalam bentuk y = bLn(x) + a digunakan
untuk mencari nilai IC (inhibitor concentration), dengan menyatakan nilai y
sebesar 50 dan nilai x sebagai IC50. Nilai IC50 menyatakan konsentrasi larutan
sampel yang dibutuhkan untuk mereduksi DPPH sebesar 50 %.
3.3.4.2. Uji fitokimia (Harborne 1987)
Uji fitokimia dilakukan untuk menentukan komponen bioaktif yang
terdapat pada ekstrak kasar lintah laut masing-masing pelarut. Uji fitokimia yang
dilakukan terdiri dari uji alkaloid, steroid/triterpenoid, saponin, flavonoid, fenol
hidrokuinon, molisch, benedict, biuret, ninhidrin. Metode uji didasarkan pada
Harborne (1987).
a) Uji Alkaloid
Sebanyak 1 gr sampel dilarutkan dalam beberapa tetes asam sulfat 2 N
dan Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk
endapan putih kekuningan, dengan pereaksi Wagner membentuk endapan putih
kekuningan, dengan pereaksi Wagner membentuk endapan coklat dan dengan
pereaksi Dragendorff membentuk endapan merah sampai jingga.
b) Uji Steroid/triterpenoid
Sebanyak 1 gr sampel dilarutkan dalam 2 ml kloroform dalam tabung
reaksi. Anhidrida asetat sebanyak 10 tetes dan asam sulfat pekat sebanyak 3 tetes
ditambahkan ke dalam campuran tersebut. Hasil uji positif sampel mengandung
steroid dan triterpenoid yaitu terbentuknya larutan berwarna merah untuk pertama
kali kemudian berubah menjadi biru dan hijau.
c) Uji Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil
selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan
sampel mengandung saponin.
d) Uji Flavonoid
Sebanyak 1 gr sampel ditambah serbuk magnesium 0,1 mg dan 0,4 ml
amil alkohol (campuran asam klorida 37 % dan etanol 95 % dengan volume sama)
dan 4 ml alkohol, kemudian campuran dikocok. Hasil uji positif sampel
mengandung flavonoid yaitu terbentuknya warna merah, kuning atau jingga pada
lapisan amil alkohol.
e) Uji Fenol hidrokuinon (pereaksi FeCl3)
Sebanyak 1 g sampel lintah laut kering diekstrak dengan 20 ml etanol
70 %. Larutan yang dihasilkan diambil sebanyak 1 ml kemudian ditambahkan
2 tetes larutan FeCl3 5 %. Hasil uji positif sampel mengandung senyawa fenol
yaitu terbentukya larutan berwarna hijau atau hijau biru.
f) Uji Molisch
Sebanyak 1 ml larutan sampel ditambahkan 2 tetes pereaksi molisch dan
1 ml asam sulfat pekat melalui dinding tabung. Hasil uji positif sampel
mengandung karbohidrat ditandai oleh terbentuknya kompleks berwarna ungu
g) Uji Benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 ml pereaksi
benedict. Campuran dikocok dan dididihkan selama 5 menit. Hasil uji positif
sampel mengandung gula pereduksi yaitu terbentuknya larutan berwarna hijau,
kuning atau endapan merah bata.
h) Uji Biuret
Larutan sampel sebanyak 1 ml ditambahkan pereaksi biuret sebanyak 4 ml.
Campuran dikocok dengan seksama. Hasil uji positif sampel mengandung
senyawa peptida yaitu terbentuknya larutan berwarna ungu.
i) Uji Ninhidrin
Larutan sampel sebanyak 2 ml ditambahkan beberapa tetes larutan
ninhidrin 0,1 %. Campuran dipanaskan dalam penangas air selama 10 menit. Hasil
uji positif sampel mengandung asam amino yaitu terbentuknya larutan warna biru.
3.4. Analisis Data
Perlakuan pada penelitian ini adalah penggunaan jenis pelarut polar yaitu
metanol, etanol, dan aquabides. Semua perlakuan dilakukan sebanyak dua kali
ulangan. Rancangan percobaan yang digunakan untuk menganalisis data
rendemen ekstrak dan hasil uji kandungan antioksidan dengan DPPH adalah
rancangan acak lengkap (RAL) dengan model sebagai berikut (Steel dan Torie
1980):
Keterangan:
Yij = nilai pengamatan rendemen ekstrak; hasil uji kandungan antioksidan
(i) pada ulangan ke-j
ð = rataan umum
ái = pengaruh jenis pelarut polar (i)
åij = pengaruh galat jenis pelarut polar (i) pada ulangan ke-j
Hipotesis rancangan acak lengkap (RAL) terhadap rendemen ekstrak dan
hasil uji kandungan antioksidan dengan DPPH adalah sebagai berikut:
H0 : jenis pelarut tidak berpengaruh nyata (ái = 0)
H1 : jenis pelarut berpengaruh nyata (ái ≠ 0)
Apabila hasil analisis ragam (ANOVA) pada rendemen ekstrak dan hasil
uji kandungan antioksidan dengan DPPH berbeda nyata pada selang kepercayaan
95% (P<0,05), maka dilanjutkan dengan uji lanjut Duncan dengan rumus sebagai
berikut: S¢ = ඥሺሻȀ
Rp = qá’ x S¢
Keterangan:
S¢ = significant range
= kuadrat tengah sisa
r = ulangan
qá’ = significant studentized range
4. HASIL DAN PEMBAHASAN
4.1. Karakteristik Bahan Baku
Bahan baku yang digunakan pada penelitian ini adalah lintah laut
(Discodoris sp.) dari Perairan Tanjung Binga Kepulauan Belitung. Lokasi
pengambilan lintah laut dapat dilihat pada Lampiran 1. Lintah laut dikurangi
kadar airnya melalui proses pengeringan. Keuntungan dilakukannya pengeringan
adalah daya awet bahan yang lebih lama, volume dan berat bahan menjadi lebih
kecil sehingga mempermudah dan menghemat ruang pengangkutan. Pengeringan
dapat berlangsung baik, jika pemanasan terjadi pada setiap tempat dari bahan dan
uap air dikeluarkan dari seluruh permukaan bahan tersebut (Winarno et al. 1980).
Lintah laut tanpa jeroan kering memiliki tekstur yang keras, dan berwarna
hitam kecoklatan. Setelah kering, lintah laut tanpa jeroan dihancurkan sehingga
diperoleh bentuk serbuk. Bahan baku dalam bentuk serbuk dapat mempermudah
saat analisis proksimat dan proses ekstraksi karena permukaan bahan baku yang
kontak dengan pelarut lebih luas. Serbuk lintah laut tanpa jeroan disimpan dalam
wadah tertutup untuk melindungi bahan baku dari lingkungan sekitarnya. Lintah
laut segar, tanpa jeroan kering dan bentuk serbuknya dapat dilihat pada Gambar 4.
Karakterisasi dilakukan untuk mengetahui sifat dari bahan baku yang
digunakan. Suatu bahan baku memiliki sifat fisik maupun kimia yang berbeda
dengan yang lainnya. Karakterisasi pada penelitian ini meliputi pengukuran
rendemen dan analisis kandungan gizi bahan baku (uji proksimat).
4.1.1. Rendemen
Rendemen adalah persentase bagian tubuh yang dapat dimanfaatkan.
Lintah laut utuh ditimbang beratnya baik sebelum maupun sesudah diambil
dengan jeroannya, kemudian dijemur dengan menggunakan panas matahari.
Daging dan jeroan lintah laut yang telah kering ditimbang kembali untuk
mengetahui penurunan berat setelah dikeringkan. Persen rendemen merupakan
perbandingan antara berat daging segar/kering dengan berat utuh lintah laut yang
digunakan.
Hasil pengukuran rendemen menunjukkan bahwa daging dan jeroan lintah
laut segar memiliki rendemen sebesar 41,79 % dan 58,21 %, sedangkan rendemen
daging dan jeroan lintah laut kering sebesar 7,20 % dan 8,64 %. Penurunan
rendemen lintah laut disebabkan penguapan kandungan air dalam bahan dengan
adanya energi panas matahari. Lintah laut yang berukuran besar akan memiliki
rendemen yang besar pula. Nilai rendemen digunakan untuk mengetahui nilai
ekonomis suatu produk atau bahan. Semakin tinggi rendemen maka semakin
tinggi pula nilai ekonomisnya sehingga lebih efektif.
4.1.2. Kandungan gizi bahan baku
Senyawa kimia yang mutlak diperlukan oleh tubuh adalah zat gizi. Zat gizi
berperan dalam penyediaan energi, proses pertumbuhan, perbaikan jaringan,
pengaturan serta pemeliharaan proses fisiologis dan biokimiawi di dalam tubuh.
Zat gizi diklasifikasikan dalam 6 kelompok besar yaitu karbohidrat, protein,
lemak, vitamin, mineral dan air (Tejasari 2003).
Kandungan zat gizi pada lintah laut dapat diketahui melalui uji proksimat.
Uji proksimat dilakukan untuk memperoleh data kasar tentang komposisi kimia
suatu bahan. Nurjanah (2009) melakukan uji proksimat pada lintah laut utuh
kering. Hasil uji menunjukkan bahwa lintah laut utuh kering mengandung abu
tidak larut asam yang dapat merusak jaringan ginjal. Abu tidak larut asam tersebut