POTENSI BAKTERI ENDOFIT ASAL TANAMAN KARET
SEBAGAI PEMACU PERTUMBUHAN BIBIT BATANG
BAWAH TANAMAN KARET (
Hevea brasiliensis
Müll. Arg.)
UMI HIDAYATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Potensi Bakteri Asal Endofit Tanaman Karet sebagai Pemacu Pertumbuhan Bibit Batang Bawah Tanaman Karet (Hevea brasiliensis Müll. Arg.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
RINGKASAN
UMI HIDAYATI. Potensi Bakteri Endofit Asal Tanaman Karet sebagai Pemacu Pertumbuhan Bibit Batang Bawah Tanaman Karet (Hevea brasiliensis Müll. Arg.) Dibimbing oleh Dwi Andreas Santosa, Iswandi Anas Chaniago, Abdul Munif, dan Siswanto.
Bakteri endofit hidup dalam jaringan tanaman, dapat diisolasi melalui sterilisasi permukaan. Isolasi bakteri endofit dari tanaman karet yang berpotensi sebagai pemacu pertumbuhan sangat penting dilakukan. Penelitian ini dilakukan dengan tujuan untuk melakukan isolasi, seleksi, dan karakterisasi bakteri endofit pemacu pertumbuhan bibit batang bawah tanaman karet, memperoleh kultur campuran bakteri endofit untuk meningkatkan pertumbuhan, dan mengetahui kemampuan bakteri endofit dalam meningkatkan efisiensi pemupukan. Bakteri endofit diisolasi dari daun, kulit sadapan (tatal), dan akar tanaman karet klon IRR 118 dan IRR 39 yang memproduksi lateks dan yang mengalami Kering Alur Sadap (KAS). Isolasi memperoleh 117 isolat bakteri endofit, setelah pengujian respon hipersensitif pada daun tembakau diperoleh 71 isolat dengan respon negatif, selanjutnya setelah pengujian hemolisis pada media agar darah diperoleh 55 isolat dengan respon negatif. Isolat kemudian diuji kemampuannya untuk meningkatkan daya kecambah dan pertumbuhan benih padi dan dari 55 isolat tersebut dihasilkan 5 isolat terpilih memiliki skor tertinggi yaitu isolat KPD6, KPA32, LPD74, LPD76 dan KPA38. Pengujian kemampuan bakteri endofit terseleksi terhadap kemampuan penambatan N2 diperoleh hasil 28.43- 42.30 nmol
C2H4/μL/jam. Isolat bakteri endofit terpilih juga mampu menghasilkan hormon
IAA (Indole Acetic Acid), giberelin, dan sitokinin (zeatin dan kinetin). Kemampuan menghasilkan hormon IAA 28.167-119 μg ml-1, giberelin 7.5-60 μg ml-1, sitokinin (zeatin) 0.012-0.025 μg ml-1, dan sitokinin (kinetin) 0.004-0.029 μg ml-1. Identifikasi 5 isolat bakteri endofit terpilih berdasarkan sekuen parsial 16S rRNA diperoleh Bacillus cereus KPD6, Pseudomonas aeruginosa KPA32, Brachybacterium paraconglomeratum LPD74, bacterium (bakteri tidak dikenal) LPD76 dan Providencia vermicola KPA38.
Lima bakteri endofit tersebut diuji kompatibilitasnya mendapatkan kultur campuran yang dapat meningkatkan pertumbuhan bibit batang bawah tanaman karet klon PB 260. Pengujian kompatibilitas 5 bakteri endofit dalam 25 perlakuan memberikan hasil positif yang berarti kompatibel. Aplikasi kultur campuran untuk meningkatkan pertumbuhan bibit batang bawah tanaman karet menunjukkan 2 kultur campuran dengan hasil yang paling baik yaitu kultur campuran 1 terdiri dari 2 spesies bakteri Brachybacterium paraconglomeratum LPD74 dan Providencia vermicola KPA38 dan kultur campuran 2 terdiri 3 spesies bakteri Bacillus cereus KPD6, Pseudomonas aeruginosa KPA32, dan Brachybacterium paraconglomeratum LPD74. Bakteri endofit mampu masuk dan mengkolonisasi planlet bibit karet microcutting yang dibuktikan berdasarkan hasil Scanning Electron Microscopy.
campuran (K) menggunakan 3 perlakuan yaitu (1) tanpa inokulasi kultur campuran (K0), (2) inokulasi kultur campuran 1 (K1), dan (3) inokulasi kultur campuran 2 (K2). Selanjutnya faktor kedua dosis pemupukan (P) menggunakan 5 perlakuan : (1) tanpa pemupukan (P0), (2) pemupukan 25 % dari dosis rekomendasi (P1), (3) pemupukan 50 % dari dosis rekomendasi (P2), (4) pemupukan 75% dari dosis rekomendasi (P3), dan (5) pemupukan 100% dosis rekomendasi (P4). Berdasarkan analisis sidik ragam yang dilakukan, tidak ada beda nyata pada perlakuan aplikasi kultur campuran dan pemupukan ke bibit batang bawah tanaman karet. Hasil analisa tanaman secara umum terdapat kecukupan hara terutama Nitrogen.
SUMMARY
UMI HIDAYATI. The Potency of Endophytic Bacteria from Rubber Plants (Hevea brasiliensis Müll. Arg.) as Plant Growth Promoting for Rubber Rootstooks. Supervised by Dwi Andreas Santosa, Iswandi Anas Chaniago, Abdul Munif, dan Siswanto.
Endophytic bacteria is bacteria living in plant tissue, and they can be isolated through surface sterilization. Isolation of endophytic bacteria from rubber plant that are potentially involved in enhanching growth is important to be carried out. The objective of this experiment was to isolate, select, and characterize the endophytic bacteria from rubber plants that have potency to enhance rubber rootstocks growth. About 117 isolates of endophytic bacteria were isolated from leaf, shaved bark and feeder root of IRR 118 and IRR 39 rubber clones. The isolates of endophytic bacteria were selected by hypersensitive response and hemolysis test, 71 isolates showed negative respons of hypersensitive test, and 55 isolates showed negative result of hemolysis test. Germinating and growth test on paddy rice seedling for 55 isolates showed 5 isolates have highest score and have been selected for further experiment. N2 fixation of the 5 selected endophytic
bacteria indicated by ARA method showed that acetylene reduction ranged from 28.43 to 42.30 nmol C2H4/μL/hour. The capacity to produce IAA (Indole Acetic
Acid) was 28.167 - 119 μg ml-1, gibberellin 7.5 - 60 μg ml-1, cytokinin (zeatin) 0.012-0.025 μg ml-1, and cytokinin (kinetin) 0.004 - 0.029 μg ml-1. The 5 bacteria were identified based on partial sequencing 16S rRNA as Bacillus cereus KPD6, Pseudomonas aeruginosa KPA32, Brachybacterium paraconglomeratum LPD74, unknow bacterium LPD76 dan Providencia vermicola KPA38.
Mixed cultures of endophytic bacteria were expected to increase the plant growth and improve the quality of rubber rootstocks. All of the selected endophytic bacteria are compatible each other. Application of mixed cultures to improve rubber rootstocks growth gave the best results of 2 mixed cultures. The first mixed culture contains 2 bacteria, namely Brachybacterium paraconglomeratum LPD74 and Providencia vermicola KPA38, then the second mixed culture contains 3 bacteria, namely Bacillus cereus KPD6, Pseudomonas aeruginosa KPA32, and Brachybacterium paraconglomeratum LPD74. Endophytic bacteria were able to enter to planlet originated from micro cutting proven by Scanning Electron Microscopy.
application on growth of rubber rootstocks. Nutrient analysis showed that indicated the optimum range of plant nutrient content, asspecially Nitrogen concentration.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Tanah
POTENSI BAKTERI ENDOFIT ASAL TANAMAN KARET
SEBAGAI PEMACU PERTUMBUHAN BIBIT BATANG
BAWAH TANAMAN KARET (
Hevea brasiliensis
Müll. Arg.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Penguji pada Ujian Tertutup :
1. Dr Ir Thomas Wijaya, MAgrSc
( Kepala Bidang Penelitian Pra Panen Pusat Penelitian Karet) 2. Dr Rahayu Widyastusti, MSc
(Staf Pengajar Depatemen Ilmu Tanah dan Sumberdaya Lahan Fakultas Pertanian, Institut Pertanian Bogor)
Penguji pada Ujian Terbuka : 1. Dr Ir Gede Wibawa, DEA
( Direktur Riset dan Pengembangan PT. Riset Perkebunan Nusantara) 2. Dr Ir Hariyadi, MS
Judul Disertasi : Potensi Bakteri Endofit Asal Tanaman Karet sebagai Pemacu Pertumbuhan Bibit Batang Bawah Tanaman Karet (Hevea brasiliensis Müll. Arg.)
Nama : Umi Hidayati
NIM : A161090011
Program Studi : Ilmu Tanah
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Dwi Andreas Santosa, MS Prof Dr Ir Iswandi Anas Chaniago, MSc Ketua Anggota
Dr Ir Abdul Munif, MScAgr Dr Siswanto, DEA Anggota Anggota
Diketahui oleh
Ketua Program Studi Ilmu Tanah
Ir Atang Sutandi, MSi PhD
Dekan Sekolah Pascasarjana
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat
dan karunia Nya sehingga penulis dapat menyelesaikan disertasi berjudul ”Potensi Bakteri Endofit Asal Tanaman Karet sebagai Pemacu Pertumbuhan Bibit
Batang Bawah Tanaman Karet (Hevea brasiliensis Müll. Arg.)”. Disertasi ini dibuat sebagai salah satu syarat untuk mahasiswa pascasarjana program S3 untuk mendapatkan gelar Doktor pada Program Studi Ilmu Tanah Fakultas Pertanian, Institut Pertanian Bogor.
Penulis menyampaikan penghargaa dan ucapan terima kasih kepada komisi pembimbing, Bapak Prof Dr Ir Dwi Andreas Santosa, MS, Bapak Prof Dr Ir Iswandi Anas Chaniago, MSc, Bapak Dr Ir Abdul Munif, MScAgr, dan Bapak Dr Siswanto, DEA, atas semua bimbingan, kritik, dan saran yang telah diberikan dengan tulus dan penuh kesabaran untuk penulis selama penelitian sampai penyelesaian disertasi ini. Terima kasih juga penulis sampaikan kepada Dr Ir Komaruddin Idris, MSc dan Dr Rahayu Widyastuti, MSc sebagai penguji ujian prakualifikasi calon doktor tertulis dan lisan. Terima kasih juga penulis sampaikan kepada Dr Ir Thomas Wijaya, MScAgr dan Dr Rahayu Widyastuti, MSc sebagai penguji pada ujian tertutup. Terima kasih juga penulis sampaikan kepada Dr Ir Gede Wibawa, DEA dan Dr Ir Hariyadi, MS sebagai penguji pada ujian terbuka. Saran dan pertanyaan yang diberikan sangat membantu dalam penyempurnaan disertasi ini.
Penulis juga mengucapkan terima kasih kepada Direktur Utama PT. Riset Perkebunan Nusantara, Direktur Pusat Penelitian Karet dan Kepala Balai Penelitian Sembawa atas izin, kesempatan, dan bantuan biaya pendidikan yang diberikan untuk penulis selama mengikuti tugas belajar Program Doktor pada Program Studi Ilmu Tanah Fakultas Pertanian Institut Pertanian Bogor. Terima kasih juga penulis sampaikan kepada Rektor Insitut Pertanian Bogor, Dekan Fakultas Pertanian, Ketua Departemen Ilmu Tanah dan Sumberdaya Lahan, Ketua Program Studi Ilmu Tanah, para staf pengajar pada Program Studi Ilmu Tanah, serta staf administrasi Sekolah Pascasarjana dan Program Studi Ilmu Tanah, atas semua bantuan untuk kelancaran penulis menempuh pendidikan di Sekolah Pascasarjana Intitut Pertanian Bogor.
Terimakasih penulis sampaikan kepada rekan-rekan peneliti, teknisi, analis, dan laboran di Balai Penelitian Sembawa dan Pusat Penelitian Karet, atas semua pemikiran dan bantuan selama penulis menyelesaikan penelitian disertasi. Terimakasih juga penulis sampaikan kepada bapak ibu dan rekan-rekan di Laboratorium Bioteknologi Tanah Departemen Ilmu Tanah dan Sumberdaya Lahan, dan Laboratorium Nematologi Departemen Proteksi Tanaman Fakultas Pertanian Institut Pertanian Bogor, serta Laboratorium Bioteknologi Lingkungan di Indonesian Center for Biodiversity and Biotechnology di Bogor. Penulis juga menyampaikan terima kasih kepada rekan-rekan Pascasarjana Program Studi Ilmu Tanah khususnya angkatan 2009 (Bedah Rupaidah, SSi MSi dan Dr. Ir. Yiyi Sulaiman, MSc) dan rekan-rekan Program Studi Fitopatologi, serta Forum Wacana Pascasarjana atas bantuan, pemikiran, dan dukungannya selama penulis menyelesaikan penelitian dan pendidikan di Insitut Pertanian Bogor.
(Alm), serta ayahanda H. Mukhayat dan ibunda Sukamti, beserta keluarga besar Moch Anwar dan Atmo Dimejo yang telah memberikan limpahan kasih sayang, doa, dan dukungan sehingga penulis dapat mencapai cita-cita ini. Terima kasih yang sebesar-besarnya untuk suami tercinta Mas Sofyan Nugroho, ST dan putra putri tercinta Annisa Kusuma Chandra dan Irfan Nabil Permadi atas doa, cinta, kasih sayang, kesetiaan, semangat, kesabaran, dan dukungan yang tulus sehingga dapat mencapai cita-cita ini.
Terima kasih juga penulis sampaikan kepada semua bapak ibu dan rekan-rekan, yang tidak bisa penulis sebutkan satu persatu atas semua doa, bantuan, dukungan, tenaga, dan waktu selama penulis menempuh pendidikan program Doktor ini, InsyaAllah kebaikan bapak ibu dan rekan-rekan akan mendapatkan limpahan berkah dari Allah SWT. Semoga disertasi ini dapat memberikan manfaat untuk perkembangan ilmu pengetahuan, amin.
DAFTAR ISI
DAFTAR TABEL xvii
DAFTAR GAMBAR xviii
DAFTAR LAMPIRAN xix
PENDAHULUAN 1
Latar Belakang 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
Nilai Kebaruan 2
TINJAUAN PUSTAKA 4
Prospek dan Kendala Pengembangan Pembibitan Tanaman Karet 4 Potensi Bakteri Endofit sebagai Pemacu Pertumbuhan 6 Mikrob Endofit yang Bermanfaat untuk Tanaman Karet 8
METODOLOGI PENELITIAN 10
Tempat dan Waktu Penelitian 10
Isolasi Bakteri Endofit dari Tanaman Karet 10
Seleksi dan Karakterisasi Isolat Bakteri Endofit 11 Identifikasi Lima Isolat Bakteri Endofit Terpilih 14
Pengujian Kompatibilitas Bakteri Endofit 15
Pengujian Kultur Campuran pada Bibit Batang Bawah Tanaman Karet 15 Pengamatan Scanning Electron Microscopy (SEM) Bakteri Endofit 16 Pengujian Bakteri Endofit untuk Meningkatkan Panjang Akar Planlet 17 Pengujian Kultur Campuran untuk Efisiensi Pemupukan Bibit Batang
Bawah Tanaman Karet 17
HASIL DAN PEMBAHASAN 19
Kondisi Lokasi Mengambilan Contoh di Perkebunan Karet
Menghasilkan 19
Hasil Isolasi Bakteri Endofit dari Tanaman Karet 23
Karakteristik Isolat Bakteri Endofit 24
Morfologi dan Uji Biokimia Bakteri Endofit 29
Identifikasi Lima Isolat Bakteri Endofit Terpilih 33 Kemampuan Penambatan N2 dan Produksi Hormon Tumbuh Tanaman
Isolat Terpilih 33
Potensi Kultur Campuran untuk Meningkatkan Pertumbuhan Bibit
Batang Bawah Tanaman karet 36
Kemampuan Bakteri Endofit untuk Meningkatkan Panjang Akar
Planlet 41
Kemampuan Kultur Campuran Meningkatkan Efisiensi Pemupukan
Bibit Batang Bawah Tanaman Karet 42
SIMPULAN DAN SARAN 49
Simpulan 49
Saran 49
DAFTAR PUSTAKA 50
LAMPIRAN 56
DAFTAR TABEL
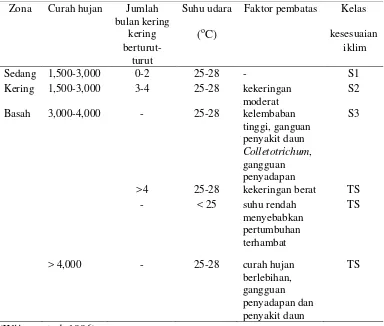
1 Sifat kimia dan fisik setiap horizon pada profil tanah yang diambil 21
2 Kriteria agroklimat tanaman karet 22
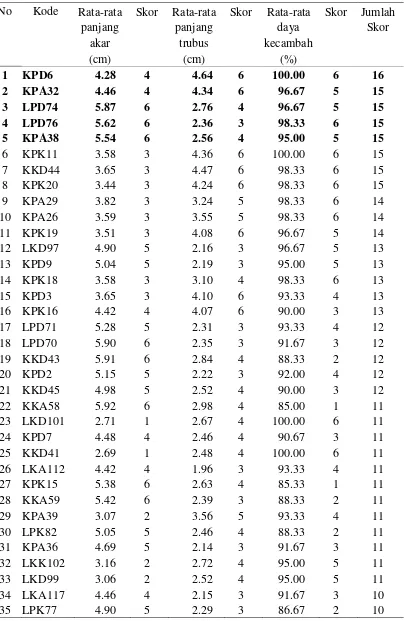
3 Sebaran jumlah isolat bakteri endofit yang diisolasi dari tanaman karet 24 4 Rata-rata panjang akar, panjang trubus, dan daya kecambah, serta skor
benih padi yang diinkubasi isolat bakteri endofit dan kontrol 27 5 Karakter morfologi lima isolat bakteri endofit 30 6 Karakter biokimia lima isolat bakteri endofit 31 7 Penelusuran sekuen gen 16S rRNA isolat bakteri yang diuji dengan
spesies padanan yang ada di GenBank 33
8 Pengujian kompatibiltas terhadap 5 bakteri endofit 37 9 Rata-rata panjang trubus dan akar, bobot basah dan bobot kering
biomasa bibit karet, serta hasil skoring 38
10 Pengaruh aplikasi kultur campuran dan pemupukan terhadap diameter
(mm) bibit batang bawah tanaman karet umur 3 bulan 43 11 Pengaruh aplikasi kultur campuran dan pemupukan terhadap tinggi
(cm) bibit batang bawah tanaman karet umur 3 bulan 44 12 Pengaruh aplikasi kultur campuran dan pemupukan terhadap panjang
akar (cm) bibit batang bawah tanaman karet umur 3 bulan 45 13 Pengaruh aplikasi kultur campuran dan pemupukan terhadap bobot
basah trubus (g) bibit batang bawah tanaman karet umur 3 bulan 45 14 Pengaruh aplikasi kultur campuran dan pemupukan terhadap bobot
kering akar (g) bibit batang bawah tanaman karet umur 3 bulan 46 15 Kandungan hara nitrogen, fosfot, kalium, dan magnesium tanaman
DAFTAR GAMBAR
1 Diagram alir penelitian 3
2 Peta jenis tanah lokasi pengambilan contoh 19
3 Profil tanah di lokasi pengambilan contoh 20 4 Lokasi pengambilan contoh di Kebun Percobaan Balai Penelitian
Sembawa, (a) klon IRR 39, dan (b) klon IRR 118 22 5 Contoh yang diambil dari tanaman karet menghasilkan klon IRR 39 dan
IRR 118, (a) daun, (b) kulit sadapan (tatal), dan (c) akar 23 6 Pengujian respon hipersensitif pada daun tembakau, (a) daun tembakau
disuntik suspensi bakteri endofit, dan (b) daun tembakau yang memperlihatkan gejala nekrosis yang ditunjukkan dengan tanda
panah 25
7 Pengujian hemolisis dengan agar darah, (a) agar darah, dan (b) gejala hemolisis dengan adanya zona bening di sekitar isolat bakteri endofit
seperti tanda panah 25
8 Pengujian daya kecambah dan pertumbuhan padi yang telah diinkubasi bakteri endofit, (a) daya kecambah padi pada hari kedua, dan (b)
pertumbuhan padi pada hari kelima 26
9 Koloni lima isolat bakteri endofit, (a) KPD6, (b) KPA32, (c) LPD74,
(d) LPD76, dan (e) KPA38 29
10 Kemampuan penambatan N2 dari lima isolat bakteri endofit, yaitu 1
(Bacillus cereus KPD6), 2 (Pseudomonas aeruginosa KPA32), 3 (Brachybacterium paraconglomeratum LPD74), 4 (bacterium LPD76),
dan 5 (Providencia vermicola KPA38) 34 11 Kemampuan menghasilkan hormon IAA dan giberelin dari lima isolat
bakteri endofit, yaitu 1 (Bacillus cereus KPD6), 2 (Pseudomonas aeruginosa KPA32), 3 (Brachybacterium paraconglomeratum LPD74),
4 (bacterium LPD76), dan 5 (Providencia vermicola KPA38) 35 12 Kemampuan menghasilkan hormon sitokinin (zeatin dan kinetin) dari
lima isolat bakteri endofit, yaitu 1 (Bacillus cereus KPD6), 2 (Pseudomonas aeruginosa KPA32), 3 (Brachybacterium paraconglomeratum LPD74), 4 (bacterium LPD76), dan 5 (Providencia
vermicola KPA38) 35 13 Pengujian kompatibiltas bakteri endofit pada media NA, (a) pengujian
kompatibiltas B. paraconglomeratum LPD74 dan P. vermicola KPA38, (b) pengujian kompatibiltas B. cereus KPD6, P.aeruginosa KPA32, dan
B. paraconglomeratum LPD74 36
14 Bibit karet PB 260 dipelihara dalam botol plastik selama 1 bulan 39 15 Foto SEM B.paraconglomeratum LPD74 dengan tanda panah putih, (a)
B paraconglomeratum LPD74 di dalam media NB (10,000 x), (b) Planlet karet tanpa inokulasi bakteri endofit (5,000 x), (c) B paraconglomeratum LPD74 di dalam jaringan kortek batang planlet karet (750 x), dan (d) B paraconglomeratum LPD74 di dalam jaringan
kortek pangkal batang planlet karet (7,500 x) 40 16 Planlet bibit karet berumur 3 minggu (a) planlet yang diinokulasi
B.paraconglomeratum LPD74 (Bp) dan kontrol (k), (b) akar planlet
17 Panaman bibit batang bawah karet klon PB 260, (a) cara penanaman
DAFTAR LAMPIRAN
1 Kelas kandungan hara tanah 56 2 Tabel data curah hujan, hari hujan, dan bulan kering di lokasi penelitian
(2000-2013) 57
3 Suhu, kelebaban relatif, dan kecepatan angin di lokasi penelitian
(2000-2011) 58
4 Morfologi 117 isolat bakteri hasil isolasi 59 5 Pengujian respon hipersensitif, hemolisis, pewarnaan Gram, bentuk sel
bakteri, dan pengujian katalase terhadap 117 isolat bakteri hasil isolasi 63 6 Kriteria penilaian status hara daun tanaman karet 67
7 Denah tata letak kantong plastik media tanam percobaan rumah kaca 68 8 Dosis rekomendasi pemupukan pembibitan batang bawah tanaman
karet 69
9 Kandungan hara pupuk pada pemupukan pembibitan batang bawah
tanaman karet 69
10 Jumlah bibit batang bawah tanaman karet untuk okulasi hijau dalam 1
ha 69
11 Dosis pemupukan berdasarkan perlakuan yang diaplikasikan pada 1
bulan setelah ditanam 70
12 Dosis pemupukan berdasarkan perlakuan yang diaplikasikan pada 2 dan
3 bulan setelah ditanam 70
13 Analisis sidik ragam diameter bibit batang bawah tanaman karet pada
pengujian perlakuan kultur campuran dan pemupukan 71 14 Analisis sidik ragam tinggi bibit batang bawah tanaman karet pada
pengujian perlakuan kultur campuran dan pemupukan 71 15 Analisis sidik ragam panjang akar bibit batang bawah tanaman karet
pada pengujian perlakuan kultur campuran dan pemupukan 71 16 Analisis sidik ragam bobot basah bibit batang bawah tanaman karet
pada pengujian perlakuan kultur campuran dan pemupukan 72 17 Analisis sidik ragam bobot kering bibit batang bawah tanaman karet
1
PENDAHULUAN
Latar Belakang
Karet merupakan komoditas perkebunan yang memberikan sumber devisa yang besar dengan areal perkebunan yang luas dan sumber lapangan kerja yang besar. Nilai ekspor karet US$ 11.8 milyar dan memberikan sumber lapangan kerja utama lebih dari 16 juta orang pada tahun 2011 (Balai Penelitian Sembawa 2012). Luas areal perkebunan karet 3.45 juta ha dengan produksi 2.73 juta ton pada tahun 2010 (Dirjenbun 2011). Hal ini merupakan potensi tanaman karet untuk dikembangkan secara luas, sehingga dapat menyerap tenaga kerja yang lebih banyak dan memberikan produksi yang lebih tinggi.
Selain potensi yang dimiliki tanaman karet, masih terdapat kendala dalam pengembangan perkebunan karet antara lain produktivitas yang rendah, matang sadap yang lama, penyakit tanaman karet, dan penyiapan bibit tanaman karet yang unggul. Pengembangan perkebunan karet ditentukan dengan penggunaan bibit yang berkualitas bagus sebagai investasi awal untuk mendapatkan matang sadap tepat waktu dan produksi lateks yang diharapkan. Pentingnya bibit tanaman karet memberikan peluang untuk meningkatkan kualitas bibit tanaman karet, dengan upaya meningkatkan pertumbuhan dan efisiensi pemupukan sehingga diperoleh bibit yang unggul untuk ditanam di perkebunan karet. Salah satu upaya untuk meningkatkan pertumbuhan dan efisiensi pemupukan dengan cara aplikasi bakteri endofit yang berpotensi sebagai pemacu pertumbuhan.
Pada saat ini eksplorasi mikrob untuk berbagai kepentingan terutama di bidang pertanian telah banyak dikembangkan, bukan hanya mikrob di rizosfer, tetapi juga mikrob di dalam tanaman (endofit) yang berpotensi sebagai pemacu pertumbuhan untuk meningkatkan pertumbuhan tanaman. Bakteri endofit adalah bakteri yang berada dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Hallmann et al. (1997) mendefinisikan bakteri endofit adalah bakteri yang hidup dalam jaringan tanaman, dapat diisolasi melalui sterilisasi permukaan jaringan tanaman tersebut.
Penelitian Mendes et al. (2007) memberikan hasil bahwa bakteri endofit yang ditemukan dalam akar dan batang tanaman tebu mampu menghasilkan hormon pemacu pertumbuhan seperti IAA (Indole Acetic Acid). Bakteri endofit tersebut diketahui dari genus Burkholderia, Pantoea, Pseudomonas, dan Microbacterium.
2
Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan sebagai berikut :
1. memperoleh bakteri endofit dari tanaman karet yang berpotensi sebagai pemacu pertumbuhan.
2. mendapatkan kultur campuran untuk meningkatkan pertumbuhan bibit batang bawah tanaman karet.
3. memperoleh kultur campuran yang mampu meningkatkan pertumbuhan dan efisiensi pemupukan bibit batang bawah tanaman karet.
Manfaat Penelitian
Penelitian ini bermanfaat untuk memberikan informasi tentang bakteri endofit yang berasal dari tanaman karet yang memiliki kemampuan sebagai pemacu pertumbuhan. Bakteri endofit yang kompatibel menjadi kultur campuran yang memiliki kemampuan meningkatkan pertumbuhan bibit batang bawah tanaman karet. Pertumbuhan bibit yang cepat dan efisien dalam penggunaan pupuk sangat diharapkan untuk menunjang pengembangan bibit karet unggul.
Ruang Lingkup Penelitian
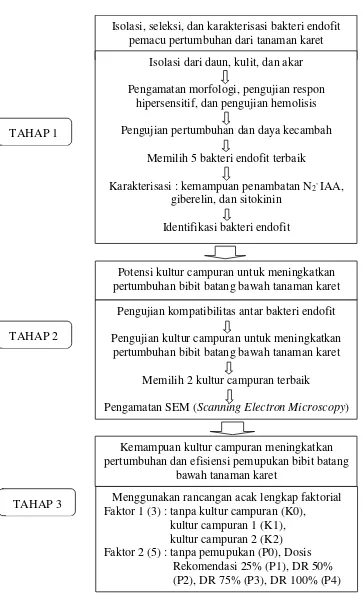
Penelitian ini meliputi kegiatan isolasi, seleksi, dan karakterisasi bakteri endofit pemacu pertumbuhan dari tanaman karet. Selanjutnya pengujian potensi kultur campuran untuk meningkatkan pertumbuhan bibit batang bawah tanaman karet. Kultur campuran kemudian diuji kemampuannya meningkatkan pertumbuhan dan efisiensi pemupukan bibit batang bawah tanaman karet. Rangkaian penelitian yang dilaksanakan seperti disajikan pada diagram alir penelitian (Gambar 1).
Nilai Kebaruan Nilai kebaruan dalam penelitian ini, antara lain :
1. memperoleh bakteri endofit dari akar, kulit sadapan, dan daun tanaman karet klon IRR 32 dan IRR 118.
2. mengetahui karakter bakteri endofit sebagai pemacu pertumbuhan bibit batang bawah tanaman karet.
3
Gambar 1 Diagram alir penelitian
TAHAP 1
TAHAP 2
TAHAP 3
Isolasi, seleksi, dan karakterisasi bakteri endofit pemacu pertumbuhan dari tanaman karet
Isolasi dari daun, kulit, dan akar
Pengamatan morfologi, pengujian respon hipersensitif, dan pengujian hemolisis
Pengujian pertumbuhan dan daya kecambah
Memilih 5 bakteri endofit terbaik
Karakterisasi : kemampuan penambatan N2, IAA,
giberelin, dan sitokinin
Identifikasi bakteri endofit
Potensi kultur campuran untuk meningkatkan pertumbuhan bibit batang bawah tanaman karet
Pengujian kompatibilitas antar bakteri endofit
Pengujian kultur campuran untuk meningkatkan pertumbuhan bibit batang bawah tanaman karet
Memilih 2 kultur campuran terbaik
Pengamatan SEM (Scanning Electron Microscopy)
Kemampuan kultur campuran meningkatkan pertumbuhan dan efisiensi pemupukan bibit batang
bawah tanaman karet
4
TINJAUAN PUSTAKA
Prospek dan Kendala Pengembangan Pembibitan Tanaman Karet di Indonesia
Tanaman karet (Hevea brasiliensis Müll. Arg.) adalah pohon hutan yang asli dari hutan hujan tropis di Amazon, Brazil (George, 2000). Tanaman karet ditanam di Indonesia pada tahun 1876 yang berasal dari Brazil, dimana bahan tanam tersebut memiliki rata-rata produktivitas yang rendah berkisar 400kg/ha/th (Dijkman 1951). Pada saat ini tanaman karet telah semakin luas ditanam yang menandakan kemampuan beradaptasi dengan berbagai kondisi lingkungan. Tanaman karet memiliki prospek cukup baik untuk dikembangkan di daerah pasang surut pada tipe luapan C dan D seperti di Air Sugihan, Sumatera Selatan (Rosyid dan Wijaya 2005).
Pemuliaan karet di Indonesia telah banyak menghasilkan klon-klon unggul. Sejak 1992 sampai sekarang tipe klon yang direkomendasikan ada 3 yaitu klon penghasil lateks, klon lateks-kayu, dan klon penghasil kayu (Woelan et al. 2005). Pengelompokan klon-klon karet berdasarkan metabolisme ada 3 yaitu jenis klon metabolisme rendah, sedang, dan tinggi. Klon metabolisme tinggi berarti memiliki kecepatan metabolik lebih tinggi dalam biosintesa lateks dibandingkan dengan kelompok metabolisme sedang dan rendah (Sumarmadji et al. 2005). Berdasarkan rekomendasi klon karet periode 2010-2014 ada 2 tipe klon yaitu klon lateks dan klon lateks-kayu, salah satu klon yang masuk tipe tersebut adalah klon IRR 118 untuk klon lateks dan klon IRR 39 klon lateks-kayu, kedua klon tersebut telah ditanam secara luas. Klon IRR 118 memiliki potensi produksi karet kering rata-rata 2,200 kg/ha, sedangkan IRR 39 1,493kg/ha. (Lasminingsih 2010).
Tanaman karet memiliki potensi sebagai penghasil lateks dan kayu, tetapi tanaman karet juga mengalami kendala adanya penyakit pada akar, batang, daun dan gangguan fisiologis yaitu KAS (kering alur sadap). Kering alur sadap adalah gangguan fisiologis tanaman karet yang alur sadapnya kering dan tidak mengalirkan lateks apabila disadap (Sumarmadji 2001). Gangguan KAS di perkebunan karet di Indonesia cukup tinggi, di perkebunan rakyat 15-22%, sedangkan di perkebunan besar 7.5 – 15 % (Siswanto et al. 2004). Tanaman yang mengalami gangguan KAS memiliki pertumbuhan yang baik, tetapi tidak berproduksi sebagaimana mestinya.
5 Bibit karet dibutuhkan untuk peremajaan perkebunan karet. Hal ini terkait areal perkebunan karet dengan tanaman karet tua dan rusak yang sudah seharusnya diremajakan masih luas, dan pembukaan lahan baru untuk perkebunan karet masih terus dilakukan. Pada tahun 2010 luas areal peremajaan perkebunan karet dengan tanaman karet yang sudah tua dan rusak seluas 30,000 ha. Seandainya peremajaan perkebunan karet dilakukan dengan jarak tanam 3 m x 6 m, maka membutuhkan bibit tanaman karet 18 juta bibit (Ditjenbun 2011). Hal ini membutuhkan bibit karet yang banyak untuk memenuhinya, sehingga bisa menjadi peluang untuk menyiapkan bibit yang berkualitas bagus.
Perkebunan karet dalam pengembangannya membutuhkan bibit yang berkualitas baik, termasuk penyiapan bibit batang bawah tanaman karet yang bermutu baik. Bibit batang bawah tanaman karet yang seragam selama ini diperoleh dengan cara perbanyakan vegetatif (Tistama dan Hamim 2007). Penggunaan biji karet yang bermutu baik sesuai anjuran untuk keperluan batang bawah adalah mutlak karena hasil penelitian menunjukkan bahwa batang bawah berpengaruh terhadap pertumbuhan dan produksi lateks (Siagian 2000).
Kualitas bibit yang digunakan sangat menentukan keberhasilan pertanaman di lapangan. Bibit yang baik akan tumbuh dengan baik dan memberi hasil yang baik. Bibit tanaman karet yang lazim digunakan sekarang ini adalah bibit okulasi yang di sebut stum, baik sebagai stum mata tidur ataupun stum polibeg berpayung dua. Keberhasilan okulasi di lapangan tidak selamanya mencapai persentase yang tinggi. Selain kemahiran tenaga pengokulasi, maka kondisi tanaman juga ikut menentukan. Produktivitas kebun karet di tentukan oleh mutu bibit yang digunakan. Kalau bibitnya bermutu tinggi maka pertumbuhan tanaman akan jagur dan seragam sehingga hasilnya akan tinggi. Batang bawah yang pertumbuhannya baik pada umumnya akan memberikan hasil okulasi yang baik. Pertumbuhan batang bawah yang baik akan mempercepat menempelnya mata okulasi dan mempercepat proses penyembuhan luka sayatan okulasi (Munthe dan Manurung 2002). Pengaruh negatif batang bawah yang tidak sesuai dengan batang atas di duga dapat menurunkan produksi karet 20 % - 40 % (Siagian et al. 1996).
Pada saat ini penyiapan bibit di petani hanya menggunakan bibit batang bawah cabutan yang diambil dari perkebunan karet. Kemudian di okulasi dengan entres yang dimiliki petani yang jarang dimurnikan yang belum jelas kebenaran jenis klonnya. Pemakaian batang bawah cabutan, jelas bukan pilihan tepat karena tidak diketahui kualitas biji nya. Hal ini harus diantisipasi dengan menggunakan batang bawah dari biji klon anjuran dan entres yang jelas jenis klonnya. Pemeliharaan yang baik ikut mendukung memperoleh bibit yang bermutu. Salah satu upaya yang dapat dilakukan dengan pemupukan sesuai dosis anjuran dan pemberian hormon tumbuh dapat membantu meningkatkan mutu bibit karet. Husny et al. (1986) menyatakan bahwa pemberian IBA pada bibit batang bawah tanaman karet dapat meningkatkan jumlah mata okulasi yang pecah, tinggi tanaman, diameter batang dan jumlah akar dengan dosis optimum 2000 – 3000 ppm, sedangkan GA3 dapat meningkatkan pecah mata okulasi dan tinggi tanaman.
6
21.1%, dan 26.8% dibandingkan kontrol. Beberapa hormon pemacu tumbuh seperti IAA, GA3, BA telah dicoba untuk mengetahui pengaruhnya terhadap kecepatan pemulihan kulit pada bidang sadap, produksi karet kering, dan kadar karet kering. Hasil penelitian menunjukkan pemakaian IAA mempercepat pertumbuhan jumlah pembuluh lateks, tebal kulit dan meningkatkan produksi berat kering (Siagian et al. 1985).
Pemanfaatan mikrob penghasil hormon juga telah banyak dilakukan, seperti Azotobacter chroococcum memiliki kemampuan dalam menambat N2,
menghasilkan zat pengatur tumbuh seperti giberelin dan sitokinin, dan memproduksi siderofor (Hindersah 2000). Sejumlah bakteri dapat memproduksi zat pengatur tumbuh seperti IAA, giberelin, dan sitokinin, misalnya Pseudomonas, Xanthomonas, Bacillus, Azotobacter, dan Rhizobium (Simarmata et al. 2004). Dari akar tanaman karet (Hevea brasiliensis Müll. Arg.), telah berhasil diisolasi beberapa bakteri penghasil hormon tumbuh tanaman. Bakteri-bakteri diinokulasi dalam medium Kings B yang mengandung L-tryptophan dan diinkubasi selama 6 hari, kemudian dilakukan analisis konsentrasi IAA (Indole Acetic Acid) dan diperoleh bakteri dari perakaran karet tersebut mampu memproduksi IAA (Maslahat dan Suharyanto 2005).
Beberapa penelitian (Simarmata et al. 2004; Maslahat dan Suharyanto, 2005) telah membuktikan bahwa mikrob penghasil hormon tumbuh sangat bermanfaat untuk memacu pertumbuhan tanaman. Pemanfaatan bakteri endofit yang berpotensi sebagai pemacu pertumbuhan dapat mendukung peningkatan pertumbuhan bibit batang bawah tanaman karet.
Potensi Bakteri Endofit sebagai Pemacu Pertumbuhan
Bakteri endofit sebagai organisme yang hidup di dalam jaringan tanaman dalam seluruh atau sebagian siklus hidupnya. Mikrob endofit berpotensi untuk meningkatkan pertumbuhan tanaman dan pengendalian hama penyakit. Bakteri endofit adalah bakteri yang hidup mengkolonisasi jaringan bagian dalam tanaman tanpa menyebabkan gangguan pada tanaman tersebut. Bakteri endofit umumnya menguntungkan, karena mampu sebagai agen pengendali hayati, dan memicu pertumbuhan tanaman. Bakteri endofit tersebut dapat meningkatkan ketersediaan nutrisi dan menghasilkan hormon pemacu pertumbuhan (Bacon and Hinton 2007). Endofit berpotensi juga sebagai sumber produk alami baru untuk bidang kedokteran, pertanian, dan industri (Strobel dan Daisy 2003).
7 pertumbuhan batang, merangsang pertumbuhan tunas anakan dengan cepat dan serentak (Wattimena 1987).
Etilen pada tanaman karet memiliki manfaat dalam kaitannya dengan hasil lateks. Etilen merupakan gas hidrokarbon sederhana, yang mempunyai aktivitas sebagai zat pengatur tumbuh pada tanaman. Etilen merupakan stimulator dari berbagai aktivitas terkait dalam sel pembuluh lateks. Etilen merupakan stimulan yang umum digunakan untuk meningkatkan produksi tanaman karet, diaplikasikan sebagai ethephon yang merupakan penghasil etilen. Mekanisme umpan balik yang positif dari etilen yang akan menginduksi beberapa gen yang terkait dengan biosintesis etilen dalam tanaman, antara lain gen penyandi ACC oksidase yang juga respon terhadap pelukaan (Kuswanhadi dan Montoro 2009).
Bakteri endofit juga diisolasi dari jaringan akar, daun, batang, dan buah-buahan dari berbagai tanaman (Hallmann et al. 1997). Bakteri endofit yang sering ditemukan mengkolonisasi jaringan tanaman, berasal dari genus Enterobacter, Bacillus, Methylobacterium, Agrobacterium, Serratia, Acinetobacter, Arthrobacter dan Pseudomonas. Bakteri endofit mengkolonisasi jaringan tanaman untuk memperoleh kondisi lingkungan yang melindunginya dari sinar matahari, hujan, suhu, dan kekurangan nutrisi. Selanjutnya bakteri endofit akan memberikan keuntungan pada tanaman dengan menghasilkan hormon tumbuh dan sebagai agen pengendali hayati (Praca et al. 2012).
Bakteri endofit mengkolonisasi jaringan tanaman dimulai di rizosfer, kemudian menempel pada rizoplan. Bakteri endofit masuk melalui zona akar rambut (zona penetrasi aktif) dan zona akar dengan celah-celah kecil yang disebabkan oleh munculnya akar lateral (zona penetrasi pasif). Bakteri endofit selanjutnya menempati ruang antar sel dari kortek sampai xilem (Malfanoya 2010).
Bakteri memberikan keuntungan untuk tanaman inang, seperti hasil penelitian Elbeltagy et al. (2001) menyatakan bahwa beberapa jenis bakteri endofit seperti Azospirillum, Enterobacter cloacae, Alcaligenes, Acetobacter diazotrophicus, Herbaspirillum seropedicae, Ideonella dechlorantans, dan Azoarcus sp. telah terbukti meningkatkan penambatan N2 pada tanaman padi.
Zinniel et al. (2002) menyampaikan bahwa bakteri endofit mampu menambat N2
sehingga dapat meningkatkan tinggi tanaman. Selain itu bakteri endofit juga mampu memproduksi fitohormon dan meningkatkan penyerapan mineral.
Bakteri endofit dapat berfungsi meningkatkan pertumbuhan dengan perannya sebagai PGPB (Plant Growth Promoting Bacteria). Bashan LE dan Bashan Y (2005) menyatakan bahwa PGPB meningkatkan pertumbuhan tanaman dengan dua cara yang berbeda yaitu, pertama bakteri endofit langsung mempengaruhi metabolisme tanaman dengan menyediakan zat yang dibutuhkan tanaman. Bakteri ini mampu menambat N2, meningkatkan kelarutan fosfat dan
8
efek buruk dari mikrob patogen (bakteri, jamur, dan virus). Mikrob sebagai agen pengendali hayati menghasilkan zat yang membahayakan atau menghambat mikrob lain, dengan membatasi ketersediaan besi untuk patogen atau dengan mengubah metabolisme tanaman inang untuk meningkatkan ketahanan terhadap patogen yang menginfeksi. Beberapa bakteri endofit dapat meningkatkan pertumbuhan pohon hutan seperti pinus sampai pohon di daerah kering seperti kaktus. Bakteri endofit, seperti Pseudomonas fluorescens dan Bacillus dapat berfungsi sebagai agen pengendali hayati untuk mengendalikan patogen Fusarium di tanah pada tanaman kapas, juga patogen Rhizoctonia solani dan Sclerotium.
Eksudat akar merupakan sumber nutrisi penting untuk mikrob di rizosfir dan berpartisipasi dalam merangsang bakteri untuk mengkolonisasi perakaran. Hasil penelitian Bacilio-Jin’enez et al. (2003) menunjukkan bahwa eksudat perakaran padi dapat menyebabkan respon bakteri endofit untuk mengkolonisasi lebih tinggi daripada bakteri lain yang berada di rizosfer padi. Selain hal tersebut, ditemukan juga bahwa komposisi dan konsentrasi gula dan asam amino dari eksudat akar padi, menjadikan daya tarik untuk bakteri endofit yaitu Azospirillium brasilense dan Bacillus. Bakteri endofit masuk ke dalam jaringan tanaman melalui jaringan akar (Gagne et al. 1987).
Mekanisme peningkatan pertumbuhan akibat interaksi bakteri endofit dengan tanaman diantaranya adalah kemampuan bakteri endofit dalam menghasilkan IAA. IAA merupakan sejenis auksin, yang terlibat dalam proses fisiologis dalam pertumbuhan tanaman seperti pemanjangan dan pembelahan sel, dan inisiasi akar (Gravel et al. 2007).
Bakteri endofit memiliki peran masing-masing yang menguntungkan. Bakteri endofit dapat dicampur dalam bentuk kultur campuran, dengan harapan bisa saling melengkapi peranan masing-masing. Kultur campuran bakteri endofit dapat memberikan manfaat lebih dibandingkan aplikasi tunggal bakteri endofit dengan diaplikasikan pada bibit tanaman karet sehingga meningkatkan pertumbuhan bibit tanaman karet.
Kultur campuran Bacillus spp. dan aktinomisetes mampu memicu pertumbuhan tajuk tanaman padi sebesar 13.35 – 26.53 % pada 7 HST (Putra 2011). Hasil penelitian Gofar et al. (2008) memperoleh dua konsorsium bakteri endofit yang konsisten memacu pertumbuhan tanaman dan meningkatkan serapan N2 tanaman padi. Hasil identifikasi bakteri memperoleh konsorsium I1 terdiri
Pseudomonas fluorescens, Klebsiella pneumoniae dan Enterobacter aerugenesa, sedangkan konsorsium I2 terdiri dari Pseudomonas aeruginosa, Pseudomonas
diminuta, Klebsiella pneumoniae, dan Burkholderia cepacia.
Mikrob Endofit yang Bermanfaat untuk Tanaman Karet
Tanaman karet telah ditanam secara luas yang menandakan kemampuan beradaptasi dengan kondisi lingkungan. Tanaman karet menyimpan potensi mikrob yang potensial yang dapat mendukung untuk pemacu pertumbuhan tanaman karet dan sebagai agen pengendali hayati penyakit pada tanaman karet.
9 terisolasi yaitu Penicillium, Pestalotiopsis dan Trichoderma. Keanekaragaman cendawan endofit lebih besar ditemukan di kulit sadapan daripada di daun, namun frekuensi kolonisasi endofit lebih tinggi pada daun dibandingkan dengan kulit sadapan (Gazis dan Chaverri 2010).
10
METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian
Lokasi pengambilan contoh di Blok klon IRR 39 dan IRR 118 tahun tanam 2002, Divisi I Kebun Percobaan Balai Penelitian Sembawa, Kecamatan Sembawa, Kabupaten Banyuasin, Sumatera Selatan. Penelitian dilaksanakan di Laboratorium Proteksi Tanaman, Laboratorium Fisiologi, Laboratorium Tanah, dan Rumah Kaca Balai Penelitian Sembawa. Selain itu juga dilaksanakan di Laboratorium Bioteknologi Tanah Departemen Ilmu Tanah dan Sumberdaya Lahan, dan Laboratorium Nematologi Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian juga dilaksanakan di Laboratorium Bioteknologi Lingkungan di Indonesian Center for Biodiversity and Biotechnology (ICBB) di Bogor. Penelitian dilakukan mulai Mei 2012 sampai dengan Desember 2013.
Isolasi Bakteri Endofit dari Tanaman Karet Pengambilan contoh
Bakteri endofit diisolasi dari daun, kulit sadapan (tatal), dan akar serabut tanaman karet klon IRR 118 dan IRR 39 tahun tanam 2002 untuk tanaman yang berproduksi tinggi dan tanaman terserang KAS (Kering Alur Sadap). Contoh yang diambil mengikuti metode pengambilan contoh daun untuk rekomendasi pemupukan tanaman karet (Adiwiganda et al. 1994). Daun diambil dari 4 tangkai daun yang ternaungi yang berumur 3 bulan lebih (dari waktu pembentukan daun baru) pada 4 arah mata angin untuk setiap pohon. Akar serabut tanaman karet diambil pada jarak 0.5 – 1 m dari pohon pada kedalaman 0 - 20 cm pada 4 arah mata angin. Kulit sadapan diambil sebanyak 2 irisan pada bidang sadapan, dengan sistem sadap ½S↓d/3 (disadap setengah lingkaran pohon, arah ke bawah, dengan frekuensi penyadapan 3 hari sekali). Pohon yang sehat dipilih berdasarkan produksi tinggi dengan pengamatan 4 kali sadap (½S↓d/3) sedangkan pohon terserang KAS (Kering Alur Sadap) dipilih yang paling jagur, klon yang digunakan klon IRR 118 (klon latek) dan IRR 32 (klon latek kayu).
Isolasi Bakteri Endofit
11 akar tanaman karet menggunakan perendaman NaOCl 3% selama 2 menit untuk daun, dan 3 menit untuk akar dan kulit sadapan.
Bakteri endofit dari tanaman karet diisolasi menggunakan metode yang dilakukan oleh Hallmann et al. (1997) dan Munif (2001) yang dimodifikasi. Contoh yang digunakan terdiri dari daun, kulit sadapan, dan akar serabut tanaman karet. Masing-masing contoh dicuci dengan air mengalir sampai bersih, dikeringkan dengan kertas tisu, dan ditimbang sebanyak 1 g. Permukaan contoh disterilisasi dengan cara dibilas dengan air steril sebanyak 2 kali, kemudian direndam selama 30 detik dalam alkohol 70 %. Selanjutnya contoh tersebut direndam dalam larutan NaOCl 3 % selama 2 menit untuk daun, dan 3 menit untuk kulit sadapan dan akar. Selanjutnya contoh dibilas dengan air steril sebanyak 3 kali. Keberhasilan sterilisasi permukaan contoh dapat diketahui dengan cara contoh disapukan di atas permukaan media Tryptic Soya Agar (Difco) 10 % dan Nutrient Agar (Difco) 10 % dalam cawan petri. Selanjutnya diinkubasikan pada suhu ruang selama 3 hari. Seandainya tidak ada pertumbuhan mikrob di permukaan media tempat contoh disapukan berarti contoh steril dan proses sterilisasi berhasil. Contoh dihancurkan sampai halus dengan mortar steril, kemudian ditambahkan 9 ml air fisiologis (NaCl 0.85) steril. Ekstrak contoh 1 ml dimasukkan ke dalam tabung reaksi berisi 9 ml air fisiologis steril, dikocok dengan vorteks, sehingga diperoleh tingkat pengenceran 10-2. Selanjutnya dilakukan pengenceran dengan cara yang sama sehingga diperoleh pengenceran sampai dengan 10-4. Setiap pengenceran diambil 1 ml suspensi dan ditumbuhkan pada media Tryptic Soya Agar (Difco) 10 % dan Nutrient Agar (Difco) 10 % dengan 3 ulangan. Setelah diinkubasi selama 3 hari pada suhu ruang, maka koloni bakteri yang tumbuh dipilih. Koloni bakteri terpilih dimurnikan pada media Tryptic Soya Agar (Difco) 100 % dan Nutrient Agar (Difco) 100 %. Bakteri disimpan dalam Nutrient Broth (Difco) dan gliserol 15% pada suhu -20oC (Badjoeri 2010).
Seleksi dan Karakterisasi Isolat Bakteri Endofit Uji respon hipersensitif
Pengujian respon hipersensitif menggunakan daun tembakau menurut Schaad et al. (2001) yang dimodifikasi, untuk mengetahui isolat berpotensi sebagai patogen pada tanaman atau tidak. Isolat dengan kerapatan 109 CFU/mL dalam media cair disuntikkan ke daun tanaman tembakau (Nicotiana tabacum L.) berumur 3 bulan menggunakan syringe 1 mL (tanpa jarum) dan diamati sampai 48 jam. Kontrol negatif menggunakan air steril dan kontrol positif dengan bakteri patogen tanaman.
Uji hemolisis
12
Uji daya kecambah dan pertumbuhan
Pengujian isolat untuk mendukung daya kecambah dan pertumbuhan, menggunakan benih padi varietas Ciherang. Metode pengujian dengan merendam benih padi dengan suspensi isolat pada Optical Density (OD)=0.1 selama 24 jam, kontrol direndam dalam air steril. Benih diletakkan pada cawan petri yang dilapisi kertas saring yang telah disemprot air steril agar lembab. Setiap cawan petri disemai 25 benih dan diulang 4 kali. Daya kecambah diamati setelah 2 hari inkubasi, sedangkan pertumbuhan setelah 5 hari inkubasi dengan diamati panjang akar dan trubus (upper part) bibit padi (Rustam 2012). Pengujian daya berkecambah dengan metode cawan petri (ISTA 2010). Perhitungan daya kecambah menggunakan rumus sebagai berikut (IRRI 2010) :
100%
Seleksi dilakukan berdasarkan metode skoring seperti yang dilakukan Vaish et al. (2011). Data pengamatan meliputi daya kecambah, panjang akar dan trubus diperoleh dari setiap perlakuan isolat dan kontrol. Selanjutnya dilakukan perhitungan skor dari data setiap parameter pengamatan berdasarkan sebaran kelas. Data setiap parameter pengamatan disusun berdasarkan nilai terendah sampai dengan tertinggi. Selanjutnya ditentukan jumlah kelas (k) menggunakan rumus k = 1 + 3.3 log n, dimana n adalah jumlah data yang diamati. Kemudian data yang diperoleh ditentukan skornya berdasarkan sebaran kelas dari data tersebut. Skor dari 3 parameter pengamatan dari setiap perlakuan isolat selanjutnya dijumlah menjadi total skor (Walpole dan Meyers 1996). Kemudian dipilih 10 % dari jumlah isolat yang ada, berarti 5 isolat yang memiliki total skor tertinggi. Kemudian 5 isolat bakteri endofit terbaik yang mendukung daya kecambah dan meningkatkan pertumbuhan bibit padi dipilih untuk penelitian selanjutnya.
Uji kemampuan menambat N2
Aktivitas nitrogenase dari bakteri penambat N2 secara tidak langsung diukur
berdasarkan pengurangan gas asetilen menjadi gas etilen atau Acetylene Reduction Assay (ARA) menggunakan Gas Chromatoghraphy (GC). Pengukuran penambatan N2 dilakukan sebagai berikut : isolat diinokulasi dalam media cair
Nitrogen Free Broth pada erlenmeyer 250 ml, diinkubasi pada mesin pengocok 180 rpm suhu 37oC selama 48 jam. Kemudian 20 ml suspensi isolat dimasukkan ke tabung inkubasi berkapasitas 30 ml. Jarum suntik steril 5 ml digunakan untuk mengambil 3 ml udara dari dalam tabung, diganti dengan 3 ml gas asetilen dan diinkubasi dalam mesin pengocok selama 24 jam. Penambatan N2 dari isolat
dihitung dengan mengukur produksi etilen.
13 diperoleh peak area yang digunakan untuk membuat persamaan regresi kurva baku yang dijadikan acuan dalam penghitungan konsentrasi gas etilen dalam sampel. Penghitungan konsentrasi gas etilen dilakukan dengan cara membandingkan peak area gas dalam sampel yang akan dihitung konsentrasinya dengan peak area gas standar yang sudah diketahui konsentrasinya. (Gothwal et al. 2008).
Uji kemampuan menghasilkan hormon IAA (Indole Acetic Acid)
Pengujian kemampuan isolat dalam menghasilkan IAA (Indole Acetic Acid) secara kuantitatif dengan menggunakan metode dari Akbari et al. (2007). Isolat ditumbuhkan pada media Nutrient Broth (Difco), untuk 1 L media membutuhkan 10 g Bacto Pepton, 10 g Beef Ekstrak, 5 g NaCl dan ditambahkan Triptofan 1.2115 g, pada pH media 7.5. Isolat diinokulasikan pada media NB+Triptofan dan diinkubasikan pada suhu ruang selama 5 hari pada mesin kocok dengan kecepatan 200 rpm. Koloni bakteri dipisahkan menggunakan sentrifus 8603 g selama 15 menit. Supernatan yang diperoleh dicampurkan dengan reagen Salkowski (100 ml asam klorat 35% dan 2 ml FeCl3 0.5M) dengan perbandingan 1:2, kemudian
diinkubasi selama 1 jam. Selanjutnya diukur menggunakan spektrofotometer pada panjang gelombang 520 nm, dengan menggunkan kurva standar, media NB dan standar IAA konsentrasi 0, 5, 10, 20, 30, 40, dan 50 ppm.
Uji kemampuan menghasilkan hormon Giberelin
Isolat ditumbuhkan pada media Jensen’s Broth, diinkubasi di mesin kocok selama 5 hari pada suhu 18oC. Selanjutnya kultur dipanen dan disentrifus pada 9167 g selama 10 menit. Kemudian masing-masing sampel diekstraksi dengan menambahkan 10 ml etil asetat murni dan divortek selama 1 menit. Setelah terjadi pemisahan larutan, ditambahkan kembali 10 ml etil asetat kemudian di vortek selama 1 menit. Hasil ekstraksi etil asetat tersebut disatukan, kemudian ditambahkan 10 ml larutan buffer fosfat dan di vortek selama 1 menit. Selanjutnya lapisan buffer fosfat dipindahkan ke tabung baru. Kemudian 5 ml larutan buffer fosfat ditambahkan ke dalam ekstrak etil asetat, divortek selama 1 menit. Setelah terjadi pemisahan, lapisan buffer fosfat dipindahkan ke tabung baru tersebut, ditambahkan kembali 5 ml buffer fosfat ke dalam ekstrak etil asetat dan di vortek selama 1 menit. Hasil ekstraksi kemudian ditambahkan buffer fosfat sampai volume 20 ml. Masing-masing sampel yang sudah diekstraksi diambil sebanyak 4.5 ml dan dicampurkan dengan 0.5 etanol murni lalu divortek. Selanjutnya ditambahkan 5 ml HCl 3,75 M, dengan jarak waktu 2 menit untuk tiap sampelnya. Setelah inkubasi, masing-masing larutan standard dapat diukur kadar absorbansinya dengan menggunakan kuvet silica menggunakan Spectrophotometer UV-Vis dengan panjang gelombang 254 nm, dengan konsentrasi untuk standar giberelin 0, 10, 20, 40, 60, 80, dan 100 ppm (Berr’ios et al. 2004).
Uji kemampuan menghasilkan hormon Sitokinin
14
kemudian dilakukan liofilisasi dan diekstraksi tiga kali dengan etil asetat. Fase organik diuapkan dengan vakum sampai kering dan dilarutkan dalam metanol (Sigma). Sitokinin terikat diekstraksi setelah fase air disesuaikan pH nya hingga 11 dan dihidrolisis. setelah pengeringan fase organik kembali dilarutkan dalam metanol. Kemudian fase cair tersebut disaring dengan Dowex 50Wx4, lalu dielusi dengan NH4OH 5 N. Eluat amoniak yang dihasilkan kemudian diukur dengan
High Performance Liquid Chromatography. Standar yang digunakan kinetin dan zeatin 0.1, 1.0, 5, 10, 15 dan 20 M (Rivier dan Crozie 1987).
Identifikasi Lima Isolat Bakteri Endofit Terpilih Morfologi dan uji biokimia bakteri endofit
Pengamatan morfologi koloni bakteri terhadap 5 isolat meliputi koloni bakteri yang meliputi warna, bentuk koloni, elevasi (kenampakan dari samping), bentuk pinggiran, dan tekstur permukaan (Hadioetomo 1993). Selanjutnya pengamatan morfologi sel bakteri meliputi bentuk sel, ukuran sel, dan pewarnaan Gram (Schaad et al. 2001). Pengujian biokimia terhadap 5 isolat menggunakan microbact kits (Mac Faddin 1979).
Pewarnaan Gram
Pewarnaan Gram untuk mengetahui bakteri endofit bersifat Gram positif atau Gram negatif. Perbedaan Gram ini disebabkan oleh struktur dinding sel bakteri. Gram (+) terdiri dari peptidoglikan sedangkan Gram (-) terdiri atas lipida yang larut oleh larutan pemucat. Cara yang dilakukan dalam pewarnaan Gram yaitu suspensi bakteri endofit dioleskan pada kaca obyek, kemudian difiksasi. Setelah itu diberi pewarna primer yaitu ungu kristal dan didiamkan selama 1 menit. Selanjutnya dibilas dengan dengan air menggunakan botol semprot dan dikeringkan bagian pinggir kaca obyek dengan tisu. Kemudian dikeringanginkan, diberi iodium dan didiamkan selama 2 menit. Selanjutnya dibilas dengan air menggunaan botol semprot. Kemudian dicuci dengan pemucat warna yaitu etanol 95%, tetes demi tetes selama 30 detik atau sampai zat warna ungu kristal tidak terlihat. Selanjutnya dicuci dengan air menggunakan botol semprot, kemudian dikeringanginkan. Selanjutnya diberi pewarna tandingan yaitu safranin selama 30 detik, dibilas dengan air dari botol semprot dan dikeringanginkan. Pengamatan menggunakan mikroskop, bakteri endofit berwarna biru gelap atau ungu berarti Gram positif, apabila berwarna merah muda berarti Gram negatif (Hadioetomo 1993).
Uji biokimia
Pengujian biokimia menggunakan microbac kits (Oxoid), dengan menumbuhkan bakteri endofit selama 24 jam pada media NA. Koloni bakteri di suspensi menggunakan air fisiologis steril. Suspensi diteteskan pada sumur-sumur microbact kits, dan ditunggu hasil reaksi nya. Uji biokimia meliputi kemampuan bakteri dalam menggunakan nitrat, lisin, ornitin, glukosa, manitol, xilos, citrat, gelatin, malonat, inositol, sorbitol, ramnosa, sukrosa, laktosa arabinosa, adonitol, rafinosa, salicin, arginan. Pengujian yang lain meliputi katalase, oksidase, H2S,
15 Identifikasi bakteri endofit berdasarkan sekuen gen 16S rRNA
Identifikasi 5 isolat berdasarkan sekuen parsial 16S rRNA. Isolasi DNA isolat menggunakan kit ekstraksi (Geneaid) sesuai dengan pedomannya. Selanjutnya deteksi DNA menggunakan teknik elektroforesis dengan gel agarosa. Konsentrasi gel agarosa yang digunakan 0.1 % dengan buffer TAE 1 x dicampur dengan 0.5 μg/ml ethium bromide. Kekuatan arus listrik 60 V selama 1 jam. Amplifikasi gen 16S rRNA menggunakan PCR (Polymerase Chain Reaction) dengan primer universal yaitu Forward primer 27F (5’ -AGAGTTTGATCCTGGCTCAG-3’) dan Reverse primer 1492R (5’-GGTTA CCTTGTTACGACTT-3’). Komponen PCR yang digunakan KAPA taq Ready Mix (KAPA Biosystem) sesuai dengan pedomannya. Proses PCR dilakukan sebanyak 30 siklus dengan kondisi pra PCR 95 oC selama 5 menit, denaturasi 95
o
C selama 1 menit, annealing 55 oC selama 5 menit, elongation 72 oC selama 1.5 menit, dan post-PCR 72 oC selama 5 menit. Hasil amplifikasi DNA selanjutnya disekuensing di laboratorium 1st BASE. Data hasil sekuensing dicocokkan dengan data Gene Bank NCBI (National Center for Biotechnology Information) menggunakan BLAST pada http://www.ncbi.nlm.nih.org.
Pengujian Kompatibilitas Bakteri Endofit
Pengujian kompatibilitas 5 bakteri endofit dibutuhkan untuk membuat kultur campuran bakteri endofit. Metode yang digunakan mengacu pada Widawati (2010). Pengujian kompatibilitas menumbuhkan 2 jenis bakteri endofit dengan digoreskan pada media NA di cawan petri. Kemudian diinkubasikan selama 24-72 jam. Selanjutnya diamati, ada atau tidak zona bening terbentuk pada perpotongan 2 jenis bakteri endofit. Bila zona bening terbentuk menandakan ada antagonis diantara bakteri endofit tersebut, sehingga tidak dipilih. Kultur campuran yang dipilih jika tidak membentuk zona bening pada perpotongan antar bakteri yang berarti bakteri endofit tersebut kompatibel satu dengan yang lainnya. Hal serupa juga dilakukan untuk pengujian kompatibilitas dari 3 jenis bakteri endofit. Pengujian kompatibilitas terdiri dari 25 perlakuan, meliputi 5 bakteri endofit tunggal, 10 kultur campuran terdiri 2 jenis bakteri endofit, dan 10 kultur campuran terdiri 3 jenis bakteri endofit.
16
perlakuan. Bibit dipindahkan ke dalam gelas plastik yang berisi media tanah steril. Bibit tanaman karet dipelihara selama satu bulan. Setelah dipelihara selama satu bulan, tanaman dipanen. Pengukuran panjang trubus (upper part) dan akar, juga penimbangan bobot kering bibit tanaman karet.
Skoring dilakukan untuk menentukan kultur campuran terbaik. Skor diperoleh dari perkalian parameter pengukuran dengan persen bobot nilai tiap parameter. Bobot nilai panjang trubus dan panjang akar 15%, sedangkan bobot nilai untuk bobot basah biomasa 20%, selanjutnya bobot nilai untuk bobot kering biomasa 30%. Selanjutnya panjang trubus dikalikan bobot nilainya (15%), panjang akar dikalikan bobot nilainya (15%). Sedangkan bobot basah biomasa dikalikan bobot nilainya (20%), dan bobot kering biomasa dikalikan bobot nilainya (30%). Selanjutnya hasil perkalian 4 parameter tersebut dijumlahkan. Penentuan kultur campuran berdasarkan skor tertinggi yang dijadikan dalam bentuk persentil. Perlakuan yang memiliki nilai perentil diatas 95 % yang dipilih untuk pegujian berikutnya. 10% terbaik dari 25 perlakuan aplikasi bakteri endofit dan kultur campuran, diperoleh 2 kultur campuran yang memiliki skor tertinggi (Walpole dan Meyers 1996).
17 Pengujian Bakteri Endofit untuk Meningkatkan Panjang Akar Planlet
Bakteri endofit yang diaplikasikan dapat meningkatkan pertumbuhan akar dengan dibuktikan menggunakan planlet bibit karet. Pengujian ini menggunakan 2 planlet bibit karet untuk kontrol tanpa inokulasi bakteri endofit dan perlakuan inokulasi bakteri endofit. Planlet bibit karet yang telah diinokulasikan bakteri endofit, ditunggu sampai terbentuk akar. Setelah 3 minggu, planlet dikeluarkan dari tabung. Akar planlet yang diinokulasi bakteri endofit diukur dibandingkan dengan kontrol.
Pengujian Kultur Campuran untuk Meningkatkan Efisiensi Pemupukan Bibit Batang Bawah Tanaman Karet
Kegiatan penelitian ini dilakukan di rumah kaca dengan rancangan acak lengkap faktorial dengan menggunakan 5 ulangan, yaitu :
Faktor pertama inokulasi kultur campuran (K) menggunakan 3 perlakuan : 1. tanpa inokulasi kultur campuran (K0)
2. inokulasi kultur campuran 1 (K1) 3. inokulasi kultur campuran 2 (K2)
Faktor kedua dosis pemupukan (P) menggunakan 5 perlakuan : 1. tanpa pemupukan (P0)
2. pemupukan 25 % dari dosis rekomendasi (P1) 3. pemupukan 50 % dari dosis rekomendasi (P2) 4. pemupukan 75% dari dosis rekomendasi (P3) 5. pemupukan 100% dari dosis rekomendasi (P4)
Media tanam diambil dari tanah di perkebunan karet sampai kedalaman kurang lebih 20 cm. Bahan tanah selanjutnya diayak menggunakan ayakan 10 mm dan diaduk hingga homogen. Sebanyak 10 kg bahan tanah homogen dimasukkan ke dalam kantung plastik (polibeg). Setiap kantung plastik ditanami dengan satu bibit batang bawah tanaman karet (berasal dari biji), dimana biji tanaman karet PB 260 yang digunakan telah direndam dalam suspensi kultur campuran. Pengulangan pemberian biakan bakteri dilakukan setelah bibit tanaman karet tumbuh di kantung plastik dengan cara disiramkan pada pangkal batang. Bibit dipelihara selama 3 bulan setelah berkecambah. Pengamatan pertumbuhan vegetatif meliputi: tinggi, diameter. Setelah 3 bulan, dipanen trubus tanaman dan akar tanaman karet diukur panjang akar, ditimbang bobot basah biomasa dan bobot kering biomasa.
Analisis data
Data yang diperoleh diolah dengan analisis ragam dan apabila ada beda nyata dilanjutkan dengan Uji Jarak Berganda Duncan pada taraf 5%. Olah data menggunakan program komputer SAS (Statistical Analysis System) for windows versi 9.1 (Matjik dan Sumertajaya 2006).
Analisis tanah dan tanaman
Analisis tanah sebelum perlakuan dan profil tanah meliputi meliputi kadar N tanah (metode Kjeldahl), P2O5 (Bray II), kation dapat ditukar K, Ca, Mg, KTK
18
setelah perlakuan meliputi kadar N tanah (metode Kjeldahl), P2O5 (Bray II),
kation dapat ditukar K, Ca, Mg. Analisa jaringan tanaman meliputi N (metode Kjeldahl cara pengabuan basah dengan H2SO4), P, K, Ca dan Mg (pengabuan
basah dengan H2SO4 dan H2O2) (Balai Penelitian Tanah 2009). Analisa dilakukan
19
HASIL DAN PEMBAHASAN
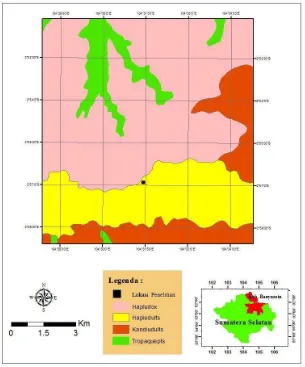
Kondisi Lokasi Pengambilan Contoh di Perkebunan Karet Menghasilkan Lokasi pengambilan sampel di Blok klon IRR 39 dan IRR 118 tahun tanam 2002, Divisi I Kebun Percobaan Balai Penelitian Sembawa, Kecamatan Sembawa, Kabupaten Banyuasin, Sumatera Selatan. Peta lokasi pengambilan contoh seperti Gambar 2 yang menunjukkan jenis tanah pada lokasi tersebut yaitu Hapludult.
Gambar 2 Peta jenis tanah lokasi pengambilan contoh
Peta jenis tanah lokasi penelitian dibuat berdasarkan peta jenis tanah digital dari Balai Besar Penelitian Sumberdaya Lahan Pertanian (2013), peta administrasi digital Provinsi Sumatera Selatan, dan peta administrasi digital Kabupaten Banyuasin dari Bakosurtanal (2013). Peta administrasi Sumatera Selatan dan Banyuasin ditumpang tindihkan (overlay) untuk mendapatkan peta administrasi daerah penelitian, menggunakan program komputer Arc GIS 10.1. Titik lokasi profil tanah dan pengambilan contoh dari GPS (Global Positioning System) yaitu
20
Quantum GIS 2.4, agar dapat dibaca oleh Arc GIS 10.1. Titik lokasi tersebut dimasukkan ke program komputer Arc GIS 10.1, kemudian dilakukan digitasi peta untuk mendapatkan peta jenis tanah lokasi pengambilan contoh.
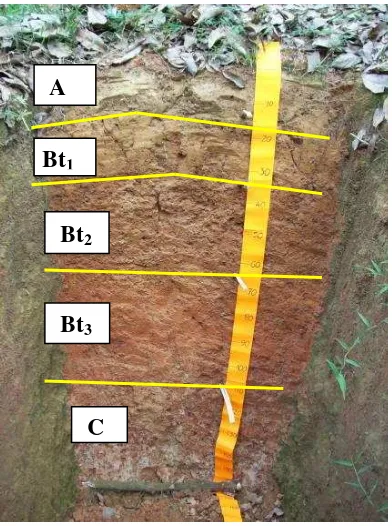
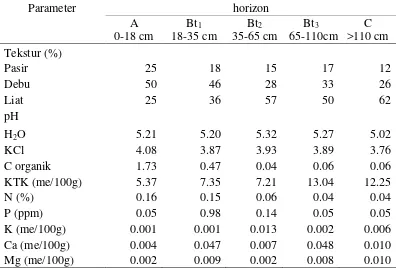
Pada lokasi pengambilan contoh juga dibuat profil tanah dengan lebar 1 m, panjang 2 m, dan kedalaman 1.5 m (Gambar 3) yang memperlihatkan 5 horizon tanah. Analisa tanah dari 5 horizon profil tanah meliputi tekstur, pH tanah, C organic, Kapasitas Tukar Kation (KTK) dan kandungan hara tanah (Tabel 1). Profil tanah di buat di blok klon IRR 118 Divisi I Kebun Percobaan Balai Penelitian Sembawa.
Gambar 3 Profil tanah di lokasi pengambilan contoh
Berdasarkan pengamatan dan hasil analisa tanah pada profil tanah terlihat 5 horizon, yang terdiri dari horizon A, horizon Bt1, Bt2 dan Bt3 yang merupakan
horizon iluviasi dimana terjadi peningkatan liat pada lapisan di bawahnya (Tabel 1), serta horizon C. Berdasarkan peta jenis tanah, pengamtan profil tanah, dan analisa laboratorium, lokasi penelitian termasuk Great Group Hapludult, Sub Ordo Udult, dan Ordo Ultisol. Menurut Rachim (2007), Ultisol termasuk tanah yang memiliki horizon argilik atau kandik dengan kejenuhan basa rendah, yang terbentuk dibawah regim suhu dan kelembaban yang beragam. Ultisol didominasi horizon eluviasi dan iluviasi liat. Horison penciri disini adalah horizon argilik. Sedangkan horizon C merupakan lapisan bahan induk.
Kondisi hara tanah pada profil tanah semakin ke bawah semakin rendah. Berdasarkan kelas kandungan hara tanah di perkebunan karet, termasuk rendah (Lampiran 1). pH tanah pada kisaran 5 termasuk masam. C organik pada horizon A yang paling tinggi yaitu 1.73 %, hal ini terjadi karena pada perkebunan karet banyak ditemui seresah daun karet yang mengalami dekomposisi. Berdasarkan
C Bt3
Bt2
A
21 kelas kandungan hara tanah di perkebunan karet termasuk rendah. C organik (0.06 % – 1.73 %), kadar hara Nitrogen (0.04% – 0.16 %), dan KTK (5.37 – 13.04 me/100g) pada profil tanah tersebut termasuk sangat rendah sampai dengan rendah. Sedangkan kadar hara Fosfor, Kalium, Kalsium, dan Magnesium termasuk sangat rendah. Hal ini memperlihatkan kondisi kesuburan tanah di lokasi penelitian termasuk rendah.
Tabel 1 Sifat kimia dan fisik setiap horizon tanah pada profil contoh yang diambil
Parameter horizon 2013) 2,659 mm/th, rata-rata hari hujan 132 hari/th, dan rata-rata bulan kering 3 bulan/th (Balai Penelitian Sembawa 2014). Hal ini menunjukkan kesesuaian iklim untuk tanaman karet di lokasi penelitian termasuk sesuai pada kelas S2. Curah hujan termasuk berkisar 1,500-3,000 mm/th, dengan jumlah bulan kering 3-4 bulan/th, dan suhu 25-28 (Wijaya et al. 1996).
Rata-rata suhu di lokasi penelitian selama 11 tahun (2000-2011) 27,4oC, rata-rata kelembaban relatif 86.5 %, dan rata-rata kecepatan angin 2.61 km/jam. Hal ini masih sesuai untuk tanaman karet, seperti Tabel 2, suhu 27,4 oC termasuk dalam kisaran kelas kesesuaian iklim S2 yaitu 25 - 28 oC. Menurut Vijayakumar et al. (2000) bahwa batasan untuk kelembaban relatif adalah 70%, sedangkan kecepatan angin 3.6 – 14.4 km/jam. Lokasi penelitian masih sesuai secara iklim untuk mendukung pertumbuhan tanaman karet.
22
Tabel 2 Kriteria agroklimat tanaman karet
Zona Curah hujan Jumlah lebih jagur penampilan tanamannya dibanding klon IRR 118. Hal ini karena klon IRR 39 merupakan klon lateks kayu yang memberikan hasil lateks dan kayu, sehingga penampilan sebagai penghasil kayu tampak jagur. Sedangkan klon IRR 118 merupakan klon lateks.
Gambar 4 Lokasi pengambilan contoh di Kebun Percobaan Balai Penelitian Sembawa, (a) klon IRR 39, dan (b) klon IRR 118
23 Contoh yang diambil dari tanaman karet klon IRR 39 dan klon IRR 118, meliputi daun, kulit sadapan (tatal), dan akar, seperti pada Gambar 5.
Gambar 5 Contoh yang diambil dari tanaman karet menghasilkan klon IRR 39 dan IRR 118, (a) daun, (b) kulit sadapan (tatal), dan (c) akar
Bakteri endofit diisolasi dari bagian daun, kulit sadapan (tatal), dan akar serabut tanaman karet klon IRR 39 dan IRR 118. Berdasarkan rekomendasi klon karet periode 2010-2014, untuk klon metabolisme tinggi ada 2 tipe klon yaitu klon latek dan klon latek-kayu, salah satu klon yang masuk tipe tersebut adalah klon IRR 118 untuk klon latek dan klon IRR 39 klon latek-kayu, kedua klon tersebut telah disebarluaskan penanamannya. Klon IRR 118 memiliki potensi produksi karet kering rata-rata 2,200 kg/ha, sedangkan IRR 39 1,493kg/ha (Lasminingsih 2010).
Penelitian ini juga menggunakan biji dari klon anjuran untuk batang bawah yaitu PB 260, seperti pernyataan Lasminingsih (2010) bahwa benih anjuran untuk batang bawah meliputi klon AVROS 2037, GT 1, BPM 24, PB 260, RRIC 100, dan PB 330.
Hasil Isolasi Bakteri Endofit dari Tanaman Karet
Bakteri endofit diisolasi dari tanaman karet menggunakan metode sterilisasi permukaan dengan konsentrasi NaOCl 3 % dan 4 %, sedangkan waktu perendaman 2 menit, 3 menit, dan 4 menit. Pada perendaman NaOCl 4 % terjadi kontaminasi bakteri dan jamur, sehingga konsentrasi ini tidak digunakan. Pada perendaman NaOCl 3 % dengan waktu perendaman 3 menit dan 4 menit pada daun, serta 2 menit dan 4 menit pada akar dan kulit sadapan, terjadi kontaminasi bakteri dan jamur. Sedangkan perendaman NaOCl 3 % dengan waktu 2 menit untuk daun dan 3 menit untuk akar dan kulit sadapan, media isolasi tempat disapukan contoh bersih, berarti sterilisasi permukaan berhasil.
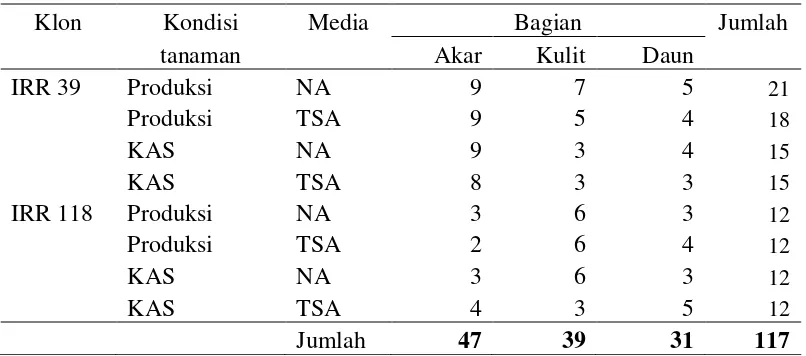
Bakteri endofit diisolasi dari tanaman karet memiliki sebaran berdasarkan klon, kondisi tanaman, media, dan bagian yang diisolasi (Tabel 3).
Sebanyak 117 isolat bakteri endofit berhasil diisolasi dari beberapa bagian tanaman karet (Tabel 3). Bagian akar memiliki jumlah isolat bakteri terbanyak, hal ini karena bakteri endofit bisa berasal dari bakteri rizosfer yang masuk ke jaringan akar tanaman dan mengkolonisasi jaringan akar tersebut. Selain itu didukung keberadaan akar tanaman di dalam tanah yang ternaungi dari sinar matahari langsung, sehingga lebih banyak diperoleh isolat bakteri endofit. Hasil