DEPURASI TIMBAL (Pb) DARI IKAN NILA NIRWANA
(
Oreochromis niloticus
) MENGGUNAKAN PAKAN YANG
DISUBSTITUSI BUNGKIL KELAPA DAN KELAPA SAWIT
FARIDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Depurasi Timbal (Pb) dari Ikan Nila Nirwana (Oreochromis niloticus) Menggunakan Pakan yang Disubstitusi Bungkil Kelapa dan Kelapa sawit adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Farida
RINGKASAN
FARIDA. Depurasi Timbal (Pb) dari Ikan Nila Nirwana (Oreochromis niloticus) Menggunakan Pakan yang Disubstitusi Bungkil Kelapa dan Kelapa Sawit. Dibimbing oleh KUKUH NIRMALA dan D DJOKOSETIYANTO.
Ikan nila Nirwana merupakan ikan konsumsi yang popular di Indonesia dan merupakan spesies budidaya yang penting. Nirwana banyak dibudidayakan di lokasi dengan karakteristik air yang berbeda sehingga dapat menyebabkan nirwana terkontaminasi oleh berbagai bahan beracun dan berbahaya termasuk timbal (Pb). Ikan memiliki kemampuan untuk menyerap dan mengakumulasi Pb dari perairan dalam jaringan tubuh, terutama jaringan tubuh yang mengandung banyak lemak seperti jaringan otot dan organ-organ viscera. Proses penyerapan dan akumulasi merupakan mekanisme yang unik dan berbeda-beda untuk setiap spesies ikan serta tingkat konsentrasinya linier dengan waktu. Senyawa Pb yang terakumulasi dapat berdampak lethal, sub lethal dan kronis terhadap ikan budidaya dan dapat mengalami biomagnifikasi saat masuk dalam rantai makanan serta akan berdampak pula pada manusia. Oleh karena itu perlu dilakukan perlakuan pascapanen ikan yang di budidayakan tersebut untuk membersihkan atau mengurangi konsentrasi Pb. Pembersihan atau pengurangan Pb dari ikan dapat dilakukan dengan cara depurasi. Metode depurasi yang digunakan dalam penelitian ini adalah dengan memberikan pakan yang disubstitusi bungkil kelapa dan kelapa sawit yang memiliki kemampuan menyerap Pb dari jaringan tubuh ikan. Hal ini didasarkan pada bungkil kelapa dan bungkil kelapa sawit termasuk bahan nabati yang umumnya memiliki serat kasar dan lemak yang tinggi. Serat kasar dibutuhkan dalam pakan untuk membantu proses pencernaan makanan. Lemak yang terkandung dalam pakan, diharapkan dapat menyerap sejumlah besar logam berat yang terdeposit dalam jaringan tubuh ikan.
Penelitian ini bertujuan menganalisa potensi bungkil kelapa dan kelapa sawit untuk depurasi Pb dari daging nirwana. Manfaat penelitian ini sebagai informasi bagi pembudidaya nila dan masyarakan perikanan, tentang penggunaan produk lokal sebagai alternatif bahan pakan untuk meningkatkan keamanan pangan melalui mekanisme depurasi.
Perlakuan dalam penelitian ini adalah pakan komersial 100% (Pk), 30% bungkil kelapa + 70% pakan komersial (PBK) dan 30% bungkil kelapa sawit + 70% pakan komersial (PBS). Ikan nila nirwana yang digunakan dengan bobot (100±15 g) sebanyak 90 ekor yang disebar ke dalam wadah drum plastik masing-masing 10 ekor sesuai jumlah perlakuan (tiga perlakuan dan tiga ulangan). Ikan uji diinjeksi dengan 1 mg/L Pb(NO3)2 secara intraperitoneal. Tiap-tiap hewan uji diberi pakan perlakuan secara at satiasi dua kali sehari selama delapan hari. Sampling dilakukan pada hari ke dua, empat, enam dan delapan. Parameter yang diamati adalah kandungan Pb didaging, feses dan air pemeliharaan, proksimat daging untuk mengetahui kandungan lemak dan serat kasar pada daging ikan, histokimia pada hati dan ginjal, kelangsungan hidup, laju pertumbuhan dan kualitas air. Analisis data yang digunakan adalah ANOVA dan deskriptif.
pakan tertinggi pada perlakuan PBK 13.33% dan PBS 4.78% dengan kandungan serat kasar pada PBK 0.38% dan PBS 7.23%. Hasil ini menunjukkan bahwa bungkil kelapa dan kelapa sawit yang disubstitusikan kedalam pakan dapat digunakan sebagai agen depurasi dan berhasil mereduksi sejumlah besar xenobiotik Pb dari jaringan ikan melalui feses.
SUMMARY
FARIDA. Depuration of Lead (Pb) from Nirwana Tilapia (Oreochromis niloticus) Using Coconut Cake and Palm Oil Cake Substituted Feed. Supervised by KUKUH NIRMALA and D DJOKOSETIYANTO.
Nirwana Tilapia is not only a popular fish for consumption in Indonesia but also an important aquaculture species. Nirwana is widely cultivated in locations with different water characteristics that can make the fish contaminated by various toxic and hazardous substances, including lead (Pb). Fish have the ability to absorb and accumulate Pb from the water in their body tissues, especially the tissues of the body that contains a lot of fat and muscle tissue such as the organs of the viscera. The process of absorption and accumulation is a mechanism that is unique and different for each fish species with the level of concentration which is linear with time. The Pb compound that accumulates can bring an effect which is lethal, sub-lethal and chronic to cultured fish and may experience biomagnifications in the food chain and will have an impact on human. Therefore, it is necessary to carry out post-fish harvest treatment of the cultured fish to clean up or reduce the concentration of Pb. The cleaning up or Pb reduction of fish can be done by depuration. The depuration method used in this research was by providing coconut cake and palm oil cake as substituted feed which have the ability to absorb Pb from the body tissues of fish since coconut cake and palm oil cake are actually vegetable materials that generally have coarse fiber and high fat. The coarse fiber in the diet is needed to assist in the digestion of food. The fat in the feed is expected to absorb large amounts of heavy metals deposited in the body tissues of fish.
This study aimed to analyze the potential of coconut cake and palm oil cake for Pb depuration of nirwana. The research result would be benefitial information for farmers and the community of tilapia fishery, especially on the use of local products as alternative feed ingredients to improve food security through depuration mechanism.
The treatments in this study were 100% commercial feed (Pk), 30% coconut cake + 70% commercial feed (PBB) and 30% palm oil cake + 70% commercial feed (PBS). The nirwana tilapia used with a weight of 100 ± 15 g. 10 fish were put in each plastic drum container corresponding with the number of treatments (3 treatments and 3 replications). Test fish were injected with 1 mg/L Pb(NO3)2 intraperitoneally. Each test animal was fed at satiation twice a day for
eight days. The sampling was done on days two, four, six and eight. Parameters observed were Pb content in flesh, feces and water used in the raising activity, proximate flesh to find out the content of fat and coarse fiber in the fish flesh, histochemistry in liver and kidney, survivability, growth rate and water quality. The data analysis used was ANOVA and descriptive.
cake-substituted Feed was used as depuration agents that successfully reduced a large amount of xenobiotic Pb from the fish tissue via their feces.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
DEPURASI TIMBAL (Pb) DARI IKAN NILA NIRWANA
(
Oreochromis niloticus
) MENGGUNAKAN PAKAN YANG
DISUBSTITUSI BUNGKIL KELAPA DAN KELAPA SAWIT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Depurasi Timbal (Pb) dari Ikan Nila Nirwana (Oreochromis niloticus) Menggunakan Pakan yang Disubstitusi Bungkil Kelapa dan Kelapa Sawit
Nama : Farida NIM : C151110131
Disetujui oleh Komisi Pembimbing
Dr Ir Kukuh Nirmala, MSc Ketua
Prof Dr Ir D Djokosetiyanto, DEA Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan bulan April-Mei 2013 ialah logam berat, dengan judul Depurasi Timbal (Pb) dari Ikan Nila Nirwana (Oreochromis niloticus) Menggunakan Bungkil Kelapa dan Kelapa Sawit.
Ungkapan terimakasih disampaikan kepada :
1. Bapak Dr Ir Kukuh Nirmala, MSc dan Bapak Prof Dr Ir D Djokosetiyanto, DEA selaku pembimbing yang telah banyak memberikan saran dan masukan dalam menyelesaikan karya ilmiah ini.
2. Bapak Dr Ir Eddy Supriyono, MSc sebagai dosen penguji luar komisi dan Ibu Dr Ir Widanarni, MSi sebagai dosen penguji dari Program Studi Ilmu Akuakultur atas saran dan masukan untuk perbaikan tesis ini.
3. Kementerian Pendidikan, Dirjen Dikti yang telah memberikan beasiswa studi. 4. Balai Pengembangan Banih Ikan Air Tawar (BPBIAT) Wanayasa atas bantuan
ikan nila nirwana.
5. Kedua orang tua tercinta Bapak Mansyur dan Ibu Maryamah serta adik-adik tercinta, atas doa dan kasih sayangnya.
6. Suami saya tercinta Abdul Zahri, S.Pi atas kesetiaan dan kesabaran selama penulis melaksanakan studi.
7. Teman-teman AKU 2011 atas bantuan dan dukungan yang diberikan. Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR ISI i
DAFTAR TABEL ii
DAFTAR GAMBAR ii
DAFTAR LAMPIRAN ii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
Bungkil Kelapa 3
Karakteristik Logam Berat Pb 5
Pencemaran Logam Berat 6
Akumulasi Logam Berat Pb Oleh Ikan 6
Pengaruh Logam Berat Pb Pada Manusia 7
Depurasi 7
Kualitas Air 8
3 METODE 8
Bahan 8
Alat 9
Tahapan Penelitian 9
Parameter yang Diamati 10
Prosedur Analisis Data 11
4 HASIL DAN PEMBAHASAN 11
Pakan Perlakuan 11
Kandungan Pb Daging, Feses dan Air 13
Kelangsungan Hidup dan Laju Pertumbuhan 14
Hubungan pH pada Penyerapan Timbal oleh Pakan 15
5 SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR TABEL
1 Kandungan asam lemak dalam bungkil kelapa 4
2 Komposisi proksimat bungkil kelapa sawit 5
3 Persentase bobot basah proksimat bahan substitusi pakan dan formulasi
pakan 12
4 Persentase bobot basah daging ikan nila Nirwana selama penelitian 12 5 Konsentrasi Pb pada daging, feses dan air selama penelitian 13
6 Korelasi serat kasar, lemak dengan feses 14
7 Parameter kualitas air media selama pemeliharaan 16
DAFTAR GAMBAR
1 Diagram alir tahapan penelitian; BK (bungkil kelapa); BS (bungkil kelapa
sawit); Pk (pakan komersial) 9
2 Kelangsungan hidup dan laju pertumbuhan ikan uji selama penelitian terhadap pakan komersial (Pk), pakan komersial yang disubstitusi bungkil sawit (PBS), pakan komersial yang disubstitusi bungkil kelapa
(PBK). 15
3 Komplek timbal-ethylenediamine 16
DAFTAR LAMPIRAN
1 Analisis sidik ragam serat kasar, lemak dengan feses 18 2 Histokimia Hati ikan nila Nirwana selama penelitian. 18 3 Histokimia ginjal ikan nila Nirwana selama penelitian 18 4 Prosedur penentuan kadar logam berat Pb berdasarkan SNI 2354.5:2011 18
5 Prosedur analisis proksimat kadar protein 18
6 Prosedur analisis proksimat kadar lemak 18
7 Prosedur analisis kadar air 18
8 Prosedur analisis proksimat kadar abu 18
9 Prosedur analisis proksimat serat kasar 18
1
PENDAHULUAN
Latar Belakang
Ikan nila Nirwana (nila ras wanayasa) merupakan ikan konsumsi yang dihasilkan dari proses pemuliaan ikan nila (Oreochromis niloticus), menggunakan metode seleksi famili yang dilakukan Balai Pengembangan Benih Ikan Air Tawar (BPBIAT) Wanayasa. Sebagai ikan budidaya dengan tujuan konsumsi, Nirwana dibudidayakan dibanyak tempat dengan beragam karakteristik lokasi dan sumber air yang dapat menyebabkan terjadinya kontaminasi Nirwana dengan berbagai jenis logam berat beracun dan berbahaya seperti timbal (Pb). Logam berat Pb yang berada dalam perairan berasal dari berbagai sumber, yaitu akibat dari aktifitas manusia dan proses alam. Aktifitas manusia dapat berupa industri, pertambangan dan transportasi termasuk asap kendaraan bermotor sedangkan melalui proses alam melalui peluruhan Pb dari kerak bumi oleh air tanah.
Di perairan umum, Pb tersedia diantaranya dalam bentuk garam nitrat, sulfat (Kusemiju et al. 2012) dan asetat (Doaa dan Hanan, 2013). Kadar Pb di sedimen sungai Ciliwung pada stasiun Srengseng 18 mg/kg, stasiun Condet 41 mg/kg, stasiun Manggarai 61 mg/kg dan kadar Pb di daging ikan sapu-sapu <0.02 mg/kg (Ratmini, 2009). Kadar logam berat Pb dalam air laut (0.0028-0.0030 ml/L) dan Pb di sedimen muara sungai Digul Arafura 6.41-7.09 mg/kg (Rochyatun et al. 2004). Masuknya Pb ke dalam sistem lingkungan, baik secara langsung maupun tidak langsung akan berdampak pada kondisi perairan dan organisme yang hidup di dalamnya. Konsentrasi Pb tersebut akan semakin meningkat seiring dengan meningkatnya beban masukan yang mengandung Pb ke dalam perairan sehingga dapat terakumulasi dalam tubuh ikan.
Ikan memiliki kemampuan untuk menyerap dan mengakumulasi Pb dari perairan dalam jaringan tubuh, terutama jaringan tubuh yang mengandung banyak lemak seperti jaringan otot dan organ-organ viscera. Penelitian Jerieska dan Witeska (2006), menemukan Pb terakumulasi pada organ otot, ginjal dan tertinggi pada hati sehingga hati proporsional digunakan sebagai biomonitor polusi logam berat pada air. Toth et al. (2012), menemukan konsentrasi timbal dalam jaringan ikan mas (otot sebanyak 0.09-0.48 mg/kg, hepatopankreas 0.14-0.35 mg/kg, ginjal 0.19-0.80 mg/kg, gonad 0.27-0.66 mg/kg, kulit 0.24-3.79 mg/kg, insang 1.40-2.16 mg/kg, sirip 2.29-3.18 mg/kg). Staniskiene et al. (2006) juga menemukan konsentrasi Pb dalam daging ikan 0.059-3.125 mg/kg, tulang 0.061-3.301 mg/kg, hati 0.210-0.941 mg/kg, insang 0.191-3.498 mg/kg dan usus 0.110-0.219 mg/kg. Robin (2012), kandungan Pb yang ditemukan pada organ daging ikan patin jambal yang dibudidayakan di lahan kolong bekas galian tambang timah propinsi Kepulauan Bangka Belitung sebanyak 3.57 mg/kg. Nilai tersebut diatas aman konsumsi yang diperbolehkan untuk manusia yaitu 2 mg/kg (Ditjen POM, 1989).
Proses penyerapan dan akumulasi merupakan mekanisme yang unik dan berbeda-beda untuk setiap spesies ikan serta tingkat konsentrasinya linier dengan waktu. Senyawa Pb yang terakumulasi dapat berdampak lethal, sub lethal dan kronis terhadap ikan budidaya dan dapat mengalami biomagnifikasi saat masuk dalam rantai makanan serta akan berdampak pula pada manusia. Oleh karena itu perlu dilakukan perlakuan pascapanen ikan yang di budidayakan tersebut untuk membersihkan atau mengurangi konsentrasi Pb.
2
penanganan pasca panen yang bertujuan untuk membersihkan ikan dari bahan-bahan berbahaya dan beracun. Metode depurasi yang umum dilakukan adalah dengan pemeliharaan ikan dalam air yang bebas logam berat, sehingga diharapkan senyawa Pb akan luruh dan terlarut ke dalam air. Permasalahannya adalah Pb lebih bersifat lipofilik sehingga sukar terlarut dalam air bila telah berikatan dalam lemak. Al-Nagaawy (2008), melakukan depurasi menggunakan air bebas Pb dan berhasil mengeliminasi senyawa Pb daging ikan nila pada konsentrasi 132.42±7.62 mg/kg turun ke 51.50±3.34 mg/kg selama 15 hari.
Metode depurasi lainnya yang digunakan dalam penelitian ini adalah dengan memberikan pakan tertentu yang memiliki kemampuan menyerap Pb dari jaringan tubuh ikan. Lemak yang terkandung dalam pakan, diharapkan dapat menyerap sejumlah besar logam berat yang terdeposit dalam jaringan tubuh ikan. Metode ini didasarkan pada karakteristik senyawa Pb yang cenderung terikat pada substrat yang mengandung lemak. Savitri dan Salami (2011) juga menemukan kecenderungan logam berat terikat dengan lemak dalam jaringan tubuh.
Sumber lemak dalam pakan komersial umumnya berasal dari tepung ikan atau minyak ikan, sementara dalam penelitian ini sumber lemak akan ditambahkan dengan memanfaatkan bungkil kelapa dan kelapa sawit. Sesuai SNI 1996, bungkil kelapa adalah hasil ikutan dari ekstraksi daging buah segar atau kering. Pemilihan bungkil kelapa dan kelapa sawit didasarkan pada kandungan lemak yang cukup tinggi. Norita et al. 2012, memperoleh kandungan lemak kasar 84.71±0.79% dan kandungan serat kasar 54.81±0.93% dengan panambahan 30% palm kernel. Penelitian lain ditemukan lemak kasar 12.91–14.51% dan serat kasar 23.64 % (Ochang et al. 2007; Orire dan Sadiku, 2012). Pemanfaatan lemak kelapa yang berasal dari minyak maupun tepung kelapa telah berkembang, penelitian yang dilakukan Aderolu dan Akinremi (2009) dan Sotolu (2010), menambahkan 5–10% minyak kelapa memberikan pertumbuhan yang baik pada ikan nila. Sedangkan Hertrampf dan Piedad-Pascual (2000) merekomendasikan 5–15%. Konsekuensi tingginya lemak berdampak pada rendahnya kandungan protein daging ikan, sehingga waktu pemberian pakan harus dibatasi.
Serat juga merupakan salah satu bagian terbesar dari proksimat bungkil kelapa 25–30%, selain lemak, protein dan bahan ekstrak tanpa nitrogen (BETN). Kandungan serat yang terlalu tinggi akan sulit dicerna oleh ikan, tetapi menurut Piliang dan Djojosoebagio (2006) dalam jumlah tertentu serat juga penting untuk membantu proses pencernaan pakan. Karenanya, penambahan bahan yang mengandung serat kasar tinggi dalam bahan pakan diupayakan tidak lebih dari 30%.
Perumusan Masalah
Pb dapat masuk ke perairan akibat dari aktifitas manusia dan proses alam. Aktifitas manusia dapat berupa industri, pertambangan dan transportasi. Sedangkan melalui proses alam melalui peluruhan Pb dari kerak bumi oleh air tanah. Masuknya Pb ke dalam sistem lingkungan, baik secara langsung maupun tidak langsung akan berdampak pada kondisi perairan dan organisme yang hidup di dalamnya. Konsentrasi Pb tersebut akan semakin meningkat seiring dengan meningkatnya beban masukan yang mengandung Pb ke dalam perairan sehingga dapat terakumulasi dalam tubuh ikan.
3 Pemanfaatan bungkil kelapa dan bungkil kelapa sawit melalui pakan pada penelitian ini lebih ditekankan untuk depurasi Pb dari daging nila Nirwana. Hal ini didasarkan pada bungkil kelapa dan kelapa sawit termasuk bahan nabati yang umumnya memiliki serat kasar dan lemak yang tinggi. Serat kasar dibutuhkan dalam pakan untuk membantu proses pencernaan makanan (Piliang dan Djojosoebagio, 2006). Lebih lanjut dikatakan bahwa dalam keadaan tanpa serat, feses dengan kandungan air rendah akan lebih lama tinggal dalam usus yang dapat menyebabkan gangguan pada gerakan peristaltik pada usus besar sehingga ekskresi feses menjadi lebih lambat. Sebaliknya pakan dengan kandungan serat kasar yang tinggi dapat menyebabkan absorbsi zat makanan berkurang dan koefisien cerna zat makanan menjadi rendah. Selain itu, logam berat mempunyai kecenderungan untuk terikat dengan lemak yang ada dalam tubuh (Savitri dan Salami, 2011). Berdasarkan hal tersebut diharapkan kandungan lemak dan serat kasar yang terdapat dalam bungkil kelapa dan kelapa sawit dapat mengikat Pb dikeluarkan dari tubuh ikan melalui feses.
Penggunaan bungkil kelapa dan kelapa sawit dalam pakan didasarkan pada pemanfaatan bahan baku lokal yang tidak terpakai lagi bagi konsumsi manusia. Produksi kelapa Indonesia mengalami peningkatan dari tahun ke tahun sehingga pengolahan minyak kelapa yang akan terus meningkat maka secara otomatis akan terjadi peningkatan limbah bungkil kelapa. Sedangkan bungkil kelapa sawit yang merupakan hasil samping agro industri pengolahan sawit menjadi minyak sawit juga dapat menyebabkan peningkatan limbah bungkil kelapa sawit.
Tujuan Penelitian
Penelitian ini bertujuan menganalisis potensi bungkil kelapa dan kelapa sawit untuk depurasi Pb pada ikan nila nirwana.
Manfaat Penelitian
Manfaat penelitian ini adalah memberikan informasi kepada pembudidaya ikan dan masyarakat, bahwa pemanfaatan produk lokal (bungkil kelapa dan kelapa sawit) sebagai bahan pakan alternatif dapat meningkatkan keamanan pangan melalui mekanisme depurasi.
2
TINJAUAN PUSTAKA
Bungkil Kelapa
Bungkil kelapa merupakan produk sampingan dari keperluan rumah tangga, industri pembuatan kue, dan dari pengolahan minyak kelapa baik skala rumah tangga maupun skala besar yang menggunakan teknologi dalam pengolahan minyak kelapa. Potensi bungkil k
4
produsen kelapa yaitu dengan luas lahan ±3,9 juta ha memproduksi 3,3 juta ton setara kopra (Ditjen Perkebunan, 2010). Dari tahun ke tahun produksi kelapa Indonesia terus meningkat, sehingga secara otomatis akan terjadi peningkatan limbah bungkil kelapa.
SNI (1996), bungkil kelapa adalah hasil ikutan yang didapat dari ekstraksi daging buah segar atau kering. Bungkil kelapa masih mengandung protein, karbohidrat, mineral dan sisa-sisa minyak yang masih tertinggal. Karena kandungan protein yang cukup tinggi, maka bungkil kelapa cukup baik apabila digunakan sebagai pakan ternak.
Protein kasar yang terkandung dalam bungkil kelapa mencapai 23% dan kandungan seratnya yang mudah dicerna merupakan suatu keuntungan tersendiri untuk menjadikan bungkil kelapa sebagai bahan pakan pellet (Derrick, 2005). Bungkil kelapa juga mengandung asam amino yang sangat bermanfaat untuk pertumbuhan ikan. Selain itu bungkil kelapa juga mengandung asam lemak yang bersifat esensial untuk ikan (Tabel 1).
Lemak merupakan sumber energi dalam pakan, tetapi penggunaan lemak dalam pakan perlu pemahaman yang tepat baik dalam jumlah, jenis ataupun sumber asalnya. Penggunaan yang kurang tepat dapat mengakibatkan pakan mudah rusak, menurunkan efisiensi pakan, pemborosan secara ekonomis.
Bungkil Sawit
Kelapa sawit adalah salah satu komoditas non migas dari sektor pertanian Indonesia. Pasar minyak sawit dunia mengalami pertumbuhan pesat dalam beberapa dasawarsa terakhir dengan produksi minyak sawit saat ini diperkirakan lebih dari 45 juta ton. Indonesia merupakan salah satu produsen dan eksportir minyak sawit terbesar di dunia, dengan produksi lebih dari 18 juta ton minyak sawit per tahun. Pengembangan kelapa sawit baik melalui perluasan areal, peningkatan kualitas dan kuantitas produksi minyak sawit perlu terus dilakukan agar mampu bersaing di pasar International. Tahun 2009-2010 produksi kelapa sawit Indonesia mengalami peningkatan sebesar 1.204.020 ton (Anggit et al. 2012). Hal ini merupakan peluang besar bagi Indonesia sebagai salah satu negara
Tabel 1 Kandungan asam lemak dalam bungkil kelapa
5 pemasok minyak sawit mentah dunia, untuk lebih meningkatkan daya saingnya di pasar internasional.
Bungkil kelapa sawit merupakan limbah hasil industri minyak kelapa sawit yang secara umum dimanfaatkan sebagai bahan baku dalam pakan ternak. Komposisi kimia bungkil kelapa sawit sangat tergantung pada keadaan buah dan biji yang digunakan dalam proses pengolahan minyak kelapa sawit. Secara kimiawi bungkil kelapa sawit mempunyai kandungan protein berkisar 14%, kandungan serat kasar tinggi sehingga sulit dicerna oleh ikan (Tabel 2).
Karakteristik Logam Berat Pb
Logam berat mempunyai sifat yang unik yaitu tidak dapat terdegradasi secara alami dan cenderung terakumulasi dalam air, tanah, sedimen dan tubuh organisme. Berdasarkan densitasnya, logam dapat digolongkan menjadi dua yaitu logam ringan yang memiliki densitas lebih kecil dari 5 g/cm3 dan logam berat yang memiliki densitas lebih besar dari 5 g/cm3 (Hutagalung, 1991). Logam berat termasuk ke dalam unsur-unsur kimia yang terletak disudut kanan bawah sistem periodik, mempunyai afinitas yang tinggi terhadap unsur sulfidril dan biasanya bernomor atom 22 sampai 92 dari periode 4 sampai 7 (Miettinen, 1977 dalam Purnamo dan Muchyiddin, 2007).
Umumnya logam dalam perairan berada dalam bentuk ion-ion, baik sebagai pasangan ion ataupun dalam bentuk ion-ion tunggal. Di lapisan Atmosfir, logam ditemukan dalam bentuk partikel yang ikut beterbangan dengan debu-debu yang ada diatmosfir (Palar, 2004). Sifat-sifat yang dimiliki oleh setiap logam menurut bentuk dan kemampuannya adalah sebagai penghantar daya listrik (konduktor), sebagai penghantar panas yang baik, rapatan yang tinggi, dapat membentuk alloy dengan logam lainnya dan untuk logam yang padat dapat ditempa dan dibentuk (Palar, 2004).
Pencemaran logam berat seperti Pb yang masuk ke lingkungan perairan akan berdampak pada organisme air yang hidup di lingkungan perairan tersebut. Apabila logam berat masuk ke dalam tubuh dengan jumlah yang berlebih, maka akan berubah fungsi menjadi racun bagi tubuh (Palar, 2004).
Salah satu logam berat yang banyak mencemari air sungai adalah timbal (Pb). Tercemarnya air sungai oleh limbah pabrik yang mengandung Pb menyebabkan terakumulasinya Pb dalam tubuh organisme air termasuk ikan. Pb merupakan salah satu bahan pencemar yang dipermasalahkan karena bersifat
6
sangat toksik dan tergolong sebagai bahan buangan beracun dan berbahaya (Purnomo dan Muchyiddin, 2007).
Pb memiliki titik lebur rendah, mudah dibentuk, memiliki sifat kimia yang aktif, sehingga dapat digunakan untuk melapisi logam agar tidak timbul perkaratan. Pb merupakan logam lunak berwarna abu-abu kebiruan mengkilat serta mudah dimurnikan dari pertambangan. Pb mempunyai nomor atom 83 dengan berat atom 207, 20. Pb meleleh pada suhu 328 oC, titik didih 1.740 oC dan memiliki gravitasi 11,34 (Widowati et. al. 2008).
Pencemaran Logam Berat
Banyak logam berat baik yang bersifat toksik maupun esensial terlarut dalam air dan mencemari air tawar dan air laut. Sumber pencemaran ini banyak berasal dari pertambangan, peleburan logam dan jenis industri lainnya serta dapat juga berasal dari lahan pertanian yang menggunakan pupuk atau anti hama yang menggunakan logam (Darmono, 2001).
Di dalam air, biasanya logam berikatan dalam senyawa kimia atau dalam bentuk logam ion, bergantung pada kompartemen tempat logam tersebut berada. Tingkat kandungan logam pada setiap kompartemen sangat bervariasi, tergantung pada lokasi, jenis kompartemen dan tingkat pencemarannya.
Unsur-unsur logam berat secara alamiah terdapat di seluruh alam baik di tanah, air maupun udara tetapi dalam kadar yang sangat rendah. Sumber pencemaran berasal dari biogenik seperti letusan gunung berapi, kebakaran hutan dan sebagainya, serta berasal dari antropogenik seperti kegiatan industri, pertanian, pertambangan dan lain sebagainya. Apabila sumber pencemaran tersebut banyak mengandung logam berat dan masuk ke lingkungan perairan secara kontinyu tanpa melalui proses pengolahan terlebih dahulu, maka lingkungan tersebut akan tercemar logam berat.
Faktor yang menyebabkan logam berat di kelompokkan ke dalam bahan pencemar adalah karena logam berat tidak dapat terurai melalui biodegradasi seperti pencemaran organik. Logam berat dapat terakumulasi dalam lingkungan terutama dalam sedimen sungai kemudian terikat dengan senyawa organik dan anorganik melalui absorpsi dan pembentukan kompleks.
Akumulasi Logam Berat Pb oleh Ikan
Semua spesies dalam air sangat terpengaruh oleh hadirnya logam yang terlarut dalam air terutama pada konsentrasi yang melebih batas normal bagi organisme air. Menurut Simkiss dan Mason (1984c) dalam Darmono (2001), logam dalam jaringan organisme akuatik dibagi menjadi dua tipe yaitu logam tipe klas A, seperti Na, K, Ca dan Mg, yang pada dasarnya bersifat elektrostatik dan pada larutan garam berbentuk ion hidrofilik dan kls B seperti Cu, Zn dan Ni yang merupakan komponen kovalen dan jarang berbentuk ion bebas.
7 Darmono (2001), respon sel terhadap masuknya logam bergantung pada sel-sel sebagai berikut :
1. Sel yang mengandung ligan berlebihan dan sesuai untuk ikatan logam yang masuk, logam dapat terikat sepenuhnya dan tidak menimbulkan gangguan metabolisme.
2. Sel yang mengandung ligan terbatas, tetapi dapat mensintesis ligan lagi apabila diperlukan, sehingga masih dapat mengikat logam yang masuk dan tidak menimbulkan gangguan metabolisme.
3. Sel yang mengandung ligan terbatas, tetapi masih dapat mensintesis ligan dengan jalan mengusir logam yang telah terikat untuk keluar sel.
4. Sel yang mengandung ligan terbatas tetapi dalam proses pengikatannya terjadi kompetisi antara logam itu sendiri.
Toksisitas logam klas B terhadap organisme air sudah tidak diragukan lagi, sehingga kerusakan yang ditimbulkan terhadap jaringan organisme akuatik terjadi pada organ yang peka seperti insang dan usus, kemudian ke jaringan bagian dalam seperti hati dan ginjal tempat logam tersebut terakumulasi.
Pengaruh Logam Berat Pb pada Manusia
Pengaruh logam berat pada manusia beraneka ragam, tergantung jenis logam yang mencemarinya. Pb dapat ditoleransi pada tingkat yang sangat rendah, sedangkan pada konsentrasi tertentu sangat beracun bagi manusia. Pb yang terakumulasi dalam tubuh manusia dapat menyebabkan berkurangnya pengembangan dan kinerja intelektual pada anak-anak, sedangkan pada orang dewasa dapat menyebabkan penyakit jantung dan meningkatnya tekanan darah (Supin et al. 2005).
Pb di dalam tubuh manusia dapat menghambat aktivitas enzim yang terlibat dalam pembentukan hemoglobin (Hb). Sebagian kecil Pb diekskresikan lewat urin atau feses karena sebagian terikat oleh protein, sedangkan sebagian lagi terakumulasi dalam ginjal, hati, kuku, jaringan lemak, dan rambut. Waktu paruh Pb dalam eritrosit adalah selama 35 hari, dalam jaringan ginjal dan hati selama 40 hari, sedangkan waktu paruh dalam tulang adalah selama 30 hari. Tingkat ekskresi Pb melalui sistem urinaria adalah sebesar 76%, gastrointestinal 16%, dan rambut, kuku, serta keringat sebesar 8% (Klaassen et al. 1986, diacu dalam Widowati et al. 2008).
Depurasi
8
Kualitas Air
Kualitas air merupakan faktor penting untuk kelangsungan hidup ikan. Faktor lingkungan yang mempengaruhi kehidupan ikan adalah suhu, pH dan oksigen terlarut. Suhu berpengaruh terhadap proses fisika, kimia dan biologi badan air dan juga kehidupan biota yang ada di dalamnya. Peningkatan suhu mengakibatkan viskositas, reaksi kimia dan evaporasi juga meningkat, tetapi menurunkan kelarutan gas dalam air. Dekomposisi bahan organik dalam perairan oleh mikroba juga meningkat dengan meningkatnya suhu. Peningkatan suhu perairan sebesar 10 oC, meningkatkan konsumsi oksigen oleh organisme akuatik sekitar 2-3 kali (Effendi, 2003).
Nilai pH mencirikan keseimbangan antara asam dan basa dalam air dan merupakan pengukuran aktifitas ion hydrogen dalam larutan. Selain itu, pH air dapat mempengaruhi jenis dan susunan zat dalam lingkungan dan mempengaruhi tersedianya hara serta toksisitas dari unsur renik. Nilai pH diperoleh dari hasil interaksi sejumlah substansi yang terlarut dalam air dan dari kejadian-kejadian biologi di dalamnya. Kebanyakan perairan mempunyai pH antara 6-9. Sebagian besar biota akuatik sensitif terhadap perubahan pH dan menyukai nilai pH sekitar 7-8.5 (Effendi, 2003).
Oksigen merupakan kebutuhan dasar untuk kehidupan tanaman dan hewan air. Kehidupan makhluk hidup dalam air tersebut tergantung dari kemampuan air untuk mempertahankan konsentrasi oksigen minimum yang dibutuhkan untuk kehidupannya. Oksigen di perairan bersumber dari difusi udara dan hasil dari proses fotosintesis oleh fitoplankton dan tumbuhan air di zona eufotik (Effendi, 2003). Selain itu, oksigen dapat masuk ke perairan karena terbawa oleh aliran air yang masuk ke dalam badan perairan.
Kebutuhan organisme akan oksigen sangat bervariasi bergantung pada umur ikan, ukuran ikan dan kondisi ikan. Brett (1979) menjelaskan bahwa jika kandungan oksigen terlarut dalam air pada wadah budidaya kurang dari 3 mg/L dan suhu air berkisar antara 20oC-32oC dapat menyebabkan laju pertumbuhan, efisiensi pakan dan jumlah pakan yang diberikan menurun. Penurunan kadar oksigen terlarut hingga di bawah 5 mg/l dapat menyebabkan gangguan pada sistem reproduksi, pertumbuhan, dan kematian organisme budidaya.
3
METODE
Penelitian dilaksanakan bulan April sampai Mei 2013, bertempat di Kolam percobaan Babakan Fakultas Perikanan dan Ilmu Kelautan IPB. Analisis kandungan Pb dari daging, feses dan air dilakukan di Laboratorium Terpadu Institut Pertanian Bogor. Analisa proksimat dilakukan di Laboratorium Nutrisi Ikan Departemen Akuakultur Fakultas Perikanan IPB. Histokimia hati dan ginjal dilakukan di Laboratorium Kesehatan Ikan Departemen Akuakultur Fakultas Perikanan dan Ilmu Kelautan IPB.
Bahan
9 tiga ulangan , larutan Pb(NO3)2, bungkil kelapa, bungkil sawit, pakan komersil, larutan anastesia MS222, larutan fiksasif BNF, aquades dan aquabides.
Alat
Peralatan yang digunakan adalah drum plastik volume 100 L, dissecting set, blower, blender, pellet moulding, termometer, indikator pH (kertas lakmus), timbangan digital, botol vial. Analisis konsentrasi Pb menggunakan Atomic Absorption Spectrophotometer (AAS).
Rancangan Penelitian
Rancangan penelitian uji depurasi Pb dalam tubuh ikan nila adalah Rancangan Acak lengkap (RAL) dengan ulangan setiap perlakuan adalah 3 ulangan. Perlakuan penelitian adalah : kontrol, bungkil kelapa+pakan, bungkil kelapa sawit+pakan.
Tahapan Penelitian
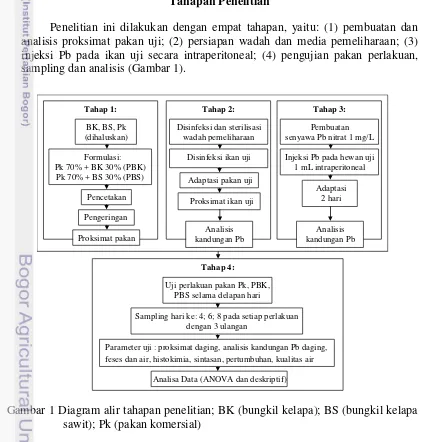
Penelitian ini dilakukan dengan empat tahapan, yaitu: (1) pembuatan dan analisis proksimat pakan uji; (2) persiapan wadah dan media pemeliharaan; (3) injeksi Pb pada ikan uji secara intraperitoneal; (4) pengujian pakan perlakuan, sampling dan analisis (Gambar 1).
Gambar 1 Diagram alir tahapan penelitian; BK (bungkil kelapa); BS (bungkil kelapa sawit); Pk (pakan komersial)
Sampling hari ke: 4; 6; 8 pada setiap perlakuan dengan 3 ulangan
Analisa Data (ANOVA dan deskriptif)
10
Tahap pertama, pakan perlakuan dibuat secara manual dengan mencampurkan 70% bagian pakan komersial dengan 30% bungkil kelapa (Zuraida, 2012) dan mencampurkan 70% pakan komersial dengan 30% bungkil kelapa sawit (Pamungkas, 2011). Pakan komersil berbentuk pellet dihaluskan menjadi tepung, kemudian dicampur dengan bungkil kelapa maupun bungkil sawit yang telah ditepungkan juga. Campuran dicetak menggunakan pellet moulding dengan ukuran 3±0,5 mm dan pellet kemudian dijemur hingga kering. Pellet kering selanjutnya diuji proksimat untuk mengetahui kadar lemak dan serat kasar.
Tahap kedua yaitu persiapan wadah dan media pemeliharaan. Wadah yang digunakan dalam penelitian ini adalah drum plastik dengan volume 100 L sebanyak sembilan unit. Kemudian drum plastik didisinfeksi dan sterilisasi terlebih dahulu. Ikan uji yang digunakan dalam penelitian ini adalah ikan nila Nirwana yang diperoleh dari Balai Pengembangan Budidaya Air Tawar (BPBIAT) Wanayasa. Ikan uji diadaptasikan dalam bak ukuran 2x3 m2. Selanjutnya pakan uji diberikan secara bertahap selama proses adaptasi pakan uji selama dua minggu. Setelah ikan uji terbiasa dengan pakan uji, ikan uji diseleksi untuk persiapan injeksi Pb.
Tahap ketiga, injeksi Pb pada ikan uji dilakukan secara intraperitonial. Pemaparan Pb ke dalam tubuh ikan uji dilakukan dengan cara injeksi sebanyak 1 mg/L. Ikan uji yang telah dipapar Pb, diadaptasikan kembali selama dua hari. Untuk menentukan apakah ikan uji sudah terpapar Pb, maka dilakukan analisa pada daging ikan uji tersebut menggunakan AAS, uji Histokimia pada hati dan ginjal ikan uji untuk mengetahui apakah Pb terdeposit di hati dan ginjal, dan analisa proksimat untuk mengetahui kadar lemak dan serat kasar dari daging ikan. Tahap keempat, ikan uji yang telah diinjeksi Pb dipelihara dalam drum plastik, kemudian dipuasakan selama dua hari. Selanjutnya ikan uji dipelihara selama delapan hari dan diberikan pakan uji sesuai dengan masing-masing perlakuan. Pakan diberikan dua kali sehari secara adsetiasi. Sampling setiap perlakuan dan ulangan tersebut dilakukan pada hari ke empat, hari keenam dan hari kedelapan.
Parameter yang Diamati
Parameter yang diamati dalam penelitian ini adalah : 1. Kandungan Pb di pakan, daging ikan, feses dan Air
11 yang diserap atom logam berat pada saat dilewatkan melalui nyala api udara-asetilen. Setiap unsur logam berat membutuhkan lampu katoda yang berbeda. Keseluruhan prosedur ini sangat sensitif dan selektif karena setiap unsur membutuhkan panjang gelombang yang sangat pasti (Tinsley, 1979).
2. Uji histokimia pada hati dan ginjal sebelum dan setelah pemaparan Pb, hari ke-4, hari ke-6 dan hari ke-8.
3. Proksimat bahan penyusun pakan dan pakan perlakuan serta uji kadar lemak dan serat kasar daging ikan uji sebelum dan setelah pemaparan Pb, hari ke-4, hari ke-6 dan hari ke-8.
4. Tingkat kelangsungan hidup (sintasan) merupakan perbandingan antara jumlah ikan yang hidup sampai akhir penelitian dengan jumlah ikan pada awal penelitian.
SR =
Keterangan :
SR = Tingkat Kelangsungan hidup pada akhir penelitian (%) Nt = Jumlah ikan yang hidup pada akhir penelitian (ekor) No = Jumlah ikan yang hidup pada awal penelitian (ekor)
5. Laju pertumbuhan dinyatakan sebagai perubahan bobot tubuh rata-rata selama penelitian, dimana data diperoleh dengan melakukan penimbangan ikan uji pada awal dan akhir penelitian kemudian dihitung dengan rumus :
GR = Keterangan :
GR = Laju pertumbuhan
Wt = Bobot rata-rata ikan pada waktu tertentu Wo = Bobot rata-rata ikan pada awal penelitian t = Jumlah hari selama penelitian
6. Analisa kualitas air
Analisa dilakukan untuk mengetahui kualitas air pada media pemeliharaan sebelum dilakukan depurasi maupun kualitas air setelah depurasi. Kualitas air yang diukur yaitu oksigen terlarut, pH, suhu.
Prosedur Analisis Data
Data analisis konsentrasi Pb (dari daging ikan, feses dan di air pemeliharaan), kadar lemak dan serat kasar di daging ikan, kelangsungan hidup dan perubahan bobot tubuh ikan uji dianalisis dengan sidik ragam (ANOVA). Histokimia hati dan ginjal dianalisis secara deskriptif.
4
HASIL DAN PEMBAHASAN
Pakan Perlakuan
12
2006). Hasil ini tidak linier dengan serat kasar, terlihat bahwa terjadi peningkatan serat kasar pada perlakuan PBS, sementara perlakuan PBK menjadi lebih rendah
dari bahan baku.
Serat kasar merupakan bagian yang sulit dicerna, keberadaannya dalam jumlah tertentu sangat dibutuhkan. Piliang dan Djojosoebagio (2006) menjelaskan, bahwa pakan tanpa serat akan mengakibatkan feses dengan kandungan air rendah lebih lama berada dalam usus. Konsekuensi dari serat terlalu tinggi mengganggu penyerapan zat nutrisi makanan dan koefisien cerna menjadi rendah.
Rendahnya kandungan serat pakan perlakuan PBK dapat terjadi karena perlakuan asam selama preparasi sampel saat uji proksimat. Selain itu, Serat kasar BK mudah mengalami degradasi melalui proses enzymatik. Krishna et al. (2010), dalam tulisannya menerangkan karakteristik produk kelapa yang lebih soluble dan mudah mengalami degradasi enzimatik dibandingkan kelapa sawit. Heradewi (2007) menjelaskan bahwa limbah padat industri kelapa sawit merupakan limbah lignoselulosa yang sulit dikonversi menjadi bahan yang lebih sederhana seperti konversi komponen selulosa menjadi gula sederhana (glukosa). Ikatan lignin pada selulosa yang sangat erat dan rumit memerlukan perlakuan tersendiri sebelum pengolahan.
Pakan formula selanjutnya diberikan pada ikan uji secara bertahap sampai ikan uji terbiasa dengan pakan formula. ikan uji diseleksi sesuai bobot dan tingkat
Tabel 3 Persentase bobot basah proksimat bahan substitusi pakan dan formulasi pakan
Sampel Protein Lemak Karbohidrat
Serat kasar BETN
Keterangan : Pk (pakan komersil); BS (bungkil kelapa sawit); BK (bungkil kelapa)
Tabel 4 Persentase bobot basah daging ikan nila Nirwana selama penelitian
13 kebugaran ikan untuk persiapan injeksi Pb. Sebagian ikan yang telah diseleksi kemudian di uji proksimat sebelum dan setelah injeksi dengan hasil tertera pada Tabel 4.
Proksimat daging ikan sangat ditentukan oleh komposisi proksimat pakan Kondisi ini berhubungan dengan kebutuhan nutrisi harian yang hampir sepenuhnya diperoleh dari pakan. Kebutuhan nutrisi harian akan digunakan untuk energi pertumbuhan dan bila terjadi serangan penyakit atau racun, maka sebagian besar energi akan digunakan untuk pertahanan tubuh. Lemak, bagi ikan merupakan cadangan energi utama setelah protein dan sebagian besar disimpan dalam jaringan otot (Sargent et al. 2002) dan juga disimpan di hati. Pemanfaatan lemak untuk energi pertahanan tampak nyata bila dilihat dari Tabel 4. Cadangan lemak menyusut hampir 40% setelah injeksi Pb, yaitu dari 1.38% menjadi 0.87% pada hari kedua. Menurut Balfry dan Higgs (2001), lemak berperan penting dalam respon pertahanan tubuh. Setelah perlakuan pakan, status lemak tidak mengalami kenaikan yang nyata. Kondisi ini terjadi karena sebagian besar lemak pakan digunakan untuk menyerap sebagian besar Pb dari jaringan. Meskipun demikian diantara semua perlakuan, perlakuan PBK mampu mempertahankan cadangan lemak tubuh lebih baik.
Kandungan Pb Daging, Feses dan Air
Penyebaran Pb secara alamiah diatur oleh pH, zat-zat pengkelat dan keadaan oksidasi komponen mineral dan sistem redoks sehingga Pb dapat berada dalam bentuk fase cair dan padat. Transisi antara fase cair dan padat dapat mengalami pengkelatan dan terendapan atau membentuk koloid, terionisasi pada lingkungan asam dan terbentuk larutan. Daging ikan merupakan lingkungan yang semi padat dan sebagian besar cairan berada dalam bentuk air yang terikat dalam sel sehingga penyebaran Pb dalam daging ikan dapat terjadi melalui proses difusi aktif melalui darah dan terdeposit dalam lemak. Connell dan Miller (2006), berpendapat bahwa gangguan metabolisme lemak dapat menyebabkan kegagalan fungsi hati, termasuk akumulasi lemak patologis dalam hati.
Aktifitas air bebas dalam daging mudah mengalami pencucian, baik difusi melalui membran kulit maupun sirkulasi darah. Kondisi ini memungkinkan terjadinya eliminasi logam Pb dari dalam daging. Senyawa Pb yang mengalami transport melalui darah akan difiltrasi oleh hati dan ginjal, selanjutnya akan dibuang melalui urine dan atau feses.
Hasil analisis AAS terhadap daging dan feses (Tabel 5), membuktikan bahwa sebagian besar Pb dibuang melalui feses. Konsentrasi Pb yang dikeluarkan melalui feses berbeda-beda menurut perlakuan, terbesar adalah perlakuan PBS (1.46 mg/kg), PBK (0.34 mg/kg) dan Pk (0.24 mg/kg) pada hari ke-2 setelah injeksi. Hari ke-4, 6 dan 8 konsentrasi Pb lebih rendah dari 0.001 mg/kg. Konsentrasi Pb pada daging lebih rendah dari 0.001 mg/kg dan konsentrasi Pb di air lebih rendah dari 0.001 mg/L.
Tabel 5 Konsentrasi Pb pada daging, feses dan air selama penelitian
Hari ke- Kontrol Perlakuan
Pk PBS PBK
Daging (mg/kg)
0; 2; 4; 6; 8 <0.001 <0.001 <0.001 Feses (mg/kg)
2 0.24 1.46 0.34
4; 6; 8 <0.001 <0.001 <0.001
14
Keluarnya sebagian besar Pb melalui feses membuktikan, bahwa keberadaan serat kasar yang berasal dari bungkil kelapa dan bungkil sawit, mampu memberikan pengaruh untuk mendepurasi Pb melalui feses. Hasil analisis korelasi menunjukkan bahwa serat kasar mempunyai korelasi positif dengan feses yaitu 0,96 sehingga Pb yang terikat dalam feses dipengaruhi oleh keberadaan serat kasar yang berasal dari bungkil kelapa dan bungkil sawit, sedangkan lemak tidak memiliki korelasi dengan feses (Tabel 6). Analisis statistik menunjukkan bahwa tidak ada perbedaan yang signifikan (P<0.05) antara feses, serat kasar dan lemak (lampiran 1). Hal ini didukung oleh hasil histokimia hati (Lampiran2) dan ginjal (Lampiran 3) yang menunjukkan adanya konsentrasi Pb pada hati dan ginjal setelah injeksi Pb. Konsentrasi Pb secara perlahan mulai berkurang pada hari ke-4, ke-6 dan hari ke-8. Pada hati, Pb lebih menyebar ke seluruh jaringan, sedangkan di ginjal Pb terkonsentrasi di sekitar lobus dan glomerulus.
Hati dan ginjal memiliki kapasitas yang lebih tinggi untuk mengikat zat-zat kimia (Ahmad, 2004). Hati merupakan alat tubuh yang penting untuk ekskresi toksikan terutama sebagai senyawa yang polaritasnya tinggi (anion dan kation), konjugat yang terikat pada protein plasma dan senyawa yang toksikannya lebih besar. Ginjal membuang toksikan dari tubuh dengan mekanisme yang digunakan untuk membuang hasil akhir metabolisme faali, yaitu dengan filtrasi glomerolus, difusi tubuler dan sekresi tubuler. Kapiler glomerolus memiliki pori-pori yang besar (70 nm) sehingga sebagian toksikan akan lewat diglomerolus kecuali toksikan yang lebih besar dari BM 60.000 atau yang terikat erat pada protein plasma. Toksikan dalam filtrat glomerolus akan mengalami absorbs pasif di sel-sel tubuler apabila koefisien partisi lipid atau airnya tinggi atau tetap dalam lumen tubuler dan dikeluarkan apabila merupakan senyawa yang polar.
Kelangsungan Hidup dan Laju Pertumbuhan
Kemampuan ikan untuk mempertahankan diri terhadap masuknya xenobiotik sangat dipengaruhi oleh tingkat vitalitas yang diperoleh dari asupan pakan. Komponen pakan yang penting diantaranya protein dan lemak dibutuhkan dalam proporsi lebih besar. Lemak dalam jumlah yang cukup dapat bertindak sebagai protein sparing effect, sehingga sejumlah protein dapat digunakan untuk pertumbuhan dan pertahanan tubuh sekaligus. Penelitian Orire dan Sadiku (2011) telah membuktikan bahwa pemanfaatan lemak 10% dari sawit mampu bertindak sebagai protein sparing effect pada ikan nila Nirwana. Tingginya lemak bungkil kelapa dan kelapa sawit, dapat menyediakan pasokan energi pada nila nirwana untuk menghadapi faktor stress dari xenobiotik Pb.
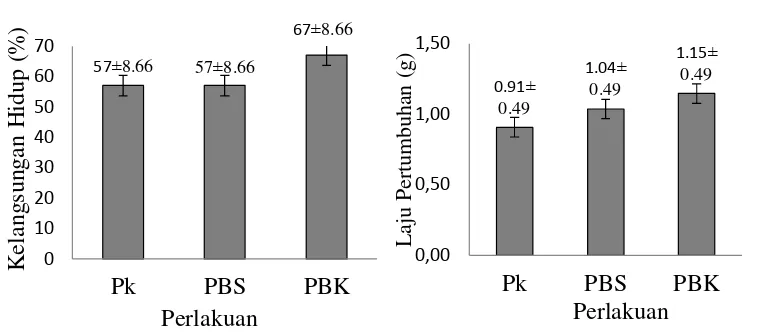
Nila nirwana mampu memanfaatkan lemak pakan ditunjukkan dengan tingginya kelangsungan hidup ikan nila Nirwana selama penelitian (>50%) dengan kelangsungan hidup yang tertinggi adalah perlakuan PBK (67%±8.66), PBS dan Pk masing-masing 57%±8.66 (Gambar 2). Nila nirwana yang mampu
Tabel 6 Korelasi serat kasar, lemak dengan feses serat kasar lemak feses
serat kasar 1
lemak -0.50 1
15 bertahan hidup hingga hari ke-8 juga menunjukkan adanya pertumbuhan bobot yaitu 1.15g±0.49 pada perlakuan PBK, 1.04g±0.49 perlakuan PBS dan 0.91g±0.49 perlakuan Pk. Walaupun tidak terlalu besar tetapi dapat membuktikan bahwa pakan komersial yang disubstitusi BS dan BK dapat digunakan untuk depurasi Pb dan tetap memberikan efek pertumbuhan. Hasil penelitian ini dan beberapa penelitian lain (Aderolu dan Akinremi, 2009) membuktikan bahwa bungkil kelapa maupun bungkil kelapa sawit (Norita et al. 2012; Dauqan et al. 2011; Orire dan Sadiku, 2011; Ochang et al. 2007) berpotensi menggantikan sebagian atau seluruh peran tepung ikan dalam bahan pakan.
Hubungan pH pada Penyerapan Timbal oleh Pakan
Penyerapan Pb di dalam tubuh dikontrol oleh pH dan suhu. Kondisi lingkungan yang asam, akan mengakibatkan Pb terionisasi membentuk Pb(II) yang toksik. Sementara pada kondisi basa, Pb cenderung mengalami pengkelatan bersama senyawa lain dan mudah terdeposit dan terendapkan. Penelitian Igwe et al. (2005) dan Igwe dan Abia (2007) yang melibatkan sejumlah logam berat menemukan ion Pb dapat mengalami pengkelatan, diantaranya dengan golongan thiol (-SH) membentuk dimerkaptopropanol atau membentuk EDTA bila bersenyawa dengan golongan karboksimethyl (-COCH3) atau ligan ethylenediamine. Kemudian studi yang dilakukan Ofomaja dan Ho (2006), pengkelatan Pb dengan golongan karboksimethyl dapat di modifikasi menggunakan media serat dari tepung buah kelapa.
Serat dari pakan yang disubstitusi dengan bungkil kelapa sawit, pada pH asam dapat terikat kuat dengan ion hidronium (H3O+) dan permukaan ligan bermuatan positif. Semakin meningkatnya pH, permukaan ligan akan bermuatan negatif karena mengalami deprotonisasi dan serat kelapa akan meningkat kemampuan mengikat Pb. Sebagaimana hasil studi Mahmoud et al. (2012) serta Ackacha dan Elsharif (2012) yang menguji beberapa material dalam menyerap Pb dari media air menemukan peran pH yang cukup dominan terhadap proses penyerapan. Pada kasus ini, tingkat penyerapan linier dengan meningkatnya pH. Gambar 2 Kelangsungan hidup dan laju pertumbuhan ikan uji selama
16
Hasil pengukuran pH media penelitian menemukan tingkat pH berada pada kondisi netral sampai sedikit basa yaitu 7–8 (Tabel 7), Kondisi pH seperti ini memberikan kekuatan pada serat pakan dalam saluran pencernaan ikan untuk menyerap sejumlah besar Pb.
Sejumlah Pb yang terikat pada serat pakan, berpotensi mengalami pengkelatan dan diduga kuat membentuk ligan ethylenediamine (Gambar 3). Komplek timbal-ethylenediamine mengakibatkan ukuran molekul menjadi lebih besar, sehingga tidak dapat menembus dinding usus dan masuk ke sistem peredaran darah. Suasana usus yang netral dan sedikit basa memberikan kondisi yang optimal untuk menjaga Pb tetap terikat pada serat pakan yang akhirnya akan dikeluarkan sebagai feses. Feses yang keluar kemudian akan berinteraksi dengan air, karena pH air antara netral dan sedikit basa Pb tidak terionisasi dan larut ke dalam air. Hasil analisa terhadap kandungan Pb pada feses dan air membuktikan
bahwa serat pakan mampu mengikat dengan kuat Pb tetap berada dalam feses, karena kandungan Pb air sangat kecil, yaitu lebih kecil dari 0,001 ppm.
Kandungan serat kasar dalam pakan yang disubtitusi dengan BS mencapai 7.23 %, lebih tinggi dari serat kasar Pk 2.27 % dan BK 0.38 %, sedangkan lemak BK 13.33 % lebih tinggi dari BS 4.78 % dan Pk 1.88%. Sinergis antara lemak dan serat kasar pada perlakuan BS memberikan mekanisme yang lebih baik dalam penyerapan Pb dari dalam daging ikan. Perlakuan BK menghasilkan lemak yang tinggi tetapi kandungan serat kasar yang rendah, sehingga kemampuan membentuk komplek dengan Pb lebih rendah. Serat kasar BS tergolong tinggi, maskipun demikian masih dapat diterima untuk konsumsi ikan nila nirwana. Menurut Ghosh et al. (2011), serat kasar dalam pakan ikan nila sebaiknya tidak lebih dari 6%. Bagaimanapun komposisi lemak dan serat kasar yang tepat dapat meningkatkan kemampuan pakan sebagai agen depurasi logam berat Pb. Meskipun kontrol pH menjadi parameter penting dalam penyerapan ion Pb.
Tabel 7 Parameter kualitas air media selama pemeliharaan Parameter
Keterangan : PK (pakan komersil); PBS (pakan komersil+bungkil kelapa sawit); PBK (pakan komersil+bungkil kelapa)
17
Hubungan Suhu pada Penyerapan Timbal oleh Pakan
Suhu berperan meningkatkan laju reaksi kimia dan bagi ikan yang berdarah dingin, suhu lingkungan menjadi salah satu parameter penting yang berpengaruh pada tingkat metabolisme sel. Metabolisme meningkat seiring dengan meningkatnya suhu, sampai pada titik maksimal yang dapat ditoleransi oleh sistem biologi ikan. Demikian pula sebaliknya bahwa metabolisme akan turun bila suhu diturunkan sampai batas yang dapat menyebabkan kematian. Suhu yang dapat memberikan kenyamanan secara bilogis bagi ikan untuk hidup dan bereproduksi adalah suhu optimum. Nila nirwana memiliki rentang suhu optimum cukup luas, yaitu dari 22°C sampai 32°C. Sistem biologis ikan memiliki tingkat organisasi yang berbeda antara ikan dan air serta darah dan jaringan lemak. Sebelum Pb disebarkan ke seluruh tubuh maka Pb harus melewati suatu membran (Connel dan Miller, 2006).
5
SIMPULAN DAN SARAN
Simpulan
Bungkil kelapa dan kelapa sawit yang disubstitusikan kedalam pakan dapat digunakan sebagai agen depurasi, dan berhasil mereduksi Pb dari jaringan ikan melalui feses.
Saran
Penelitian lebih lanjut dapat dilakukan untuk melindungi pakan dengan kandungan bungkil kelapa dan kelapa sawit terhadap potensi oksidasi terhadap lemak dan meningkatkan kemampuan depurasinya terhadap xenobiotik lainnya.
DAFTAR PUSTAKA
Abidin, Z. 2006. Pengaruh Tepung Bungkil Kelapa Sawit Dalam Pakan Ikan Lele (Clarias sp.). Tesis. Sekolah Pascasarjana. Institut Pertanian Bogor.
Ackacha MA dan Elsharif LA. 2012. Adsorption Removal of Lead Ions by Acacia tortilis Leaves: Equilibrium, Kinetics and Thermodinamics. Int. Jou. of Env. Sci and Dev, 3(6): 584–589. DOI: 10.7763/IJESD.2012.V3.290.
Aderolu AZ dan Akinremi OA. 2009. Dietary Effects of Coconut Oil and Peanut Oil in Improving Biochemical Characteristic of Clarias gariepinus Juvenile. Turkish Journal of Fisheries and Aquatic Sciences. 9: 105–110.
Ahmad R. 2004. Kimia Lingkungan. Yogyakarta.
Al-Nagaawi AM. 2008. Accumulation and Elimination of Cooper and Lead from Oreochromis niloticus Fingerlings and Consequent Influence on Their Tissue Residues and Some Biochemical Parameters. International Symposium on Tilapia in Aquaculture.
18
Balfry SK dan Higgs DA. 2001. Influence of Dietary Lipid Composition on the Immune System and Disease Resistance of Finfish. In Nutrition Fish Health. Eds. Lim C and Webster CD. Food Products Press. 213–228.
Brett JR. 1979. Environmental Factor and Growth. In. Fish Physiology: Bioenergetics and Growth. Vol. VIII. Academic Press. New York. pp.599-675. Connell WD and Miller JG. 2006. Kimia dan Ekotoksikologi Pencemaran.
Koestoer Y. (Penerjemah). Cet. 6. Universitas Indonesia Press. Jakarta. 520. Dabrowski K dan Portella MC. 2006. Feeding Plasticity and Nutritional
Physiology in Tropical Fishes. In. Fish Physiology: The Physiology of Tropical Fishes. Vol. 21. Academic Press. pp.155–196.
Darmono. 2001. Lingkungan Hidup dan Pencemaran, Hubungan Dengan Toksikologi Senyawa Logam. Penerbit Universitas Indonesia.
Dauqan EMA, Aminah A dan Halimah AS. 2011. Natural Antioxidants, Lipid Profile, Lipid Peroxidation, Antioxidant Enzyme of Different Vegetable Oils. Advance Journal of Food Science and Technology, 3(4): 308–316.
Derrick. 2005. Protein In Calf Feed. http://www.winslowfeeds.co.nz/ pdfs/feedingcal.vesarticle. (2 Februari 2005).
Ditjen Perkebunan. 2010. Central produksi kelapa dan produksi kelapa Indonesia. Http://www.ditjenbun.deptan.go.id.
Ditjen POM. 1989. Keputusan Ditjen Pengawasan Obat dan Makanan tentang batas maksimum cemaran logam berat pada makanan. No.0372/B/SK/VII/89. Doaa MM dan Hanan HAE. 2013. Histological Changes in Selected Organs of
Oreochromis niloticus Exposed to Doses of Lead Acetate. Journal Life Science and biomedicine, 3 (3): 256–263.
Heradewi. 2007. Isolasi lignin dari lindi hitam proses pemasakan Organosolv Serat tandan kosong Kelapa sawit (TKKS) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hertrampf JW dan Piedad-Pascual F. 2000. Handbook on Ingredients for Aquaculture Feeds. Kluwer Academic Publishers. 446–472.
Hutagalung, H.P. 1991. Pencemaran Laut oleh Logam Berat. Status Pencemaran Laut di Indonesia dan Teluk Pemantauannya. Jakarta
Igwe JC dan Abia AA. 2007. Adsorption Isotherm Studies of Cd(II), Pb(II) and Zn(II) Ions Bioremediation from Aqueous Solution Using Unmodified and EDTA-modified Maize Cob. Acl. Quim, Sao Paulo, 32(1): 33–42.
Igwe JC, Nwokennaya EC dan Abia AA. 2005. The Role of pH in Heavy Metal Detoxification by Biosorption from Aqueous Solutions Containing Chelating Agents. African Journal of Biotechnology, vol 4(10): 1109–1112.
Jerieska B dan Witeska M. 2006. The Metal Uptake and Accumulation in Fish Living in Polluted Waters. Soil and Water Pollution Monitoring, Protection and Remediation, Springer. 3–23.
Krishna GAG, Raj G, Singh AB, Kumar PPK dan Chandrashekar P. 2010. Coconut Oil: Chemistry, Production and Its Applications. Review. Departemen of Lipid Science and Traditional Food, Central Food Technology Research Institute (CSIR), Mysore.
19 Nominal Concentration of Lead Nitrate. Agriculture and Biology Juornal of North America. 3 (12): 510–515.
Mahmoud WH, Assirey EARAM dan Sirry SM. 2012. Utilization of Date Stone as Natural Renewable Resources for Biosorption of Copper(II) and Lead(II) from Natural Water. Journal of Material Science and Engineering B 2(2): 126– 130.
Norita SM, Hariz AAG, Mumtaziah AH dan Reha NH. 2012. Influence of Mannnanase Suplementation in Palm Kernel Cake Diet on The Nutrient Digestibility and Carcass Composition of Red Tilapia. Freshwater Fisheries Research Division, Malaysia.
Ochang SN, Fagbenro OA dan Adebayo O. 2007. Influence of Dietary Palm Oil on Growth Response, Carcas Composition, Haematology and Organoleptic Properties of Juvenile Nile tilapia, Oreochromis niloticus. Pakistan journal of Nutrition, 6 (5): 424–429.
Ofomaja AE and Ho YS. 2006. Effect of pH on Cadmium biosorptin by coconut copra meal. Elsevier.
Orire AM dan Sadiku SOE. 2012. Protein Sparing Effects of Lipids in The Practical Diets of Oreochromis niloticus (Nile Tilapia). Nigerian Journal of Basic and Applied Science, 19 (1): 142–150.
Palar, H. 2004. Pencemaran dan Toksikologi Logam Berat. Jakarta.
Pamungkas, W.S. 2011. Uji efektifitas penambahan enzim cairan rumen domba terhadap penurunan serat kasar dan nilai kecernaan bungkil kelapa sawit sebagai pakan benih ikan patin siam (Pangasius hypopthalmus). [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Piliang, W dan Djojosobagio, S.A. 2006. Fisiologi Nutrisi Volume I. IPB Press. Purnomo, T. Muchyiddin. 2007. Analisis Kandungan timbal (Pb) Pada Ikan
Bandeng (Chanos-chanos Forsk.) di Tambak Kecamatan Gresik. Surabaya. Universitas Negeri Surabaya.
Rahmawati S, Salami IRS dan Oktaviatun. 2006. Cooper and Lead Depuration in Nila Fish (Oreochromis niloticus L.). Departemen of Environmental Engeenering. Institute Technology Bandung.
Ratmini NA. 2009. Kandungan Logam Berat Timbal (Pb), Mercuri (Hg) dan Cadmium (cd) pada Daging Ikan sapu-sapu (hyposarcus pardalis) di Sungai Ciliwung Stasiun Srengseng, Condet dan Manggarai. Vis Vitalis. Vol. 02. No.1. Robin. 2012. Analisis bioakumulasi timbale (Pb) pada ikan nila merah
(Oreochromis niloticus) dan patin jambal (Pangasius djambal) yang dibudidayakan di kolong tua pasca tambang timah Bangka Belitung [tesis]. Bogor (ID): Institut Pertanian Bogor.
Rochyatun E, Lestari, Rozak A. 2004. Kondisi Periaran Muara Sungai digul dan Perairan Laut Arafura Dilihat dari Kandungan Logam Berat. Oceanografi dan Limnologi di Indonesia. No.36:15-31.
Santoso, U. Kazhuhiro, K.Toru, O. Tadahiro, T and Akio, M. 2006. Nutrien Composition of Kopyor Coconuts (Cocos nicifera L). Food Chemistry, Vol. 51. No. 2. hal. 299-304.
Savitri PO dan Salami IRS. 2011. Kajian kandungan Logam Berat pada Ikan Air Tawar di Pasar Tradisional dan Pasar Swalayan Kota Bandung. Program studi Teknik Lingkungan, Institute Teknologi Bandung.
Sargent JR, Tocher DR dan Bell JG. 2002. The Lipids. In Fish Nutrition. Third Edition. Eds. Halver JE and Hardy RW. Academic Press. 201–204.
20
Vegetable Oils as Total Replacements. World Journal of Fish and Marine Science. 2 (2): 93–98.
Standar Nasional Indonesia (SNI). 1996. SNI Bungkil Kelapa. Revisi SNI.01-2904-1992.
Staniskiene B, Matusevicius P, Budreckiene R, Skibniewska KA. 2006. Distribution of Heavy Metals in Tissues of Freshwater Fish in Lithuania. Polish J. of Environ. Stud. Vol. 15, No. 4 (2006), 585-591.
Supin, D. Zahlbruckner, R. Krapfenbauer-Cermak, C.H. Hassan-Hauser, C.H. Smulders, F.J.M. 2005. Mercury, Lead and Cadmium Content of Fresh and Canned Fish Collected From Austrian Retail Operations. Ernahrung/Nutrition. Vol.29.
Tinsley, IJ. 1979. Chemical consepts in pollutants behavior. NewYork: John Wiley and Sons.
Toth T, Andreji J, Toth J, Slavik M, Arvay J, Stanovic R. 2012. Cadmium, Lead And Mercury Contents In Fishes – Case Study. Journal of Microbiology, Biotechnology and Food Sciences. pp.837-847.
Widowati, W. Sastiono, A. Jusuf, R. 2008. Efek Toksik Logam. Yogyakarta. Zuraida. 2012. Efektifitas penggunaan enzim cairan rumen domba terhadap
21
Lampiran 1 Analisis sidik ragam serat kasar, lemak dengan feses Data serat kasar, lemak dan feses perlakuan
Serat kasar Lemak Feses
PK 2,27 1,88 0,24
PBS 7,23 4,47 1,46
PBK 0,83 13,33 0,34
SK JK db KT Fhit P-value F tabel
Perlakuan 51,92 2 25,96 1,63 0,27 5,14
Galat 95,57 6 15,93
22
Lampiran 2 Histokimia Hati ikan nila Nirwana selama penelitian.
23
Lampiran 3 Histokimia ginjal ikan nila Nirwana selama penelitian
24
Preparasi contoh a. Produk kering
Lumatkan atau haluskan contoh dengan blender atau homogenizer hingga menjadi partikel kecil. Tempatkan contoh dalam wadah polystyrene yang bersih dan tutup. Jika contoh tidak langsung dianalisis, simpan contoh dalam suhu ruang sampai saatnya untuk dianalisis.
b. Produk basah
Lumatkan atau haluskan contoh dengan blender atau homogenizer hingga homogen dan tempatkan contoh dalam wadah polystyrene yang bersih dan tutup. Jika contoh tidak langsung dianalisis, simpan contoh refrigerator atau freezer sampai saatnya dianalisis. Pastikan contoh masih tetap homogeny sebelum ditimbang. Jika terjadi pemisahan antara cairan dan contoh maka dilakukan blender ulang sebelum dilakukan analisis.
1. Prosedur
a. Penganbuan kering (dry ashing)
Timbang produk basah sebanyak 5g atau produk kering sebanyak 0,5g dalam cawan porselen dan catat beratnya (W). Buat control positif Pb (contoh pembuatan spiled 0,5 mg/kg Pb :tambahkan sebanyak 0,25 ml larutan standar Pb 1 mg/L kedalam contoh sebelum dimasukkan ketungku pengabuan). Uapkan spiled diatas hotplate pada suhu 100oC sampai kering. Masukkan contoh dan spiled kedalam tungku pengabuan dan tutup separuh permukaannya. Naikkan suhu tungku pengabuan secara bertahap 100oC setiap 30 menit sampai mencapai 450oC dan pertahan selama 18 jam. Keluarkan contoh dan spiled dari tungku pengabuan dan dinginkan pada suhu kamar. Setelah dingin tambahkan 1 ml HNO3 65%, goyangkan secara hati-hati sehingga semua abu terlarut 0,1M dan dinginkan pada suhu ruang selama 1 jam, pindahkan larutan kedalam labu takar polypropylene 50 ml dan tambahkan larutan matrik modifier, tepatkan sampai tanda batas dengan menggunakan HNO3 0,1M.
b. Destruksi basah menggunakan microwave
Timbang contoh basah sebanyak 2g atau contoh kering sebanyak 0,2g-0,5g kedalam tabung sampel (vessel) kemudian dicatat beratnya (W). untuk control positif (spiled 0,1 mg/kg), tambahkan masing-masing 0,2 ml larutan standar Pb atau larutan standar 200 µg/L sebanyak 1 ml kedalam contoh kemudian di vortex. Tambahkan secara berurutan 5 ml – 10 ml HNO3 65% dan 2 ml H2O2. Lakukan destruksi dengan mengatur program microwave (sesuai dengan microwave yang digunakan). Pindahkan hasil destruksi kelabu takar 50 ml dan Lampiran 4 Prosedur penentuan kadar logam berat Pb berdasarkan SNI
25 tambahkan larutan matrik modifier, tepatkan sampai tanda batas dengan air deionisasi.
c. Pembacaan kurva kalibrasi dan contoh pada AAS
Siapkan larutan standar kerja Pb masing-masing minimal 5 titik konsentrasi. Baca larutan standar kerja, contoh dan spiled pada alat spektrofotometer serapan atom graphite furnace pada panjang gelombang 283,3 nm.
2. Perhitungan
Konsentrasi Pb =
Keterangan : D adalah konsentrasi contoh µg/L dari hasil pembacaan AAS E adalah konsentrasi blanko contoh µg/L dari hasil pembacaan AAS
Fp adalah factor pengenceran
V adalah akhir larutan contoh yang disiapkan (ml) harus diubah kedalam satuan liter
W adalah berat contoh (g)
26
A. Tahap destilasi
1 Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi dengan akuades sampai setengahnya untuk menghindari kontaminasi oleh ammonia lingkungan, kemudian didihkan selama 10 menit.
2 Erlenmeyer yang berisi 10 ml H2SO4 0.05 N dan 2 tetes larutan indicator disimpan dibawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3 Masukkan 5 ml larutan sampel ke dalam tabung destilasi melalui corong tersebut dan masukkan ke dalamnya 10 ml NaOH 30% lalu ditutup.
4 Campuran alkalin dalam labu destilasi disuling menjadi uap air selama 10 menit setelah terjadi pengembunan pada kondensor.
5 Labu Erlenmeyer diturunkan sehingga kondensor berada dileher labu, diatas permukaan larutan. Bilas kondensor dengan akuades selama 1-2 menit.
B. Tahap titrasi
1 Larutan hasil destilasi dititrasi dengan NaOH 0.05 N sehingga berubah warna. 2 Catat volume titrasi.
Lakukan prosedur yang sama terhadap blanko.
27
1. Labu silinder dioven terlebih dahulu pada suhu 110oC selama 1 jam, dinginkan dalam desikator selama 30 menit kemudian ditimbang (X1).
2. Timbang 2-3 g bahan atau sampel (A) ke dalam gelas homogenize.
3. Tambahkan larutan kloroform atau methanol C (20 ml x A), sisakan sebagian untuk membilas pada saat penyaringan.
4. Sampel yang telah diberi larutan tadi kemudian dihomogenize selama 5 menit, setelah itu saring dengan vacuum pump.
5. Masukkan sampel yang telah disaring tersebut ke dalam labu pemisah yang telah diberi larutan MgCl2 0.03 M (sebanyak 0.2 ml x C), kemudian kocok dengan kuat minimal 1 menit. Tutup dengan aluminium foil dan diamkan semalam.
6. Lapisan bawah yang terdapat pada labu pemisah disaring ke dalam labu silinder, kemudian dievaporator sampai kering. Tiup sisa kloroform atau methanol yang terdapat pada labu menggunakan vacuum. Setelah itu timbang (X2).
28
Panaskan cawan dalam oven pada suhu 110oC selama 1 jam
Dinginkan cawan dalam desikator selama 30 menit
Timbang bobot cawan tadi (g) …… A
Timbang bahan atau sampel,
catat bobotnya (g) …… B
Panaskan cawan dengan sampel tadi, di oven 110oC selama 2 jam
Dinginkan dalam desikator selama 30-60 menit
Timbang cawan tersebut
Ulangi pemanasan dan prosedur tadi, s ampai bobot cawan tetap
Penimbangan terakhir pada cawan dicatat (g) …… C
Perhitungan kadar air (%) =
29
Panaskan cawan dalam oven pada suhu 110oC selama 1 jam
Dinginkan cawan dalam desikator selama 30 menit
Timbang bobot cawan tadi (g) …… A
Masukkan bahan atau sampel 1-2 g kedalam cawan Dan timbang dengan ketelitian 0.0001 g
catat bobotnya (g) …… B
Bakar cawan dalam tanur yang diset pada suhu 600oC
Diamkan semalaman
Dinginkan dalam desikator selama 30-60 menit
Ulangi pemanasan dan prosedur tadi, s ampai bobot cawan tetap
Timbang dan catat beratnya (g) …… C
Perhitungan kadar abu (%) =