DAN OPSONIN UNTUK PENCEGAHAN SERANGAN
Salmonella
ENTERITIDIS
EFRIZAL
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DAN OPSONIN UNTUK PENCEGAHAN SERANGAN
Salmonella
ENTERITIDIS
EFRIZAL
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
untuk Pencegahan serangan Salmonella Enteritidis Nama : Efrizal
NIM : B054040031
Disetujui
Komisi Pembimbing
Dr. drh. I. Wayan T. Wibawan, M.S. Dr. drh. Retno D. Soejoedono, M.S. Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Kesehatan Masyarakat Veteriner
Dr. drh. Denny W. Lukman, M.S. Prof. Dr. Ir. Khairil Anwar Notodiputro, MS.
EFRIZAL. Peran Imunoglobulin Yolk (IgY) Sebagai Anti Adhesi dan Opsonin Untuk
Pencegahan Serangan
S
. Enteritidis. Dibimbing oleh : I. WAYAN T. WIBAWAN
dan RETNO D. SOEJOEDONO.
Ayam petelur memiliki peranan penting sebagai penghasil antibodi poliklonal.
Antibodi ayam atau dikenal dengan IgY dapat dipurifikasi dari kuning telur. Biaya
untuk memproduksi IgY relatif lebih murah daripada antibodi mamalia karena biaya
pemeliharaan ayam tidak mahal, relatif lebih murah dan cepat menghasilkan telur.
Penelitian ini bertujuan untuk mempelajari cara memproduksi IgY anti
S
. Enteritidis
dari telur dan mengetahui peran IgY
S
. Enteritidis sebagai anti adhesi dan opsonin
untuk pencegahan serangan
S
. Enteritidis. IgY spesifik dikoleksi dari telur ayam
Single Comb Brown Leghorn
yang telah diimunisasi dengaan antigen untuk
S
. Enteritidis.
Imunisasi diaplikasikan secara intravena dengan dosis antigen untuk
S
. Enteritidis 0.5 ml (10
9sel/ml) selama tiga hari berturut-turut pada minggu pertama.
Selanjutnya dilakukan pengulangan imunisasi sebanyak 3 kali dengan interval waktu
seminggu secara
intramuscular
dengan dosis untuk antigen 1 ml (10
9sel/ml)
S
. Enteritidis dalam
Freund’s adjuvant complete
di minggu kedua dan
Freund’s
adjuvant incomplete
di minggu ketiga dan keempat. Uji agar gel prepitasi (AGP)
dilakukan untuk mengetahui terbentuknya IgY anti
S
. Enteritidis. Ekstraksi IgY dari
kuning telur menggunakan metode PEG-amonium sulfat, kemudian dipurifikasi
dengan
fast protein liquid chromatography
. Konsentrasi IgY yang telah dimurnikan
dihitung dengan spektrofotometer UV dan untuk mengetahui berat molekul dari IgY
dilakukan dengan SDS-PAGE.
Aktifitas biologi IgY anti
S
. Enteritidis sebagai anti adhesi dipelajari dengan uji
hambat anti adhesi secara in vitro menggunakan sel epitel pipi manusia. Uji hambat
adhesi dilakukan dengan dosis 100 µg mampu menurunkan jumlah bakteri pada sel
epitel pipi manusia. Adhesi
S
. Enteritidis pada sel epitel pipi berjumlah 61 sel
bakteri/sel epitel pipi, sementara nilai anti adhesi adalah 35 sel bakteri/sel epitel pipi
manusia. IgY mampu meningkatkan nilai aktifitas makrofag dan kapasitas fagositosis
dalam proses fagositosis. Perlakuan tanpa pemberian IgY diperoleh nilai aktifitas
makrofag sebesar 34% dan kapasistas fagositosis sebesar 4.8 sel bakteri/sel epitel pipi
manusia. Sedangkan perlakuan dengan pemberian IgY anti
S.
Enteretidis 100 µg
diperoleh nilai aktifitas makrofag sebesar 56% dan kapasitas fagositosis sebesar
5.1 sel bakteri/sel epitel pipi manusia. Kesimpulan dari penelitian ini adalah IgY anti
S.
Enteritidis berperan sebagai anti adhesi dan opsonin untuk pencegahan serangan
S.
Enteritidis.
EFRIZAL. The Role of Yolk Immunoglobulin (IgY) as anti adhesion and opsonin
againts
Salmonella
Enteritidis. Under the direction of I. WAYAN T. WIBAWAN and
RETNO D. SOEJOEDONO.
Laying hens has significants part as prosedurs of polyclonal antibody. Antibody
from egg or Yolk immunoglobulin can he purified from egg yolk. The cost for
producing IgY is cheaper than for mammalia antibodies. The aim of the stuy was to
explore the role of IgY anti
Salmonella
Enteritidis as opsonin and anti adhesion.
Spesific IgY was collected from egg of
Single Comb Brown Lenghorn
hen was
applied intravenously with initial dose 0.5 ml x 10
9cell/ml.
The immunization was repeated three times with an interval of one week
intramuscularly wih dose 1 ml x 10
9cell/ml. First booster was
Salmonella
Enteritidis
antigen mixed with freund’s adjuvant complete. Anti
Salmonella
Enteritidis
extracted from egg yolks by means of PEG-amonium sulfat and purified using fast
purification liquid chromatography. The existence of anti
Salmonella
Enteritidis was
determined by agar presipitation test and spectrophotometer UV. The molecular
weight of anti
Salmonella
Enteritidis was determined with SDS-PAGE.
Anti adhesion and phagositosis assay using human cheek ephitel cell with dose
100 µg of anti
Salmonella
Enteritidis. The result show the decrease pf adhesion from
61 cell bactery/cheek ephitel cell to 35 cell bactery/cheek ephitel cell. IgY also
increase the capacity of phagositosis from 4.8 cell bactery/cheek ephitel cell to 5.1
cell bactery/cheek ephitel cell. The actifity of phagositosis are also increase from 34%
to 56%. This research concluded that hens were capable producing IgY anti
Salmonella
Enteritidis ad it can be used as anti adhesion and opsonin to prevent
infection by
Salmonella
Enteritidis.
Puji syukur penulis panjatkan kepada Allah Subhana Wata’ala atas rahmat yang telah dilimpahkan sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis yang berjudul “Peran Imunoglobulin Yolk (IgY) Sebagai Anti Adhesi dan Opsonin Untuk Pencegahan Serangan Salmonella Enteritidis”.
Ucapan terima kasih penulis sampaikan kepada :
1. Dr. drh. I. Wayan T. Wibawan, M.S. selaku ketua komisi pembimbing dan Dr. drh. Retno D. Soejoedono, M.S. selaku anggota komisi pembimbing atas waktu, saran, kesempatan , nasehat dan bimbingannya.
2. Dr. drh. Denny W. Lukman, M.Si. selaku Ketua Program Studi Kesehatan Masyarakat Veteriner.
3. selaku dosen penguji luar.
4. drh. Okti Nadya Poetri selaku teman tim IgY, Dr. drh. Sri Murtini, M.S., Dr. drh. I. Nyoman Suartha, M.Si, drh. R. Susanti, M.P., drh. Dwi Desmiyeni Putri, M.Si, dan drh. Nyi Luh Ika Mayasari atas bantuan, motivasi dan sarannya.
5. Teman-teman Program Studi Kesmavet (Kelas khusus dan reguler 2005).
6. Staf Teknisi laboratorium Imunologi (Pak Lukman, Pak Nur dan Mas Wahyu) Departemen IPHK Fakultas Kedokteran Hewan IPB.
7. Adek-adek Tim IgY ( Eka, Anggi, Vivi dan Arif) atas kerjasama selama penelitian.
8. Ayahanda, Ibunda dan saudara-saudara saya (Hendri Maulyani, S.P, Deshayati, S.Pd dan Fitriandi) atas segala doa dan perhatiannya.
9. Teman-teman kos Sanggar Kenangan sengked (Hazein, Dedek, Agung, Faldy, Chaerul dan Danar).
Bogor, April 2007
© Hak cipta milik Institut Pertanian Bogor, tahun 2007.
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya
Penulis dilahirkan di Gunung Bayu Simalungun Sumatera Utara, 23 Januari 1978 dari ayah Harius dan ibu Nurbaiti. Penulis merupakan anak ketiga
dari empat bersaudara.
PENDAHULUAN
Latar Belakang
Diare merupakan salah satu gejala klinis penyakit saluran pencernaan
(gastrointestinal), ditandai dengan meningkatnya frekuensi buang air besar lebih
dari tiga kali sehari, adanya perubahan bentuk dan konsistensi tinja penderita.
Dikenal 2 jenis diare : (1) diare akut, timbul dengan tiba-tiba dan berlangsung
beberapa hari dan (2) diare kronis yang berlangsung lebih dari tiga minggu
bervariasi dari hari ke hari yang disebabkan oleh makanan tercemar atau penyebab
lainnya (Harianto 2004; Anonim 2007a). Gejala diare diikuti dengan rasa mulas,
tubuh lemas, muka pucat, kadang-kadang mual, muntah dan demam. Diare ada
yang dapat sembuh sendiri tanpa diobati, namun bila tidak ditanggulangi sedini
mungkin dapat menyebabkan dehidrasi dan bila tidak ditolong akan meninggal.
Diare merupakan salah satu masalah kesehatan di Indonesia dan menurut
Survei Kesehatan Rumah Tangga 1986 ternyata diare termasuk dalam 8 penyakit
utama di Indonesia (Budiarso dalam Harianto 2004). Angka kesakitan diare
mencapai 200 sampai 400 kejadian tiap 1000 penduduk setiap tahun. Sebagian
besar (70 sampai 80%) penderita adalah anak balita dan 1 sampai 2% dari
penderita menderita dehidrasi. Tercatat 300 000 sampai 500 000 anak balita yang
meninggal akibat diare (Gertruida et al. dalam Harianto 2004).
Diare dapat disebabkan oleh infeksi bakteri, virus, parasit dan dapat pula
disebabkan oleh malaborpsi makanan, keracunan makanan, alergi ataupun karena defisiensi. Salah satu bakteri penyebab diare adalah Salmonella dan penyakitnya disebut dengan Salmonellosis. Salmonellosis selain merugikan secara ekonomi,
juga sangat penting dalam kaitannya dengan kesehatan masyarakat. Meskipun
banyak patogen lain yang dapat menyebabkan sakit, Salmonella tetap menjadi
penyebab utama penyakit. Strain bakteri S. Enteritidis dan S. typhimurium
dilaporkan penyebab Salmonellosis yang paling utama.
Dalam upaya menanggulangi penyakit diare yang disebabkan oleh
S. Enteritidis, pencegahan dini adalah upaya yang sangat penting. Salah satu
bentuk pencegahan adalah pemberian imunisasi pasif yang dapat dilakukan
Antibodi spesifik dapat ditemukan pada imunoglobulin Y pada telur ayam
(IgY) yang diinfeksi dengan S. Enteritidis, sehingga imunisasi pasif dapat
dilakukan dengan penggunaan IgY.
Teknologi penggunaan IgY unggas sebagai upaya pemberian kekebalan
pasif khususnya untuk pencegahan dan pengobatan belum banyak dilaksanakan.
Para peneliti masih menggunakan imunoglobulin dari mamalia seperti kelinci,
mencit putih, tikus, babi dan hewan mamalia besar seperti kuda, kambing, domba
dan sapi. Prosedur produksi antibodi pada hewan tersebut menyebabkan hewan
mengalami cekaman (stress) . Cekaman terjadi saat : (1) melakukan imunisasi
pada hewan dan (2) pengambilan darah untuk memanen antibodi. Berkenaan
dengan animal welfare dan juga efisiensi biaya, penggunaan antibodi dalam telur
lebih bisa diterima dibandingkan dengan penggunaan hewan percobaan
(Svendsen et al. 1994).
Penggunaan IgY anti S. Enteritidis dalam telur, dapat dilakukan karena :
(1) IgY yang terdapat dalam darah mudah ditransfer ke dalam telur dengan
konsentrasi sangat tinggi, (2) proses pengebalan ayam mudah dilakukan,
(3) produksi telur anti S. Enteritidis secara masal sangat mungkin dilakukan.
Tujuan Penelitian
Tujuan penelitian ini untuk mengetahui peran IgY anti S. Enteritidis sebagai
anti adhesi dan opsonin untuk pencegahan serangan S. Enteritidis.
Manfaat Penelitian
Penelitian ini diharapkan mampu memberi informasi tentang karakter IgY
ayam anti S. Enteritidis sebagai anti adhesi dan opsonin untuk pencegahan
TINJAUAN PUSTAKA
Imunoglobulin Yolk (IgY)
Imunoglobulin merupakan substansi pertama yang diidentifikasi sebagai
molekul dalam serum yang mampu menetralkan sejumlah mikroorganisme
penyebab infeksi. Molekul ini disentesis oleh sel ß dalam dua bentuk yang
berbeda yaitu sebagai reseptor permukaan (untuk mengikat antigen) dan sebagai
antibodi yang disekresikan ke dalam cairan ekstraseluler (Kresno 2001).
Pada ayam terdapat tiga kelas imunoglobulin yang analog dengan
imunoglobulin mamalia yaitu IgA, IgM dan IgY (IgG). Warr et al. (1995) telah
mengusulkan keberadaan antibodi pada ayam yang homolog dengan IgE dan IgD
mamalia namun belum dibuktikan. Imunoglobulin Yolk (IgY) adalah
imunoglobulin (Ig) yang sebagian besar ditemukan pada serum dan telur unggas,
selain Ig yang lain seperti Ig A dan Ig M (Carlander 2002). Molekul IgY secara
struktural terdiri dari dua rantai berat dan dua rantai ringan. Rantai berat tidak
memiliki engsel dan memiliki empat domain variabel yaitu Cv1, Cv2, Cv3 dan
Cv4. IgY memiliki berat molekul ~180 kDa dengan masing-masing rantai berat
~65 sampai 68 kDa, koefisien sedimentasi 7.8 S dan titik isoelektrik 5.7 sampai
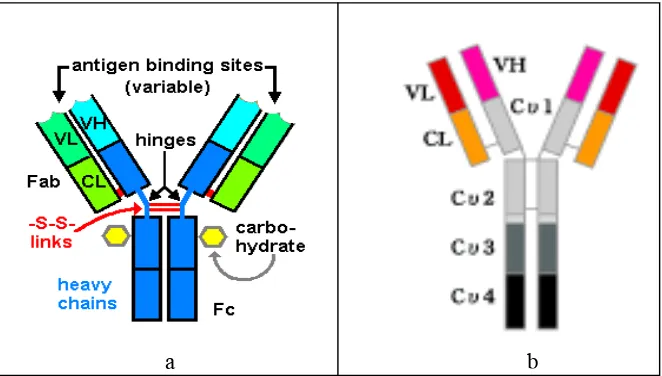
7.6 (Davalos et al. 2000). Struktur IgG dan IgY ditunjukkan pada Gambar 1.
Gambar 1 Struktur IgG dan IgY (Anonim 2007b). a : IgG, b : IgY.
Dari sudut pandang evolusi, IgY diduga menjadi cikal bakal IgG dan IgE
mamalia. Perbandingan IgG dan IgY disajikan pada Tabel 1.
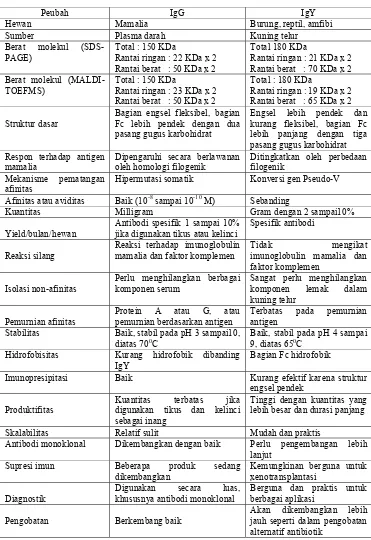
Tabel 1 Perbandingan IgY dan IgG (Zhang 2003)
Peubah IgG IgY
Hewan Mamalia Burung, reptil, amfibi
Sumber Plasma darah Kuning telur
Berat molekul (SDS-PAGE)
Total : 150 KDa
Rantai ringan : 22 KDa x 2 Rantai berat : 50 KDa x 2
Total 180 KDa
Rantai ringan : 21 KDa x 2 Rantai berat : 70 KDa x 2 Berat molekul
(MALDI-TOEFMS)
Total : 150 KDa
Rantai ringan : 23 KDa x 2 Rantai berat : 50 KDa x 2
Total : 180 KDa
Rantai ringan : 19 KDa x 2 Rantai berat : 65 KDa x 2
Struktur dasar
Bagian engsel fleksibel, bagian Fc lebih pendek dengan dua pasang gugus karbohidrat
Engsel lebih pendek dan kurang fleksibel, bagian Fc lebih panjang dengan tiga pasang gugus karbohidrat Respon terhadap antigen
mamalia
Dipengaruhi secara berlawanan oleh homologi filogenik
Ditingkatkan oleh perbedaan filogenik
Mekanisme pematangan afinitas
Hipermutasi somatik Konversi gen Pseudo-V
Afinitas atau aviditas Baik (10-8 sampai 10-10 M) Sebanding
Kuantitas Milligram Gram dengan 2 sampai10%
Yield/bulan/hewan
Antibodi spesifik 1 sampai 10% jika digunakan tikus atau kelinci
Spesifik antibodi
Reaksi silang
Reaksi terhadap imunoglobulin mamalia dan faktor komplemen
Tidak mengikat imunoglobulin mamalia dan
faktor komplemen
Isolasi non-afinitas
Perlu menghilangkan berbagai komponen serum
Sangat perlu menghilangkan komponen lemak dalam kuning telur
Pemurnian afinitas
Protein A atau G, atau pemurnian berdasarkan antigen
Terbatas pada pemurnian antigen
Stabilitas Baik, stabil pada pH 3 sampai10, diatas 700C
Baik, stabil pada pH 4 sampai 9, diatas 650C
Hidrofobisitas Kurang hidrofobik dibanding IgY
Bagian Fc hidrofobik
Imunopresipitasi Baik Kurang efektif karena struktur engsel pendek
Produktifitas
Kuantitas terbatas jika digunakan tikus dan kelinci sebagai inang
Tinggi dengan kuantitas yang lebih besar dan durasi panjang
Skalabilitas Relatif sulit Mudah dan praktis
Antibodi monoklonal Dikembangkan dengan baik Perlu pengembangan lebih lanjut
Supresi imun Beberapa produk sedang dikembangkan
Kemungkinan berguna untuk xenotransplantasi
Diagnostik
Digunakan secara luas, khususnya antibodi monoklonal
Berguna dan praktis untuk berbagai aplikasi
Pengobatan Berkembang baik
Kelebihan IgY Ayam Dibanding IgG Mamalia
Beberapa kelebihan IgY ayam dibanding IgG mamalia dari segi molekul
antibodinya, yaitu :
1. Aviditas tinggi
Secara filogenik, ayam dengan mamalia jaraknya jauh. Perbedaan tersebut
berpengaruh pada aviditas antibodi ayam yang tinggi terhadap protein mamalia
yang terkonservasi. Dibanding dengan antibodi yang diproduksi mamalia,
antibodi ayam dapat lebih mengenali lebih banyak epitop antigenik pada antigen
mamalia (Haak 1994).
2. Reaksi silang dengan IgG mamalia rendah
Antibodi mamalia menunjukkan tingkat reaksi silang yang tinggi terhadap
imunoglobulin mamalia. Misalnya IgG kelinci anti-manusia akan bereaksi silang
terhadap IgG mamalia lain kecuali dengan IgG kelinci. Namun tidak akan
bereaksi silang dengan IgY yang secara imunologis sangat berbeda dengan IgG
mamalia. Dengan demikian IgY ayam dapat digunakan sebagai antibodi primer
dan imunoglobulin Kelinci anti IgY ayam sebagai antibodi sekunder (Larson &
Sjoquist 1998).
3. IgY tidak berkaitan dengan faktor rheumatoid
IgY ayam bereaksi dengan faktor rheumatoid (penanda respon inflamasi)
dapat menghasilkan positif palsu seperti pada kasus pengujian serum pasien yang
menderita penyakit autoimun. IgY yang tidak dapat bereaksi dengan faktor
rheumatoid memungkinkan hasil akurasi yang tinggi pada diagnostik
(Davalos et al. 2000).
4. IgY tidak berikatan dengan protein A dan G
Protein A Staphylococcus dan protein G Streptococcus tidak dapat mengikat
bagian Fc ayam. Hal ini memungkinkan anti-protein A dan anti-protein G dari
ayam untuk bereaksi dengan protein A dan G. Kompleks protein A IgG dan
protein G IgG dapat bereaksi dengan antibodi ini.
5. IgY tidak mengaktifkan faktor komplemen
Komplemen merupakan mediator terpenting dalam reaksi antigen antibodi
dan terdiri atas sekitar 20 jenis protein yang berbeda satu dengan yang lain baik
reaksi imunologik lain yang melibatkan aktifasi sel-sel efektor dengan cara
berikatan dengan reseptor komplemen yang terdapat pada permukaan sel yang
bersangkutan, atau memacu respon imun humoral yang lain (Kresno 2001).
Pemanfaatan IgY
Adanya IgY dalam telur memberikan prospek yang sangat berarti, bukan
hanya bagi pemberian kekebalan pasif. Prinsip pengebalan pasif adalah transfer
kekebalan terhadap beberapa penyakit dapat dilakukan dengan
mengkomsumsi ”telur yang dibuat telah mengandung zat kebal” dan dipreparasi
secara khusus. IgY unggas mengenal lebih banyak epitoip protein mamalia
dibandingkan dengan imunoglobulin kelinci sehingga cocok untuk percobaan
imunologi untuk protein mamalia (Schade et al. 1996).
Penggunaan IgY spesifik bukan hanya bermanfaat bagi tindakan profilaksis
atau pengobatan, tetapi juga dapat dikembangkan untuk tujuan imunodiagnostik,
seperti misalnya pembuatan konjugat untuk tujuan Western Blotting, ELISA dan
reaksi imunopresipitasi (Haak 1994).
Keuntungan penggunaan telur sebagai sumber antibodi dibandingkan
dengan mamalia adalah (1) satu butir telur menghasilkan IgY setara dengan IgG
yang diambil dari 40 ml darah kelinci, (2) cara panennya sederhana, (3)
pengambilannya tidak invansif dan tidak menyakiti hewan, (4) merupakan
alternatif yang paling menjanjikan sebagai pengganti cara memproduksi IgG
konvensional, (5) dapat dipanen tiap hari terus menerus, (6) tidak menunjukkan
reaksi silang dengan komponen jaringan mamalia, karena jarak filogenik antara
unggas dan mamalia sangat jauh, (7) telur dapat disimpan dengan mudah dalam
jangka waktu relatif lama, (8) menghasilkan respon imun yang lebih spesifik, dan
(9) tidak memiliki efek samping, karena tidak bereaksi dengan IgG mamalia dan
reseptor (Davalos et al. 2000).
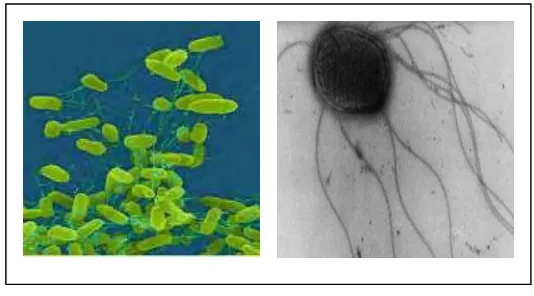
Salmonella Enteritidis
Salmonella Enteritidis merupakan salah satu serotipe dari sekitar 2463
serotipe Salmonella baik pada hewan atau manusia. Serotipe ini ditunjukkan oleh
Pada tahun 1888 Gartner pertama kali mengisolasi S. Enteritidis dari kotoran
manusia yang terkena wabah keracunan daging di Frankenhausen, Jerman.
S. Enteritidis merupakan bakteri gram negatif, berdiameter 0.6 sampai 0.7 mm dan
panjang 2 sampai 3 mm, bergerak dengan flagel peristik, soliter, berpasangan atau
kadang membentuk rantai pendek. Pada media agar S. Enteritidis membentuk
koloni yang memiliki diameter 2 sampai 4 mm ( Saeed 1999; Clark 2007).
Gambar 2 Salmonella Enteritidis (Clark 2007).
Keberadaan organisme ini dapat dideteksi dengan isolasi dan identifikasi
menggunakan reaksi kimia. Gejala yang mungkin terlihat pada ayam yang
terinfeksi adalah depresi, malas bergerak, diare, sayap terkulai, feses berwarna
putih encer, kornea keruh dan bola mata mengalami perkejuan. Setelah nekropsi
akan terlihat adanya perikarditis, periphepatitis, salphingitis, enteritis
hemoraghika, sekum membengkak, bercak nekrosis dan adanya lesio nekrotik
pada paru-paru, hati dan jantung (Lay 2000).
Keamanan pangan merupakan hal yang sangat penting untuk diperhatikan
dalam upaya penyediaan pangan hewan bagi konsumsi masyarakat, yang sangat
erat kaitannya dengan kesehatan masyarakat. Produk asal ternak unggas
merupakan sumber utama Salmonella yang menyebabkan penyakit pada manusia
(Gast 2003). Kasus Salmonellosis pada manusia paling sering dilaporkan akibat
mengkonsumsi daging, telur atau hasil olahannya (Pascual et al. 1999; Craven &
Williams 1997).
Humprey (1998) menyatakan bahwa, meningkatnya konsumsi daging dan
beberapa tahun terakhir ini. Di Amerika Serikat sekitar 50% kejadian
Salmonellosis pada manusia disebabkan oleh bakteri S. Enteritidis,
S. typhimurium dan S. heidelberg (Pascual et al. 1999).
Di Indonesia, telah banyak dilaporkan kasus Salmonellosis yang
disebabkan oleh Salmonella Enteritidis pada peternakan ayam broiler. Dari tahun
1990–1996 telah diisolasi S. Enteritidis dari sampel ayam yang dikirim ke Balai
Penelitian Veteriner Bogor (Purnomo & Bahri 1997). Sampai saat ini
S. Enteritidis telah diisolasi dari ayam (usapan rectal, usus/sekum, hati, limpa dan
jantung), karkas, kuning telur, litter dan fluff (bulu-bulu halus dari mesin tetas).
Salmonellosis juga dapat ditularkan oleh ayam ke telur secara trans ovarial,
sehingga telur ayam dapat terkontaminasi Salmonella tanpa menimbulkan
perubahan pada penampilan telur.
Daging dan telur ayam merupakan sumber protein hewani yang utama
bagi masyarakat, yang sering tidak bebas dari bakteri ini. Lebih berbahaya lagi
S. Enteritidis dapat diisolasi dari kuning telur, padahal telur dan hasil olahannya
sering disajikan dalam bentuk mentah atau setengah matang (seperti omelette,
scramble dan mayonnaise). Ini menunjukkan bahwa infeksi S. Enteritidis masih
merupakan ancaman bagi manusia. Jika dikaitkan dengan kebiasaan masyarakat
Indonesia yang mencampurkan kuning telur ke dalam jamu, maka penularan
langsung S. Enteritidis dari telur ke manusia sangat mudah terjadi.
Sejak tahun 1980-an, di beberapa negara telah dilaporkan terjadi kenaikan
kasus salmonellosis yang disebabkan oleh S. Enteritidis pada ayam dan manusia
(Rodrique et al. 1990; Adesiyun et al. 2000). Meningkatnya kasus Salmonellosis
pada manusia disebabkan oleh infeksi S. Enteritidis karena mengkonsumsi
makanan seperti ayam, telur dan hasil olahannya yang terkontaminasi oleh bakteri
tersebut (Craven and Williams 1997; Pascual et al. 1999; Ahmed et al. 2000).
Meningkatnya kasus Salmonellosis pada manusia juga dilaporkan dari Amerika
Serikat dan Canada (Ahmed et al. 2000; CCDR 1997; Riemann et al. 1998).
Kenaikan kasus pada ayam dan telur juga dilaporkan dari Inggris, Korea, Wales,
Amerika Serikat, Zambia dan Yunani (Chang 2000; Gast & Holt 2000;
Hang’ombe et al. 1999) dan pada manusia dilaporkan dari Amerika Serikat dan
telah terjadi kenaikan resistensi S. Enteritidis terhadap antibiotika, seperti telah
dilaporkan dari Taiwan dan Amerika Serikat (Su et al. 2002).
Patogenitas Salmonella Enteritidis
Salmonellosis dibagi dalam tiga tahap, yaitu (1) kolonisasi usus yang
merupakan tahapan terpenting dalam proses ini. Kolonisasi usus terjadi karena
adanya penambahan keseimbangan flora normal usus sehingga menghambat
proses kolonisasi bakteri non patogen dan penurunan gerakan peristaltik sehingga
memudahkan kolonisasi Salmonella (2) Perasukan lapisan epitel usus. Tahap ini
terjadi pada bagian vili dari ileum dan kolon dengan melewati lapisan ”Brush
Border” hingga sampai ke dalam sel lainnya, lalu melewati lamina propia dan
terus berkembang yang diikuti proses fagositosis dan terperangkapnya mikroba
dalam limfo glandula dan (3) Penggertakan pengeluaran cairan. Tahap ini terjadi
akibat peningkatan aktivitas enzim adenil siklase oleh infeksi Salmonella dan
akibat aktivasi enterotoksin Salmonella yang dapat menginduksi respon sekretori
dari sel epitel usus, maka terjadilah akumulasi cairan dalam lumen usus (Lay &
Hastowo 1992). .
Keparahan penyakit dipengaruhi oleh faktor antigen baik somatik maupun
flagela, produksi toksin, kemampuan bertahan dalam pH asam dan suhu tinggi
dari bakteri, jumlah bakteri dan kemampuan berinvansi serta berkolonisasi dalam
jaringan. Faktor lain adalah kondisi inang, seperti stres dan lingkungan
(Gast 2003).
Sistem Kekebalan yang Menanggapi Serangan Bakteri
Bila bakteri melekat pada permukaan mukosa usus, bakteri akan berhadapan
dengan sel-sel imunitas. Bakteri akan didegradasi oleh makrofag dan
menghasilkan reruntuhan (debris) yang akan dikeluarkan oleh makrofag, tetapi
fragmen peptida dari protein bakteri akan ditransfer ke permukaan makrofag.
Selanjutnya akan dibentuk kompleks peptida-MHC (Major Histocompability
Complex). Kompleks ini akan menstimulasi sel T. helper yang akan menstimulasi
Saat ini dikenal dua macam antibodi yaitu antibodi poliklonal dan antibodi
monoklonal. Antibodi yang diperoleh dari hewan hiperimun dikenal antibodi
poliklonal atau konvensional yang bersifat heterogen. Cara ini digunakan untuk
memperoleh sejumlah besar antibodi terhadap antigen spesifik. Antibodi
monoklonal merupakan produk klon tunggal sel ß yang mempunyai keseragaman
struktur molekul. Antibodi monoklonal sudah luas digunakan untuk berbagai
kepentingan yaitu untuk diagnosa (deteksi antigen atau antibodi baik secara in
vitro maupun in vivo, terapi (pencegahan), pemurnian (koagulasi) dan penelitian
(klasifikasi, taksonomi mekanisme) species bakteri dan studi biokimia
(Macario & Macario 1985).
Adhesi
Proses adhesi merupakan tahap awal infeksi bakteri yang berperan dalam
kolonisasi bakteri tersebut pada permukaan sel inang. Adanya adhesi
memperpendek jarak antara bakteri dengan permukaan tubuh inang sehingga
mempermudah toksin yang dihasilkan bakteri untuk melekat pada reseptornya.
Dalam adhesi dikenal dua bentuk pola adhesi yaitu (1) adhesi yang bersifat non
spesifik, dan (2) adhesi yang bersifat spesifik (Christensen & Beachey 1984).
Perlekatan bakteri pada sel inang berfungsi sebagai menetap dan dapat
merupakan langkah awal proses infeksi. Proses ini dipengaruhi oleh interaksi
komponen permukaan bakteri dan sel inang dengan faktor lingkungan yang dapat
mendukungnya seperti fibrinectin (suatu protein yang bersifat adhesif), fibrinogen,
vitronektin dan laktoferin (Mims 1982). Struktur yang mungkin bertanggung
jawab terhadap sifat adhesi bakteri adalah adhesin fimbiriae, asam lipoteikoat dan
protein adhesin. Interaksi yang terlibat dalam adhesin sebagian besar disebabkan
oleh struktur permukaan hidrofob (Doyle & Rosenberg 1990).
Opsonisasi
Opsonisasi merupakan pengikatan partikel oleh suatu zat (oleh molekul Ig
atau C3). Opsonisasi dipermudah dengan adanya reseptor untuk FC Ig dan C3
pada permukaan sel membran makrofag. Opsonisasi antigen oleh imunoglobulin
memproses dan menyajikan antigen ke sel T dan meningkatkan fungsi sel NK
(Natural Killer) dalam mekanisme antibodi dependent cytotoxicity (ADCC)
(Kresno 2001).
Mekanisme opsonisasi dapat melalui beberapa cara yaitu (1) antibodi
spesifik yang berfungsi sebagai opsonin, (2) ikut campurnya komponen C3b
sistem komplemen, mirip dengan kemotaksis, dan (3) bantuan substansi yang
berasal dari protein serum berupa heat-labile factor dan bersifat opsonin
(Shwatz & Lazar 1980).
Fagositosis
Fagositosis adalah suatu proses penjeratan dan penghancuran benda asing
yang dilakukan oleh sel-sel fagositik dan merupakan sistem pertahanan inang.
Terdapat dua tipe sel fagositik yaitu sel leukosit polimorf
(Polymorphonuclear/netrofil) dan sel mononuclear fagosit (makrofag). Banyak
faktor yang mempengaruhi proses fagositosis antara lain pergerakan sel fagositik
karena rangsangan benda asing dan kerentanan benda asing untuk difagositasi
(Kuby 1997). Dalam kerjanya, sel fagosit juga berinteraksi dengan komplemen
dan sistem imun spesifik. Penghancuran kuman terjadi dalam beberapa tingkat
yaitu kemotaksis, menangkap, memakan (fagositosis), membunuh dan mencerna.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan pada bulan Juni 2005 sampai Desember 2006 di
Kandang Hewan Percobaan, Laboratorium Terpadu, Laboratorium Bakteriologi,
Laboratorium Produksi Bahan Biologis dan Imunologi Fakultas Kedokteran
Hewan, Institut Pertanian Bogor.
Metode Penelitian
Preparasi Antigen S. Enteritidis
Bakteri S. Enteritidis rujukan ATCC 130706 dan lokal 821/94 ditumbuhkan
pada media BHI dan diinkubasi pada suhu 37 oC selama 18 jam. Suspensi
disentrifugasi pada kecepatan 10 000 rpm selama 10 menit. Pelet diresuspensikan
dengan 5 ml NaCl fisiologis, disentrifugasi pada 10 000 rpm 10 menit, dilakukan
2 kali. Pelet dilarutkan dalam 5 ml NaCl fisiologis, dihomogenkan dan diukur
pada Ȝ 620 nm dengan transmisi 10% konsentrasi selnya untuk menentukan
kandungan bakteri 109 sel/ml. Suspensi diinaktifkan dalam penangas air pada
suhu 56 oC selama 60 menit, didinginkan dan siap digunakan sebagai vaksin
untuk memproduksi antibodi.
Produksi Antibodi
Ayam petelur Single Comb Brown Leghorn berumur 24 minggu diinjeksi
dengan 0.5 ml (109sel/ml) suspensi S. Enteritidis secara intravena (Carlander
2002) selama tiga hari berturut-turut. Kemudian dilanjutkan dengan menyuntik
1 ml (109sel/ml) suspensi S. Enteritidis dalam Freund’s adjuvant complete pada
minggu II , serta 1 ml (109sel/ml) suspensi S. Enteritidis dalam Freund’s
adjuvant incomplete pada minggu III dan IV secara intramuskular (Wibawan
& Laemmler 1992). Satu minggu setelah penyuntikan terakhir dilakukan panen
serum dan keberadaan antibodi diuji dengan uji Agar Gel Prepisipitasi (AGP).
Telur-telur yang memiliki antibodi terhadap S. Enteritidis dikoleksi dan disimpan
Persiapan Antigen Untuk Uji Agar Gel Presepitasi (AGP)
Bakteri S. Enteritidis ditumbuhkan pada media BHI, diinkubasi pada suhu
37 oC selama 18 jam. Suspensi disentrifugasi pada kecepatan 10 000 rpm selama
10 menit. Pelet diresuspensikan dengan 5 ml NaCl fisiologis, disentrifugasi pada
10 000 rpm dilakukan 2 kali. Pelet dicuci, ditambah 0.5 ml HCl 0.2 N dan
ditangas dalam penangas air dengan suhu 56 oC selama 1 jam. Kemudian
ditambah satu tetes phenol red dan ditambah NaOH 1 N hingga berwarna merah.
Suspensi disentrifugasi pada 10 000 rpm selama 10 menit, dilakukan 2 kali.
Supernatan digunakan sebagai antigen (Wibawan & Laemmler 1992).
Pengujian IgY anti S. Enteritidis dengan Uji AGP
Agar dibuat dengan melarutkan 0.4 g agarose dan 1.2 g Poly Ethylene
Glycol 6000 dalam 20 ml akuades dan 25 ml PBS 0.5 M pH 7.4. Campuran
dididihkan pada suhu 70 sampai 80 oC hingga larut. Campuran dipipet sebanyak
3.75 ml, dituangkan pada gelas obyek dan ditunggu sampai mengeras. Kemudian
dibuat sumur-sumur dengan puncher. Pada sumur tengah dimasukkan antigen
(25 ȝl) dan 25 ȝl antibodi (IgY) dari serum pada sumur sekelilingnya. Gelas
obyek diletakkan di atas kertas saring basah agar terjaga kelembabannya. Reaksi
dibaca setelah 18 sampai 48 jam, reaksi positif ditunjukkan dengan adanya garis
prepisitasi pada daerah antigen tersebut.
Ekstraksi IgY dari Kuning Telur Ayam
Kuning telur dipisahkan dari bagian putih telur, dan dicuci dengan air
deionisasi. Kuning telur diletakkan di atas kertas saring untuk menghilangkan
putih telur yang melekat. Membran kuning telur dilubangi dengan cara diangkat
dengan pinset, cairan kuning telur ditampung pada gelas beaker dan dilarutkan
secara perlahan dalam milli-Q pH 4. Setelah homogen ditambahkan lagi milli-Q
pH 2 hingga pH suspensi 5.0 sampai 5.2 dan diinkubasi pada suhu 4 oC minimal
12 jam. Suspensi disenrifugasi dengan kecepatan 4 880 rpm pada suhu 4 oC
selama 20 menit dan supernatan diambil (Water Soluble Fractination) serta
WSF dipekatkan dengan PEG 6000 dan amonium sulfat. WSF ditambahkan
PEG 6000 sehingga kosentrasi akhir 12% (w/v). Suspensi disentrifugasi dengan
kecepatan 3 000 rpm selama 15 menit suhu 20oC. Pelet ditambahkan dengan
amonium sulfat 40% sebanyak 5 ml dan disentrifugasi dengan kecepatan
11 700 rpm selama 15 menit, dilakukan 3 kali. Pelet disuspensikan dengan PBS
sebanyak 1 ml, dan ditambahkan dua tetes 0.1% Na-azide. Suspensi didialisis
selama 24 jam dengan PBS pH 8.0 (Polson et al. 1980).
Pemurnian IgY dengan FPLC
Pemurnian dilakukan dengan fast protein liquid chromatography (FPLC)
menggunakan kolom Hi-trap IgY (Anonim 2006). Matriks dalam kolom dibilas
dengan buffer K2SO4 20 mM dalam larutan NaH2PO4 20 mM pH 7.5. IgY hasil
dialisis dimasukkan ke dalam kolom, bersamaan dengan buffer K2SO4 20 mM.
Matriks akan mengikat IgY dan protein-protein, selain IgY akan lolos protein lain
yang dapat dilihat dari kenaikan garis pada grafik. Protein-protein ini dibuang.
Selanjutnya dilakukan elusi IgY dari matriks dengan larutan NaH2PO4
20 mM pH 7.5. IgY yang terelusi akan terdeteksi oleh monitor absorban yang
ditandai dengan naiknya garis sampai terbentuk garis puncak. Larutan ini
ditampung dalam tabung reaksi, kemudian dipekatkan sampai kira-kira kembali
ke volume asal. Matriks dicuci dengan cleaning buffer (larutan 30% propanol
dalam NaH2PO4 20 mM pH 7.5).
Penentuan Konsentrasi Protein
Kosentrasi protein ditentukan dengan menggunakan metode Bradford (1976).
Absorbansi sampel ditentukan dengan pembacaan pada spektrofotometer UV pada Ȝ 280 nm. Konsentrasi sampel dihitung berdasarkan kurva larutan standard (Bovine Serum Albumin) yang telah dibuat.
Penentuan Berat Molekul Sampel dengan SDS-PAGE
Untuk mengetahui berat molekul dari IgY dilakukan dengan metode
(Laemmli 1970). SDS-PAGE dengan menggunakan sistem diskontinu, terdiri atas
gel pemisah konsentrasi 12% dan gel pengumpul 4%. Masing-masing dari sampel
IgY hasil FPLC (fraksi ke-3 dan fraksi ke-4) ditambah dengan buffer sampel
dengan perbandingan 1:1 dan ditangas dalam penangas air pada suhu 70 oC
selama 5 menit sebelum dimasukkan ke dalam sumur gel elektroforesis.
Marker dan sampel IgY sebanyak 10 µl dimasukkan dalam masing-masing
sumur, kemudian perangkat elektroforesis dijalankan dengan arus listrik 80 mA
dan 100 volt selama 180 menit. Elektroforesis dihentikan apabila pewarna sampel
telah mencapai 0.5 cm dari bagian atas bawah gel. Gel diangkat dari lempeng kaca
dan direndan dengan pewarna comassie brilliant blue (Sigma chemical co.)
selama 3 jam pada suhu ruang sambil diagitasi secara perlahan. Pewarna yang
tidak terikat pada protein dihilangkan dengan merendam gel pada larutan pemucat
methanol dan asam asetat hingga pita-pita protein pada gel terbentuk dengan jelas
(Svendsen et al. 1994).
Uji Biologis Ig Y Preparasi S. Enteritidis
Preparasi bakteri dilakukan menurut metode Estuningsih (1998) dengan
modifikasi. Preparasi bakteri digunakan untuk uji adhesi, anti adhesi dan
opsonisasi. Bakteri S. Enteritidis ditumbuhkan pada media BHI kemudian
diinkubasi pada suhu 37 oC selama 18 jam. Inokulum disentrifugasi pada
kecepatan 10 000 rpm selama 10 menit. Pelet diresuspensikan dengan 5 ml NaCl
fisiologis kemudian disentrifugasi pada 10 000 rpm 10 menit, dilakukan 2 kali.
Pelet dilarutkan dalam 5 ml NaCl fisiologis, dihomogenkan dengan vortek mixer,
diukur pada Ȝ 620 nm dengan transmisi 10% konsentrasi selnya untuk
menentukan kandungan bakteri 109 sel/ml. Suspensi diinaktifkan dalam penangas
air dengan suhu 56 oC selama 60 menit dan didinginkan.
Suspensi Sel
Sel epitel pipi yang digunakan berasal dari kerokan mukosa pipi manusia.
Kerokan mukosa pipi manusia tersebut diambil dengan menggunakan spatel yang
diambil dengan menggunakan pipet pasteur dan disentrifugasi dengan kecepatan
3 000 rpm selama 10 menit. Larutan sel epitel pipi dicuci dengan PBS sebanyak
2 kali dan dengan menggunakan haemasitometer dihitung jumlah sel epitel pipi
yang digunakan dalam penelitian sebanyak 106 sel/ml (Wibawan et al. 1999).
Uji adhesi
Uji adhesi dilakukan menurut metode Wibawan et al. (1999) dengan
modifikasi. Uji ini dilakukan sebagai kontrol uji hambat anti adhesi, dengan cara
membuat bahan percobaan yang terdiri dari sel epitel dan bakteri. Bahan
percobaan terdiri dari suspensi sel epitel pipi 0.5 x 106 sel/ml dan 0.5 x 108 sel/ml
bakteri . Bahan coba tersebut ditempatkan pada tabung mikro dan diinkubasikan
selama 1 jam suhu 37 oC. Suspensi disentrifugasi dengan kecepatan 1000 rpm
selama 10 menit. Preparat ulas difiksasi dengan methanol selama 15 menit,
diwarnai dengan Giemsa selama 60 menit, dan selanjutnya dilihat di bawah
mikroskop menggunakan perbesaran 1000x. Perhitungan dilakukan terhadap
20 sel pada setiap pengamatan.
Uji Hambat Adhesi
Uji hambat adhesi dilakukan dengan cara membuat bahan percobaaan
bakteri, yang terdiri dari campuran antibodi, sel epitel pipi dan bakteri
(Pruimboom et al. 1996). Dalam penelitian ini bahan percobaan bakteri terdiri dari
IgY (100 µg/ml), suspensi sel epitel pipi 0.5 x 106 sel/ml dan 0.5 x 108 sel/ml
bakteri . Bahan coba tersebut ditempatkan pada tabung mikro dan diinkubasikan
selama 1 jam suhu 37 OC. Suspensi disentrifugasi dengan kecepatan 1000 rpm
selama 10 menit. Preparat ulas difiksasi dengan metanol selama 15 menit,
diwarnai dengan Giemsa selama 60 menit, dan selanjutnya dilihat di bawah
mikroskop menggunakan perbesaran 1000x.
Preparasi Makrofag
Makrofag mengandung maksimal 50% limfosit disiapkan dengan mencuci
menggunakan makrofag yang berasal dari mencit putih (Mus musculus albinus)
strain Ddy, umur 5 sampai 6 minggu dengan berat rata-rata 20 sampai 30 gram per
ekor dengan jenis kelamin jantan yang berasal dari PT. Biofarma Bandung.
Makrofag didapat dengan cara menyuntikkan cairan PBS dan IgY pada bagian
perut mencit. Satu jam kemudian dilakukan pembedahan pada perut, sebelum
dibedah terlebih dahulu dilakukan pemijatan pada perut mencit. Setelah
pembedahan cairan peritonium dipanen dan dihitung dengan haemasitometer
jumlah makrofag sebanyak 105 sel/ml yang digunakan dalam bahan coba
fagositosis.
Uji Aktifitas IgY Sebagai Opsonin
Untuk mengetahui IgY sebagai opsonin ditunjukkan dalam uji fagositosis.
Assay fagositosis dilakukan menurut metode Wibawan et al. (1999) dengan
modifikasi. Bahan coba fagositosis dibuat dengan cara menambahkan IgY
(100 µg/ml), suspensi makrofag 0.5 x 106 sel/ml dan 0.5 x 108 sel/ml bakteri
ditempatkan pada tabung mikro, diinkubasi selama 1 jam suhu 37 oC. Suspensi
disentrifugasi dengan kecepatan 1000 rpm selama 10 menit dan pelet dibuat
preparat ulas. Preparat ulas difiksasi dengan metanol selama 15 menit, diwarnai
dengan Giemsa selama 60 menit, lalu dilihat di bawah mikroskop dengan
perbesaran 1000x.
Penentuan Nilai Aktifitas dan Kapasistas Fagositosis a. Nilai Aktifitas Fagositosis
Nilai aktifitas fagositosis ditetapkan menurut jumlah sel makrofag yang
secara aktif melakukan proses fagositosis dalam 100 sel dibandingkan dengan
banyaknya makrofag, dinyatakan dalam persen.
Aktifitas makrofag = Jumlah makrofag aktif X 100%
Jumlah makrofag total
b. Nilai Kapasitas Fagositosis
Nilai kapasitas fagositosis ditetapkan menurut jumlah bakteri S. Enteritidis
ditambah IgY dan S. Enteritidis tanpa IgY yang dimakan oleh 50 sel PMN yang
HASIL DAN PEMBAHASAN
Produksi IgY Anti Salmonella Enteritidis pada Telur Ayam
Antibodi spesifik terhadap S. Enteritidis pada serum ayam dan telur
dideteksi dengan menggunakan uji agar gel presipitasi (AGP). Keberadaan
antibodi spesifik terhadap S. Enteritidis ditandai dengan pembentukan garis
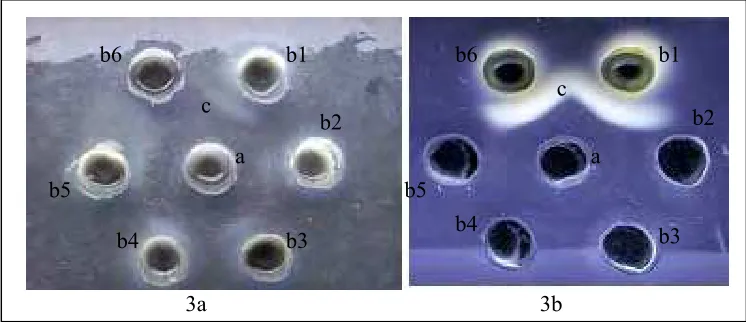
presipitasi pada agar gel (Gambar 3).
Gambar 3 Hasil uji agar gel presipitasi IgY anti S. Enteritidis.
3a : Serum, 3b : Kuning telur. a : Antigen, b1-b6 : Antibodi c : Garis prepitasi.
Antibodi mulai terdeteksi minggu kelima dan tidak terdeteksi lagi pada
minggu keenam setelah imunisasi pertama (Tabel 2). Setelah dilakukan
pengulangan imunisasi (booster), satu minggu kemudian IgY di dalam serum
terdeteksi lagi. Sedangkan IgY di dalam telur mulai terdeteksi dua minggu setelah
booster. IgY di dalam serum dan telur masih terdeteksi sampai minggu kedua
belas setelah imunisasi pertama.
Injeksi dosis pertama akan menghasilkan antibodi spesifik yang muncul di
dalam serum, pemaparan pertama ini membangkitkan respon primer. Injeksi
dengan sel-sel bakteri akan memunculkan reaksi antibodi sepuluh sampai empat
belas hari pasca injeksi (Bellanti 1993). Beberapa faktor yang berpengaruh
terhadap terbentuknya antibodi adalah imugenesitas, kualitas, bentuk dan
3a 3b a
b1
b2
b3 b4
b5 b6
c
a c
b1
b2
b3 b4
kelarutan stimulan, species hewan yang diinjeksi, rute imunisasi dan sensifitas
assay. Titer antibodi tertinggi terhadap toksoid bakteri gram positif bertahan
selama dua sampai tiga bulan.
Aplikasi imunisasi secara intravena diharapkan dapat segera memicu
pembentukan antibodi di dalam darah. Pengulangan imunisasi plus adjuvant
secara intramuscular pada mingggu kedua, ketiga dan keempat diharapkan dapat
merangsang pembentukan antibodi dalam jumlah yang banyak dan secara
konsisten tetap terbentuk. Adjuvant berfungsi sebagai molekul protein pembawa
antigen untuk membentuk komplek lebih besar sehingga menjadi lebih imugenik.
Adjuvant juga memperlambat pelepasan dan degradasi antigen (efek depot)
sehingga memberikan waktu yang cukup sistem imun untuk merespon antigen.
Penggunaan adjuvant juga merangsang makrofag melalui aktivasi dan
meningkatkan proses fagositosis dengan cara mempengaruhi limfosit melepaskan
monokin ( Behn et al. 1996).
Tabel 2 Hasil uji AGP IgY pada serum dan telur ayam
Minggu Serum Telur
1 2 3 4 1 2 3 4
I* - - - - td td td td II* - - - - td td td td III* - - - - td td td td IV* - - - - td td td td V - + + + td td td td VI + - - - td td td td VII** + + + - - - - - VIII + + + + - - - - IX + + + + + + + + X + + + + + + + + XI + + + + + + + + XII + + + + + + + + Keterangan :
* : waktu imunisasi, ** : imunisasi ulang, td : tidak dilakukan koleksi telur
Ekstraksi, Purifikasi dan Karakterisasi IgY dari Kuning Telur
IgY anti S. Enteritidis dikoleksi dari kuning telur ayam yang menunjukkan
reaksi positif pada uji AGP. Ekstraksi dari kuning telur bertujuan untuk
memisahkan protein dari lemak telur. Metode ekstraksi yang dipilih adalah
pemisahan kuning telur dengan menggunakan Poly Ethylene Glycol-Amonium
sulfat (Polson et al. 1980). PEG digunakan untuk memisahkan lemak,
mempresipitasi dan mengendapkan IgY agar tidak mempengaruhi tahap
pemurnian berikutnya, misalnya dengan kromatografi penukar ion atau
kromatografi afinitas (Harris dalam Mustopa 2004). Amonium sulfat sering
digunakan untuk memisahkan protein dalam larutan. Protein dalam larutan akan
membentuk ikatan hidrogen dengan air, ketika amonium sulfat ditambahkan ke
dalam larutan tersebut, maka amonium sulfat akan menjadi kompetitor untuk
berikatan dengan air. Hal ini menyebabkan rendahnya molekul air dari protein,
menurunnya daya larut dan menyebabkan presipitasi protein (Harlow &
Lane 1998).
Garam yang berlebih di dalam larutan ekstrak IgY dapat dihilangkan dengan
cara dialisis. Dialisis IgY ditempatkan ke dalam kantung plastik (membran)
semipermiabel yang direndam dalam larutan PBS pH 8 selama 24 jam pada suhu
4 oC. Molekul yang berukuran kecil akan keluar melalui membran dan molekul
yang berukuran besar akan tertahan di membran dialisis. Selanjutnya, hasil
ekstraksi IgY dipurifikasi secara kromatografi dengan teknik fase purification
liquid chromatografi (FPLC) menggunakan AKTATMexplorer 10S dengan kolom
Hi Trap TM IgY Purification (Amersham pharmacia biotech) (Anonim 2006).
Fraksi yang ditampung dan digunakan untuk uji selanjutnya adalah fraksi dengan
puncak tertinggi yaitu fraksi ke-3, ke-4 dan ke-5 (Gambar 4). Hasil purifikasi IgY
dipekatkan dengan PEG 6000, kemudian didialisis dalam larutan PBS pH 8
selama 24 jam dengan tujuan menarik sisa-sisa garam yang mungkin tersisa.
Setelah itu IgY diidentifikasi kandungan proteinnya menggunakan
spektrofotometer UV dengan metode Bradford dan diperoleh hasilnya yaitu
fraksi ke-3 sebesar 6.9 mg/ml, fraksi ke-4 sebesar 6.58 mg/ml dan fraksi ke-5
sebesar 5.01 mg/ml. Zhang (2003) menyatakan bahwa, dalam sebutir telur ayam
dalam penelitian ECVAM, bahwa jumlah antibodi unggas dalam sebutir telur
yaitu 50 sampai 100 mg/ml. Mustopa (2004), menyatakan bahwa konsentrasi IgY
tertinggi dari Escherichia coli Enteropatogenik (EPEC) K1.1 yang dipurifikasi
menggunakan teknik kromatografi pertukaran ion DEAE-Sephacel adalah sebesar
8.1 mg/ml. Perbedaan jumlah IgY yang dihasilkan dipengaruhi oleh metode
ekstraksi yang digunakan.
Gambar 4 Kromatografi hasil FPLC IgY anti
S. Enteritidis.Untuk meyakinkan fraksi tersebut merupakan protein (IgY) yang diharapkan,
dilanjutkan pengujian SDS-PAGE untuk menentukan berat molekul dari protein.
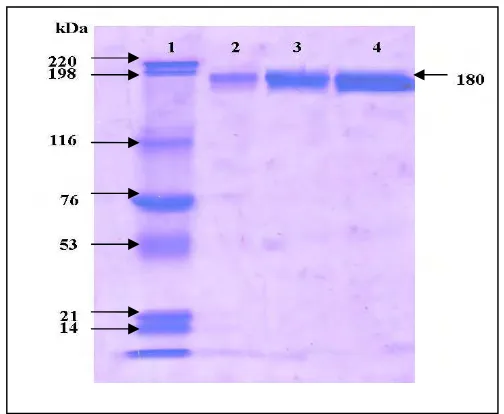
Profil pita IgY hasil pemurnian menggunakan kromatografi (FPLC) yang
dianalisis menggunakan SDS-PAGE dengan pewarnaan comassie blue disajikan
pada Gambar 5. Metode SDS-PAGE digunakan untuk mendeteksi keberadaan
protein dari larutan hasil purifikasi berdasarkan atas ukuran dari protein. SDS
adalah detergen anionik yang mampu bereaksi dengan bagian hidrofobik dari
protein . Dengan pemanasan maka seluruh bagian polipeptida akan terselimuti
sehingga menjadi tidak bermuatan (Hames & Rickwood dalam Suartha 2006).
Profil pita protein setelah pemurnian pada sumur ke-2 dan ke-3 (fraksi ke-3 dan
fraksi ke-4 dari hasil FPLC) menunjukkan adanya pita protein dengan berat
lain menandakan tidak adanya cemaran protein lain. Hal ini menunjukkan
purifikasi dengan metode FPLC mendapatkan sampel protein (IgY) murni.
Verdoliva et al. (2000) menyatakan bahwa, kemurnian IgY dengan metode
FPLC lebih tinggi dibandingkan dengan metode dialisis karena protein dipisahkan
dengan spesifik berdasarkan ukuran protein, hidrofobisitas, afinitas dan muatan
listrik. Beberapa peneliti juga melaporkan berat molekul dari IgY berkisar antara
160 kDa sampai 180 kDa (Zhang 2003), kadang-kadang pada SDS-PAGE
didapatkan dua pita protein dengan berat molekul 70 kDa untuk rantai berat dan
21 kDa untuk rantai ringan (Hatta dalam Suartha 2006).
[image:31.612.197.449.278.485.2]Gambar 5 Hasil SDS-PAGE IgY anti S. Enteritidis setelah pemurnian FPLC. 1: Marker umum (Bio-Rad), 2 : Marker IgY (Promega),
3-4 : hasil FPLC.
Aktifitas Biologis IgY sebagai Anti adhesi
Uji hambat adhesi menggunakan dosis IgY anti S. Enteritidis 100 µg/ml
yang diinkubasikan pada sel epitel pipi (0.5 x 106 sel/ml), kemudian diinfeksikan
dengan bakteri utuh S. Enteritidis (0.5 x 108 sel/ml). Sementara sebagai kontrol
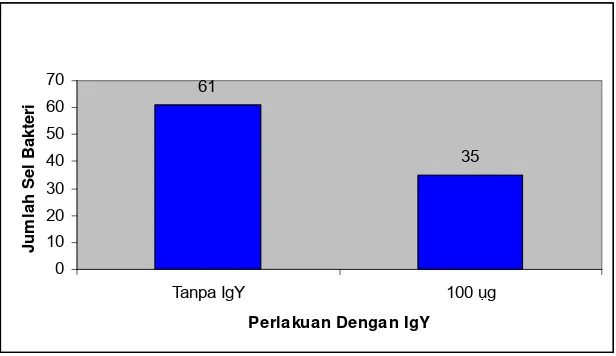
dilakukan uji adhesi (tanpa menggunakan IgY). Nilai adhesi kontrol adalah 61 sel
pipi (Gambar 6). Ini berarti IgY anti S. Enteritidis mempunyai kemampuan untuk
menghambat perlekatan bakteri S. Enteritidis pada sel epitel pipi. Proses infeksi
bakteri selalu diawali dengan proses adhesi. Adhesi merupakan tahap inisiasi dari
proses kolonisasi. Ada tiga faktor yang mendukung perlekatan bakteri terhadap sel
inang yaitu tropisme sel, spesifitas species dan spesifitas genetika. Disamping itu
ada faktor non spesifik seperti ikatan kimia yang terbentuk antara komponen
permukaan bakteri dan sel inang yang spontan secara termodinamika
mempengaruhi proses perlekatan tersebut (Beachey dalam Mustopa 2004).
Nilai Adhesi Anti S.Enteritidis
61 35 0 10 20 30 40 50 60 70
Tanpa IgY 100 ụg
Perlakuan Dengan IgY
[image:32.612.161.469.257.435.2]J u m lah S e l B a kt er i
Gambar 6 Nilai adhesi IgY anti S. Enteritidis.
Pada penelitian ini menunjukkan bahwa adanya adhesi S. Enteritidis pada
permukaan sel epitel pipi dan bisa dilihat pada Gambar 7. Hasil penelitian ini
menunjukkan bahwa, IgY mampu berikatan dengan antigen yang terdapat pada
permukaan bakteri S. Enteritidis dan menyebabkan penurunan kemampuan
adhesif bakteri tersebut ke permukaan sel epitel pipi. Burges dalam Mustopa
(2004) menyatakan bahwa, immunoassay antibodi monoklonal lebih spesifik
karena antibodi monoklonal biasanya diarahkan pada satu epitop dari antigen
target. Antibodi terhadap toksin (antitoksin) bekerja dengan cara memblok bagian
aktif toksin sehingga kemampuannya dalam menginfeksi sel-sel inang menjadi
lemah. Hasil penelitian ini menunjukkan adanya peluang tentang penggunaan IgY
Gambar 7 Adhesi dan anti adhesi S. Enteritidis pada sel epitel pipi menggunakan pewarnaan Giemsa dengan mikroskop 1000x.
a : adhesi , b : anti adhesi S. Enteritidis.
Fagositosis dan Peran IgY sebagai Opsonin
Preinkubasi bakteri S. Enteritidis dengan IgY selama 60 menit menyebabkan
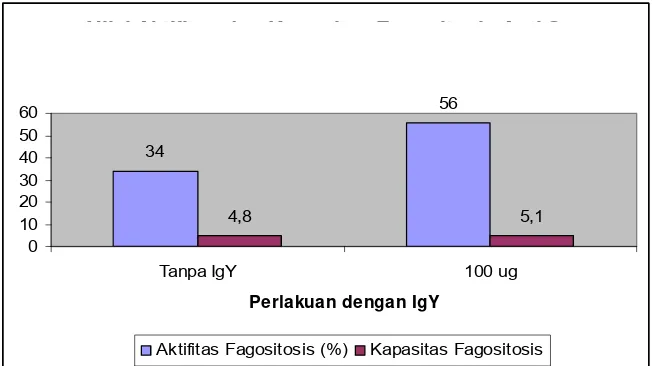
kapasitas fagositosis meningkat secara nyata. Dalam penelitian ini, perlakuan
tanpa pemberian IgY diperoleh nilai aktifitas makrofag sebesar 34% dan kapasitas
fagositosis sebesar 4.8 sel bakteri per sel epitel pipi. Sementara perlakuan dengan
pemberian IgY diperoleh nilai aktifitas makrofag sebesar 56% dan kapasitas
fagositosis sebesar 5.1 sel bakteri per sel epitel pipi (Gambar 8).
Nilai Aktifitas dan Kapasitas Fagositosis Anti S. Enteritidis
34
56
4,8 5,1
0 10 20 30 40 50 60
Tanpa IgY 100 ug
Perlakuan dengan IgY
Aktifitas Fagositosis (%) Kapasitas Fagositosis
Gambar 8 Nilai aktifitas dan kapasitas fagositosis anti S. Enteritidis.
[image:33.612.160.486.495.678.2]Proses fagositosis secara garis besar dibagi dalam dua tahap, yaitu fase
perlekatan dan fase ingesti. Selama fase perlekatan, terjadi sentuhan kuat oleh
partikel dan fagositosis melalui proses tanpa dorongan. Fase ingesti merupakan
proses penelanan partikel dan kemudian partikel dimasukkan ke dalam sitoplasma
yang terinvaginasi (Kuby 1997). Adanya proses fagositosis S. Enteritidis oleh sel
makrofag dapat dilihat pada Gambar 9.
Bila kepada bakteri tersebut diberikan antibodi spesifik terhadap kapsulnya
yang tersusun oleh polisakarida, maka bakteri tersebut akan diselimuti sehingga
dapat mempermudah fagositosis oleh sel fagosit (Kuby 1997). Semua jenis
antibodi atau faktor-faktor serum lain, yang mampu membuat setiap selubung
mikroorganisme maupun partikel sehingga lebih sensitif untuk difagositosis,
dinamakan opsonin. Dan prosesnya dinamakan opsonisasi. Opsonisasi
menyebabkan bakteri lebih dikenal oleh makrofag sehingga aktifitas fagositosis
lebih besar.
Gambar 9 Respon fagositosis sel makrofag peritonium terhadap bakteri S. Enteritidis didalam sitoplasma sel fagosit terhadap banyak bakteri menggunakan pewarnaan Giemsa dengan mikroskop 1000x. a : tanpa IgY (kontrol) b : dengan penambahan IgY
SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian dapat disimpulkan sebagai berikut :
1. Adhesi S. Enteritidis pada permukaan sel epitel pipi bersifat spesifik dan
IgY anti S. Enteritidis dapat menghambat perlekatan S. Enteritidis pada sel
epitel pipi (IgY anti S. Enteritidis dapat berfungsi sebagai anti adhesi).
2. IgY anti S. Enteritidis dapat berfungsi sebagai opsonin dan inkubasi
S. Enteritidis dengan IgY meningkatkan nilai kapasitas fagositosis.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai pembuatan sediaan
DAFTAR PUSTAKA
Adesiyun A, Carson A, McAdo K, Bailey C. 2000. Molecular analysis of
Salmonella Enteritidis isolates from the Carribean by pulsed field gel electhrophoresis. Pan Am. J Public Health 8(50): 342-347.
Ahmed R, Soule G, Demezuk WH, Clack C, Khakhtia R, Ratman S, Marshall S, Ng. Lai-King, Woodward DL, Johnsons WM, Rodgers. 2000. Epidemiologic typing of Salmonella enterica serotype Enteritidis in a Canada wide outbreak of gastroenteritis due to contaminated cheese.
J CLin Microbiol 38(6): 2403-2406.
[Anonim]. 2006. Fast protein liquid chromatography (FPLC). http://www.en.wikipedia/wiki/FPLC-12.catched. [24 Juli 2006].
[Anonim]. 2007a. Diare. http://www.dinkes-dki.go.id [5 Februari 2007].
[Anonim]. 2007b. Basic immunology for ICU3.
http://www.bmb.leds.ac.uk/…/immunol/index.htm [5 Februari 2007].
Behn I, Hommel U, Oertel M, Hauschild S. 1996. Kinetic of IgY formation after immnunisation of hens with differents protein antigen . Altex 13: 18-21.
Bellanti JA. 1993. Imunologi III. Waholo AS Penerjemah; Soeripto N editor. Gajah Mada University Press. Terjemahan dari : Imunology III.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantitites of protein utilizing the principle of protein dye binding. Anal Biochem 72: 248-254.
Carlender D. 2002. Avian IgY antibodi : in vivo and in vitro. Uppsala. Acta Universitatis Upsaliensis.
[CCDR] Canada Communicable Diseases Report. 1997. Salmonella Enteritidis Phage 4 in Ontario. 23(1).
Chang YB. 2000. Prevalence of Salmonella spp. In poultry broiler and shell egg in Korea.J Food Prot 63(5): 655-658.
Clark M. 2007. About Salmonella. [terhubung berkala]. http://www.about-salmonella.com. [1Februari 2007]
Craven SE, Williams DS. 1997. Inhibition of Salmonella typhimurium attachment to chicken cecal mucus by intestinal isolates of Enterobacteriaceae and Lactobacilli. Avian Dis 4: 548-558
Davalos PL, Ortego VJL, Bastos GD, Hodalgo AR. 2000. Collodial stability of IgY coated latex microspheres. Colloids and surfaces B. Biointerfaces. 20 (2): 165-175.
Doyle, Rosenberg. 1990. Microbial cell surface hidrophobicity. Am.
Soc Microbiol Pp 1-37.
Estuningsih S. 1998. Isolasi dan karekterisasi reseptor hemaglutinin Streptococcus agalaticiae pada permukaan sel epitel ambing sapi perah sebagai landasan pencegahan mastitis. [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Gast RK, Holt PS. 2000. Deposition of phages type 4 and 13a Salmonella
Enteritidis strains in yolk and albumen of eggs laid by experimentally infected hens. Avian Dis 44: 706-710.
Gast RK. 2003. Salmonella infection. In disease of poultry. Ed ke-10. B. To Calnek. Pp 81-82.
Haak FM. 1994. Why IgY? Chicken policlonal antibody, an appealing alternative. Promega noes magazine.
Hang’ombe BM, Sharma RN, Skjerve E, Tuchili LM. 1999. Occurance of
Salmonella Enteritidis in pooled table eggs and market ready chicken carcasses in Zambia.Avian Dis 43: 597-599.
Harianto. 2004. Penyuluhan penggunaan oralit untuk menanggulangi diare di masyarakat.Majalah Ilmu Kefarmasian 1 (1): 27–33. Departemen Farmasi, FMIPA Universitas Indonesia. [terhubung berkala].
http://jurnal.farmasi.ui.ac.id/pdf/2004/v01n01/Harianto010104.pdf. [5 Februari 2007].
Harloe ED, Lane D. 1998. Antibodies : a laboratory manual. Cold spring Harbor laboratory. USA.
Hudson L, Hay FC. 1989. Practical immunology. Ed ke-3. Boston, Melbourne : Blackwell science publications. Oxford London. Edinburgh.
Humprey T. 1998. Important and relevant attributs of Salmonella organism proceeding of international symposium on food borne Salmonella in poultry. Baltimore, Maryland. p: 44-55.
Kuby J. 1997. Imunology. Ed ke-3. New York W.H. Freeman and Company.
Kusumaningsih A. 2007. Profil dan gen resistensi antimikroba Salmonella
Enteritidis asal ayam, telur dan manusia. [Disertasi]. Bogor : Sekolah Pascasarjana, Institut Pertanian Bogor.
Laemmli U. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227: 680–685.
Larson A, Sjoquist J. 1998. Chicken antibodies : a tool to avoid false positive result by rheumatoid factor in latex fixation test. J Immunol Method
p: 108.
Lay BW, S Hastowo. 1992. Mikrobiologi. Jakarta. Rajawali Press.
Lay BW. 2000. Bahan ajar ilmu penyakit unggas. Fakultas Kedokteran Hewan. Institut Pertanian Bogor.
Macario AJL, Macario EC EC. 1985. Monoclonal antibodies againts bacteria.. Academic Press. New York.
Mims CA. 1982. The Pathogenesis of infectious disease. Academic Press London.
Mustopa AZ. 2004. Peran imunoglobulin Y (IgY) sebagai anti adhesi dan opsonin untuk pencegahan serangan Escherichia coli Enteropatogenik (EPEC) K 1.1. [Tesis]. Bogor : Sekolah Pascasarjana, Institut Pertanian Bogor.
Narat M. 2003. Production of antibodies in chicken. Food Technol Biotechnol
41 (3): 259-267.
Pascual MM, Hugas JL, Baidola, Monfort JM, Gariga M. 1999. Lactobacilus salivartius CTC2197 Prevents Salmonella Enteritidis colonization in chickens. App Environ Microb 65(11): 4981-4986
Polson A, Von WM, Van RM. 1980. Isolation of viral IgY antibodies from yolks of immunized hens. ImmunolCommun 9 (5): 475-493.
Pruimboom IM, Rimler RB, Ackerman MR, Brogden KA. 1996. Capsular hyaluronic acid mediated adhesion of Pasteurella mulcotida to Turkey airsac macrophages. Avian Disease 40: 887-893.
Poernomo S, Bahri. 1997. Salmonella serotyping conducting at Bogor Research.
Rawendra R. 2005. Prospek pengembangan imunoglobulin Yolk (IgY) kering beku sebagai Nutraceutical Food anti Enterophatogenic Eschericia coli
Riemann H, Himathongkha S, Wiiooughby D, Tarbell R, Breitmeyer R. 1998. A survey for Salmonella by drag swabbing manure piles in Californian egg ranches. Avian Dis 42: 67-72.
Roitt IM, Delvas PJ. 2001. Roitt’s essensial imumunology. London : Balcwell Science.
Rodrique DC, Tauxe RV, Rowe B. 1990. International increase in Salmonella enteritidis: a new pandemic? Epidemiol Infect 105: 21-27.
Saeed AM. 1999. Salmonella enterica serovar Enteritidis in human and animal, epidemiology, pathogenesis and control. Iowa State University Press. Iowa USA.
Schade R, Stack C, Hendriksen C, Erhard M, Hugl H, Koch G, Larsson A, Polmann W, Rogenmortel M Van, Erijke, Spielmann H, Steinbusch H, Straughan D. 1996. The Production of Avian (Egg Yolk) antibodies. IgY
Alternatives to Lboratorium Animal. 24: 925-934.
Schwartz, Lazar M. 1980. Compendium of immunology. New York. Van Nostrand Reihold Company.
Soejoedono RD, Hayati Z, Wibawan IWT. 2005. Pemanfaatan telur ayam sebagai pabrik biologis : produksi Yolk Imunoglobulin (IgY) anti plaque dan diare dengan titik berat pada anti Streptococcus mutan, Escherichia coli dan Salmonella Enteritidis. Laporan RUT XII Kerjasama Lembaga Penelitian dan Pengabdian Masyarakat IPB dengan Kementrian Riset dan Teknologi RI.
Soejoedono RD, Hayati Z, Wibawan IWT. 2006. Pemanfaatan telur ayam sebagai pabrik biologis : produksi Yolk Imunoglobulin (IgY) anti plaque dan diare dengan titik berat pada anti Streptococcus mutan, Escherichia coli dan Salmonella Enteritidis. Laporan RUT XII Kerjasama Lembaga Penelitian dan Pengabdian Masyarakat IPB dengan Kementrian Riset dan Teknologi RI.
Suartha IN. 2006. Karakteristik imunoglobulin Y antitetanus diisolasi dari telur ayam sebagi pengganti antitetanus serum kuda. [Disertasi]. Bogor : Sekolah Pascasarjana, Institut Pertanian Bogor.
Su LH, C. Chiu, T. Wu, J. Chia, A. Kuo, C. Lee, C. Sun, J. Ou. 2002. Molecular epidemiology of Salmonella Enteritidis isolated in Taiwan.
Microbiol Immunol 46(12): 833-840.
Svendsen BL, Hau J. 1996. Chickens eggs in polyclonal antibody production. Scand J. Lab. Anim Sci 23 (1): 85-91.
Verdoliva A, Basile G, Farnssina G. 2000. Affinity purification of immunoglobulin from chicken egg yolk using a new synthetic ligand. Biopharmaceutich Italy. http://www.ncbi.nlm.nih.gov/query.fcgi?CMD . [ 2 Februari 2007].
Warr GW, Magor KE, Higgins. 1995. IgY : Clues to the prigins of modern antibodies. Imunology today 16 (8) : 392-398.
Wibawan IWT, Laemmler Ch. 1992. Relationship between group B Streptococcal serotypes and cell surface hidrophobicity. J Vet Med 39: 376-382.
Wibawan IWT, Pasaribu FH. 1993. Peluang pengembangan test koaglutinasi untuk deteksi serotipe Streptococcus agalactiae. Agrotek 1 (2): 43-47.
Wibawan IWT, Pasaribu FH, Utama IH, Abdul Mawjood A, Laemmler Ch. 1999. The role hyaluronic acid capsular material of Streptococcus equi subsp. zooepidemicus in mediating adherence to hela cells and in resisting phagocytosis. Res Vet Sci 67: 131-135.
Zhang W. 2003. The use of gene spesific IgY antibodies for drag target discovery.