BIOSORPSI LOGAM Pb(II) DAN Ni(II) OLEH BIOMASSA
PERIFITON PADA PERAIRAN LOTIK
FAJAR SUMI LESTARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FAJAR SUMI LESTARI. Biosorpsi Logam Pb(II) dan Ni(II) oleh Biomassa
Perifiton pada Perairan Lotik. Dibimbing oleh TETTY KEMALA dan EVI
SUSANTI.
Biosorpsi adalah metode yang efektif untuk menghilangkan ion logam berat
dari air limbah. Penelitian ini memanfaatkan perifiton sebagai biosorben Pb(II)
dan Ni(II) dari larutan tunggal serta mempelajari pengaruh waktu, bobot
biosorben, dan konsentrasi logam berat pada kapasitas dan efisiensi biosorpsi
logam berat Pb(II) dan Ni(II). Setelah 24 jam proses adsorpsi, konsentrasi Pb(II)
yang tersisa dalam air 0.05 mg/L dan Ni(II) 0.03 mg/L. Kapasitas biosorpsi
maksimum perifiton terhadap logam Pb ialah 1.97 mg/g dan terhadap logam Ni
ialah 1.92 mg/g. Kinetika biosorpsi Pb(II) dan Ni(II) mengikuti persamaan orde
kedua semu dengan nilai
k
2=
4.5
×
10
-3g.mg
-1.menit
-1untuk logam Pb dan
22.6
×
10
-3g.mg
-1.menit
-1untuk logam Ni dengan koefisien determinasi (
R
2)
masing-masing 0.97. Spektrum inframerah biomassa perifiton sebelum dan
sesudah adsorpsi logam Pb dan Ni memperlihatkan kemiripan gugus fungsi
dengan
Spirogyra
. Penelitian ini menunjukkan bahwa perifiton berpotensi sebagai
biosorben untuk mengadsorpsi logam Pb dan Ni.
Kata kunci: biosorpsi, perifiton, Pb(II), Ni(II)
ABSTRACT
FAJAR SUMI LESTARI. Biosorption of Pb(II) and Ni(II) Metals by Periphyton
Biomass at Lotic Water. Supervised by TETTY KEMALA and EVI SUSANTI.
BIOSORPSI LOGAM Pb(II) DAN Ni(II) OLEH BIOMASSA
PERIFITON PADA PERAIRAN LOTIK
FAJAR SUMI LESTARI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
Skripsi
: Biosorpsi Logam Pb(II) dan Ni(II) oleh Biomassa Perifiton pada
Perairan Lotik
Nama
: Fajar Sumi Lestari
NIM
: G44086004
Disetujui
Pembimbing
I,Pembimbing
II,Judul Skripsi
: Biosorpsi Logam Pb(II) dan Ni(II) oleh Biomassa Perifiton pada
Perairan Lotik
Nama
: Fajar Sumi Lestari
NIM
: G44086004
Disetujui
Pembimbing I,
Pembimbing II,
Dr Tetty Kemala, SSi, MSi
Evi Susanti, MT
NIP 197104071999032001
NIP 197507312006042001
Diketahui
Ketua Departemen,
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 195012271976032002
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat
dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Shalawat
beriring salam tercurahkan kepada Nabi Besar Muhammad SAW beserta
keluarganya, semoga kita semua menjadi pengikut-Nya hingga akhir zaman.
Skripsi ini disusun berdasarkan penelitian yang dilaksanakan dari bulan Juli 2011
hingga Januari 2012 di Laboratorium Pengendalian Pencemaran, Puslit Limnologi
LIPI, Cibinong.
Penulis mengucapkan terima kasih kepada Ibu Dr Tetty Kemala, MSi dan
Ibu Evi Susanti, MT selaku pembimbing yang telah memberi banyak arahan,
inspirasi, dorongan, kritik, dan saran selama penulis melaksanakan penelitian ini.
Penulis mengucapkan terima kasih kepada Ayahanda dan Ibunda serta Adik-adik
tercinta yang telah memberi banyak kasih sayang, semangat, dan doa selama
penulis menempuh studi, penelitian, dan penulisan skripsi ini.
Penulis juga mengucapkan terimakasih kepada Puslit Limnologi LIPI, Ibu Ir
Fachmijany Sulawesty, teman-teman Labers atas segala bantuannya selama
penelitian. Ucapan terima kasih juga penulis berikan kepada Martha, Taufik
Akbar, Richa, Gusur dan teman-teman Ekstensi Kimia angkatan 2008 yang turut
membantu memberikan semangat dan dukungannya dalam penyusunan skripsi ini.
Semoga skripsi ini bermanfaat.
Bogor, April 2013
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
BAHAN DAN METODE
Bahan dan Alat ... 1
Metode Penelitian ... 1
Pembuatan Sistem Kanal ... 2
Pembuatan Larutan Tunggal Ion Logam ... 2
Biosorpsi Ion Logam Oleh Perifiton ... 2
Kinetika Biosorpsi ... 2
Analisis Struktur ... 2
HASIL DAN PEMBAHASAN
Kolonisasi Perifiton ... 3
Biosorpsi Ion Logam Oleh Perifiton ... 4
Kinetika Biosorpsi ... 5
Analisis FTIR ... 6
SIMPULAN DAN SARAN
Simpulan ... 7
Saran... 7
DAFTAR PUSTAKA ... 7
DAFTAR TABEL
Halaman
1 Kinetika reaksi pada adsorpsi logam Pb dan Ni oleh perifiton ... 6
2 Perbandingan spektrum IR perifiton sebelum dan sesudah adsorpsi Pb(II) dan
Ni(II) dengan
Spirogyra
... 7
DAFTAR GAMBAR
Halaman
1 Sistem kanal perifiton ... 1
2 Substrat batuan kali yang digunakan untuk penumbuhan perifiton. ... 3
3 Koloni perifiton pada sistem kanal ... 3
4 Penurunan konsentrasi logam Pb dan Ni di air selama 24 jam proses adsorpsi . 4
5 Kenaikan konsentrasi logam Pb dan Ni pada biomassa perifiton, selama 24 jam
proses adsorpsi... 4
6 Kapasitas dan efisiensi biosorpsi logam Pb dan Ni. ... 5
7 Model kinetika orde pertama semu dari adsorpsi logam Pb dan Ni pada
biomassa perifiton. ... 5
8 Model kinetika orde kedua semu dari adsorpsi logam Pb dan Ni pada biomassa
perifiton ... 5
9 Spektrum FTIR
Spirogyra
(a); perifiton sebelum adsorpsi (b); sesudah adsorpsi
logam Pb(II) (c); perifiton sesudah adsorpsi logam Ni(II) (d) ... 6
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 10
2 Model kanal perifiton yang digunakan pada percobaan ... 10
3 Data konsentrasi logam Pb(II) dalam air dan perifiton ... 11
4 Data konsentrasi logam Ni(II) dalam air dan perifiton ... 11
5 Kinetika laju penyerapan logam Pb(II) ... 12
6 Kinetika laju penyerapan logam Ni(II) ... 12
7 Nilai kapasitas dan efisiensi biosorpsi logam Pb(II) ... 13
1
PENDAHULUAN
Keberadaan logam berat di lingkungan yang berasal dari limbah industri sangat membahayakan kehidupan perairan dan kesehatan manusia, jika konsentrasinya melewati batas yang diperbolehkan. Beberapa usaha dilakukan untuk mengatasi pencemaran logam berat ini, di antaranya dengan metode fisika-kimia seperti presipitasi kimia, osmosis balik, pertukaran ion, dan bioreduksi (Cabuk
et al. 2005), tetapi sering kali hasilnya kurang memuaskan karena efisiensi dan kapasitas adsorpsinya kecil, biayanya pun relatif mahal. Metode seperti biosorpsi atau bioakumulasi menjadi metode alternatif untuk mengatasi pencemaran logam berat. Biosorpsi terbukti cukup efektif memindahkan ion logam dari larutan yang tercemari dengan biaya rendah dan ramah lingkungan (Volesky 1990). Salah satu biomassa yang dapat digunakan adalah perifiton.
Perifiton merupakan organisme yang tumbuh atau menempel pada substrat, tetapi tidak melakukan penetrasi ke dalam substrat tersebut (Weitzel 1979). Secara alami, perifiton bersifat tetap dan menempel pada akar tumbuhan, bebatuan, kayu, dan benda-benda dalam air lainnya, sehingga cenderung lebih banyak menerima polutan dari area tersebut dibandingkan dengan hidrobiota yang lain. Perifiton merupakan sumber makanan penting bagi invertebrata dan beberapa ikan, dan dapat menjadi akumulator penting dari logam berat (Newman & McIntosh 1989).
Perifiton di perairan lotik (mengalir) terdiri atas diatom (Bacillariophyceae), alga biru berfilamen (Myxophyceae), alga hijau berfilamen (Chlorophyceae), bakteri atau jamur berfilamen, protozoa, dan rotifera (tidak banyak pada perairan tidak tercemar), serta beberapa jenis serangga (Welch 1952). Penelitian ini bertujuan memanfaatkan perifiton tipe Epilhitic (perifiton yang menempel pada batu) sebagai biosorben Pb(II) dan Ni(II) dari larutan tunggal. Pengaruh waktu, bobot biosorben, dan konsentrasi logam berat pada kapasitas dan efisiensi biosorpsi dipelajari dan biosorben juga dianalisis.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah perifiton, HNO3 65%, larutan standar Pb 1000
mg/L, larutan standar Ni 1000 mg/L, larutan NPK 2 mg/L, dan air deionisasi. Alat yang digunakan antara lain spektrofotometer serapan atom (AAS) Hitachi Z2000, spektrofotometer inframerah transformasi Fourier (FTIR) Shimadzu IRPrestige-21, mikroskop Nikon Diaphot 300, neraca analitik, penyaring vakum, oven, lempeng pemanas, dan alat-alat kaca yang lazim di laboratorium.
Metode Penelitian
Penelitian meliputi beberapa tahap, yaitu pembuatan sistem kanal, kolonisasi perifiton, pembuatan larutan tunggal ion logam, biosorpsi ion logam oleh perifiton, analisis laju kinetika sorpsi, dan analisis struktur. Diagram alir penelitian dapat dilihat pada Lampiran 1.
Pembuatan Sistem Kanal
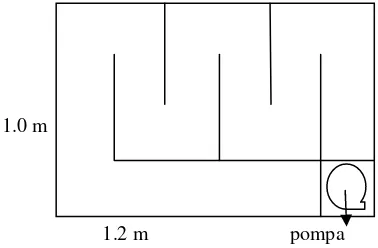
Sistem kanal dirancang menyerupai kondisi perairan lotik (mengalir) pada kondisi stabil dan pada periode waktu yang pendek (Gambar 1 dan Lampiran 2). Sistem kanal yang digunakan merupakan kolam berliku berbahan akrilik dengan dimensi panjang 1.2 m dan lebar 1.0 m. Kolam sistem kanal diisi dengan air sebanyak 132 L dan area perifiton 1.20 m2. Kedalaman sistem kanal berkisar 0.09–0.10 m dengan kecepatan arus 0.04–0.06 m/s.
1.0 m
1.2 m pompa
Gambar 1 Sistem kanal perifiton.
Kolonisasi Perifiton
2
Susanti 2010). Contoh perifiton yang tumbuh diambil dan diamati di bawah mikroskop. Proses adsorpsi dilakukan dengan memasukkan larutan logam Pb(II) dan Ni(II) ke dalam sistem kanal.
Pembuatan Larutan Tunggal Ion Logam Larutan tunggal Pb(II) dan Ni(II) dibuat dengan konsentrasi masing-masing 1.4 mg/L dalam pelarut air deionisasi dari larutan standar logam Pb(II) dan Ni(II) 1000 mg/L. Konsentrasi 1.4 mg/L merupakan nilai konsentrasi efektif 50% (EC50) dari Pb dan Ni (Yap et al. 2004).
Biosorpsi Ion Logam Oleh Perifiton
Biosorpsi ion logam oleh perifiton diamati pada periode waktu pengamatan 0, 15, dan 30 menit serta 1, 2, 4, 8, dan 24 jam setelah pemaparan untuk menentukan laju adsorpsi. Contoh air dan biomassa perifiton diambil secara acak. Contoh air didestruksi dengan HNO3 65% sesuai metode standar (APHA 1998). Biomassa perifiton yang melekat pada substrat batu disikat untuk selanjutnya dikeringkan pada suhu 40 ºC dan ditimbang bobot keringnya, kemudian didestruksi dengan HNO3 65% sesuai metode standar (APHA 1998). Larutan diukur menggunakan AAS pada panjang gelombang 261 nm untuk pengukuran Pb(II) dan 232 nm untuk Ni(II).
Kapasitas biosorpsi dapat dihitung dengan rumus
Sementara efisiensi biosorpsi dapat dihitung dengan rumus
Efisiensi %
dengan
Q = kapasitas adsorpsi per bobot biosorben (µg/g biosorben)
V = volume larutan (mL)
Cawal = konsentrasi awal larutan (mg/L)
Cakhir = konsentrasi akhir larutan (mg/L)
dengan k1 adalah tetapan laju orde pertama semu (menit¯¹), q1 adalah jumlah ion logam yang dijerap pada kesetimbangan, dan qt adalah jumlah ion logam yang dijerap pada permukaan adsorben pada waktu t (mg/g).
Kinetika laju orde kedua semu dievaluasi dari persamaan Ho et al. (2000) yang dapat ditulis sebagai berikut:
dengan k2 adalah tetapan laju orde kedua semu (g/mg⋅menit), qe adalah jumlah ion logam divalen yang diserap pada saat t (mg/g). Dengan memisahkan peubah pada persamaan, dan mengintegrasikan persamaan pada kondisi batas t = 0 sampai t dan qt = 0 sampai t, persamaan dapat disusun kembali menjadi bentuk linear berikut:
dengan h (mg/g jam) adalah tetapan k2qe². Tetapan laju orde kedua (k2) dapat ditentukan secara eksperimental dengan mengalurkan t/qt dengan t.
Analisis Struktur
Struktur perifiton dianalisis sebelum dan setelah proses biosorpsi. Sejumlah sampel yang akan dianalisis dikeringkan terlebih dahulu dan dicampur dengan KBr. Campuran digerus hingga halus lalu ditekan untuk membentuk pelet. Pelet yang diperoleh dimasukkan ke tempat sampel dan direkam spektrum serapan inframerahnya pada bilangan gelombang 400–4000 cm-1.
HASIL DAN PEMBAHASAN
Koloni Perifiton
3
20–36 ºC dan 7.5–8.4, sedangkan suhu optimum fotosintesis 28–30 ºC.
(a)
(b)
Gambar 2 Substrat batuan kali yang digunakan untuk penumbuhan perifiton (a). Koloni perifiton yang dihasilkan setelah 2 minggu (b).
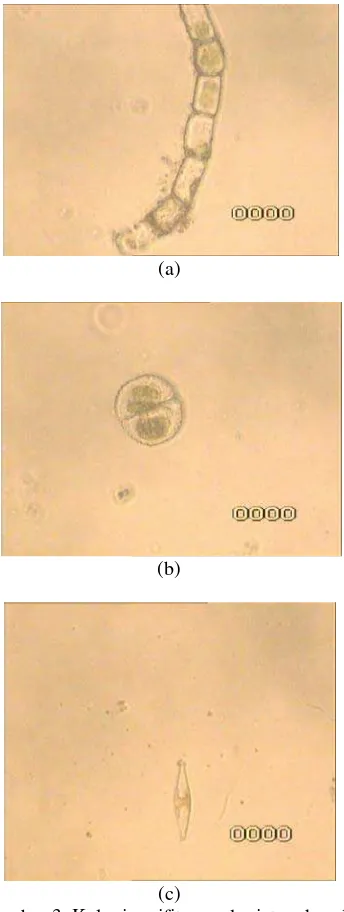
Perifiton yang tumbuh diamati di bawah mikroskop dengan perbesaran 100×. Koloni perifiton yang tumbuh didominasi oleh jenis alga filamentous Spirogyra sp (Gambar 3a) dari kelompok Chlorophyta. Selain itu, ditemukan juga Cosmarium sp (Gambar 3b)
dan diatom (Gambar 3c). Spirogyra
merupakan alga hijau air tawar bentik yang tersebar di seluruh dunia. Foto mikroskop memperlihatkan bentuk Spirogyra sp yang tidak bercabang dan pita kloroplas Spirogyra
yang berbentuk spiral (Lee & Chang 2011). Dinding sel alga terutama terdiri atas selulosa, asam alginat, dan mengandung polisakarida sulfat sebagai blok pembangun dasar, yang semuanya memiliki sifat pertukaran ion (Loukido et al. 2004; Turker & Baytak 2004). Polimer ini memiliki berbagai gugus fungsi yang dapat bertindak sebagai tapak pengikatan ion logam.
(a)
(b)
(c)
Gambar 3 Koloni perifiton pada sistem kanal:
Spirogyra sp (a), Cosmarium sp (b), diatom (c).
Biosorpsi Ion Logam oleh Perifton
Gambar 4
Adsorps pertama dan 120 menit p menit, kons 0.59 mg/L menit, kons 0.76 mg/L. selama 60 lebih dari 5 menit pertam Selama ku adsorpsi fi permukaan Selama 4 ja logam sang dari adsorps Pb dan Ni y 0.20 dan 0. mulai kons Jejari logam daripada Ni awal adsorp sehingga tap lebih cepat selanjutnya lain, sepert kompleksasi Chang 2011 Setelah konsentrasi
Penurunan k dan Ni di proses adsorp
i cepat Pb te n adsorpsi ce pertama. Pada sentrasi Pb ya dan pada w sentrasi Ni ya
Nilai ini men menit pertam 50%. Demiki ma Ni telah t urun waktu isis atau pe perifiton yan am pertama, gat tinggi, me si keseluruhan ang tersisa da 15 mg/L. Kem stan menuju m Pb (0.175 n i (0.072 nm) psi logam Pb pak aktif di t jenuh. Fa mungkin me ti kejenuhan i, atau mikro
; Onyancha e
24 jam Pb(II) dalam
konsentrasi log air selama psi, • Pb ♦Ni
erjadi pada 60 epat Ni terja a waktu adso ang tersisa da waktu adsorp ang tersisa da ngindikasikan ma Pb telah
ian pula selam terjerap hamp
ini, diduga ertukaran ion
g berlangsung laju adsorps encapai sekit n dengan kon alam air bertur mudian laju a keadaan seti nm) yang lebi ) menyebabka lebih cepat permukaan a se lambat a elibatkan mek pada tapak o-presipitasi
t al. 2008). proses a m air 0.05 mg
gam Pb 24 jam i. 0 menit di pada orpsi 60 alam air psi 120 alam air n bahwa terjerap ma 120 pir 50%. terjadi n pada g cepat. i kedua tar 85% nsentrasi rut-turut adsorpsi imbang. ih besar an pada terjerap dsorben adsorpsi kanisme k aktif, (Lee & adsorpsi, g/L dan
Gambar 5 Ke da se ad Dalam pe dapat disebab pada per mikroorganis pengambilan acak memung ketebalan ya waktu pengam antarkoloni penyebab tid logam pada Pb(II) dan N pada Lampira Komposis pada sistem kemampuan pada perairan oleh spesies perbedaan sif dinding sel. P utama pengik yang terikat melebihi log kompartemen 2005; Mehta memiliki gug hidroksil, fo
enaikan kons an Ni pada elama 24 dsorpsi, • Pb ♦
enelitian ini, bkan oleh ada rifiton ya me hidup.
sampel yang gkinkan teram ang tidak ser
mbilan. Perbe perifiton jug dak meratany kanal. Data Ni(II) selengka
an 3 dan 4. si jenis perif m kanal san pengikatan lo n. Perbedaan alga terutam fat permukaan Permukaan sel katan logam pa di permuk gam yang te n intraselular a & Gaur 200
gus fungsi ya sfat, amino,
sentrasi loga biomassa pe jam
♦Ni.
penurunan te anya proses bi ang meru Selain itu, g dilakukan mbilnya batu d ragam untuk daan konsum ga dapat m ya proses ad konsentrasi apnya dapat
fiton yang tu ngat memen ogam yang te adsorpsi loga ma disebabkan n selnya, khus l merupakan t ada alga, dan kaan acapkali erakumulasi r (Andrade 05). Permuka ang berbeda aldehida, su
4
dan efisiens selengkapny
Gambar 6
Bere et
tingkat tok dibandingka perifiton d Percobaan menggunaka dan Cd deng mg/L. Kinetika ditentukan Lagergren. diterapkan semu, deng logam mel permukaan banyak dim kinetika mikroorgani dan proses b 2004; Gupta 2008). Reg log(qe–qt) model kine tetapan k1 (G
i biosorpsi log ya diberikan d
(a)
(b) Kapasitas biosorpsi Ni, • Pb ♦
t al. (2012) ksisitas Cr an dengan C dari sungai
tersebut an larutan cam gan konsentra
Kinetika Bi
a biosorpsi log menggun Persamaan sebagai kin gan mengasu lebihi jumla adsorben. P anfaatkan unt sorpsi yan isme hidup sa berlangsung t a & Rastogi 2 gresi linear d
terhadap t
etika orde pe Gambar 7).
gam Pb(II) da di Lampiran 7
s (a) dan e (b) logam
♦Ni.
melaporkan dan Pb m Cd dalam ko
Monjoliho, dilakukan mpuran logam asi masing-ma
iosorpsi
gam Pb(II) da nakan per Lagergren etika orde p umsikan juml
ah tapak ak Persamaan in tuk memodelk g terjadi aat konsentras etap (Loukido 2008; Onyanch dengan meng akan mengh ertama semu an Ni(II) dan 8. efisiensi Pb dan bahwa menurun munitas Brazil. dengan m Cr, Pb, asing 10 an Ni(II) rsamaan dapat pertama lah ion ktif di ni telah kan data dalam si tinggi ou et al.
ha et al.
galurkan hasilkan dengan
Gambar 7 M da pa N Analisis k menghasilkan rendah, yaitu Ni. Oleh k menggunakan semu. Men menghasilkan semu dengan
Gambar 8 M d p • Hasil pe kinetika bioso perifiton me semu, ditunj determinasi Berdasarkan maka prose sebagai kemis orde kedua berturut-turut 22.589×10-3 data ini dapat interaksi Ni dibandingkan Bhattacharyy Model kinetika ari adsorpsi ada biomassa Ni.
kinetika orde p n koefisien de 0.701 untuk arena itu ev n persamaan k
ngalurkan n model kin
tetapan k2 (Ga
Model kinetik dari adsorpsi pada biomass
•Ni.
ercobaan me orpsi ion loga engikuti persa jukkan deng (R2) yang ti Ho et. al. (20 es sorpsi d sorpsi. Nilai t semu (k2) t adalah
g.mg-1.menit -t disimpulkan dengan per n dengan ya 2008).
a orde pertama logam Pb d a perifiton, •
pertama semu eterminasi (R2
Pb dan 0.330 valuasi dilan kinetika orde
t/qt terhada netika orde
ambar 8).
ka orde kedua logam Pb d sa perifiton,
enunjukkan am Pb dan Ni
amaan orde gan nilai ko
nggi sebesar 000), jika alur dapat digamb
tetapan laju ad untuk Pb da 4.516×10-3 -1 (Tabel 1). bahwa kemam rifiton lebih Pb (Gupt
5
a semu dan Ni Pb •hanya 2 ) yang 0 untuk njutkan kedua ap t
kedua
a semu dan Ni
• Pb
6
Tabel 1 Kinetika reaksi pada adsorpsi logam Pb dan Ni oleh perifiton
Logam Kinetika model orde pertama semu Kinetika model orde kedua semu
k1 (menit-1) qe (mg/g) R2 k2 (×10-3g/mg⋅menit) qe (g/mg) R2
Pb -0.052 1.454 0.701 4.516 2.577 0.971
Ni -0.085 3.796 0.330 22.589 0.541 0.971
Spektrum FTIR
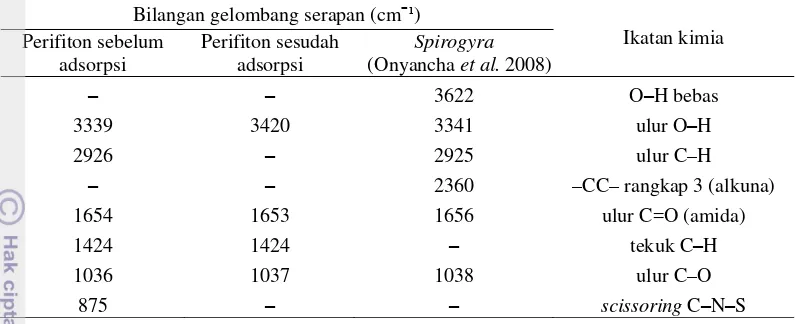
Analisis FTIR dilakukan terhadap perifiton sebelum dan sesudah proses adsorpsi logam Pb(II) dan Ni(II) untuk mengamati perubahan gugus fungsi yang terdapat dalam perifiton. Spektrum FTIR sebelum proses adsorpsi (Gambar 9b) menunjukkan kemiripan dengan spektrum FTIR Spirogyra (Gambar 9a). Spektrum FTIR Spirogyra menunjukkan gugus fungsi O-H dan N-H pada bilangan gelombang 3622 cm-1 dan 3333 cm-1, C-H
pada 2925 cm-1, C-C pada 2360 cm-1, C=O pada 1656 cm-1, dan C-O pada 1038 cm-1 (Onyancha et al. 2008).
Spektrum FTIR perifiton sesudah adsorpsi logam Pb (Gambar 9c), dan sesudah adsorpsi logam Ni (Gambar 9d) tidak menunjukkan perubahan gugus fungsi dari sebelum proses adsorpsi (Gambar 9b). Perbandingan spektrum IR perifiton sebelum dan sesudah adsorpsi Pb(II) dan Ni(II) dengan Spirogyra
7
Tabel 2 Perbandingan spektrum IR perifiton sebelum dan sesudah adsorpsi Pb(II) dan Ni(II) dengan Spirogyra
Bilangan gelombang serapan (cm¯¹)
Ikatan kimia Perifiton sebelum adsorpsi Perifiton sesudah adsorpsi Spirogyra (Onyancha et al. 2008)
– – 3622 O–H bebas
3339 3420 3341 ulur O–H
2926 – 2925 ulur C–H
– – 2360 –CC– rangkap 3 (alkuna)
1654 1653 1656 ulur C=O (amida)
1424 1424 – tekuk C–H
1036 1037 1038 ulur C–O
875 – – scissoring C–N–S
Biosorpsi ion logam pada alga mengikuti 2 fase. Fase pertama adalah metabolisme cepat dengan adsorpsi pada dinding sel dan permukaan luar, fase kedua adalah metabolisme lambat bergantung pada pengangkutan melintasi membran sel (Bere & Tundisi 2012). Pada akhir percobaan tidak dilakukan pengamatan di bawah mikroskop pada komunitas perifiton yang masih terdapat dalam sistem kanal.
Menurut Bere & Tundisi (2012), komposisi spesies akan berubah, yakni keragaman dan dominasi spesies menurun dan terjadi deformasi sel diatom, akibat kenaikan konsentrasi Cd setelah 4 minggu spesies
Achnanthidium minutissimum, Diatoma vulgare, Navicula viridula terpapar konsentrasi Cd 0.1 mg/L. Perubahan komposisi dan kelimpahan spesies perifiton dengan meningkatnya konsentrasi logam Pb(II) dan Ni(II) akan menunjukkan kegunaan komunitas perifiton dalam mengidentifikasi tinggi atau rendahnya konsentrasi logam dalam aliran. Hal ini akan menjadikan perifiton alat pemantau yang potensial untuk pencemaran logam di sungai yang sama baiknya dengan pengukuran logam dalam sedimen dan padatan tersuspensi (Fuchs et al.
1996).
SIMPULAN DAN SARAN
Simpulan
Perifiton berpotensi sebagai biosorben logam Pb dan Ni. Kapasitas biosorpsi maksimum untuk logam Pb sebesar 1.97 mg/g dan logam Ni 1.92 mg/g.
Kinetika biosorpsi logam Pb(II) dan Ni(II) mengikuti persamaan reaksi orde kedua semu
dengan nilai k2 = 4.516×10-3 g.mg-1.menit-1 untuk logam Pb dan nilai k2 = 22.589×10-3 g.mg-1.menit-1 untuk logam Ni. Nilai koefisien determinasi (R2) masing-masing 0.97.
Saran
Perlu pengujian adsorpsi menggunakan campuran 2 logam atau lebih untuk melihat persaingan antarkation logam terhadap tapak aktif perifiton. Pengamatan dengan mikroskop komunitas perifton setelah proses adsorpsi juga diperlukan.
DAFTAR PUSTAKA
[APHA] American Public Health Association.
1998. Standard Method for The
Examination of Water and Wastewater. Ed ke-20. Washington: America Water Works Association and Water Polution Control Federation.
Andrade AD, Rollemberg MCE, Nobrega JA. 2005. Proton and metal binding capacity of the green freshwater alga Chaetophora elegans. Process Biochem 40:1931-1936. Bere T, Tundisi JG. 2012. Effects of cadmium
stress and sorption kinetics on tropical freshwater periphytic communities in indoor mesocosm experiments. Sci Environ 432:103-112.
Bere T, Chia MA, Tundisi JG. 2012. Effects of Cr III and Pb on the bioaccumulation and toxicity of Cd in tropical periphyton communities: implications of pulsed metal exposures. Environ Poll 163:184-191. Cabuk A, Ilhan S, Fluk C, Caliskan F. 2005.
8
Ehrlich HL, Briefley CL. 1990. Microbial
Mineral Recovery. New York: Mc Graw-Hill.
Fuchs S, Haritopoulou T, Wilhelmi M. 1996. Biofilms in freshwater ecosystems and their use as a pollutant monitor. Water Sci Technol 34:137-140.
Gupta SS, Bhattacharayya GK. 2008. Immobilization of Pb(II), Cd(II), Ni(II) ions on kaolinite and montmorillonite surfaces from aqueous medium.J Environ Manag 87:46-58.
Gupta VK, Rastogi A. 2008. Biosorption of lead from aqueous solutions by green algae Spirogyra species: kinetics and equilibrium studies. J Hazard Mater
152:407-414.
Hill WR, Boston HL. 1991. Community development alters photosyntesis-irradiance relations in stream periphyton.
Limnol Oceanog 36:1375-1389.
Ho YS, Mc Kay G, Wase DAJ, Forster CF. 2000. Study of sorption of divalent metal ions onto peat. Adsorp Sci Technol
18:639-650.
Lee YC, Chang SP. 2011. The biosorption of heavy metals from aqueous solution by
Spirogyra and Cladophora filamentous macroalgae. Biores Technol 102:5297-5304.
Loukidou MX, Zouboulis AI, Karapantsios TD, Matis KA. 2004. Equilibrium and kinetic modeling of chromium(VI) biosorption by Aeromonas caviae. Coll Surf 242:93-104.
Mehta SK, Gaur JP. 2005. Use of algae for removing heavy metals ions from wastewater: progress and prospect. Crit Rev Biotechnol 25:113-152.
Nofdianto, Susanti E. 2010. Pseudo second order kinetic model for the biosorption of Cr6+ ion from aqueous solution to periphyton biomass. Di dalam: Prospek Ekosistem Perairan Darat Indonesia: Mitigasi Bencana dan Peran Masyarakat. Prosiding Seminar Nasional Limnologi V; Bogor, 28 Juli 2010. Bogor: Pusat Penelitian Limnologi LIPI. hlm 731-738. Onyancha D et al. 2008. Studies of chromium
removal from tannery wastewaters by green algae biosorbent, Spirogyra condensata and Rhizoclonium hieroglyphicum. J Hazard Mat 158:605-614.
Pavasant P et al. 2006. Biosorption of Cu2+, Cd2+, Pb2+, and Zn2+ using dried marine green macroalga Caulerpa lentillifera.
Biores Technol 97:2321-2329.
Sing C, Yu J. 1998. Copper adsorption and removal from water by living mycelium of
white-rot fungus Phanerochaete
chrysosporium. Water Res 32:2746-2752. Singh A, Kumar D, Gaur JP. 2007. Copper(II)
and lead(II) sorption from aqueous solution by non-living Spirogyra neglecta. Biores Technol 98:3622-3629.
Turker A, Baytak S. 2004. Use of Escherichia coli immobilized on amberlite XAD-4 as a solid-phase extractor for metal preconcentration and determination by atomic absorption spectroscopy. Anal Sci
20:329-334.
Volesky B. 1990. Biosorption and
biosorbents. Di dalam: Biosorption of Heavy Metals, editor. Florida: CRC Pr. Yap CK, Ismail A, Omar H, Tan SG. 2004.
9
10
Lampiran 1 Diagram alir penelitian
Lampiran 2 Model kanal perifiton yang digunakan pada percobaan
Kapasitas adsorpsi
(t = 0; 15; 30; 60; 120; 240; 480; 1440 menit)
Persiapan sistem kanal
Kolonisasi perifiton
Biosorpsi larutan Pb(II) dan Ni(II) 1.4 mg/L oleh perifiton dalam sistem kanal
11
Lampiran 3 Data konsentrasi logam Pb(II) dalam air dan perifiton
Waktu (menit)
Konsentrasi logam Pb Bobot
perifiton (g)
Konsentrasi logam Pb dalam perifiton (mg/g) Air (mg/L) Perifiton (mg/L)
Baseline 0.02 0.06 0.1119 0.0134
0 0.81 2.61 0.1048 0.6226
15 1.03 3.13 0.0955 0.8194
30 0.86 3.04 0.0626 1.2141
60 0.59 5.55 0.1278 1.0857
120 0.34 5.03 0.1244 1.0109
240 0.20 5.52 0.1080 1.2778
480 0.14 7.97 0.0843 2.3636
1440 0.05 11.40 0.1160 2.4569
Lampiran 4 Data konsentrasi logam Ni(II) dalam air dan perifiton
Waktu (menit)
Konsentrasi logam Ni Bobot
perifiton (g)
Konsentrasi logam Ni dalam perifiton (mg/g) Air (mg/L) Perifiton (mg/L)
Baseline 0.00 0.06 0.0948 0.0158
0 1.33 0.12 0.0822 0.0365
15 1.37 0.23 0.0955 0.0602
30 1.29 0.23 0.0535 0.1075
60 1.01 0.62 0.0901 0.1720
120 0.76 1.08 0.1186 0.2276
240 0.15 2.54 0.1548 0.4102
480 0.09 2.80 0.1066 0.6567
1440 0.03 1.87 0.0941 0.4968
Data percobaan merupakan rerata dari 2 kali ulangan.
Baseline merupakan konsentrasi logam sebelum dimasukkan larutan logam ke dalam sistem kanal.
Contoh perhitungan konsentrasi logam dalam perifiton:
Ni dalam perifiton mg g⁄ Ni dalam perifiton mg Lbobot perifiton g⁄ . L
. mg L. ⁄ g. L
.
12
Lampiran 5 Kinetika laju penyerapan logam Pb(II)
Waktu (menit)
Konsentrasi logam Pb
qt log (qe–qt) t/qt Air (mg/L) Perifiton (mg/L)
0 0.81 2.61 0.6226 0 0
15 1.03 3.13 0.8194 0.181683 18.30671
30 0.86 3.04 1.2141 0.152507 24.71053
60 0.59 5.55 1.0857 0.754448 55.26486
120 0.34 5.03 1.0109 0.656070 118.7117
240 0.20 5.52 1.2778 0.749028 187.8261
480 0.14 7.97 2.3636 1.116334 203.0816
1440 0.05 11.40 2.4569 1.474263 586.1053
Lampiran 6 Kinetika laju penyerapan logam Ni(II)
Waktu (menit)
Konsentrasi logam Ni
qt log (qe–qt) t/qt Air (mg/L) Perifiton (mg/L)
0 1.33 0.12 0.0365 0 0
15 1.37 0.23 0.0602 0.650588 249.1304
30 1.29 0.23 0.1075 0.650588 279.1304
60 1.01 0.62 0.1720 1.642228 348.7742
120 0.76 1.08 0.2276 2.197225 527.1111
240 0.15 2.54 0.4102 3.052428 585.0709
480 0.09 2.80 0.6567 3.149883 730.9714
1440 0.03 1.87 0.4968 2.746202 2898.481
Contoh perhitungan tetapan laju adsorpsiuntuk logam Ni(II):
log log .
Persamaan grafik yang didapat y = 0.085x + 1.334, maka k1 = -0.085
13
Lampiran 7 Nilai kapasitas dan efisiensi biosorpsi logam Pb(II)
Waktu (menit) Konsentrasi logam (mg/L)
Bobot perifiton (g)
Kapasitas biosorpsi (Q)
Efisiensi (%)
0 0.81 0.1048 0.7431 42.14
15 1.03 0.0955 0.5114 26.43
30 0.86 0.0626 1.1387 38.57
60 0.59 0.1278 0.8366 57.86
120 0.34 0.1244 1.1248 75.71
240 0.20 0.1080 1.4667 85.71
480 0.14 0.0843 1.9730 90.00
1440 0.05 0.1160 1.5362 96.43
Lampiran 8 Nilai kapasitas dan efisiensi biosorpsi logam Ni(II)
Waktu (menit) Konsentrasi logam (mg/L)
Bobot perifiton (g)
Kapasitas biosorpsi (Q)
Efisiensi (%)
0 1.33 0.0822 0.1124 5.00
15 1.37 0.0955 0.0415 2.14
30 1.29 0.0535 0.2714 7.86
60 1.01 0.0901 0.5714 27.86
120 0.76 0.1186 0.7123 45.71
240 0.15 0.1548 1.0659 89.29
480 0.09 0.1066 1.6221 93.57
1440 0.03 0.0941 1.9218 97.86
Contoh perhitungan kapasitas biosorpsi untuk logam Ni:
mg g⁄ bobot perifiton g
L .. g . mg/L
.
Contoh perhitungan efisiensi biosorpsi untuk logam Ni:
Efisiensi %
. . . %