BIOAKTIVITAS ANTIOKSIDAN DAN ANTIINFLAMASI
IN VITRO
SERTA KANDUNGAN KURKUMINOID
TEMULAWAK DAN KUNYIT ASAL SUKABUMI
NI LUH PUTU EKA KARTIKA SARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
NI LUH PUTU EKA KARTIKA SARI. Bioaktivitas Antioksidan dan
Antiinflamasi
In Vitro
serta Kandungan Kurkuminoid Temulawak dan Kunyit
Sukabumi. Dibimbing oleh WARAS NURCHOLIS dan LAKSMI AMBARSARI.
Temulawak (Curcuma xanthorrhiza) dan kunyit (Curcuma domestica) adalah
salah satu jenis tanaman obat dari famili
Zingiberaceae yang memiliki banyak
manfaat bagi kesehatan. Kedua rimpang ini memiliki kandungan kurkuminoid dan
bermanfaat sebagai antioksidan, serta antiinflamasi. Penelitian ini bertujuan untuk
menganalisis aktivitas antioksidan, antiinflamasi serta kadar kurkuminoid dari
ekstrak etanol temulawak dan kunyit asal Sukabumi. Metode HPLC digunakan
untuk mengukur kadar kurkuminoid. Aktivitas antioksidan (penangkapan radikal
bebas) dengan menggunakan metode DPPH (2,2-difenil-1-pikrilhidrazil).
Sedangkan, aktivitas antiinflamasi dianalisis dengan metode inhibisi enzim
COX-2 secara
in vitro. Kadar kurkuminoid yang diperoleh pada temulawak sebesar
31.27 mg/g dan kunyit sebesar 66.32 mg/g. Aktivitas antioksidan pada kunyit
lebih tinggi dari temulawak karena nilai IC
50pada kunyit
73.31 μg/ml s
edangkan
pada temulawak
81.99 μg/ml.
Nilai % inhibisi terhadap penghambatan enzim
COX-2 diperoleh sampel kunyit sebesar 74.84 % sedangkan temulawak 67.96 %.
Berdasarkan penelitian ini, disimpulkan bahwa ekstrak etanol rimpang kunyit asal
Sukabumi memiliki kadar kurkuminoid, aktivitas antioksidan, dan antiinflamasi
yang lebih tinggi dari pada rimpang temulawak Sukabumi.
ABSTRACT
NI LUH PUTU EKA KARTIKA SARI. In Vitro Antioxidant and
Anti-Inflamatory Bioactivities and Curcuminoid Contents of Indonesia
Curcuma
xanthorrhiza Roxb. and
Curcuma domestica Val. Supervised by WARAS
NURCHOLIS and LAKSMI AMBARSARI.
Curcuma xanthorrhiza
and
Curcuma domestica are kind of medicinal plants
which have many health benefits. Both of them have curcuminoid content which
is useful as an antioxidant and anti-inflamatory. In this study, ethanol extracts of
C. xanthorrhiza and C. domestica promising lines from Sukabumi, Indonesia were
investigated for the presence of curcuminoids, antioxidant and anti-inflamatory
activities. HPLC method were used to determined curcuminoids content. The
antioxidant (radical scavenging) potential of the samples was evaluated using
2,2-diphenyl-1-picrylhydrazyl (DPPH) free radical method. While for the
anti-inflamatory activity, the in vitro cyclooxygenase 2 (COX2) inhibition method was
used. The curcuminoid content of
C. xanthorrhiza and
C. domestica
were 31.27
mg/g and 66.32 mg/g, respectively. IC
50values for DPPH radical scavenging
activity were 81.99
μg/
mL
and 73.31 μg/
mL, with
C. domestica
having lowest
value and most potent than C. xanthorrhiza. Percent inhibition values for COX2
inhibitor activity were 74.84 % and 67.96 %, with C. domestica having the highest
value. In this study, the ethanol extracts of
C. domestica
promosing line from
Sukabumi of Indonesia exhibited most in curcuminoids content, antioxidants
properties and anti-inflamatory activity than C. xanthorrhiza promosing line.
BIOAKTIVITAS ANTIOKSIDAN DAN ANTIINFLAMASI
IN VITRO
SERTA KANDUNGAN KURKUMINOID
TEMULAWAK DAN KUNYIT ASAL SUKABUMI
NI LUH PUTU EKA KARTIKA SARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Bioaktivitas Antioksidan dan Antiinflamasi Secara
In Vitro
serta Kandungan Kurkuminoid Temulawak dan Kunyit Asal
Sukabumi
Nama
: Ni Luh Putu Eka Kartika Sari
NIM
: G84080084
Disetujui
Komisi Pembimbing
Waras Nurcholis, S.Si, M.Si Dr.Laksmi Ambarsari, M.S
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App. Sc.
Ketua Departemen Biokimia
2
PRAKATA
Segala puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah
memberikan rahmat dan kemudahan dalam penyusunan karya ilmiah yang
berjudul Bioaktivitas Antioksidan dan Antiinflamasi
In Vitro serta Kandungan
Kurkuminoid Temulawak dan Kunyit Sukabumi. Penelitian ini dilakukan pada
bulan November 2011- Maret 2012 di Laboratorium Pusat Studi Biofarmaka,
Institut Pertanian Bogor (IPB). Penelitian ini didukung oleh Direktorat Jenderal
Pendidikan Tinggi dalam kegiatan penelitian Hibah Kompetitif Penelitian
Strategis Unggulan Nasional, Direktorat Jenderal Pendidikan Tinggi, Kemetrian
Pendidikan dan Kebudayaan Republik Indonesia.
Ucapan terima kasih penulis sampaikan kepada Bapak Waras Nurcholis dan
Ibu Laksmi Ambarsari selaku komisi pembimbing atas bimbingan, arahan serta
nasehat dalam penyusunan karya ilmiah ini. Ungkapan terima kasih juga
dipersembahkan kepada kedua orang tua penulis, adik Gede Sanjaya Adi Putra
atas doa dan kasih sayangnya. Terima kasih Penulis ucapkan kepada Prof. Dr. Ir.
Latifah K Darusman selaku Kepala Pusat Studi Biofarmaka Institut Pertanian
Bogor, serta seluruh staf laboratorium Pusat Studi Biofarmaka, khususnya Ibu
Nunu, Mbak Wiwik, Mas Endi, dan Pak Zaim atas bantuan teknis dan saran yang
diberikan selama penelitian. Penulis menyampaikan terima kasih kepada seluruh
dosen dan staf Departemen Biokimia IPB atas bantuan dan saran yang telah
diberikan.
Ucapan terima kasih penulis berikan kepada Lusianawati, Vita, Yoan, Dita,
Osa, Shelly, Annisa Rosyana, Nasodikin, Adit, Ucup, Reza, Faris, Iqbal Syukri
atas saran dan dukungan yang telah diberikan. Penulis mengucapkan terima kasih
kepada I.B Dharma Yoga Santosa, Lilik Pratami, Meyga Semarayani, Mita, Ayus,
Debby, Made Ayu, Mayun, Wira, Dewa, Yuda, Joni atas doa, semangat,
dukungan moril serta segala motivasi untuk selalu berusaha menjadi lebih baik.
Semoga karya ilmiah ini dapat memberikan manfaat bagi seluruh pembaca serta
dapat menjadi langkah awal penulis untuk berjalan mencapai impiannya.
Bogor, Juni 2012
RIWAYAT HIDUP
Ni Luh Putu Eka Kartika Sari terlahir sebagai anak pertama dari Ketut
Suryadi dan Komang Suardani pada tanggal 5 Mei 1990. Penulis menyelesaikan
pendidikan jenjang menengah atas di SMA Negeri 3 Denpasar, Bali pada tahun
2008. Pada tahun yang sama penulis melanjutkan pendidikan di Departemen
Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian
Bogor (IPB) melalui jalur SNM-PTN (Seleksi Nasional Masuk Perguruan Tinggi
Negeri.
Selama mengikuti kegiatan perkuliahan, penulis pernah menjadi asisten
praktikum mata kuliah Kimia Dasar pada tahun ajaran 2011/2012. Pada tahun
2010 penulis mendapat kesempatan untuk mengikuti kegiatan PKM-P (Program
Kreatifitas Mahasiswa bidang Penelitian) dengan judul karya ilmiah Fortifikasi
Yogurt Susu Kerbau (Dadih) Dengan
Bifidobacterium bifidum
dalam Bentuk
Tablet Hisap Effervescent. Pada tahun 2011 penulis melaksanakan kegiatan
praktik lapang di Laboratorium Pangan dan Pakan Balai Pengawasan Mutu
Barang (BPMB) dengan karya ilmiah yang berjudul Studi Perbandingan Metode
Uji Komposisi Asam Lemak pada Minyak Goreng Secara Kromatografi Gas.
4
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Temulawak ... 2
Kunyit ... 3
Kurkuminoid ... 3
Antioksidan ... 4
Uji Antioksidan 2,2 Difenil-1-Pikril-Hidrazil ... 5
Inflamasi ... 5
High Performance Liquid Chromatography ... 6
BAHAN DAN METODE
Bahan dan Alat ... 7
Metode Penelitian ... 7
HASIL DAN PEMBAHASAN
Ekstrak Rimpang Temulawak dan Kunyit ... 9
Kadar Kurkuminoid Ekstrak Rimpang Temulawak dan Kunyit ... 10
Aktivitas Antioksidan Ekstrak Rimpang Temulawak dan Kunyit ... 11
Aktivitas Antiinflamasi Ekstrak Rimpang Temulawak dan Kunyit ... 12
SIMPULAN ... 13
SARAN ... 13
DAFTAR PUSTAKA ... 13
DAFTAR GAMBAR
Halaman
1 Morfologi Tanaman (a) dan Rimpang Temulawak (b) ... 2
2 Morfologi Tanaman (a) dan Rimpang Kunyit (b) ... 3
3 Struktur Kimia Kurkuminoid ... 4
4 Struktur Kimia DPPH ... 5
5 Diagram Alir HPLC ... 7
6 Format Micro plate Inhibisi COX-2 ... 9
7 Kadar Kurkuminoid Ekstrak Etanol Temulawak dan Kunyit ... 10
8 Jenis Senyawa Kurkuminoid Pada Temulawak dan Kunyit ... 11
9 Penghambatan Radikal Bebas DPPH Oleh Temulawak dan Kunyit ... 11
10 Perubahan Warna DPPH Dalam Micro Plate ... 11
11 Hasil Uji Antioksidan Ekstrak Temulawak dan Kunyit ... 12
12 Penghambatan COX-2 oleh Temulawak dan Kunyit ... 13
DAFTAR LAMPIRAN
Halaman
1 Diagram Alir Penelitian ... 19
2 Prosedur Ekstraksi Simplisia Temulawak dan Kunyit (BPOM 2005) ... 20
3 Diagram Alir Uji Aktivitas Antioksidan Dengan Metode DPPH ... 21
4 Preparasi Larutan Untuk Uji Aktivitas Inhibisi COX-2 ... 22
5 Rendemen Hasil Ekstraksi ... 25
6 Hasil Pengukuran Kadar Kurkuminoid Temulawak Dengan HPLC ... 26
7 Hasil Pengukuran Kadar Kurkuminoid Kunyit Dengan HPLC ... 27
8 Data Absorban Ekstrak Temulawak Sukabumi ... 28
9 Data Absorban Ekstrak Kunyit Sukabumi ... 29
10 Pengaruh Sampel Terhadap % Inhibisi ... 30
11 Hasil Uji IC
50Sampel Temulawak dan Kunyit ... 31
12 Kurva Standar Uji Inhibisi COX-2 ... 32
1
PENDAHULUAN
Penggunaan berbagai jenis tumbuh-tumbuhan sebagai tanaman obat tradisional telah lama dikenal oleh masyarakat Indonesia jauh sebelum perkembangan obat-obatan sintetik. Penggunaan obat-obatan tradisional kembali meningkat seiring dengan kesadaran masyarakat terhadap dampak yang ditimbulkan dari penggunaan obat-obatan sintetik sehingga masyarakat beralih dari konsumsi obat-obatan sintetik ke obat-obatan tradisional. Perkembangan konsumsi obat-obatan tradisional sebagai alternatif dalam penyembuhan berbagai penyakit memicu banyaknya penelitian di bidang biofarmaka yaitu mengenai obat-obatan alami yang berasal dari tumbuhan.
Indonesia dikenal sebagai negara dengan megabiodiversitas, yaitu suatu negara yang memiliki keanekaragaman hayati flora dan fauna yang sangat melimpah. Hal ini didukung oleh keadaan geografis Indonesia yang beriklim tropis dengan curah hujan rata-rata tinggi sepanjang tahun. Sekitar 30.000 jenis tumbuhan yang ditemukan di Indonesia, kurang lebih 7.000 diantaranya memiliki khasiat sebagai obat. Beberapa jenis tanaman yang diketahui berpotensi sebagai obat fitofarmaka diantaranya temulawak (Curcuma xanthorrhiza Roxb.) dan kunyit (Curcuma domestica Val.). Karakteristik tanaman sebagai obat fitofarmaka didasarkan pada potensi tanaman tersebut sebagai antimikroba, antioksidan, antifungi, antiinflamasi (Nuratmi
et al. 1996).
Temulawak merupakan salah satu jenis tanaman obat dari famili Zingiberaceae yang potensial untuk dikembangkan dan merupakan salah satu dari sembilan jenis tanaman unggulan dari Direktorat Jenderal Pengolahan Obat dan Makanan (Ditjen POM) yang memiliki banyak manfaat sebagai bahan obat (Hadipoentyanti & Syahid 2007). Rimpang temulawak memiliki banyak manfaat diantaranya sebagai antimikroba (Hwang et al. 2000), antikarsinogenik (Huang et al.
1998), antioksidan (Masuda et al. 1992), antiinflamasi (WHO 1999), sedangkan kunyit biasanya digunakan sebagai zat pewarna, bahan baku industri, obat-obatan tradisional dan bumbu masak. Berbagai penelitian telah membuktikan manfaat yang dimiliki oleh kunyit, yaitu sebagai antihepatoksik, antikolesterol, obat tumor, dan kanker. Sama halnya dengan temulawak, kunyit juga berkhasiat sebagai antiinflamasi dan antioksidan (Unnikrishnan & Rao 1995).
Salah satu komponen senyawa aktif yang bertanggung jawab terhadap respon biologis yang dimiliki temulawak dan kunyit adalah kurkuminoid (Permadi 2008). Kurkuminoid adalah pemberi warna kuning pada rimpang temulawak dan kunyit. Kurkuminoid mempunyai aroma yang khas dan tidak bersifat toksik (Sidik et al. 1995). Salah satu efek farmakologi yang dimiliki kurkuminoid adalah sebagai antiinflamasi (Banerjee et al.
2003), antitumor (Khar et al. 1999). Menurut Jayaprakash et al. (2006) kurkuminoid berpotensi sebagai antioksidan (pertahanan terhadap serangan radikal bebas).
Kondisi stres dan meningkatnya usia pada seseorang akan memicu pembentukan radikal bebas. Radikal bebas adalah senyawa yang mengganggu sistem kekebalan tubuh, pemicu beberapa penyakit degeneratif seperti kanker, katarak, diabetes melitus, dan penyakit jantung koroner. Stres oksidatif adalah suatu keadaan ketika jumlah antioksidan tubuh kurang dari yang diperlukan untuk meredam efek buruk radikal bebas yang merusak kelangsungan hidup sel dan jaringan (Bagiada 2010). Serangan berbagai penyakit degeneratif di tubuh tidak terlepas dari mekanisme inflamasi. Proses inflamasi adalah respon proteksi dari tubuh apabila ada cedera jaringan atau infeksi akibat adanya agen-agen berbahaya. Namun, respon ini dapat menyebabkan reaksi hipersensitivitas yang bisa membawa kematian atau kerusakan organ sehingga proses inflamasi di tubuh harus dihambat melalui kerja enzim yang berperan agar sesuai dengan kebutuhan perlindungan tubuh (Hayes & Kee 1996).
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan, antiinflamasi serta kandungan kurkuminoid pada rimpang temulawak dan kunyit Sukabumi melalui uji antioksidan dengan metode DPPH untuk mendapatkan nilai Inhibition Concentration
(IC50) terbaik dari temulawak dan kunyit, uji
antiinflamasi dengan Colorimetric COX Inhibitor Screening Assay, serta menentukan kandungan kurkuminoid dengan High Performance Liquid Chromatography
kualitas metabolit sekunder yang baik terlihat dari potensinya sebagai antioksidan dan antiinflamasi.
Hasil penelitian terhadap potensi rimpang temulawak dan kunyit Sukabumi sebagai antioksidan, antiinflamasi serta kandungan kurkuminoid diharapkan mampu menjadikan daerah Sukabumi menjadi daerah pembudidayaan temulawak dan kunyit dengan kualitas metabolit sekunder yang baik. Kandungan metabolit sekunder yang baik tentunya meningkatkan potensi bioaktivitas dan efek farmakologis dari temulawak dan kunyit.
TINJAUAN PUSTAKA Temulawak
Temulawak merupakan tanaman obat berupa tumbuhan rumpun berbatang semu (Gambar 1). Temulawak (Curcuma xanthorrhiza Roxb.) adalah tanaman yang berasal dari daerah Jawa, Bali, dan Maluku. Curcuma berasal dari bahasa arab kurkum yang berarti kuning, sedangkan xanthorriza berasal dari bahasa Yunani xantos yang berarti kuning dan rhiza yang berarti akar. Sesuai dengan klasifikasi botani, temulawak termasuk dalam kingdom Plantae, divisi Spermatophyta, sub divisi Angiospemae, kelas Monocotyledonae, ordo Zingiberales, famili Zingiberaceae, genus Curcuma dan nama spesies Curcuma xanthorrhiza Roxb.
(Rukmana 2006).
Tumbuhan temulawak adalah tumbuhan tahunan yang berbatang tegak dengan tinggi kurang lebih 2 m, berwarna hijau atau coklat gelap. Pada Gambar 1a terlihat bahwa pada tanaman temulawak, tiap batangnya mempunyai daun 2–9 helai dengan bentuk bundar memanjang, berwarna hijau atau coklat keunguan terang sampai gelap (Sidik et al. 1995). Sebagai tanaman monokotil,
temulawak tidak memiliki akar tunggang. Akar yang dimiliki adalah rimpang. Akar rimpang temulawak terbentuk dengan sempurna, bercabang-cabang kuat. (Afifah 2003). Rimpang temulawak sering disebut umbi temulawak. Umbi batang temulawak berbentuk bulat telur sebesar telur ayam namun terkadang ada yang lebih besar (Gambar 1b). Umbi batang ini dinamakan rimpang yang penampang pinggirnya berwarna kuning muda, sedangkan bagian dalamnya berwarna kuning tua, aromanya tajam dan rasanya pahit (Darwis 1991).
Kandungan kimia rimpang temulawak sebagai sumber bahan pangan, bahan baku industri atau bahan baku obat dapat dibedakan atas beberapa senyawa, yaitu pati, kurkuminoid, dan fraksi minyak atsiri (Sidik
et al. 1995). Kadar seluruh fraksi kandungan bioaktif pada temulawak tersebut bervariasi diantaranya pati (48 - 59.64%), kurkuminoid (1.6 - 2.2%), dan minyak atsiri (1.48 - 1.63%) (Sidik et al. 1995). Rimpang temulawak telah digunakan oleh nenek moyang bangsa Indonesia untuk makanan, tujuan pengobatan, dan sebagai penambah energi
Tanaman temulawak merupakan satu dari beberapa jenis Curcuma yang dikenal dan banyak dikonsumsi masyarakat. Tanaman temulawak memiliki kandungan flavonoid dan minyak atsiri yang berpotensi sebagai antioksidan (Rachman et al. 2008). Di Indonesia satu-satunya bagian yang dimanfaatkan adalah rimpang dari temulawak untuk dibuat jamu godog. Rimpang temulawak dipercaya dapat meningkatkan kerja ginjal serta antiinflamasi. Manfaat lain dari rimpang tanaman ini adalah sebagai obat jerawat, meningkatkan nafsu makan, antikolesterol, antiinflamasi, anemia, antioksidan, pencegah kanker, dan antimikroba (Rukmana 2008).
Gambar 1 Morfologi tanaman (a) dan rimpang temulawak (b)
3
Kunyit
Kunyit (Curcuma domestica Val.) merupakan salah satu tanaman rempah dan obat. Habitat asli tanaman kunyit meliputi wilayah Asia khususnya Asia Tenggara. Tumbuhan kunyit tergolong dalam kingdom Plantae, divisi Spermatophyta, sub divisi Angiospermae, kelas Monocotyledonae, ordo
Zingiberales, suku Zingiberaceae, genus
Curcuma dan spesies Curcuma xanthorrhiza
Val. Tanaman kunyit dapat hidup dengan baik pada suhu yang berkisar antara 20-300C dengan curah hujan 1500-2000 mm/tahun (Rukmana 2008). Tanaman kunyit memiliki daun besar berbentuk lonjong dengan ujung yang meruncing dan berwarna hijau (Gambar 2a). Tanaman kunyit tumbuh pada daerah dataran rendah hingga 2000 meter diatas permukaan laut dan memiliki tinggi kurang lebih 40-100 cm.
Sama halnya dengan tanaman temulawak, tanaman kunyit tidak memiliki akar tunggang karena merupakan tumbuhan monokotil. Tanaman kunyit memiliki akar berupa rimpang. Khasiat terbaik rimpang kunyit yang digunakan sebagai obat terdapat pada rimpang induk yang warna bagian dalamnya kemerahan dan masih segar (Gambar 2b). Rimpang kunyit banyak digunakan oleh masyarakat sebagai bagian dari rempah-rempah untuk berbagai masakan, obat, dan bahan kecantikan. Rimpang kunyit juga mengandung tepung dan zat warna yang mengandung alkaloid kurkumin sehingga memiliki manfaat untuk bahan obat tradisional serta bahan baku industri jamu dan kosmetik, dan bahan bumbu masak. Selain itu rimpang tanaman kunyit juga bermanfaat sebagai antiinflamasi, antioksidan, antimikroba, antidiabetes, pencegah kanker, dan antitumor (Syukur 2010).
Rimpang kunyit mengandung senyawa bioaktif yang berkhasiat sebagai obat yakni, senyawa kurkuminoid yang terdiri atas tiga senyawa yaitu: kurkumin, demetoksikurkumin dan bisdemetoksikurkumin. Beberapa kandungan senyawa lainnya dari rimpang kunyit adalah resin, oleoresin, dan minyak atsiri yang terdiri atas senyawa monoterpen,
dan sesquiterpen meliputi zingiberin, α
-tumeron, β-tumeron, tumerol, α-atlanton, dan linalool (Oomah 2000). Menurut Rustam et al.
(2007), kurkuminoid yang terkandung di dalam kunyit sebagai senyawa isolasi maupun kurkuminnya mempunyai aktivitas yang sangat luas, diantaranya sebagai antioksidan (Hudayani 2008).
Gambar 2 Morfologi tanaman (a) dan rimpang kunyit (b)
Kurkuminoid
Kurkuminoid merupakan senyawa golongan flavonoid. Peningkatan kadar kurkuminoid berhubungan dengan penurunan kadar protein. Kadar protein yang mengalami penurunan disebabkan karena protein diubah menjadi kurkuminoid pada rimpang yang akan digunakan untuk regenerasi. Pada umumnya metabolit sekunder akan meningkat apabila tanaman mengalami cekaman dari lingkungannya (Fatmawati 2008).
Kurkuminoid adalah komponen yang memberikan warna kuning pada rimpang temulawak dan kunyit. Kurkuminoid berwarna kuning atau kuning jingga, dan berbentuk serbuk dengan rasa pahit. Kurkuminoid larut dalam aseton, alkohol, asam asetat glasial, dan alkali hidroksida. Kurkuminoid tidak larut dalam air dan dietil eter. Kurkuminoid mempunyai aroma yang khas dan bersifat toksik (Sidik et al. 1995).
Senyawa kurkuminoid pada rimpang temulawak terdiri dari dua komponen senyawa kurkuminoid, yaitu kurkumin dan demetoksikurkumin. Lain halnya, dengan rimpang kunyit mengandung kurkuminoid yang terdiri dari tiga komponen senyawa turunan kurkuminoid, yaitu senyawa kurkumin, demetoksikurkumin, serta bisdemetoksikurkumin. Sifat menarik dari bisdemetoksikurkumin ini adalah aktivitas kerjanya tehadap sekresi empedu antagonis
a
5
antioksidan maksimal yang diperbolehkan dalam campuran makanan adalah sebesar 200 ppm (Hernani & Rahardjo 2005).
Uji Antioksidan 2,2 Difenil-1-Pikril-Hidrazil
Metode pengujian aktivitas antioksidan diklasifikasikan berdasarkan transfer atom hidrogen dan transfer elektron. Metode transfer elektron pengukurannya didasarkan pada kapasitas antioksidan dalam mereduksi senyawa oksidan yang ditandai dengan perubahan warna ketika direduksi. Terdapat beberapa metode untuk menentukan aktivitas antioksidan, diantaranya DPPH (2,2-difenil-1-pikrilhidrazil), Cupric Ion Reducing Antioxidant (CUPRAC) dan Ferric Reducing Ability of Plasma (FRAP) (Apak et al. 2007).
Reagen atau senyawa DPPH yang digunakan dalam pengujian ini ditemukan pertama kali pada tahun 1922 oleh Goldschmidt dan Renn (Ionita 2003). Senyawa DPPH adalah komponen berwarna ungu yang tidak berdimerisasi dan berbentuk kristalin. Senyawa tersebut adalah radikal bebas yang stabil karena serapan delokalisasi elektron pada seluruh molekul. Delokalisasi yang terjadi pada senyawa radikal bebas terjadi karena adanya warna violet tua dengan panjang gelombang maksimum.
Senyawa atau reagen DPPH merupakan senyawa yang tidak larut dalam air atau disebut dengan senyawa hidrofobik. Senyawa DPPH ini dapat berubah dari senyawa hidrofobik ke hidrofilik dengan cara melekatkan gugus CO maupun SO2 pada
DPPH. Berdasarkan karakteristiknya yang merupakan senyawa radikal bebas yang stabil maka reagen ini dapat disimpan dalam jangka waktu yang lama tentunya pada kondisi penyimpanan yang baik seperti tempat kering (Ionita 2003).
Metode DPPH menggunakan reagen atau senyawa DPPH sebagai model radikal bebas. Selain sifat pengujiannya yang lebih sederhana, metode DPPH memiliki beberapa keunggulan lainnya, yaitu cepat, sensitif, dan hanya membutuhkan sedikit sampel (Apak et al. 2004). Penggunaan DPPH dalam pengujian antioksidan harus diperhatikan sifat DPPH terhadap pengaruh lingkungan penyimpanan. Pada penggunaan DPPH harus dilakukan secara hati-hati yang diinterpretasikan setelah direaksikan dengan senyawa antioksidan karena dapat didegradasi oleh cahaya, oksigen, pH, dan jenis pelarut. Metode DPPH dapat digunakan untuk screening berbagai
sampel dalam penentuan aktivitas antioksidannya (Molyneux 2004).
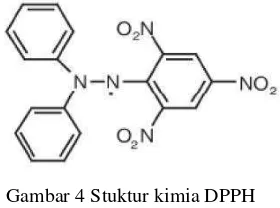
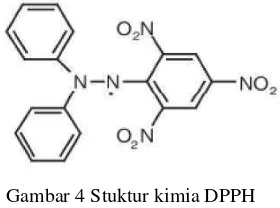
Pengukuran aktivitas antioksidan dengan metode DPPH menggunakan prinsip spektrofotometri. Prinsip metode uji antioksidan DPPH didasarkan pada reaksi penangkapan hidrogen oleh reagen atau senyawa DPPH (Gambar 4) dari senyawa antioksidan. Senyawa yang aktif sebagai antioksidan mereduksi radikal bebas DPPH menjadi senyawa difenil pikril hidrazin (Amic
et al. 2003). Reaksi yang terjadi ialah DPPH akan diubah menjadi DPPH-H (bentuk tereduksi DPPH) oleh senyawa antioksidan. Reduksi DPPH menjadi DPPH-H menyebabkan perubahan warna pada reagen DPPH dari warna semula ungu menjadi kuning (Lupea et al. 2006).
Metode DPPH dapat memberikan informasi mengenai reaktifitas senyawa yang diuji dengan suatu radikal yang stabil. Penangkapan radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan perubahan warna yang sebanding dengan jumlah elektron yang diambil. DPPH hanya dapat mengukur senyawa antioksidan yang terlarut dalam pelarut organik. Pengukuran absorbansi DPPH dapat dilakukan pada kisaran panjang gelombang 515-520 nm (Molyneux 2004).
Gambar 4 Stuktur kimia DPPH (Kikuzaki et al. 2002)
Inflamasi
Inflamasi adalah respon protektif tubuh karena adanya cedera jaringan dan infeksi yang terjadi pada tubuh serta reaksi antara antigen dan antibodi. Antibodi merupakan sistem pertahanan tubuh terhadap bakteri, virus, dan sel-sel asing lainnya yang dilakukan oleh sel darah putih. Sel antibodi akan menghadapi sel antibodi yang telah berubah menjadi antigen dan akan menyerang sendi serta organ eksternal lainnya, peristiwa tersebut dapat menyebabkan terjadinya inflamasi (Darlina & Wahyuni 2004).
(tumor), nyeri (dolor), dan akhirnya menyebabkan gangguan fungsi (fungtio lasea)
(Hakim 2005). Penyebab inflamasi atau cedera jaringan antara lain karena pengaruh bahan kimia, mekanis atau fisika, seperti trauma radiasi, panas, benda asing serta trauma biologis seperti bakteri, fungi atau parasit. Proses inflamasi merupakan suatu mekanisme perlindungan dimana tubuh berusaha untuk menetralisir dan membasmi agen-agen yang berbahaya pada tempat cedera serta mempersiapkan keadaan untuk perbaikan jaringan (Mitchell 2006).
Adanya pencederaan jaringan akan membebaskan berbagai jenis mediator inflamasi, seperti prostaglandin, bradikinin, histamin, dan sebagainya. Salah satu mediator inflamasi yaitu prostaglandin merupakan kelompok senyawa turunan asam lemak prostanoat (C20). Asam arakidonat merupakan
zat terpenting untuk mensintesis prostaglandin pada manusia (Kartasasmita 2002).
Prostaglandin adalah senyawa lipida yang dibangun oleh 20 atom karbon sebagai pembentuk rantai utamanya dengan mengandung gugus hidroksil (-OH) pada strukturnya. Prostaglandin dihasilkan oleh jaringan yang sedang terluka atau sakit yang disintesis dari asam lemak arakidonat. Prostaglandin berperan penting terhadap timbulnya nyeri, demam, dan reaksi-reaksi inflamasi lainnya maka obat antiinflamasi berbasis non steroid melalui penghambatan (inhibisi) aktivitas enzim siklooksigenase mampu menekan gejala-gejala tersebut. Obat antiinflamasi non steroid dengan cara menghambat biosintesis prostaglandin melalui penghambatan (inhibisi) aktivitas enzim siklooksigenase (Dannhardt & Laufer 2000).
Saat ini dikenal dua isoenzim COX (Siklooksigenase), yaitu COX-1 dan COX-2. Enzim COX-1 berfungsi sebagai enzim
constitutive yaitu mengubah PGH2 menjadi berbagai jenis prostaglandin (PGI2, PGE2) dan tromboxan yang dibutuhkan dalam fungsi homeostatis. Enzim COX-2 yang terdapat di dalam sel-sel imun (makrofag dan lainnya), sel endotel pembuluh darah, dan fibroblas sinovial sangat mudah diinduksi oleh berbagai mekanisme sehingga akan mengubah PGH2 menjadi PGE2 yang berperan dalam proses inflamasi, yaitu nyeri dan demam. Oleh karena itu, COX-2 dikenal sebagai enzim
inducible. Pada kenyataannya, baik COX-1 dan COX-2 adalah isoenzim yang dapat diinduksi (Lelo 2001).
Enzim COX-1 mengkatalisis pembentukan prostaglandin baik yang bertanggung jawab
untuk menjalankan fungsi-fungsi regulasi fisiologis (Dannhardt & Laufer 2000). Sebaliknya, enzim COX-2 tidak ditemukan di jaringan pada kondisi normal, tetapi diinduksi oleh berbagai stimulus, seperti endotoksin, sitokin, mitogen, dan dihubungkan dengan produksi prostaglandin selama proses inflamasi, nyeri, dan respon piretik (Zhang et al. 2004). Enzim COX-2 dapat diinduksi apabila terdapat stimuli radang, mitogenesis atau onkogenesis (Dannhardt & Laufer 2000). Menurut Danhardt & Laufer (2000), inflamasi tidak akan terlepas dari adanya senyawa prostaglandin. Mekanisme inflamasi yang terjadi di dalam tubuh bermula pada membran sel atau jaringan yang mengalami sakit atau terluka. Enzim fosfolipase dalam tubuh dari membran sel menghasilkan asam arakidonat yang nantinya akan melalui dua jalur tahapan yaitu siklooksigenase dan lipoksigenase. Pada jalur siklooksigenase, akan terbentuk endoperoksida sedangkan pada jalur lipoksigenase terbentuk asam hidroperoksida. Setelah proses stimulasi, dua enzim siklooksigenase mulai mensintesis pembentukan modulator peradangan seperti halnya enzim COX-2 mengkatalisis pembentukan prostaglandin jahat yang menyebabkan radang (Dannhardt & Laufer 2000).
High Performance Liquid Chromatography
Kromatografi adalah suatu teknik pemisahan molekul berdasarkan perbedaan pola pergerakan antara fase gerak dan fase diam untuk memisahkan komponen yang ada pada larutan sampel. Komponen-komponen tersebut dipisahkan berdasarkan perbedaan sifat fisiknya. Salah satu jenis kromatografi adalah High Performance Liquid Chromatography (HPLC) yang merupakan teknik kromatografi dengan fase gerak berupa cairan (Harvey 2000). Kromatografi cair kinerja tinggi dikembangkan pada pertengahan tahun 1970-an.
7
Selanjutnya, sampel akan keluar kolom dan dideteksi oleh detektor kemudian direkam dalam pengolah data dalam bentuk kromatogram (Gambar 5) (Meyer 2004). Seperti pada kromatografi gas, jumlah peak
yang muncul menyatakan konsentrasi komponen dalam campuran. Sistem komputerisasi digunakan untuk mengontrol kerja sistem HPLC dan mengumpulkan serta mengolah data hasil pengukuran HPLC.
Prinsip dasar HPLC adalah pemisahan analit berdasarkan kepolarannya, dengan fase diam berupa kolom dan larutan tertentu sebagai fase geraknya. Teknik HPLC digunakan untuk memisahkan senyawa-senyawa yang tidak mudah menguap tetapi mudah terurai oleh panas. HPLC digunakan untuk memisahkan golongan minyak, misalnya terpenoid tinggi, segala senyawa jenis fenol, alkaloid, lipid dan gula. Selain untuk pemisahan, metode ini juga digunakan untuk analisis kualitatif maupun kuantitatf seperti penentuan kadar kurkuminoid. Keuntungan menggunakan HPLC adalah jumlah contoh yang digunakan sedikit (mikroliter), waktu retensi hanya beberapa menit, dan batas deteksi sampai nanogram/liter (Hendayana et al. 1994).
Gambar 5 Diagram alir HPLC
BAHAN DAN METODE Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah rimpang temulawak dan kunyit asal Sukabumi, etanol 70 %, metanol, standar kurkuminoid (kurkumin, demetoksikurkumin, bisdemetoksikurkumin), DPPH (2,2 difenil-1-pikril hidrazil), DMSO
(Dimethyl Sulfoxyde), kit colorimetric COX inhibitor screenin assay No. 560131 (Cayman Chem Com 2011), UltraPure water, aluminium foil.
Alat yang digunakan dalam penelitian ini, diantaranya gelas piala, gelas ukur, tabung reaksi, gelas arloji, labu takar, cawan petri, sudip, spatula, pipet mikro, tip, vortex, micro plate, oven, rotavapor, penggiling 100 mesh,
freezer, neraca digital, dan micro platereader.
Metode Penelitian Persiapan Sampel
Sampel basah terdiri atas 20 kg rimpang temulawak dan 20 kg rimpang kunyit. Masing-masing sampel dibersihkan dan dicuci menggunakan air mengalir sampai semua tanah dan kotoran yang menempel pada simplisia hilang. Semua simplisia yang telah bersih dipotong, selanjutnya dikeringkan di bawah sinar matahari selama 5 hari. Kemudian setiap simplisia kasar dari masing-masing sampel digiling dengan ukuran 100 mesh. Ukuran serbuk simplisia masing-masing sampel yang digunakan adalah 100 mesh (telah menjadi simplisia kering dengan
kadar air ≤ 10%).
Penentuan Kadar Air (AOAC 2006)
Cawan porselen kosong dikeringkan pada suhu 1050C selama 30 menit di dalam oven. Cawan porselen tersebut selanjutnya didinginkan di dalam eksikator dan ditimbang sebagai bobot kosong cawan. Sebanyak 2 gram simplisia dimasukkan ke dalam cawan dan dikeringkan pada suhu 1050C selama 3 jam. Setelah itu, cawan yang berisi simplisia didinginkan dalam eksikator dan ditimbang kembali sebagai bobot kering sampel. Perlakuan dilakukan sebanyak tiga kali ulangan.
Ekstraksi Sampel Rimpang (BPOM 2005)
Pada teknik maserasi menggunakan pelarut etanol 70% dengan perbandingan simplisia dengan pelarut (b/v) adalah 1:10. Sebanyak 0,5 kg simplisia dan 5 L etanol 70% dimasukkan ke dalam maserator dan direndam sambil sesekali diaduk, kemudian didiamkan sampai 24 jam. Selanjutnya, maserat dipisahkan dengan menyaring filtrat dengan menggunakan kertas saring Whatman tipe 4. Semua maserat dikumpulkan dan diuapkan dengan rotavapor penguap vakum (BUCHI, R-250, Switzerland) pada suhu 500C hingga diperoleh ekstrak kental. Ekstrak simplisia Wadah fase gerak
yang telah pekat siap digunakan untuk penelitian selanjutnya.
Analisis Kadar Komponen Bioaktif Temulawak Menggunakan HPLC (Jayaprakasha et al. 2002)
Sebanyak 25 mg ekstrak rimpang temulawak dan kunyit ditimbang dan dilarutkan ke dalam 5 ml metanol. Larutan disaring dengan kertas saring yang berukuran 0,45 μm dan ditempatkan pada vial HPLC.
Sebanyak 10 μL dari larutan ekstrak sampel temulawak dan kunyit yang berasal dari Sukabumi diinjeksikan ke dalam kolom HPLC. Senyawa standar kurkuminoid yang digunakan memiliki konsentrasi sebesar 0,5 ppm. Kondisi HPLC untuk analisis ini digunakan jenis kolom C18 detektor UV Vis
dengan volume injeksi 10 μl, elusi gradien dan suhu kolom yang digunakan yaitu pada 480 C. Analisis kadar kurkuminoid dengan HPLC menggunakan fase gerak polar yaitu metanol.
Analisis Aktivitas Antioksidan dengan Metode DPPH (Udenigwe et al. 2009)
Ekstrak kental dari sampel temulawak dan kunyit Sukabumi dari hasil maserasi dilarutkan dengan metanol dan dimasukkan ke dalam tabung reaksi. Modifikasi metode dilakukan dengan mengubah konsentrasi ekstrak yang digunakan untuk analisis yaitu 12,5, 25, 50, 100, 200 ppm. Larutan induk untuk masing-masing sampel temulawak dan kunyit Sukabumi yaitu 200 ppm dibuat dengan menimbang 1 mg sampel dan ditambahkan dengan 5 ml metanol. Pembuatan larutan DPPH dilakukan dengan menimbang 1,23 mg DPPH kemudian diencerkan dengan metanol hingga 25 ml menggunakan labu takar. Larutan sampel dengan konsentrasi 12,5 ppm, 25 ppm, 50 ppm, 100 ppm dan 200 ppm dimasukkan ke dalam masing-masing sumur (well plate) dan dilakukan masing-masing tiga kali ulangan
sebanyak 100 μL setiap sampel dengan masing-masing konsentrasi tersebut.
Pada masing-masing sumur ditambahkan
100 μL larutan DPPH 0,1 μM hingga volume
akhir yang terdapat pada sumur yaitu 200 μL.
Selanjutnya, diinkubasi pada suhu 370C selama 30 menit dan diukur serapannya menggunakan ELISA reader dengan panjang gelombang 517 nm. Nilai absorbansi yang diperoleh selanjutnya digunakan untuk mendapatkan persen penangkapan radikal bebas dan digunakan untuk mendapatkan
persamaan regresi linier dengan rumus yaitu y = a + b ln x. Nilai IC50 dihitung dengan
menggunakan rumus persamaan regresi tersebut (Lampiran 11). Nilai IC50 yang paling
rendah menunjukkan aktivitas antioksidan yang paling tinggi.
Uji Daya Inhibisi Ekstrak Etanol Rimpang Temulawak dan Kunyit Sukabumi terhadap Enzim COX-2 Secara In Vitro (Cayman Chemical Catalog No. 560131).
Ekstrak diuji daya inhibisinya terhadap enzim COX-2. Uji daya inhibisi dilakukan dengan metode ELISA (Enzym Linked Immunosorbent Assay), dengan menggunakan
COX Inhibitor Screening Assay Kit (Cayman Chemical Catalog No. 560131) ) (Lampiran 4). Uji daya ekstrak etanol rimpang temulawak dan kunyit dilakukan pada micro plate yang telah disiapkan (Gambar 6). Selajutnya hasil reaksi inhibisi antara sampel rimpang temulawak dan kunyit Sukabumi terhadap enzim COX-2 dibaca serapannya menggunakan ELISA reader.
Preparasi larutan-larutan yang digunakan pada uji aktivitas enzim COX-2 dapat dilihat
pada Lampiran 4. Sebanyak 100 μl buffer Enzym ImmunoAssay (EIA) dimasukkan pada sumur Non Spesific Binding (NSB).
Kemudian 50 μl buffer EIA pada sumur B0.
Larutan standar prostaglandin diisi ke dalam sumur S8-S1. Sumur BC diisi dengan 50 μl larutan background, sebanyak 50 μl larutan
aktivitas awal COX-2 dengan pengenceran 2.000 kali pada sumur (%), selanjutnya pada sumur inhibitor COX-2 diisi dengan larutan ekstrak etanol rimpang temulawak dan kunyit yang telah diencerkan 2.000 kali. Tahap berikutnya, setiap sumur ditambahkan prostaglandin asetilkolinesterase (PG AchE
tracer) kecuali pada sumur Total Activity
(TA) dan Blk (Blanko), setiap sumur
ditambahkan 50 μl antiserum prostaglandin
kecuali sumur TA dan NSB kemudian plat ditutup dan diinkubasi selama 18 jam pada suhu ruang.
Setelah plate diinkubasi, plate dicuci dengan larutan penyangga pencuci, kemudian setiap sumur ditambahkan dengan pereaksi Ellman sebanyak 0,2 ml dan sumur TA diisi dengan larutan PG AchE tracer atau
prostaglandin asetilkolinesterase (tracer) sebanyak 5 μl. Micro plate ditutup menggunakan plastik film dan dibiarkan bereaksi dengan diikubasi pada ruang gelap selama 60-90 menit lalu diukur menggunakan
9
nm. Persiapan larutan untuk uji dapat dilihat pada Lampiran 4 yang sesuai dengan Cayman Chemical Catalog No. 560131). Aktivitas antiinflamasi diperoleh dengan perhitungan absorbansi.
1 2 3 4 5 A Blk S1 S1 BC2 BC2 B Blk S2 S2 % % C NSB S3 S3 % % D NSB S4 S4 H H E B0 S5 S5 H H
F B0 S6 S6 - -
G B0 S7 S7 - -
H TA S8 S8 - -
Gambar 6 Format Micro plate inhibisi COX-2
Keterangan gambar Blk : blanko TA : aktivitas total NSB : non specific binding
B0 : maksimum binding
S1-S8 : standar 1-8
BC2 : background COX-2
% : 100% initial activity samples
H : COX inhibitor samples
Penentuan IC50 (Udenigwe et al. 2009) Inhibition concentration 50 atau IC50
merupakan nilai konsentrasi minimal ekstrak yang dapat menginhibisi enzim sampai 50%. Nilai IC50 diperoleh dari masing-masing kurva
ekstrak sampel dengan memasukkan nilai Y=50.
Y = a + bx (fungsi linier)
Y = ax2 + bx +c (fungsi kuadratik) Y = a + b ln (x) (fungsi ln) Keterangan:
a dan b = konstanta x = IC50
Dipilih satu persamaan yang paling sesuai untuk masing-masing sampel dengan melihat nilai r2 tertinggi yang diperoleh.
HASIL DAN PEMBAHASAN Ekstrak Rimpang Temulawak dan Kunyit
Ekstraksi serbuk rimpang temulawak dilakukan dengan menggunakan metode maserasi. Pelarut yang digunakan dalam proses maserasi adalah etanol 70%. Penggunaan etanol sebagai pelarut disebabkan beberapa hal di antaranya, kepolaran, toksisitas, dan mudah diperoleh. Sifat dari pelarut etanol yang tidak beracun
menyebabkan etanol ditetapkan standar sebagai pelarut yang aman oleh Badan Pengawas Obat dan Makanan (BPOM).
Etanol 70% digunakan karena memiliki dua gugus fungsi yang berbeda tingkat kepolarannya, yaitu gugus hidroksil (OH) yang bersifat polar dan gugus alkil (-R) yang bersifat non polar. Adanya kedua gugus tersebut diharapkan agar senyawa-senyawa kimia dengan tingkat kepolaran yang berbeda dalam simplisia sampel akan terekstrak ke dalam etanol (Khopkar 2003). Seperti halnya, kurkuminoid merupakan senyawa yang bersifat polar, kepolarannya disebabkan oleh gugus –OH yang terdapat pada struktur senyawa kurkuminoid. Kurkuminoid larut dalam pelarut-pelarut yang mempunyai kepolaran hampir sama. Etanol memiliki kepolaran yang mirip dengan kurkuminoid sehingga cocok digunakan sebagai pelarut dalam proses ekstraksi rimpang temulawak dan kunyit.
Metode maserasi dilakukan selama 3 x 24 jam. Menurut hasil penelitian yang dilakukan Basalmah (2006) rendemen yang dihasilkan dari suatu proses ekstraksi akan meningkat seiring dengan peningkatan waktu ektraksi. Hal ini disebabkan semakin lama waktu ekstraksi, semakin lama waktu kontak antara pelarut dan bahan baku sehingga proses penetrasi pelarut ke dalam sel bahan (sampel) akan semakin baik yang menyebabkan semakin banyaknya senyawa yang berdifusi keluar sel.
Rendemen ekstrak rata-rata dari 3 kali ulangan yang dilakukan diperoleh hasil dari penelitian ini yakni rendemen temulawak sebesar 11,78% dan kunyit 15,65% (Tabel 1). Berdasarkan hasil tersebut, rimpang kunyit (C. domesticae) memiliki persentase rendemen lebih tinggi dibandingkan temulawak. Rendemen ekstrak rimpang temulawak dan kunyit dari hasil penelitian ini lebih kecil jika dibandingkan dengan hasil yang diperoleh Suwiah (1991), yakni sebesar 21.81-66.74%. Hal ini disebabkan karena beberapa hal diantaranya ukuran serbuk, suhu, dan kecepatan pengadukan yang digunakan berbeda. Suwiah (1991) melakukan ekstraksi dengan ukuran serbuk yang digunakan 60 mesh, suhu 70 oC dan kecepatan pengadukan dengan pengaduk magnet skala 7, sedangkan pada penelitian ini ukuran butir 100 mesh, suhu 50 oC, dan pengadukan yang hanya dilakukan sesekali.
0 10 20 30 40 50 60 70
C. xanthorrhiza C. domestica
Kan d u n g an k u rk u m in o id ( m g /g )
didih sekitar 78 °C dan bersifat volatil meskipun pada suhu ruang sehingga perlakuan suhu yang terlalu tinggi dapat mengakibatkan penguapan pelarut yang lebih besar dan dapat merusak senyawa yang tidak tahan panas.
Perbedaan jumlah rendemen pada ekstrak sampel temulawak dan kunyit dikarenakan pada ekstrak dengan rendemen tertinggi mengandung lebih banyak senyawa yang mudah larut dalam pelarut etanol 70%, sedangkan ekstrak dengan rendemen yang lebih rendah mengandung sejumlah senyawa yang kurang larut dalam pelarut etanol 70%.
Pada penelitian ini rimpang temulawak dan kunyit yang digunakan adalah rimpang dari tanaman temulawak dan kunyit yang berumur kurang lebih 9 bulan. Menurut Wahid & Sudiarto (1985), mutu rimpang temulawak sangat tergantung pada umur, tempat tumbuh, dan jenis tanah. Umumnya pada tanaman berimpang, peningkatan karbohidrat terus meningkat secara cepat, kemudian makin lambat dengan bertambahnya umur tanaman tersebut. Panen rimpang dapat dilakukan pada saat kandungan karbohidrat tinggi, yaitu pada umur 9-10 bulan, ukuran rimpang sudah optimal dengan warna kuning kecoklatan (Rahmat 1995).
Tabel 1 Persentase rendemen ekstrak temulawak dan kunyit Sukabumi
Jenis sampel Rendemen rata-rata (%) Temulawak 11.78
Kunyit 15.65
Kadar Kurkuminoid Ekstrak Rimpang Temulawak dan Kunyit
Senyawa kurkuminoid umumnya terdapat pada tanaman jenis Curcuma dan telah dilaporkan memiliki aktivitas biologis seperti antioksidan dan antiinflamasi (Itokawa et al.
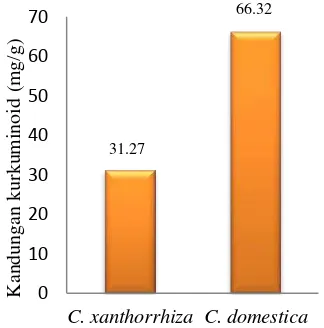
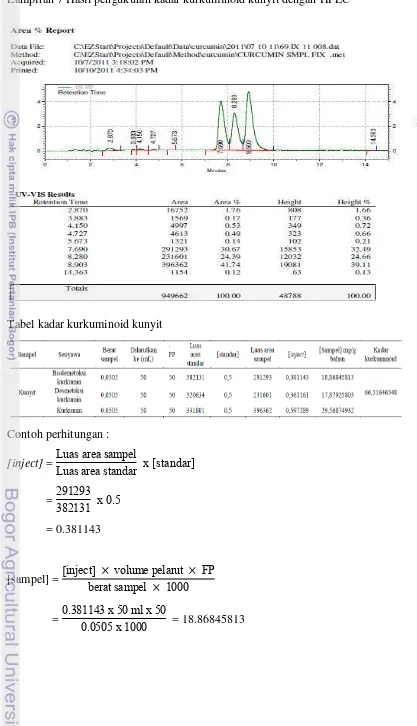
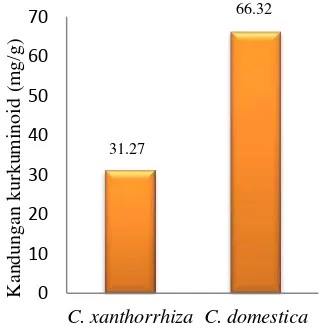
2008) Penetapan kadar kurkuminoid pada temulawak dan kunyit Sukabumi dilakukan dengan menggunakan High Performance Liquid Chromatography (HPLC). Hasil yang diperoleh menunjukkan bahwa konsentrasi kurkuminoid pada ekstrak etanol rimpang temulawak lebih rendah dari rimpang kunyit. Kadar kurkuminoid pada ekstrak etanol temulawak adalah sebesar 31.27 mg/g sedangkan kadar kurkuminoid pada ekstrak etanol kunyit yaitu sebesar 66.32 mg/g. Jadi, kadar kurkuminoid pada kunyit lebih tinggi dibandingkan temulawak (Gambar 7).
Kadar kurkuminoid yang lebih tinggi pada rimpang kunyit dibandingkan temulawak dikarenakan perbedaaan jumlah kandungan senyawa turunan kurkuminoid pada kunyit dan temulawak. Menurut Hernani & Rahardjo (2005), kadar senyawa kurkuminoid dalam rimpang temulawak yang terdiri dari kurkumin yaitu 21.75 mg/g bahan dan demetoksikurkumin yaitu 9.93 mg/g bahan. Lain halnya dengan rimpang kunyit, yaitu kurkumin sebesar 29.57 mg/g bahan, (Bermawie et al. 2006), demetoksikurkumin 17.88 mg/g bahan, dan bisdemetoksikurkumin 18.87 mg/g bahan. (Wardiyati et al. 2008).
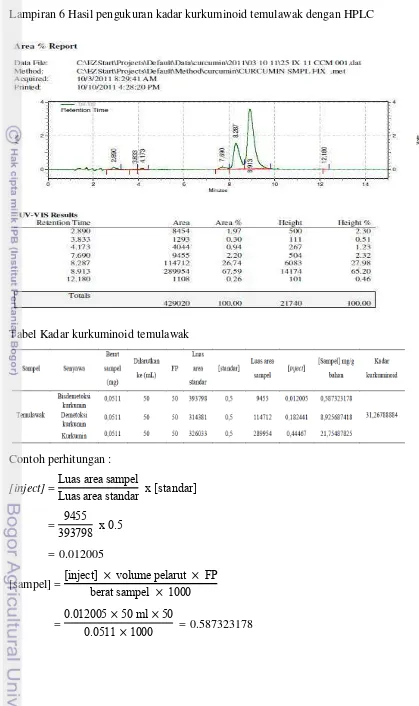
Berdasarkan hasil analisis kandungan kurkuminoid dengan HPLC untuk kunyit dan temulawak terlihat pada Lampiran 6 & 7 terlihat perbedaan kandungan senyawa turunan kurkuminoid yang sangat mencolok pada temulawak dan kunyit yaitu senyawa bisdemetoksikurkumin pada temulawak hanya sebesar 0,58 mg/g sedangkan pada kunyit 18,86 mg/g. Pada umumnya kunyit mengandung senyawa turunan kurkuminoid berupa senyawa kurkumin, senyawa demetoksikurkumin, dan senyawa bisdemetoksikurkumin sedangkan pada temulawak hanya mengandung senyawa kurkumin dan senyawa demetoksikurkumin (Lechtenberg et al. 2004) (Gambar 8). Namun pada beberapa jenis rimpang temulawak ditemukan senyawa bisdemetoksikurkumin dalam jumlah yang kecil. Hal ini dipengaruhi sifat genetis dan kondisi lingkungan dari rimpang temulawak. Pada dasarnya, untuk pembentukan metabolit sekunder dipengaruhi oleh sifat dan jenis tanaman yaitu adanya sifat-sifat genetik bawaan yang dimiliki oleh suatu spesies baik antara spesies yang sama maupun spesies yang berbeda.
Gambar 7 Kadar kurkuminoid ekstrak etanol temulawak dan kunyit
31.27
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
12.5 25 50 100 200
P en g u k u ran ab so rb an si p ad a 5 1 7 n m C. xanthorrhiza C. domestica
Gambar 11 Hasil uji antioksidan ekstrak temulawak dan kunyit
Artinya, konsentrasi sampel yang semakin tinggi memiliki aktivitas antioksidan yang semakin tinggi pula sehingga mampu menghambat radikal bebas lebih banyak. Peghambatan radikal bebas ini ditandai dengan peluruhan warna warna ungu. Penurunan nilai absorban karena yang diukur oleh micro plate reader adalah warna ungu DPPH yang semakin pudar seiring dengan meningkatnya konsentrasi sampel.
Hal ini disebabkan satu molekul dari senyawa antioksidan disumbangkan kepada senyawa DPPH dan mekanisme ini dibuktikan dengan perubahan warna DPPH (Naik et al.
2003). Perubahan warna DPPH diukur pada panjang gelombang 517 nm dengan menggunakan ELISA reader. Pemilihan panjang gelombang 517 nm disebabkan warna ungu larutan DPPH memiliki serapan yang kuat pada panjang gelombang 517 nm dalam bentuk teroksidasi (Masuda et al. 1999).
Perbedaan aktivitas antioksidan pada temulawak dan kunyit disebabkan adanya perbedaan kadar senyawa kurkuminoid yang terkandung pada temulawak dan kunyit. Dari keseluruhan komponen senyawa bioaktif yang dimiliki temulawak dan kunyit, senyawa kurkuminoid memiliki peran yang sangat besar terhadap akvitas antioksidan pada kedua rimpang ini (Timmerman 1995). Pada kunyit, memiliki 3 jenis senyawa turunan dari kurkuminoid yaitu senyawa kurkumin, senyawa demetoksikurkumin, dan senyawa bisdemetoksikurkumin. Ketiga senyawa tersebut memiliki aktivitas tinggi sebagai antioksidan dan kadarnya dalam kunyit pun tinggi.
Lain halnya, dengan temulawak yang hanya mengandung senyawa kurkumin dan senyawa demetoksikurkumin serta senyawa
bisdemetoksikurkumin dalam kadar yang kecil. Namun, besarnya aktivitas antioksidan pada temulawak juga disebabkan ada senyawa bioaktif lain yang terkandung pada rimpang temulawak. Masuda et al. (1992) berhasil mengisolasi analog kurkumin baru dari rimpang temulawak, yaitu: 1-(4-hidroksi-3,5- dimetoksifenil)-7-(4 hidroksi-3-metoksifenil)-(1E.6E.)-1,6-heptadien-3,4-dion. Senyawa tersebut ternyata menunjukkan efek antioksidan.
Nilai IC50 rimpang temulawak dan kunyit
sesuai dengan syarat aktivitas antioksidan yang baik karena berbagai senyawa bioaktif yang terkandung. Nilai IC50 sebagai aktivitas
antioksidan dari rimpang temulawak dan kunyit adalah suatu konsentrasi sampel kedua rimpang yang dibutuhkan untuk menghambat aktivitas radikal bebas (serapan radikal bebas) sebanyak 50 % (Molyneux 2004). Hal ini sangat penting diketahui untuk berbagai pengembangan produk berbasis antioksidan.
Aktivitas Antiinflamasi Ekstrak Rimpang Temulawak dan Kunyit
Aktivitas antiinflamasi pada temulawak dan kunyit diukur dengan menggunakan metode COX Inhibitor Screening Assay Kit (Cayman Chemical Catalog No. 56013).
Aktivitas antiinflamasi dapat diketahui dengan besarnya nilai % inhibisi sampel temulawak dan kunyit terhadap aktivitas enzim Siklooksigenase-2 (COX-2). Penghambatan enzim COX-2 untuk mengetahui aktivitas antiinflamasi suatu bahan (sampel) disebabkan ezim COX-2 memiliki peranan penting dalam mensintesis prostaglandin yang berperan penting dalam proses peradangan (Dannhardt & Laufer 2000).
13
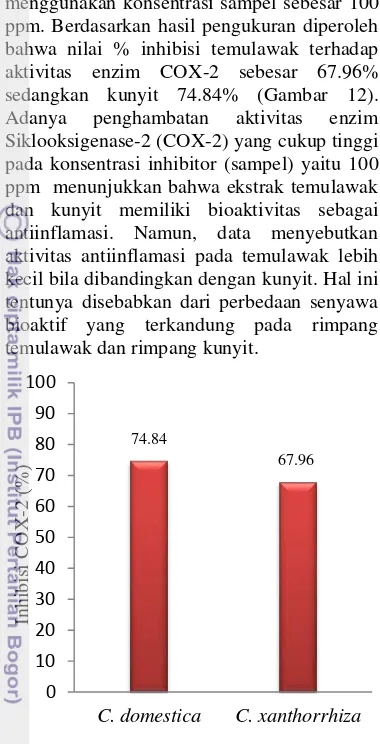
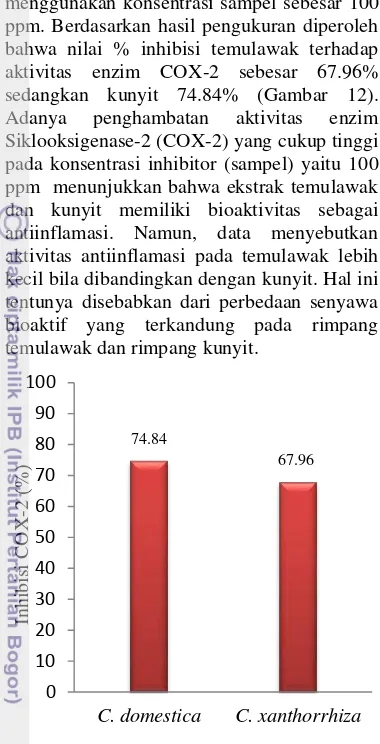
Aktivitas penghambatan enzim COX-2 menggunakan konsentrasi sampel sebesar 100 ppm. Berdasarkan hasil pengukuran diperoleh bahwa nilai % inhibisi temulawak terhadap aktivitas enzim COX-2 sebesar 67.96% sedangkan kunyit 74.84% (Gambar 12). Adanya penghambatan aktivitas enzim Siklooksigenase-2 (COX-2) yang cukup tinggi pada konsentrasi inhibitor (sampel) yaitu 100 ppm menunjukkan bahwa ekstrak temulawak dan kunyit memiliki bioaktivitas sebagai antiinflamasi. Namun, data menyebutkan aktivitas antiinflamasi pada temulawak lebih kecil bila dibandingkan dengan kunyit. Hal ini tentunya disebabkan dari perbedaan senyawa bioaktif yang terkandung pada rimpang temulawak dan rimpang kunyit.
Gambar 12 Penghambatan COX-2 oleh temulawak dan kunyit
Perbedaan nilai % inhibisi dari aktivitas antiinflamasi pada temulawak dan kunyit disebabkan kadar kurkuminoid yang berbeda pada kedua rimpang. Berdasarkan hasil pengujian kadar kurkuminoid dengan HPLC
(High Performance Liquid Chromatography)
diperoleh bahwa kadar kurkuminoid pada kunyit jauh lebih tinggi dari temulawak yaitu 66.32 mg/g dan 31.27 mg/g. Hal inilah yang menyebabkan perbedaan aktivitas antiinflamasi pada kedua sampel karena pada dasarnya yang berperan sebagai senyawa bioaktif untuk antiinflamasi ialah senyawa kurkuminoid.
Timmerman (1995) melaporkan kurkuminoid memiliki aktivitas ynag tinggi terhadap penghambatan aktivitas enzim siklooksigenase. Sama halnya dengan aktivitas antioksidan temulawak dan kunyit, pada aktivitas antiinflamasi ini nilai % inhibisi dipengaruhi oleh senyawa turunan
kurkuminoid yang terkandung pada kedua rimpang ini. Kunyit mengandung kurkumin, demetoksikurkumin serta senyawa bisdemetoksikurkumin dengan kadar yang tinggi sedangkan temulawak hanya mengandung kurkumin, demetoksikurkumin serta senyawa bisdemetoksikurkumin dalam kadar yang rendah.
Pada temulawak, selain kurkuminoid juga terkandung senyawa yang sangat berkhasiat yaitu xanthorrhizol yang merupakan salah satu jenis minyak atsiri. Rahardjo (2010) menyebutkan bahwa minyak atsiri dari temulawak (Curcuma xanthorrhiza Roxb.)
secara in vitro memiliki daya antiinflamasi yang lemah. Sementara, Ozaki (1990) melaporkan bahwa efek antiinflamasi yang dimiliki temulawak disebabkan adanya germakron. Selanjutnya, Claeson et al. (1993) berhasil mengisolasi tiga jenis senyawa non fenolik diarylheptanoid dari ekstrak temulawak, yaitu trans-trans-1,7-difenil-1,3, - heptadien - 4 –on (alnuston) ; trans1,7-difenil-1-hepten-5-ol, dan trans, trans – 1,7-difenil- 1,3 – heptadien 5-ol. Senyawa tersebut telah diuji dan terbukti mempunyai efek antiinflamasi terhadap tikus percobaan.
SIMPULAN DAN SARAN Simpulan
Berdasarkan hasil pengujian yang telah dilakukan, diperoleh bahwa rimpang kunyit memiliki bioaktivitas lebih tinggi dari rimpang temulawak. Kadar kurkuminoid pada rimpang kunyit dari hasil pengukuran dengan HPLC ialah 66.32 mg/g sedangkan rimpang temulawak 31.27 mg/g. Uji aktivitas antioksidan diperoleh bahwa rimpang kunyit memiliki nilai IC50 sebesar 73.31 μg/mL dan
temulawak 81.99 μg/mL. Aktivitas antiinflamasi didasarkan pada nilai % inhibisi kedua ekstrak untuk enzim COX-2, nilai % inhibisi sampel kunyit sebesar 74.84% sedangkan temulawak bernilai 67.96%.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui secara spesifik efek yang ditimbulkan mengenai aktivitas antioksidan, antiinflamasi dan manfaat kurkuminoid kunyit serta temulawak di dalam tubuh yang diuji in vivo. Hal ini dilakukan untuk memahami reaksi yang terjadi dalam sistem organ tubuh sehingga dapat dilakukan analisis mendalam untuk aplikasinya di masyarakat.
0 10 20 30 40 50 60 70 80 90 100
C. domestica C. xanthorrhiza
DAFTAR PUSTAKA
[AOAC]. 2006. Official Methods of Analysis of The Association of Official Analytical Chemist. Washington DC: Association of Official Analytical Chemist.
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2005.
Gerakan Nasional Minum Temulawak.
Jakarta : BPOM RI.
Afifah E. 2003. Khasiat dan Manfaat Temulawak. Jakarta: Agromedia Pustaka. Agnam N, Samhoedi H, Timmerman H, Venie
UA, Sugiyanto, Goot H. 1995. The relationship between structure and inhibition of lipoxygenase activity of curcumin derivates. Yogyakarta:
International Symposium on Curcumin Pharmacochemistry (ISCP).
Amic D D, Beslo D, Trinajstic N. 2003. Structure-radical scavenging activity relationship of flavonoids. Croatia Chem. Acta 76: 55-61.
Apak R. Guclu K, Ozyurek M, Karademir SE. 2007. Comparative evaluation of various total antioxidant capacity assay applied to phenolic compounds with the CUPRAC Assay. Molecules 12: 1496-1547.
Bagiada N A. 2001. Proses Penuaan dan Penanggulangannya. Denpasar: Fakultas Kedokteran, Universitas Udayana.
Banerjee M, Tripathi LM, Srivastava VM, Puri A, Shukla R. 2003. Modulation of inflammatory mediators by ibuprofen and curcumin treatment during chronic inflammation in rat. Immuno-pharmacol. Immunotoxicol 25: 213–24.
Basnet P, Natasa S B. 2011. Curcumin: An anti-inflammatory molecule from a curry spiceon the path to cancer treatment.
Molecules 16: 4567-4598.
Bermawie N, Rahardjo M, Wahyono D, Makmun. 2006. Status teknologi budidaya dan pasca panen tanaman kunyit dan temulawak sebagai penghasil kurkumin.
EDSUS Littro 2 (4) : 84-99.
Blois MS. 1958. Antioxidant determination by the use of stable free radical. Nature 181: 1191-1200.
Chainani-Wu N. 2003. Safety and anti-inflammatory activity of curcumin:
component of tumeric (Curcuma longa). J. Altern. Complement Med. 9: 161-168. Claeson P A. Panthong, Tuchinda P,
Reutrakul V, Kanjanapothi D, Taylor W C, Santisuk T. 1993. Three non phenolic diarylheptanoids with antiinflammatory activity from Curcuma xanthorrhiza.
Planta Medica 59 (5): 451-454.
Dannhardt G dan Laufer S. 2000. Structural approach to explain the selectivity of COX-2 inhibitors: Is there a common pharmacophore?. Curr. Med. Chem 7: 1101–1112.
Darlina dan Wahyuni S. 2004.
Radiosinovektomi Sebagai Alternatif Pengobatan Radang Sendi Tapa Operasi. Volume ke-5. Jakarta: Alara.
Darwis S N, Haiyah S, Madjo ABD. 1991.
Tumbuhan Obat Famili Zingiberaceae.
Bogor: Pusat Penelitian dan Pengembangan Industri.
Fatmawati DA. 2008. Pola protein dan kandungan kurkuminoid rimpang temulawak (Curcuma xanthorrhiza Roxb.) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hadipoentyanti E, Syahid SF. 2007. Respon temulawak (Curcuma xanthorriza Roxb.)
hasil rimpang kultur jaringan generasi kedua terhadap pemupukan. Jurnal Littri
13: 106-110.
Hakim L. 2005. Inhibisi formula ekstrak sidaguri (Sida rhombifolia) dan seledri
(Apium graveolens) pada enzim xantin oksidase serta efek antiinflamasi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hanani E, Munim A, Sekarini R. 2005. Identifikasi senyawa antioksidan dalam spons Callyspongia sp dari Kepulauan Seribu. Majalah Ilmu Kefarmasian 3: 127-133.
Harvey D. 2000. Modern Analytical Chemistry. Toronto: McGraw-Hill. Hayes E R & Kee J L. 1996. Farmakologi.
15
Heldt HW. 1997. Plant Biochemistry & Molecular Biology. New York: Oxford University Press.
Hendayana S, Kadarohman A, Sumarna AA, Supriatna A. 1994. Kimia Analitik Instrumen. Ed ke-1. Semarang: IKIP Semarang Press.
Hernani, Rahardjo M. 2005. Tanaman Berkhasiat Antioksidan. Jakarta: Penebar Swadaya.
Hudayani F. 2008. Efek antidiare ekstrak etanol rimpang kunyit (Curcuma domestica. Val) pada mencit galur: Swiss Webster [skripsi]. Surakarta: Fakultas Farmasi Universitas Muhammadiyah Surakarta.
Huang M, Lou Y, Xie J, Ma W, Lu Y, Yen P, Zhu B, Newmark H, Ho C. 1998. Effect of dietary curcumin and dibenzoylmethane on formation of 7, 12-dimethylbenzena [anthracene-induced mammary tumors and lymphomas/leukemias in Sencar mice.
Carcinogenesis. 19: 1697-1700.
Hwang JK. Shim JS, Pyun YR. 2000. Antibacterial activity of xanthorrhizol from Curcuma Xanthorrhiza againts oral pathogens. Fitotherapia 71: 321-323.
Ionita P. 2003. Is DPPH stable free radical a good scavenger for oxygen active species.
Chem Pap 59: 11-16.
Itokawa H, Shi Q, Akiyama T, Morris-Natschke SL, Lee KH. 2008. Recent advances in the investigation of curcuminoids. Chinese Medicine 3 (11): 13.
Jayaprakasha GK, Rao LJ, Sakariah KK. 2002. Improved HPLC method for determination of curcumin, demethoxy-curcumin, and bisdemethoxycurcumin.
Agric. Food. Chem. 50: 3668-3672. Josephy P D. 1997. Molecular Toxicology,
New York: Oxford University Press. Kartasasmita RE. 2002. Perkembangan obat
antiradang bukan steroid. Laporan Unit bidang ilmu kimia medisinal/farmasi analisis. Bandung: Institut Teknologi Bandung.
Khar A, Ali AM, Pardhasaradhi BV, Begum Z, Anjum R. 1999. Antitumor activity of curcumin is mediated through the induction of apoptosis in AK-5 tumor
cells. FEBS lett 19: 165-8. Khopkar M. 2003. Konsep Dasar Kimia
Analitik. Penerjemah: Saptorahardjo A. Jakarta: Universitas Indonesia Press. Terjemahan dari: Analytical Chemistry Basic Concept.
Kikuzaki H, Hisamoto M, Hirose K, Akiyama K, Taniguchi H. 2002. Antioxidant properties of ferulic acid and its related compounds. J Agric Food Chem 50: 2161– 2168.
Kumalaningsih S. 2007. Antioksidan Sumber dan Manfaatnya. Antioxidant centre. www. Antioxidant centre.com (11 desember 2011).
Lechtenberg M, Quandt B, Nahrstedt A. 2004. Quantitative determination of curcuminoids in Curcuma rhizomes and rapid differentiation of Curcuma domestica Val. and Curcuma xanthorrhiza
Roxb. by capillary electrophoresis.
Phytochem. Anal. 15: 152–158.
Lelo A. 2001. Pertimbangan yang muncul dari OAINS yang digunakan. Naskah Lengkap Temu Ilmiah Rematologi 2001. (eds. Setyohadi B, Kasjmir YI). Jakarta: Ikatan Reumatologi Indonesia.
Lupea AX, Chambire D, Iditoiou C, Szabro MR. 2006. Short communication improved DPPH determination for antioxidant activity spectrophotometric Assay. Chem Pap 3: 214-216.
Masuda T, Isoke J, Jitoe A, Nakatani N. 1992. Antioxidative curcuminoids from rhizomes of Curcuma xanthorrhiza.
Phytochemistry 31 (10): 3645-3647.
Meyer FR. 2004, Practical High-Performance Liquid Chromatography, 4th Ed. New York: John Wiley & Sons.
Mitchell R N. 2006. Buku Saku Dasar Patologis Penyakit Robbins & Cotran, Ed. 7. Hartono A, penerjemah; Handayani S et al, editor. New York: Elsevier Inc. Terjemahan dari: Pocket Companion To Robbins & Cotran Pathologic Basis of Disease, 7th edition.
Molyneux P. 2004. The Use of The Stable Free Radical Diphenylpicryl-Hydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin J.Sci. Technol
26: 211-219.
antioxidant activity of individual herbal components used in ayurvedic medicine.
Phytochemistry 63 (1): 97-104
Nuratmi B, Adjirni, Paramitha DL. 1996. Penelitian farmakologis sambiloto
(Andrographis paniculata) . Warta Tumbuhan Obat Indonesia 3: 23.
Oomah BD. 2000. Herbs, Botanicals, and Teas. Pennsylvania: Technomic.
Permadi A. 2008. Membuat Kebun Tanaman Obat. Jakarta: Pustaka Bunda.
Rachman F, Logawa E D, Hegartika H, Simanjuntak P. 2008. Aktivitas Antioksidan Ekstrak Tunggal dan Kombinasinya dari Tanaman Curcuma
spp. Ilmu Kefarmasian 6: 69-74.
Rahardjo M. 2010. Penerapan SOP budidaya untuk mendukung temulawak sebahai bahan baku obat tradisional. Perspektif 9: 78-93.
Rahmat R. 1995. Temulawak : Tanaman Rempah dan Obat. Yogyakarta: Kanisius. Rukmana R. 2006. Temulawak, Tanaman
Rempah dan Obat. Yogyakarta: Kanisius. Rukmana R. 2008. Temu-temuan, Apotik
Hidup di Pekarangan. Ed ke-5.
Yogyakarta: Kanisius.
Rustam E, Atmasari I, Yanwirasti. 2007. Efek antiinflamasi etanol kunyit (Curcuma domestica Val.) pada tikus putih jantan galur wistar. Jurnal Sains dan Teknologi Farmasi 12: 112-115.
Sidik, Moelyono M W, Mutadi A. 1995.
Temulawak (Curcuma xanthorrhiza
Roxb.). Jakarta: Phyto Medika.
Srijanto B, Rosidah I, Rismana R, Syabirin G, Aan, Mahreni. 2004. Pengaruh waktu, suhu, dan perbandingan bahan bakupelarut pada ekstraksi kurkumin dari temulawak
(Curcuma xanthorrhiza Roxb.). Didalam:
Prosiding Seminar Nasional Rekayasa Kimia dan Proses. 2004. Jakarta: Pusat Pengkajian dan Penerapan Teknologi Farmasi dan Medika BPPT Jakarta. Suwiah A. 1991. Pengaruh perlakuan bahan
dan jenis pelarut yang digunakan pada pembuatan temulawak instant terhadap rendemen dan mutunya [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Syukur, Cheppy. 2010. Turina, Varietas Unggul Kunyit Kurkumin Tinggi. Jurnal Sinar Tani Edisi 3-9 November 2010.
Timmerman H. 1995. New perspective for antiinflammatory drugs. Yogyakarta:
International Symposium onCurcumin Pharmacochemistry (ISCP).
Udenigwe et al. 2009. Flaxseed protein-derived peptide fractions: Antioxidant properties and inhibition of lipopolysaccharide-induced nitric oxide production in murine macrophages. Food Chem. 116(1): 277–284.
Unnikrishnan MK, Rao MN. 1995. Inhibition of nitrite induced oxidation of hemoglobin by curcuminoids. Pharmazie 50: 490-492. WHO. 1999. WHO Monograph on selected
medicinal plants. Vol I.ISBN 92-125178. Wahid P, Sudiarto. 1985. Pembudidayaan
tanaman temulawak. Prosiding symposium nasional temulawak. Bandung: Lembaga Penelitian Universitas Padjajaran.
Wardiyati T, Rinanto Y, Sunarni T, Azizah. 2008. Koleksi dan identifikasi temulawak
(Curcuma xanthorrhiza Roxb.) dan kunyit
(Curcuma domestica) di Jawa dan Madura: Pengaruh lingkungan terhadap bobot rimpang dan kadar kurkumin. Winarsi H. 2010. Antioksidan alami dan
radikal bebas. Potensi dan aplikasinya dalam kesehatan. Cetakan ke-4. Yogyakarta : Penerbit Kanisius.
Wulandari RR. 2009. Uji Aktivitas Penangkapan Radikal DPPH Analog Kurkumin Siklik dan N-Heterosiklik Monoketon [Skripsi]. Surakarta. Fakultas Farmasi: Universitas Muhammadiyah Surakarta.
Yasni S, Imainizumi K, Sugano M, Nakamura M, Aimoto J. 1993. Effect of Curcuma Xanthoriza Roxb. and curcuminoids on the level of serum and liver lipids, serum apolipoprotein A-I and lipogenic enzymes in rats. Food and Chem Toxicol 31: 213-218.
18
Lampiran 1 Diagram alir penelitian
-
Dicuci
-
Dipotong
-
Dikeringkan
-
Digiling
-
Ekstrak dengan etanol 70 %
(maserasi)
-
Evaporator
-
% rendemenen
Rimpang kunyit atau temulawak
Sukabumi
Ekstrak kunyit dan temulawak
Sukabumi
Uji bioaktivitas potensi hayati
ekstrak temulawak dan kunyit
Uji aktivitas
antioksidan DPPH
Uji antiinflamasi
dengan inhibisi COX-2
Uji kandungan
kurkuminoid dengan
HPLC
Simplisia 100 mesh
19
Lampiran 2 Prosedur ekstraksi simplisia temulawak dan kunyit (BPOM 2005)
Diamkan selama 24 jam
Maserat dipisahkan dan ekstrak
diuapkan hingga kental dengan
evaporator pada suhu 50
0C
Serbuk simplisia temulawak dan kunyit
100 mesh dengan kadar air < 10%
1 kg sampel dilarutkan dalam 10 L
etanol 70 % (1:10)
Direndam dan diaduk
dalam maserator
Lampiran 3 Diagram alir uji aktivitas antioksidan dengan metode DPPH
Timbang 1 mg sampel dan dilarutkan
dengan 5 ml metanol sehingga
konsentrasi stok 200 ppm
Timbang 1.23 mg DPPH diencerkan
hingga 25 ml dengan metanol
Sampel dimasukkan ke dalam micro
plate dengan konsentrasi 200, 100, 50,
25, 12.5 ppm
100
μL
larutan DPPH
ditambahkan pada setiap sampel
Sampel diinkubasi selama 30 menit
pada suhu 37
0C
Sampel dibaca dengan Elisa
reader pada panjang gelombang
21
Lampiran 4 Preparasi larutan untuk uji aktivitas inhibisi COX-2
Preparasi Larutan Untuk Aktivitas COX-2
Larutan
Background.
Sebanyak 0.02 ml COX-2 dipindahkan ke dalam tabung
mikrofuge 0.5 ml dan ditempatkan pada air mendidih selama 3 menit untuk
dinonaktifkan. Enzim yang sudah non aktif ini akan digunakan untuk memperoleh
nilai
background. Sebanyak 0.97 ml bufer reaksi, 0.01 ml larutan heme, dan 0.01
ml COX-2 nonaktif dicampurkan dalam tabung reaksi. Selanjutnya campuran
tersebut diinkubasi selama 10 menit pada suhu 37
0C dan ditambahkan 0.01 ml
substrat asam arakidonat. Campuran kemudian diinkubasi kembali selama 2 menit
pada suhu 37
0C. Sebanyak 0.05 ml HCl dan 0.01 ml dan SnCl
2ditambahkan ke
dalam campuran kemudian diinkubasi selama 5 menit dalam suhu ruang. Larutan
background lalu diencerkan 100 kali dengan mencampurkan 0.01 ml larutan
background dengan 0.99 ml bufer EIA.
Larutan aktivitas awal COX-2 100%.
Sebanyak 0.95 ml bufer reaksi, 0.01
ml larutan heme, dan 0.01 ml COX-2 dicampurkan dan dimasukkan ke dalam dua
tabung reaksi, kemudian ditambahkan 0.02 ml bufer reaksi atau solven kemudian
dihomogenisasi. Larutan tersebut diinkubasi selama 10 menit pada temperatur
37
0C. Reaksi diinisiasikan dengan ditambahkan larutan asam arakidonat sebanyak
0.01 ml pada semua larutan lalu dihomogenisasi dan diinkubasi selama 2 menit
pada temperatur 37
0C. Sebanyak 0.05 ml HCl dan 0.01 ml SnCl
2ditambahkan ke
dalam campuran dan diinkubasi selama 5 menit pada suhu ruang. Larutan tersebut
lalu diencerkan 100 kali dengan mencapurkan 0.01 ml larutan aktivitas awal
COX-2 100 % dengan 0.99 ml bufer EIA, kemudian larutan tersebut diambil 0.05
ml dan ditambahkan 0.95 ml bufer EIA untuk pengenceran 2000 kali.
Larutan inhibitor COX-2 (ekstrak etanol rimpang temulawak dan k