IDENTIFIKASI DAN KARAKTERISASI GEN TOLERAN
GENANGAN POPULASI PADI BC4F1 CIHERANG-
Sub1
RESTU RAHAYU
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Identifikasi dan Karakterisasi Gen Toleran Genangan Populasi Padi BC4F1 Ciherang-Sub1 adalah benar karya saya dengan arahan dari komisi pembimbing yang dipimpin oleh Dr Djarot Sasongko Hami Seno, MSi dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2013
Restu Rahayu
ABSTRAK
RESTU RAHAYU. Identifikasi dan Karakterisasi Gen Toleran Genangan Populasi Padi BC4F1 Ciherang-Sub1. Dibimbing oleh DJAROT SASONGKO HAMI SENO dan TRI JOKO SANTOSO.
Cekaman genangan merupakan salah satu faktor penghambat pada produktivitas tanaman padi. Oleh karena itu, dalam rangka ketahanan pangan, perlu dikembangkan padi toleran genangan. Introduksi gen toleran genangan (Sub1) dilakukan melalui persilangan terarah antara padi Ciherang sebagai tetua pemulih dengan padi IR64-Sub1 dan Swarna-Sub1 sebagai tetua donor Sub1. Penelitian ini bertujuan mengidentifikasi dan mengkarakterisasi tanaman BC4F1 Ciherang-Sub1 hasil persilangan balik antara tanaman BC3F1 Ciherang-Sub1 dengan Ciherang. Keberadaan gen Sub1 pada sampel dideteksi menggunakan analisis PCR berbasis marka molekul terkait gen Sub1. Tahapan penelitian dimulai dari penanaman benih padi BC4F1 Ciherang-Sub1, pengujian toleransi genangan, isolasi DNA padi, pengukuran konsentrasi dan kemurnian DNA padi, serta analisis PCR dengan marka AEX1 dan RM219. Hasil uji genangan diperoleh 15 tanaman BC4F1 Ciherang/Swarna-Sub1 dan 21 tanaman BC4F1 Ciherang/IR64-Sub1. Hasil PCR dengan marka AEX1F dan AEX1R menunjukkan pita DNA berukuran 231 bp sedangkan hasil PCR dengan marka gabungan RM219F dan AEX1R dapat membedakan sifat heterozigot antara padi Ciherang, Swarna-Sub1
dan IR64-Sub1.
ABSTRACT
RESTU RAHAYU. Identification and Characterization Gene of Submergence Tolerant BC4F1 Ciherang-Sub1 Rice Population
.
Supervised by DJAROT SASONGKO HAMI SENO and TRI JOKO SANTOSO.Submergence stress is one of the inhibitor factor at rice productivity. Therefore, in order to improve food security, the rice of submergence-tolerant need to be developed. Introduction of gene related to submergence-tolerant (Sub1) was done by site-directed crossing between Ciherang rice as host with rice
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
IDENTIFIKASI DAN KARAKTERISASI GEN TOLERAN
GENANGAN POPULASI PADI BC4F1 CIHERANG-
Sub1
RESTU RAHAYU
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Identifikasi dan Karakterisasi Gen Toleran GenanganPopulasi Padi BC4F1 Ciherang-Sub1
Nama : Restu Rahayu NIM : G84080044
Disetujui oleh
Dr Djarot Sasongko Hami Seno, MSi Pembimbing I
Dr Tri Joko Santoso, SP MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2012 ini ialah padi tahan genangan, dengan judul Identifikasi dan Karakterisasi Gen Toleran GenanganPopulasi Padi BC4F1 Ciherang-Sub1.
Terima kasih penulis ucapkan kepada Bapak Dr. Djarot Sasongko Hamiseno, M.Si dan Bapak Dr. Tri Joko Santoso, M.Si. selaku pembimbing yang telah banyak memberi saran dalam penyusunan karya ilmiah ini. Di samping itu, terima kasih pula kepada pak Umar, mbak Dewi Praptiwi, kak Falin, dan kak Indra selaku laboran Laboratorium Biologi Molekuler dan Rumah Kaca Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB Biogen) Bogor yang telah membantu selama pengumpulan data. Tak lupa penulis sampaikan penghargaan sebesar-besarnya kepada ayah, ibu, seluruh keluarga, dan rekan-rekan Biokimia 45 atas segala doa dan dukungannya.
Demikianlah skripsi ini disusun, semoga dapat bermanfaat baik bagi penulis maupun para pembaca.
Bogor, Juni 2013
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Metode 3
HASIL 6
Penanaman Benih Padi BC4F1 Ciherang-Sub1 6
Tanaman Padi Hasil Pengujian Toleransi Genangan 6
DNA Hasil Isolasi dan Karakterisasi 7
Identifikasi Padi BC4F1 Ciherang-Sub1 melalui Analisis PCR 9
Marka Sub1A (AEX1) 9
Marka Gabungan RM219F dan AEX1R 10
PEMBAHASAN 11
Pemuliaan Padi BC4F1 Ciherang-Sub1 11
Pengaruh Uji Toleransi Genangan terhadap Padi BC4F1 Ciherang-Sub1 11
Kuantifikasi DNA BC4F1 Ciherang-Sub1 12
Identifikasi Padi BC4F1 Ciherang-Sub1 melalui Analisis PCR 13
SIMPULAN 14
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR GAMBAR
1 Pola tanam benih padi dalam satu bak 3 2 Padi hasil penanaman selama 14 hari 6 3 Uji genangan padi BC4F1 Ciherang-Sub1 7 4 Hasil elektroforesis padi BC4F1 Ciherang/Swarna-Sub1 dengan marka
AEX1F dan AEX1R 9
5 Hasil elektroforesis padi BC4F1 Ciherang/IR64-Sub1 dengan marka
AEX1F dan AEX1R 9
6 Hasil elektroforesis padi BC4F1 Ciherang-Sub1 dengan marka
RM219F dan AEX1R 10
DAFTAR LAMPIRAN
1 Diagram alir penelitian 17 2 Diagram alir pertumbuhan dan uji genangan benih padi BC4F1
Ciherang-Sub1 18
3 Diagram alir isolasi DNA (Doyle & Doyle 1987) 19 4 Komposisi bufer ekstraksi DNA (Marlina 2011) 20 5 Varietas-varietas padi hasil persilangan yang mengandung gen Sub1
PENDAHULUAN
Padi merupakan komoditas penting yang dapat menunjang ketahanan pangan nasional. Hal ini dikarenakan padi adalah sumber makanan pokok bagi sebagian besar penduduk Indonesia, terlihat dari tingkat konsumsi beras penduduknya yaitu sekitar 141 kg/kapita/tahun. Nilai konsumsi beras tersebut menuntut pemerintah dalam meningkatkan produksi padi nasional seiring meningkatnya jumlah penduduk di Indonesia (Badan Ketahanan Pangan 2009).
Upaya peningkatan produksi padi nasional tidak terlepas dari program intensifikasi pertanian yang didukung oleh inovasi teknologi panca usahatani, terutama penggunaan benih padi varietas unggul. Kontribusi varietas unggul dalam peningkatan produktivitas padi mencapai 75% jika diintegrasikan dengan teknologi pengairan dan pemupukan. Benih padi varietas unggul merupakan penyumbang terbesar (16%) terhadap peningkatan produksi padi nasional, jauh di atas irigasi (5%) dan pupuk (4%) (Satoto et al. 2006). Varietas-varietas unggul yang dominan digunakan dalam kurun waktu pengembangannya adalah varietas PB-36 (1970-an), Cisadane (1980-an), IR-64 (1990-an), dan Ciherang (2000-an) (Sitorus 2009).
Keberhasilan upaya peningkatan produksi padi dihadapkan kepada berbagai kendala dan masalah, antara lain penurunan produktivitas lahan, penyimpangan iklim, serta cekaman biotik dan abiotik. Salah satu bentuk cekaman abiotik ialah genangan air. Genangan air terhadap tanaman terjadi akibat terhambatnya proses fotosintesis dan respirasi, hal tersebut dikarenakan difusi gas dalam air lebih lambat 104 kali dibandingkan dengan di udara dan rendahnya penetrasi cahaya yang dapat diterima oleh tanaman (Armstrong & Drew 2002).
Genangan yang mengakibatkan cekaman terhadap tanaman padi di wilayah Asia Tenggara diperkirakan mencapai 15 juta hektar setiap tahunnya (Septiningsih
et al. 2009). Adapun di Indonesia potensi areal persawahan yang terkena cekaman genangan yaitu sekitar 13,3 juta ha yang terdiri atas 4,2 juta ha genangan dangkal, 6,1 juta ha genangan sedang, dan 3,0 juta ha genangan dalam (Nugroho et al. 2002). Cekaman genangan pada areal pertanaman padi ini akan semakin meluas karena terjadi peningkatan curah hujan dan kenaikan permukaan air laut akibat terjadinya pemanasan global (CGIAR 2006).
Varietas padi tahan genangan yang diproduksi di Indonesia diantaranya adalah padi IR64-Sub1 dan Swarna-Sub1. Kedua varietas padi ini memiliki gen
2
solusi dalam upaya perbaikan produktivitas padi di daerah tergenang, meningkatkan ekonomi petani sekaligus devisa negara jika diekspor, dan lebih menggairahkan minat pertanian, baik petani maupun industri, serta mendukung program ketahanan pangan nasional. Padi hasil persilangan tersebut merupakan produk nontransgenik karena tidak melalui proses rekayasa genetik. Selain itu, padi ini mempunyai keuntungan yaitu waktu tanam relatif singkat, resiko kegagalan panen rendah, dan produktivitas tinggi.
Penelitian ini bertujuan mengidentifikasi dan mengkarakterisasi tanaman BC4F1 Ciherang-Sub1 hasil persilangan balik (backcross) antara tanaman BC3F1 Ciherang-Sub1 dengan Ciherang. Tanaman BC4F1 yang mengandung gen Sub1 diidentifikasi menggunakan marka molekuler terkait gen toleran genangan pada proses PCR. Hipotesis penelitian ini adalah metode persilangan terarah ( site-directed crossing) digunakan untuk memperoleh F1 yang memiliki gen Sub1
tahan genangan dan analisis molekuler berbasis PCR digunakan untuk melacak keberadaan alel gen Sub1. Manfaat dari penelitian ini adalah memberikan informasi dan kesempatan kepada para petani atau industri dalam menggunakan padi BC4F1 untuk meningkatkan produktivitas padi di daerah persawahan yang tergenang air ataupun pada saat musim penghujan tiba.
METODE
Bahan dan Alat
Bahan tanaman padi diperoleh dari BB-BIOGEN dan LIPI. Tanaman padi yang digunakan yaitu tetua host (Ciherang), padi BC4F1 Ciherang-Sub1, tetua donor Sub1 (padi IR64-Sub1 dan padi Swarna-Sub1), dan padi IR42 sebagai kontrol. Reagen untuk isolasi DNA yaitu etanol 70%, etanol 95%, bufer ekstraksi (NaCl 5 M, Tris-HCl 1 M, EDTA 0,5 M, lauril sarkosin, dan urea), fenol kloroform isoamilalkohol (PCI), isopropanol, dan larutan TE (Tris-EDTA). Bahan-bahan yang digunakan untuk menguji hasil isolasi DNA dengan PCR adalah bufer PCR 10x, MgCl2 50 mM, dNTP mix 10 mM, primer AEX1, primer RM219, Taq polymerase, sampel DNA 50 ng/µ L, dan MQ H2O. Bahan-bahan yang digunakan untuk elektroforesis yaitu loading dye, bufer TAE (Tris-Acetic Acid EDTA) 1x, agarosa, sampel DNA hasil PCR, marker DNA 1 kb, etidium bromida, dan akuabides.
3
Metode
Penanaman Tanaman Padi (Septiningsih et al. 2009)
Tanaman padi yang ditanam adalah padi host (Ciherang), padi BC4F1- Sub1, tetua Sub1 (padi IR64-Sub1 dan padi Swarna-Sub1), dan padi IR42. Semua jenis padi tersebut ditanam secara bersamaan pada waktu dan tempat yang sama agar umur tanaman tersebut relatif sama sehingga diharapkan dapat berbunga secara bersamaan.
Terdapat 5 buah bak tanam yang setiap baknya ditanami benih padi Ciherang, IR42, IR64-Sub1 dan Swarna-Sub1 serta 3 galur dari benih BC4F1. Setiap bak ditanami benih BC4F1 dari 3 galur berbeda yang setiap galurnya diplotkan dalam 2 barisan tanam. Dengan kata lain, dalam setiap bak terdapat 10 barisan tanam. Setiap barisan tanam tersebut berisi 15 benih padi dari galur yang berbeda. Tersedia sebanyak 14 kantong berisi benih padi dari galur BC4F1 yaitu 8 kantong berisi BC4F1 (Ciherang/IR64-Sub1) dan sisanya yaitu 6 kantong lagi berisi BC4F1 (Ciherang/Swarna-Sub1). Dengan demikian, terdapat 28 barisan tanam yang kemudian dibagi ke dalam setiap bak sehingga setiap bak tersebut berisi kira-kira 5-6 barisan tanam dari benih galur BC4F1. Ilustrasi tersebut dapat dilihat pada Gambar 1.
Benih-benih dari galur BC4F1 diberi penomoran sesuai dengan kode masing-masing galur, contoh: BC4F1 Cih/Sw-Sub1 1-4, BC4F1 Cih/IR-Sub1 5-5, dan seterusnya. Jarak tanam setiap bibit sekitar 3 cm x 3 cm dengan luasan bak sekitar 60 cm x 30 cm = 1.8 m2. Jumlah semua benih yang ditanam adalah sekitar 720 benih kemudian benih tersebut dibiarkan tumbuh sekitar 14 hari di rumah kaca untuk siap dilakukan uji genangan.
Gambar 1 Pola tanam benih padi dalam satu bak
Pengujian Toleransi Genangan (Septiningsih et al. 2009)
4
kontrol toleran genangan karena sensitif terhadap genangan sehingga dapat memudahkan mengetahui batas uji genangan yang dilakukan.
Setelah padi berumur 14 hari dalam bak tanam, pengujian toleransi genangan dilakukan pada tanaman padi yang telah disejajarkan dalam bak tanam tersebut. Bak tanam dimasukkan ke dalam bak (tray) yang lebih besar. Kemudian bak yang sudah berisi tanaman padi tersebut diisi dengan air (digenangi) sampai keseluruhan padi tersebut terendam/tergenang. Ketika kontrol IR42 sudah menunjukkan kerusakan >50 % biasanya setelah 14 hari maka genangan air dalam bak tersebut dibuang. Setelah itu tanaman padi yang bertahan tersebut secara keseluruhan dibiarkan selama 10 hari untuk melakukan recovery dan ditumbuhkan sampai daunnya siap dipanen untuk proses isolasi DNA.
Isolasi DNA Padi (Doyle & Doyle 1987)
DNA genom total tanaman padi BC4F1 diisolasi dari daun menggunakan metode Doyle & Doyle (1987). Isolasi DNA berlangsung dalam empat tahap yang meliputi pemanenan, preparasi ekstrak sel, pemurnian DNA, dan pemekatan DNA. Tanaman padi yang sudah melewati masa recovery selama kurang lebih 3 minggu kemudian dipanen dan dimasukkan daunnya dalam tabung mikro.
Pemecahan sel dibantu dengan cara penggerusan dalam mortar dan ditambah 1000 µL bufer ekstraksi CTAB hingga homogen. Suspensi diinkubasi di dalam waterbath selama 15 menit suhu 65 ºC (setiap 5 menit dikocok dengan cara tabung dibolak-balik secara perlahan). Pemurnian DNA dari pengotor dihilangkan dengan penambahan 100 µL fenol kloroform isoamilalkohol (PCI) ke dalam tabung dan dikocok selama 20 detik hingga merata.
Suspensi selanjutnya disentrifugasi dengan kecepatan 12000 rpm selama 10 menit. Pemekatan DNA dilakukan dengan menambahkan 500 µL isopropanol ke supernatan dan dicampur selama 5 menit. Sampel divorteks dan disentrifugasi kembali pada kecepatan 12000 rpm selama 5 menit. Pelet yang diperoleh dicuci dengan 500 µL etanol 70%. Campuran disentrifugasi kembali selama 5 menit pada kecepatan 12000 rpm. Pelet tersebut selanjutnya dikeringkan di oven dengan suhu 60 0C selama 10 menit. Pelet yang telah kering dilarutkan dengan larutan TE yang mengandung ribonuklease sebanyak 50-100 µL. Kemudian pelet yang telah dilarutkan dengan TE diinkubasi suhu 37 °C selama 30 menit. Selanjutnya pelet DNA tersebut siap untuk diukur konsentrasi dan kemurniannya secara kuantitatif menggunakan spektrofotometer.
Pengukuran Konsentrasi dan Kemurnian DNA (Sambrook & Russel 1989)
5
konsentrasi dan kemurnian sampel terbaca pada software NanoDrop. DNA yang sudah diukur konsentrasinya diencerkan dengan faktor pengenceran 10 kali sehingga didapatkan konsentrasi yang seragam yang akan digunakan dalam analisis PCR. Kemurnian larutan DNA diperoleh dari nisbah rasio absorban yang terbaca pada panjang gelombang 260 nm dibagi nilai absorban pada panjang gelombang 280 nm. Nisbah rasio antara 1,8-2,0 menunjukkan kemurnian DNA yang tinggi.
Analisis PCR dengan Marka AEX1 (Septiningsih et al. 2008)
Hasil isolasi DNA yang diperoleh disamakan terlebih dahulu konsentrasinya yaitu dilakukan pengenceran hingga 50 ng/µ L, selanjutnya dilakukan tahap PCR. Campuran reaksi untuk PCR terdiri atas 2 µL DNA 50 ng/µ L, 2 µL buffer PCR 10x, 0.6 µL MgCl2 50 mM, 0.4 µL dNTP mix 50 mM, 1 µL masing-masing primer AEX1F ukuran 231 bp sebagai forward dengan sekuen 5’
AGGCGGAGCTACGAGTACCA 3’ dan primer AEX1R sebagai reverse dengan
sekuen 5’ GCAGAGCGGCTGCGA 3’ (Septiningsih et al. 2008), 0.16 µL Taq
polymerase, dan 12.84 µL MW. Kemudian dilakukan amplifikasi PCR dengan kondisi denaturasi awal 94ºC selama 5 menit, denaturasi 94ºC selama 1 menit, penempelan primer 55ºC selama 1 menit, perpanjangan primer 72ºC selama 2 menit, dan perpanjangan primer akhir 72ºC selama 5 menit. Program PCR yang dilakukan menggunakan program SUB1C sebanyak 34 siklus reaksi. Elektroforesis yang dilakukan menggunakan gel agarosa 2 % dengan marker 1kb.
Analisis PCR dengan Marka RM219 (Xu et al. 2004)
Seleksi keberadaan gen Sub1 juga dilakukan dengan menggunakan marka mikrosatelit RM219 dengan campuran reaksi untuk reaksi terdiri atas 1 µL DNA 50 ng/µ L, 2µL buffer PCR 10x, 1.2 µL MgCl2 50 mM, 0.4 µL dNTP mix 50 mM, 1 µL masing-masing primer RM219F sebagai forward dengan sekuen 5’
CGTCGGATGATGTAAAGCCT 3’ dan primer AEX1R sebagai reverse dengan
sekuen 5’ GCAGAGCGGCTGCGA 3’, 0.16 µL Taq polimerase, dan 12.84 µL MW. Selanjutnya dilakukan amplifikasi PCR seperti pada marka AEX1. Gel agarosa yang digunakan dalam PCR dengan marka kombinasi antara RM219F dan AEX1R ini adalah 1%.
Elektroforesis Produk PCR (Septiningsih et al. 2008)
Sebanyak 2% gel agarosa dan 1x buffer TAE (Tris Acetic Acid EDTA) dimasukkan ke dalam cetakan. Setelah gel agarosa memadat kemudian dimasukkan ke dalam tangki elektroforesis yang berisi 1x buffer TAE. Sebanyak 10 µL produk PCR dari masing-masing sampel ditambahkan dengan 2 µL loading dye dan dicampur sempurna, kemudian dimasukkan ke dalam sumur gel. Penentuan ukuran dari produk PCR disertakan juga DNA standar (100 bp ladder) sebagai pembanding. Sampel dielektroforesis dengan tegangan 80 volt selama kurang lebih 1.5 jam. Setelah itu, gel agarosa diwarnai dengan larutan etidium bromide (EtBr) sebanyak 10 mg/L selama 10 menit dan dicuci dengan air selama 10-20 menit. Gel agarosa kemudian divisualisasi dengan Chemidoc gel system
6
HASIL
Penanaman Benih Padi BC4F1 Ciherang-Sub1
Penanaman benih padi BC4F1 Ciherang-Sub1 bertujuan memperoleh populasi tanaman padi BC4F1 Ciherang-Sub1 yang akan dipanen daunnya untuk proses isolasi DNA. Benih padi BC4F1 Ciherang-Sub1 ditanam secara bersamaan dengan benih padi Ciherang, IR64-Sub1, Swarna-Sub1, serta IR42 dalam 5 buah bak tanam bermedia tanah. Benih-benih padi tersebut ditanam sejajar/sebaris antara satu sama lain. Pengamatan dan perawatan tanaman selama masa pertumbuhan dilakukan secara intensif seperti penyiraman, pencegahan dari serangan hama, dan lain-lain.
Setelah penanaman padi selama 14 hari, dihasilkan tanaman padi berjumlah 720 tanaman dengan kondisi tinggi ± 20 cm dan lebar ± 5 cm. Tanaman-tanaman padi ini tumbuh tegak dengan daun berwarna hijau muda dan rata-rata mempunyai cabang/batang sebanyak tiga buah (Gambar 2). Selanjutnya tanaman padi tersebut diuji ketahanannya terhadap cekaman genangan dengan merendam semua bagian tubuhnya dalam air dan dibiarkan selama 14 hari.
Tanaman Padi Hasil Pengujian Toleransi Genangan
Pengujian padi terhadap cekaman genangan bertujuan untuk menyeleksi padi yang dapat bertahan hidup (survival) jika digenangi air selama waktu tertentu. Batas waktu pengujian genangan ini disesuaikan dengan tingkat kerentanan tanaman padi tersebut terhadap cekaman genangan yaitu sekitar 14 hari (Septiningsih et al. 2009). Tanaman yang dapat bertahan terhadap genangan diasumsikan sudah tersisipi gen Sub1 (positif Sub1) (Septiningsih et al. 2009).
Proses pengujian toleransi genangan selama dua minggu ditandai dengan kerusakan pada padi IR42. Tahap selanjutnya adalah pengurangan air dari dalam bak secara perlahan dan masih menyisakan sedikit air di dalam bak agar tanaman tidak stress. Kemudian tanaman dibiarkan 10-21 hari untuk melakukan recovery
(tumbuh normal kembali) dengan kondisi daun yang tidak terlalu tegak dan batang lebih menjuntai (Septiningsih et al. 2009). Kondisi padi dari awal penanaman sampai proses uji toleransi genangan diperlihatkan pada Gambar 3.
7
Hasil yang diperoleh dari uji genangan yaitu hanya sebagian kecil tanaman BC4F1 yang mampu bertahan hidup yaitu 21 tanaman varietas Ciherang/IR64-Sub1 dan 15 tanaman varietas Ciherang/Swarna-Sub1 dari 720 benih padi yang ditanam. Tanaman-tanaman yang bertahan ini dapat dilihat pada Tabel 1.
DNA Hasil Isolasi dan Karakterisasi
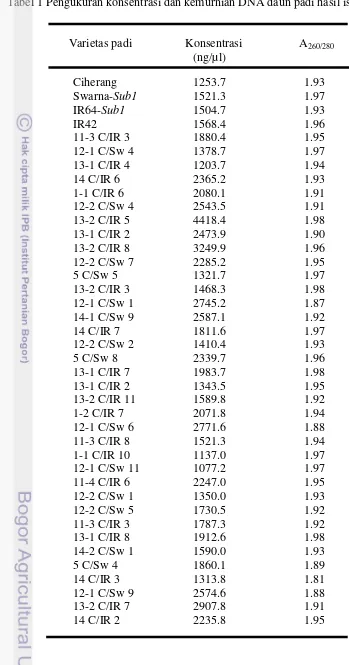
DNA daun padi dapat dipisahkan dari kontaminan seperti polisakarida dan metabolit sekunder menggunakan bufer ekstraksi CTAB. Menurut Ardiana (2009), DNA seringkali terkontaminasi amilum, tanin, pigmen, alkaloid dan flavonoid. Karakterisasi DNA adalah pengenalan substansi DNA melalui identifikasi secara kualitatif dan kuantitatif (Subandi 2010). Secara kualitatif, DNA diidentifikasi melalui visualisasi gel agarosa setelah proses elektroforesis. Sedangkan secara kuantitatif, DNA dianalisis menggunakan spektrofotometer dengan panjang gelombang 260 dan 280 nm.
Isolasi DNA padi BC4F1 Ciherang-Sub1 menggunakan metode CTAB dikatakan berjalan baik dikarenakan DNA yang dihasilkan relatif banyak. Hal ini sejalan dengan nilai konsentrasinya yang relatif besar yaitu antara rentang 1077.2-4418.4 ng/µl dengan rataan sekitar 1960.4 ng/µl setelah diukur dengan spektrofotometer pada panjang gelombang 260 nm. Sedangkan nilai kemurniannya bervariasi antar rentang 1,81 – 1,98 pada rasio panjang gelombang 260/280 nm dengan nilai rata-rata 1.94 (Tabel 1).
8
Tabel 1 Pengukuran konsentrasi dan kemurnian DNA daun padi hasil isolasi
9
Identifikasi Padi BC4F1 Ciherang-Sub1 melalui Analisis PCR
Marka Sub1A (AEX1)
Seleksi tanaman BC4F1 secara spesifik dilakukan dengan analisis PCR berbasis marka molekul gen Sub1. Adapun marka molekul gen Sub1 yang digunakan dalam PCR ini adalah marka AEX1. Marka ini secara spesifik dirancang untuk mendeteksi keberadaan alel toleran genangan.
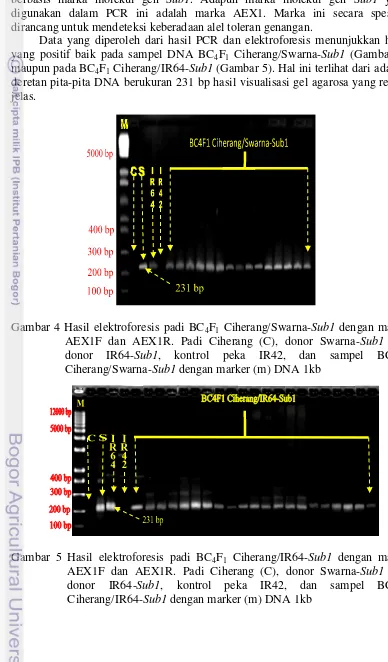
Data yang diperoleh dari hasil PCR dan elektroforesis menunjukkan hasil yang positif baik pada sampel DNA BC4F1 Ciherang/Swarna-Sub1 (Gambar 4) maupun pada BC4F1 Ciherang/IR64-Sub1 (Gambar 5). Hal ini terlihat dari adanya deretan pita-pita DNA berukuran 231 bp hasil visualisasi gel agarosa yang relatif jelas.
Gambar 4 Hasil elektroforesis padi BC4F1 Ciherang/Swarna-Sub1 dengan marka AEX1F dan AEX1R. Padi Ciherang (C), donor Swarna-Sub1 (S), donor IR64-Sub1, kontrol peka IR42, dan sampel BC4F1 Ciherang/Swarna-Sub1 dengan marker (m) DNA 1kb
10
Pada hasil visualisasi terlihat bahwa padi Ciherang (host) sebagai kontrol negatif dan padi IR42 sebagai kontrol sensitif (peka) tidak mempunyai pita pada ukuran 231 bp, sehingga terbukti kedua tanaman tersebut tidak toleran genangan (Septingsih et al. 2009). Padi BC4F1 Ciherang/Swarna-Sub1 dan BC4F1 Ciherang/IR64-Sub1 mempunyai pita DNA berukuran 231 bp yang berarti kedua jenis padi ini memiliki gen toleran genangan(Sub1).
Marka Gabungan RM219F dan AEX1R
Penelitian ini menggunakan marka mikrosatelit yang bertujuan membedakan heterozigositas pada tanaman padi BC4F1 Ciherang-Sub1. Marka mikrosatelit yang digunakan dalam penelitian ini adalah marka RM219. Marka ini dipilih karena terkait dan ideal untuk seleksi toleran genangan (Xu et al. 2004). Analisis PCR dilakukan dengan marka gabungan antara primer RM219F sebagai
forward dan AEX1R sebagai reverse. Hal ini bertujuan untuk membedakan tetua Ciherang, Swarna-Sub1, IR64-Sub1, dan BC4F1 Ciherang-Sub1, serta mendeteksi pola heterozigositas masing-masing tanaman tersebut.
Hasil yang diperoleh dari visualisasi elektroforesis menunjukkan pola sebaran pita dari semua tanaman. Sampel Swarna dan IR64 menunjukkan pita yang tidak ada pada padi Ciherang. Pita Ciherang (host) dan pita Swarna/IR64 (donor) yang dimiliki oleh tanaman BC4F1 Ciherang-Sub1 dalam pola sebaran pitanya menunjukkan bahwa padi tersebut bersifat heterozigot (Moeljopawiro 2010). Tanaman nomor 2 dan nomor 5 masing-masing memiliki pita dari kedua tetua yaitu berukuran 740 bp. Oleh karena itu dapat disimpulkan bahwa kedua tanaman tersebut bersifat heterozigot sedangkan tanaman lainnya bersifat homozigot (Gambar 6).
11
PEMBAHASAN
Pemuliaan Padi BC4F1 Ciherang-Sub1
Benih padi BC4F1 Ciherang-Sub1 pada penelitian ini merupakan hasil penggabungan sifat yang dimiliki dari dua jenis tetua yang berbeda melalui persilangan antara benang sari dari padi Ciherang dan putik dari padi
Swarna-Sub1 maupun IR64-Sub1. Penggabungan sifat yang dihasilkan dari kedua tetua pada BC4F1 terjadi secara acak, sehingga kombinasi sifat yang dihasilkan bersifat lebih menguntungkan dari kedua tetuanya. Keturunan yang dihasilkan memiliki sifat baru yang berbeda dengan kedua induknya (Susanto 2008). Hasil persilangan antara Ciherang (host) dengan BC3F1 Ciherang-Sub1 menghasilkan komposisi gen 96,375% : 3,625% yang artinya gen dari kedua tetua telah bersegregasi dalam tanaman BC4F1 dengan komposisi paling dominan adalah gen Ciherang (Marlina 2011).
Pemuliaan padi BC4F1 Ciherang-Sub1 dilakukan melalui metode persilangan terarah (site-directed crossing). Metode site-directed crossing atau lebih dikenal dengan sebutan marker-assisted backcrossing (MAB) dapat meminimalisasi intogresi gen donor sehingga hanya sifat yang diinginkan saja yang terintroduksi pada host, dengan kata lain sifat-sifat yang baik pada host dapat dipertahankan (Mackill et al. 2007). Metode ini lebih menguntungkan bila dibandingkan dengan seleksi fenotip karena berdasarkan pada sifat genetik saja dan tidak dipengaruhi oleh lingkungan. Oleh karena itu, kegiatan pemuliaan menjadi lebih cepat, tepat, dan relatif lebih hemat biaya dan waktu (Azrai 2005).
Perbanyakan padi BC4F1 Ciherang-Sub1 dilakukan melalui penanaman selama 14 hari. Benih- benih padi BC4F1 Ciherang-Sub1 ditanam hingga tumbuh menjadi tanaman padi seutuhnya. Populasi padi yang dihasilkan memiliki tubuh tegak berukuran tinggi ± 20 cm dan lebar ± 5 cm sesuai metode penanaman Septiningsih et al. (2009). Populasi padi terintrogesi gen Sub1 memiliki tubuh tegak setelah ditanam selama 14 hari dan cukup umur untuk pengujian terhadap genangan (Septiningsih et al. 2009). Oleh karena itu padi yang akan diuji terhadap cekaman genangan harus memiliki tubuh tegak sehingga seluruh tubuhnya kuat jika digenangi dengan air.
Pengaruh Uji Toleransi Genangan terhadap Padi BC4F1 Ciherang-Sub1
12
terhambat akibat rendahnya ketersediaan CO2 dan penetrasi cahaya (Jackson & Ram 2003). Ketersediaan CO2 dalam air lebih rendah dibandingkan di udara yaitu dengan konsentrasi sebanyak 0.004 mol m-3 sedangkan di udara kesetimbangannya sebanyak 0.01 mol m-3 (Sarkar et al. 2006).
Padi juga merespon kondisi cekaman genangan melalui sifat ketahanannya terhadap genangan tersebut. Sifat tahan/toleran ini dimiliki padi yang sudah tersisipi gen toleran genangan (Sub1). Sub1 (Submergence 1) merupakan gen pengendali sifat toleran terhadap genangan (Xu et al. 2004). Gen inimenghambat gen yang berkaitan dengan elongasi sel dan katabolisme karbohidrat. Introgesi
Sub1 pada padi mengakibatkan tanaman lebih toleran terhadap genangan. Beberapa gejala metabolisme padi toleran ini meliputi karbohidratnya bersifat terlarut dalam air (soluble), lambatnya penurunan pati yang dikonsumsi padi,
mRNA α-amilase dan sukrosa sintasenya berukuran relatif kecil, tingginya aktivitas piruvat dekarboksilase (Pdc) dan alkohol dehidrogenase (Adh), produksi etilennya relatif sedikit, dan transkripsi gen ekspansinya semakin berkurang (Fukao & Bailey-Serres 2008). Berdasarkan data-data fisiologi di atas dapat disimpulkan bahwa strategi survival padi terhadap genangan berlangsung melalui konservasi karbohidrat, represi elongasi sel, dan peningkatan kapasitas fermentasi (Perata & Voesenek 2006; Fukao & Bailey-Serres 2008).
Berdasarkan hasil yang diperoleh, tanaman padi BC4F1 yang mampu bertahan hidup terdapat 21 tanaman varietas Ciherang/IR64-Sub1 dan 15 tanaman varietas Ciherang/Swarna-Sub1. Hal ini sesuai dengan prosedur Septiningsih et al.
(2009) yang menyatakan bahwa tanaman yang dapat bertahan (survival) terhadap genangan diasumsikan sudah tersisipi gen Sub1 (positif Sub1). Sedangkan sebaliknya, padi yang mati diasumsikan tidak terintroduksi gen Sub1 (negatif
Sub1). Padi intoleran genangan akan mati setelah 14 hari dalam cekaman genangan karena strategi pertahanan dirinya melalui elongasi sel yang menitikberatkan sejumlah karbohidratnya untuk dipakai memperpanjang sel-sel tubuhnya. Padi mengalami kondisi kekurangan cadangan makanan karena terhambatnya proses fotosintesis dalam air. Fotosintesis terhambat akibat rendahnya ketersediaan CO2 dan penetrasi cahaya di dalam air. Oleh karena itu dapat disimpulkan bahwa hanya padi yang memiliki gen Sub1 saja yang dapat bertahan hidup terhadap cekaman genangan selama 14 hari.
Kuantifikasi DNA Padi BC4F1 Ciherang-Sub1
Kuantifikasi DNA adalah suatu cara identifikasi DNA yang meliputi pengukuran konsentrasi serta kemurniaan DNA. Konsentrasi DNA dapat terkuantifikasi menggunakan bantuan sinar UV (ultraviolet) pada panjang gelombang 260 dan 280 nm. Sedangkan kemurnian dan kualitas isolat DNA diukur melalui nisbah rasio panjang gelombang 260/280 (William et al. 2007). Apabila rasionya bernilai < 1.8 maka DNA tersebut terkontaminasi oleh protein sedangkan jika nilainya > 2.0 maka DNA terkontaminasi oleh fenol, kloroform, atau RNA. DNA murni diperoleh pada rentang nilai 1.8-2.0 (Sambrook et al.
1989).
13
memiliki dinding sel yang kuat dan seringkali pada beberapa jenis tanaman, kontaminasi tersebut sulit dipisahkan dari ekstrak asam nukleat. Pemakaian suatu bufer ekstraksi dapat memudahkan proses memperoleh DNA. Bufer ekstraksi CTAB dapat memisahkan DNA dari kontaminan lain dan menghasilkan konsentrasi DNA yang relatif lebih banyak jika dibandingkan dengan bufer lain (Jose & Usha 2000).
Berdasarkan hasil pengukuran konsentrasi DNA, diperoleh jumlah DNA yang relatif banyak yaitu dengan nilai konsentrasi antara rentang 1077.2-4418.4 ng/µl. Nilai ini sangat berpengaruh pada analisis PCR dalam proses amplifikasinya. Menurut Nurhaimi-Haris et al. (2003), konsentrasi DNA akan berdampak pada kualitas fragmen hasil amplifikasi. Jika konsentrasi DNA terlalu rendah fragmen yang dihasilkan sebagai pita akan sangat tipis pada gel atau bahkan pita tidak terlihat secara visual, sebaliknya jika konsentrasi DNA terlalu tinggi akan menyebabkan fragmen terlihat tebal sehingga sulit dibedakan antara satu pita dengan pita lainnya.
DNA padi BC4F1 Ciherang-Sub1 yang diperoleh tergolong memiliki tingkat kemurnian yang relatif tinggi. Nilai kemurniannya bervariasi antar rentang 1,81-1,98 pada rasio panjang gelombang 260/280 nm. Hal ini sesuai pernyataan Sambrook et al. (1989) yaitu DNA murni berada pada rentang nilai 1.8-2.0. Hal ini diperkuat dengan teori Murray et al. (2003) yang menyatakan bahwa DNA dapat menyerap sinar UV pada panjang gelombang 260 nm karena adanya ikatan rangkap terkonjugasi pada basa heterosiklik purin dan pirimidin. Hal ini menyebabkan nukleosida, nukleotida, dan polinukleotida dapat menyerap sinar tersebut. Oleh karena itu makromolekul lain selain DNA seperti protein dan karbohidrat tidak dapat terdeteksi pada panjang gelombang tersebut.
Identifikasi Padi BC4F1 Ciherang-Sub1 melalui Analisis PCR
Identifikasi padi BC4F1 Ciherang-Sub1 melalui analisis PCR dibantu dengan beberapa marka molekuler. Marka molekuler yang digunakan terkait dalam toleransi genangan pada penelitian ini adalah marka AEX1 dan RM219. Marka molekuler yang dirancang khusus untuk mendeteksi keberadaan alel toleran genangan (gen Sub1) adalah marka AEX1. Sedangkan RM219 adalah marka mikrosatelit yang digunakan khusus untuk melacak pola heterozigositas alel-alel genom pada tanaman.
Analisis PCR dengan marka AEX1 bertujuan untuk mengamplifikasi fragmen DNA Sub1 yang telah terlacak oleh marka AEX1 yaitu pada ukuran 231 bp. Marka ini dapat melacak keberadaan gen Sub1 pada ukuran pita 231 bp (Septiningsih et al. 2009). Analisis ini pun secara tidak langsung dapat menyeleksi DNA padi yang tidak terintrogesi alel toleran genangan. Apabila pada proses visualisasinya tidak terlihat pita berukuran 231 bp, maka DNA tersebut tidak mengandung alel toleran genangan.
14
bahwa padi yang telah terintroduksi gen Sub1 mempunyai pita DNA pada ukuran 231 bp mengikuti tetua donornya yaitu IR64-Sub1 dan Swarna-Sub1. Di sisi lain terlihat pula bahwa padi Ciherang (host) sebagai kontrol negatif dan padi IR42 sebagai kontrol sensitif (peka) tidak mempunyai pita pada ukuran 231 bp, sehingga terbukti kedua tanaman tersebut tidak toleran genangan. Keberadaan gen
Sub1 pada padi BC4F1 ini berimplikasi pada keberhasilan metode persilangan terarah yang telah dilakukan pada generasi sebelumnya yaitu BC3F1.
Marka mikrosatelit atau SSR (Simple Sequence Repeat) adalah marka molekul berupa urutan dinukleotida atau tetranukleotida yang berulang dan berurutan. Marka ini mampu membedakan homozigot dan heterozigot (codominant) serta dapat melacak banyak alel pada genom tanaman (McCouch et al. 2002). Selain itu marka ini mempunyai kelebihan yaitu penggunaannya tidak merusak bahan tanaman karena jumlah DNA sampel yang dibutuhkan relatif rendah dan dapat melacak gen secara akurat. Marka mikrosatelit yang digunakan dalam penelitian ini adalah marka RM219. Marka ini dipilih karena terkait dan ideal untuk seleksi toleran genangan, selain itu relatif praktis dan efisien. Marka mikrosatelit RM219 memiliki ukuran pita 204 dan 194 bp (Xu et al. 2004). Analisis PCR dilakukan dengan marka gabungan antara primer RM219F sebagai
forward dan AEX1R sebagai reverse. Hal ini bertujuan untuk membedakan tetua Ciherang, Swarna-Sub1, IR64-Sub1, dan BC4F1 Ciherang-Sub1, serta mendeteksi pola heterozigositas masing-masing tanaman tersebut.
Berdasarkan data yang diperoleh dari hasil visualisasi elektroforesis menunjukan bahwa terlihat pola sebaran pita dari semua tanaman. Sampel Swarna dan IR64 menunjukkan pita yang tidak ada pada padi Ciherang. Pita Ciherang (host)dan pita Swarna/IR64 (donor) yang dimiliki oleh tanaman BC4F1 Ciherang-Sub1 dalam pola sebaran pitanya menunjukkan bahwa padi tersebut bersifat heterozigot (Moeljopawiro 2010). Terdapat dua tanaman yang masing-masing memiliki pita yang sama dari kedua tetua pada ukuran 740 bp yaitu sampel 2 dan 5. Kedua tanaman tersebut bersifat heterozigot karena masing-masing mempunyai pita yang sama dari kedua tetuanya sedangkan tanaman lainnya bersifat homozigot.
SIMPULAN
15
DAFTAR PUSTAKA
Ardiana DW. 2009. Teknologi isolasi DNA genom tanaman padi dengan menggunakan modifikasi bufer CTAB. Buletin Teknik Pertanian Vol. 14 No. 1 2009: 12-16.
Armstrong W, Drew MC. 2002. Root Growth and Metabolism Under Oxygen Deficiency. Di dalam: Waisel Y, Eshel A, Kafkafi U, editor. Plant roots: the hidden half. Ed ke-3. New York: Marcel Dekker. hlm 729–761.
Azrai M. 2005. Pemanfaatan marka molekuler dalam proses seleksi pemuliaan tanaman. J Agro Biogen 1:26-37.
Badan Ketahanan Pangan. 2009. Konsumsi Padi Indonesia 2009. [internet]. [diunduh 23 Juli 2012]. Tersedia pada: http://www.badanketahananpangan.com [BBPTP] Balai Besar Penelitian Tanaman Padi. 2009. Deskripsi Varietas Padi. [internet]. [diunduh 10 Juli 2012]. Tersedia pada: pustaka.litbang.deptan.go.id/bppi/lengkap/bpp09001.pdf.
CGIAR (Consultative Group on International Agriculture Research). 2006. Intensified Research Effort Yields Climate-Resilient Agriculture To Blunt Impact of Global Warming, Prevent Widespread Hunger.Heat-tolerant Wheat, Flood-proof Rice, Satellites for Carbon Trading Among New Technologies. Doyle JJ, Doyle JL. 1987. A rapid DNA isolation from small amount of fresh leaf
tissue. J Phytochem Bull 19:11-15.
Fukao T, Bailey-Serres J. 2008. Submergence tolerance conferred by Sub1A is mediated by SLR1 and SLRL1 restriction of gibberellin responses in rice.
PNAS 105: 16814-19.
Jackson MB, Ram PC. 2003. Physiological and molecular basis of susceptibility and tolerance of rice plants to complete submergence. Annals of Botany 91: 227–241.
Jose J, Usha R. 2000. Extraction of geminiviral DNA from a highly mucilaginous plant (Abelmoschus esculentus). Plant Mol. Biol. Rep. 18: 349-355.
Mackill DJ et al. 2007. Marker assisted selection for submergence tolerance in rice. Mol Plant Breeding 5:207-208.
Marlina E. 2011. Aplikasi PCR berbasis marka Sub1 (AEX1 dan RM219) pada seleksi padi BC1F1 Ciherang-Sub1 [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
McCouch et al. 2002. Development and mapping of 2240 new SSR markas for rice (Oryza sativa L.). DNA Res 9: 199-207.
Moeljopawiro S. 2010. Aplikasi marka molekuler terkait dengan umur genjah 90 hari dan produktivitas 7 ton/ha pada padi. Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian.
Murray RK, Granner DK, Mayes PA, Rodwell VW. 2003. Biokimia Harper. Edisi ke-27. Jakarta : Penerbit Buku Kedokteran EGC.
Nugroho et al. 2002. Peta areal untuk pengembangan pertanian lahan pasang surut dan pantai. Proyek Penelitian Sumber Daya Lahan. Pusat Penelitian Tanah dan Agro Klimat. Badan Litbang Pertanian.
16
Perata P, Voesenek L. 2006. Submergence tolerance in rice requires Sub1A, an ethylene-response-factor-like gene. Trends in Plant Science 12 (2).
Sambrook J, Fritsch EF, and Manuatis T. 1989. Moleculer Cloning : A Laboratory Manual. New York : Harbour Lab press.
Sarkar RK, Reddy JN, Sharma SG, Ismail AM. 2006. Physiological basis of submergence tolerant in rice and implications on crop development. Current Science 91: 899-906.
Septiningsih et al. 2009. Development of submergence tolerant rice cultivars: The Sub1 locus and beyond. Annals of Botany 103: 151-160.
Sitorus FMT. 2009. Benih bersertifikat basis swasembada beras. Suara Pembaharuan 21 Agustus 2009.
Subandi. 2010. Isolasi dan karakterisasi DNA dari tanaman kina : Cinchona ledgeriana. MIPA: Jurnal matematika, Ilmu pengetahuan alam dan pengajarannya No 1 Vol 29, Januari-2010.
Susanto U. 2008. Padi Hibrida Vs Padi Inhibrida. Buletin Organik th.II/ edisi I/Sept-Okt 2008. [internet]. [diacu 23 Juli 2012]. Tersedia pada: www.ri1organik.com
William W, Wilfinger, Karol Mackey, Chomczynski P. 2007. Effect of pH and ionic strength on the spectrophotometric assessment of nucleic acid purity.
BioTechniques 22: 474-481.
17
Lampiran 1 Diagram alir penelitian
Identifikasi dan karakterisasi tanaman BC4F1 Ciherang-Sub1
Amplifikasi menggunakan marka AEX1 dan gabungan AEX1-RM219 (PCR)
Visualisasi sampel (Elektroforesis)
Penanaman dan pengujian genangan padi BC4F1 Ciherang-Sub1 selama masing-masing 14 hari dalam bak selanjutnya dibiarkan
selama 3-4 minggu untuk proses recovery
Isolasi DNA
18
Lampiran 2 Diagram alir uji genangan benih padi BC4F1 Ciherang-Sub1
Penanaman benih padi Ciherang (host), padi donor Sub1 (IR64-Sub1 dan
Swarna-Sub1), padi IR42, dan galur-galur padi BC4F1 Ciherang/Swarna-Sub1 dalam bak
tanam berukuran 60 cm x 30 cm BC F Ciherang/IR64-Sub1
Benih-benih disebar merata mengikuti pola barisan
Tanaman setelah 14 hari masa pertumbuhan
Uji genangan selama 14 hari dalam bak tanam dimasukkan ke dalam bak plastik
yang dapat menampung 100 L air
Pemulihan (recovery) selama 10-21 hari dalam ember dan tanaman siap untuk
19
20
Lampiran 4 Komposisi bufer ekstraksi DNA (Marlina 2011)
Larutan Stok Jumlah untuk 500 Konsentrasi akhir mL
Tris-Cl 1 M (pH = 8,5) 50 mL 100 mM NaCl 5 M 140 mL 1.4 M
EDTA 0.25 M 40 mL 20 mM CTAB 10 g 2% (b/v) PVP 10 g 2% (b/v) Merkaptoetanol 1 mL 0.2% (v/v)
Lampiran 5 Varietas-varietas padi hasil persilangan yang mengandung gen Sub1
(Xu et al. 2004; Sarkar et al. 2006)
Varietas Lama Lama Tinggi Produktivitas berbunga matang (cm) (ton/ha) (hari) (hari)
IR64-Sub1 (IR07F102) 86 116 95 5.9 Swarna-Sub1 (IR05F102) 104 134 85 5.3 Samba Mahsuri-
Sub1 (IR07F101) 98 126 85 6.5 TDK1-Sub1 (IR07F289)
BR11-Sub1 (IR07F290) Sedang dikarakterisasi oleh IRRI CR1009Sub1 (IR07F291)
21
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 13 Mei 1990 dari ayah Yunus dan Ibu Dedeh. Penulis merupakan anak keempat dari enam bersaudara. Pendidikan formal penulis dimulai dari SD Negeri Kotabatu I dan melanjutkan pendidikan di SMP Rimba Teruna Bogor. Penulis lulus tahun 2008 dari SMA Negeri 4 Bogor dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis terpilih sebagai mahasiswa mayor Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah melakukan Praktik Lapangan (PL) di Laboratorium Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia Jl. Taman Kencana 1 Bogor selama periode Juli hingga Agustus 2011 dengan judul Amplifikasi dan kloning daerah promotor gen yang terkait dengan abnormalitas pembungaan kelapa sawit (Elaeis guineensis Jacq.)