ABSTRAK
EMILIA FATMAWATI. Ekstrak Etanol Daun Salam dan Fraksinya sebagai
Inhibitor Alfa-Amilase. Dibimbing oleh ELLY SURADIKUSUMAH dan IRMA
HERAWATI SUPARTO.
Eugenia polyantha
yang dikenal dengan nama salam di Indonesia adalah
tanaman obat yang banyak digunakan dalam mengobati berbagai penyakit,
termasuk diabetes. Tujuan penelitian ini adalah memperoleh fraksi teraktif dalam
menginhibisi alfa-amilase dari ekstrak etanol daun salam serta mengidentifikasi
kandungan fitokimianya. Ekstrak etanol kasar yang difraksionasi menggunakan
ekstraksi cair-cair menghasilkan 3 fraksi, yaitu fraksi
n
-heksana, fraksi etil asetat,
dan fraksi air.
Uji aktivitas inhibisi alfa-amilase menunjukkan bahwa semua fraksi
aktif menghambat alfa-amilase, fraksi air menunjukkan aktivitas tertinggi sebesar
22.52%. Fraksinasi lanjutan fraksi air menggunakan kromatografi kolom silika gel
dengan elusi gradien menghasilkan 4 fraksi. Semua fraksi menunjukkan aktivitas
hambat alfa-amilase, fraksi 2 menunjukkan aktivitas tertinggi, yaitu 57.57%.
Berdasarkan uji fitokimia, komponen kimia yang terkandung dalam fraksi teraktif
adalah golongan alkaloid, flavonoid, dan saponin.
ABSTRACT
EMILIA FATMAWATI. Ethanolic Extract of
Eugenia polyantha
Leaves and it’s
Fraction as Alpha-Amylase Inhibitor. Supervised by ELLY SURADIKUSUMAH
and IRMA HERAWATI SUPARTO.
1
PENDAHULUAN
Diabetes melitus (DM) adalah suatu penyakit metabolik yang dicirikan dengan tingginya kadar glukosa dalam darah (hiperglisemia) disertai terganggunya metabolisme karbohidrat, protein, dan lemak karena tubuh kekurangan insulin atau insulin tidak bekerja secara efektif. Menurut data yang dipublikasikan dalam jurnal Diabetes
Care tahun 2004, penderita diabetes di
Indonesia pada tahun 2000 mencapai 8.4 juta orang dan menempati urutan keempat setelah India, Cina, dan Amerika Serikat. Penderita diabetes secara menyeluruh sekitar 6% dari populasi penduduk dunia, 90% di antaranya diabetes tipe 2 (Subroto 2006).
Berbagai pendekatan farmakologis telah dilakukan untuk mengobati diabetes, di antaranya menstimulasi pelepasan insulin, menginhibisi glukoneogenesis, dan menurunkan absorpsi glukosa pada usus halus. Salah satu terapi yang bermanfaat untuk DM tipe 2 adalah pengendalian kadar gula darah pascamakan. Penurunan kadar gula darah pascamakan dapat dilakukan dengan menunda absorpsi glukosa melalui penghambatan kerja enzim penghidrolisis
karbohidrat, seperti α-amilase dan α
-glukosidase pada tahap pencernaan. Dengan adanya inhibitor enzim ini, waktu cerna karbohidrat menjadi lebih lama dan absorpsi glukosa dalam tubuh diperlambat sehingga kadar gula darah yang tinggi pascamakan
dapat dikendalikan (Geethalaksmi et al.
2010).
Beberapa penelitian melaporkan adanya korelasi yang positif antara aktivitas inhibisi
α-amilase dan α-glukosidase dalam suatu
ekstrak, artinya bila ekstrak tersebut aktif menghambat α-amilase maka ekstrak tersebut
aktif dalam menghambat α-glukosidase.
Penelitian yang dilakukan oleh Kim et al. (2005) menunjukkan ekstrak kulit batang pinus 60 g/mL dapat menghambat kerja enzim α-amilase dan α-glukosidase berturut-turut sebesar 97.2% dan 98.5%. Sama halnya dengan penelitian yang dilakukan Basak dan Candan (2010) terhadap minyak atsiri Eucalyptus camaldulensis 0.350 g/mL menghambat kerja enzim α-amilase dan α -glukosidase berturut-turut sebesar 48.22% dan 35.28%.
Penggunaan bahan alam dalam terapi pengendalian kadar gula darah pascamakan sudah banyak dilakukan di antaranya menggunakan daun mengkudu, buah mahkota dewa, daun sambiloto, dan daun salam.
Masyarakat Indonesia menggunakan daun salam sebagai pelengkap bumbu masak. Selain itu, daun salam dikenal memiliki khasiat untuk menyembuhkan diare, penyakit lambung, mabuk akibat alkohol, dan diabetes melitus. Studiawan dan Santosa (2005) melaporkan, ekstrak etanol daun salam dapat menurunkan kadar gula darah pada mencit yang diinduksi aloksan sebesar 12.97%, tetapi mekanisme menurunkan kadar gula darahnya belum diketahui.
Pengujian daun salam sebagai antidiabetes
dilakukan secara in vitro dengan
menggunakan enzim α-amilase, kemudian
dilakukan fraksionasi ekstrak teraktif menggunakan kromatografi kolom. Selanjutnya, dilakukan identifikasi kandungan fitokimia fraksi teraktif. Komponen kimia yang terkandung dalam fraksi teraktif diharapkan dapat digunakan sebagai obat antidiabetes. Tujuan penelitian ini adalah memperoleh fraksi teraktif untuk inhibisi α -amilase serta mengidentifikasi golongan senyawa yang terkandung dalam fraksi tersebut.
TINJAUAN PUSTAKA
Salam (Eugenia polyantha Wight.)
Salam (Gambar 1) mempunyai nama botani Eugenia polyatha Wight, tanaman ini
mempunyai nama lain Sczygium polyanthum
(Wight) Klasifikasi salam adalah sebagai berikut: kingdom Plantae, filum Magnoliophyta, kelas Magnoliate, ordo Myrtales, famili Myrtaceae, genus Eugenia,
spesies Eugenia polyantha Wight. Salam
merupakan tumbuhan liar yang dapat tumbuh di hutan, pegunungan, maupun di pekarangan rumah. Tumbuhan ini dapat ditemukan di dataran rendah maupun dataran tinggi (Tjitrosoepomo 1996).
Gambar 1 Tanaman salam (Eugenia polyantha).
1
PENDAHULUAN
Diabetes melitus (DM) adalah suatu penyakit metabolik yang dicirikan dengan tingginya kadar glukosa dalam darah (hiperglisemia) disertai terganggunya metabolisme karbohidrat, protein, dan lemak karena tubuh kekurangan insulin atau insulin tidak bekerja secara efektif. Menurut data yang dipublikasikan dalam jurnal Diabetes
Care tahun 2004, penderita diabetes di
Indonesia pada tahun 2000 mencapai 8.4 juta orang dan menempati urutan keempat setelah India, Cina, dan Amerika Serikat. Penderita diabetes secara menyeluruh sekitar 6% dari populasi penduduk dunia, 90% di antaranya diabetes tipe 2 (Subroto 2006).
Berbagai pendekatan farmakologis telah dilakukan untuk mengobati diabetes, di antaranya menstimulasi pelepasan insulin, menginhibisi glukoneogenesis, dan menurunkan absorpsi glukosa pada usus halus. Salah satu terapi yang bermanfaat untuk DM tipe 2 adalah pengendalian kadar gula darah pascamakan. Penurunan kadar gula darah pascamakan dapat dilakukan dengan menunda absorpsi glukosa melalui penghambatan kerja enzim penghidrolisis
karbohidrat, seperti α-amilase dan α
-glukosidase pada tahap pencernaan. Dengan adanya inhibitor enzim ini, waktu cerna karbohidrat menjadi lebih lama dan absorpsi glukosa dalam tubuh diperlambat sehingga kadar gula darah yang tinggi pascamakan
dapat dikendalikan (Geethalaksmi et al.
2010).
Beberapa penelitian melaporkan adanya korelasi yang positif antara aktivitas inhibisi
α-amilase dan α-glukosidase dalam suatu
ekstrak, artinya bila ekstrak tersebut aktif menghambat α-amilase maka ekstrak tersebut
aktif dalam menghambat α-glukosidase.
Penelitian yang dilakukan oleh Kim et al. (2005) menunjukkan ekstrak kulit batang pinus 60 g/mL dapat menghambat kerja enzim α-amilase dan α-glukosidase berturut-turut sebesar 97.2% dan 98.5%. Sama halnya dengan penelitian yang dilakukan Basak dan Candan (2010) terhadap minyak atsiri Eucalyptus camaldulensis 0.350 g/mL menghambat kerja enzim α-amilase dan α -glukosidase berturut-turut sebesar 48.22% dan 35.28%.
Penggunaan bahan alam dalam terapi pengendalian kadar gula darah pascamakan sudah banyak dilakukan di antaranya menggunakan daun mengkudu, buah mahkota dewa, daun sambiloto, dan daun salam.
Masyarakat Indonesia menggunakan daun salam sebagai pelengkap bumbu masak. Selain itu, daun salam dikenal memiliki khasiat untuk menyembuhkan diare, penyakit lambung, mabuk akibat alkohol, dan diabetes melitus. Studiawan dan Santosa (2005) melaporkan, ekstrak etanol daun salam dapat menurunkan kadar gula darah pada mencit yang diinduksi aloksan sebesar 12.97%, tetapi mekanisme menurunkan kadar gula darahnya belum diketahui.
Pengujian daun salam sebagai antidiabetes
dilakukan secara in vitro dengan
menggunakan enzim α-amilase, kemudian
dilakukan fraksionasi ekstrak teraktif menggunakan kromatografi kolom. Selanjutnya, dilakukan identifikasi kandungan fitokimia fraksi teraktif. Komponen kimia yang terkandung dalam fraksi teraktif diharapkan dapat digunakan sebagai obat antidiabetes. Tujuan penelitian ini adalah memperoleh fraksi teraktif untuk inhibisi α -amilase serta mengidentifikasi golongan senyawa yang terkandung dalam fraksi tersebut.
TINJAUAN PUSTAKA
Salam (Eugenia polyantha Wight.)
Salam (Gambar 1) mempunyai nama botani Eugenia polyatha Wight, tanaman ini
mempunyai nama lain Sczygium polyanthum
(Wight) Klasifikasi salam adalah sebagai berikut: kingdom Plantae, filum Magnoliophyta, kelas Magnoliate, ordo Myrtales, famili Myrtaceae, genus Eugenia,
spesies Eugenia polyantha Wight. Salam
merupakan tumbuhan liar yang dapat tumbuh di hutan, pegunungan, maupun di pekarangan rumah. Tumbuhan ini dapat ditemukan di dataran rendah maupun dataran tinggi (Tjitrosoepomo 1996).
Gambar 1 Tanaman salam (Eugenia polyantha).
2
Menurut Dalimartha (2000), salam merupakan pohon bertajuk rimbun dengan tinggi mencapai 25 m, batang bulat dengan permukaan licin, dan akar tunggang. Daun salam berbentuk lonjong dan elips. Selain itu, daun salam mempunyai sistem pertulangan yang menyirip, letaknya berhadapan, dan tunggal. Bunga salam majemuk bersusun, berwarna putih, dan baunya harum. Buahnya merupakan buah buni dengan bentuk bulat, rasanya sepat, berwarna hijau (saat muda), dan merah gelap (saat masak). Biji salam berwarna cokelat dan bentuknya bulat. Daun salam digunakan sebagai pelengkap bumbu masak, dan memiliki khasiat untuk menyembuhkan diare, penyakit lambung, mabuk akibat alkohol, dan diabetes melitus. Winarto (2004) menyatakan, daun salam mengandung tanin, flavonoid, dan minyak atsiri yang terdiri atas eugenol dan sitral. Beberapa senyawa fenolik telah diketahui dari daun tanaman ini, yaitu asam vanilat, asam p -hidroksibenzoat, flavonol dengan gugus hidroksil (OH) pada C3 terikat sebagai glikosida dan pada posisi 5, 7, 3’, dan 4 bebas (Belami et al. 1997). Sementara itu, pada kulit batang tanaman ini diketahui memiliki kandungan tanin terkondensasi sebesar 82.7% dan sisanya steroid atau triterpenoid. Tanin terkondensasi ini adalah prodelfinidin (Olivina et al. 2005).
Penelitian yang dilakukan oleh Studiawan dan Santosa (2005) menunjukkan bahwa ekstrak etanol daun salam dengan dosis 2.62 mg/20 g BB dapat menurunkan kadar glukosa darah mencit yang diinduksi aloksan sebesar 12.97%.
Diabetes Melitus
Diabetes melitus (DM) adalah suatu penyakit yang disebabkan oleh tingginya kadar glukosa (gula sederhana) di dalam darah karena tubuh tidak dapat melepaskan atau menggunakan insulin secara cukup. Insulin adalah hormon yang dilepaskan oleh organ pankreas, yang terletak di rongga perut dekat usus, dan merupakan zat utama yang bertanggung jawab dalam mempertahankan kadar gula darah normal. Insulin berfungsi mengubah gula darah menjadi gula otot dan disimpan ke dalam sel atau jaringan, yang digunakan untuk menghasilkan energi atau disimpan sebagai cadangan energi dalam bentuk gula otot. Menurut Suyono (2002), berdasarkan pada fungsi organ pankreas sebagai penghasil insulin dan pengatur kerja insulin, penyakit DM dapat digolongkan
menjadi dua kelompok, yaitu DM tipe 1 dan 2.
Penyakit DM tipe I bergantung pada insulin. Kadar glukosa darah meningkat akibat kurangnya kelenjar pankreas menyekresikan hormon insulin. Hormon insulin yang dihasilkan tidak mencukupi untuk mengubah glukosa darah menjadi glukosa intraseluler. Hal ini disebabkan sebagian besar sel beta pankreas yang memproduksi insulin mengalami kerusakan sehingga kadar insulin menjadi kurang atau tidak ada. Faktor lingkungan (berupa infeksi virus atau faktor gizi pada masa kanak-kanak atau dewasa awal) menyebabkan sistem kekebalan menghancurkan sel penghasil insulin di pankreas. Penyakit DM tipe 1 terjadi pada usia muda, gambaran klinisnya biasanya timbul pada masa kanak-kanak dan puncaknya pada masa puber. Diabetes tipe 1 hanya bisa diobati dengan terapi suntik insulin.
Penyakit DM tipe 2 tidak bergantung pada insulin, jumlah insulin normal bahkan lebih banyak dari batas normal, tetapi jumlah reseptor insulin yang terdapat pada permukaan sel kurang sehingga penyerapan glukosa ke dalam sel terhambat. Keadaan ini akan menyebabkan meningkatnya kadar glukosa darah dan menurunnya kadar glukosa intraseluler. Penyakit ini disebabkan oleh obesitas, diet tinggi lemak, rendah serat, kurang gerak badan, dan faktor herediter. Peningkatan gula darah pascamakan (postprandial hyperglycemia) merupakan awal terganggunya metabolisme yang terjadi pada DM tipe 2 (Suyono 2002).
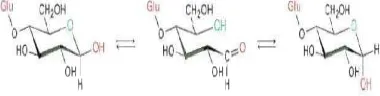
Alfa-am glukanohidr menghidroli acak (Fesse ini terdapat Pati ialah po pada tumbu padi, dan g atas amilosa adalah ami amilopektin dari α-D-glu ikatan α -amilopektin Hidrolisis pa maltosa se Terdapat 25 molekul bergantung tumbuhan. Gambar Amilop lebih besar 1000 satuan Seperti am amilopektin Bedanya bercabang Alfa-am milase atau rolase adal isis pati men enden & Fess dalam air liur olisakarida sim uhan tinggi, s
gandum. Hom a dan amilopek ilosa dan 8
. Amilosa ad ukosa yang
1,4’. Struk dapat diliha arsial amilosa ebagai satu-50 satuan glu
amilosa; b
pada spe
(a)
(b)
2 Struktur (a amilopekt
ektin ialah po daripada am n glukosa atau milosa, rant
mengandun dengan am sehingga ter
ilase
u α-1,4-gl
ah enzim njadi maltosa senden 1986). r dan cairan pa mpanan yang t seperti pada k mopolimer ini ktin, sekitar 2 0% sisanya dalah polimer
dihubungkan ktur amilosa
at pada Gam a hanya mengh -satunya dis ukosa atau le
banyaknya esies hewan
a) amilosa dan tin (McMurry
olisakarida ya milosa, meng
u lebih per m tai utama ng 1,4’-α-D-g milosa, amil rdapat satu lukan-4-yang a secara . Enzim ankreas. terdapat kentang, i terdiri 20% pati adalah r linear dengan a dan mbar 2. hasilkan akarida. ebih per satuan n atau n (b) 2008). ang jauh gandung molekul. dalam glukosa. lopektin glukosa G ujung untuk Ikatan pada t 1,6’-α-glikosi amilopektin sedangkan hi suatu campur Maltosa parsial pati satuan D-glu dari satuan maltosa me hemiasetal. anomer malto kesetimbanga (Gambar 3). dan bersifat g
Gambar 3 Be ma (an ran
Senyawa antidiabetes d kompleks kar terpenoid, p flavonoid, lip anorganik antidiabetes gula darah a berkompetisi dengan insul menstimulasi merintangi k menstimulasi penyerapan Farnwort 199 Tanaman oleh herbalis tipe 2. Da penderita te dipantau seca berarti dapa Bagaimanapu penderita DM dan pengend dilakukan hipoglisemia dengan herba tipe 2 dapat
kira-kira tiap titik percaban ida. Hidr
menghasilk idrolisis parsia ran maltosa da
yang dihasil secara enzim ukopiranosa.
kedua glu erupakan ba Akibatnya, t osa (α- dan β) an satu sama
Maltosa me gula pereduksi
erbagai bentuk altosa dari kiri
nomer β),
ntai terbuka), m
Antidiabe bahan alam ditemukan da rbohidrat, alk peptida dan pid, kumarin, dan lainn yang meliput ada banyak, d
langsung in, menstimu i glikogenesis kanal kalium i cAMP, glukosa dari 95). antidiabetes dalam mengo lam beberap erhadap peng ara saksama da at diperoleh un, pengguna M tipe 1 dap dalian terhadap untuk men
atau hipergl a antidiabetes
menurunkan
25 satuan gl ngannya ialah
rolisis le kan α-D-gl alnya mengha an isomaltosa. lkan dari hid matis memilik Karbon ano ukopiranosa agian dari
terdapat 2 b ) yang berada
lain dalam l engalami mut
i.
k karbon ano i ke kanan : m maltosa (al maltosa (anom
etes
m dengan ak alam bentuk tu kaloid, glikope n amina, s
senyawa sulfu nya. Meka ti penurunan di antaranya
secara berla ulasi sekresi in
s dan glikolisi sel beta pan dan mengh i usus (Mar
s lazim digu obati penderit pa kasus, re gobatan ini an keuntungan dari terap aan herbal in pat membaha p gula darah ncegah terj isemia. Peng pada penderi n kadar gula
3
lukosa. ikatan engkap lukosa, asilkan . drolisis ki dua omerik dalam gugus bentuk dalam larutan arotasi omerik maltosa dehida mer α).4
karena bekerja memengaruhi insulin. Salah satu cara mengendalikan kadar gula darah pada penderita DM tipe 2 adalah dengan menghambat aktivitas enzim penghidrolisis
karbohidrat seperti α-amilase dan α
-glukosidase. Kedua enzim ini bertanggung jawab terhadap pengubahan karbohidrat menjadi glukosa. Salah satu obat hipoglisemik oral yang digunakan sebagai inhibitor enzim ini adalah akarbosa (Gambar 4).
Gambar 4 Struktur kimia akarbosa.
Akarbosa bekerja dengan memperlambat pemecahan karbohidrat seperti disakarida, polisakarida, dan karbohidrat kompleks lainnya menjadi monosakarida. Karbohidrat secara normal diubah terlebih dahulu menjadi monosakarida untuk dapat diserap oleh usus menjadi glukosa darah. Dengan demikian, akarbosa dapat mengurangi konsentrasi gula darah akibat karbohidrat yang dikonsumsi. Akarbosa (obat sintetik) dapat menghambat kerja enzim α-amilase yang dihasilkan oleh
pankreas dan α-glukosidase yang terdapat
pada usus halus. Struktur kimia akarbosa ditunjukkan pada Gambar 4. Penggunaan obat sintetik ini menimbulkan efek samping, misalnya kembung, diare, dan kram usus.
Ekstraksi dan Fraksionasi Senyawa Metabolit Sekunder dari Tanaman
Ekstraksi merupakan suatu proses yang secara selektif mengambil zat terlarut yang terkandung dalam suatu campuran dengan bantuan pelarut. Metode pemisahan pada ekstraksi pelarut menggunakan prinsip kelarutan like dissolve like, yaitu pelarut polar akan melarutkan zat polar dan sebaliknya. Dalam pemilihan pelarut, hal-hal yang perlu dipertimbangkan adalah selektivitas, sifat racun, dan kemudahannya untuk diuapkan (Khopkar 2002).
Salah satu prosedur klasik untuk memperoleh kandungan senyawa organik dari jaringan tumbuhan adalah maserasi. Metode maserasi digunakan untuk mengekstrak sampel yang relatif tidak tahan panas. Metode ini dilakukan dengan merendam sampel dalam suatu pelarut tanpa menggunakan pemanasan. Kelebihan metode maserasi, yaitu lebih
sederhana, relatif murah, serta dapat menghindari kerusakan komponen senyawa yang tidak tahan panas. Kelemahannya di antaranya dari segi waktunya lama, dan penggunaan pelarut yang tidak efisien (Meloan 1999).
Ekstraksi cair-cair merupakan metode ekstraksi yang didasarkan pada sifat kelarutan komponen target dan distribusinya dalam dua pelarut yang tidak saling bercampur. Senyawa polar akan terbawa dalam pelarut polar, senyawa semipolar akan terbawa dalam pelarut yang semipolar, dan senyawa nonpolar akan terbawa dalam pelarut nonpolar. Ekstraksi cair-cair bertahap merupakan teknik ekstraksi cair-cair yang paling sederhana, cukup dengan menambahkan pelarut pengekstraksi yang tidak saling bercampur kemudian dilakukan pengocokan sehingga terjadi distribusi zat terlarut di antara kedua pelarut (Khopkar 2002).
Dalam hal ini, pemisahan zat yang polar dan nonpolar dapat dilakukan dengan ekstraksi cair-cair (partisi) dalam corong pisah. Pengocokan bertujuan memperluas area permukaan kontak di antara kedua pelarut sehingga pendistribusian zat terlarut di antara keduanya dapat berlangsung dengan baik. Syarat pelarut untuk ekstraksi cair-cair adalah memiliki kepolaran yang sesuai dengan bahan yang diekstraksi dan harus terpisah setelah pengocokan (Harvey 2000).
Kromatografi lapis tipis (KLT) merupakan jenis kromatografi partisi menggunakan sebuah lapis tipis silika atau alumina yang seragam pada sebuah lempeng gelas atau logam yang keras. Fase diam untuk kromatografi lapis tipis sering kali mengandung substansi yang dapat berpendar dalam sinar ultraviolet. Fase gerak merupakan pelarut atau campuran pelarut yang sesuai (Furniss et al. 1989). Pada KLT, pergerakan zat relatif terhadap garis depan pelarut dalam sistem kromatografi tertentu dapat
didefinisikan sebagai nilai Rf, yaitu
perbandingan jarak tempuh zat dengan jarak tempuh garis depan pelarut.
5
dialirkan secara kontinu melalui kolom dan komponen demi komponen dari campuran yang pada akhirnya keluar dari kolom dapat dikumpulkan dan difraksionasi (Rouessac & Rouessac 1994).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan antara lain peralatan kaca, neraca analitik, oven, cawan porselin, eksikator, penguap putar, penangas air, pengaduk magnet, lempeng pemanas, spektrofotometer Genesys, bejana kromatografi, kolom, dan lampu UV.
Bahan-bahan yang digunakan adalah daun salam keenam sampai kesepuluh dari pucuk yang berasal dari Citayam, etanol 96%, akuades, n-heksana, etil asetat, metanol, n -butanol, aseton, asam asetat glasial, dimetil
sulfoksida (DMSO), FeCl3 1%, anhidrida
asam asetat, kloroform, NH4OH, dietil eter,
pereaksi Lieberman-Burchard, serbuk Mg,
amil alkohol, H2SO4 2 M, pereaksi
Dragendorff, Meyer, dan Wagner, HCl pekat, silika gel G60 (Merck 230-400 mesh), pelat
silika gel G60 F254 (Merck), alumunium foil,
Na2HPO4.2H2O, NaH2PO4.H2O, NaOH, NaCl,
Na2SO3, pati terlarut, kalium natriumtartarat,
tablet Glucobay (Bayer), enzim α-amilase tipe VI-B (Sigma Aldrich Inc) dan asam 3,5-dinitrosalisilat (Sigma Aldrich Inc) .
Metode
Metode penelitian mengikuti diagram alir pada Lampiran 1 yang meliputi penyiapan sampel, penentuan kadar air daun salam dan serbuk daun salam, ekstraksi serbuk daun salam, ekstraksi cair-cair, uji aktivitas α -amilase, penentuan eluen terbaik dengan KLT, fraksinasi menggunakan kromatografi kolom, analisis fitokimia dari ekstrak dan fraksi teraktif.
Penyiapan Sampel
Daun salam dikumpulkan dari daerah Kampung Baru, Citayam, Bogor. Daun salam yang digunakan adalah daun keenam sampai kesepuluh dari pucuk tanaman. Daun salam dicuci, dipotong kecil-kecil, dikering-udarakan, kemudian digiling hingga diperoleh serbuk daun salam. Serbuk tersebut selanjutnya disimpan dalam wadah kedap udara.
Penentuan Kadar Air Serbuk Daun Salam
Cawan porselin dicuci bersih dan dikeringkan di dalam oven bersuhu 105 °C selama 30 menit. Selanjutnya cawan didinginkan dalam eksikator selama 30 menit, kemudian ditimbang bobot kosongnya. Sebanyak 3 g sampel dimasukkan ke dalam cawan dan dikeringkan di dalam oven pada suhu 105 °C selama 2x24 jam. Cawan beserta isinya didinginkan dalam eksikator sekitar 30 menit kemudian ditimbang. Proses pengeringan dan penimbangan diulang kembali sampai diperoleh bobot konstan. Penentuan kadar air dilakukan sebanyak tiga kali ulangan.
Kadar air (%) = A – B × 100% A
Keterangan:
A = bobot bahan sebelum dikeringkan (g) B = bobot bahan setelah dikeringkan (g)
Ekstraksi
Serbuk daun salam sebanyak 100 g dimaserasi dengan 1 L etanol 96% pada suhu ruang selama 24 jam. Setelah itu, maserat dipisahkan kemudian residu dimaserasi kembali dengan jenis dan jumlah pelarut yang sama. Maserasi dilakukan sebanyak 3 kali pengulangan. Semua maserat dikumpulkan dan dipekatkan dengan penguap putar. Bobot ekstrak kering yang diperoleh kemudian ditimbang. Rendemen ekstrak dihitung dengan membandingkan bobot ekstrak yang diperoleh terhadap bobot sampel awal, dengan faktor koreksi berupa kadar air sampel yang digunakan.
Ekstraksi Cair-Cair Ekstrak Daun Salam
Ekstrak etanol daun salam sebanyak 3 g ditambahkan dengan 100 mL akuades dan dimasukkan ke dalam corong pisah. Larutan
kemudian ditambah n-heksana dengan
perbandingan 1:1 v/v dan diekstraksi. Fraksi
n-heksana dipisahkan dan fraksi air
5
dialirkan secara kontinu melalui kolom dan komponen demi komponen dari campuran yang pada akhirnya keluar dari kolom dapat dikumpulkan dan difraksionasi (Rouessac & Rouessac 1994).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan antara lain peralatan kaca, neraca analitik, oven, cawan porselin, eksikator, penguap putar, penangas air, pengaduk magnet, lempeng pemanas, spektrofotometer Genesys, bejana kromatografi, kolom, dan lampu UV.
Bahan-bahan yang digunakan adalah daun salam keenam sampai kesepuluh dari pucuk yang berasal dari Citayam, etanol 96%, akuades, n-heksana, etil asetat, metanol, n -butanol, aseton, asam asetat glasial, dimetil
sulfoksida (DMSO), FeCl3 1%, anhidrida
asam asetat, kloroform, NH4OH, dietil eter,
pereaksi Lieberman-Burchard, serbuk Mg,
amil alkohol, H2SO4 2 M, pereaksi
Dragendorff, Meyer, dan Wagner, HCl pekat, silika gel G60 (Merck 230-400 mesh), pelat
silika gel G60 F254 (Merck), alumunium foil,
Na2HPO4.2H2O, NaH2PO4.H2O, NaOH, NaCl,
Na2SO3, pati terlarut, kalium natriumtartarat,
tablet Glucobay (Bayer), enzim α-amilase tipe VI-B (Sigma Aldrich Inc) dan asam 3,5-dinitrosalisilat (Sigma Aldrich Inc) .
Metode
Metode penelitian mengikuti diagram alir pada Lampiran 1 yang meliputi penyiapan sampel, penentuan kadar air daun salam dan serbuk daun salam, ekstraksi serbuk daun salam, ekstraksi cair-cair, uji aktivitas α -amilase, penentuan eluen terbaik dengan KLT, fraksinasi menggunakan kromatografi kolom, analisis fitokimia dari ekstrak dan fraksi teraktif.
Penyiapan Sampel
Daun salam dikumpulkan dari daerah Kampung Baru, Citayam, Bogor. Daun salam yang digunakan adalah daun keenam sampai kesepuluh dari pucuk tanaman. Daun salam dicuci, dipotong kecil-kecil, dikering-udarakan, kemudian digiling hingga diperoleh serbuk daun salam. Serbuk tersebut selanjutnya disimpan dalam wadah kedap udara.
Penentuan Kadar Air Serbuk Daun Salam
Cawan porselin dicuci bersih dan dikeringkan di dalam oven bersuhu 105 °C selama 30 menit. Selanjutnya cawan didinginkan dalam eksikator selama 30 menit, kemudian ditimbang bobot kosongnya. Sebanyak 3 g sampel dimasukkan ke dalam cawan dan dikeringkan di dalam oven pada suhu 105 °C selama 2x24 jam. Cawan beserta isinya didinginkan dalam eksikator sekitar 30 menit kemudian ditimbang. Proses pengeringan dan penimbangan diulang kembali sampai diperoleh bobot konstan. Penentuan kadar air dilakukan sebanyak tiga kali ulangan.
Kadar air (%) = A – B × 100% A
Keterangan:
A = bobot bahan sebelum dikeringkan (g) B = bobot bahan setelah dikeringkan (g)
Ekstraksi
Serbuk daun salam sebanyak 100 g dimaserasi dengan 1 L etanol 96% pada suhu ruang selama 24 jam. Setelah itu, maserat dipisahkan kemudian residu dimaserasi kembali dengan jenis dan jumlah pelarut yang sama. Maserasi dilakukan sebanyak 3 kali pengulangan. Semua maserat dikumpulkan dan dipekatkan dengan penguap putar. Bobot ekstrak kering yang diperoleh kemudian ditimbang. Rendemen ekstrak dihitung dengan membandingkan bobot ekstrak yang diperoleh terhadap bobot sampel awal, dengan faktor koreksi berupa kadar air sampel yang digunakan.
Ekstraksi Cair-Cair Ekstrak Daun Salam
Ekstrak etanol daun salam sebanyak 3 g ditambahkan dengan 100 mL akuades dan dimasukkan ke dalam corong pisah. Larutan
kemudian ditambah n-heksana dengan
perbandingan 1:1 v/v dan diekstraksi. Fraksi
n-heksana dipisahkan dan fraksi air
6
dan air kemudian dipekatkan dengan penguap putar. Rendemen ekstrak dihitung dengan membandingkan bobot ekstrak yang diperoleh terhadap bobot sampel awal.
Pembuatan Larutan untuk Uji Inhibisi α -Amilase
Larutan enzim α-amilase 5U/mL. Enzim
α-amilase sebanyak 0.0215 g dilarutkan dalam 100 mL bufer fosfat 20 mM (pH 6.9) yang mengandung NaCl 6.7 mM, diaduk sampai homogen.
Larutan substrat 0.5%. Pati terlarut sebanyak 0.5 g dilarutkan dalam 100 mL akuades, dididihkan dengan lempeng pemanas sambil terus diaduk menggunakan pengaduk magnet hingga homogen. Pendidihan dilakukan selama 15 menit sampai diperoleh larutan pati yang jernih.
Larutan Asam 3,5-dinitrosalisilat (DNS) 1%. Sebanyak 1 g kristal NaOH dilarutkan dalam 100 mL akuadestilata, diaduk menggunakan pengaduk magnet, ditambahkan 18.2 g kalium natrium tartarat, sambil terus diaduk lalu ditambahkan 1 g asam 3,5-dinitrosalisilat dan 0.15 g Na2SO3,
pengadukan dilanjutkan sampai homogen.
Uji Inhibisi α-Amilase (Odhav et al. 2010)
Pengujian inhibisi α-amilase dilakukan terhadap ekstrak etanol, fraksi hasil ekstraksi cair-cair, dan fraksi hasil kromatografi kolom.
Inhibisi α-amilase ditentukan dengan
menghitung gula pereduksi yang dihasilkan pada kondisi percobaan. Inhibisi enzim dihitung sebagai penurunan jumlah maltosa yang terbentuk. Metode asam 3,5-dinitrosalisilat (DNS), metode kromogenik yang dikembangkan oleh Bernfeld pada tahun 1955, digunakan untuk memperkirakan ekivalen maltosa yang terbentuk. Pengujian dilakukan dengan menyiapkan larutan ekstrak etanol, fraksi hasil ekstraksi cair-cair, dan fraksi hasil kromatografi kolom dengan konsentrasi 0.1% (b/v dalam DMSO). Sebanyak 1 mL larutan sampel ditambahkan 1 mL larutan enzim 5U/mL, dihomogenkan, diinkubasi selama 30 menit pada suhu 37 ºC. Setelah itu, ditambahkan 1 mL larutan substrat 0.5% b/v dalam akuades, dihomogenkan, diinkubasi kembali selama 10 menit. Larutan hasil inkubasi, ditambahkan 1 mL larutan DNS 1% lalu dipanaskan dalam penangas air mendidih selama 10 menit sampai terbentuk warna merah kecoklatan. Larutan tersebut didinginkan sampai suhu ruang lalu ditambahkan 10 mL akuades. Sistem reaksi
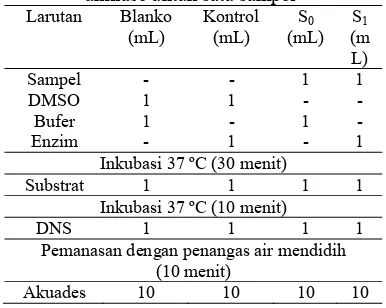
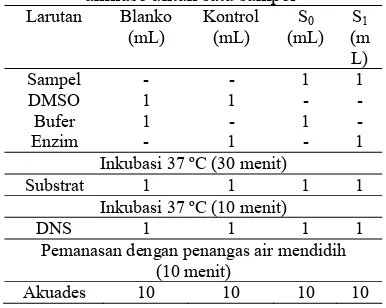
pengujian enzim untuk satu sampel dapat ditampilkan pada Tabel 1.
Tabel 1 Sistem reaksi pengujian enzim α -amilase untuk satu sampel
Larutan Blanko (mL)
Kontrol (mL)
S0
(mL) S1
(m L) Sampel - - 1 1 DMSO 1 1 - - Bufer 1 - 1 - Enzim - 1 - 1
Inkubasi 37 ºC (30 menit)
Substrat 1 1 1 1 Inkubasi 37 ºC (10 menit)
DNS 1 1 1 1
Pemanasan dengan penangas air mendidih (10 menit)
Akuades 10 10 10 10
Serapan larutan diukur menggunakan spektrofotometer Genesys pada panjang gelombang 540 nm. Panjang gelombang ini merupakan panjang gelombang maksimum asam 3-amino-5-nitrosalisilat. Serapan larutan yang diukur adalah serapan blanko, serapan kontrol, serapan sampel dengan enzim dan sampel tanpa enzim. Larutan kontrol berisi DMSO, enzim, substrat, dan DNS, sedangkan larutan blanko sama seperti kontrol hanya tidak berisi larutan enzim tetapi bufer. Larutan sampel dengan enzim berisi larutan sampel, enzim, substrat, dan DNS, sedangkan pada larutan sampel tanpa enzim, larutan enzim diganti dengan bufer. Banyaknya maltosa yang terbentuk sebanding dengan asam 3-amino-5-nitrosalisilat yang terukur. Semakin banyak maltosa yang terbentuk, semakin tinggi serapan asam 3-amino-5-nitrosalisilat yang terukur. Persentase inhibisi α-amilase ditentukan menggunakan persamaan berikut :
% inhibisi = K S S
K × 100%
Keterangan : K : Serapan kontrol B : Serapan blanko
S1 : Serapan sampel dan produk yang
terbentuk S0 : Serapan sampel
Penentuan Eluen Terbaik
Pelat kromatografi lapis tipis (KLT) yang digunakan adalah pelat aluminium jenis silika gel G60 F254 dari Merck dengan ukuran lebar 1
7
Fraksi air daun salam ditotolkan pada pelat KLT sebanyak 15 kali penotolan. Setelah kering, pelat dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Elusi dilakukan dengan menggunakan eluen tunggal, yaitu kloroform, etil asetat, n-butanol, etanol, aseton, metanol, asetat glasial, dan air. Noda yang dihasilkan dari proses elusi masing-masing eluen diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm. Eluen yang menghasilkan noda terbanyak dan terpisah dipilih sebagai eluen terbaik.
Fraksionasi dengan Kromatografi Kolom
Fraksionasi dilakukan dengan kolom kemas menggunakan silika gel sebanyak 60 g. Diameter kolom yang digunakan sebesar 2.5 cm dengan tinggi adsorben 30 cm. Sampel berupa fraksi air daun salam 1.50 g diaplikasikan ke dalam kolom. Pemisahan komponen dilakukan dengan elusi landaian menggunakan eluen metanol:air dengan perbandingan (100:0) dan (0:100). Eluat ditampung setiap 5 mL dalam tabung reaksi yang telah diberi nomor kemudian diuji dengan KLT menggunakan eluen terbaik. Noda pemisahan dideteksi di bawah lampu UV dengan 254 dan 366 nm. Eluat dengan
nilai Rf dan pola KLT yang hampir sama
digabungkan sebagai satu fraksi. Setiap fraksi dipekatkan kemudian dihitung rendemennya. Semua fraksi yang diperoleh digunakan untuk analisis tahap selanjutnya, yaitu uji inhibisi α -amilase untuk menentukan fraksi teraktif. Fraksi teraktif yang diperoleh dianalisis kandungan fitokimia.
Uji Fitokimia
Uji fitokimia dilakukan terhadap ekstrak etanol, fraksi teraktif hasil ekstraksi cair-cair, dan fraksi teraktif hasil pemisahan dengan kromatografi kolom.
Uji Flavonoid. Sampel sebanyak 0.1 g ditambah 10 mL air panas, dididihkan selama 5 menit, kemudian disaring. Filtrat sebanyak 10 ml ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat. Uji positif ditandai dengan timbulnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Saponin dan Tanin. Sampel sebanyak 0.1 g dilarutkan dengan 10 mL akuadestilata kemudian dididihkan selama 5 menit. Campuran disaring dan filtrat dibagi ke dalam 2 tabung reaksi. Bagian pertama digunakan untuk uji saponin; filtrat didiamkan
sampai agak dingin kemudian dikocok kuat sampai timbul busa. Bila busa stabil dalam 10 menit, maka filtrat positif mengandung saponin. Bagian kedua digunakan untuk uji tanin; filtrat ditambahkan FeCl3 1%. Bila
dihasilkan warna hijau, biru, atau hitam, maka filtrat positif mengandung tanin.
Uji Alkaloid. Sampel sebanyak 0.1 g dilarutkan dalam 10 mL kloroform dan
ditambah beberapa tetes NH4OH kemudian
disaring ke dalam tabung reaksi tertutup. Ekstrak kloroform dalam tabung reaksi ditambahkan 10 tetes H2SO4 2 M, dikocok
kuat kemudian lapisan asamnya dipindahkan ke tabung reaksi yang lain. Lapisan asam ini diteteskan pada pelat tetes dan ditambahkan pereaksi Meyer, Wagner, dan Dragendorff. Uji positif apabila terbentuk endapan dengan warna berturut-turut putih, cokelat, dan merah jingga.
Uji Triterpenoid dan Steroid sebanyak 0.1 g dilarutkan dalam 25 mL etanol panas, disaring, dan residu ditambahkan dietil eter. Filtrat ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan munculnya warna merah atau ungu untuk triterpenoid dan hijau atau biru untuk steroid.
HASIL DAN PEMBAHASAN
Kadar Air Daun Salam
Penetapan kadar air dalam suatu bahan bertujuan mengetahui banyaknya air yang terkandung dalam suatu bahan, mengoreksi rendemen hasil ekstraksi, mengetahui masa simpan bahan serta ketahanan bahan tersebut terhadap mikrob. Dalam penelitian ini, penetapan kadar air dilakukan terhadap daun salam segar dan serbuk daun salam kering. Kadar air daun salam segar yang diperoleh sebesar 60.98% (b/b daun segar) (Lampiran 2). Air yang terkandung dalam daun salam lebih sedikit dibandingkan dengan air yang terkandung dalam kebanyakan daun tumbuhan, yaitu sekitar 90% (Harborne 1987).
7
Fraksi air daun salam ditotolkan pada pelat KLT sebanyak 15 kali penotolan. Setelah kering, pelat dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Elusi dilakukan dengan menggunakan eluen tunggal, yaitu kloroform, etil asetat, n-butanol, etanol, aseton, metanol, asetat glasial, dan air. Noda yang dihasilkan dari proses elusi masing-masing eluen diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm. Eluen yang menghasilkan noda terbanyak dan terpisah dipilih sebagai eluen terbaik.
Fraksionasi dengan Kromatografi Kolom
Fraksionasi dilakukan dengan kolom kemas menggunakan silika gel sebanyak 60 g. Diameter kolom yang digunakan sebesar 2.5 cm dengan tinggi adsorben 30 cm. Sampel berupa fraksi air daun salam 1.50 g diaplikasikan ke dalam kolom. Pemisahan komponen dilakukan dengan elusi landaian menggunakan eluen metanol:air dengan perbandingan (100:0) dan (0:100). Eluat ditampung setiap 5 mL dalam tabung reaksi yang telah diberi nomor kemudian diuji dengan KLT menggunakan eluen terbaik. Noda pemisahan dideteksi di bawah lampu UV dengan 254 dan 366 nm. Eluat dengan
nilai Rf dan pola KLT yang hampir sama
digabungkan sebagai satu fraksi. Setiap fraksi dipekatkan kemudian dihitung rendemennya. Semua fraksi yang diperoleh digunakan untuk analisis tahap selanjutnya, yaitu uji inhibisi α -amilase untuk menentukan fraksi teraktif. Fraksi teraktif yang diperoleh dianalisis kandungan fitokimia.
Uji Fitokimia
Uji fitokimia dilakukan terhadap ekstrak etanol, fraksi teraktif hasil ekstraksi cair-cair, dan fraksi teraktif hasil pemisahan dengan kromatografi kolom.
Uji Flavonoid. Sampel sebanyak 0.1 g ditambah 10 mL air panas, dididihkan selama 5 menit, kemudian disaring. Filtrat sebanyak 10 ml ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat. Uji positif ditandai dengan timbulnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Saponin dan Tanin. Sampel sebanyak 0.1 g dilarutkan dengan 10 mL akuadestilata kemudian dididihkan selama 5 menit. Campuran disaring dan filtrat dibagi ke dalam 2 tabung reaksi. Bagian pertama digunakan untuk uji saponin; filtrat didiamkan
sampai agak dingin kemudian dikocok kuat sampai timbul busa. Bila busa stabil dalam 10 menit, maka filtrat positif mengandung saponin. Bagian kedua digunakan untuk uji tanin; filtrat ditambahkan FeCl3 1%. Bila
dihasilkan warna hijau, biru, atau hitam, maka filtrat positif mengandung tanin.
Uji Alkaloid. Sampel sebanyak 0.1 g dilarutkan dalam 10 mL kloroform dan
ditambah beberapa tetes NH4OH kemudian
disaring ke dalam tabung reaksi tertutup. Ekstrak kloroform dalam tabung reaksi ditambahkan 10 tetes H2SO4 2 M, dikocok
kuat kemudian lapisan asamnya dipindahkan ke tabung reaksi yang lain. Lapisan asam ini diteteskan pada pelat tetes dan ditambahkan pereaksi Meyer, Wagner, dan Dragendorff. Uji positif apabila terbentuk endapan dengan warna berturut-turut putih, cokelat, dan merah jingga.
Uji Triterpenoid dan Steroid sebanyak 0.1 g dilarutkan dalam 25 mL etanol panas, disaring, dan residu ditambahkan dietil eter. Filtrat ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan munculnya warna merah atau ungu untuk triterpenoid dan hijau atau biru untuk steroid.
HASIL DAN PEMBAHASAN
Kadar Air Daun Salam
Penetapan kadar air dalam suatu bahan bertujuan mengetahui banyaknya air yang terkandung dalam suatu bahan, mengoreksi rendemen hasil ekstraksi, mengetahui masa simpan bahan serta ketahanan bahan tersebut terhadap mikrob. Dalam penelitian ini, penetapan kadar air dilakukan terhadap daun salam segar dan serbuk daun salam kering. Kadar air daun salam segar yang diperoleh sebesar 60.98% (b/b daun segar) (Lampiran 2). Air yang terkandung dalam daun salam lebih sedikit dibandingkan dengan air yang terkandung dalam kebanyakan daun tumbuhan, yaitu sekitar 90% (Harborne 1987).
8
tinggi, enzim masih aktif, sedangkan substrat tidak ada, maka enzim tersebut akan bereaksi dengan kandungan kimia yang telah terbentuk dan mengubahnya menjadi produk lain yang mungkin tidak memiliki aktivitas farmakologi sama seperti senyawa aslinya (Katno 2008). Kadar air serbuk daun salam yang diperoleh sebesar 7.29% (b/b serbuk kering) (Lampiran 3), lebih kecil dibandingkan dengan kadar air yang dilaporkan Adyana et al. (2005), yakni sebesar 8.80%. Jumlah air yang terkandung dalam suatu bahan berbeda-beda, bergantung pada perlakuan yang dialami bahan serta kelembapan tempat disimpannya bahan tersebut (Harjadi 1986). Suatu sampel dikatakan baik dan dapat disimpan dalam jangka waktu lama bila memiliki kadar air <10% karena pada tingkat kadar air tersebut, sampel relatif terhindar dari cemaran mikrob penyebab kerusakan sampel (Winarno 1995). Kadar air serbuk salam yang diperoleh <10%, berarti serbuk daun salam dapat disimpan lama. Menurut Harjadi (1986), air yang terikat secara fisik dalam suatu bahan dapat dihilangkan dengan memanaskan bahan tersebut pada suhu 100
–
105 °C.Analisis Hasil Ekstraksi
Ekstraksi serbuk daun salam dilakukan dengan metode maserasi. Maserasi merupakan metode ekstraksi dengan cara merendam sampel menggunakan pelarut yang sesuai dalam jangka waktu tertentu. Metode sederhana ini dapat digunakan untuk mengekstraksi komponen bahan alam dalam sampel yang tidak tahan (termolabil) atau tahan terhadap pemanasan (termostabil) sehingga kerusakan komponen dapat dihindari (Meloan 1999).
Rendemen ekstrak etanol diperoleh sebesar 13.68% (b/b serbuk kering) (Lampiran 4). Digunakan pelarut etanol karena komponen yang diduga aktif sebagai antidiabetes dalam daun salam adalah flavonoid dan tanin. Flavonoid dan tanin merupakan senyawa fenolik yang larut dalam etanol. Di samping itu, etanol termasuk golongan alkohol yang digunakan untuk ekstraksi komponen kimia yang terkandung dalam jaringan tanaman secara keseluruhan (Harborne 1987), dalam penelitian ini dilakukan ekstraksi daun salam secara keseluruhan.
Komponen kimia yang terdapat dalam jaringan tanaman dapat terekstraksi karena adanya perbedaan konsentrasi larutan di dalam dan di luar jaringan. Larutan dengan
konsentrasi tinggi terdapat dalam jaringan tanaman, berkesetimbangan dengan larutan konsentrasi rendah di luar jaringan (pelarut) sehingga komponen yang terdapat dalam jaringan terbawa oleh pelarut. Ekstrak etanol yang diperoleh dipisahkan ke dalam fraksi-fraksi agar lebih sederhana, yaitu fraksi-fraksi nonpolar, semipolar, dan polar. Pemisahan ke dalam fraksi-fraksi tersebut menggunakan metode ekstraksi cair-cair. Pelarut yang digunakan adalah n-heksana, etil asetat, dan air. Prinsip pemisahan ini, berdasarkan pada kesamaan sifat senyawa dengan pelarut. Rendemen fraksi n-heksana, etil asetat, dan air berturut-turut sebesar 8.59, 2.30, dan 1.32% (b/b serbuk kering) (Lampiran 5).
Ekstrak etanol dilarutkan dalam air, diekstraksi cair-cair dengan n-heksana dan etil asetat. Adanya perbedaan kepolaran antara air dan n-heksana menyebabkan terbentuknya 2 lapisan. Air memiliki rapatan sebesar 1 g/mL, sedangkan n-heksana sebesar 0.6 g/mL. Oleh karena itu, senyawa yang terlarut dalam air (senyawa polar) terdapat pada lapisan bawah, sedangkan senyawa yang terlarut dalam n -heksana (senyawa nonpolar) berada pada lapisan atas.
Fraksi air awal yang diperoleh diekstraksi kembali menggunakan etil asetat. Etil asetat bersifat semipolar sehingga dapat mengestrak senyawa yang bersifat semipolar pada fraksi air awal. Etil asetat juga memiliki rapatan yang lebih kecil daripada air (0.8 g/mL), maka senyawa yang terlarut dalam etil asetat terdapat pada lapisan atas. Hasil ekstraksi cair-cair menunjukkan bahwa dalam ekstrak etanol (96%) daun salam mengandung fraksi nonpolar yang lebih banyak dibandingkan dengan fraksi semipolar dan fraksi polar.
Aktivitas Inhibisi α-Amilase
Aktivitas antidiabetes ekstrak etanol daun salam dan semua fraksi yang diperoleh diamati secara in vitro menggunakan metode spekrofotometri, dengan menguji aktivitas ekstrak dan fraksi dalam menghambat kerja
enzim α-amilase. Metode yang digunakan
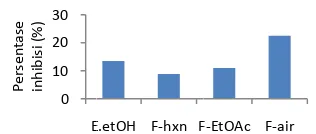
Gambar 5
Penguji terdiri dari 2 menjadi ma amilase, da dinitrosalisil nitrosalisilat berlangsung kondisi bufe dengan kon larutan DN reaksi hidro perubahan p basa. Reaks berlangsung tinggi di at bertujuan m aktif suatu enzim α-am amino-5-nitr Semua menunjukka kerja enzim yang berbed aktivitas in dibandingka heksana, da Persentase ekstrak etan asetat, dan 13.52, 8.86, Ekstrak
inhibisi α
dibandingka ekstraksi ca sangat dimu etanol masi ruahan (belu komponen k maltosa Anion maltobi Reduksi asam
menjadi a
nitrosalisilat 2010).
ian aktivitas 2 tahapan. Ta altosa yang d an tahap 2, lat menjadi t. Reaksi hidr g pada suhu er fosfat. Kon ndisi reaksi d S ditambahka olisis pati ter pH larutan, da si reduksi asa g pada suasa tas 100 °C. P mengencerkan
sampel dalam milase, semak rosalisilat yan larutan sam an hasil positi
α-amilase, tet da-beda. Frak nhibisi enzim
an dengan eks an fraksi etil
inhibisi enz nol, fraksi n
fraksi air b 10.95, dan 22 k etanol me
α-amilase y an dengan frak air-cair ekstr ungkinkan te ih dalam ben um murni) seh kimia di dalam
O2N
O2N + Asam 3,5 (kunin
+
onat Asam
3
-m 3,5-dinitro asam 3-am
(Basak &
enzim α-a ahap 1, hidrol
dikatalisis en reduksi asa asam 3-am rolisis pati (t
37 °C, pH 6 ndisi ini sanga
dalam tubuh. an pada laru rhenti karena ari pH netral m am 3,5-dinitro ana basa, da Penambahan a
larutan uji. S m menghamb kin sedikit a ng dihasilkan. mpel yang d
if, yaitu meng tapi dengan ke ksi air menun
α-amilase t strak etanol, f asetat (Gam zim α-amilas -heksana, fra berturut-turut
2.52% (Lampi enunjukkan a yang lebih
ksi air (dipero rak etanol). H erjadi karena ntuk campura hingga masih mnya. OH NO2 OH O O H NH2 OH O O 5-dinitrosalisilat ng kejinggaan) amino-5-nitrosali (merah) osalisilat mino-5-candan amilase, isis pati nzim α -am 3,5- mino-5-ahap 1) 6.9 dan at sesuai Ketika utan uji, a terjadi menjadi osalisilat an suhu akuades Semakin at kerja asam diujikan ghambat eaktifan njukkan tertinggi fraksi n -mbar 6). se dari aksi etil sebesar iran 6). aktivitas kecil oleh dari Hal ini ekstrak an atau banyak OH isilat Gambar 6 Kompone menutupi ko keaktifan bes amilase, se inhibitor enzi sedangkan p yang ada aktivitas inhi Fraksi ai
enzim α-am
dengan kedu heksana dan demikian, da kimia terakt bersifat polar dilakukan pen dengan kroma Penentuan Kro Pemiliha salam mengg F254. Sebelu
dipanaskan d selama 1 jam terikat secara air pada p pemisahan k partisi antara silika gel d diinginkan ad gugus fungsi air yang te ditotolkan pa kali, lalu diel tunggal dan kromatografi. kromatografi selama 10 melancarkan dengan memb sehingga kom (noda) akan Penjenuhan penguapan pe 0 10 20 30 E Persentase inhibisi (%)
Persentase i E.etOH: ekst fraksi n-he fraksi etil ase
en kimia y omponen kim sar dalam men ehingga akt
im α-amilase t ada fraksi ai sudah lebih ibisi α-amilase ir menunjukka milase tertin ua fraksi lainn n fraksi eti apat disimpulk tif sebagai i r. Terhadap fra
nentuan eluen atografi kolom
Eluen Terba omatografi L
an eluen terba gunakan fase
um digunak dalam oven p m untuk meng
a fisik. Apab permukaan komponen ya
a lapisan air dan fase ger dalah pemisah
silika gel dan elah dilarutk ada pelat silik lusi mengguna n campuran . Sebelum dijenuhkan menit. H gerak eluen bentuk kesetim mponen yang n naik tanp
ini juga d elarut.
E.etOH F‐hxn F
inhibisi α-am trak etanol; F eksana; F-E etat; F-air: frak
yang banya mia yang me
nghambat enz tivitasnya s
tidak begitu te ir komponen murni, seh e lebih terliha an aktivitas in nggi dibandi
nya, yaitu fra il asetat. D kan bahwa se
inhibitor α-a aksi air selanj n terbaik, pem m, dan uji fito
aik Mengguna Lapis Tipis
aik fraksi air diam silika g kan, pelat
pada suhu 1 ghilangkan air
ila terdapat l silika gel, ang terjadi r pada perm rak, padahal han adsorpsi n fase gerak. kan dalam e
ka gel sebany akan berbagai n dalam
elusi, dengan uap Hal ini ber
n dan komp mbangan caira g akan dipis pa ada gang dapat mempe
F‐EtOAc F‐air
9
milase: F-hxn: EtOAc: ksi air. ak ini emiliki zim α-ebagai erlihat, kimia hingga at. nhibisi ingkan aksi n -Dengan enyawa amilase jutnya, misahan kimia. akan r daun gel G60
10
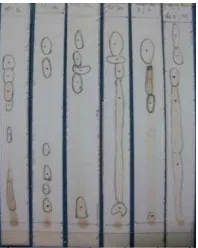
Pergerakan suatu senyawa dalam ekstrak bergantung pada kesamaan polaritasnya dengan polaritas eluen. Fraksi air mengandung komponen yang bersifat polar, maka akan terbawa oleh eluen yang bersifat semipolar sampai polar. Jika digunakan eluen nonpolar, maka komponen akan tertahan pada garis awal eluen dan tidak terpisah. Eluen tunggal yang digunakan adalah kloroform, n -butanol, etanol, metanol, aseton, dan air. Setelah dielusi, noda yang terbentuk diamati dengan lampu UV pada 254 dan 366 nm. Profil kromatogram fraksi air daun salam disajikan pada Gambar 7. Semua eluen tunggal yang digunakan dapat memisahkan fraksi air dengan kemampuan pemisahan yang berbeda-beda. Eluen tunggal terbaik adalah metanol dengan 4 noda yang terpisah, tetapi noda pertama masih terlalu dekat dengan garis awal pelarut. Semua eluen polar selain metanol juga menghasilkan 4 noda, tetapi masih bertumpuk dan berekor. Sementara itu, elusi menggunakan eluen air menghasilkan 4 noda, noda pertama berekor panjang dari garis awal pelarut sampai pertengahan, tetapi 3 noda lainnya terpisah mendekati garis depan pelarut.
Gambar 7 Profil kromatogram fraksi air daun salam dengan berbagai eluen tunggal diamati dengan lampu UV pada panjang gelombang 254 dan 366 nm : kloroform (1), n-butanol (2), etil asetat (3), etanol (4), metanol (5), aseton (6), dan air (7).
Pemisahan yang diperoleh dengan eluen tunggal belum cukup baik, maka dilakukan pemisahan dengan eluen campuran dengan komposisi metanol : air (9:1, 8:2, 7:3, 6:4, 5:5, dan 1:9). Pemilihan kedua eluen ini, yaitu metanol dan air, karena pada metanol noda yang terpisah berada dekat garis awal pelarut, sedangkan pada air komponen dekat garis awal pelarut belum terpisah sempurna.
Pencampuran kedua eluen ini diharapkan mampu memisahkan komponen dengan baik dan lebih banyak komponen yang terpisah. Berdasarkan profil kromatogram yang diperoleh dari eluen campuran (metanol:air) dengan berbagai nisbah, maka dipilihlah eluen campuran metanol:air dengan nisbah 8:2 sebagai eluen terbaik karena dihasilkan noda terbanyak dan terpisah (Gambar 8). Menurut Skoog et al. (2004), eluen terbaik adalah yang menghasilkan jumlah noda terbanyak dan terpisah. Data lengkap hasil analisis pemilihan eluen terbaik dengan KLT untuk fraksi air daun salam disajikan dalam Lampiran 7. Hasil analisis KLT kemudian dijadikan dasar penggunaan metanol dan air sebagai eluen pada proses fraksinasi dan pengelompokan fraksi hasil pemisahan fraksi air daun salam.
Gambar 8 Profil kromatogram fraksi air daun salam dengan eluen (metanol:air) berbagai perbandingan diamati dengan lampu UV pada panjang gelombang 254 dan 366 nm : 9:1 (1), 8:2 (2), 7:3 (3), 6:4 (4), 5:5 (5), 1:9 (6).
Fraksionasi dengan Kromatografi Kolom
Fraksionasi dengan kromatografi kolom menggunakan fraksi air daun salam, karena fraksi ini memiliki aktivitas inhibisi α-amilase tertinggi. Fraksionasi menggunakan metode elusi landaian, yaitu menggunakan lebih dari 1 pelarut dan berdasarkan kenaikan kepolaran. Hal ini bertujuan agar dengan peningkatan polaritas sistem eluen, semua komponen akan terbawa lebih cepat (Harvey 2000). Fraksionasi diawali menggunakan metanol, kemudian dilanjutkan dengan air.
Eluat yang diperoleh ditampung sebanyak 5 mL dalam tabung yang telah diberi nomor, hasil pemisahan ini ditampung dalam 151 tabung. Penentuan fraksi dari eluat yang diperoleh, menggunakan metode KLT dengan eluen terbaik dan diamati dengan lampu UV
1 2 3 4 5 6 7
11
pada panjang gelombang 254 dan 366 nm. Eluat dengan nilai Rf dan pola kromatogram
yang sama digabungkan. Berdasarkan hasil KLT eluat, diperoleh 4 fraksi (Lampiran 8). Keempat fraksi ini diuji aktivitas inhibisi α -amilase.
Fraksi Teraktif Inhibitor α-Amilase
Fraksi teraktif antidiabetes ditentukan dengan menguji aktivitas inhibisi α-amilase terhadap fraksi yang diperoleh. Prosedur pengujiannya sama seperti dalam penentuan aktivitas fraksi hasil ekstraksi cair-cair. Konsentrasi fraksi dan akarbosa yang digunakan adalah 0.1% (b/v dalam akuades). Semua fraksi menunjukkan aktivitas inhibisi
α-amilase dengan keaktifan yang
berbeda-beda. Persentase inhibisi α-amilase fraksi 1 sampai fraksi 4 berturut-turut sebesar 5.93, 57.57, 20.15, dan 22.57% (Gambar 9).
Gambar 9 Persentase inhibisi α-amilase fraksi hasil pemisahan dengan kromato- grafi kolom dan akarbosa sebagai pembanding, (F1) fraksi 1, (F2) fraksi 2, (F3) fraksi 3, (F4) fraksi 4, (A) akarbosa.
Akarbosa sebagai pembanding, memiliki persentase inhibisi sebesar 72.69%. Aktivitas inhibisi α-amilase tertinggi yang ditunjukkan oleh fraksi 2 masih lebih kecil dibandingkan dengan akarbosa. Semakin besar persentase
inhibisi α-amilase, semakin besar pula
aktivitas antidiabetes, maka fraksi 2 merupakan fraksi teraktif. Data penentuan fraksi teraktif disajikan pada Lampiran 9. Fraksi 2 memiliki persentase inhibisi α -amilase tertinggi dibandingkan dengan ekstrak etanol sebesar 13.52% dan fraksi air sebesar 22.52%. Hal ini menunjukkan kemurnian komponen meningkat dengan bertambahnya tahap fraksionasi. Oleh karena itu, fraksi 2 dipilih untuk analisis tahap selanjutnya, yaitu analisis fitokimia.
Analisis Hasil Uji Fitokimia
Kandungan senyawa metabolit sekunder yang terdapat dalam sampel dapat diketahui dengan melakukan uji fitokimia. Uji ini bersifat kualitatif, spesifik, dan sensitif. Dalam penelitian ini, uji fitokimia dilakukan terhadap ekstrak etanol, fraksi teraktif hasil partisi, dan fraksi teraktif hasil fraksionasi dengan kromatografi kolom. Berdasarkan uji fitokimia, diketahui bahwa ekstrak etanol (96%) daun salam mengandung alkaloid, flavonoid, saponin, tanin, dan steroid. Hasil uji fitokimia disajikan pada Tabel 2.
Komponen kimia yang terdapat dalam fraksi air adalah alkaloid, flavonoid, saponin, dan tanin, sedangkan komponen kimia yang terkandung dalam fraksi 2, hanya alkaloid, flavonoid, dan saponin. Fraksi 2 mengandung komponen kimia lebih sedikit dibandingkan dengan fraksi air dan ekstrak etanol. Hal ini terjadi karena fraksionasi lanjutan ekstrak etanol menyebabkan terbaginya komponen kimia berdasarkan kepolarannya dan meningkatkan kemurnian komponen tersebut.
Tabel 2 Hasil uji fitokimia
Komponen kimia
Ekstrak etanol
Fraksi air
Fraksi 2 Alkaloid + + + Flavonoid + + +
Saponin + + + Tanin + + - Steroid + - -
Triterpenoid - - -
Keterangan:
+ : terdeteksi komponen - : tidak terdeteksi komponen
Komponen kimia yang tidak ada dalam fraksi air dari ekstrak etanol adalah steroid. Steroid bersifat nonpolar, cenderung larut dalam lipiddan pelarut organik lain yang bersifat nonpolar. Sangat dimungkinkan steroid ini berada di fraksi nonpolar, yaitu fraksi n-heksana. Komponen kimia yang tidak ada pada fraksi 2 adalah tanin. Kemungkinan tanin berada pada fraksi lain selain fraksi 2 yang aktivitasnya kurang terlihat dibandingkan dengan komponen kimia yang terdapat pada fraksi 2. Keempat komponen kimia yang terdapat dalam fraksi air, yaitu alkaloid, flavonoid, tanin, dan saponin, bersifat polar.
Alkaloid merupakan senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen. Biasanya alkaloid bersifat toksik bagi manusia, tetapi tidak semua, ada juga 0
20 40 60 80
F1 F2 F3 F4 A
Per
sentase inhibisi
(%)
12
yang memiliki efek farmakologis tertentu. Alkaloid umumnya sukar larut dalam air, tetapi mudah larut dalam bentuk garamnya (alkaloid dapat bereaksi dengan asam mineral membentuk garam). Beberapa alkaloid dilaporkan memiliki aktivitas antidiabetes, di antaranya kriptolepin, sejenis alkaloid indolkuinolin yang menurunkan kadar gula darah pada mencit diabetes (Bnouham et al. 2006), dan alkaloid berberina dengan cara menurunkan aktivitas transaminase, dan produksi kreatinin dan pada mencit diabetes (Punitha et al. 2006).
Flavonoid termasuk senyawa fenolik, jarang terdapat di alam dalam bentuk fenol sederhana, umumnya terikat dengan gula sebagai O-glikosida dan C-glikosida, dan dalam sel tumbuhan terdapat pada vakuola sel. Flavonoid membentuk kompleks dengan protein melalui ikatan hidrogen. Tanin termasuk senyawa polifenol, dapat membentuk kopolimer stabil dengan protein yang taklarut dalam air. Kumarin dan asam ferulat (termasuk senyawa fenolik) memiliki aktivitas antidiabetes dengan cara meningkatkan proliferasi dan sekresi insulin pada sel β pankreas (Tanko et al. 2007). Saponin adalah glikosida triterpena dan sterol, merupakan senyawa aktif permukaan dan bersifat seperti sabun, dapat dideteksi berdasarkan kemampuannya membentuk busa, dan dapat menghemolisis sel darah. Pola glikosida saponin kadang rumit, banyak saponin mempunyai satuan gula sampai 5. Beberapa saponin dilaporkan memiliki aktivitas antidiabetes di antaranya saponin yang diisolasi dari akar Aralia elata Seem (elastosida E) dan saponin yang diisolasi dari
daun Acanthopanax senticocus yang
menurunkan kadar gula darah pascamakan pada mencit diabetes tanpa menurunkan kadar gula darah pada mencit normal (Bnouham et al. 2006).
Ketiga komponen kimia, yaitu alkaloid, saponin, dan flavonoid telah dilaporkan memiliki aktivitas antidiabetes dengan menurunkan kadar gula darah pascamakan pada mencit diabetes melalui mekanisme yang berbeda-beda. Dalam penelitian ini, ketiga komponen tersebut terdapat dalam fraksi 2, yaitu fraksi teraktif sebagai inhibitor α -amilase. Oleh karena itu, fraksi 2 mengandung komponen aktif antidiabetes.
SIMPULAN DAN SARAN
Simpulan
Ekstrak etanol daun salam dengan konsentrasi 0.1% (b/v) menghambat aktivitas
α-amilase sebesar 13.52%. Pemisahan fraksi air menggunakan kromatografi kolom memperoleh 4 fraksi dan fraksi 2 merupakan fraksi teraktif dengan persentase inhibisi α -amilase sebesar 57.57%. Uji fitokimia, menunjukkan komponen yang terkandung dalam fraksi 2 adalah golongan alkaloid, flavonoid, dan saponin.
Saran
Penelitian lebih lanjut perlu dilakukan
untuk menguji aktivitas inhibisi α
-glukosidase, memurnikan dan menentukan senyawa aktif yang terkandung dalam fraksi 2 dari fraksi hasil partisi air daun salam. Dengan demikian, dapat diteliti lebih lanjut aktivitas antidiabetes dari senyawa yang terkandung dalam fraksi teraktif tersebut.
DAFTAR PUSTAKA
Adnyana IK, Yulinah E, Sigit JI, Fitriani D. 2005. Uji aktivitas antikolesterol ekstrak
air bulbus (Allium sativum L), daun
(Eugenia polyantha Wight), dan buah (Phaleria macrocarpa (Scheffi) BOERL menggunakan kultur primer sel hati tikus [abstrak]. Acta Pharmaceutica 30:43-47.
Basak SS dan Candan F. 2010. Chemical
composition and in vitro antioxidant
activities of Eucalyptus camaldulensis
Dehnh. essential oil. J Iran Chem Soc
7:216-226.
Belami D, Gana A, Kusmardiyani S. 1997. Flavonoid utama dan asam fenolat daun
salam (Eugenia polyantha Wight),
Myrtaceae [abstrak]. [Terhubung Berkala]. http://bahan-alam.fa.itb.ac.id [15 Jun 2010].
12
yang memiliki efek farmakologis tertentu. Alkaloid umumnya sukar larut dalam air, tetapi mudah larut dalam bentuk garamnya (alkaloid dapat bereaksi dengan asam mineral membentuk garam). Beberapa alkaloid dilaporkan memiliki aktivitas antidiabetes, di antaranya kriptolepin, sejenis alkaloid indolkuinolin yang menurunkan kadar gula darah pada mencit diabetes (Bnouham et al. 2006), dan alkaloid berberina dengan cara menurunkan aktivitas transaminase, dan produksi kreatinin dan pada mencit diabetes (Punitha et al. 2006).
Flavonoid termasuk senyawa fenolik, jarang terdapat di alam dalam bentuk fenol sederhana, umumnya terikat dengan gula sebagai O-glikosida dan C-glikosida, dan dalam sel tumbuhan terdapat pada vakuola sel. Flavonoid membentuk kompleks dengan protein melalui ikatan hidrogen. Tanin termasuk senyawa polifenol, dapat membentuk kopolimer stabil dengan protein yang taklarut dalam air. Kumarin dan asam ferulat (termasuk senyawa fenolik) memiliki aktivitas antidiabetes dengan cara meningkatkan proliferasi dan sekresi insulin pada sel β pankreas (Tanko et al. 2007). Saponin adalah glikosida triterpena dan sterol, merupakan senyawa aktif permukaan dan bersifat seperti sabun, dapat dideteksi berdasarkan kemampuannya membentuk busa, dan dapat menghemolisis sel darah. Pola glikosida saponin kadang rumit, banyak saponin mempunyai satuan gula sampai 5. Beberapa saponin dilaporkan memiliki aktivitas antidiabetes di antaranya saponin yang diisolasi dari akar Aralia elata Seem (elastosida E) dan saponin yang diisolasi dari
daun Acanthopanax senticocus yang
menurunkan kadar gula darah pascamakan pada mencit diabetes tanpa menurunkan kadar gula darah pada mencit normal (Bnouham et al. 2006).
Ketiga komponen kimia, yaitu alkaloid, saponin, dan flavonoid telah dilaporkan memiliki aktivitas antidiabetes dengan menurunkan kadar gula darah pascamakan pada mencit diabetes melalui mekanisme yang berbeda-beda. Dalam penelitian ini, ketiga komponen tersebut terdapat dalam fraksi 2, yaitu fraksi teraktif sebagai inhibitor α -amilase. Oleh karena itu, fraksi 2 mengandung komponen aktif antidiabetes.
SIMPULAN DAN SARAN
Simpulan
Ekstrak etanol daun salam dengan konsentrasi 0.1% (b/v) menghambat aktivitas
α-amilase sebesar 13.52%. Pemisahan fraksi air menggunakan kromatografi kolom memperoleh 4 fraksi dan fraksi 2 merupakan fraksi teraktif dengan persentase inhibisi α -amilase sebesar 57.57%. Uji fitokimia, menunjukkan komponen yang terkandung dalam fraksi 2 adalah golongan alkaloid, flavonoid, dan saponin.
Saran
Penelitian lebih lanjut perlu dilakukan
untuk menguji aktivitas inhibisi α
-glukosidase, memurnikan dan menentukan senyawa aktif yang terkandung dalam fraksi 2 dari fraksi hasil partisi air daun salam. Dengan demikian, dapat diteliti lebih lanjut aktivitas antidiabetes dari senyawa yang terkandung dalam fraksi teraktif tersebut.
DAFTAR PUSTAKA
Adnyana IK, Yulinah E, Sigit JI, Fitriani D. 2005. Uji aktivitas antikolesterol ekstrak
air bulbus (Allium sativum L), daun
(Eugenia polyantha Wight), dan buah (Phaleria macrocarpa (Scheffi) BOERL menggunakan kultur primer sel hati tikus [abstrak]. Acta Pharmaceutica 30:43-47.
Basak SS dan Candan F. 2010. Chemical
composition and in vitro antioxidant
activities of Eucalyptus camaldulensis
Dehnh. essential oil. J Iran Chem Soc
7:216-226.
Belami D, Gana A, Kusmardiyani S. 1997. Flavonoid utama dan asam fenolat daun
salam (Eugenia polyantha Wight),
Myrtaceae [abstrak]. [Terhubung Berkala]. http://bahan-alam.fa.itb.ac.id [15 Jun 2010].
EKSTRAK ETANOL DAUN SALAM DAN
FRAKSINYA SEBAGAI INHIBITOR ALFA-AMILASE
EMILIA FATMAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
13
Dalimartha S. 2000. Atlas Tumbuhan Obat
Indonesia Jilid II. Jakarta: Trubus Agriwidya.
Fessenden RJ dan Fessenden JS. 1986. Kimia Organik. Jilid 1. Pudjaatmaka AH, penerjemah. Jakarta: Erlangga. Terjemahan dari: Organic Chemistry.
Furniss BS et al. 1989. Vogel’s Textbook of Practical Organic Chemistry.Ed ke-4. New York: J Wiley.
Geethalaksmi R, Sarada DVL, Marimuthu P, Ramasamy K. 2010. Alpha-amylase inhibitory of Trianthema decandra L. Int J Biotechnol Biochem 6: 369-376.
Harborne JB. 1987. Metode Fitokimia :
Penuntun Cara Menganalisis Tumbuhan. Padmawinata K, Soediro I, penerjemah. Bandung: ITB Pr. Terjemahan dari: Phytochemical Methods.
Harjadi W. 1986. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Harvey D. 2000. Modern Analytical
Chemistry. New York: McGraw-Hill.
Houghton PJ, Raman A. 1998. Laboratory
Handbook for The Fractionation of Natural Extract. London: Chapman & Hall.
Katno. 2008. Pengelolaan Pascapanen
Tanaman Obat. Jakarta: B2P2TO-OT.
Khopkar. 2002. Konsep Dasar Kimia Analitik. Saptorahardjo, penerjemah. Jakarta: UI Pr.
Terjemahan dari: Basic Concept of
Analytical Chemistry.
Kim et al. 2005. Inhibitory effect of pine
extract on α-glucosidase activity and
postpandrial hyperglycemia. Nutrition
21:756-761.
Lee SK. et al. 2007. Inhibitory activity
Euonymus alatus against α-glucosidase in
vitro and in vivo. Nutrition Res Practice 1:
184-188.
Marles RJ & Farnsworth NR. 1995. Antidiabetic plants and their active constituents. Phytomedicine 2:123-189.
McMurry J. 2008. Organic Chemistry.Ed ke-7. Belmont: Thomas Learning Inc.
Meloan CE. 1999. Chemical Separation. New York: J Wiley.
Odhav B, Kandasamy T, Khumalo N, Baijnath H. 2010. Screening of African traditional vegetable for their alpha-amylase inhibitory effect. Med Plants Res 4:1502-1507.
Olivina, Sukrasno, Iwo MI. 2005. Telaah fitokimia dan aktivitas penghambatan xantin oksidase ekstrak kulit batang salam [Syzygium polyanthum (Wight) walp, myrtaceae] [abstrak]. [terhubung berkala]. http://bahan-alam.fa.itb.ac.id [15 Jun 2010].
Punitha ISR, Shirwaikar A, Shirwaikar A. 2006. Antidiabetic activity of benzyl tetra isoquinoline alkaloid berberine in streptozocin-nicotinamide induced type 2
diabetic rats. Diabetalogia Croatica
34:117-128.
Rouessac F, Rouessac A. 1994. Chemical
Analysis Modern Instrumentation Methods and Techniques. Ed ke-2. New York: J Wiley.
Skoog DA, Holler PJ, Nieman TA. 2004. Principles of Instrumental Analysis. Ed ke-5. Philadelphia: Hartcaurt Brace. hlm 715-730.
Studiawan H, Santosa MH. 2005. Uji aktivitas penurun kadar glukosa darah ekstrak daun Eugenia polyantha Wight pada mencit yang diinduksi aloksan. Media Kedokteran Hewan 21:62-65.
Subroto A. 2006. Ramuan Herbal untuk
Diabetes Melitus. Jakarta: Penebar Swadaya.
Suyono. 2002. Kecenderungan Peningkatan
Jumlah Pasien Diabetes Melitus Terpadu. Jakarta: Fakultas Kedokteran Universitas Indonesia.
Tanko et al. 2007. Toxicological and
14
Tjitrosoepomo. 1996. Morfologi Tumbuhan. Yogyakarta: Gajah Mada Pr.
Winarno FG. 1995. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama.
Winarto WP. 2004. Memanfaatkan Bumbu
EKSTRAK ETANOL DAUN SALAM DAN
FRAKSINYA SEBAGAI INHIBITOR ALFA-AMILASE
EMILIA FATMAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
EMILIA FATMAWATI. Ekstrak Etanol Daun Salam dan Fraksinya sebagai
Inhibitor Alfa-Amilase. Dibimbing oleh ELLY SURADIKUSUMAH dan IRMA
HERAWATI SUPARTO.
Eugenia polyantha
yang dikenal dengan nama salam di Indonesia adalah
tanaman obat yang banyak digunakan dalam mengobati berbagai penyakit,
termasuk diabetes. Tujuan penelitian ini adalah memperoleh fraksi teraktif dalam
menginhibisi alfa-amilase dari ekstrak etanol daun salam serta mengidentifikasi
kandungan fitokimianya. Ekstrak etanol kasar yang difraksionasi menggunakan
ekstraksi cair-cair menghasilkan 3 fraksi, yaitu fraksi
n
-heksana, fraksi etil asetat,
dan fraksi air.
Uji aktivitas inhibisi alfa-amilase menunjukkan bahwa semua fraksi
aktif menghambat alfa-amilase, fraksi air menunjukkan aktivitas tertinggi sebesar
22.52%. Fraksinasi lanjutan fraksi air menggunakan kromatografi kolom silika gel
dengan elusi gradien menghasilkan 4 fraksi. Semua fraksi menunjukkan aktivitas
hambat alfa-amilase, fraksi 2 menunjukkan aktivitas tertinggi, yaitu 57.57%.
Berdasarkan uji fitokimia, komponen kimia yang terkandung dalam fraksi teraktif
adalah golongan alkaloid, flavonoid, dan saponin.
ABSTRACT
EMILIA FATMAWATI. Ethanolic Extract of
Eugenia polyantha
Leaves and it’s
Fraction as Alpha-Amylase Inhibitor. Supervised by ELLY SURADIKUSUMAH
and IRMA HERAWATI SUPARTO.
EKSTRAK ETANOL DAUN SALAM DAN
FRAKSINYA SEBAGAI INHIBITOR ALFA-AMILASE
EMILIA FATMAWATI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Ekstrak Etanol Daun Salam dan Fraksinya sebagai Inhibitor
Alfa-Amilase
Nama :
Emilia
Fatmawati
NIM :
G44062785
Disetujui,
Pembimbing I,
Pembimbing II,
Ir. Elly Suradikusumah, MS
Dr. dr. Irma Herawati Suparto, MS
NIP 19450214 197010 2 001
NIP 19581123 198603 2 002
Diketahui,
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Penulis memanjatkan puji dan syukur ke hadirat Allah SWT karena atas
limpahan hidayah dan rahmat-Nya, karya ilmiah yang berjudul “Ekstrak Etanol
Daun Salam dan Fraksinya sebagai Inhibitor Alfa-Amilase” ini dapat diselesaikan.
Pada penelitian ini, dilakukan pengujian aktivitas ekstrak daun salam dalam
menghambat kerja enzim
α
-amilase, fraksionasi fraksi teraktif dari ekstrak
tersebut, serta telaah fitokimia ekstrak etanol dan fraksi teraktif sebagai inhibitor
alfa-amilase. Penelitian dilaksanakan mulai bulan Agustus 2010 sampai dengan
Juni 2011 di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, IPB.
Penulis menyampaikan ucapan terima kasih sebesar-besarnya kepada Ibu Ir.
Elly Suradikusumah, MS dan Dr. dr. Irma Herawati Suparto, MS selaku
pembimbing yang telah memberi bimbingan dengan penuh pengertian dan
kesabaran, motivasi, saran, dan meluangkan waktunya kepada penulis selama
berkonsultasi. Penulis mengucapkan terima kasih yang tak terhingga kepada
Mama dan Bapak tercinta atas pengertian dan kesabarannya dalam menunggu
penulis menyelesaikan penelitian, Dik Reza, dan seluruh keluarga yang senantiasa
mendo’akan, memotivasi, mencurahkan kasih sayang yang tiada henti. Tidak lupa
penulis mengucapkan terima kasih pula kepada Om Eman, Bu Nunung, dan para
pegawai di Laboratorium Kimia Analitik, Ahmad Yani (yang telah banyak
membantu penulis dari awal penelitian sampai akhir penelitian), Aisyah, Arini,
dan teman-teman Kimia 43 yang selalu memberi dukungan teknis dan akademis.
Akhir kata, tiada yang dapat penulis berikan kepada orang-orang yang telah
berjasa bagi penulis selain ucapan terima kasih yang sebesar-besarnya, do’a, dan
karya ilmiah ini, semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 15 Oktober 1989 dari pasangan
Muhammad Nasir dan Neneng S Yulinza. Penulis adalah anak pertama dari dua
bersaudara, lulus dari SMA Daar el-Qolam pada tahun 2006 dan pada tahun yang
sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan
Seleksi Masuk IPB (USMI).