PENGOPTIMUMAN EKSTRAKSI FLAVONOID DAUN
SALAM (Syzygium polyanthum) DAN ANALISIS SIDIK JARI
DENGAN KROMATOGRAFI LAPIS TIPIS
JULIA DEVY OKTAVIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
ABSTRAK
JULIA DEVY OKTAVIA. Pengoptimuman Ekstraksi Flavonoid Daun Salam
(Syzygium polyanthum) dan Analisis Sidik Jari dengan Kromatografi Lapis Tipis.
Dibimbing oleh LATIFAH KOSIM DARUSMAN dan WULAN TRI WAHYUNI.
Daun salam diketahui mengandung senyawa flavonoid yang berfungsi sebagai
antioksidan. Penelitian ini bertujuan mencari kondisi optimum ekstraksi flavonoid
daun salam dengan meragamkan metode ekstraksi, polaritas pelarut, dan waktu
ekstraksi. Metode ekstraksi yang digunakan adalah maserasi dan sonikasi, polaritas
pelarut yang digunakan adalah nisbah antara metanol dan air, serta waktu ekstraksi
untuk sonikasi berada dalam rentang 5 hingga 15 menit, sedangkan untuk maserasi
berada dalam rentang 6 hingga 24 jam. Kadar flavonoid total dan aktivitas
antioksidan menjadi parameter keberhasilan ekstraksi. Penelitian dirancang
menggunakan rancangan kombinasi D-Optimal dengan bantuan perangkat lunak
DX8.0.6 versi uji coba. Berdasarkan analisis statistik, kondisi optimum ekstraksi
ditentukan dengan melihat kebaikan model. Kondisi optimum tersebut diperoleh saat
kondisi ekstraksi sonikasi dengan pelarut metanol 96% selama 15 menit yang
memiliki aktivitas antioksidan dengan nilai IC
5013,1593 µg/ml dan kadar flavonoid
total 0,0127 mg QE/mg ekstrak. Komposisi ekstrak terbaik berdasarkan uji fitokimia
di antaranya merupakan golongan senyawa antosianidin, flavonol, flavon, dan kalkon.
Profil sidik jari ekstrak terbaik yang memiliki bioaktivitas paling tinggi dideteksi
dengan kromatografi lapis tipis. Analisis sidik jari ekstrak tersebut dilakukan
menggunakan kloroform sebagai fase gerak terbaik yang menghasilkan 8 pita.
ABSTRACT
JULIA DEVY OKTAVIA. Optimization in Flavonoid Extraction of Salam Leaves
(Syzygium polyanthum) and Fingerprint Analysis Using Thin Layer Chromatography.
Supervised by LATIFAH KOSIM DARUSMAN and WULAN TRI WAHYUNI.
Salam leaves contain flavonoids having a function as antioxidants. The aim of
this study is to find optimum condition for flavonoid extraction from salam leaves by
varying the extraction methods, solvent polarity, and extraction time. The extraction
was conducted by maceration and sonication methods, with methanol and water ratio
as indication of solvent polarity. Extraction by maseration was run for 6 to 24 hours,
while sonication was run for 6 to 15 minutes. Total flavonoid content and antioxidant
activity were the parameters for measuring the selection of extraction process. The
study was designed using a combination design of D-Optimal with software DX8.0.6
for trial version. Based on statistical analysis, the optimum conditions of extraction
was determined with the goodness of the model. The optimum condition was the
sonication extraction in 96% methanol for 15 minutes. This condition has the best the
antioxidant activity with IC
50value of 13,1593 mg/mL and total flavonoid content of
0,0127 mg QE/mg extract. The composition of the best extract based on
phitochemical assay were anthocyanidins, flavonol, flavone, and khalkon. The
fingerprint profiles of the best extract that has highest bioactivity was detected by thin
layer chromatography analysis. Fingerprint analysis of the extract was performed
using chlorofom as the best eluent which resulting 8 bands.
PENGOPTIMUMAN EKSTRAKSI FLAVONOID DAUN
SALAM (Syzygium polyanthum) DAN ANALISIS SIDIK JARI
DENGAN KROMATOGRAFI LAPIS TIPIS
JULIA DEVY OKTAVIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Judul : Pengoptimuman Ekstraksi Flavonoid Daun Salam (Syzygium
polyanthum) dan Analisis Sidik Jari dengan Kromatografi Lapis Tipis
Nama : Julia Devy Oktavia
Nim
: G44070064
Disetujui
Pembimbing I Pembimbing II
Prof. Dr. Ir. Latifah K. Darusman, MS
Wulan Tri Wahyuni, S.Si, M.Si
NIP 19530824 197603 2 001
Diketahui
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur kehadirat Allah SWT atas rahmat dan karunia-Nya yang
berlimpah sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini
dilaksanakan dari bulan Maret hingga bulan Agustus 2011, bertempat di
Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor dan Laboratorium Uji Pusat Studi
Biofarmaka, Insstitut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Prof. Dr. Latifah K. Darusman,
MS dan Wulan Tri Wahyuni, M.Si selaku pembimbing yang senantiasa
memberikan arahan, dorongan semangat, kepada penulis selama melaksanakan
penelitian dan penyusunan karya ilmiah ini. Terima kasih kepada Rudi Heryanto,
M.Si yang telah memberikan masukan dan saran penggunaan rancangan
percobaan dan mengajarkan penggunaan piranti lunak DX8.0.6 versi uji coba
yang digunakan dalam penelitian ini. Terima kasih kepada bagian Kimia Analitik
yang telah melibatkan dalam tema penentuan senyawa penciri dalam tanaman
obat. Penulis juga mengucapkan terima kasih kepada analis Laboratorium Kimia
Analitik maupun Laboratorium Uji Pusat Studi Biofarmaka (Ibu Nunung, Ibu
Salina, dan Ibu Nunuk) serta staf laboran (Pak Eman, Pak Dede, dan Mas Endi)
atas bantuan dan masukan yang sangat berarti selama penelitian berlangsung.
Terima kasih tak terhingga penulis ucapkan kepada mama, ayah, serta
seluruh keluarga atas doa dan kasih sayangnya, serta teman-teman sekalian atas
dorongan semangat, masukan, dan saran kepada penulis.
Penulis berharap, karya ilmiah ini dapat bermanfaat bagi perkembangan
ilmu pengetahuan.
Bogor, Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 14 Juli 1990 dari ayah Migda
Oktavia dan ibu Tuti Kurniasih. Penulis adalah anak pertama dari 1 bersaudara.
Tahun 2007 penulis lulus dari SMA Negeri 5 Jakarta dan pada tahun yang sama
penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB
(USMI), dan diterima di Departemen Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis aktif sebagai staf Pengembangan
Sumber Daya Mahasiswa (PSDM) Ikatan Mahasiswa Kimia (Imasika) pada tahun
2008-2009 dan menjadi ketua departemen PSDM Imasika pada tahun 2009-2010.
Penulis juga aktif sebagai asisten praktikum Elektroanalisis dan Teknik
Pemisahan pada tahun 2010-2011, asisten praktikum Kimia Analitik II pada tahun
2010-2011, asisten praktikum Kimia Dasar pada tahun 2010-2011. Bulan
Juli-Agustus 2010 penulis melaksanakan Praktik Lapangan di Balai Pengujian Mutu
Barang Ekspor-Impor (BPMBEI) dengan judul Analisis Residu Kloramfenikol
dalam Madu Menggunakan Liquid Chromatography-Tandem Mass Spectrometry
(LC-MS/MS).
DAFTAR ISI
Halaman
DAFTAR ISI ... vi
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN
TINJAUAN PUSTAKA
Salam (Syzygium polyanthum) ... 2
Flavonoid ... 2
Ekstraksi Senyawa Metabolit Sekunder ... 3
Radikal Bebas dan Antioksidan ... 4
Aktivitas Antioksidan Metode DPPH ... 4
Kromatografi Lapis Tipis (KLT) ... 5
Rancangan Percobaan ... 6
BAHAN DAN METODE
Bahan dan Alat ... 7
Ruang Lingkup ... 7
Pengumpulan dan Persiapan Contoh ... 7
Penentuan Kadar Air ... 7
Ekstraksi Flavonoid Total dengan Bantuan Rancangan Percobaan
D-Optimal ... 7
Uji Golongan Flavonoid ... 8
Penentuan Antosianidin ... 8
Penentuan Flavonoid Lain ... 8
Penentuan Kadar Flavonoid Total ... 8
Uji Aktivitas Antioksidan ... 9
Pemilihan Fase Gerak Terbaik menggunakan Kromatografi
Lapis Tipis (KLT) ... 9
HASIL DAN PEMBAHASAN
Perlakuan Pendahuluan ... 9
Kadar Air Simplisia Daun Salam ... 10
Ekstraksi Flavonoid Daun Salam ... 10
Kadar Flavonoid Daun Salam ... 11
Aktivitas Antioksidan Daun Salam ... 12
Kondisi Optimum Ekstraksi Flavonoid ... 14
Uji Fitokimia Senyawa Golongan Flavonoid ... 16
Penentuan Campuran Fase Gerak dari Fase Gerak Tunggal ... 16
Analisis Sidik Jari pada Kondisi Optimum ... 17
SIMPULAN DAN SARAN
Simpulan ... 18
Saran ... 18
DAFTAR PUSTAKA ... 18
LAMPIRAN ... 21
DAFTAR TABEL
Halaman
1 Uji kualitatif golongan flavonoid ... 3
2 Rancangan kombinasi hasil D- Optimal untuk metode maserasi ... 8
3 Rancangan kombinasi hasil D-Optimal untuk metode sonikasi ... 8
4 Rancangan komposisi fase gerak ... 9
5 Hasil IC
50dan kadar flavonoid total untuk rancangan kombinasi pada
metode maserasi ... 13
6 Hasil IC
50dan kadar flavonoid total untuk rancangan kombinasi pada
metode sonikasi ... 13
DAFTAR GAMBAR
Halaman
1 Tanaman salam ... 2
2 Kerangka dasar senyawa flavonoid. ... 2
3 Reaksi penangkapan radikal bebas DPPH dengan antioksidan ... 5
4 Ruangan pengembang dan pelat kromatografi lapis tipis ... 5
5 Model simplex centroid design with axial ... 6
6 Grafik hasil persen rendemen ekstraksi maserasi. ... 11
8 Plot permukaan respon dan kontur IC
50pada polaritas pelarut dan waktu
ekstraksi. ... 14
9 Plot permukaan respon dan kontur kadar flavonoid pada polaritas pelarut
dan waktu ekstraksi. ... 15
10 Jumlah spot pada elusi KLT ekstrak terbaik daun salam untuk fase gerak
dengan deteksi UV 366 nm. ... 16
11 Jumlah pita hasil KLT ekstrak daun salam dengan deteksi UV 366 nm... 17
12 Plot kontur desain campuran simplex centroid untuk jumlah pita
optimasi fase gerak. ... 17
13 Kromatogram KLT dengan fase gerak pada titik optimum (kloroform)
dengan deteksi pada UV 366 nm. ... 18
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 22
2 Hasil penentuan kadar air ... 23
3 Penentuan kadar flavonoid ekstrak daun salam ... 24
4 Data uji aktivitas antioksidan... 27
5 Kondisi optimum hasil keluaran rancangan kombinasi D-Optimal ... 28
6 Data ANOVA kadar flavonoid total pada kondisi ekstraksi optimum ... 29
7 Data ANOVA nilai IC
50pada kondisi ekstraksi optimum ... 29
8 Hasil uji golongan flavonoid pada ekstrak sonikasi 7 dengan pelarut ... 30
9 Hasil pemisahan ekstrak terbaik daun salam dengan berbagai pelarut
tunggal ... 31
10 Hasil elusi ekstrak terbaik daun salam dengan campuran fase gerak
kloroform, n-butanol, dan etil asetat pada deteksi UV 366 nm ... 32
11 Data ANOVA penentuan komposisi fase gerak optimum ... 32
PENDAHULUAN
Meningkatnya penyakit degeneratif seperti kanker disebabkan karena terjadinya suatu kondisi stress oksidatif, yaitu kondisi saat antioksidan yang ada di dalam tubuh tidak mampu menetralisir peningkatan konsentrasi radikal bebas, sehingga dapat menimbulkan kerusakan pada komponen sel seperti DNA, lipid, dan protein (Chen et al. 1996). Untuk itu, manusia membutuhkan antioksidan yang berasal dari luar tubuh. Penggunaan antioksidan sintetik mulai dibatasi karena dari hasil penelitian yang telah dilakukan diketahui antioksidan sintetik seperti propil galat, butil-hidroksianisol (BHA), butyl-hidroksitoluena (BHT), dan tersier-butil-hidrokuinon (TBHQ) memberikan efek buruk terhadap kesehatan dan dapat bersifat toksik (Chen et al 1992; Kahl & Kappus 1993; Miyake & Shibamoto 1997). Oleh karena itu antioksidan alami menjadi alternatif yang sangat dibutuhkan.
Kemampuan flavonoid sebagai antioksidan telah banyak diteliti belakangan ini (Pourmorad et al. 2006; Sunarni et al. 2007; Setiawan 2008; Zuhra et al. 2008; Akbar 2010; Borges 2010). Sebagai antioksidan, flavonoid memiliki kemampuan mengubah atau mereduksi radikal bebas dan juga sebagai anti radikal bebas (Zuhra 2008). Salam (Syzygium polyanthum) merupakan salah satu sumber flavonoid yang berpotensi sebagai antioksidan. Daun salam mengandung beberapa komponen utama, yaitu minyak atsiri (sitral dan eugenol), tanin dan flavonoid (Dalimartha 2003). Daun salam berkhasiat untuk pengobatan diabetes melitus, inflamasi, dan diare (Lelono 2009). Kandungan flavonoid dalam daun salam mendorong dilakukannya suatu usaha yang dapat mengoptimalkan pemanfaatan tanaman tersebut. Potensi salam sebagai antioksidan yang dapat menangkap molekul radikal bebas telah diketahui dalam penelitian Lelono (2009), yaitu aktivitas antioksidan kulit batang salam meningkat dengan meningkatnya kandungan fenol total dari kulit batang salam. Aktivitas radikal bebas tertinggi terdapat pada ekstrak metanol-air dengan nilai IC50 sebesar
0,18 mg/mL.
Terdapat beberapa teknik ekstraksi yang dapat digunakan untuk mengisolasi senyawa aktif dari bahan alam, di antaranya ekstraksi maserasi, sonikasi, soxhlet, refluks, dan distilasi (Velickovic 2007). Namun, banyak bahan alam yang tidak stabil secara termal dan dapat terdegradasi selama proses ekstraksi
seperti pada ekstraksi soxhlet. Metode ekstraksi seperti maserasi membutuhkan waktu yang lama sehingga menjadi tidak efisien. Untuk itu, perlu dikembangkan metode ekstraksi lain yang bertujuan menjadikan proses ekstraksi lebih efisien dan mempersingkat waktu ekstraksi, salah satunya adalah ekstraksi sonikasi yang memanfaatkan gelombang ultrasonik.
Efektivitas ekstraksi sangat bergantung pada kondisi-kondisi percobaan yang digunakan seperti waktu ekstraksi, nisbah sampel-pelarut, dan jenis pelarut. Oleh karena itu perlu dilakukan optimisasi pada kondisi percobaan untuk mendapatkan hasil yang optimal. Pengaruh perbedaan metode ekstraksi, pelarut, dan waktu ekstraksi terhadap kadar flavonoid dan aktivitas antioksidan ekstrak diamati pada penelitian ini. Pengoptimuman kondisi ekstraksi disusun dengan bantuan desain eksperimental.
Banyaknya komponen kimia yang terdapat pada tanaman obat memungkinkan sulitnya untuk menjamin keamanan, kendali mutu, dan konsistensi produknya dibandingkan dengan obat sintetis (Reich & Schibli 2008). Dalam kendali mutu dan uji stabilitas produk tanaman obat, analisis sidik jarimenggunakan kromatografi merupakan teknik yang dapat digunakan untuk mengevaluasi dan membandingkan komponen-komponen kimia yang terdapat pada produk tersebut. Pola sidik jari kromatografi menunjukkan profil keseluruhan komponen karena dapat merepresentasikan keragaman komponen yang ada dalam tanaman obat tanpa memperhatikan jenisnya (Liang et al. 2004). Pada penelitian ini sidik jari ekstrak flavonoid dengan bioaktivitar terbaik diperiksa dengan menggunakan kromatografi lapis tipis (KLT).
Penelitian ini bertujuan mencari kondisi optimum ekstraksi flavonoid daun salam (Syzygium polyanthum) dengan memvariasikan metode ekstraksi, polaritas pelarut, dan waktu ekstraksi. Aktivitas antioksidan dan kadar flavonoid total menjadi parameter pengukur keberhasilan ekstraksi. Profil sidik jari ekstrak yang memiliki bioaktivitas paling tinggi diperiksa dengan KLT.
TINJAUAN PUSTAKA
Salam (Syzygium polyanthum) Syzygium polyanthum [Wight.] Walp.,
sinonim Eugenia polyantha Wight., dan E.
lucidula miq., memiliki nama daerah salam
(Indonesia, Sunda, Jawa, Madura); gowok (Sunda); manting (Jawa); kastolam (Kangean); dan meselangan, ubar serai (Melayu). Salam diklasifikasikan ke dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledoneae, ordo Myrtales, family Myrtaceae, genus Syzygium, spesies Syzygium polyanthum (Wight) Walp (Sumono 2008).
Salam merupakan tanaman asli Indonesia dan tumbuh di wilayah iklim tropis dan subtropis, termasuk di Asia Tenggara dan Cina. Secara morfologi (Gambar 1), salam merupakan pohon bertajuk rimbun dengan tinggi mencapai 25 m, berakar tunggang, dan berbatang bulat dengan permukaan yang licin. Daun tunggal, berbentuk lonjong hingga elips, letak berhadapan, panjang tangkai 0,5-1 cm, ujung meruncing, pangkal runcing, tepi rata, panjang 5-15 cm, lebar 3-8 cm, pertulangan menyirip, permukaan atas licin berwarna hijau tua, dan permukaan bawah berwarna hijau muda. Bunga majemuk, tersusun dalam malai yang keluar dari ujung ranting, berwarna putih dan baunya harum. Buah buni, berbentuk bulat, diameter 8-9 mm, saat masih muda berwarna hijau, saat matang berubah warna menjadi merah gelap, dan rasanya agak sepat. Biji berbentuk bulat, penampang sekitar 1 cm, dan berwarna coklat (Sumono 2008).
Gambar 1 Tanaman salam. (Sumono 2008) Efek farmakologi daun salam diperoleh dari daun, kulit batang, akar, dan buah salam. Kandungan kimia tanaman salam dilaporkan di antaranya minyak atsiri (0,05%) yang terdiri dari sitral dan eugenol (Sumono 2008), serta mengandung tanin tidak kurang dari 21,7% dan flavonoid dengan fluoretin dan kuersitrin sebagai golongan utama (BPOM 2004). Kuersitrin merupakan senyawa golongan flavonoid yang diketahui sebagai
senyawa penciri pada daun salam (Depkes RI 2008).
Berdasarkan penelitian Muflihat (2008), dari uji fitokimia yang dilakukan diketahui bahwa ekstrak air daun salam mengandung flavonoid, saponin dan tanin. Ekstrak air bersifat kurang toksik dengan nilai LC50
sebesar 2174,23 ppm. Ekstrak etanol daun salam mengandung alkaloid, flavanoid, saponin, dan tanin serta memiliki potensi bioaktif dan dapat dimanfaatkan sebagai obat karena memiliki nilai LC50 <1000 ppm, yaitu
sebesar 114,55 ppm. Studiawan (2004) menyatakan dalam penelitiannya bahwa ekstrak etanol daun salam dapat menurunkan kadar glukosa darah pada tikus dengan metode aloksan karena daun salam mengandung flavonoid yang dapat menangkap radikal hidroksil, sehingga menghambat aksi diabetik dari aloksan. Ekstrak metanol-air kulit batang salam menunjukkan kandungan fenolik total tertinggi (856 mg ekuivalen asam galat (GAE)/g dan 161 mg ekuivalen katekin (CE)/g) dan total kapasitas antioksidan 449 mg ekuivalen asam askorbat (AAE)/g (Lelono 2009).
Flavonoid
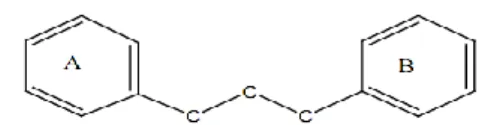
Flavonoid termasuk senyawa fenolik alam yang potensial sebagai antioksidan dan mempunyai bioktivitas sebagai obat. Flavonoid merupakan kandungan khas tumbuhan hijau. Flavonoid dalam tubuh manusia berfungsi sebagai antioksidan sehingga sangat baik untuk pencegahan kanker. Senyawa flavonoid adalah senyawa-senyawa polifenol yang memiliki 15 atom karbon (C6-C3-C6), terdiri dari dua cincin
benzena yang dihubungkan menjadi satu oleh rantai linier yang terdiri dari tiga atom karbon (Gambar 2). Flavonoid mengandung sistem aromatik yang terkonjugasi. Kebanyakan senyawa terkonjugasi pada umumnya berwarna cerah sehingga menunjukkan pita serapan yang kuat pada dearah spektrum sinar ultraviolet dan spektrum sinar tampak (Harborne 1996).
Gambar 2 Kerangka dasar senyawa flavonoid.
Flavonoid dalam tumbuhan terdapat sebagai bentuk O-glikosida dan C-glikosida.
Bentuk flavonoid O-glikosida, satu gugus hidroksil (-OH) flavonoid (lebih) terikat pada satu gula (lebih) dengan ikatan hemiasetal yang tidak tahan asam, biasanya pada posisi 3 atau 7. Bentuk C-glikosida memiliki gula yang terikat pada atom karbon flavonoid dan dalam hal ini gula terikat langsung pada inti benzena dengan ikatan karbon-karbon yang tahan asam, dan hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoid. Glukosa merupakan gula yang paling umum terlibat, selain itu juga terdapat galaktosa, ramnosa, xilosa, dan arabinosa (Markham 1988). Sejumlah gugus hidroksil yang tak terganti atau suatu gula menyebabkan flavonoid bersifat polar sehingga larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformamida, dan lain-lain. Pengaruh glikosilasi (gula terikat pada flavonoid) menyebabkan flavonoid menjadi kurang reaktif sehingga lebih mudah larut dalam pelarut polar seperti air dan dengan demikian campuran pelarut di atas dengan air merupakan pelarut yang lebih baik untuk glikosida flavonoid (Harborne 1996; Markham 1988).
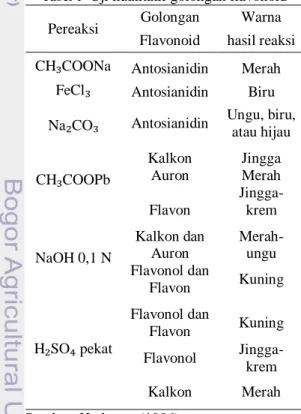
Tabel 1 Uji kualitatif golongan flavonoid Pereaksi Golongan Warna Flavonoid hasil reaksi CH₃COONa Antosianidin Merah
FeCl₃ Antosianidin Biru Na₂CO₃ Antosianidin Ungu, biru,
atau hijau CH₃COOPb Kalkon Jingga Auron Merah Flavon Jingga-krem NaOH 0,1 N Kalkon dan Auron Merah-ungu Flavonol dan Flavon Kuning H₂SO₄ pekat Flavonol dan Flavon Kuning Flavonol Jingga-krem Kalkon Merah Sumber: Harborne (1996)
Perbedaan kelas antara golongan senyawa flavonoid adalah adanya tambahan oksigen yang terikat pada cincin heterosiklik dan gugus hidroksil. Aglikon flavonoid
dikelompokkan ke dalam beberapa golongan, di antaranya flavon, flavonol, flavonon, isoflavon, khalkon, auron, antosianidin. Flavonoid dalam tumbuhan terdapat sebagai campuran. Penggolongan jenis flavonoid didasarkan pada sifat kelarutan dan reaksi warna (Tabel 1).
Ekstraksi Senyawa Metabolit Sekunder Ekstraksi merupakan suatu proses selektif yang dilakukan untuk mengambil zat-zat yang terkandung dalam suatu campuran dengan menggunakan pelarut yang sesuai. Metode pemisahan ini bekerja berdasarkan prinsip kelarutan like dissolve like, yaitu pelarut polar akan melarutkan zat polar, dan sebaliknya (Khopkar 2002). Proses ini merupakan langkah awal yang penting dalam penelitian tanaman obat, karena preparasi ekstrak kasar tanaman merupakan titik awal untuk isolasi dan pemurnian komponen kimia yang terdapat pada tanaman. Pemisahan zat dari suatu campuran relatif mudah dilakukan jika zat tersebut larut dalam pelarut yang digunakan, sedangkan zat lain tidak ikut larut. Dengan demikian, hasil ekstraksi yang diperoleh bergantung pada kandungan ekstrak yang terdapat dalam sampel dan jenis pelarut yang digunakan (Khopkar 2002).
Berdasarkan fase yang terlibat terdapat 2 jenis ekstraksi, yaitu ekstraksi car-cair dan ekstraksi cair. Proses ekstraksi padat-cair sangat dipengaruhi oleh waktu ekstraksi, suhu yang digunakan, pengadukan, dan banyaknya pelarut yang digunakan (Harborne 1996). Perlakuan pendahuluan untuk bahan padat dapat dilakukan dengan beberapa cara di antaranya dengan pengeringan bahan baku sampai kadar air tertentu dan penggilingan untuk mempermudah proses ekstraksi dengan memperbesar kontak antara bahan dan pelarut (Harborne 1996). Kontak yang intensif menyebabkan komponen aktif pada campuran akan berpindah ke dalam pelarut (Gamse 2002).
Pemilihan pelarut merupakan faktor yang menentukan dalam ekstraksi. Pelarut yang digunakan dalam ekstraksi harus dapat menarik komponen aktif dari campuran. Hal-hal yang harus diperhatikan dalam memilih pelarut adalah selektivitas, sifat pelarut, kemampuan untuk mengekstraksi, tidak bersifat racun, mudah diuapkan, dan harganya relatif murah (Gamse 2002). Perendaman suatu bahan dalam pelarut dapat meningkatkan permeabilitas dinding sel dalam 3 tahapan, yaitu masuknya pelarut ke dalam
dinding sel tanaman dan membengkakkan sel, kemudian senyawa yang terdapat dalam dinding sel akan terlepas dan masuk ke dalam pelarut, diikuti oleh difusi senyawa yang terekstraksi oleh pelarut keluar dari dinding sel tanaman (Supriadi 2008). Umumnya pelarut ditambahkan sekurang-kurangnya sampai seluruh contoh tepat terendam.
Salah satu prosedur klasik untuk memperoleh kandungan senyawa organik dari jaringan tumbuhan ialah maserasi. Metode maserasi digunakan untuk mengekstrak komponen, baik yang tidak tahan panas, maupun yang tahan panas. Metode ini dilakukan hanya dengan merendam sampel dalam suatu pelarut dengan lama waktu tertentu, biasanya selama 24 jam tanpa menggunakan pemanasan. Kelebihan metode maserasi di antaranya sederhana, tidak menggunakan peralatan yang rumit, relatif murah, serta dapat menghindari kerusakan komponen senyawa yang tidak tahan panas. Kelemahan dari metode ini di antaranya membutuhkan waktu yang lama dan penggunaan pelarut yang tidak efisien (Meloan 1999).
Metode ekstraksi sonikasi memanfaatkan gelombang ultrasonik dengan frekuensi rendah 20-40 kHz yang dapat mempercepat waktu kontak antara sampel dan pelarut meskipun pada suhu ruang. Hal ini menyebabkan proses perpindahan massa senyawa bioaktif dari dalam sel tanaman ke pelarut menjadi lebih cepat. Sonikasi mengandalkan energi gelombang yang menyebabkan proses kavitasi, yaitu proses pembentukan gelembung-gelembung kecil akibat adanya transmisi gelombang ultrasonik untuk membantu difusi pelarut ke dalam dinding sel tanaman (Ashley et al. 2001).
Radikal Bebas dan Antioksidan Radikal bebas adalah substansi reaktif yang dibentuk dalam sel-sel tubuh sebagai hasil proses metabolisme. Radikal bebas merupakan molekul atau atom yang tidak stabil karena memiliki satu atau lebih elektron tidak berpasangan pada orbital terluarnya. Radikal bebas sangat berbahaya karena sangat reaktif dalam mencari pasangan elektronnya, bereaksi dengan cepat pada biomolekul melalui banyak jenis reaksi, antara lain penangkapan hidrogen, donor elektron, dan penggunaan elektron bersama. Radikal bebas akan melepaskan elektron pada molekul sekitarnya untuk menghasilkan pasangan elektron untuk menjadi molekul yang stabil.
Reaksi ini akan berlangsung terus-menerus dalam tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit seperti kanker, penuaan dini, serta penyakit degeneratif lainnya (Ng 2000; Pourmorad 2006). Untuk itu, tubuh memerlukan suatu substansi penting yang mampu menangkap radikal bebas tersebut sehingga tidak dapat menginduksi suatu penyakit.
Antioksidan dinyatakan sebagai senyawa yang secara nyata dapat memperlambat oksidasi, walaupun dengan konsentrasi yang lebih rendah dibandingkan dengan substrat yang dapat dioksidasi. Antioksidan dapat menangkap berbagai jenis oksigen yang secara biologis bersifat reaktif (O2-, H2O2,
-OH, -HOCl, dsb), dengan cara mengubah pembentukan molekul radikal bebas atau dengan melengkapi kekurangan elektron radikal bebas yang dapat menimbulkan stress oksidatif (Pietta 2000). Oleh karena itu, antioksidan merupakan substansi yang diperlukan tubuh untuk menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas tersebut.
Berdasarkan sumbernya antioksidan dibagi dalam dua kelompok, yaitu antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesa reaksi kimia) dan antioksidan alami (antioksidan hasil ekstraksi bahan alami). Antioksidan sintetik yang diizinkan dalam pangan di antaranya Butylated Hydroxyanisol (BHA), Butylated Hydroxytoluene (BHT), propil galat, dan tokoferol (Leclerrcq et al. 2000).
Menurut Shahidi & Naczk (1995), senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin, tokoferol dan asam-asam organik polifungsional. Ditambahkan oleh Pratt (1992), golongan flavonoid yang memiliki aktivitas antioksidan meliputi flavon, flavonol, isoflavon, katekin, flavonol dan kalkon.
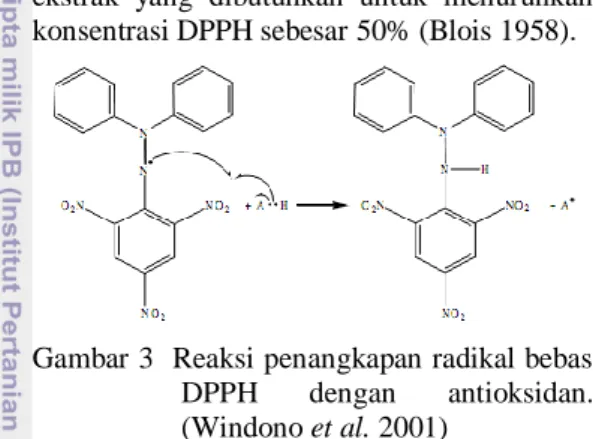
Aktivitas Antioksidan Metode DPPH Metode DPPH digunakan secara luas untuk menguji kemampuan senyawa dalam menangkap radikal bebas atau donor hidrogen. DPPH merupakan radikal bebas yang stabil pada suhu kamar dan sering digunakan untuk mengevaluasi aktivitas antioksidan beberapa senyawa atau ekstrak bahan alam. DPPH berperan sebagai radikal bebas yang diredam oleh antioksidan dari
bahan uji. DPPH akan bereaksi dengan antioksidan tersebut membentuk 1,3-difenil-2-pikrilhidrazin (Gambar 3). Reaksi ini menyebabkan terjadinya perubahan warna yang dapat diukur dengan spektrometer UV-vis, sehingga aktivitas peredaman radikal bebas oleh sampel dapat ditentukan. Pengukuran diukur secara stoikiometri sesuai dengan jumlah elektron atau atom hidrogen yang ditangkap oleh molekul DPPH akibat adanya zat antioksidan. Aktivitas antioksidan dinyatakan dengan nilai IC50 yaitu konsentrasi
ekstrak yang dibutuhkan untuk menurunkan konsentrasi DPPH sebesar 50% (Blois 1958).
Gambar 3 Reaksi penangkapan radikal bebas DPPH dengan antioksidan. (Windono et al. 2001)
Radikal DPPH merupakan sebuah radikal bebas yang stabil dan memberikan serapan pada panjang gelombang sekitar 520 nm, serta memiliki warna ungu yang ditunjukkan oleh pita absorbans ketika dilarutkan dalam etanol atau metanol. DPPH akan berubah menjadi bentuk tereduksi dan kehilangan warna ungunya ketika dicampurkan dengan zat yang mampu bertindak sebagai donor atom hidrogen (Molyneux 2004).
Kromatografi Lapis Tipis (KLT) Kromatografi lapis tipis, dikenal sebagai kromatografi planar, merupakan teknik yang digunakan untuk memisahkan campuran komponen berdasarkan distribusi komponen tersebut di antara dua fase, yaitu fase diam dan fase gerak. Pemisahan dilakukan pada lapisan tipis fase diam (100-200 µm), pada umumnya silika gel yang terdapat pada pelat. Pelat tersebut dapat terbuat dari kaca, plastik, atau aluminium dengan ukuran beberapa sentimeter. Bahan pengikat inert seperti gipsum dicampurkan ke dalam fase diam selama pembuatan pelat untuk mempetahankan agar fase diam tetap berada pada pelat dan untuk menjamin kepaduan antar-partikel. Fase diam untuk KLT seringkali juga mengandung substansi yang dapat berpendar (fluoresens) dalam sinar ultra
violet (254 nm), ini berfungsi untuk memudahkan visualisasi spot yang dihasilkan. Fase gerak bekerja berdasarkan prinsip kapilaritas terhadap fase diam. Fase gerak menggerakkan komponen sampel pada berbagai laju karena perbedaan tingkatan interaksi dari setiap komponen dengan matriks dan kelarutannya dalam pelarut (Gambar 4). Lokalisasi setiap komponen pada pelat berfungsi untuk mengukur jarak migrasi komponen dari tempat asalnya. Pergerakan zat relatif terhadap garis depan pelarut dalam sistem kromatografi lapis tipis dapat didefinisikan sebagai nilai Rf, yaitu perbandingan jarak tempuh zat dengan jarak tempuh senyawa dengan jarak yang ditempuh pelarut. Nilai Rf khas untuk suatu senyawa tertentu (Khopkar 2002).
Gambar 4 Ruangan pengembang dan pelat kromatografi lapis tipis. (Rouessac & Rouessac 1994) Analisis Sidik Jari
Analisis sidik jari merupakan analisis yang dapat dimanfaatkan untuk evaluasi dan kontrol kualitas multikomponen dari tanaman obat. Komponen kimia dalam tanaman obat sangat bergantung pada musim panen, sumber tanaman, proses pengeringan, dan faktor lainnya, sehingga perlu dilakukan penentuan komponen kimia dalam tanaman obat untuk menjamin kepercayaan dalam penelitian klinis dan farmakologis, mengetahui bioaktivitas dan kemungkinan efek samping dari komponen aktif, dan untuk meningkatkan kontrol kualitas produk (Liang et al. 2004). Analisis ini memberikan informasi komponen kimia dalam bentuk spektrogram, kromatogram, dan grafik lainnya yang diperoleh dari teknik analitik untuk menentukan identitas, kualitas, dan keaslian tanaman obat (Borges et al. 2007).
Beberapa teknik kromatografi seperti kromatografi lapis tipis (KLT), kromatografi cair kinerja tinggi (KCKT), kromatografi gas (KG), dan elektroforesis kapiler dapat digunakan dalam analisis sidik jari. Kromatografi lapis tipis (KLT) direkomendasikan sebagai teknik yang efektif untuk identifikasi tanaman obat. Beberapa
kelebihan dengan menggunakan KLT, yaitu cepat, mudah digunakan pada penapisan awal dengan penilaian semikuantitatif daripada teknik kromatografi lainnya, sederhana, murah, persiapan sampel yang mudah serta dapat mendeteksi dalam jumlah yang besar (Liang et al. 2004). Namun terdapat beberapa keterbatasan dalam ketepatan dan keterulangan dibandingkan dengan analisis kolom.
Rancangan Percobaan
Rancangan percobaan adalah proses perencanaan studi untuk memenuhi tujuan tertentu. Konsep dalam rancangan percobaan yaitu menggunakan satu set percobaan yang dipilih dengan baik yang bertujuan untuk mengoptimumkan proses dengan melakukan masing-masing percobaan dan untuk menarik kesimpulan tentang interaksi dari objek yang dipelajari (Triefenbach 2008). Rancangan percobaan merupakan suatu pendekatan dalam pengembangan dan pengoptimuman. Metode ini layak mendapatkan formulasi yang diinginkan secepat mungkin dengan menghindari percobaan yang tidak perlu. Efek dari setiap faktor pada respon masing-masing formulasi dapat dievaluasi dan faktor-faktor kritis dapat diidentifikasi berdasarkan analisis statistik (Bolourtchian 2008). Metodologi respon permukaan (RSM) adalah kumpulan teknik matematis dan statistik yang berguna untuk merancang percobaan, membangun model, dan menganalisis pengaruh beberapa faktor independen. RSM menyediakan alat yang efektif untuk menyelidiki aspek-aspek yang memengaruhi respon yang diinginkan jika terdapat banyak faktor dan interaksi dalam percobaan (Yin et al. 2009).
Rancangan campuran adalah kelas rancangan permukaan respon dengan jumlah dari semua komponen adalah satu. Rancangan campuran merupakan rancangan yang digunakan pada percobaan dengan campuran bahan. Dalam rancangan ini, faktornya adalah komponen atau bahan dari campuran sehingga taraf dari masing-masing faktor tidak saling bebas (Montgomery 1991). Dalam campuran percobaan, faktor-faktor independen adalah komponen campuran dan respon tergantung pada proporsi relatif masing-masing bahan, hal ini melibatkan perubahan komposisi campuran dan mengeksplorasi dalam mengetahui pengaruh sifat-sifat campuran (Bolourtchian 2008). Rancangan campuran dapat digunakan untuk larutan ekstraksi dan fase gerak kromatografi untuk keperluan
optimisasi (Borges 2007). Rancangan campuran dapat digambarkan dalam sistem koordinat simplex yang terdiri atas simplex
lattice, simplex centroid, dan extreme vartices. Simplex centroid diperkenalkan oleh
Scheffe pada tahun 1963 untuk memberikan ulasan percobaan dari respon permukaan di bagian tengah bidang. Salah satu cara untuk menggambarkan model adalah mempertimbangkan struktur dari percobaan tiga faktor. Titik tengah ditempatkan dalam model dengan menemukan rata-rata tingkatan dari semua faktor yang terlibat. Rancangan tiga komponen dapat digambarkan dengan segitiga sama sisi dengan dua dimensi (Soares
et al. 2007) dapat dilihat pada Gambar 5.
Penelitian mengenai pengoptimuman fase gerak menggunakan simplex centroid design (SCD) telah dilakukan oleh Borges et al. (2007), serta Soares et al. (2007).
Gambar 5 Model simplex centroid design with
axial.
Rancangan kombinasi merupakan rancangan campuran ganda. Rancangan kombinasi memungkinkan penggabungan antara komponen campuran dan faktor proses. Terdapat dua jenis rancangan untuk membuat rancangan kombinasi. Rancangan optimal termasuk ke dalam kelas rancangan percobaan yang optimal berhubungan dengan beberapa kriteria statistik. Rancangan optimal memungkinkan parameter yang akan diestimasi dengan variasi minimum. Rancangan D-Optimal (D-Optimal design) merupakan salah satu bentuk rancangan yang disediakan oleh algoritma komputer. Rancangan ini dapat disesuaikan untuk memenuhi rancangan campuran klasik, menghasilkan estimasi yang tidak ortogonal dan efek estimasi dapat berkorelasi (Bolourtchian 2008). Kelebihan menggunakan rancangan optimal, yaitu dapat mengurangi biaya percobaan karena memungkinkan model statistik yang akan diestimasi dengan
(0,1,0) B (0,0,1)
menjalankan percobaan yang lebih sedikit, dapat menampung beberapa jenis faktor seperti proses, campuran, dan faktor diskrit.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan antara lain daun salam dari daerah Cikabayan, metanol, akuades, etil asetat, FeCl3, HCl 1 N, H2SO4
pekat, amil alkohol, kloroform, CH3COONa,
Na2CO3, CH3COOPb, NaOH 0.1 N, DPPH,
n-butanol, etanol, asam asetat, diklorometana, etil asetat, standar kuersetin, AlCl3 2%.
Alat yang digunakan adalah peralatan gelas, neraca analitik XT 220A (Precisa), cawan porselin, oven (Momert), maserator, eksikator, ultrasonic batch processor 38 kHz, pelat KLT GF254 (Merck), penguap putar
R-114 (Buchi), freeze dryer, pipet mikro,
microplate reader, Camag Linomat V, Camag
reprostar 3, Camag aplikator, piranti lunak DX8.0.6 versi uji coba.
Ruang Lingkup
Metode penelitian yang akan dilakukan mengikuti diagram alir pada Lampiran 1 yang meliputi penentuan kadar air serbuk daun salam yang telah dikeringudarakan dan dikeringkan dengan oven pada suhu 50 ⁰C, kemudian dilakukan ekstraksi flavonoid serbuk daun salam tersebut dengan meragamkan metode ekstraksi, polaritas pelarut, dan waktu ekstraksi menggunakan bantuan rancangan percobaan D-Optimal
Design melalui piranti lunak DX8.0.6 versi uji
coba, selanjutnya ekstrak kasar yang dihasilkan dihitung rendemennya dan diuji aktivitas antioksidannya, kemudian dilakukan penentuan kadar flavonoid total terhadap ekstrak tersebut. Ekstrak dengan bioaktivitas terbaik, yaitu ekstrak yang memiliki kadar flavonoid dan aktivitas antioksidan tertinggi selanjutnya dilakukan analisis sidik jari dengan kromatografi lapis tipis (KLT). Pemilihan fase gerak terbaik untuk analisis sidik jari dilakukan dengan memilih 3 dari 6 pelarut yang menunjukkan pita terbanyak pada pelat hasil elusi ekstrak daun salam. Selanjutnya ketiga pelarut tersebut dirancang menggunakan rancangan campuran Simplex
Centroid Design (SCD) with axial
menghasilkan 10 perbandingan komposisi pelarut. Komposisi pelarut terbaik adalah
pelarut yang menunjukkan keterpisahan pita terbaik pada pelat KLT.
Pengumpulan dan Persiapan Contoh Contoh daun salam dikeringudarakan untuk mendapatkan kadar air yang relatif rendah. Setelah itu, digiling sehingga didapatkan serbuk daun salam.
Penentuan Kadar Air (AOAC 1984) Cawan porselin dikeringkan dalam oven pada suhu 105 ⁰C selama 30 menit. Cawan porselin yang telah dikeringkan selanjutnya didinginkan dalam eksikator selama 30 menit dan ditimbang bobot kosongnya. Sampel daun salam ditimbang sebanyak 3 g dan dimasukkan ke dalam cawan porselin tersebut, selanjutnya sampel beserta cawan dimasukkan dalam oven bersuhu 105 ⁰C selama 3 jam. Setelah itu, cawan porselin tersebut didinginkan dalam eksikator selama 30 menit dan ditimbang. Prosedur dilakukan berulang kali hingga didapat bobot tetap dengan selisih kurang dari 1 mg. Penentuan kadar air dilakukan sebanyak 3 kali ulangan (triplo). Kadar air daun salam dihitung dengan rumus: Kadar air (%) = x 100
a adalah bobot daun sebelum dikeringkan (g) dan b adalah bobot daun setelah dikeringkan (g).
Ekstraksi Flavonoid Total dengan Bantuan Rancangan Percobaan D-Optimal Serbuk daun salam dimasukkan ke dalam Erlenmeyer kemudian ditambahkan pelarut ke dalamnya dan diekstraksi dalam waktu tertentu, nisbah jumlah pelarut dengan bahan yang digunakan adalah 1:10. Residu kemudian ditambah lagi pelarut yang sama dan diekstraksi dengan kondisi operasi yang sama hingga tiga kali. Selanjutnya maserat disatukan dan dikeringkan dengan penguap putar dan pengering beku. Ekstrak yang diperoleh kemudian ditimbang dan ditentukan rendemennya.
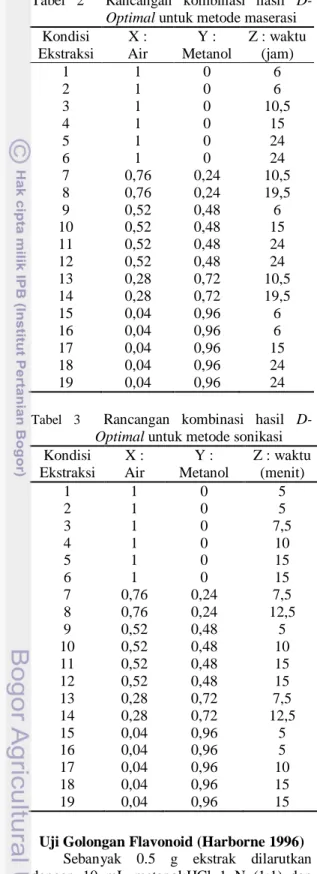
Ekstraksi dilakukan dengan meragamkan metode ekstraksi (maserasi dan sonikasi), polaritas pelarut (air:metanol), serta waktu ekstraksi. Rancangan yang optimal dipilih untuk mendapatkan formulasi dengan variasi minimum. Model dirancang melalui rancangan kombinasi menggunakan perangkat lunak DX8.0.6 versi uji coba. Rancangan kombinasi yang dicobakan selengkapnya dapat dilihat pada Tabel 2 dan 3.
Tabel 2 Rancangan kombinasi hasil D-
Optimal untuk metode maserasi
Kondisi X : Y : Z : waktu Ekstraksi Air Metanol (jam)
1 1 0 6 2 1 0 6 3 1 0 10,5 4 1 0 15 5 1 0 24 6 1 0 24 7 0,76 0,24 10,5 8 0,76 0,24 19,5 9 0,52 0,48 6 10 0,52 0,48 15 11 0,52 0,48 24 12 0,52 0,48 24 13 0,28 0,72 10,5 14 0,28 0,72 19,5 15 0,04 0,96 6 16 0,04 0,96 6 17 0,04 0,96 15 18 0,04 0,96 24 19 0,04 0,96 24
Tabel 3 Rancangan kombinasi hasil
D-Optimal untuk metode sonikasi
Kondisi X : Y : Z : waktu Ekstraksi Air Metanol (menit)
1 1 0 5 2 1 0 5 3 1 0 7,5 4 1 0 10 5 1 0 15 6 1 0 15 7 0,76 0,24 7,5 8 0,76 0,24 12,5 9 0,52 0,48 5 10 0,52 0,48 10 11 0,52 0,48 15 12 0,52 0,48 15 13 0,28 0,72 7,5 14 0,28 0,72 12,5 15 0,04 0,96 5 16 0,04 0,96 5 17 0,04 0,96 10 18 0,04 0,96 15 19 0,04 0,96 15
Uji Golongan Flavonoid (Harborne 1996) Sebanyak 0.5 g ekstrak dilarutkan dengan 10 mL metanol:HCl 1 N (1:1) dan dipanaskan dalam labu Erlenmeyer pada suhu 95 ⁰C selama 1 jam. Setelah itu, didinginkan dan disaring, lalu filtratnya diekstraksi dengan etil asetat. Fase asamnya dipanaskan kembali lalu diekstrak dengan amil alkohol. Ekstrak amil alkohol digunakan untuk penentuan
antosianidin dan ekstrak etil asetat digunakan untuk penentuan adanya flavonoid yang lain. Penentuan Antosianidin
Sebanyak 1 mL ekstrak amil alkohol ditambahkan 3 tetes CH3COONa lalu diamati,
kemudian ditambahkan dengan 3 tetes FeCl3
dan diamati kembali. Antosianidin dengan CH3COONa memberikan warna merah hingga
ungu, dan bila ditambahkan dengan FeCl3
menjadi warna biru. Antosianidin dengan CH3COONa memberikan biru muda, dan bila
ditambahkan dengan FeCl3 warna tetap biru.
Sebanyak 1 mL ekstrak amil alkohol ditambahkan 3 tetes Na2CO3 lalu diamati.
Antosianidin memberikan warna ungu, biru, atau hijau.
Penentuan Flavonoid Lain
Sebanyak 1 mL ekstrak etil asetat ditambahkan 3 tetes CH3COOPb lalu diamati.
Senyawa flavon memberikan warna jingga hingga krem, kalkon memberikan warna jingga tua dan auron memberikan warna merah.
Sebanyak 1 mL ekstrak etil asetat ditambahkan 3 tetes NaOH 0,1 N lalu diamati. Senyawa flavonol dan flavon memberikan warna kuning, sedangkan kalkon dan auron memberikan warna merah hingga ungu.
Sebanyak 1 mL ekstrak etil asetat ditambahkan 3 tetes H2SO4 pekat lalu diamati.
Senyawa flavonol dan flavon memberikan warna kuning, flavonol memberikan warna jingga hingga krem, dan kalkon memberikan warna krem hingga merah tua.
Penentuan Kadar Flavonoid Total (Zongo
et al. 2010)
Penentuan flavonoid total dilakukan menggunakan metode kolorimetri dengan kuersetin sebagai standar. Ekstrak dilarutkan dengan etanol 75% dan 100 µL dari larutan ini kemudian dicampurkan dengan 100 µL AlCl3
2%. Setelah 15 menit inkubasi pada suhu ruang, absorbans diukur pada 435 nm menggunakan multiwell plate reader. Tiga ulangan dibuat untuk setiap sampel yang diuji. Untuk setiap sampel, larutan blanko disiapkan dengan mengganti AlCl3 dengan pelarut yang
digunakan untuk melarutkan ekstrak. Kuersetin digunakan sebagai standar untuk kalibrasi dan kurva kalibrasi (berkisar dari 0-50 µg/mL) dihasilkan. Kandungan flavonoid total (rata-rata dari analisis tiga ulangan) ditunjukkan sebagai kuersetin ekivalen dalam mg/mg ekstrak.
Uji Aktivitas Antioksidan (Salazar-Alandra 2009)
Ekstrak pekat dibuat larutan dengan konsentrasi berbeda yang berkisar antara 0,234-200 µg/mL dalam etanol dari larutan stok 1 mg/mL. Sebanyak 100 µL larutan DPPH 125 µM dalam etanol ditambahkan dengan 100 µL larutan ekstrak, sehingga volume total menjadi 200 µL. Campuran diaduk dan diinkubasi pada suhu 37 ⁰C dalam gelap selama 30 menit. Serapan kemudian diukur pada 517 nm dengan spektrofotometer. Kuersetin digunakan sebagai kontrol positif. Kapasitas penangkapan radikal DPPH dihitung dengan rumus:
Aktivitas penangkapan radikal (%) =
x 100
A adalah absorbans kontrol negatif (larutan DPPH dalam etanol) dan B adalah absorbans sampel (larutan DPPH dalam larutan ekstrak). Hubungan antara setiap konsentrasi dan aktivitas penangkapan radikal diplotkan, dan nilai IC50 kemudian dihitung.
Pemilihan Fase Gerak Terbaik menggunakan Kromatografi Lapis Tipis
(KLT) Penotolan sampel
Ekstrak pekat daun salam dilarutkan dalam pelarut yang sesuai sehingga didapatkan ekstrak dengan konsentrasi 10000 µg/mL dan ditotolkan pada pelat KLT GF254.
Pemilihan fase gerak
Pemilihan fase gerak diawali menggunakan 6 pelarut tunggal, yaitu n-butanol, metanol, asam asetat, diklorometana, etil asetat, dan kloroform. Sebanyak 10 mL dari 6 pelarut tersebut dimasukkan ke dalam bejana kromatografi dan dijenuhkan selama 20 menit. Setelah itu, pelat KLT yang telah berisi sampel dimasukkan ke dalam bejana kromatografi dan dipisahkan hingga fase gerak mencapai ± 0,5 cm dari tepi atas pelat. Selanjutnya pelat KLT diangkat, dikeringkan, dan dideteksi. Deteksi dilakukan untuk melihat pita yang muncul pada pelat KLT menggunakan UV pada panjang gelombang 254 nm dan 366 nm. Setelah itu, dipilih tiga pelarut yang menghasilkan penampakan pita terbanyak dan pemisahan ekstrak yang lebih baik. Ketiga pelarut terpilih dikombinasikan berdasarkan Simplex Centroid Design (SCD)
with axial menghasilkan 10 perbandingan
komposisi pelarut (Tabel 4). Selanjutnya dilakukan pemisahan komponen sampel
menggunakan 10 kombinasi pelarut. Nilai Rf serta jumlah pita yang diperoleh menjadi parameter untuk menentukan eluen terbaik. Deteksi komponen
Deteksi komponen dapat dilakukan menggunakan UV 366 nm.
Tabel 4 Rancangan komposisi fase gerak Fase
Gerak
Komposisi Fase Gerak (v/v/v) A B C 1 1 0 0 2 0 0 1 3 0 1 0 4 1/2 0 1/2 5 0 1/2 1/2 6 1/2 1/2 0 7 1/3 1/3 1/3 8 1/6 2/3 1/6 9 1/6 1/6 2/3 10 2/3 1/6 1/6 Pengolahan Data
Pengolahan data yang dihasilkan dilakukan dengan piranti lunak DX8 versi uji coba. Pengolahan tersebut dengan membuat model regresi. Kondisi optimum ekstraksi ditentukan dengan melihat kebaikan dari model yang dibuat.
HASIL DAN PEMBAHASAN
Perlakuan Pendahuluan
Daun salam yang digunakan dalam penelitian ini diambil dari daerah Cikabayan. Umur tanaman salam tersebut sekitar 10 tahun. Daun salam yang diambil merupakan daun dari seluruh bagian tanaman yang dihomogenkan.
Serbuk daun salam disiapkan dari simplisia daun salam yang telah dikeringudarakan hingga kadar air relatif rendah selanjutnya digiling dan dihomogenkan. Penggilingan bertujuan memperluas permukaan bahan agar pada tahap ekstraksi interaksi antara pelarut pengekstraksi dan bahan yang diekstraksi menjadi lebih efektif (Harborne 1996). Hal ini dapat mempermudah kelarutan komponen bioaktif dan meningkatkan rendemen ekstraksi.
Setelah dilakukan pengukuran kadar air, kadar air serbuk daun salam tersebut masih tinggi sehingga pengeringan dilanjutkan kembali di dalam oven pada suhu 50 ⁰C hingga kadar airnya di bawah 10%. Hal ini dilakukan untuk mencegah terjadinya perubahan kimia yang tidak diinginkan pada sampel. Suhu ini relatif aman serta mencegah terjadinya kerusakan pada senyawa metabolit sekunder tertentu, khususnya flavonoid. Flavonoid merupakan senyawa fenol yang memiliki sistem aromatik yang terkonjugasi (Harborne 1996). Sistem aromatik terkonjugasi mudah rusak pada suhu tinggi. Selain itu, beberapa golongan flavonoid memiliki ikatan glikosida dengan molekul gula. Ikatan glikosida akan mudah rusak atau putus pada suhu tinggi (Poedjiadi 1994).
Kadar Air Simplisia Daun Salam Penentuan kadar air berfungsi mengetahui kandungan air pada sampel sebagai persen bahan keringnya, hal ini berguna sebagai faktor koreksi terhadap hasil rendemen ekstrak kasar flavonoid yang diperoleh. Selain itu berfungsi untuk mengetahui ketahanan sampel terhadap penyimpanan (Harjadi 1986), karena kandungan air di dalam bahan merupakan medium tumbuh bagi mikroorganisme. Kadar air yang baik adalah kurang dari 10% karena pada tingkat kadar air tersebut waktu simpan sampel akan relatif lebih lama dan terhindar dari pencemaran yang disebabkan oleh mikroba (Winarno 1992).
Penentuan kadar air dilakukan pada suhu 105 ⁰C. Menurut Harjadi (1986), air yang terikat secara fisik dapat dihilangkan pada suhu 100-105 ⁰C. Kadar air rerata dari serbuk daun salam kering ialah sebesar 8,80%. Kadar air tersebut memenuhi standar kadar air untuk tanaman obat yaitu kurang dari 10%. Berdasarkan nilai tersebut dapat dikatakan dalam 100 g sampel daun salam terdapat kandungan air 8,8 g (Lampiran 2). Hasil ini menunjukkan bahwa daun salam dapat disimpan dalam jangka waktu relatif lama. Kadar air pada sampel tidak selalu sama karena dipengaruhi oleh kelembaban, perlakuan terhadap sampel, serta besarnya penguapan.
Ekstraksi Flavonoid Daun Salam Metode ekstraksi yang digunakan adalah maserasi dan sonikasi. Metode ekstraksi maserasi dipilih karena maserasi merupakan
metode yang sering digunakan untuk mengekstraksi bahan alam. Ekstraksi dengan maserasi merupakan teknik merendam sampel dengan pelarut yang sesuai dalam waktu tertentu. Waktu yang diperlukan untuk ekstraksi maserasi relatif lebih lama. Untuk itu, pada penelitian ini dibandingkan dengan metode ekstraksi sonikasi dengan memanfaatkan energi gelombang ultrasonik yang menyebabkan proses kavitasi sehingga diharapkan senyawa yang ada pada sel tanaman akan terekstrak pada pelarut yang digunakan dan waktu menjadi lebih singkat. Ekstraksi flavonoid dilakukan dengan pelarut metanol:air, mengacu pada metode Markham (1988). Penelitian ini meragamkan nisbah kedua pelarut tersebut, dan juga waktu ekstraksi. Kisaran waktu ekstraksi untuk maserasi ialah antara 6 hingga 24 jam, sedangkan sonikasi antara 5 hingga 15 menit.
Ekstraksi dilakukan menggunakan pelarut metanol:air. Sejumlah gugus hidroksil yang tak terganti atau suatu gula menyebabkan flavonoid bersifat polar sehingga larut dalam pelarut polar seperti metanol. Pengaruh glikosilasi (gula terikat pada flavonoid) menyebabkan flavonoid menjadi kurang reaktif sehingga lebih mudah larut dalam pelarut polar seperti air (Harborne 1996; Markham 1988). Ekstraksi senyawa aktif dari suatu jaringan tanaman dengan berbagai jenis pelarut pada tingkat kepolaran berbeda dan waktu yang berbeda bertujuan untuk memperoleh hasil yang optimal, baik jumlah ekstrak maupun senyawa aktif yang terkandung dalam sampel.
Nisbah bahan baku dan pelarut (1:10) didasarkan pada penelitian Umar (2008) yang menyatakan bahwa kadar flavonoid total tertinggi dihasilkan pada nisbah bahan baku dan pelarut (1:10). Pada nisbah tersebut pelarut cukup untuk merendam sampel, sehingga proses ekstraksi menjadi lebih efektif.
Ekstraksi dilakukan dengan meragamkan tiga faktor, yaitu metode ekstraksi (maserasi dan sonikasi), pelarut ekstraksi (campuran metanol dan air), serta waktu ekstraksi, sesuai dengan Tabel 2 dan 3. Rendemen ekstraksi yang diperoleh berkisar antara 8,83% hingga 23,69%. Rendemen tertinggi pada teknik maserasi adalah 24,56% diperoleh saat digunakan pelarut metanol 48%, pada waktu 15 jam. Rendemen tertinggi pada teknik sonikasi adalah 19,76% diperoleh saat digunakan pelarut metanol 48%, pada waktu 15 menit. Data rendemen selengkapnya dapat dilihat pada Gambar 6 dan 7.
Gambar 6 Grafik rendemen ekstraksi maserasi (%) dengan ragam perlakuan pelarut ( air, metanol 24%, metanol 48%, metanol 72%, metanol 96%) dan waktu (6-24 jam) dengan meningkatnya waktu dari kanan ke kiri.
Gambar 7 Grafik rendemen ekstraksi sonikasi (%) dengan ragam perlakuan pelarut ( air, metanol 24%, metanol 48%, metanol 72%, metanol 96%) dan waktu
(5-15 menit) dengan meningkatnya waktu dari kanan ke kiri. Proses ekstraksi berdasarkan pada prinsip
kelarutan like dissolve like, yaitu pelarut polar akan melarutkan senyawa polar, dan pelarut nonpolar akan melarutkan senyawa nonpolar. Rendemen estraksi tertinggi diperoleh saat menggunakan pelarut metanol 48% yang bersifat polar. Pelarut tersebut dapat mengekstrak senyawa polar maupun nonpolar dalam sampel sehingga menghasilkan rendemen paling tinggi di antara penggunaan pelarut lainnya. Pelarut metanol 48% dapat mengambil senyawa flavonoid yang terikat dengan glikosida maupun flavonoid yang tidak memiliki ikatan glikosida. Lama waktu ekstraksi juga sangat mempengaruhi rendemen ekstraksi, terlihat rendemen ekstraksi tertinggi terdapat pada teknik ekstraksi maserasi yaitu sebesar 24,56%. Hal ini dikarenakan pada teknik maserasi terjadi kontak yang lebih lama dan intensif antara pelarut dan sampel yang menyebabkan komponen dalam sampel berpindah ke dalam pelarut sehingga rendemen ekstraksi semakin tinggi.
Berdasarkan rancangan kombinasi
D-Optimal tidak semua kondisi dari setiap teknik
eksraksi memiliki ulangan. Hal ini bertujuan
untuk melihat ketelitian yang dihasilkan dari kondisi yang diulang dan diharapkan dapat mewakili ketelitian yang dilakukan untuk kondisi ekstraksi lainnya. Ketelitian diperoleh dengan kisaran 82,78% hingga 99,97%.
Kadar Flavonoid Daun Salam Pembuatan kurva standar flavonoid didasarkan pada metode kolorimetri (Zongo et
al. 2010). Analisis ini didasarkan pada reaksi
pembentukan kompleks antara flavonoid dan aluminium klorida. Gugus orto dihidroksi dan gugus hidroksi keton dari flavonoid ini membentuk kompleks dengan AlCl3 sehingga
memberikan efek batokromik (Harborne 1996) dan kemudian diukur menggunakan spektrofotometri UV-vis sebagai ekivalen kuersetin. Kuersetin digunakan sebagai standar karena senyawa ini merupakan senyawa flavonoid kuat golongan flavonol. Flavonol diketahui sebagai senyawa penciri adanya flavonoid karena keberadaanya yang banyak tersebar dalam tumbuhan. Selain itu, kebanyakan tanaman obat memperlihatkan aktivitas kandungan kuersetin yang tinggi. 0 5 10 15 20 25 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 13,31 13,82 12,90 13,47 8,8311,28 21,61 19,75 23,0224,5621,12 23,53 18,86 22,85 23,93 23,69 24,3021,1123,35 ren d em en (% ) kondisi ekstraksi 0 5 10 15 20 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 13,78 13,7913,9913,8014,0014,84 18,1718,83 17,48 18,8918,78 19,76 14,19 17,90 17,48 17,2816,13 14,42 16,76 ren d em en (% ) kondisi ekstraksi
Menurut metode ini, larutan standar kuersetin dengan berbagai konsentrasi diukur pada panjang gelombang 435 nm. Kurva standar yang diperoleh memiliki persamaan garis y = 0,025x + 0,043 dengan R2 = 0,9993 yang menunjukkan konsentrasi mampu menerangkan keragaman absorbans sebesar 99,93%, dan sekitar 0,007% oleh faktor lain. Berdasarkan kurva standar, dapat ditentukan kadar flavonoid total dari sampel sesuai perlakuan yang dicobakan. Hasil selengkapnya disajikan dalam Lampiran 3.
Nilai kadar flavonoid total tertinggi untuk teknik maserasi dan sonikasi masing-masing berturut-turut sebesar 0,0153 mg QE/mg ekstrak dan 0,0139 mg QE/mg ekstrak (Tabel 5 dan 6). Nilai kadar flavonoid tertinggi untuk teknik maserasi diperoleh saat digunakan pelarut metanol 96% dengan waktu ekstraksi selama 24 jam, sedangkan untuk teknik sonikasi diperoleh saat digunakan pelarut metanol 96% dalam waktu ekstraksi 5 menit.
Apabila dibandingkan dari kedua teknik ekstraksi yang digunakan, kadar flavonoid tertinggi diperoleh dengan teknik maserasi. Perendaman suatu bahan dalam pelarut dapat meningkatkan permeabilitas dinding sel dalam 3 tahapan, yaitu masuknya pelarut ke dalam dinding sel tanaman dan membengkakkan sel, kemudian senyawa yang terdapat dalam dinding sel akan terlepas dan masuk ke dalam pelarut, diikuti oleh difusi senyawa yang terekstraksi oleh pelarut keluar dari dinding sel tanaman (Gamse 2002). Hal ini berkaitan dengan waktu kontak antara bahan dan pelarut pengekstraksi yang lebih intensif pada teknik maserasi menyebabkan komponen dalam sampel terutama flavonoid berpindah ke dalam pelarut pengekstraksi yang digunakan.
Kedua teknik ekstraksi menunjukkan pelarut metanol 96% dapat mengekstraksi flavonoid daun salam dengan baik. Hal ini dikarenakan pelarut organik polar seperti metanol 96% selektif dalam mengekstraksi senyawa fenol seperti flavonoid yang tidak memiliki ikatan glikosida dengan molekul gula sederhana. Senyawa flavonoid ini kurang polar sehingga pelarut metanol 96% merupakan pelarut yang baik untuk mengekstraksi flavonoid tersebut.
Kadar flavonoid daun salam berdasarkan kondisi yang dicobakan dapat dilihat pada Tabel 5 dan 6. Secara keseluruhan, teknik ekstraksi maserasi memberikan kadar flavonoid lebih tinggi dibandingkan dengan teknik sonikasi. Semakin polar pelarut organik yang digunakan, semakin tinggi pula kadar flavonoid yang diperoleh. Semakin lama
waktu ekstraksi yang digunakan, maka semakin tinggi pula kadar flavonoidnya. Secara keseluruhan faktor-faktor yang dicobakan berpengaruh pada kadar flavonoid.
Aktivitas Antioksidan Daun Salam Aktivitas antioksidan diuji dengan metode penangkapan radikal bebas 1,1- difenil-1,2-pikrilhidrazil (DPPH). DPPH berperan sebagai radikal bebas akan bereaksi dengan antioksidan membentuk 1,3-difenil-2-pikrilhidrazin. Antioksidan akan memberikan atom hidrogennya kepada radikal DPPH untuk melengkapi kekurangan elektron dan membentuk radikal antioksidan yang lebih stabil. Reaksi ini menyebabkan DPPH kehilagan warna ungunya ketika dicampurkan dengan zat yang mampu bertindak sebagai antioksidan dan selanjutnya diukur dengan spektrometer UV-Vis pada panjang gelombang 517 nm sehingga aktivitas peredaman radikal bebas oleh sampel dapat ditentukan.
Pengujian aktivitas antioksidan ekstrak daun salam dari kondisi ekstraksi secara keseluruhan memberikan nilai IC50 kurang
dari 100 ppm, nilai tersebut menunjukkan aktivitas antioksidan yang kuat pada ekstrak daun salam (Tabel 5 dan 6). IC50 adalah
bilangan yang menunjukkan konsentrasi ekstrak (mikrogram/mililiter) yang mampu menghambat proses oksidasi sebesar 50%. Semakin kecil nilai IC50 berarti semakin tinggi
aktivitas antioksidan. Secara spesifik, suatu senyawa dikategorikan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 50 ppm,
kuat jika IC50 bernilai 50-100 ppm, sedang
jika IC50 bernilai 100-150 ppm, dan lemah jika
IC50 adalah 151-200 ppm (Mardawati 2008).
Nilai IC50 terendah untuk metode maserasi
dan sonikasi berturut-turut adalah 11,460 µg/ml dan 7,199 µg/ml. Dengan demikian ekstrak hasil ekstraksi sonikasi memiliki aktivitas antioksidan yang lebih kuat daripada ekstraksi maserasi. Teknik sonikasi memanfaatkan gelombang ultrasonik dengan frekuensi 38 kHz yang dapat mempercepat waktu kontak antara sampel dan pelarut karena adanya proses kavitasi yaitu proses pembentukan gelembung-gelembung kecil akibat adanya transmisi gelombang ultrasonik untuk membantu difusi pelarut ke dalam dinding sel tanaman (Ashley et al. 2001). Hal ini menyebabkan proses perpindahan massa senyawa bioaktif dari dalam sel tanaman ke pelarut menjadi lebih cepat, sehingga dalam waktu 15 menit senyawa bioaktif dalam
Tabel 5 Hasil IC50 dan kadar flavonoid total
untuk rancangan kombinasi pada metode maserasi
pelarut waktu Antioksidan kadar flavonoid (jam) IC50 (mg/L) (mg QE/mg ekstrak) air 6 61,615 0,0112 air 6 61,013 0,0062 air 10,5 73,393 0,0085 air 15 53,273 0,0090 air 24 46,097 0,0151 air 24 54,185 0,0116 metanol 24% 10,5 44,519 0,0060 metanol 24% 19,5 75,236 0,0072 metanol 48% 6 17,241 0,0065 metanol 48% 15 49,312 0,0054 metanol 48% 24 21,314 0,0056 metanol 48% 24 21,873 0,0050 metanol 72% 10,5 51,906 0,0051 metanol 72% 19,5 52,505 0,0068 metanol 96% 6 21,303 0,0107 metanol 96% 6 33,940 0,0135 metanol 96% 15 11,457 0,0141 metanol 96% 24 25,062 0,0153 metanol 96% 24 27,684 0,0122
sampel terekstraksi dengan baik ke dalam pelarut.
Nilai IC50 terendah untuk teknik maserasi
diperoleh saat digunakan pelarut metanol 96% dengan waktu ekstraksi selama 15 jam, sedangkan untuk teknik sonikasi diperoleh saat digunakan pelarut metanol 48% dalam waktu ekstraksi 15 menit. Namun, aktivitas antioksidan daun salam masih lebih rendah apabila dibandingkan dengan standar kuersetin yang memiliki nilai IC50 4,683
µg/ml (Lampiran 4).
Aktivitas antioksidan tertinggi diperoleh dengan pelarut metanol 48% yang bersifat polar. Pelarut ini dapat mengekstraksi glikosida flavonoid. Molekul gula mempunyai gugus hidroksil yang bersifat polar, sehingga akan mudah larut dalam pelarut dengan kepolaran yang tinggi. Kekua-
Tabel 6 Hasil IC50 dan kadar flavonoid total
untuk rancangan kombinasi pada metode sonikasi
pelarut
waktu Antioksidan kadar flavonoid (menit) IC50 (mg/L) (mg QE/mg ekstrak) Air 5 17,598 0,0031 Air 5 16,199 0,0032 Air 7,5 36,447 0,0059 air 10 21,053 0,0033 air 15 13,875 0,0033 air 15 22,507 0,0034 metanol 24% 7,5 11,307 0,0042 metanol 24% 12,5 47,965 0,0041 metanol 48% 5 17,119 0,0039 metanol 48% 10 11,519 0,0023 metanol 48% 15 8,214 0,0048 metanol 48% 15 7,199 0,0053 metanol 72% 7.5 7,624 0,0059 metanol 72% 12,5 49,682 0,0060 metanol 96% 5 9,454 0,0112 metanol 96% 5 8,806 0,0139 metanol 96 % 10 32,490 0,0089 metanol 96% 15 10,305 0,0129 metanol 96% 15 12,469 0,0126
tan aktivitas antioksidan dari flavonoid bergantung pada jumlah dan posisi gugus hidroksil yang terdapat pada molekul. Semakin banyak gugus hidroksil pada molekul menyebabkan aktivitas antioksidan molekul tersebut akan semakin besar.
Aktivitas antioksidan tinggi tidak diperoleh saat menggunakan pelarut air yang bersifat sangat polar di antara pelarut lain yang dicobakan. Hal ini sesuai dengan Markham (1988) yang menyatakan bahwa campuran pelarut metanol dan air merupakan pelarut yang baik untuk glikosida flavonoid.
Aktivitas antioksidan berdasarkan kondisi yang dicobakan dapat dilihat pada Gambar 5 dan 6. Secara keseluruhan, aktivitas antioksidan teknik ekstraksi sonikasi memberikan aktivitas antioksidan lebih baik dibandingkan dengan teknik maserasi. Hal ini
(a) (b)
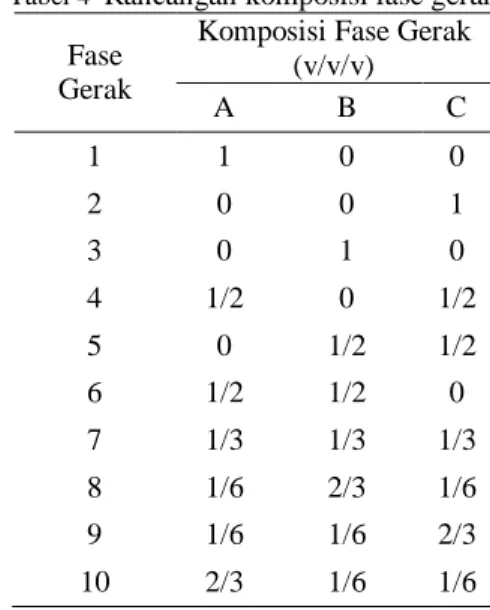
Gambar 8 Plot permukaan respon (a) dan kontur (b) kadar flavonoid pada polaritas pelarut dan waktu ekstraksi.
terlihat dengan nilai IC50 kondisi yang
dicobakan pada teknik sonikasi lebih rendah dibandingkan teknik maserasi. Campuran pelarut metanol dan air dengan proporsi yang semakin sama menunjukkan aktivitas antioksidan yang semakin tinggi. Semakin lama waktu ekstraksi yang digunakan, maka semakin tinggi pula aktivitas antioksidannya. Secara keseluruhan, faktor-faktor yang dicobakan berpengaruh pada aktivitas antioksidan.
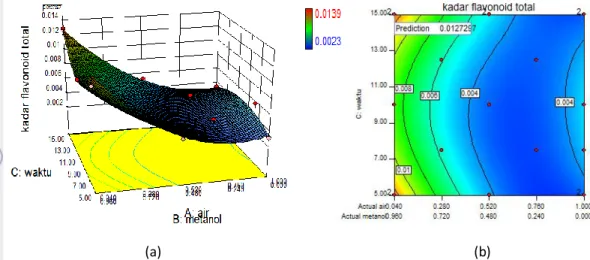
Kondisi Optimum Ekstraksi Flavonoid Faktor kondisi ekstraksi yang akan dioptimumkan berupa teknik ekstraksi, polaritas pelarut, dan waktu ekstraksi. Pengoptimuman dilakukan menggunakan rancangan kombinasi D-Optimal dengan bantuan piranti lunak DX8.0.6 versi uji coba yang akan melihat pengaruh faktor-faktor tersebut terhadap kadar flavonoid total dan aktivitas antioksidan sebagai responnya. Berdasarkan pengolahan data statistik, ekstrak daun salam yang memiliki kadar flavonoid tertinggi dan nilai IC50 terendah adalah
kondisi ekstraksi sonikasi menggunakan pelarut metanol 96% dalam waktu 15 menit (Lampiran 5). Kadar flavonoid dugaan pengolahan tersebut ialah sebesar 0,0125 mg QE/mg ekstrak dan nilai IC50 8,0289 µg/mL.
Pengaruh masing-masing faktor pada nilai respon dapat dijelaskan dengan model dan grafik dari rancangan D-Optimal (Gambar 8 dan 9).
Keberhasilan ekstraksi ditentukan oleh respon kadar flavonoid dan aktivitas antioksidan. Nilai IC50 diperlukan sebagai
respon untuk melihat aktivitas antioksidan dari flavonoid yang berhasil diekstrak dengan berbagai kondisi ekstraksi.
Berdasrkan hasil pengolahan data dengan piranti lunak DX8.0.6 versi uji coba, didapat model regresi sebagai berikut :
Kadar flavonoid = 4,828. X + 8,790. XY – 0,014 XZ – 8,887. YZ + 1,692. XYZ – 1,451. XZ2 + 3,851. YZ2 + 1,036 . XYZ2 IC50 = 30,46 + 36,84 Z – 16,53 Z2 – 37,62 Z3
(X= Air, Y= Metanol, Z= Waktu ekstraksi) Berdasarkan hasil uji statistika terlihat bahwa faktor polaritas pelarut dan waktu ekstraksi berpengaruh secara linear terhadap kadar flavonoid total. Berpengaruhnya faktor-faktor tersebut terhadap kadar flavonoid ditunjukkan dengan model regresi kadar flavonoid memiliki nilai p lebih kecil dari taraf α (0,05), dapat dilihat pada Lampiran 6. Hal ini menunjukkan parameter yang terlibat berpengaruh secara signifikan. Model regresi kadar flavonoid memiliki nilai koefisien determinasi R-Sq yang cukup tinggi yaitu 95,49% sehingga model yang dihasilkan dapat digunakan karena memenuhi syarat model yang baik.
Berdasarkan persamaan model dapat digambarkan plot permukaan respon dan kontur dari model yang diperoleh untuk setiap respon. Gambar 8 menunjukkan bahwa penurunan polaritas pelarut dan peningkatan waktu ekstraksi menghasilkan kadar flavonoid total yang semakin tinggi. Namun, pada polaritas pelarut tersebut terdapat pengaruh keragaman waktu ekstraksi. Plot permukaan