FRAKSIONASI GOLONGAN FLAVONOID DARI DAUN
KEPEL (
Stelechocarpus burahol)
YANG BERPOTENSI
SEBAGAI ANTIBAKTERI
AISYAH HIDAYAT
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
AISYAH HIDAYAT
Fraksionasi Golongan Flavonoid dari Daun Kepel
(Stelechocarpus burahol)
yang Berpotensi sebagai Antibakteri. Dibimbing oleh
LATIFAH KOSIM DARUSMAN
dan
IRMANIDA BATUBARA
.
Penelitian ini bertujuan memisahkan senyawa flavonoid yang terkandung
dalam ekstrak metanol daun kepel yang berpotensi sebagai antibakteri. Bakteri
yang digunakan ialah
Staphylococcus epidermidis yang merupakan bakteri
penyebab bau badan. Ekstrak metanol kepel dipartisi dalam metanol:air (7:3) lalu
dengan
n-heksana dan kloroform. Ekstrak metanol:air (7:3) yang mengandung
flavonoid paling banyak selanjutnya difraksionasi menggunakan kromatografi
kolom silika gel (elusi isokratik dengan butanol:metanol:asam asetat 1:8:1 sebagai
eluen) menghasilkan 7 fraksi. Semua fraksi diuji aktivitas antibakteri dengan
metode
microplate. Fraksi V merupakan fraksi yang paling aktif dengan
konsentrasi hambat minimum (KHM) sebesar 0.06 mg/mL dan konsentrasi bunuh
minimum (KBM) sebesar 0.50 mg/mL. Fraksi V dipisahkan lebih lanjut
menggunakan kromatografi lapis tipis preparatif dan diperoleh 3 fraksi. Fraksi V3
merupakan fraksi yang paling aktif dengan KHM sebesar 1.00 mg/mL dan KBM
2.00 mg/mL. Hasil identifikasi fraksi V3 berdasarkan pendugaan spektrum
ultraviolet-tampak dan inframerah adalah golongan flavon.
ABSTRACT
AISYAH HIDAYAT
Fractionation of Flavonoid Group from Kepel
(Stelechocarpus burahol) Leaves as Antibacterial Agent. Supervised by
LATIFAH KOSIM DARUSMAN
and
IRMANIDA BATUBARA
.
FRAKSIONASI GOLONGAN FLAVONOID DARI DAUN
KEPEL (
Stelechocarpus burahol
) YANG BERPOTENSI
SEBAGAI ANTIBAKTERI
AISYAH HIDAYAT
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Fraksionasi
Golongan
Flavonoid
dari
Daun
Kepel
(Stelechocarpus burahol) yang Berpotensi sebagai Antibakteri
Nama
: Aisyah Hidayat
NIM
: G44062347
Disetujui,
Pembimbing I,
Pembimbing II,
Prof. Dr. Ir. Latifah K Darusman, MS
Dr. Irmanida Batubara, M.Si
NIP 19530824 197603 2 001
NIP 19750807 200501 2 001
Diketahui,
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Penulis memanjatkan puji dan syukur ke hadirat Allah SWT atas limpahan
hidayah dan rahmat-
Nya sehingga karya ilmiah yang berjudul “Fraksi
onasi
Golongan Flavonoid dari Daun Kepel (Stelechocarpus burahol) yang Berpotensi
sebagai Antibakteri” ini dapat diselesaikan. Penelitian ini bert
ujuan memisahkan
senyawa flavonoid yang terkandung dalam ekstrak metanol daun kepel yang
berpotensi sebagai antibakteri. Penelitian dilaksanakan sejak bulan Oktober 2010
sampai April 2011 di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Uji Pusat Studi
Biofarmaka, Institut Pertanian Bogor.
Penulis menyampaikan ucapan terima kasih kepada Prof. Dr. Ir. Latifah K
Darusman, MS dan Dr. Irmanida Batubara, M.Si selaku pembimbing yang selalu
memberi bimbingan, motivasi, saran, dan meluangkan waktunya kepada penulis
selama berkonsultasi. Terima kasih kepada Pusat Studi Biofarmaka yang telah
memberikan fasilitas dan penggunaan peralatan selama penulis melaksanakan
penelitian. Ucapan terima kasih juga penulis sampaikan kepada Umi, Bapak, Kak
Wahyu, Dek Hidir, dan seluruh keluarga yang senantiasa mendoakan, memberi
motivasi, dan kasih sayang yang tiada henti. Tidak lupa penulis ucapkan terima
kasih kepada Om Eman, Bu Nunung, Pak Dede, dan para pegawai di
Laboratorium Kimia Analitik, juga kepada Ibu Nunuk, Mba Wiwi, dan para
pegawai di Pusat Studi Biofarmaka yang telah membantu penulis selama
penelitian. Akhir kata, semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 26 November 1986 dari pasangan
Tarpa Sujana dan Atiah. Penulis merupakan anak kedua dari tiga bersaudara.
Penulis lulus dari SMAN 1 Jonggol pada tahun 2006 dan pada tahun yang sama
penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan
Seleksi Masuk IPB (USMI). Pada tahun 2007, penulis diterima di Departemen
Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR ISI ... vii
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ...
1
TINJAUAN PUSTAKA...
1
Tanaman Kepel (Stelechicarpus burahol) ...
1
Bakteri ...
2
Antibakteri ...
2
Ekstraksi dan Fraksionasi ...
2
Spektrofotometri UV-tampak ...
3
Spektrofotometri IR ...
3
Flavonoid ...
4
BAHAN DAN METODE ...
4
Alat dan Bahan ...
4
Metode ...
4
HASIL DAN PEMBAHASAN ...
6
Kadar Air dan Kadar Abu ...
6
Analisis Hasil Ekstraksi ...
7
Uji Fitokimia ...
7
Penentuan Eluen Terbaik dengan Kromatografi Lapis Tipis (KLT) ...
7
Fraksinasi dengan Kromatografi Kolom ...
8
Aktivitas Antibakteri pada Hasil Fraksionasi ...
8
Analisis Spektrofotometer UV-tampak ...
9
Analisis Spektrofotometer FTIR ...
9
SIMPULAN DAN SARAN ... 10
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Hasil Uji Flavonoid ...
7
2 Hasil Fraksionasi Ekstrak Metanol:Air (7:3)...
8
3 Hasil Uji Aktivitas Antibakteri ...
8
4 Hasil Uji Aktivitas Antibakteri Hasil KLTP ...
9
5 Absorpsi FTIR Gugus-gugus Fungsi Fraksi V3 ...
9
DAFTAR GAMBAR
Halaman
1 Daun Kepel (Stelechocarpus burahol) ...
2
2 Srtuktur Umum Flavonoid ...
4
3 Hasil Fraksionasi Ekstrak Metanol:air dengan Kromatografi Kolom ...
8
4 Struktur Dasar Senyawa Dugaan (Flavon) ...
9
DAFTAR LAMPIRAN
Halaman
1 Bagan Alir Lingkup Kerja Penelitian ... 14
2 Kadar Air Daun Kepel... 15
3 Kadar Abu Daun Kepel ... 15
4 Rendemen Ekstrak Daun Kepel dalam Metanol ... 16
5 Rendemen Hasil Partisi Ekstrak Metanol Daun Kepel ... 16
6 Hasil Penentuan Eluen Terbaik Ekstark Metanol:Air (7:3) ... 17
7 Hasil Fraksionasi Ekstrak Metanol:Air (7:3)... 17
8 Hasil Uji Aktivitas Antibakteri ... 18
9 Hasil Pemisahan dari Fraksi V ... 19
10 Hasil Uji Aktifitas Antibakteri Setelah Pemisahan dengan KLTP ... 20
PENDAHULUAN
Indonesia merupakan negara yang kaya akan sumberdaya hayati. Terdapat sekitar 30000 spesies tumbuhan berbunga di hutan tropika Indonesia. Jumlah tersebut belum termasuk kehidupan lainnya, seperti herba, semak, paku-pakuan, epifit, cendawan, dan jasad renik lainnya. Keanekaragaman hayati yang terhimpun dalam berbagai formasi hutan Indonesia merupakan aset nasional yang tidak terhingga nilainya bagi kepentingan manusia. Salah satu manfaat keanekaragaman hayati adalah kegunaannya sebagai obat. Menurut hasil penelitian Zuhud et al. (2004), telah ditemukan sebanyak 1260 spesies tumbuhan obat yang secara pasti diketahui berasal dari hutan tropika Indonesia.
Salah satu tumbuhan yang dapat dimanfaatkan sebagai obat ialah kepel (Stelechocarpus burahol). Kepel merupakan tumbuhan yang secara tradisional telah digunakan sebagai pewangi khususnya di kalangan keraton. Mengonsumsi buahnya dapat mengurangi bau keringat, bau nafas, dan bau air seni (Heyne 1987; Verheij dan Coronell 1997).
Masalah bau badan dapat dialami oleh setiap orang dan dapat disebabkan oleh beberapa hal, seperti faktor genetik, kondisi kejiwaan, faktor makanan, faktor kegemukan, dan bahan pakaian yang dipakai. Keringat yang dikeluarkan seseorang sangat terlibat dalam proses timbulnya bau badan. Infeksi kelenjar apokrin yang menghasilkan keringatoleh bakteri berperan dalam proses pembusukan. Bakteri yang diduga menjadi penyebab bau badan tersebut diantaranya ialah Staphylococcus epidermidis, Corynebacterium acne, Pseudomonas aeruginosa, dan Streptococcus pyogenes (Endarti & Soediro 2002). Penggunaan antibiotik yang tidak benar biasanya akan membuat bakteri menjadi bersifat resisten dan tetap memperbanyak diri dalam inangnya.
Menurut Bartlett (2007), bakteri S. epidermidis umumnya telah resisten terhadap antibiotik penisilin dan metisilin, sehingga perlu diketahui bahan alternatif yang dapat membasmi atau menghambat pertumbuhan bakteri tersebut. Darusman et al. (komunikasi pribadi 2010) melaporkan bahwa aktivitas flavonoid dari ekstrak daun kepel sebagai antibakteri lebih tinggi daripada tanin. Oleh karena itu, dilakukan penelitian untuk mengetahui senyawa aktif antibakteri pada ekstrak daun kepel dalam menghambat
pertumbuhan bakteri S. epidermidis yang dilakukan secara in vitro.
Penelitian ini bertujuan mengidentifikasi golongan flavonoid yang berpotensi sebagai antibakteri terhadap S. epidermidis dari ekstrak daun kepel (S. burahol) secara in vitro.
TINJAUAN PUSTAKA
Tanaman Kepel (Stelechocarpusburahol)
Tumbuhan kepel atau burahol (Stelechocarpus burahol) adalah pohon penghasil buah hidangan meja yang menjadi flora identitas Daerah Istimewa Yogyakarta. Klasifikasi ilmiah kepel adalah sebagai berikut:
Kingdom : Plantae Subkingdom : Trachebionta Superdivisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Subkelas : Magnoliales Famili : Annonaceae Genus : Stelechocarpus Spesies : Stelechocarpus burahol
(Blume) Hook&Thompson (USDA 2007)
S. burahol merupakan jenis tanaman buah-buahan Indonesia, dengan nama lain kepel, simpel, dan kecindul (Jawa). Tinggi pohon ini dapat mencapai 25 m, batang lurus berwarna cokelat tua, diameter mencapai 40 cm, memiliki benjolan-benjolan bekas keluar bunga dan buah, daun tunggal, elips–lonjong sampai bundar telur–lanset, panjang 12–27 cm dan lebar 5–9 cm.Buah berbentuk bulat, berwarna kecoklatan, diameter 5–6 cm, berbiji empat atau lebih dan berbentuk elip (LIPI 2000). Kepel akan tumbuh baik pada tanah yang subur, drainase yang baik, dan pH 5.8– 6.7 (Solikin 2010).
pertumbuhan kolorektal karsinoma antara lain asetogenin, lakton, dan isoflavon.
Hasil uji fitokimia kepel menunjukkan adanya alkaloid, flavonoid, tanin, dan steroid-triterpenoid (Sunardi 2010). Sebagai anti gout, ekstrak polar daun dan buah kepel memiliki aktivitas penghambatan COX-2 pada
konsentrasi 50 g/mL (Batubara et al. 2010). Rahminiwati et al. (2010) melaporkan bahwa ekstrak daun dan buah kepel tidak memiliki aktivitas antimikroba terhadap Propionibacterium acnes pada konsentrasi 4 mg/mL. Priastini dan Flora (2010) melaporkan bahwa ekstrak buah kepel mengandung antioksidan yang dapat menjaga kualitas sperma kelinci pada penyimpanan selama sembilan hari pada suhu 5 oC.
Gambar 1 Daun Kepel (Stelechocarpus burahol)
Bakteri
Bakteri adalah sel prokariotik yang bersifat khas, uniseluler, dan tidak mengandung struktur yang terbatasi membran di dalam sitoplasmanya. Sel-selnya secara khas, berbentuk bola seperti batang atau spiral. Bakteri berdiameter sekitar 0.5 sampai 1.0 µm dan panjangnya 1.5 sampai 2.5 µm. Kulit secara konstan berhubungan dengan bakteri dari udara atau dari benda-benda. Bakteri kulit dijumpai pada epithelium membentuk koloni pada permukaan sel-sel mati. Kebanyakan bakteri ini adalah spesies Staphylococcus (S. epidermidis dan S. aureus), sianobakteri aerobik, dan difteroid. Jauh di dalam kelenjar lemak dijumpai bakteri-bakteri anaerobik lipofilik seperti Propionibacterium acnes penyebab jerawat (Pelczar & Chan 2007).
S. epidermidis adalah salah satu spesiesbakteri dari genus Staphylococcus. Beberapa karakteristik bakteri ini adalah fakultatif anaerobik, koagulase negatif,
katalase positif, gram positif, berbentuk kokus, berdiameter 0,5–1,5 µm, dan suhu optimum pertumbuhan 35–37 oC (Lisa dan Anne 1998). Secara klinis, bakteri ini menyerang orang-orang yang rentan atau imunitas rendah, seperti penderita AIDS, pasien kritis, pengguna obat terlarang (narkotika), bayi yang baru lahir, dan pasien rumah sakit yang dirawat dalam waktu lama (Jodi 2008).
Antibakteri
Antibakteri adalah senyawa yang dihasilkan oleh mikroorganisme atau tumbuhan yang dalam jumlah tertentu mempunyai daya penghambat terhadap kegiatan mikroorganisme atau tumbuhan lain (Dwidjoseputro 1990). Berdasarkan aktivitasnya, zat antibakteri dibedakan menjadi dua jenis, yaitu bakteriostatik dan bakteriosida. Bakteriostatik adalah zat antibakteri yang memiliki aktivitas menghambat pertumbuhan bakteri namun tidak mematikan. Bakteriosida adalah zat antibakteri yang memiliki aktivitas membunuh bakteri (Madigan et al. 2005;Schunack et al. 1990). Namun ada beberapa zat antibakteri yang bersifat bakteriostatik pada konsentrasi rendah dan bersifat bakterisida pada konsentrasi tinggi (Fardiaz et al. 1987). Berdasarkan efektivitas kerjanya terhadap berbagai macam mikroorganisme, zat antibakteri dikelompokkan menjadi dua kelompok, yaitu antibakteri berspektrum luas yang efektif terhadap berbagai jenis mikroorganisme dan antibakteri berspektrum sempit yang hanya efektif terhadap mikroorganisme tertentu (Pelczar & Chan 2007). Mekanisme kerja dari zat antibakteri diantaranya yaitu menghambat sintesis dinding sel, menghambat keutuhan permeabilitas dinding sel, menghambat kerja enzim, dan menghambat sintesis asam nukleat dan protein. Sebagai contoh antibakteri dengan mekanisme kerja tersebut adalah penisilin, sefalosporin, vankomisin, basitrasin, sikloserin, dan ampisilin (Jawetz et al. 1996).
Ekstraksi dan Fraksionasi
Salah satu prosedur klasik untuk memperoleh kandungan senyawa organik dari jaringan tumbuhan ialah maserasi. Metode maserasi digunakan untuk mengekstraksi sampel yang relatif tidak tahan panas. Metode ini dilakukan hanya dengan merendam sampel dalam suatu pelarut dengan lama waktu tertentu, biasanya selama 24 jam tanpa menggunakan pemanasan. Kelebihan metode maserasi, yaitu sederhana, tidak memerlukan alat-alat yang rumit, relatif murah, serta dapat menghindari kerusakan komponen senyawa yang tidak tahan panas. Kelemahannya diantaranya dari segi waktu yang lama dan penggunaan pelarut yang tidak efisien. Pemilihan pelarut untuk proses maserasi akan memberikan efektivitas yang tinggi dengan memperhatikan kelarutan senyawa bahan alam pada pelarut tersebut (Rohman et al.2006). Efektivitas ekstraksi dipengaruhi oleh beberapa faktor antara lain ukuran partikel bahan yang disari, tekstur bahan atau jaringan simplisia, faktor fisika seperti suhu, tekanan, kelarutan, jenis dan polaritas cairan penyari dan teknik penyaringan yang digunakan (Depkes RI 1986).
Fraksinasi adalah proses pemisahan komponen dalam suatu ekstrak menjadi kelompok-kelompok senyawa yang memiliki kemiripan karakteristik secara kimia (Houghton & Raman 1998). Teknik fraksinasi dapat dilakukan dengan kromatografi kolom, yaitu teknik analisis untuk menentukan jumlah komponen dalam suatu campuran senyawa, dan juga untuk memisahkan dan memurnikan komponen senyawa tertentu dari campurannya. Pemisahan kromatografi kolom ini menggunakan suatu pelarut pengelusi yang dialirkan secara kontinu melalui kolom dan komponen demi komponen dari campuran pada akhirnya keluar dari kolom kemudian dapat dikumpulkan dan difraksinasi (Rouessac & Rouessac 1994).
Kromatografi lapis tipis (KLT) merupakan jenis kromatografi partisi menggunakan sebuah lapis tipis silika atau alumina yang seragam pada sebuah lempeng gelas atau logam yang keras. Fase diam untuk KLT seringkali juga mengandung substansi yang dapat berpendar dalam sinar ultra violet. Fase gerak merupakan pelarut atau campuran pelarut yang sesuai (Harvey 2000). Pergerakan zat relatif terhadap garis depan pelarut dalam sistem kromatografi lapis tipis dapat didefinisikan sebagai nilai Rf, yaitu perbandingan jarak tempuh zat dengan jarak tempuh garis depan pelarut.
Spektrofotometri UV-tampak
Spektroskopi ultraviolet merupakan transisi elektronik yang terjadi pada daerah 200-380 nm sedangkan spektrum tampak
terjadi pada daerah 380−800 nm. Spektrum tampak kurang baik dalam penentuan struktur karena kebanyakan senyawa organik tidak berwarna sedangkan spektrum UV dapat digunakan untuk menentukan struktur dalam suatu larutan. Pelarut yang umum digunakan untuk spektoskopi UV ialah air, etanol 95% dan heksana (Pavia et al. 2001). Pada daerah sinar ultraviolet dan sinar tampak, energi diperoleh dari transisi elektronik. Energi yang diserap oleh molekul digunakan untuk menaikan energi elektron dari keadaan dasar ke tingkat energi yang lebih tinggi. Transisi elektron secara umum terjadi antara orbital ikatan (bonding) dengan orbital anti ikatan (anti-bonding) tak terisi. Penyerapan dari panjang gelombang tersebut kemudian menjadi ukuran dari pemisahan tingkat energi dari orbital-orbital terkait (Wiryawan 2011)
Semua molekul dapat mengabsorpsi radiasi dalam daerah UV-Tampak karena mereka mengandung elektron baik berpasangan maupun menyendiri yang dapat dieksitasikan ke tingkat energi yang lebih tinggi. Panjang gelombang yang diabsorpsi bergantung pada berapa kuat elektron itu terikat dalam molekul (Day & Underwood 2001). Spektrum serapan kandungan tumbuhan dapat diukur dalam larutan yang sangat encer dengan pembanding blanko pelarut serta menggunakan spektrofotometer yang merekam otomatis. Sampel untuk spektrofotometri UV-tampak paling sering dalam bentuk cairan daripada gas atau padatan. Spektrum flavonoid biasanya ditentukan dalam larutan dengan pelarut metanol atau etanol. Spektrum khas terdiri atas dua maksima pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I) (Markham 1988).
Spektrofotometri Infra merah
Spektroskopi inframerah merupakan suatu metode yang mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah panjang gelombang 0.75–1.000 µm atau pada bilangan gelombang 13.000–10 cm-1. Berdasarkan pembagian daerah panjang gelombang sinar infra merah dibagi atas tiga daerah, yaitu daerah infra merah dekat
(0.75−2.5 µm), daerah infra merah
merah jauh (50–1000 µm) (Giwangkara 2007). Spektrofotometer inframerah dibagi menjadi 3 jenis yaitu spektrofotometer Inframerah dispersive (kualitatif), spektrofotometer inframerah tak dispersive (kuantitatif), dan spektrofotometer inframerah transformasi fourier (kualitatif dan kuantitatif).
Spektroskopi FTIR menggunakan prinsip interferometer (Skoog et al. 2004). Spektroskopi FTIR mengukur vibrasi dominan dari gugus fungsi dan ikatan yang memiliki kepolaran yang tinggi (Thor & Jeffery 2005). Prinsip FTIR adalah ketika sampel berinteraksi dengan sinar (radiasi elektromagnetik), maka ikatan kimia pada panjang gelombang tertentu akan menyerap sinar ini dan akan bervibrasi. Vibrasi ini dapat berupa vibrasi tekuk atau vibrsi ulur. Absorbans atau vibrasi ini dihubungkan dengan ikatan tunggal atau gugus fungsi dari molekul untuk identifikasi senyawa yang tidak diketahui (Dunn & David 2005).
Flavonoid
Flavonoid (Gambar 2) merupakan salah satu metabolit sekunder, kemungkinan keberadaannya dalam daun dipengaruhi oleh adanya proses fotosintesis sehingga daun muda belum terlalu banyak mengandung flavonoid (Markham 1988). Lebih dari 2000 flavonoid yang berasal dari tumbuhan telah diidentifikasi, namun ada tiga kelompok yang umum dipelajari, yaitu antosianin, flavonol, dan flavon. Flavonoid sering terdapat di sel epidermis. Sebagian besar flavonoid terhimpun di vakuola sel tumbuhan walaupun tempat sintesisnya ada di luar vakuola (Salisbury & Ross 1995)
Flavonoid berupa senyawa yang larut dalam air dan dapat diekstrak dengan etanol 70% dan tetap ada dalam lapisan air setelah ekstrak ini dikocok dengan eter. Flavonoid berupa senyawa fenol karena itu warnanya berubah bila ditambah basa atau amonia, jadi mereka mudah dideteksi pada kromatogram atau dalam larutan. Flavonoid terdapat dalam semua tumbuhan pembuluh dan dalam bentuk campuran, jarang sekali dijumpai hanya flavonoid tunggal. Penggolongan jenis flavonoid dalam jaringan tumbuhan mula-mula didasarkan kepada telaah sifat kelarutan dan reaksi warna (Harbone 1987).
Menurut Cos et al. (1998), aktivitas flavonoid sebagai penurun kadar asam urat melalui penghambatan enzim xantin oksidase. Selain itu juga bersifat sebagai antioksidan
penangkap radikal superoksida. Hamdiyati et al. (2008) melaporkan bahwa senyawa aktif dari daun patikan kebo yang dapat menghambat pertumbuhan S. epidermidis adalah flavonoid, tanin, alkaloid, dan terpenoid. Sukadana (2009) melaporkan bahwa isolat flavonoid fraksi FB dari ekstrak
kental air buah belimbing manis diduga termasuk golongan katekin yang dapat menghambat bakteri gram positif (S. aureus) dan gram negatif (E. coli), masing-masing mulai dari konsentrasi 500 ppm dan 100 ppm. Isolat flavonoid yang berhasil diisolasi dari kulit akar awar-awar adalah golongan flavanon yang mempunyai aktivitas sebagai antibakteri terhadap Vibrio cholera dan E. coli (Sukadana 2010).
Gambar 2 Struktur Umum Flavonoid
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan yang digunakan adalah serbuk daun kepel, akuades, heksana, etil asetat, kloroform metanol, etil asetat, pelarut DMSO, silika gel, media trypticase soy broth (TSB), bakteri S. epidermidis, tetrasiklin, TCC, dan pelat aluminium jenis silika gel G60F254 dari Merck.
Peralatan yang digunakan adalah peralatan gelas, cawan porselen, oven, eksikator, neraca analitik, penguap putar, bejana kromatografi, kromatografi kolom, autoklaf, inkubator, 96-well plates, spektrofotometer UV-tampak (Shimadzu)
,
dan FTIR (Brucker).Metode
senyawa yang terkandung dalamfraksi teraktif dengan spekrtofotometer UV-tampak dan FTIR.
Identifikasi dan Pengumpulan Sampel
Daun kepel (Stelechocarpus burahol) yang digunakan dalam penelitian ini berasal dari Cilacap pulau Jawa Indonesia. Identifikasi dan spesimen contoh disimpan di Laboratorium Uji Pusat Studi Biofarmaka, Institut Pertanian Bogor.
Penentuan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan pada suhu 105 ºC selama 30 menit lalu didinginkan dalam eksikator dan ditimbang. Sebanyak 3 g contoh daun kepel dimasukkan dalam cawan dan dipanaskan pada suhu 105 ºC selama 3 jam sampai diperoleh bobot konstan, kemudian didinginkan dalam eksikator dan ditimbang. Penetapan kadar air ini dilakukan berdasarkan penentuan jumlah bobot kering contoh. Penentuan kadar air dilakukan sebanyak tiga kali ulangan (triplo).
Kadar air (%) = 100% A
B A
Keterangan:
A = bobot contoh sebelum dikeringkan (g) B = bobot contoh setelah dikeringkan (g)
Penentuan Kadar Abu (AOAC 2006)
Cawan porselin dikeringkan di dalam tanur listrik bersuhu 600 °C selama 30 menit. Selanjutnya cawan didinginkan dalam eksikator selama 30 menit, kemudian ditimbang bobot kosongnya. Sebanyak 1 g contoh dimasukkan ke dalam cawan, kemudian dipijarkan di atas nyala api pembakar bunsen sampai tidak berasap lagi. Setelah itu, dimasukkan ke dalam tanur listrik dengan suhu 600 °C sampai contoh menjadi abu. Setelah abu berwarna putih, cawan yang berisi abu diangkat dari dalam tanur dan didinginkan dalam eksikator, lalu ditimbang. Penentuan kadar abu dilakukan sebanyak tiga kali ulangan (triplo).
Kadar abu (%) = 100% A
B
Keterangan:
A = bobot contoh (g) B = bobot abu (g)
Ekstraksi (Sukadana 2009)
Serbuk daun kepel dimaserasi dengan metanol sebanyak 3 kali selama 24 jam. Ekstraksi dilakukan dengan perbandingan 1 g serbuk daun kepel : 10 mL metanol. Ekstrak metanol yang diperoleh dipekatkan dengan penguap putar vakum pada suhu 60 °C sampai diperoleh ekstrak kental metanol. Ekstrak kental metanol disuspensikan kedalam campuran pelarut metanol:air (7:3) kemudian dipartisi dengan n-heksana 25 mL. Ekstrak n-heksana yang diperoleh diuapkan sampai kental, sedangkan bagian metanol:air dipartisi dengan 25 mL kloroform sehingga didapat ekstrak metanol:air dan ekstrak kloroform yang selanjutnya masing-masing ekstrak tersebut diuapkan sehingga diperoleh ekstrak kental metanol:air dan ekstrak kental kloroform. Masing-masing ekstrak kental yang diperoleh (ekstrak kental n-heksana, ekstrak kental kloroform dan ekstrak kental metanol:air) dilakukan uji fitokimia flavonoid. Ekstrak yang positif flavonoid dilanjutkan untuk dipisahkan dan dimurnikan dengan teknik kromatografi kolom.
Uji Fitokimia (Harborne 1987)
Uji Flavonoid. Sebanyak 0.1 g ekstrak daun kepel yang diperoleh ditambahkan 10 mL air panas kemudian dididihkan selama 5 menit dan disaring. Sebanyak 10 mL filtrat ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat-kuat. Uji positif ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Pemilihan Eluen Terbaik(Houghton & Raman 1998)
Pelat kromatografi lapis tipis (KLT) yang digunakan adalah pelat alumunium jenis silika gel G60F254 dari Merck. Ekstrak daun kepel
tersebut dicampurkan dengan perbandingan mengikuti metode konstruksi segitiga.
Fraksionasi
Fraksionasi dilakukan dengan pengemasan kolom sebanyak 15 g silika gel untuk memisahkan 1.5 g ekstrak dengan diameter kolom 1 cm dan tinggi kolom 30 cm. Ekstrak daun kepel yang paling banyak mengandung flavonoid dilarutkan dalam metanol:air (7:3). Komponen-komponennya kemudian dipisahkan menggunakan kolom kromatografi dengan elusi isokratik. Eluat ditampung setiap 5 mL dalam tabung reaksi yang telah diberi nomor kemudian diuji dengan KLT. Noda pemisahan dideteksi di bawah lampu UV pada panjang gelombang 254 nm dan 366 nm. Eluat yang memiliki nilai Rf dan pola KLT yang sama digabungkan sebagai satu fraksi. Semua fraksi yang diperoleh, diuji aktivitas antibakterinya. Fraksi yang memiliki aktivitas antibakteri paling tinggi dipisahkan lebih lanjut menggunakan kromatografi lapis tipis preparatif sehingga diperoleh fraksi traktif yang memiliki noda tunggal.
Pendugaan Senyawa dengan
spektrofotometer UV-tampak
Sebanyak 1 mg fraksi teraktif dilarutkan dengan metanol, lalu dimasukkan ke dalam labu takar 50 mL dan ditera dengan akuades. Setelah itu, larutan dimasukkan kedalam kuvet dan ditempatkan ke dalam tempat sampel pada alat spektrofometer UV-tampak untuk dianalisis.
Pendugaan Senyawa dengan FTIR
Sedikit fraksi teraktif (kira-kira 1−2 mg) ditambahkan bubuk KBr murni (kira-kira 200 mg) kemudian diaduk hingga rata. Campuran ditempatkan dalam cetakan dan ditekan dengan menggunakan alat penekan mekanik. Tekanan ini dipertahankan beberapa menit, kemudian sampel (pelet KBr yang terbentuk) diambil dan ditempatkan dalam tempat sampel pada alat spektrofotometer FTIR untuk dianalisis.
Uji Aktivitas Antibakteri (Batubara et al
2009)
Organisme yang digunakan dalam penelitian ini adalah Staphylococcus epidermidis. Media yang digunakan trypticase soy broth (TSB). Sebanyak 100 µL medium steril, 40 µL sampel dilarutkan dalam DMSO 20% atau kontrol dan 5 µL inokulum bakteri dimasukkan ke dalam masing-masing sumur (96-well plate). Inokulum telah disiapkan
pada konsentrasi 10-2 CFU/mL. S. epidermidis diinkubasi dalam media selama 48 jam pada suhu 37 oC. Konsentrasi ekstrak yang tidak menunjukkan pertumbuhan bakteri (bening) secara visual dideskripsikan sebagai konsentrasi hambat minimum (KHM).
Sebanyak 100 µL dari media yang tidak menunjukkan pertumbuhan bakteri diinokulasikan pada 100 µL media baru. Kemudian diinkubasi selama 48 jam pada suhu 37 oC. Konsentrasi yang tidak menunjukkan pertumbuhan bakteri setelah inokulasi kedua dideskripsikan sebagai konsentrasi bunuh minimum (KBM). Kontrol negatif yang digunakan adalah DMSO dan kontrol positifnya adalah tetrasiklin dan TCC.
HASIL DAN PEMBAHASAN
Kadar air dan Kadar Abu
Kadar air ditentukan untuk mengidentifikasi banyaknya air yang terkandung dalam sampel sebagai persen bahan kering. Selain itu, penentuan kadar air berfungsi mengetahui masa simpan serbuk kering sampel dan sebagai salah satu syarat bahan baku herbal (Depkes RI 1995). Suatu sampel dikatakan baik dan dapat disimpan dalam jangka waktu yang lama apabila memiliki kadar air <10%, karena pada tingkat kadar air tersebut sampel dapat terhindar dari pertumbuhan jamur yang cepat (Soetarno & Soediro 1997). Air yang terkandung dalam serbuk daun kepel dihilangkan dengan pemanasan pada suhu 105 oC. Menurut Harjadi (1993), air yang terikat secara fisik dapat dihilangkan dengan pemanasan pada
suhu 100−105 oC. Pada penelitian ini, kadar air serbuk daun kepel diperoleh sebesar 12.79%(b/b) (Lampiran 2). Kadar air tersebut lebih dari 10%, sehingga tidak memenuhi standar mutu MMI (1995). Kadar air dalam suatu sampel dapat dipengaruhi oleh kelembapan udara, cara penyimpanan, dan lama pengeringan.
Analisis Hasil Ekstraksi
Cara ekstraksi yang digunakan mengacu pada metode Sukadana (2009). Metode ini dilakukan dengan metanol sebagai pelarut, mengacu pada sifat polar metanol dalam mengekstraksi senyawa flavonoid. Umumnya, flavonoid larut dalam pelarut polar seperti etanol, metanol, n-butanol, aseton, dimetil sulfoksida, dimetil formamida, dan air. Adanya gula yang terikat pada flavonoid cenderung menyebabkan flavonoid lebih mudah larut dalam air (Markham 1998). Proses maserasi sangat menguntungkan dalam isolasi senyawa bahan alam karena dengan perendaman akan terjadi pemecahan dinding dan membran sel. Hal tersebut terjadi akibat perbedaan tekanan antara di dalam dan di luar sel, sehingga metabolit sekunder yang ada dalam sitoplasma akan terlarut dalam pelarut. Ekstraksi senyawa akan sempurna, karena lama perendaman yang dilakukan dapat diatur. Pada penelitian ini, perendaman dilakukan selama 3 kali 24 jam. Bobot serbuk daun yang dimaserasi sebanyak 100.0368 g. Maserat dan residu dipisahkan dengan penyaringan kemudian maserat dipekatkan dengan penguap putar. Rendemen ekstrak daun diperoleh sebesar 15.15%(b/b) (Lampiran 4).
Ekstrak metanol daun kemudian dilarutkan dalam metanol:air (7:3) dan diekstraksi cair-cair menggunakan n-heksana dan kloroform. Prinsip dasar ekstraksi cair-cair ialah proses kontak antara pelarut yang satu dan yang lainnya yang tidak saling bercampur dan memiliki densitas yang berbeda sehingga akan terbentuk 2 fase beberapa saat setelah penambahan dan pengocokan pelarut dalam corong pisah. Hal ini menyebabkan terjadinya perpindahan massa dari pelarut asal ke pelarut pengekstraksi (Mirwan & Ariono 2009). Komponen polar akan terdistribusi pada metanol:air, komponen semipolar akan terdistribusi pada kloroform, dan komponen nonpolar akan terdistribusi pada n-heksana. Komponen yang terdistribusi pada n-heksana dan kloroform diantaranya lemak, terpena, klorofil, dan xantofil (Markham 1988).
Bobot ekstrak metanol daun yang digunakan untuk ekstraksi cair-cair adalah 3.0079 g. Ekstrak hasil partisi kemudian dipekatkan dengan penguap putar. Rendemen ekstrak n-heksana, kloroform, dan metanol:air yang diperoleh dari ekstrak daun berturut-turut sebesar 31.98, 11.81, dan 27.82%(b/b) (Lampiran 5). Rendemen ekstrak n-heksana lebih tinggi dibandingkan dengan yang
lainnya menunjukkan dalam daun kepel banyak terdapat komponen nonpolar.
Uji Fitokimia
Uji fitokimia merupakan uji kualitatif yang digunakan untuk mengetahui kandungan senyawa metabolit sekunder dalam sampel. Dalam penelitian ini, uji fitokimia dilakukan terhadap ekstrak n-heksana, kloroform, dan metanol:air (7:3). Uji fitokimia hanya dilakukan untuk golongan flavonoid. Ekstrak daun yang memiliki kandungan flavonoid terbanyak akan dilanjutkan untuk fraksionasi. Dari hasil uji fitokimia, ekstrak metanol:air memiliki kandungan flavonoid terbanyak (Tabel 1). Hal ini ditunjukkan dengan adanya intensitas warna jingga yang lebih kuat dibandingkan dengan ekstrak kloroform. Ekstrak n-heksana tidak menunjukkan warna kuning, merah atau jingga pada lapisan amil alkohol, artinya ekstrak tersebut tidak mengandung flavonoid.
Tabel 1 Hasil uji flavonoid
Penentuan Eluen Terbaik dengan Kromatografi Lapis Tipis (KLT)
Ekstrak metanol:air daun kepel dianalisis dengan KLT menggunakan fase diam gel silika G60F254 dari Merck untuk menentukan
komposisi eluen terbaik yang akan digunakan untuk fraksionasi menggunakan kromatografi kolom. Pelarut yang digunakan sebagai eluen adalah n-heksana, kloroform, etil asetat, aseton, n-butanol, metanol, dan asam asetat. Profil kromatogram ekstrak metanol:air daun kepel setelah dielusi dengan berbagai eluen tunggal diamati di bawah lampu UV pada 254 dan 366 nm. Beberapa eluen menghasilkan noda yang kurang terpisah sehingga dilakukan penggabungan eluen dengan berbagai komposisi (Lampiran 6).
Dari hasil penggabungan tersebut diperoleh bahwa eluen yang terbaik untuk pemisahan adalah n-butanol:metanol:asam asetat (1:8:1), karena menghasilkan noda terbanyak dan pemisahannya cukup baik dibandingkan dengan eluen lainnya. Menurut Skoog et al. (2004), eluen terbaik adalah yang
Ekstrak Hasil Uji
n-heksana −
Kloroform +
menghasilkan jumlah noda terbanyak dan terpisah. Hasil analisis KLT ini kemudian dijadikan eluen pada proses fraksionasi dan analisis fraksi hasil pemisahan ekstrak metanol:air (7:3) daun kepel menggunakan kromatografi kolom.
Fraksionasi dengan Kromatografi Kolom
Prinsip fraksionasi dengan kromatografi kolom didasarkan pada interaksi komponen-komponen yang dipisahkan terhadap fase diam dan fase gerak secara adsorpsi (Harvey 2000). Ekstrak metanol:air (7:3) dipisahkan komponennya menggunakan kromatografi kolom. Pemisahan dilakukan dengan elusi isokratik menggunakan eluen terbaik yang didapat dari tahap analisis KLT, yaitu n -butanol:metanol:asam asetat (1:8:1). Elusi menggunakan eluen terbaik ini diharapkan dapat memisahkan komponen-komponen ekstrak dengan baik.
Fraksi-fraksi yang terpisah dan keluar dari kolom ditampung setiap 5 mL pada tabung reaksi. Hasil fraksionasi ditampung ke dalam 34 tabung reaksi dan diperoleh 7 fraksi dengan pola seperti pada Gambar 3. Masing-masing fraksi menunjukkan komponen yang berbeda yang ditunjukkan oleh perbedaan nilai Rf yang berbeda pula (Tabel 2). Rendemen dari masing-masing fraksi yang diperoleh secara lengkap ada pada Lampiran 7.
Tabel 2 Hasil fraksionasi ekstrak metanol:air (7:3)
Aktivitas Antibakteri pada Hasil Fraksionasi
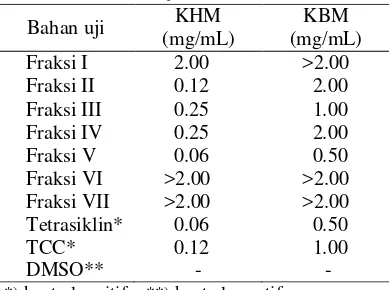
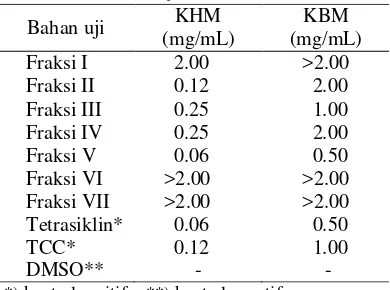
Semua fraksi dari hasil pemisahan dengan kromatografi kolom diuji aktivitas antibakterinya menggunakan metode microplate. Berdasarkan hasil pengujian, Fraksi V merupakan fraksi teraktif dengan konsentrasi hambat minimum (KHM) sebesar 0.06 mg/mL dan konsentrasi bunuh minimum (KBM) sebesar 0.50 mg/mL (Tabel 3). Adanya penghambatan ditandai dengan beningnya media secara visual pada konsentrasi tertentu dibandingkan dengan kontrol negatif dan kontrol positif, begitu pula dengan penentuan KBM (Lampiran 8). KHM dan KBM fraksi V sama dengan tetrasiklin artinya aktivitas Fraksi V sama dengan aktivitas tetrasiklin. Apabila dibandingkan dengan TCC, Fraksi V memiliki aktivitas lebih tinggi dari TCC. Tetrasiklin dan TCC merupakan kelompok antiinfeksi berspektrum luas yang biasa digunakan secara komersial dalam sabun, sampo, deodoran, dan produk rumah tangga lainnya (Richardson 2010).
Tabel 3 Hasil uji aktivitas antibakteri
*) kontrol positif **) kontrol negatif
No Fraksi
Jumlah
Noda Nilai Rf I 2 0.78; 0.91 II 2 0.86; 0.94 III 4 0.66; 0.75; 0.84; 0.91 IV 4 0.54; 0.69; 0.76; 0.88
V 3 0.35; 0.59; 0.74 VI 1 0.35
VII 1 0.08 Bahan uji
KHM (mg/mL)
KBM (mg/mL) Fraksi I 2.00 >2.00 Fraksi II 0.12 2.00 Fraksi III 0.25 1.00 Fraksi IV 0.25 2.00 Fraksi V 0.06 0.50 Fraksi VI Fraksi VII Tetrasiklin* TCC* DMSO** >2.00 >2.00 0.06 0.12 - >2.00 >2.00 0.50 1.00 - Gambar 3 Hasil fraksionasi ekstrak metanol:air
Fraksi V sebagai fraksi teraktif merupakan campuran (3 noda), sehingga dipisahkan lebih lanjut dengan menggunakan KLTP. Pemisahan dengan KLTP menggunakan eluen n-butanol:asam asetat:air (4:1:5) sebagai eluen terbaik untuk memisahkan golongan flavonoid (Markham 1988). Berdasarkan pemisahan yang dilakukan diperoleh 3 fraksi (Lampiran 9). Semua fraksi hasil KLTP diuji aktivitas antibakterinya. Berdasarkan hasil pengujian, fraksi V3 merupakan fraksi yang paling aktif dibandingkan dengan fraksi lainnya dengan KHM sebesar 1.00 mg/mL dan KBM 2.00 mg/mL (Tabel 4). KHM dan KBM fraksi V3 lebih tinggi dari tetrasiklin dan TCC, artinya Fraksi V3 memiliki aktivitas lebih rendah daripada tetrasiklin dan TCC. Aktivitas Fraksi V lebih tinggi daripada fraksi V3 (hasil KLTP), hal ini diduga masih ada beberapa senyawa yang bercampur dalam Fraksi V yang berpotensi sebagai antibakteri. Penurunan aktivitas juga dapat disebabkan oleh hasil pemisahan yang kurang terpisah saat menggunakan eluen n-butanol:asam aetat:air (4:1:5).
KHM ekstrak daun kepel terhadap S. epidermidis berbeda dengan hasil penelitian Hamdiyati et al. (2008) yang memperoleh KHM sebesar 20 mg/mL dengan sampel daun patikan kebo, artinya konsentrasi zat aktif yang diperoleh dari daun patikan kebo terhadap S. epidermidis lebih tinggi daripada daun kepel. Nilai KHM dan KBM berbanding terbalik dengan aktivitas. Semakin tinggi nilai KHM dan KBM yang diperoleh dari suatu sampel maka semakin kecil aktivitas dari sampel tersebut.
Tabel 4 Hasil uji aktivitas antibakteri hasil KLTP
*) kontrol positif **) kontrol negatif
Analisis Spektrofotometer UV-tampak
Fraksi V3 (Fraksi teraktif) yang diperoleh dari hasil KLTP dianalisis dengan menggunakan spektrofometer UV-tampak. Pemayaran dilakukan dengan perubahan panjang gelombang 2 nm. Hasil analisis UV-tampak Fraksi V3 memiliki panjang
gelombang maksimum 327 nm. Hasil tersebut
menunjukkan terjadinya transisi π→π* dan n→π* yang dihasilkan dari kromofor C=C
terkonjugasi dan C=O. Senyawa yang
mempunyai transisi π→π* dan n→π* akan
mengabsorpsi cahaya di daerah UV pada panjang gelombang 200-400 nm (Creswell et al. 2005). Menurut Markham (1988), kisaran panjang gelombang maksimum 310−350 nm merupakan flavonoid golongan flavon. Spektrum UV-tampak fraksi V3 dapat dilihat pada Lampiran 11.
Analisis Spektrofotometer FTIR
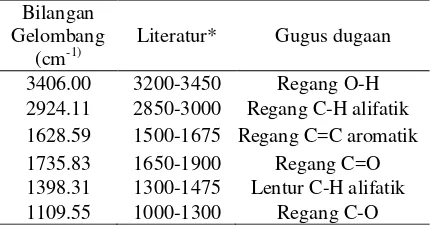
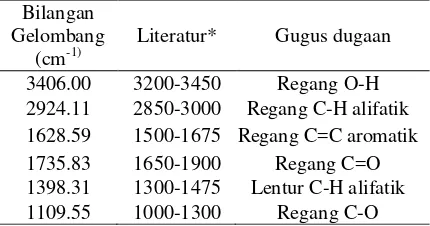
Berdasarkan spektrum FTIR fraksi V3 kemungkinan mengandung beberapa gugus fungsi seperti –OH (3406.00 cm-1) yang didukung juga oleh munculnya serapan pada daerah bilangan gelombang 1109.55 cm-1 untuk ikatan C-O. Regang C-H alifatik muncul pada 2924.11 cm-1 dan diperkuat dengan munculnya serapan lentur pada daerah bilangan gelombang 1398.31cm-1. Gugus dari ikatan C=C aromatik ditunjukkan dengan munculnya serapan pada daerah bilangan gelombang 1628.59 cm-1 dan terdapat regang C=O pada daerah 1735.83 cm-1. Berdasarkan dugaan gugus fungsi yang diperoleh maka diduga bahwa dalam Fraksi V3 mengandung senyawa flavon. Spektrum FTIR Fraksi V3 dapat dilihat pada Tabel 5 dan Lampiran 11.
Tabel 5 Absorpsi FTIR gugus-gugus fungsi Fraksi V3
*) Sumber: Creswell et al 2005 and Field et al 2002
Gambar 4 Struktur dasar senyawa dugaan (flavon)
Bahan uji KHM (mg/mL)
KBM (mg/mL) Fraksi V1 2.00 >2.00 Fraksi V2 2.00 >2.00 Fraksi V3 Tetrasiklin* TCC* DMSO** 1.00 0.50 0.50 - 2.00 0.50 1.00 - Bilangan Gelombang (cm-1)
Literatur* Gugus dugaan
SIMPULAN DAN SARAN
Simpulan
Kadar air serbuk daun kepel adalah 12.79% dan kadarabunya sebesar 11.44%(b/b). Kadar air daun kepel yang digunakan tidak memenuhi standar MMI, sedangkan kadar abunya memenuhi. Pencarian eluen terbaik dengan menggunakan KLT diperoleh n-butanol:metanol:asam asetat (1:8:1) sebagai eluen terbaiknya dengan 6 noda terpisah. Fraksionasi ekstrak metanol:air (7:3) daun kepel dengan elusi isokratik menggunakan kromatografi kolom menghasilkan 7 fraksi. Fraksi V3 merupakan fraksi teraktif dengan KHM sebesar 1.00 mg/mL dan KBM 2.00 mg/mL. Hasil identifikasi UV-tampak dan FTIR diduga bahwa senyawa aktif sebagai antibakteri dari daun kepel adalah kelompok flavon.
Saran
Perlu dilakukan identifikasi menggunakan UV-tampak dengan pereaksi geser untuk mengetahui perubahan pola hidroksilasinya dan perlu dilakukan pemurnian lebih lanjut agar didapatkan senyawa murni.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of Analysis. Ed ke-14. Arlington: Association of Official Analytical Chemist.
Bartlett JG. 2007. Staphylococcus epidermidis [terhubung berkala]. http://prod.hopkins_abxguide.org/pathoge ns/bacteria/aerobicgrampositivecocci/stap hylococcusepidermidis.html[8 Jul 2010].
Batubara I, T Mitsunaga, H Ohashi. 2009. Screening Antiacne Potency of Indonesia Medicinal Plant: antibacterial, Lipase inhibitor and antioxidant activities. J Wood Sci 55:230-235.
Batubara I, L.K Darusman, E Djauhari, & T Mitsunaga. 2010. Potency of Kepel (Stelechocarpus Burahol) as Cyclooxygenase-2 Inhibitor. Proceeding of International Conference on Medicinal
Plant. Surabaya 21-21 July 2010. Surabaya Indonesia.
Cos P, Ying L, Calomme M, Hu J.P, Cimanga K, Poel B.V, Pieters L, Vlietinck, A.J, and Berghe D.V. 1998. Structure-Activity Relationship and Classification of Flavonoids as Inhibitors of Xanthine Oxidase and Superoxide Scavengers, J.Nat. Prod., 61 : 71-76.
Creswell CJ, Olaf AR dan Malcolm MC. 2005. Analisis Spektrum Senyawa Organik Edisi ke 3. Bandung: ITB.
Day RA, AL Underwood. 2001. Analisis Kimia Kuantitatif Ed VI. Alih bahasa Iis Sopyan, Editor Hilarius Wibi&Lameda Simarmata. Jakarta: Erlangga.
[Depkes RI] Departemen Kesehatan Republik Indonesia. 1986.Sediaan Galenik. Jakarta: Depkes RI.
[Depkes RI] Departemen Kesehatan Republik Indonesi. 1995. Materia Medika Indonesia Jilid IV. Jakarta: Depkes RI.
Dunn WB, David IE. 2005. Metabolomics: current analytical flatforms and methodologies. Trends in analytical chemistry 24:285-294.
Dwidjoseputro. 1990. Dasar-Dasar Mikrobiologi. Ed ke-2. Jakarta: Djambatan.
Endarti YE, Soediro I. 2002. Kajian Aktivitas Asam Usnat terhadap Bakteri Penyebab Bau Badan [terhubung berkala]. http://bahan-alam.fa.itb.ac.id [8 Jul 2010].
Fardiaz S, Suliantri, Dewanti R. 1987. Senyawa Antimikrob. Bogor: PAU.
Field L.D, S. Sternhell and J.R.Kalman. 2002. Organic Structures From Spectra Third Edition. England: John Wiley&Sons Ltd.
Giwangkara. 2007. Spektrofotometri Infra Merah. [terhubung Berkala]. http://www.chemisty.org. [17 April 2010].
Pertumbuhan Bakteri Staphylococcus epidermidis. Jurnal Pengajaran MIPA. 12(2):1412-0917.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan Ed ke-2. Bandung: ITB.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia Pustaka Utama.
Harvey D. 2000. Modern Analytical Chemistry. New York: McGraw-Hill.
Heyne K. 1987. Tumbuhan Berguna Indonesia Jilid II. Jakarta: Badan Litbang Kehutanan.
Houghton PJ, Raman A. 1998. Laboratory handbook for the Fractionation of Natural Ekstract. London: Chapman & Hall.
Jawetz E, Melnick JL, Adelberg EA. 1996. Mikrobiologi Kedokteran. Ed ke-20. Penerjemah: Nugroho E, Maulany RF,. Jakarta : Buku Kedokteran EGC.
Jodi A. L. 2008. Staphylococcus: molecular genetics. Caister Academic Press.
[LIPI] Lembaga Ilmu Pengetahuan Indonesia. 2000. Tanaman Buah Kebun Raya Bogor. Seri Koleksi Kebun Raya. LIPI 1:70-71.
Lisa A.S dan Anne T. 1998. Essentials of diagnostic microbiology. Delmar Cengage Learning
Madigan MT, Martinko JM, Dunlap PV, Clark DP. 2005. Biology of Microorganisms 12th edition. San Francisco: Pearson.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung: ITB. Terjemahan dari: Techniques of Flavonoid of Identification.
Mirwan A, Ariono D. 2009. Dinamika Tetes Ekstraksi Cair-cair dalam Kolom Isian dan Tanpa isian. Prosiding Seminar Nasional Teknik Kimia Indonesia. Bandung.
Pavia DL, Gary ML, George SK. 2001. Intoduction to Spectroscopy. Washington: Washington University.
Pelzhar Michael J dan Chan E.S.C. 2007. Dasar-Dasar Mikrobiologi. Jakarta: UI-Press.
Priastini R, Flora R. 2010. Effect of Additional Antioxidant of Fruit Extract of Kepel (Stelechocarpus Burahol) in Semen Diluent to the Quality of Rex
Rabbit’s Spermatozoa. Proceeding of International Conference on Medicinal Plant. Surabaya 21-21 July 2010. Surabaya Indonesia.
Rahminiwati M, I Batubara, S Sa’diah, L K Darusman dan T Mitsunaga. 2010. Anti-acne Potency of Kepel (Stelechocarpus Burahol)’s Leaf and Fruit. Proceeding of International Conference on Medicinal Plant. Surabaya 21-21 July 2010. Surabaya Indonesia.
Rohman A, Riyanto S, Utari D. 2006. Aktivitas antioksidan, kandungan fenolik total dan kandungan flavonoid total ekstrak etil asetat buah mengkudu serta fraksi-fraksinya. Majalah farmasi Indo-nesia 17: 136-142.
Rouessac F, Rouessac A. 1994. Chemical Analysis Modren Instrumentation Methods and Techniques 2nd. USA: John Wiley & Sons, Ltd
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan, Jilid 2. penerjemah: Lukman DR, Sumaryono. Bandung: ITB.
Schunack W, Mayer K, Haake M. 1990. Senyawa Obat Ed ke-2. Penerjemah: Wattimenna JR, Subito,. Yogyakarta: UGM Press.
Shiddiqi T, Yuyun R, Nuraini SW. 2008. Potensi In Vitro Zat Sitotoksik Antikanker Daun Tanaman Kepel (Stelechocarpus burahol) Terhadap Carcinoma Colorectal. Karya Ilmiah, Fakultas Kedokteran, Universitas Sebelas Maret. Surakarta.
Soetarno S, Soediro LS. 1997. Standardisasi Mutu Simplisia dan Ekstrak Bahan Obat Tradisional. Presidium Temu Ilmiah Nasional Bidang Frmasi.
Solikin. 2010. Ecology of Kepel (Stelechocarpus Burahol (Blume) Hook.F.&Thomsom) in Purwodadi Botanical Garden. . Proceeding of International Conference on Medicinal Plant. Surabaya 21-21 July 2010. Surabaya Indonesia.
Sukadana IM. 2009. Senyawa antibakteri golongan flavonoid dari buah belimbing manis (Averrhoa carambola Linn.L). Jurnal Kimia 3(2):109-116.
Sukadana I.M. 2010. Aktivitas antibakteri senyawa flavonoid dari kulit awar-awar (Ficus septica Burm F). Jurnal Kimia 4(1):63-70.
Sunardi C. 2010. Several Standard Parameter and Phytochemical Screening of Stelechocarpus Burahol Hook F. & Thomson Stem Bark. Proceeding of International Conference on Medicinal Plant. Surabaya 21-21 July 2010. Surabaya Indonesia.
Sunarni T, Suwidjiyo P dan Ratna A.2007. Flavonoid antioksidan penangkap radikal dari daun kepel (Stelechocarpus burahol (Bl.) Hook f. & Th.). Majalah Farmasi Indonesia 18(3): 111-116.
Sutomo. 2003. Penurunan asam urat darah ayam jantan Braille hiperurisemia oleh fraksi ekstrak metanol daun kepel (Stelechocarpus burahol, Hook f. & Th.), Tesis, Pasca Sarjana, Prodi Ilmu Farmasi, Universitas Gadjah Mada, Yogyakarta.
Thor G, Jefferi T. 2005. solving drug discovery with metabolomic and
metabonomicsμ new asfecs of the “omic”
revolution. D&MDpulication 4:1-4
Tisnadjaja D, Erward S, Silvia, Partomuan S. 2006. Pengkajian burahol (Stelechocarpus burahol (Blume) Hook & Thomson) sebagai buah yang memiliki kandungan senyawa antioksidan. Biodiversitas 7(2):199-202.
[USDA] United States Departement of Agricuture. 2007. Stelechocarpus
Burahol [terhubung bekala] http://www.usda.com[28 Jun 2010].
Verheij EWM,Coronel RE. 1997. Sumber Daya Nabati Asia Tenggara 2. Buah-buahan yang dapat Dimakan. Bogor: Prosea.
Wiryawan A. 2011. Abrorpsi Radiasi Oleh Molekul. [terhubung berkala] http://www.chem-is-try.org/ materi_ kimia/ instrumen_analisis/ spektrum_serapan_ultraviolet_ tampak. [23 Juni 2011].
Lampiran 1 Bagan alir lingkup kerja penelitian
Identifikasi senyawa dengan FTIR&UV-tampak
Uji aktivitas antibakteri Fraksi 2 Fraksi 3 Fraksi ke-n
Pemisahan dengan KLTP diuapkan
Ekstrak kental n-heksana
Fraksi 1
Fraksi Teraktif
Uji aktivitas antibakteri
Kromatografi kolom dengan eluen terbaik Uji flavonoid
Ekstrak terbanyak dan (+) flavonoid
Fraksi ke-n Fraksi I Fraksi II Fraksi III
diuapkan
Partisi dengan kloroform
Lapisan metanol:air Lapisan kloroform
Ekstrak kental kloroform Ekstrak kental metanol:air
Ditambah metanol:air (7:3) Partisi dengan n-heksana
Penentuan kadar air dan kadar abu Maserasi dengan metanol
Serbuk daun kepel
Ekstrak kental metanol
Lapisan n-heksana Lapisan metanol:air
Fraksi Teraktif
Lampiran 2 Kadar air daun kepel
Bobot daun kering = (bobot cawan + daun kering)
–
(bobot cawan kosong)
= 23.7351
–
21.1197
= 2. 6154 g
Kadar air (%) =
100% AB A
=
100
%
0007
.
3
6154
.
2
0007
.
3
= 12.8403 %(b/b)
Keterangan:
A adalah bobot daun sebelum dikeringkan (g)
B adalah bobot daun setelah dikeringkan (g)
Lampiran 3 Kadar abu daun kepel
Bobot abu = (bobot cawan + abu)
–
(bobot cawan kosong)
= 21.2296
–
21.1123
= 0.1173 g
Kadar abu (%) =
100% AB
=
100
%
0091
.
1
1173
.
0
= 11.6242 %(b/b)
Keterangan:
A adalah bobot daun
B adalah bobot abu
Ulangan
Bobot (g)
Kadar air (% b/b) Cawan
kosong Daun awal
Cawan + daun kering
Daun kering
1 21.1197 3.0007 23.7351 2.6154 12.8403 2 17.7810 3.0003 20.3942 2.6132 12.9020 3 16.4787 3.0009 19.1003 2.6216 12.6395
Rerata 12.7940
Ulangan
Bobot (g)
Kadar abu (% b/b) Cawan
kosong Daun awal Cawan + abu Abu
1 21.1123 1.0091 21.2296 0.1173 11.6242 2 21.1996 1.0044 21.3136 0.1140 11.3501 3 18.7107 1.0024 18.8244 0.1137 11.3428
Lampiran 4 Rendemen ekstrak daun kepel dalam metanol
Faktor koreksi = 100 + kadar air
100
= 100 + 12.79
100
= 1.1279
Rendemen (% b/b kering)
= Bobot ekstrak x faktor koreksi x 100%
Bobot contoh awal
= 14.4579 x 1.1279 x 100%
100.0071
= 16.3059% (b/b kering)
Lampiran 5 Rendemen hasil partisi ekstrak metanol daun kepel
Ulangan Bobot Ekstrak Kasar (g) Pelarut
Bobot Ekstrak
Partisi (g) Rendemen (%b/b) n-heksana 0.9777 32.4925 1 3.0090 Kloroform 0.2462 8.1821
Metanol:Air (7:3) 0.3587 11.9209 n-heksana 0.9362 31.1309 2 3.0073 Kloroform 0.3344 11.1196 Metanol:Air (7:3) 1.2092 40.2088 n-heksana 0.9723 32.3303 3 3.0074 Kloroform 0.4851 16.1302 Metanol:Air (7:3) 0.9425 31.3394 n-heksana 31.9846
Rerata Kloroform 11.8106
Metanol:Air (7:3) 27.8230
Rendemen n-heksana
= Bobot ekstrak x 100%
(% b/b ekstrak MeOH)
Bobot ekstrak MeOH
= 0.9777 x 100%
3.0090
= 32.4925 % (b/b ekstrak MeOH)
Ulangan Bobot daun (g) Bobot Ekstrak (g) Faktor koreksi Rendemen (%b/b)
1 100.0071 14.4579 1.1279 16.3059
2 100.0098 13.4732 1.1279 15.1949
3 100.0052 12.3559 1.1279 13.9355
Lampiran 6 Hasil penentuan eluen terbaik ekstrak metanol:air (7:3)
Keterangan:
Eluen terbaik dari hasil penelitian yang disajikan pada tabel di atas adalah pelarut campuran n -butanol:metanol:asam asetat (1:8:1)
Lampiran 7 Hasil Fraksinasi ekstrak metanol:air (7:3)
No Fraksi Jumlah Spot Nilai Rf Bobot Fraksi (g) Rendemen (%b/b)
I 2 0.78; 0,91 0.0235 1.5592
II 2 0.86; 0.94 0.0325 2.1563
III 4 0.66; 0.75; 0.84; 0.91 0.0728 4.8301
IV 4 0.54; 0.69; 0.76; 0.88 1.1024 73.1423
V 3 0.35; 0.59; 0.74 0.0941 6.2434
VI 1 0.35 0.0812 5.3875
VII 1 0.08 0.0710 4.7107
Bobot awal yang digunakan = 1.5072 g
Rendemen Fraksi I
= Bobot fraksi x 100%
(% b/b ekstrak MeOH:air) Bobot awal
= 0.0235 x 100%
1.5072
= 1.5592 % (b/b ekstrak MeOH:air)
No Jenis Eluen Volumetotal
Jumlah
Noda Nilai Rf
1 n-heksana 5 − −
2 Kloroform 5 − −
3 Etil Asetat 5 2 0.075; 0.21
Lampiran 8 Hasil Uji aktivitas antibakteri
Konsentrasi (mg/mL)
BahanUji
Fraksi I Fraksi II Fraksi III Fraksi IV Fraksi V Fraksi VI
Fraksi VII
Ekstrak
kasar Tetrasiklin TCC
Kontrol negatif 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2
2.00 √ √ √ √ √ √ √ √ √ √ x x x x √ √ √ √ √ √ x x 1.00 x x √ √ √ √ √ √ √ √ x x x x √ √ √ √ √ √ x x 0.50 x x √ √ √ √ √ √ √ √ x x x x √ √ √ √ √ √ x x 0.25 x x √ √ √ √ √ √ √ √ x x x x √ √ √ √ √ √ x x 0.12 x x √ √ x x √ x √ √ x x x x x x √ √ √ √ x x 0.06 x x x x x x x x √ √ x x x x √ x √ √ x x x x 0.03 x x x x x x x x x x x x x x x x x x x x x x 0.01 x x x x x x x x x x x x x x x x x x x x x x KHM 2.00 2.00 0.12 0.12 0.25 0.25 0.12 0.25 0.06 0.06 >2.00 0.25 0.25 0.06 0.06 0.12 0.12 - -
Konsentrasi (mg/mL)
Bahan Uji
Fraksi I Fraksi II Fraksi III Fraksi IV Fraksi V Ekstrak kasar Tetrasiklin TCC 1 2 1 2 1 2 1 2 1 2 1 2 1 2 1 2
2.00 x x √ √ √ √ √ √ √ √ √ √ √ √ √ √
1.00 x x √ √ √ x √ √ √ √ √ √ √ √
0.50 x x x x x x √ √ √ √ √ √
0.25 x x x x x x x x √ √ x x
0.12 x x x x x x x x
0.06 x x x x
0.03
Keterangan:
√ adalah bening (tidak ada pertumbuhan bakteri) x adalah keruh (ada pertumbuhan bakteri)
Fraksi V merupakan fraksi teraktif sebagai antibakteri
Lampiran 9 Hasil Pemisahan dari Fraksi V
No Fraksi
Bobot awal
Bobot Fraksi
Rendemen (%b/b)
A
0.0941
0.0124
13.1775
B
0.0308
32.7311
C
0.0419
44.5271
RendemenFraksi A
= Bobot Fraksi Ax 100%
(% b/b Fraksi V)
Bobot Fraksi V
= 0.0124 x 100%
0.0941
Lampiran 10 Hasil uji aktivitas antibakteri setelah pemisahan dengan KLTP
Konsentrasi (mg/mL)
Bahan Uji
Fraksi 1 Fraksi 2 Fraksi 3 Tetrasiklin TCC 1 2 1 2 1 2 1 2 1 2 2.00 √ x x x √ √ √ √ √ √
1.00 x x √ √ √ √
0.50 √ √ x x
0.25
0.12
0.06
0.03
0.01 KBM 2.00 >2.00 >2.00 >20 2.00 2.00 0.50 0.50 1.00 1.00 Keterangan:
√ adalah bening (tidak ada pertumbuhan bakteri)
x adalah keruh (ada pertumbuhan bakteri)
Fraksi V3 merupakan fraksi teraktif sebagai antibakteri Konsentrasi
(mg/mL)
Bahan Uji
Lampiran 11 Spektrum UV-tampak&FTIR Fraksi V3
Spektrum UV-tampak
Spektrum FTIR
max
= 327 nm
Regang O-H
Regang C-H alifatik
Regang C=C aromatik Regang C=O
Lentur C-H alifatik
ABSTRAK
AISYAH HIDAYAT
Fraksionasi Golongan Flavonoid dari Daun Kepel
(Stelechocarpus burahol)
yang Berpotensi sebagai Antibakteri. Dibimbing oleh
LATIFAH KOSIM DARUSMAN
dan
IRMANIDA BATUBARA
.
Penelitian ini bertujuan memisahkan senyawa flavonoid yang terkandung
dalam ekstrak metanol daun kepel yang berpotensi sebagai antibakteri. Bakteri
yang digunakan ialah
Staphylococcus epidermidis yang merupakan bakteri
penyebab bau badan. Ekstrak metanol kepel dipartisi dalam metanol:air (7:3) lalu
dengan
n-heksana dan kloroform. Ekstrak metanol:air (7:3) yang mengandung
flavonoid paling banyak selanjutnya difraksionasi menggunakan kromatografi
kolom silika gel (elusi isokratik dengan butanol:metanol:asam asetat 1:8:1 sebagai
eluen) menghasilkan 7 fraksi. Semua fraksi diuji aktivitas antibakteri dengan
metode
microplate. Fraksi V merupakan fraksi yang paling aktif dengan
konsentrasi hambat minimum (KHM) sebesar 0.06 mg/mL dan konsentrasi bunuh
minimum (KBM) sebesar 0.50 mg/mL. Fraksi V dipisahkan lebih lanjut
menggunakan kromatografi lapis tipis preparatif dan diperoleh 3 fraksi. Fraksi V3
merupakan fraksi yang paling aktif dengan KHM sebesar 1.00 mg/mL dan KBM
2.00 mg/mL. Hasil identifikasi fraksi V3 berdasarkan pendugaan spektrum
ultraviolet-tampak dan inframerah adalah golongan flavon.
ABSTRACT
AISYAH HIDAYAT
Fractionation of Flavonoid Group from Kepel
(Stelechocarpus burahol) Leaves as Antibacterial Agent. Supervised by
LATIFAH KOSIM DARUSMAN
and
IRMANIDA BATUBARA
.
PENDAHULUAN
Indonesia merupakan negara yang kaya akan sumberdaya hayati. Terdapat sekitar 30000 spesies tumbuhan berbunga di hutan tropika Indonesia. Jumlah tersebut belum termasuk kehidupan lainnya, seperti herba, semak, paku-pakuan, epifit, cendawan, dan jasad renik lainnya. Keanekaragaman hayati yang terhimpun dalam berbagai formasi hutan Indonesia merupakan aset nasional yang tidak terhingga nilainya bagi kepentingan manusia. Salah satu manfaat keanekaragaman hayati adalah kegunaannya sebagai obat. Menurut hasil penelitian Zuhud et al. (2004), telah ditemukan sebanyak 1260 spesies tumbuhan obat yang secara pasti diketahui berasal dari hutan tropika Indonesia.
Salah satu tumbuhan yang dapat dimanfaatkan sebagai obat ialah kepel (Stelechocarpus burahol). Kepel merupakan tumbuhan yang secara tradisional telah digunakan sebagai pewangi khususnya di kalangan keraton. Mengonsumsi buahnya dapat mengurangi bau keringat, bau nafas, dan bau air seni (Heyne 1987; Verheij dan Coronell 1997).
Masalah bau badan dapat dialami oleh setiap orang dan dapat disebabkan oleh beberapa hal, seperti faktor genetik, kondisi kejiwaan, faktor makanan, faktor kegemukan, dan bahan pakaian yang dipakai. Keringat yang dikeluarkan seseorang sangat terlibat dalam proses timbulnya bau badan. Infeksi kelenjar apokrin yang menghasilkan keringatoleh bakteri berperan dalam proses pembusukan. Bakteri yang diduga menjadi penyebab bau badan tersebut diantaranya ialah Staphylococcus epidermidis, Corynebacterium acne, Pseudomonas aeruginosa, dan Streptococcus pyogenes (Endarti & Soediro 2002). Penggunaan antibiotik yang tidak benar biasanya akan membuat bakteri menjadi bersifat resisten dan tetap memperbanyak diri dalam inangnya.
Menurut Bartlett (2007), bakteri S. epidermidis umumnya telah resisten terhadap antibiotik penisilin dan metisilin, sehingga perlu diketahui bahan alternatif yang dapat membasmi atau menghambat pertumbuhan bakteri tersebut. Darusman et al. (komunikasi pribadi 2010) melaporkan bahwa aktivitas flavonoid dari ekstrak daun kepel sebagai antibakteri lebih tinggi daripada tanin. Oleh karena itu, dilakukan penelitian untuk mengetahui senyawa aktif antibakteri pada ekstrak daun kepel dalam menghambat
pertumbuhan bakteri S. epidermidis yang dilakukan secara in vitro.
Penelitian ini bertujuan mengidentifikasi golongan flavonoid yang berpotensi sebagai antibakteri terhadap S. epidermidis dari ekstrak daun kepel (S. burahol) secara in vitro.
TINJAUAN PUSTAKA
Tanaman Kepel (Stelechocarpusburahol)
Tumbuhan kepel atau burahol (Stelechocarpus burahol) adalah pohon penghasil buah hidangan meja yang menjadi flora identitas Daerah Istimewa Yogyakarta. Klasifikasi ilmiah kepel adalah sebagai berikut:
Kingdom : Plantae Subkingdom : Trachebionta Superdivisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Subkelas : Magnoliales Famili : Annonaceae Genus : Stelechocarpus Spesies : Stelechocarpus burahol
(Blume) Hook&Thompson (USDA 2007)
S. burahol merupakan jenis tanaman buah-buahan Indonesia, dengan nama lain kepel, simpel, dan kecindul (Jawa). Tinggi pohon ini dapat mencapai 25 m, batang lurus berwarna cokelat tua, diameter mencapai 40 cm, memiliki benjolan-benjolan bekas keluar bunga dan buah, daun tunggal, elips–lonjong sampai bundar telur–lanset, panjang 12–27 cm dan lebar 5–9 cm.Buah berbentuk bulat, berwarna kecoklatan, diameter 5–6 cm, berbiji empat atau lebih dan berbentuk elip (LIPI 2000). Kepel akan tumbuh baik pada tanah yang subur, drainase yang baik, dan pH 5.8– 6.7 (Solikin 2010).
PENDAHULUAN
Indonesia merupakan negara yang kaya akan sumberdaya hayati. Terdapat sekitar 30000 spesies tumbuhan berbunga di hutan tropika Indonesia. Jumlah tersebut belum termasuk kehidupan lainnya, seperti herba, semak, paku-pakuan, epifit, cendawan, dan jasad renik lainnya. Keanekaragaman hayati yang terhimpun dalam berbagai formasi hutan Indonesia merupakan aset nasional yang tidak terhingga nilainya bagi kepentingan manusia. Salah satu manfaat keanekaragaman hayati adalah kegunaannya sebagai obat. Menurut hasil penelitian Zuhud et al. (2004), telah ditemukan sebanyak 1260 spesies tumbuhan obat yang secara pasti diketahui berasal dari hutan tropika Indonesia.
Salah satu tumbuhan yang dapat dimanfaatkan sebagai obat ialah kepel (Stelechocarpus burahol). Kepel merupakan tumbuhan yang secara tradisional telah digunakan sebagai pewangi khususnya di kalangan keraton. Mengonsumsi buahnya dapat mengurangi bau keringat, bau nafas, dan bau air seni (Heyne 1987; Verheij dan Coronell 1997).
Masalah bau badan dapat dialami oleh setiap orang dan dapat disebabkan oleh beberapa hal, seperti faktor genetik, kondisi kejiwaan, faktor makanan, faktor kegemukan, dan bahan pakaian yang dipakai. Keringat yang dikeluarkan seseorang sangat terlibat dalam proses timbulnya bau badan. Infeksi kelenjar apokrin yang menghasilkan keringatoleh bakteri berperan dalam proses pembusukan. Bakteri yang diduga menjadi penyebab bau badan tersebut diantaranya ialah Staphylococcus epidermidis, Corynebacterium acne, Pseudomonas aeruginosa, dan Streptococcus pyogenes (Endarti & Soediro 2002). Penggunaan antibiotik yang tidak benar biasanya akan membuat bakteri menjadi bersifat resisten dan tetap memperbanyak diri dalam inangnya.
Menurut Bartlett (2007), bakteri S. epidermidis umumnya telah resisten terhadap antibiotik penisilin dan metisilin, sehingga perlu diketahui bahan alternatif yang dapat membasmi atau menghambat pertumbuhan bakteri tersebut. Darusman et al. (komunikasi pribadi 2010) melaporkan bahwa aktivitas flavonoid dari ekstrak daun kepel sebagai antibakteri lebih tinggi daripada tanin. Oleh karena itu, dilakukan penelitian untuk mengetahui senyawa aktif antibakteri pada ekstrak daun kepel dalam menghambat
pertumbuhan bakteri S. epidermidis yang dilakukan secara in vitro.
Penelitian ini bertujuan mengidentifikasi golongan flavonoid yang berpotensi sebagai antibakteri terhadap S. epidermidis dari ekstrak daun kepel (S. burahol) secara in vitro.
TINJAUAN PUSTAKA
Tanaman Kepel (Stelechocarpusburahol)
Tumbuhan kepel atau burahol (Stelechocarpus burahol) adalah pohon penghasil buah hidangan meja yang menjadi flora identitas Daerah Istimewa Yogyakarta. Klasifikasi ilmiah kepel adalah sebagai berikut:
Kingdom : Plantae Subkingdom : Trachebionta Superdivisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Subkelas : Magnoliales Famili : Annonaceae Genus : Stelechocarpus Spesies : Stelechocarpus burahol
(Blume) Hook&Thompson (USDA 2007)
S. burahol merupakan jenis tanaman buah-buahan Indonesia, dengan nama lain kepel, simpel, dan kecindul (Jawa). Tinggi pohon ini dapat mencapai 25 m, batang lurus berwarna cokelat tua, diameter mencapai 40 cm, memiliki benjolan-benjolan bekas keluar bunga dan buah, daun tunggal, elips–lonjong sampai bundar telur–lanset, panjang 12–27 cm dan lebar 5–9 cm.Buah berbentuk bulat, berwarna kecoklatan, diameter 5–6 cm, berbiji empat atau lebih dan berbentuk elip (LIPI 2000). Kepel akan tumbuh baik pada tanah yang subur, drainase yang baik, dan pH 5.8– 6.7 (Solikin 2010).
pertumbuhan kolorektal karsinoma antara lain asetogenin, lakton, dan isoflavon.
Hasil uji fitokimia kepel menunjukkan adanya alkaloid, flavonoid, tanin, dan steroid-triterpenoid (Sunardi 2010). Sebagai anti gout, ekstrak polar daun dan buah kepel memiliki aktivitas penghambatan COX-2 pada
konsentrasi 50 g/mL (Batubara et al. 2010). Rahminiwati et al. (2010) melaporkan bahwa ekstrak daun dan buah kepel tidak memiliki aktivitas antimikroba terhadap Propionibacterium acnes pada konsentrasi 4 mg/mL. Priastini dan Flora (2010) melaporkan bahwa ekstrak buah kepel mengandung antioks