AGLAONEMA PRIDE OF SUMATERA SECARA
IN VITRO
MELALUI PENAMBAHAN BAP DAN 2,4-D
LIMAS AGUNG
A24061521
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
ABSTRACT
LIMAS AGUNG. Induction of Aglaonema Pride of Sumatera Axillary Bud Proliferation In Vitro by BAP and 2,4-D Plant Growth Hormones.
The research aimed to study the effect of plant growth regulator (BAP and 2,4-D) on the shoot bud growth of aglaonema Pride of Sumatera using axillary bud explant in vitro. This research was conducted from February 2010 to March 2011 at Laboratory of Plant Tissue Culture, Department of Agronomy and Horticulture IPB, Bogor. Completely Randomized Block Design was used in this research. The research consisted of two factors and three replications. The first factor is 2,4-D with two concentrations are 1 and 2 mg/l. The second factor is BAP with five concentrations are 2, 4, 6, 8, and 10 mg/l. The result showed that the treatment of BAP, 2,4-D, and the interaction between them are not
significantly affected the number and the length of buds. The treatment of 6 mg/l BAP + 1 mg/l 2,4-D gave the fastest growth of shoot bud, that was 2.17
RINGKASAN
LIMAS AGUNG. Induksi Pertumbuhan Mata Tunas Aksilar Aglaonema Pride of Sumatera Secara In Vitro Melalui Penambahan BAP dan 2,4-D. (Dibimbing oleh NI MADE ARMINI WIENDI).
Penelitian ini bertujuan untuk mempelajari pengaruh zat pengatur tumbuh BAP dan 2,4-D terhadap pertumbuhan mata tunas aksilar aglaonema Pride of Sumatera secara in vitro. Media dasar yang digunakan yaitu media MS (Murashige & Skoog). Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, Bogor pada bulan Februari 2010 hingga Maret 2011.
Penelitian ini menggunakan perlakuan faktorial disusun dalam rancangan lingkungan acak lengkap dengan dua faktor. Faktor pertama yaitu perlakuan 2,4-D dengan konsentrasi 1 dan 2 mg/l. Faktor kedua yaitu perlakuan BAP dengan konsentrasi 2, 4, 6, 8, dan 10 mg/l. Penelitian ini terdiri dari 10 kombinasi perlakuan dengan tiga ulangan untuk masing-masing kombinasi perlakuan, sehingga terdapat 30 satuan percobaan. Setiap satu satuan percobaan terdiri dari satu botol kultur dengan tiga buah eksplan per botol kultur, sehingga terdapat 90 satuan amatan. Bahan tanaman yang digunakan yaitu mata tunas batang tanaman aglaonema Pride of Sumatera yang memiliki delapan sampai 10 lembar daun.
Persentase eksplan aglaonema Pride of Sumatera yang terkontaminasi pada penelitian ini termasuk tinggi. Persentase kontaminasi rata-rata yang tertinggi yaitu 100% pada 12 MST, sedangkan persentase kontaminasi rata-rata terendah yaitu 13% pada 12 MST. Persentase eksplan mati rata-rata tertinggi, yaitu 22% pada 12 MST. Kematian eksplan terutama karena kontaminasi cendawan dan sterilisasi yang berulang-ulang. Perlakuan 6 mg/l BAP + 1 mg/l 2,4-D memberikan waktu muncul tunas rata-rata yang paling cepat yaitu pada 2.17 MST.
INDUKSI PERTUMBUHAN MATA TUNAS AKSILAR
AGLAONEMA PRIDE OF SUMATERA SECARA
IN VITRO
MELALUI PENAMBAHAN BAP DAN 2,4-D
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
LIMAS AGUNG
A24061521
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
Judul : INDUKSI PERTUMBUHAN MATA TUNAS AKSILAR AGLAONEMA PRIDE OF SUMATERA SECARA IN VITRO
MELALUI PENAMBAHAN BAP DAN 2,4-D Nama : Limas Agung
NRP : A24061521
Menyetujui, Dosen Pembimbing
Dr. Ir. Ni Made Armini Wiendi, MS. NIP: 19610412 198703 2 003
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, MSc. Agr. NIP: 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, Propinsi DKI Jakarta pada tanggal 14 Maret 1988. Penulis merupakan anak pertama dari Bapak Ronny Wiryo Pranoto dan Ibu Sri Muljati.
Penulis lulus dari SDK 3 Penabur pada tahun 2000, kemudian pada tahun 2003 penulis menyelesaikan studi di SLTPK 1 Penabur. Selanjutnya penulis lulus dari SMAK 3 Penabur pada tahun 2006 dan diterima di IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Penulis juga mengikuti pendidikan non formal yaitu kursus matematika di Kumon pada tahun 1998-2006. Tahun 2007 penulis diterima sebagai mahasiswa Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Tahun 2010 penulis menjadi asisten mata kuliah Dasar Bioteknologi Tanaman. Penulis juga aktif di beberapa organisasi mahasiswa seperti Unit Kegiatan Mahasiswa Musik Max dan Keluarga Mahasiswa Buddhis IPB (KMB IPB). Tahun 2007-2008 penulis menjabat sebagai koordinator humas KMB IPB.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat dan rahmat-Nya penulis dapat menyelesaikan penelitian ini dengan baik. Penelitian ini dilaksanakan di Laboratorium Bioteknologi Tanaman IPB, Darmaga, Bogor.
Penulis menyampaikan terima kasih kepada:
1. Dr. Ir. Ni Made Armini Wiendi, MS selaku dosen pembimbing skripsi yang telah memberikan arahan dan bimbingan dalam penelitian ini.
2. Ayah, ibu, adik, dan keluarga besar yang telah memberi dukungan dan semangat dalam menyelesaikan penelitian.
3. Ir. Edhi Sandra, Msi yang telah memberikan ilmu yang bermanfaat dalam menjalankan penelitian ini.
4. Keluarga besar Lab. Biotek : Kak Asep, Teteh Eneng, Mbak Arda, Kak Irwan, Kak Agus, Kiki, Kak Lina, Mbak Seri, Mbak Okti, Mbak Ai, Kak Yogo, Yudi, Bang Monje, dan Pak Wasil. Terima kasih atas bantuan, kerja sama, dan dukungan selama penulis menjalankan penelitian.
5. Teman-teman yang telah membantu selama penelitian : Candra, Ayip, Kentung, Ikiw, Dika, Husni, Dial, dan Ratih.
6. Teman-teman Agronomi dan Hortikultura angkatan 43.
7. Semua pihak yang tidak dapat disebutkan satu per satu atas perhatian, dukungan, doa, dan bantuan kepada penulis selama ini.
Semoga hasil penelitian ini dapat berguna bagi pihak yang memerlukan.
Bogor, Mei 2011
Halaman
Kultur Jaringan dan Media Kultur Jaringan ... 5
Zat Pengatur Tumbuh ... 6
Kultur Jaringan Tanaman Araceae ... 8
BAHAN DAN METODE ... 10
Tempat dan Waktu ... 10
Bahan dan Alat ... 10
Metode Penelitian ... 11
Pelaksanaan Penelitian... 12
Persiapan Sumber Bahan Tanaman ... 12
Sterilisasi Alat ... 13
Jumlah Eksplan Kontaminasi dan Mati ... 17
DAFTAR TABEL
Nomor Halaman
1. Kombinasi Perlakuan BAP dan 2,4-D pada Percobaan Induksi Mata Tunas Aksilar Aglaonema Pride of Sumatera Secara In Vitro ... 12
2. Rekapitulasi Hasil Uji F Pengaruh BAP, 2,4-D, dan Interaksi BAP dan 2,4-D terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro. ... 21
3. Pengaruh BAP terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro. ... 21
4. Pengaruh 2,4-D terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro. ... 22
5. Pengaruh Interaksi BAP dan 2,4-D terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro. ... 23
6. Rekapitulasi Hasil Uji F Pengaruh BAP, 2,4-D, dan Interaksi BAP dan 2,4-D terhadap Rata-rata Panjang Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro. ... 24
7. Pengaruh BAP terhadap Rata-rata Panjang Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro. ... 24
8. Pengaruh 2,4-D terhadap Rata-rata Panjang Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro. ... 25
DAFTAR GAMBAR
Nomor Halaman
1. Struktur Kimia 2,4-Dichlorophenoxy Acetic Acid ... 7
2. Struktur Kimia Benzyl Amino Purine ... 8
3. Tanaman Aglaonema Pride of Sumatera sebagai Sumber Eksplan ... 10
4. Tahap Pembentukan Mata Tunas pada Kultur Aglaonema Pride of Sumatera (A) 1 MST dan (B) 12 MST ... 16
5. Kontaminasi pada Kultur Aglaonema Pride of Sumatera : (A) Kontaminasi oleh Cendawan (Tanda Panah) dan (B) Kontaminasi oleh Bakteri (Tanda Panah) ... 17
6. Histogram Persentase Rata-rata Kontaminasi Kultur Per Perlakuan pada Aglaonema Pride of Sumatera Secara In Vitro
pada 12 MST ... 18
7. Histogram Persentase Rata-rata Eksplan Mati Per Perlakuan pada Aglaonema Pride of Sumatera Secara In Vitro pada 12 MST ... 19
8. Histogram Pengaruh 2,4-D dan BAP terhadap Rata-rata Waktu Munculnya Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro ... 20
9. Eksplan Aglaonema Pride of Sumatera pada Perlakuan 10 mg/l BAP + 2 mg/l 2,4-D dengan Panjang Mata Tunas
DAFTAR LAMPIRAN
Nomor Halaman
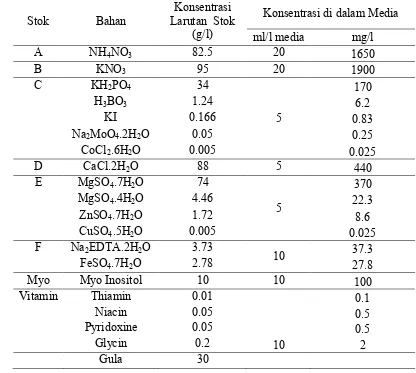
1. Komposisi Media Murashige dan Skoog yang Digunakan di dalam Penelitian Induksi Mata Tunas Aksilar Aglaonema Secara In Vitro . 32
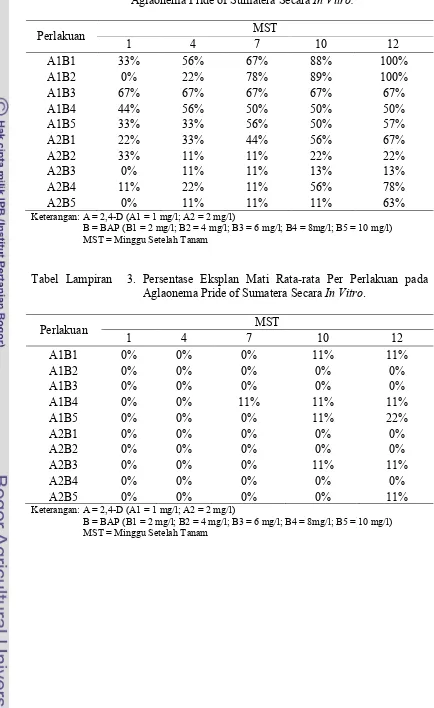
2. Persentase Kontaminasi Kultur Rata-rata Per Perlakuan pada Aglaonema Pride of Sumatera Secara In Vitro. ... 33
3. Persentase Eksplan Mati Rata-rata Per Perlakuan pada Aglaonema Pride of Sumatera Secara In Vitro. ... 33
4. Sidik Ragam Pengaruh BAP, 2,4-D, dan Interaksi BAP dan 2,4-D terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro. ... 34
Latar Belakang
Aglaonema adalah satu dari banyak spesies tanaman hias daun yang sudah dikenal cukup lama. Orang yang pertama kali menyilangkan aglaonema warna hijau putih menjadi merah ungu adalah Gregory Hambali dari Bogor, Jawa Barat. Gregory mulai menyilangkan A. comutatum tricolor x A. rotundum pada sekitar tahun 1980 dan hasilnya baru dikeluarkan sekitar tahun 1988 dengan nama aglaonema Pride of Sumatera (Djojokusumo, 2006). Sejak ditemukannya aglaonema Pride of Sumatera, aglaonema mulai dikembangkan. Nilai ekonomi tanaman hias daun terletak pada estetikanya yaitu pada bentuk daun, jumlah daun, dan warna daun yang ditentukan oleh keragaman genetiknya. Daya tarik aglaonema terletak pada keindahan daun dan warnanya.
Aglaonema merupakan tanaman yang mudah dirawat dan diperbanyak. Cara perbanyakan aglaonema pada umumnya dengan biji atau dengan perbanyakan secara vegetatif berupa stek, pemisahan anakan, dan pencangkokan. Perbanyakan dengan stek merupakan cara yang paling banyak dilakukan karena cara ini mudah dan cepat menghasilkan anakan baru. Akan tetapi, kendala perbanyakan dengan stek di lapangan terbuka yaitu serangan patogen, sehingga tanaman tidak dapat berkembang dengan baik atau mati.
Seiring dengan permintaan bibit aglaonema yang semakin meningkat, cara perbanyakan secara konvensional menggunakan stek, anakan, dan cangkok tidak lagi bisa mencukupi kebutuhan akan bibit. Alternatif cara perbanyakan yang sanggup memenuhi permintaan bibit dalam jumlah besar yaitu dengan kultur jaringan (Purwanto, 2006). Perbanyakan tanaman secara kultur jaringan atau
2
dihasilkan benar-benar serupa dengan tanaman induk. Metode ini disebut juga sebagai perbanyakan klonal.
Literatur menunjukkan bahwa komposisi media dan zat pengatur tumbuh yang dibutuhkan pada umumnya berbeda antar spesies, antar klon, atau varietas dalam satu spesies (Enggaringati, 2006). Hartmann dan Kester (1983) menyatakan bahwa zat pengatur tumbuh yang digunakan dalam kultur jaringan adalah auksin dan sitokinin. Kedua zat ini berpengaruh dalam pembentukan akar, tunas, dan kalus. Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel secara endogen menentukan arah perkembangan suatu kultur.
Pada perbanyakan anthurium (Anthurium andraeanum Linden ex André) secara in vitro, yang merupakan tanaman satu famili dengan aglaonema, eksplan yang digunakan berupa daun dari hasil perkecambahan benih secara in vitro. Zat pengatur tumbuh yang digunakan yaitu air kelapa, NAA, dan BAP. Hasil penelitian menunjukkan persentase eksplan yang mati setelah mengering sebesar 78.3%, persentase eksplan yang mati karena browning sebesar 14.72%, dan sisanya eksplan yang hidup. Eksplan yang hidup menunjukkan organogenesis tunas, daun, dan akar melalui kalus (Prihatmanti, 2002).
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh BAP dan 2,4-D dalam menginduksi pertumbuhan mata tunas aksilar tanaman aglaonema Pride of Sumatera secara in vitro.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini yaitu:
2. Zat pengatur tumbuh 2,4-D berpengaruh nyata terhadap pertumbuhan mata tunas aksilar tanaman aglaonema Pride of Sumatera.
TINJAUAN PUSTAKA
Aglaonema sp.
Aglaonema disebut juga sri rejeki atau chinese evergreen merupakan tanaman hias daun dari suku talas-talasan atau Araceae. Genus Aglaonema berjumlah sekitar 30 spesies. Menurut Lawrence (1959), klasifikasi tanaman aglaonema adalah sebagai berikut:
Nama aglaonema berasal dari bahasa Yunani, yaitu aglaos yang bermakna terang atau sinar, dan nema yang bermakna benang (benang sari). Jika digabungkan artinya menjadi helaian benang yang bersinar terang. Di Thailand, aglaonema dikenal dengan nama siamese rainbow, sedangkan di Malaysia lebih dikenal dengan nama good luck (Junaedhie, 2006).
termasuk bunga majemuk dan tergolong bunga tongkol (spandix). Pada tongkol, bunga jantan terletak di bagian atas, sedangkan bunga betina pada bagian bawah (Purwanto, 2006).
Suhu ideal bagi aglaonema pada siang hari adalah sekitar 30° C dan pada malam hari sekitar 23° C. Tanaman aglaonema tumbuh lebih cepat di dataran rendah karena suhu udara lebih hangat dan matahari bersinar lebih lama, sehingga fotosintesis lebih banyak. Pertumbuhan satu helai daun aglaonema memerlukan waktu sekitar 25 hari. Aglaonema membutuhkan naungan dengan pencahayaan terbatas (10 – 30%). Kelembaban yang sesuai bagi aglaonema yaitu 50 – 60% (Djojokusumo, 2006).
Kultur Jaringan dan Media Kultur Jaringan
Kultur jaringan adalah suatu metode untuk mengisolasi bagian-bagian tanaman seperti sel, protoplasma, jaringan, organ serta menumbuhkannya dalam kondisi yang aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali. Keberhasilan penerapan teknik kultur jaringan dipengaruhi oleh keberhasilan studi regenerasi dari jaringan yang ditanam. Ada juga yang menyebutnya sebagai kultur in vitro. Kultur in vitro
adalah kultur di dalam wadah gelas (Gunawan, 1992).
Kultur in vitro memerlukan beberapa komponen utama yaitu bahan awal, media yang sesuai, dan tempat kultivasi. Bahan awal yang digunakan untuk kultur
in vitro tanaman bermacam-macam, antara lain batang, daun, tunas apikal, tunas aksilar, petiol, anter, polen, petal, ovul, akar, dan lain-lain. Bagian tanaman yang digunakan sebagai bahan awal kultur in vitro disebut sebagai eksplan (Yuwono, 2008).
6
Komposisi media yang digunakan pada kultur jaringan tergantung dari jenis tanaman yang akan diperbanyak. Wetherell (1982) menyatakan bahwa salah satu formulasi yang sering dipakai sebagai media kultur adalah Murashige-Skoog (MS). Formulasi hara mineral dari MS dapat digunakan untuk sejumlah besar spesies tanaman pada propagasi secara in vitro.
Menurut Gunawan (1987) selain golongan persenyawaan organik yang konstitusinya jelas, media kultur jaringan juga kadang-kadang ditambahkan persenyawaan yang kompleks. Salah satu persenyawaan yang dimaksud adalah air kelapa. Penelitian yang lebih mendalam menemukan bahwa efek air kelapa pada pertumbuhan menjadi lebih baik bila dalam media juga diberikan auksin. Auksin tertentu dan air kelapa dapat bersifat sinergis. Steward dan Caplin (1951) mendapatkan bahwa antara 2,4-D dan air kelapa terjadi reaksi sinergistik yang memacu pertumbuhan kalus Daucus carota. Tetapi tidak semua auksin dan air kelapa mempunyai kerja sama yang sinergis. Menurut Wattimena (1988) air kelapa telah lama diketahui sebagai sumber yang kaya akan zat-zat aktif yang diperlukan untuk perkembangan embrio. Salah satu zat aktif tersebut adalah sitokinin endogen. Pada air kelapa dapat dilihat suatu interaksi antara sitokinin dengan fitohormon lainnya di dalam proses perkembangan embrio itu.
Zat Pengatur Tumbuh
Zat pengatur tumbuh adalah senyawa organik bukan nutrisi yang dalam jumlah kecil dapat merangsang, menghambat, atau memodifikasi proses-proses fisiologis dalam tanaman (Tukey, 1954).
Peran fisiologis auksin adalah memacu pemanjangan sel batang dan koleoptil, inisiasi akar, diferensiasi jaringan pembuluh, respon tropik, perkembangan tunas samping, dan perkembangan bunga dan buah (Davies, 1995). Menurut Wattimena (1988) 2,4-D (2,4-Dichlorophenoxy acetic acid) adalah auksin sintetik yang tidak diproduksi sendiri oleh tanaman. Wetherell (1982) menyatakan bahwa 2,4-D merupakan auksin yang lebih stabil dan lebih kuat dari jenis auksin lainnya karena lambat diuraikan oleh sel tumbuhan dan stabil pada pemanasan dengan autoklaf. Salah satu faktor yang mempengaruhi aktivitas auksin sintetik yaitu kemampuan auksin tersebut berinteraksi dengan hormon tumbuhan lainnya (Wattimena, 1988). Senyawa 2,4-D diketahui menginduksi perbanyakan sel tetapi menekan diferensiasi pada tanaman dikotil, tetapi 2,4-D dan 2,4,5-T diketahui bersifat efektif untuk menginduksi embriogenesis pada tanaman monokotil (Yuwono, 2008). Struktur kimia 2,4-D disajikan pada Gambar 1.
Gambar 1. Struktur Kimia 2,4-Dichlorophenoxy Acetic Acid
Gunawan (1987) melaporkan bahwa sitokinin sangat penting dalam pengaturan pembelahan sel dan morfogenesis. Menurut Pierik (1987), sitokinin juga banyak digunakan untuk memacu inisiasi dan proliferasi tunas. Janick (1972) melaporkan bahwa sitokinin jenis BAP (Benzyl Amino Purine) sering dipakai karena efektivitasnya tinggi, harganya murah, dan bisa disterilisasi dengan suhu di atas 100°C. Campuran sitokinin dengan auksin rendah dipakai untuk menumbuhkan dan menggandakan tunas aksilar atau merangsang tumbuhnya tunas-tunas adventif. Struktur kimia BAP dapat dilihat pada Gambar 2.
Peran fisiologis auksin adalah memacu pemanjangan sel batang dan koleoptil, inisiasi akar, diferensiasi jaringan pembuluh, respon tropik, perkembangan tunas samping, dan perkembangan bunga dan buah (Davies, 1995). Menurut Wattimena (1988) 2,4-D (2,4-Dichlorophenoxy acetic acid) adalah auksin sintetik yang tidak diproduksi sendiri oleh tanaman. Wetherell (1982) menyatakan bahwa 2,4-D merupakan auksin yang lebih stabil dan lebih kuat dari jenis auksin lainnya karena lambat diuraikan oleh sel tumbuhan dan stabil pada pemanasan dengan autoklaf. Salah satu faktor yang mempengaruhi aktivitas auksin sintetik yaitu kemampuan auksin tersebut berinteraksi dengan hormon tumbuhan lainnya (Wattimena, 1988). Senyawa 2,4-D diketahui menginduksi perbanyakan sel tetapi menekan diferensiasi pada tanaman dikotil, tetapi 2,4-D dan 2,4,5-T diketahui bersifat efektif untuk menginduksi embriogenesis pada tanaman monokotil (Yuwono, 2008). Struktur kimia 2,4-D disajikan pada Gambar 1.
Gambar 1. Struktur Kimia 2,4-Dichlorophenoxy Acetic Acid
Gunawan (1987) melaporkan bahwa sitokinin sangat penting dalam pengaturan pembelahan sel dan morfogenesis. Menurut Pierik (1987), sitokinin juga banyak digunakan untuk memacu inisiasi dan proliferasi tunas. Janick (1972) melaporkan bahwa sitokinin jenis BAP (Benzyl Amino Purine) sering dipakai karena efektivitasnya tinggi, harganya murah, dan bisa disterilisasi dengan suhu di atas 100°C. Campuran sitokinin dengan auksin rendah dipakai untuk menumbuhkan dan menggandakan tunas aksilar atau merangsang tumbuhnya tunas-tunas adventif. Struktur kimia BAP dapat dilihat pada Gambar 2.
Peran fisiologis auksin adalah memacu pemanjangan sel batang dan koleoptil, inisiasi akar, diferensiasi jaringan pembuluh, respon tropik, perkembangan tunas samping, dan perkembangan bunga dan buah (Davies, 1995). Menurut Wattimena (1988) 2,4-D (2,4-Dichlorophenoxy acetic acid) adalah auksin sintetik yang tidak diproduksi sendiri oleh tanaman. Wetherell (1982) menyatakan bahwa 2,4-D merupakan auksin yang lebih stabil dan lebih kuat dari jenis auksin lainnya karena lambat diuraikan oleh sel tumbuhan dan stabil pada pemanasan dengan autoklaf. Salah satu faktor yang mempengaruhi aktivitas auksin sintetik yaitu kemampuan auksin tersebut berinteraksi dengan hormon tumbuhan lainnya (Wattimena, 1988). Senyawa 2,4-D diketahui menginduksi perbanyakan sel tetapi menekan diferensiasi pada tanaman dikotil, tetapi 2,4-D dan 2,4,5-T diketahui bersifat efektif untuk menginduksi embriogenesis pada tanaman monokotil (Yuwono, 2008). Struktur kimia 2,4-D disajikan pada Gambar 1.
Gambar 1. Struktur Kimia 2,4-Dichlorophenoxy Acetic Acid
8
Gambar 2. Struktur Kimia Benzyl Amino Purine
Sitokinin dan auksin berinteraksi untuk mempengaruhi diferensiasi. Konsentrasi auksin yang tinggi dan sitokinin yang rendah menimbulkan perkembangan akar, konsentrasi auksin yang rendah dan sitokinin yang tinggi menimbulkan perkembangan tunas, sedangkan jika konsentrasinya seimbang menimbulkan pertumbuhan kalus (Janick, 1972).
Kultur Jaringan Tanaman Araceae
Literatur mengenai kultur jaringan aglaonema belum ada yang dipublikasikan. Perbanyakan klonal Anthurium andraeanum yang merupakan tanaman satu famili dengan aglaonema, dicapai dengan menggunakan eksplan dari daun kecambah aseptik dan ditumbuhkan pada media padat dengan penambahan 0.2 mg/l BAP. Konsentrasi tersebut menghasilkan pembentukan kalus minimal, sedangkan pembentukan tunas adventif dan akar optimal (Kunisaki, 1977).
Kultur biji anthurium mampu membentuk tunas pada media MS maupun media Nitsch yang keduanya telah ditambah 15% air kelapa dengan perlakuan 0.5 mg/l NAA atau kombinasi 0.5 - 1.5 mg/l NAA dan BAP. Media terbaik untuk produksi jumlah tunas adalah media Nitsch dengan penambahan 0.5 mg/l NAA dan 1.5 mg/l BAP (Haryanto et al., 1995).
Penelitian Prihatmanti (2002) menggunakan eksplan berupa daun
Anthurium andreanum Linden ex. Andre dengan media dasar MS. Kombinasi perlakuan tanpa air kelapa, 100 ml air kelapa, 1.07 µM NAA, serta 4.44 µM dan 8
Gambar 2. Struktur Kimia Benzyl Amino Purine
Sitokinin dan auksin berinteraksi untuk mempengaruhi diferensiasi. Konsentrasi auksin yang tinggi dan sitokinin yang rendah menimbulkan perkembangan akar, konsentrasi auksin yang rendah dan sitokinin yang tinggi menimbulkan perkembangan tunas, sedangkan jika konsentrasinya seimbang menimbulkan pertumbuhan kalus (Janick, 1972).
Kultur Jaringan Tanaman Araceae
Literatur mengenai kultur jaringan aglaonema belum ada yang dipublikasikan. Perbanyakan klonal Anthurium andraeanum yang merupakan tanaman satu famili dengan aglaonema, dicapai dengan menggunakan eksplan dari daun kecambah aseptik dan ditumbuhkan pada media padat dengan penambahan 0.2 mg/l BAP. Konsentrasi tersebut menghasilkan pembentukan kalus minimal, sedangkan pembentukan tunas adventif dan akar optimal (Kunisaki, 1977).
Kultur biji anthurium mampu membentuk tunas pada media MS maupun media Nitsch yang keduanya telah ditambah 15% air kelapa dengan perlakuan 0.5 mg/l NAA atau kombinasi 0.5 - 1.5 mg/l NAA dan BAP. Media terbaik untuk produksi jumlah tunas adalah media Nitsch dengan penambahan 0.5 mg/l NAA dan 1.5 mg/l BAP (Haryanto et al., 1995).
Penelitian Prihatmanti (2002) menggunakan eksplan berupa daun
Anthurium andreanum Linden ex. Andre dengan media dasar MS. Kombinasi perlakuan tanpa air kelapa, 100 ml air kelapa, 1.07 µM NAA, serta 4.44 µM dan 8
Gambar 2. Struktur Kimia Benzyl Amino Purine
Sitokinin dan auksin berinteraksi untuk mempengaruhi diferensiasi. Konsentrasi auksin yang tinggi dan sitokinin yang rendah menimbulkan perkembangan akar, konsentrasi auksin yang rendah dan sitokinin yang tinggi menimbulkan perkembangan tunas, sedangkan jika konsentrasinya seimbang menimbulkan pertumbuhan kalus (Janick, 1972).
Kultur Jaringan Tanaman Araceae
Literatur mengenai kultur jaringan aglaonema belum ada yang dipublikasikan. Perbanyakan klonal Anthurium andraeanum yang merupakan tanaman satu famili dengan aglaonema, dicapai dengan menggunakan eksplan dari daun kecambah aseptik dan ditumbuhkan pada media padat dengan penambahan 0.2 mg/l BAP. Konsentrasi tersebut menghasilkan pembentukan kalus minimal, sedangkan pembentukan tunas adventif dan akar optimal (Kunisaki, 1977).
Kultur biji anthurium mampu membentuk tunas pada media MS maupun media Nitsch yang keduanya telah ditambah 15% air kelapa dengan perlakuan 0.5 mg/l NAA atau kombinasi 0.5 - 1.5 mg/l NAA dan BAP. Media terbaik untuk produksi jumlah tunas adalah media Nitsch dengan penambahan 0.5 mg/l NAA dan 1.5 mg/l BAP (Haryanto et al., 1995).
Penelitian Prihatmanti (2002) menggunakan eksplan berupa daun
8.88 µM BAP menunjukkan organogenesis tunas dan akar eksplan Anthurium andreanum Linden ex. Andre yang lebih baik. Perlakuan 1 mg/l dan 2 mg/l BAP menunjukkan kecenderungan kalus berwarna hijau, hal tersebut dapat menjelaskan bahwa sitokinin dapat mendorong pembentukan klorofil. Kombinasi perlakuan 100 ml air kelapa dengan 1 mg/l BAP menunjukkan kecenderungan pembentukan kalus dan pertumbuhan kultur tercepat, serta jumlah tunas, daun, dan akar terbanyak.
Kultur batang yang diambil dari perkecambahan Anthurium plowmanii
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Bioteknologi Tanaman, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, Bogor. Penelitian dilaksanakan pada bulan Februari 2010 hingga Maret 2011.
Bahan dan Alat
Bahan tanaman yang digunakan pada penelitian ini yaitu mata tunas aksilar dari batang tanaman aglaonema varietas Pride of Sumatera yang berasal dari genus Aglaonema dan famili Araceae. Tanaman aglaonema yang digunakan adalah tanaman yang memiliki delapan sampai 10 lembar daun (Gambar 3).
Gambar 3. Tanaman Aglaonema Pride of Sumatera sebagai Sumber Eksplan
agar. Zat pengatur tumbuh yang digunakan antara lain sitokinin (BAP dan BA) dan auksin (2,4-D dan NAA). Bahan lain yang ditambahkan pada media yaitu air kelapa. Bahan untuk mengatur pH yaitu larutan HCl 1 N dan KOH 1 N. Bahan-bahan yang digunakan untuk sterilisasi antara lain natrium hipoklorit 5%, alkohol, fungisida dengan bahan aktif mankozeb 80%, fungisida dengan bahan aktif benomil 50%, bakterisida dengan bahan aktif streptomisin sulfat 20%, antibiotik amoxicillin, dan cefotaxime. Bahan penutup botol yaitu plastik dan karet gelang. Bahan-bahan lain yang digunakan antara lain spiritus, tisu, korek api, dan aquadestilata.
Alat-alat yang digunakan dalam membuat media yaitu labu takar, gelas ukur, pipet, pipette filler, timbangan, magnetic stirrer, dan pH meter. Alat untuk sterilisasi botol dan media yaitu autoklaf. Alat-alat yang digunakan ketika menanam antara lain pinset, gunting, scalpel, lampu spiritus, botol semprot, cawan petri, orbital shaker, dan laminar air flow cabinet. Alat-alat yang digunakan untuk menyimpan botol kultur yaitu rak kultur dan lampu TL 20 watt sebagai sumber penyinaran dengan suhu ruang 23 ± 2 °C.
Metode Penelitian
12
Tabel 1. Kombinasi Perlakuan BAP dan 2,4-D pada Percobaan Induksi Mata Tunas Aksilar Aglaonema Pride of Sumatera Secara In Vitro
2,4-D (mg/l) 2 4 BAP (mg/l) 6 8 10
1 A1B1 A1B2 A1B3 A1B4 A1B5
2 A2B1 A2B2 A2B3 A2B4 A2B5
Model rancangan statistika yang digunakan adalah: Yijk = µ + αi + βj + (αβ)ij + εijk Keterangan:
Yijk = nilai sampel karena pengaruh 2,4-D konsentrasi ke-i, BAP konsentrasi ke-j, dan ulangan ke-k
µ = nilai rataan umum
αi = nilai akibat pengaruh perlakuan 2,4-D konsentrasi ke-i (i = 1, 2) βj = nilai akibat pengaruh perlakuan BAP konsentrasi ke-j (j = 1, 2, 3, 4, 5) (αβ)ij = nilai akibat pengaruh interaksi 2,4-D konsentrasi ke-i dan BAP
konsentrasi ke-j
εijk = nilai pengaruh galat pada perlakuan 2,4-D konsentrasi ke-i, BAP konsentrasi ke-j, dan ulangan ke-k
Pengolahan data dilakukan dengan uji F menggunakan program Statistical Analysis System (SAS). Perlakuan yang berpengaruh nyata pada uji F diuji lanjut menggunakan Duncan Multiple Range Test (DMRT) pada taraf 5%.
Pelaksanaan Penelitian
Persiapan Sumber Bahan Tanaman
(bahan aktif 20% streptomisin sulfat) dilakukan seminggu dua kali di seluruh bagian tanaman selama satu bulan. Air yang digunakan untuk mengencerkan fungisida dan bakterisida adalah air steril.
Sterilisasi Alat
Alat tanam yang digunakan di dalam laminar yaitu pinset, gunting, dan
scalpel. Peralatan dicuci bersih dan dibungkus dengan kertas kemudian bersama-sama dengan botol kultur disterilkan dengan autoklaf pada suhu 121°C dengan tekanan 0.175 bar selama 60 menit. Permukaan laminar disterilkan dengan menyemprotkan alkohol 70% lalu dibersihkan dengan tisu. Semua alat yang digunakan disemprot dengan alkohol 70% sebelum dimasukan ke dalam laminar. Alat-alat direndam dengan alkohol dan dibakar diatas api lampu spiritus sebelum menanam agar alat tetap steril.
Pembuatan Media
Media yang digunakan ada dua jenis, yaitu media awal dan media perlakuan. Media awal yang digunakan yaitu media MS dengan penambahan 5 mg/l BA, 0.5 mg/l NAA, dan 100 ml/l air kelapa. Media perlakuan yaitu media MS yang diberi penambahan 2,4-D, BAP, dan 100 ml/l air kelapa.
14
suhu 121°C dengan tekanan 0.175 bar selama 20 menit. Media selanjutnya disimpan di ruang penyimpanan media.
Penanaman
Tanaman sumber eksplan yang sudah diberi perlakuan penyemprotan selama satu bulan kemudian dipotong seluruhnya sehingga hanya batang tanaman dekat pangkal akar yang tersisa. Batang dicuci dengan air steril dan dimasukkan ke dalam botol berisi air steril. Botol tersebut kemudian dimasukkan ke dalam laminar. Batang dipotong-potong dengan scalpel sehingga dalam satu eksplan terdapat satu mata tunas. Selanjutnya eksplan disterilisasi dengan merendam dalam larutan alkohol 70% selama satu menit, lalu dilanjutkan disterilisasi dengan sterilan berbahan aktif natrium hipoklorit 5% dengan konsentrasi 15% selama 15 menit, sterilisasi tahap akhir dengan merendam di larutan konsentrasi 10% selama 10 menit. Kemudian eksplan dibilas dengan air steril. Selanjutnya eksplan direndam di dalam larutan dengan campuran bahan-bahan sebagai berikut: fungisida berbahan aktif mankozeb 80% dengan konsentrasi 2 g/l, fungisida berbahan aktif benomil 50% dengan konsentrasi 2 g/l, bakterisida berbahan aktif streptomisin sulfat 20% dengan konsentrasi 2 g/l, antibiotik amoxicillin dengan konsentrasi 1000 mg/l, dan cefotaxime dengan konsentrasi 1000 mg/l. Eksplan direndam dengan larutan tersebut selama 24 jam sambil dikocok dengan menggunakan orbital shaker.
Pengamatan
Pengamatan terhadap pertumbuhan eksplan aglaonema dilakukan setiap minggu selama 12 minggu (1 – 12 MST). Parameter yang akan diamati antara lain:
1. Persentase eksplan yang terkontaminasi
Persentase kontaminasi dihitung dengan cara membandingkan jumlah eksplan yang terkontaminasi dengan jumlah eksplan dari suatu perlakuan dikalikan 100%.
2. Persentase eksplan yang mati
Persentase eksplan yang mati dihitung dengan cara membandingkan jumlah eksplan yang mati dengan jumlah eksplan dari suatu perlakuan dikalikan 100%.
3. Waktu munculnya mata tunas 4. Jumlah mata tunas
Jumlah mata tunas dihitung dari 1 - 12 MST. 5. Panjang mata tunas
HASIL DAN PEMBAHASAN
Kondisi Umum
Penelitian ini dibagi menjadi dua tahap, yaitu penanaman di media awal untuk mendapatkan eksplan yang steril dan penanaman di media perlakuan. Media
awal yang digunakan yaitu media MS dengan penambahan 5 mg/l BA, 0.5 mg/l NAA, dan 100 ml/l air kelapa. Setelah satu minggu eksplan yang steril
kemudian disubkultur ke media perlakuan. Eksplan disimpan di ruang kultur selama 12 minggu setelah tanam (MST). Penanaman pada media perlakuan menunjukkan adanya pembentukan dan pertambahan panjang mata tunas (Gambar 4).
(A) (B)
Gambar 4. Tahap Pembentukan Mata Tunas pada Kultur Aglaonema Pride of Sumatera (A) 1 MST dan (B) 12 MST.
Jumlah Eksplan Kontaminasi dan Mati
Kontaminasi dapat disebabkan oleh cendawan dan bakteri (Gambar 5). Kontaminasi oleh cendawan dicirikan dengan adanya benang hifa, sedangkan kontaminasi oleh bakteri dicirikan dengan adanya lapisan lendir di permukaan media (Nurhasanah, 2009).
(A) (B)
Gambar 5. Kontaminasi pada Kultur Aglaonema Pride of Sumatera : (A) Kontaminasi oleh Cendawan (Tanda Panah) dan (B)
Kontaminasi oleh Bakteri (Tanda Panah).
Kontaminasi mulai terlihat pada 1 MST. Sumber kontaminasi merupakan kontaminasi sistemik dari dalam eksplan. Gejala kontaminasi cendawan muncul dari sisi dan bagian atas eksplan, sedangkan gejala kontaminasi bakteri muncul dari bagian bawah eksplan. Kontaminasi juga disebabkan oleh faktor eksternal. Karet penutup botol kultur semakin lama menjadi longgar, sehingga kontaminan dapat masuk ke dalam botol kultur melalui kontak udara. Eksplan yang terkontaminasi cendawan disterilisasi dengan natrium hipoklorit 5% dengan konsentrasi 15% selama 10 menit, dan selanjutnya dengan konsentrasi 10% selama 10 menit. Eksplan kemudian dipindahkan ke media steril.
18
oleh bakteri lebih banyak daripada kontaminasi oleh cendawan, sehingga kontaminasi bakteri tidak disterilkan untuk mencegah kematian eksplan dalam jumlah yang lebih besar.
Persentase kontaminasi rata-rata yang tertinggi yaitu 100% pada 12 MST. Persentase kontaminasi rata-rata terendah yaitu 13% pada 12 MST (Gambar 6).
Keterangan: A = 2,4-D (A1 = 1 mg/l; A2 = 2 mg/l)
B = BAP (B1 = 2 mg/l; B2 = 4 mg/l; B3 = 6 mg/l; B4 = 8mg/l; B5 = 10 mg/l)
Gambar 6. Histogram Persentase Rata-rata Kontaminasi Kultur Per Perlakuan pada Aglaonema Pride of Sumatera Secara In Vitro pada 12 MST.
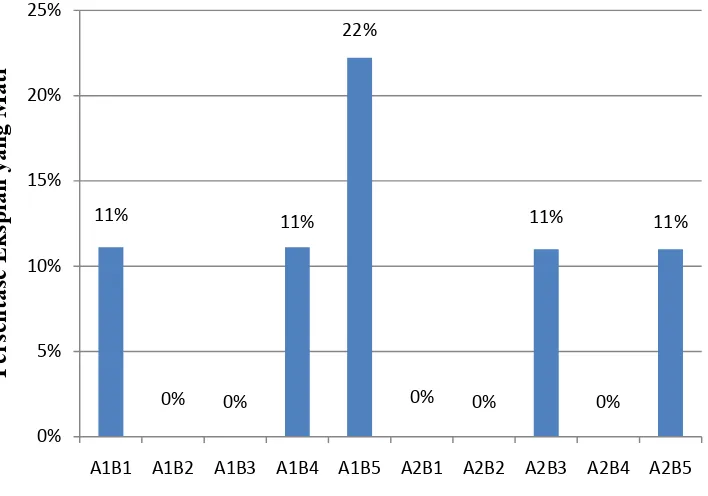
Perbandingan persentase eksplan mati rata-rata disajikan pada Gambar 7. Persentase eksplan mati rata-rata tertinggi yaitu 22%, sedangkan persentase eksplan mati terendah yaitu 0% pada 12 MST. Kematian eksplan terutama karena kontaminasi cendawan dan sterilisasi yang berulang-ulang. Eksplan yang mati yaitu eksplan yang berwarna transparan (vitrous).
Keterangan: A = 2,4-D (A1 = 1 mg/l; A2 = 2 mg/l)
B = BAP (B1 = 2 mg/l; B2 = 4 mg/l; B3 = 6 mg/l; B4 = 8mg/l; B5 = 10 mg/l)
Gambar 7. Histogram Persentase Rata-rata Eksplan Mati Per Perlakuan pada Aglaonema Pride of Sumatera Secara In Vitro pada 12 MST.
Waktu Muncul Mata Tunas
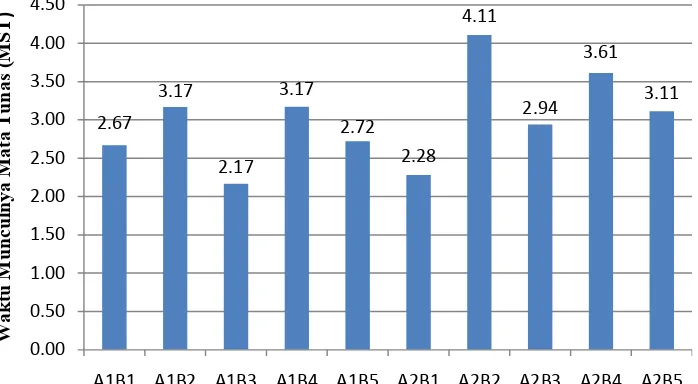
Perlakuan 6 mg/l BAP + 1 mg/l 2,4-D memberikan waktu muncul mata tunas yang paling cepat dengan rata-rata waktu munculnya mata tunas yaitu pada 2.17 MST. Perlakuan 4 mg/l BAP + 2 mg/l 2,4-D memberikan waktu muncul mata tunas yang paling lambat dengan rata-rata waktu munculnya mata tunas yaitu pada 4.11 MST. Siringo ringo (2009) melaporkan bahwa waktu munculnya tunas Anthurium plowmanii tercepat diperoleh pada perlakuan MS + 3 mg/l BAP yaitu 6.6 hari setelah tanam (HST). Rata-rata waktu munculnya mata tunas kultur aglaonema Pride of Sumatera disajikan pada Gambar 8.
20
Keterangan: A = 2,4-D (A1 = 1 mg/l; A2 = 2 mg/l)
B = BAP (B1 = 2 mg/l; B2 = 4 mg/l; B3 = 6 mg/l; B4 = 8mg/l; B5 = 10 mg/l) MST = Minggu Setelah Tanam
Gambar 8. Histogram Pengaruh 2,4-D dan BAP terhadap Rata-rata Waktu Munculnya Mata Tunas Kultur Aglaonema Pride of Sumatera Secara
In Vitro.
Jumlah Mata Tunas
Pembentukan tunas secara in vitro baik melalui morfogenesis langsung ataupun tidak langsung sangat tergantung pada jenis dan konsentrasi yang tepat dari senyawa organik, inorganik, dan zat pengatur tumbuh. Pengaruh sitokinin dalam kultur jaringan tanaman berhubungan dengan proliferasi tunas ketiak, selain itu proliferasi tunas aksilar hanya memerlukan sitokinin yang tinggi tanpa auksin atau auksin dalam konsentrasi yang sangat rendah (Wiendi et al., 1992).
21
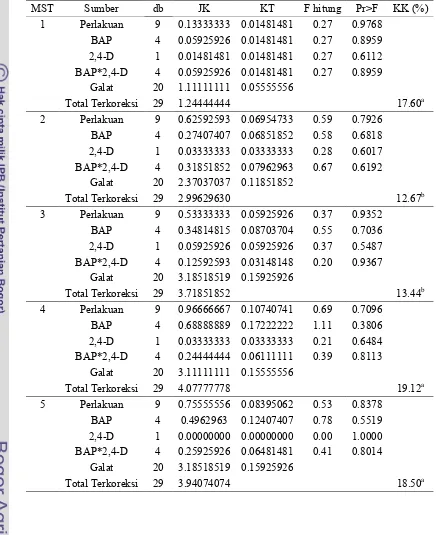
Tabel 2. Rekapitulasi Hasil Uji F Pengaruh BAP, 2,4-D, dan Interaksi BAP dan 2,4-D terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
Umur Eksplan (MST) BAP 2,4-D Perlakuan BAP x 2,4-D KK (%)
Keterangan: tn tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman
MST = Minggu Setelah Tanam a = hasil transformasi √(x+0.5) b = hasil transformasi √(x+1)
Tabel 3. Pengaruh BAP terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
Keterangan : tn tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman
MST = Minggu Setelah Tanam a = hasil transformasi √(x+0.5)
Pengaruh BAP terhadap rata-rata jumlah mata tunas disajikan pada Tabel 3. Sidik ragam pengaruh BAP terhadap rata-rata jumlah mata tunas Perlakuan BAP (mg/l) Rata-rata Jumlah Mata Tunas MST
22
disajikan pada Tabel Lampiran 4. Penambahan BAP tidak berpengaruh nyata terhadap rata-rata jumlah mata tunas. Rata-rata jumlah mata tunas tertinggi pada akhir pengamatan (12 MST) yaitu pada perlakuan 10 mg/l BAP, sedangkan rata-rata jumlah mata tunas terendah yaitu pada perlakuan 6 mg/l BAP. Intania (2005) melaporkan bahwa BAP sangat mempengaruhi pembentukan tunas Alocasia suhirmaniana, tetapi terdapat titik jenuh dalam merespon BAP yaitu pada konsentrasi 2 mg/l (8.88 µM) yang menyebabkan daya multiplikasi menjadi berkurang.
Pengaruh 2,4-D terhadap rata-rata jumlah mata tunas disajikan pada Tabel 4. Sidik ragam pengaruh 2,4-D terhadap rata-rata jumlah mata tunas disajikan pada Tabel Lampiran 4. Hasil analisis menunjukkan perlakuan 2,4-D tidak berpengaruh nyata terhadap rata-rata jumlah mata tunas. Jumlah tunas berbanding lurus dengan jumlah konsentrasi 2,4-D. Rata-rata jumlah mata tunas terbanyak pada 12 MST yaitu pada perlakuan 2 mg/l 2,4-D. Rata-rata jumlah mata tunas tiap perlakuan bertambah setiap minggu, kecuali pada 10 MST. Turunnya rata-rata jumlah mata tunas disebabkan oleh kematian eksplan.
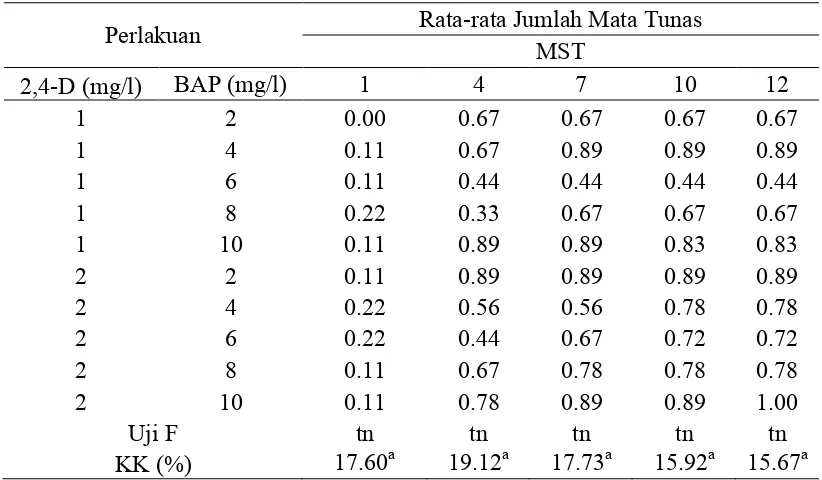
Tabel 4. Pengaruh 2,4-D terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
Perlakuan 2,4-D (mg/l) Rata-rata Jumlah Mata Tunas MST
1 4 7 10 12
1 0.11 0.60 0.71 0.70 0.70
2 0.16 0.67 0.76 0.81 0.83
Uji F tn tn tn tn tn
KK (%) 17.60a 19.12a 17.73a 15.92a 15.67a
Keterangan : tn tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman
MST = Minggu Setelah Tanam a = hasil transformasi √(x+0.5)
23
jumlah mata tunas terbanyak diperoleh pada perlakuan 10 mg/l BAP + 2 mg/l 2,4-D yaitu 1 mata tunas pada 12 MST, sedangkan rata-rata jumlah mata
tunas paling sedikit diperoleh pada perlakuan 6 mg/l BAP + 1 mg/l 2,4-D yaitu 0.44 mata tunas. Menurut Tourte (2005) kombinasi antara konsentrasi auksin yang rendah dengan konsentrasi sitokinin yang tinggi dapat merangsang proliferasi tunas aksilar.
Tabel 5. Pengaruh Interaksi BAP dan 2,4-D terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
Perlakuan Rata-rata Jumlah Mata Tunas MST
2,4-D (mg/l) BAP (mg/l) 1 4 7 10 12
Keterangan : tn tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman
MST = Minggu Setelah Tanam a = hasil transformasi √(x+0.5)
Panjang Mata Tunas
24
berpengaruh nyata terhadap rata-rata panjang mata tunas. Interaksi BAP dan 2,4-D tidak berpengaruh nyata terhadap rata-rata panjang mata tunas.
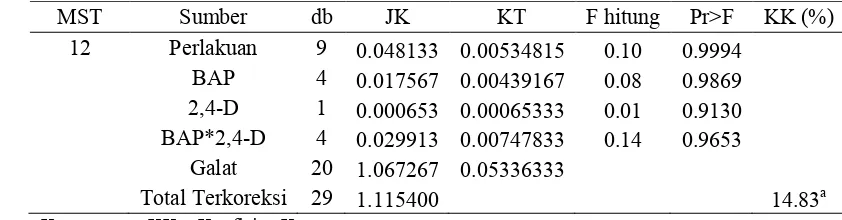
Tabel 6. Rekapitulasi Hasil Uji F Pengaruh BAP, 2,4-D, dan Interaksi BAP dan 2,4-D terhadap Rata-rata Panjang Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
Umur Eksplan (MST) BAP 2,4-D Perlakuan BAP x 2,4-D KK (%)
12 tn tn tn 14.83a
Keterangan : tn tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman
MST = Minggu Setelah Tanam a = hasil transformasi √(x+0.5)
Tabel 7 menunjukkan pengaruh BAP terhadap rata-rata panjang mata tunas. Sidik ragam pengaruh BAP terhadap rata-rata panjang mata tunas disajikan pada Tabel Lampiran 5. Perlakuan BAP tidak berpengaruh nyata terhadap rata-rata panjang mata tunas. Perlakuan 10 mg/l BAP menghasilkan rata-rata-rata-rata panjang mata tunas tertinggi yaitu 0.33 cm. Penelitian induksi organogenesis tanaman
Anthurium andreanum secara in vitro oleh Syara (2006) menunjukkan bahwa penggunaan BAP dengan konsentrasi yang lebih tinggi (2.0 mg/l) menghasilkan tanaman tertinggi yaitu 1.03 cm, dibandingkan dengan tanpa BAP yaitu 0.89 cm.
Tabel 7. Pengaruh BAP terhadap Rata-rata Panjang Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
Perlakuan BAP (mg/l) Rata-rata Panjang Mata Tunas pada 12 MST (cm)
2 0.28
Keterangan : tn tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman
25
Pengaruh 2,4-D terhadap rata-rata panjang mata tunas disajikan pada Tabel 8. Sidik ragam pengaruh 2,4-D terhadap rata-rata panjang mata tunas disajikan pada Tabel Lampiran 5. Perlakuan 2,4-D tidak berpengaruh nyata terhadap rata-rata panjang mata tunas. Rata-rata panjang mata tunas tertinggi didapat pada perlakuan 2 mg/l 2,4-D yaitu 0.29 cm. Hasil analisis menunjukkan peningkatan konsentrasi 2,4-D menghasilkan mata tunas yang lebih panjang.
Tabel 8. Pengaruh 2,4-D terhadap Rata-rata Panjang Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
Perlakuan 2,4-D (mg/l) Rata-rata Panjang Mata Tunas pada 12 MST (cm)
1 0.28
2 0.29
Uji F tn
KK (%) 14.83a
Keterangan : tn tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman
MST = Minggu Setelah Tanam a = hasil transformasi √(x+0.5)
Tabel 9. Pengaruh Interaksi BAP dan 2,4-D terhadap Rata-rata Panjang Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
Perlakuan Rata-rata Panjang Mata Tunas pada 12 MST (cm) 2,4-D (mg/l) BAP (mg/l)
Keterangan : tn tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman
26
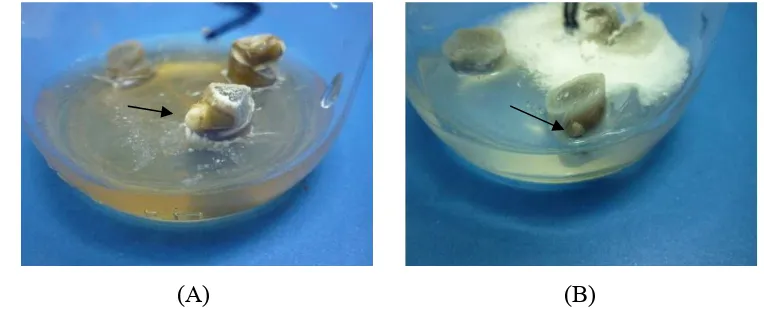
Pengaruh interaksi antara BAP dan 2,4-D terhadap rata-rata panjang mata tunas dapat dilihat pada Tabel 9. Sidik ragam pengaruh interaksi antara BAP dan 2,4-D terhadap rata-rata panjang mata tunas disajikan pada Tabel Lampiran 5. Interaksi antara BAP dan 2,4-D tidak memberikan pengaruh nyata terhadap rata-rata panjang mata tunas. Perlakuan 10 mg/l BAP + 2 mg/l 2,4-D menghasilkan
rata-rata panjang mata tunas tertinggi yaitu 0.38 cm, sedangkan perlakuan 4 mg/l BAP + 2 mg/l 2,4-D menghasilkan rata-rata panjang mata tunas terendah
(Gambar 9).
(A) (B)
Gambar 9. Eksplan Aglaonema Pride of Sumatera pada Perlakuan 10 mg/l BAP + 2 mg/l 2,4-D dengan Panjang Mata Tunas Tertinggi (A) dan pada Perlakuan 4 mg/l BAP + 2 mg/l 2,4-D dengan Panjang Mata Tunas Terendah (B) pada 12 MST.
Kelemahan pada penelitian ini adalah proses sterilisasi yang lama yaitu direndam selama 24 jam di dalam larutan fungisida, bakterisida, dan antibiotik. Hal ini menyebabkan bagian bawah tanaman menjadi busuk dan mudah terkontaminasi bakteri.
KESIMPULAN DAN SARAN
Kesimpulan
Perlakuan BAP, 2,4-D, dan interaksi antara BAP dan 2,4-D tidak berpengaruh nyata terhadap pertumbuhan mata tunas aksilar tanaman aglaonema
Pride of Sumatera. Perlakuan terbaik pada penelitian ini yaitu perlakuan 10 mg/l BAP + 2 mg/l 2,4-D karena menghasilkan jumlah dan panjang mata tunas
aksilar tertinggi. Penelitian ini belum berhasil menginduksi munculnya tunas tanaman aglaonema Pride of Sumatera sampai pada minggu ke-12 setelah eksplan dikulturkan.
Saran
Perlu dicari metode sterilisasi yang lebih baik untuk menghindari tingkat kontaminasi yang tinggi. Perlu adanya percobaan lanjutan mengenai kombinasi zat pengatur tumbuh dan media yang lebih efisien dalam pertumbuhan dan induksi mata tunas aksilar aglaonema.
DAFTAR PUSTAKA
Davies, P.J. 1995. The plant hormone: their nature occurrence and functions. p. 1-38. In P.J. Davies (Ed.). Plant Hormone: Physiology, Biochemistry, and Molecular Biology, 2nd Edition. Kluwer Academic Publishers. Netherlands.
Djojokusumo, P. 2006. Aglaonema Spektakuler. PT. AgroMedia Pustaka. Jakarta. 148 hal.
Enggaringati, L. 2006. Pengaruh Sitokinin dan Auksin terhadap Multiplikasi Nenas (Ananas comosus (L) Merr.) CV. Smooth Cayenne Secara In Vitro. Skripsi. Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Bogor. 25 hal.
Gunawan, L.W. 1987. Teknik Kultur Jaringan. Pusat Antar Universitas. Institut Pertanian Bogor. Bogor. 252 hal.
_____________. 1988. Teknik Kultur Jaringan Tumbuhan. Pusat Antar Universitas. Institut Pertanian Bogor. Bogor. 304 hal.
_____________. 1992. Teknik Kultur Jaringan Tumbuhan. Pusat Antar Universitas. Institut Pertanian Bogor. Bogor. 165 hal.
_____________. 1992. Pendahuluan. Hal. 7. Dalam Tim Laboratorium Kultur Jaringan Tanaman (Eds.). Bioteknologi Tanaman. Pusat Antar Universitas. Bogor. 309 hal.
Hartmann, H.T. and L.P.J. Kester. 1983. Plant Propagation, Principles, and Practice. Pretice-Hall, Inc. New Jersey. 727 p.
Intania. 2005. Pengaruh Sitokinin (BAP), Air Kelapa, dan Media terhadap Pertumbuhan dan Multiplikasi Alocasia suhirmaniana Secara In Vitro. Skripsi. Departemen Budidaya Pertanian. Fakultas Pertanian. Institut Pertanian Bogor. Bogor. 45 hal. Purwanto (Ed.). Aglaonema, Pesona Kecantikan Sang Ratu Daun. Kanisius. Yogyakarta.
Nurhasanah, E. 2009. Perbanyakan Anggrek Grammatophyllum scriptum
Melalui Proliferasi Tunas Adventif Secara In Vitro. Skripsi. Program Studi Hortikultura. Fakultas Pertanian. Institut Pertanian Bogor. Bogor. 49 hal.
Pierik, R.M.L. 1987. In Vitro Culture of Higher Plant. Marthinus Mijhoff Pub. Nederland. 344 p.
Pratiwi, R.R. 2009. Pengaruh Konsentrasi Air Kelapa dan BA terhadap Organogenesis Anthurium Gelombang Cinta (Anthurium plowmanii) Secara In Vitro. Skripsi. Program Studi Hortikultura. Departemen Agronomi dan Hortikultura. Departemen Pertanian. Institut Pertanian Bogor. Bogor. 56 hal.
Prihatmanti, D. 2002. Penggunaan Zat Pengatur Tumbuh NAA dan BAP serta Air Kelapa untuk Menginduksi Organogenesis Tanaman Anthurium (Anthurium andraeanum Linden ex André). Skripsi. Jurusan Budidaya Pertanian. Fakultas Pertanian. Institut Pertanian Bogor. Bogor. 32 hal.
30
Siringo ringo, R.C.H. 2009. Penggunaan Komposisi Media Dasar dan BAP untuk Induksi Organogenesis Athurium Wave of Love (Anthurium plowmanii) Secara In Vitro. Skripsi. Program Studi Pemuliaan Tanaman dan Teknologi Benih. Fakultas Pertanian. Institut Pertanian Bogor. Bogor. 52 hal.
Steward, F.C. and S.M. Caplin. 1951. A tissue culture from potato tuber: the synergistic action of 2,4-D and of coconut milk. Science 111:518-520.
Syara, S. 2006. Penggunaan IAA dan BAP untuk Menstimulasi Organogenesis Tanaman Anthurium andreanum dalam Kultur In Vitro. Skripsi. Program Studi Hortikultura. Fakultas Pertanian. Institut Pertanian Bogor. 2006. 42 hal.
Tourte, Y. 2005. Genetic Engineering and Biotechnology : Concepts, Methods, and Agronomic Applications. Science Publishers, Inc. USA. 199 p.
Tukey, H.B. 1954. Plant Regulators in Agriculture. John Wiley and Sons, Inc. New York. 268 p.
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas. Institut Pertanian Bogor. Bogor. 247 hal.
Wetherell, D.F. 1982. Pengantar Propagasi Tanaman Secara In Vitro. Terjemahan dari : Introduction to In Vitro Propagation. Penerjemah : Koesoemardiyah. IKIP Semarang Press. Semarang. 110 hal.
Wiendi, N.M.A., G.A. Wattimena, dan L.W. Gunawan. 1992. Perbanyakan tanaman. Hal. 17-77. Dalam Tim Laboratorium Kultur Jaringan Tanaman (Eds.). Bioteknologi Tanaman. Pusat Antar Universitas. Bogor. 309 hal.
32
Tabel Lampiran 1. Komposisi Media Murashige dan Skoog yang Digunakan di dalam Penelitian Induksi Mata Tunas Aksilar Aglaonema Secara In Vitro.
Tabel Lampiran 2. Persentase Kontaminasi Kultur Rata-rata Per Perlakuan pada Aglaonema Pride of Sumatera Secara In Vitro.
Perlakuan 1 4 MST 7 10 12 Aglaonema Pride of Sumatera Secara In Vitro.
34
Tabel Lampiran 4. Sidik Ragam Pengaruh BAP, 2,4-D, dan Interaksi BAP dan 2,4-D terhadap Rata-rata Jumlah Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
MST Sumber db JK KT F hitung Pr>F KK (%)
1 Perlakuan 9 0.13333333 0.01481481 0.27 0.9768
BAP 4 0.05925926 0.01481481 0.27 0.8959 2,4-D 1 0.01481481 0.01481481 0.27 0.6112 BAP*2,4-D 4 0.05925926 0.01481481 0.27 0.8959
Galat 20 1.11111111 0.05555556
Total Terkoreksi 29 1.24444444 17.60a
2 Perlakuan 9 0.62592593 0.06954733 0.59 0.7926
BAP 4 0.27407407 0.06851852 0.58 0.6818 2,4-D 1 0.03333333 0.03333333 0.28 0.6017 BAP*2,4-D 4 0.31851852 0.07962963 0.67 0.6192
Galat 20 2.37037037 0.11851852
Total Terkoreksi 29 2.99629630 12.67b
3 Perlakuan 9 0.53333333 0.05925926 0.37 0.9352
BAP 4 0.34814815 0.08703704 0.55 0.7036 2,4-D 1 0.05925926 0.05925926 0.37 0.5487 BAP*2,4-D 4 0.12592593 0.03148148 0.20 0.9367
Galat 20 3.18518519 0.15925926
Total Terkoreksi 29 3.71851852 13.44b
4 Perlakuan 9 0.96666667 0.10740741 0.69 0.7096
BAP 4 0.68888889 0.17222222 1.11 0.3806 2,4-D 1 0.03333333 0.03333333 0.21 0.6484 BAP*2,4-D 4 0.24444444 0.06111111 0.39 0.8113
Galat 20 3.11111111 0.15555556
Total Terkoreksi 29 4.07777778 19.12a
5 Perlakuan 9 0.75555556 0.08395062 0.53 0.8378
BAP 4 0.4962963 0.12407407 0.78 0.5519
2,4-D 1 0.00000000 0.00000000 0.00 1.0000 BAP*2,4-D 4 0.25925926 0.06481481 0.41 0.8014
Galat 20 3.18518519 0.15925926
Lanjutan..
6 Perlakuan 9 0.68518519 0.07613169 0.49 0.8646
BAP 4 0.37037037 0.09259259 0.60 0.6702
2,4-D 1 0.00370370 0.00370370 0.02 0.8789 BAP*2,4-D 4 0.31111111 0.07777778 0.50 0.7360
Galat 20 3.11111111 0.15555556
Total Terkoreksi 29 3.79629630 18.22a
7 Perlakuan 9 0.68148148 0.07572016 0.51 0.8494
BAP 4 0.34814815 0.08703704 0.59 0.6754
2,4-D 1 0.01481481 0.01481481 0.10 0.7551 BAP*2,4-D 4 0.31851852 0.07962963 0.54 0.7099
Galat 20 2.96296296 0.14814815
Total Terkoreksi 29 3.64444444 17.73a
8 Perlakuan 9 0.58403000 0.06489222 0.52 0.8455
BAP 4 0.39698000 0.09924500 0.79 0.5453
2,4-D 1 0.06075000 0.06075000 0.48 0.4948 BAP*2,4-D 4 0.12630000 0.03157500 0.25 0.9054
Galat 20 2.51266667 0.12563333
Total Terkoreksi 29 3.09669667 15.96a
9 Perlakuan 9 0.52222222 0.05802469 0.46 0.8838
BAP 4 0.29074074 0.07268519 0.58 0.6825
2,4-D 1 0.09259259 0.09259259 0.74 0.4013 BAP*2,4-D 4 0.13888889 0.03472222 0.28 0.8902
Galat 20 2.51851852 0.12592593
Total Terkoreksi 29 3.04074074 15.92a
10 Perlakuan 9 0.52222222 0.05802469 0.46 0.8838
BAP 4 0.29074074 0.07268519 0.58 0.6825
2,4-D 1 0.09259259 0.09259259 0.74 0.4013 BAP*2,4-D 4 0.13888889 0.03472222 0.28 0.8902
Galat 20 2.51851852 0.12592593
36
Lanjutan..
11 Perlakuan 9 0.52222222 0.05802469 0.46 0.8838
BAP 4 0.29074074 0.07268519 0.58 0.6825
2,4-D 1 0.09259259 0.09259259 0.74 0.4013 BAP*2,4-D 4 0.13888889 0.03472222 0.28 0.8902
Galat 20 2.51851852 0.12592593
Total Terkoreksi 29 3.04074074 15.92a
12 Perlakuan 9 0.64444444 0.07160494 0.59 0.7934
BAP 4 0.37592593 0.09398148 0.77 0.5580
2,4-D 1 0.13333333 0.13333333 1.09 0.3087 BAP*2,4-D 4 0.13518519 0.03379630 0.28 0.8897
Galat 20 2.44444444 0.12222222
Total Terkoreksi 29 3.08888889 15.67a
Keterangan : KK = Koefisien Keragaman a = hasil transformasi √(x+0.5) b = hasil transformasi √(x+1)
Tabel Lampiran 5. Sidik Ragam Pengaruh BAP, 2,4-D, dan Interaksi BAP dan 2,4-D terhadap Rata-rata Panjang Mata Tunas Kultur Aglaonema Pride of Sumatera Secara In Vitro.
MST Sumber db JK KT F hitung Pr>F KK (%)
12 Perlakuan 9 0.048133 0.00534815 0.10 0.9994 BAP 4 0.017567 0.00439167 0.08 0.9869 2,4-D 1 0.000653 0.00065333 0.01 0.9130 BAP*2,4-D 4 0.029913 0.00747833 0.14 0.9653
Galat 20 1.067267 0.05336333
Total Terkoreksi 29 1.115400 14.83a
LIMAS AGUNG. Induction of Aglaonema Pride of Sumatera Axillary Bud Proliferation In Vitro by BAP and 2,4-D Plant Growth Hormones.
The research aimed to study the effect of plant growth regulator (BAP and 2,4-D) on the shoot bud growth of aglaonema Pride of Sumatera using axillary bud explant in vitro. This research was conducted from February 2010 to March 2011 at Laboratory of Plant Tissue Culture, Department of Agronomy and Horticulture IPB, Bogor. Completely Randomized Block Design was used in this research. The research consisted of two factors and three replications. The first factor is 2,4-D with two concentrations are 1 and 2 mg/l. The second factor is BAP with five concentrations are 2, 4, 6, 8, and 10 mg/l. The result showed that the treatment of BAP, 2,4-D, and the interaction between them are not
significantly affected the number and the length of buds. The treatment of 6 mg/l BAP + 1 mg/l 2,4-D gave the fastest growth of shoot bud, that was 2.17
RINGKASAN
LIMAS AGUNG. Induksi Pertumbuhan Mata Tunas Aksilar Aglaonema Pride of Sumatera Secara In Vitro Melalui Penambahan BAP dan 2,4-D. (Dibimbing oleh NI MADE ARMINI WIENDI).
Penelitian ini bertujuan untuk mempelajari pengaruh zat pengatur tumbuh BAP dan 2,4-D terhadap pertumbuhan mata tunas aksilar aglaonema Pride of Sumatera secara in vitro. Media dasar yang digunakan yaitu media MS (Murashige & Skoog). Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, Bogor pada bulan Februari 2010 hingga Maret 2011.
Penelitian ini menggunakan perlakuan faktorial disusun dalam rancangan lingkungan acak lengkap dengan dua faktor. Faktor pertama yaitu perlakuan 2,4-D dengan konsentrasi 1 dan 2 mg/l. Faktor kedua yaitu perlakuan BAP dengan konsentrasi 2, 4, 6, 8, dan 10 mg/l. Penelitian ini terdiri dari 10 kombinasi perlakuan dengan tiga ulangan untuk masing-masing kombinasi perlakuan, sehingga terdapat 30 satuan percobaan. Setiap satu satuan percobaan terdiri dari satu botol kultur dengan tiga buah eksplan per botol kultur, sehingga terdapat 90 satuan amatan. Bahan tanaman yang digunakan yaitu mata tunas batang tanaman aglaonema Pride of Sumatera yang memiliki delapan sampai 10 lembar daun.
Persentase eksplan aglaonema Pride of Sumatera yang terkontaminasi pada penelitian ini termasuk tinggi. Persentase kontaminasi rata-rata yang tertinggi yaitu 100% pada 12 MST, sedangkan persentase kontaminasi rata-rata terendah yaitu 13% pada 12 MST. Persentase eksplan mati rata-rata tertinggi, yaitu 22% pada 12 MST. Kematian eksplan terutama karena kontaminasi cendawan dan sterilisasi yang berulang-ulang. Perlakuan 6 mg/l BAP + 1 mg/l 2,4-D memberikan waktu muncul tunas rata-rata yang paling cepat yaitu pada 2.17 MST.
PENDAHULUAN
Latar Belakang
Aglaonema adalah satu dari banyak spesies tanaman hias daun yang sudah dikenal cukup lama. Orang yang pertama kali menyilangkan aglaonema warna hijau putih menjadi merah ungu adalah Gregory Hambali dari Bogor, Jawa Barat. Gregory mulai menyilangkan A. comutatum tricolor x A. rotundum pada sekitar tahun 1980 dan hasilnya baru dikeluarkan sekitar tahun 1988 dengan nama aglaonema Pride of Sumatera (Djojokusumo, 2006). Sejak ditemukannya aglaonema Pride of Sumatera, aglaonema mulai dikembangkan. Nilai ekonomi tanaman hias daun terletak pada estetikanya yaitu pada bentuk daun, jumlah daun, dan warna daun yang ditentukan oleh keragaman genetiknya. Daya tarik aglaonema terletak pada keindahan daun dan warnanya.
Aglaonema merupakan tanaman yang mudah dirawat dan diperbanyak. Cara perbanyakan aglaonema pada umumnya dengan biji atau dengan perbanyakan secara vegetatif berupa stek, pemisahan anakan, dan pencangkokan. Perbanyakan dengan stek merupakan cara yang paling banyak dilakukan karena cara ini mudah dan cepat menghasilkan anakan baru. Akan tetapi, kendala perbanyakan dengan stek di lapangan terbuka yaitu serangan patogen, sehingga tanaman tidak dapat berkembang dengan baik atau mati.
Seiring dengan permintaan bibit aglaonema yang semakin meningkat, cara perbanyakan secara konvensional menggunakan stek, anakan, dan cangkok tidak lagi bisa mencukupi kebutuhan akan bibit. Alternatif cara perbanyakan yang sanggup memenuhi permintaan bibit dalam jumlah besar yaitu dengan kultur jaringan (Purwanto, 2006). Perbanyakan tanaman secara kultur jaringan atau
dihasilkan benar-benar serupa dengan tanaman induk. Metode ini disebut juga sebagai perbanyakan klonal.
Literatur menunjukkan bahwa komposisi media dan zat pengatur tumbuh yang dibutuhkan pada umumnya berbeda antar spesies, antar klon, atau varietas dalam satu spesies (Enggaringati, 2006). Hartmann dan Kester (1983) menyatakan bahwa zat pengatur tumbuh yang digunakan dalam kultur jaringan adalah auksin dan sitokinin. Kedua zat ini berpengaruh dalam pembentukan akar, tunas, dan kalus. Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel secara endogen menentukan arah perkembangan suatu kultur.
Pada perbanyakan anthurium (Anthurium andraeanum Linden ex André) secara in vitro, yang merupakan tanaman satu famili dengan aglaonema, eksplan yang digunakan berupa daun dari hasil perkecambahan benih secara in vitro. Zat pengatur tumbuh yang digunakan yaitu air kelapa, NAA, dan BAP. Hasil penelitian menunjukkan persentase eksplan yang mati setelah mengering sebesar 78.3%, persentase eksplan yang mati karena browning sebesar 14.72%, dan sisanya eksplan yang hidup. Eksplan yang hidup menunjukkan organogenesis tunas, daun, dan akar melalui kalus (Prihatmanti, 2002).
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh BAP dan 2,4-D dalam menginduksi pertumbuhan mata tunas aksilar tanaman aglaonema Pride of Sumatera secara in vitro.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini yaitu:
3
2. Zat pengatur tumbuh 2,4-D berpengaruh nyata terhadap pertumbuhan mata tunas aksilar tanaman aglaonema Pride of Sumatera.
Aglaonema sp.
Aglaonema disebut juga sri rejeki atau chinese evergreen merupakan tanaman hias daun dari suku talas-talasan atau Araceae. Genus Aglaonema berjumlah sekitar 30 spesies. Menurut Lawrence (1959), klasifikasi tanaman aglaonema adalah sebagai berikut:
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Monocotyledoneae Ordo : Araceales
Famili : Araceae Genus : Aglaonema
Spesies : Aglaonema costatum Aglaonema commutatum Aglaonema hospitum Aglaonema crispum.
Nama aglaonema berasal dari bahasa Yunani, yaitu aglaos yang bermakna terang atau sinar, dan nema yang bermakna benang (benang sari). Jika digabungkan artinya menjadi helaian benang yang bersinar terang. Di Thailand, aglaonema dikenal dengan nama siamese rainbow, sedangkan di Malaysia lebih dikenal dengan nama good luck (Junaedhie, 2006).
5
termasuk bunga majemuk dan tergolong bunga tongkol (spandix). Pada tongkol, bunga jantan terletak di bagian atas, sedangkan bunga betina pada bagian bawah (Purwanto, 2006).
Suhu ideal bagi aglaonema pada siang hari adalah sekitar 30° C dan pada malam hari sekitar 23° C. Tanaman aglaonema tumbuh lebih cepat di dataran rendah karena suhu udara lebih hangat dan matahari bersinar lebih lama, sehingga fotosintesis lebih banyak. Pertumbuhan satu helai daun aglaonema memerlukan waktu sekitar 25 hari. Aglaonema membutuhkan naungan dengan pencahayaan terbatas (10 – 30%). Kelembaban yang sesuai bagi aglaonema yaitu 50 – 60% (Djojokusumo, 2006).
Kultur Jaringan dan Media Kultur Jaringan
Kultur jaringan adalah suatu metode untuk mengisolasi bagian-bagian tanaman seperti sel, protoplasma, jaringan, organ serta menumbuhkannya dalam kondisi yang aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali. Keberhasilan penerapan teknik kultur jaringan dipengaruhi oleh keberhasilan studi regenerasi dari jaringan yang ditanam. Ada juga yang menyebutnya sebagai kultur in vitro. Kultur in vitro
adalah kultur di dalam wadah gelas (Gunawan, 1992).
Kultur in vitro memerlukan beberapa komponen utama yaitu bahan awal, media yang sesuai, dan tempat kultivasi. Bahan awal yang digunakan untuk kultur
in vitro tanaman bermacam-macam, antara lain batang, daun, tunas apikal, tunas aksilar, petiol, anter, polen, petal, ovul, akar, dan lain-lain. Bagian tanaman yang digunakan sebagai bahan awal kultur in vitro disebut sebagai eksplan (Yuwono, 2008).
Komposisi media yang digunakan pada kultur jaringan tergantung dari jenis tanaman yang akan diperbanyak. Wetherell (1982) menyatakan bahwa salah satu formulasi yang sering dipakai sebagai media kultur adalah Murashige-Skoog (MS). Formulasi hara mineral dari MS dapat digunakan untuk sejumlah besar spesies tanaman pada propagasi secara in vitro.
Menurut Gunawan (1987) selain golongan persenyawaan organik yang konstitusinya jelas, media kultur jaringan juga kadang-kadang ditambahkan persenyawaan yang kompleks. Salah satu persenyawaan yang dimaksud adalah air kelapa. Penelitian yang lebih mendalam menemukan bahwa efek air kelapa pada pertumbuhan menjadi lebih baik bila dalam media juga diberikan auksin. Auksin tertentu dan air kelapa dapat bersifat sinergis. Steward dan Caplin (1951) mendapatkan bahwa antara 2,4-D dan air kelapa terjadi reaksi sinergistik yang memacu pertumbuhan kalus Daucus carota. Tetapi tidak semua auksin dan air kelapa mempunyai kerja sama yang sinergis. Menurut Wattimena (1988) air kelapa telah lama diketahui sebagai sumber yang kaya akan zat-zat aktif yang diperlukan untuk perkembangan embrio. Salah satu zat aktif tersebut adalah sitokinin endogen. Pada air kelapa dapat dilihat suatu interaksi antara sitokinin dengan fitohormon lainnya di dalam proses perkembangan embrio itu.
Zat Pengatur Tumbuh
Zat pengatur tumbuh adalah senyawa organik bukan nutrisi yang dalam jumlah kecil dapat merangsang, menghambat, atau memodifikasi proses-proses fisiologis dalam tanaman (Tukey, 1954).