RUMEN DENGAN PEMBERIAN DAUN KERSEN
(Muntingia calabura) SECARA IN VITRO
SKRIPSI
IDE RISENTITO PUSPITANING
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
IDE RISENTITO PUSPITANING. D24080097. 2012. Populasi Protozoa dan Karakteristik Fermentasi Rumen dengan Pemberian Daun Kersen (Muntingia calabura) secara In Vitro. Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Sri Suharti, S.Pt. M.Si.
Pembinmbing Anggota : Dr. Anuraga Jayanegara, S.Pt. M.Sc.
Daun kersen (Muntingia calabura) memiliki kandungan saponin yang cukup tinggi sehingga dapat dimanfaatkan sebagai agen defaunasi protozoa yang dapat meningkatkan efisiensi fermentasi rumen. Penyebarannya yang luas yang mudah ditemukan pada berbagai kondisi lahan termasuk lahan marginal, menjadikan tumbuhan ini sangat potensial untuk dimanfaatkan sebagai pakan ternak. Penelitian ini bertujuan untuk menganalisis kandungan fitokimia daun kersen yang meliputi senyawa tanin dan saponin serta mengevaluasi dosis daun kersen yang tepat dan sesuai untuk mengoptimalkan fermentasi rumen.
Rancangan yang digunakan pada penelitian ini adalah Rancangan Acak Kelompok (RAK) dengan 5 taraf perlakuan dan 4 kelompok sebagai ulangan. dengan Uji Jarak Duncan. Analisis data dilakukan menggunakan software statistik SPSS versi 16.
Hasil analisis fitokimia menunjukkan bahwa daun kersen memiliki kandungan saponin 10,28% dan tanin 1,41%. Hasil analisis ragam menunjukkan bahwa penggunaan daun kersen pada ransum tidak nyata (P>0,05) mempengaruhi nilai pH rumen dan populasi protozoa. Konsentrasi NH3 menurun sangat nyata
(P<0,01), namun produksi VFA meningkat sangat nyata (P<0,01). Kecernaan bahan kering dan bahan organik menurun secara nyata (P<0,05). Penggunaan tepung daun kersen sampai level 20% dapat menurunkan kecernaan bahan kering, kecernaan bahan organik, dan konsentrasi NH3 serta mampu meningkatkan produksi VFA total,
namun belum efektif dalam penekanan populasi protozoa dengan waktu inkubasi 4 jam secara in vitro.
Protozoal Population and Rumen Fermentation Characteristics of Diet with Muntingia calabura Leaves Addition In Vitro
Puspitaning, I. R., S. Suharti, and A. Jayanegara
The exotic tree Muntingia calabura L. (MCL), is a fast-growing tree that contains secondary metabolite compounds such as saponins and tannins. Saponins and tannins has potency to improve rumen fermentation. An in vitro study was conducted to determine the effect of MCL supplementation on protozoal population and fermentation characteristics. Randomized complete block design was applied to this research by using 5 treatments with 4 replications for each treatment. The treatments were: R0: 30% concentrate (C) + 70% forage (F); R1: 30% C + 65% F + 5% MCL; R2: 30% C + 60% F + 10% MCL; R3: 30% C + 55% F + 15% MCL; R4: 30% C + 50% F + 20% MCL. Variables observed were pH, protozoal population, N-NH3 and
total volatile fatty acid(VFA) production, dry matter and organic matter digestibility. Data were analyzed using analysis of variance (ANOVA). The results showed that the addition of MCL up to 20% in the ration did not affect (P>0.05) pH and protozoal population. Amonia-N concentration decreased (P<0.01) and total VFA increased (P<0.01) when MCL was included. In vitro dry matter and organic matter digestibility decreased (P<0.05) with MCL addition. In conclusion, addition of MCL powder up to 20% from total diet could decrease in vitro dry matter and organic matter digestibility, amonia-N concentration, and increase total VFA production, but did not effective to decrease protozoal population in 4 h incubation in vitro.
RUMEN DENGAN PEMBERIAN DAUN KERSEN
(Muntingia calabura) SECARA IN VITRO
IDE RISENTITO PUSPITANING D24080097
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
Daun Kersen (Muntingia calabura) secara In Vitro
Nama : Ide Risentito Puspitaning
NIM : D24080097
Menyetujui,
Pembimbing Utama,
(Dr. Sri Suharti, S.Pt.M.Si) NIP: 19741012 200501 2 002
Pembimbing Anggota,
(Dr. Anuraga Jayanegara, S.Pt.M.Sc) NIP: 19830602 200501 1 001
Mengetahui Ketua Departemen,
Ilmu Nutrisi dan Teknologi Pakan
(Dr. Ir. Idat Galih Permana, M.Sc.Agr) NIP: 19670506 199103 1 001
Penulis dilahirkan pada tanggal 26 September 1990
di Pati, Jawa Tengah. Penulis adalah anak pertama dari
dua bersaudara dari pasangan Bapak Lis Indrianto dan Ibu
Eri Lestari Muryani.
Penulis mengawali pendidikan dasar pada tahun
1996 di Sekolah Dasar Negeri Pati Lor 04 dan diselesaikan
pada tahun 2002. Pendidikan lanjutan tingkat pertama
dimulai pada tahun 2002 dan diselesaikan pada tahun 2005
di Sekolah Lanjutan Tingkat Pertama Negeri 2 Pati.
Penulis melanjutkan pendidikan di Sekolah Menengah Atas Negeri 3 Pati pada tahun
2005 dan diselesaikan pada tahun 2008.
Penulis diterima sebagai mahasiswa Departemen Ilmu Nutrisi dan Teknologi
Pakan, Fakultas Peternakan, Institut Pertanian Bogor pada tahun 2008 melalui jalur
Undangan Seleksi Masuk IPB (USMI). Penulis aktif dalam Unit Kegiatan
Mahasiswa Uni Konservasi Fauna (UKF) sebagai staf Konservasi Eksitu (periode
2009-2011) dan sekretaris bidang Sosial Lingkungan (periode 2010-2011). Penulis
juga aktif dalam organisasi Himpunan Mahasiswa Nutrisi dan Makanan Ternak
(HIMASITER) sebagai staf Kewirausahaan (periode 2009-2011), Kelompok Pecinta
Alam Fakultas Peternakan (KEPAL-D) dan Organisasi Mahasiswa Daerah Ikatan
Keluarga Mahasiswa Pati (IKMP). Penulis pernah mengikuti kegiatan magang di
Internasional Animal Rescue (IAR) Bogor dan Taman Margasatwa Ragunan Jakarta
pada tahun 2010, serta mengikuti kegiatan magang di Balai Embrio Ternak (BET)
Bogor pada tahun 2011. Karya tulis dari penulis yang pernah dipublikasikan adalah
Prosiding Seminar Nasional Uni Konservasi Fauna 2011 dengan judul Konservasi
Raptor sebagai Salah Satu Potensi Ekowisata.
Bogor, Juli 2012
Ide Risentito Puspitaning
Bissmillahirrahmannirrahim.
Puji syukur penulis panjatkan kehadirat Allah SWT karena atas rahmat,
karunia serta ridho-Nya penyusunan skripsi ini dapat terselesaikan dengan baik.
Skripsi yang berjudul “Populasi Protozoa dan Karakteristik Fermentasi Rumen dengan Pemberian Daun Kersen (Muntingia calabura) secara In Vitro” merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan, Institut Pertanian Bogor.
Tujuan penulisan skripsi ini yaitu untuk menganalisis kandungan fitokimia
daun kersen yang meliputi senyawa tanin dan saponin serta mengevaluasi dosis daun
kersen yang tepat dan sesuai untuk mengoptimalkan fermentasi rumen secara in
vitro. Penelitian ini dilaksanakan dari bulan Maret sampai Mei 2012. Lokasi
Penelitian bertempat di Laboratorium Biokimia, Fisiologi, dan Mikrobiologi Nutrisi,
Laboratorium Nutrisi Perah, dan Laboratorium Pusat Penelitian Sumberdaya Hayati
dan Bioteknologi Institut Pertanian Bogor serta Laboratorium Balai Penelitian
Ternak (Balitnak) Ciawi, Bogor.
Penulis mengucapkan terima kasih atas kritik dan saran yang membangun
oleh berbagai pihak demi kesempurnaan skripsi ini. Penulis berharap semoga skripsi
ini dapat bermanfaat terutama dalam dunia peternakan.
Bogor, Juli 2012
Perlakuan ... 16
Peubah ... 16
Model ... 16
Analisis Data ... 16
HASIL DAN PEMBAHASAN ... 17
Daun Kersen sebagai Pakan ... 17
Nilai pH Rumen ... 18
Populasi Protozoa ... 18
Konsentrasi Amonia (NH3) ... 20
Produksi VFA Total ... 21
Kecernaan Bahan Kering dan Bahan Organik ... 22
KESIMPULAN DAN SARAN ... 23
Kesimpulan ... 23
Saran ... 23
UCAPAN TERIMA KASIH ... 24
DAFTAR TABEL
Nomor Halaman
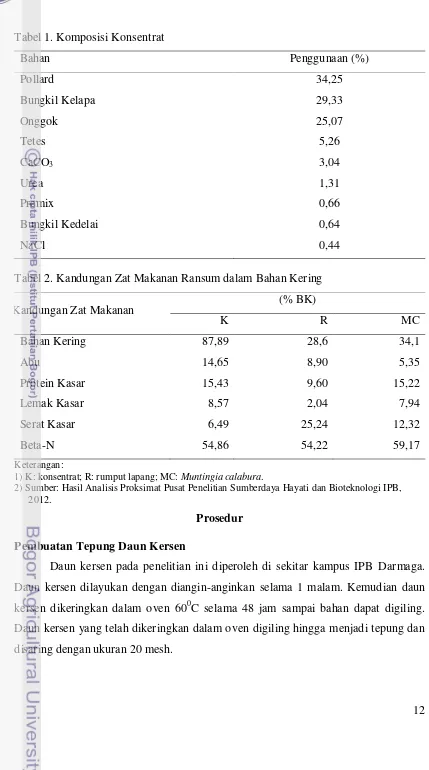
1. Komposisi Konsentrat ... 12
2. Kandungan Zat Makanan Ransum dalam Bahan Kering ... 12
3. Kandungan Fitokimia Daun Kersen ... 17
4. Pengaruh Perlakuan terhadap Populasi Protozoa dan Karakteristik
DAFTAR GAMBAR
Nomor Halaman
1. Daun Kersen (Muntingia calabura) ... 3
2. Struktur Saponin Steroid ... 4
3. Struktur Saponin Triterpenoid ... 4
4. Unit Monomer Tanin Terkondensasi (Catechin dan Gallocatechin dan
Terhidrolisis (Asam Gallic dan Ellagic) ... 5
5. Proses Metabolisme Protein dalam Rumen Ternak Ruminansia ... 8
DAFTAR LAMPIRAN
Nomor Halaman
1. Hasil Analisa Pengaruh Perlakuan terhadap Nilai pH ... 29
2. Hasil Analisa Pengaruh Perlakuan terhadap Populasi Protozoa ... 29
3. Hasil Analisa Pengaruh Perlakuan terhadap Konsentrasi NH3 ... 29
4. Hasil Analisa Pengaruh Perlakuan terhadap Produksi VFA Total ... 30
5. Hasil Analisa Pengaruh Perlakuan terhadap Nilai KCBK ... 31
PENDAHULUAN
Latar Belakang
Kebutuhan impor daging belum dapat dihindarkan karena tingkat kebutuhan
daging di Indonesia lebih banyak daripada produksinya. Badan Pusat Statistik (2012)
mencatat terdapat 14.805.053 ekor sapi potong pada masa sensus Juni 2011, namun
hasil sensus tersebut belum dapat mengurangi kebutuhan impor karena hanya 1,425
juta ekor sapi yang siap potong. Laporan tahunan tahun 2011 oleh Badan Penelitian
dan Pengembangan Pertanian (2012) menyatakan bahwa Indonesia diperkirakan
mengimpor sapi hidup sebanyak 650 ribu ekor dari Australia dan 72 ribu ton daging
sapi beku (setara dengan 220 ribu ekor sapi). Penekanan jumlah impor daging dapat
dilakukan dengan meningkatkan produksi daging lokal.
Peternakan rakyat menjadi kunci keberhasilan program kecukupan daging
karena sistem peternakan sapi potong di Indonesia masih mengandalkan peternakan
rakyat (Mayulu et al., 2010). Sementara peternakan rakyat menggunakan ransum
hijauan dalam jumlah banyak (hampir 100%) yang sering menyebabkan defisiensi
nutrien sehingga mengakibatkan produktivitas ternak rendah. Peningkatan efisiensi
fermentasi rumen perlu dilakukan sebagai upaya untuk meningkatkan produktivitas
ternak yang sangat ditentukan oleh aktifitas mikroba rumen.
Ekosistem rumen ternak ruminansia termasuk sapi potong dihuni oleh bakteri,
protozoa, fungi, dan arkae yang berperan dalam pencernaan pakan. Populasi protozoa
yang tinggi dalam rumen ruminansia kurang menguntungkan karena sifatnya yang
memangsa (predator) bakteri untuk memenuhi kebutuhan proteinnya. Akibatnya
biomassa bakteri akan berkurang sehingga laju degradasi pakan di dalam rumen dan
suplai protein mikroba akan berkurang pula (Soetanto, 2004). Sementara itu pada
ternak yang mendapat pakan tinggi hijauan, perkembangan populasi mikroba rumen
terutama bakteri pencerna serat sangat menentukan fermentasi pakan di dalam
rumen.
Salah satu strategi untuk meningkatkan efisiensi fermentasi rumen pada
ternak yang mendapat ransum hijauan tinggi adalah menghambat pertumbuhan
protozoa secara parsial (defaunasi parsial). Defaunasi parsial pada protozoa tersebut
diharapkan dapat mengakibatkan peningkatan biomassa bakteri, sehingga terjadi
2 mengontrol populasi protozoa dengan berbagai agen defaunasi, salah satunya
menggunakan senyawa saponin asal tanaman, yaitu tanaman teh (Hu et al., 2005),
akasia (Santoso et al., 2007), dan lerak (Suharti et al., 2011).
Muntingia calabura atau yang biasa disebut dengan kersen (talok) merupakan
tumbuhan yang mengandung saponin, tanin, dan flavonoid (Zakaria et al., 2010).
Kandungan saponin dalam daun kersen tersebut diharapkan mampu menekan
populasi protozoa. Pohon kersen sangat mudah ditemukan di Indonesia termasuk di
kota-kota besar dan di tempat yang kering berkepanjangan. Menurut Figueiredo et al.
(2008) pohon kersen merupakan tumbuhan yang mampu tumbuh cepat di lahan
marginal sehingga mudah dikembangkan dan sangat berpotensi sebagai pakan
ternak.
Sejauh ini penelitian tentang pemanfaatan daun kersen sebagai sumber pakan
ruminansia belum ada. Oleh karena itu dilakukan analisis in vitro untuk mengetahui
pengaruh pemberian daun kersen terhadap ternak.
Tujuan
Penelitian ini bertujuan untuk menganalisis kandungan fitokimia daun kersen
yang meliputi senyawa tanin dan saponin serta mengevaluasi dosis penggunaan daun
kersen yang tepat dan sesuai untuk mengoptimalkan kecernaan bahan kering,
TINJAUAN PUSTAKA
Kersen (Muntingia calabura)
Kersen berasal dari Amerika tropis dan banyak ditanam di kebun sebagai
pohon peneduh. Kersen memiliki pohon yang kecil dengan tinggi 2-10 m.
Rantingnya diselimuti rapat oleh rambut biasa yang halus dan oleh rambut kelenjar.
Daunnya berseling, helaian daun tidak sama sisi, bulat telur bentuk lanset dengan
ujung runcing bergerigi, berambut rapat terutama di bawah daun, lebarnya 4,5-14
kali 1,5-4 cm, tangkai daun pendek dan berambut seperti wol. Bunga berjumlah 1-3
menjadi satu di ketiak daun, berbilangan 5 dan berkelamin 2. Mahkota bunganya
berbentuk bulat telur terbalik dan berwarna putih. Buahnya buni berwarna merah
(Steenis, 2006). Taksonomi tumbuhan Muntingia calabura adalah sebagai berikut: Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Superdivisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (Dikotil/berkeping dua)
Ordo : Malvales
Famili : Muntingiaceae
Genus : Muntingia L.
Spesies : M. calabura
Pohon kersen termasuk pohon yang tumbuh cepat dan dapat tumbuh subur di
lahan marginal. Tumbuhan ini mampu melakukan penyerbukan sendiri secara
spontan, mampu memproduksi buah dan biji dalam jumlah besar sepanjang tahun
serta memiliki laju perkecambahan biji yang tinggi (Figueiredo et al., 2008). Daun
kersen mengandung flavonoid, tanin, dan saponin (Zakaria et al., 2010).
Gambar 1. Daun Kersen (Muntingia calabura)
4
Saponin
Saponin termasuk ke dalam golongan glikosida yang terdapat pada tanaman
tinggi dan dapat menimbulkan buih bila dikocok. Glikosida adalah suatu senyawa
yang bila dihidrolisis akan terurai menjadi gula (glikon) dan senyawa lain (aglikon
atau genin). Saponin memiliki rasa pahit atau getir dan dapat membentuk senyawa
kompleks dengan kolesterol. Sebagian besar saponin bereaksi netral (larut dalam air),
beberapa ada yang bereaksi asam (sukar larut dalam air), sebagian kecil ada yang
bereaksi basa. Saponin berdasarkan struktur aglikonnya dapat dikelompokkan
menjadi dua yaitu saponin sterol (steroid) dan saponin triterpen (triterpenoid).
Saponin sterol bila dihidrolisis akan membentuk senyawa sterol, sedangkan saponin
triperten bila dihidrolisis akan membentuk senyawa triterpen (Sirait, 2007).
Saponin mempunyai pengaruh yang lebih menguntungkan pada ternak
ruminansia dibandingkan pada ternak non ruminansia. Pemberian bahan yang
mengandung saponin dapat meningkatkan pertumbuhan, efisiensi pakan, dan
kesehatan ternak dengan kemampuannya sebagai agen defaunasi. Kemampuan
saponin sebagai agen defaunasi dapat menyebabkan penurunan total populasi
protozoa rumen (Suparjo, 2008). Hal ini sesuai dengan penelitian sebelumnya yang
menyatakan bahwa senyawa saponin asal tanaman yaitu teh (Hu et al., 2005) dan
lerak (Suharti et al., 2010) dapat menekan pertumbuhan protozoa.
Gambar 2. Struktur Saponin Steroid Gambar 3. Struktur Saponin Triterpenoid
Sumber: Sirait (2007) Sumber: Sirait (2007)
Tanin
Tanin disebut juga zat samak yang memiliki sifat dapat menciutkan dan
mengendapkan protein dari larutan dengan membentuk senyawa yang tidak larut
(Sirait, 2007). Tanin merupakan polimer polifenolik yang dapat larut dalam air
membentuk senyawa kompleks dengan protein membentuk kelompok fenolik
hidroksil yang besar. Tanin banyak terdapat pada hijauan pohon yang memiliki
nutrisi baik, semak belukar, dan kacang-kacangan, buah-buahan serta biji-bijian.
Tanin dapat dikelompokkan menjadi dua yaitu tanin terhidrolisa dan tanin
terkondensasi. Tanin terhidrolisa merupakan molekul kompleks dengan polyol
sebagai intinya seperti glukosa, glusitol, asam quinic, quersitol, dan asam shikimic
yang sebagian atau seluruhnya teresterifikasi dengan kelompok fenolik. Tanin
terkondensasi merupakan sebagian besar dari polimer flavan-3-ol unit (epi)catechin
dan (epi)gallocatechin yang berikatan dengan hubungan C4-C8 dan C4-C6
interflavoniod (Patra dan Saxena, 2010).
Gambar 4. Unit Monomer Tanin Terkondensasi (Catechin dan Gallocatechin) dan Terhidrolisis (Asam Gallic dan Ellagic)
Sumber: Patra dan Saxena (2010)
Pengaruh umum tanin terhadap ruminansia yaitu dapat menurunkan
pemanfaatan nutrien secara in vivo terutama dalam pemanfaatan protein oleh ternak,
menurunkan tingkat pertumbuhan ternak, menurunkan palatabilitas dan konsumsi
atau menurunkan berbagai aktivitas enzim. Tanin dapat bersifat racun dan dapat
mengakibatkan kematian jika dikonsumsi dalam jumlah yang besar (Makkar, 2003).
Catechin Asam Gallic
6
Mikroba Rumen
Perut ruminansia terdiri dari 4 bagian yaitu rumen, retikulum, omasum, dan
abomasum. Rumen merupakan saluran fermentasi terbesar pada ruminansia yang di
dalamnya terdapat beberapa jenis mikroba. Mikroba tersebut memiliki hubungan
simbiosis mutualisme (saling menguntungkan) dengan tubuh inangnya (ruminansia).
Mikroba rumen mendapatkan makanan dari pakan yang masuk ke saluran
pencernaan inangnya, sementara mikroba tersebut membantu dalam mencerna pakan
inangnya (Dehority, 2004). Mikroba rumen dibagi menjadi 4 kelompok utama yaitu
bakteri, protozoa, jamur, dan bakteriophage atau virus. Disamping itu terdapat
amoeba yang populasinya belum diketahui secara pasti (Soetanto, 2004). Faktor
utama yang mempengaruhi pertumbuhan dan aktifitas populasi mikroba rumen
adalah temperatur, pH, kapasitas buffer, tekanan osmotik, kandungan bahan kering,
dan potensial oksidasi reduksi. Temperatur di dalam rumen relatif konstan yaitu
38-40oC sedangkan pH normal rumen sekitar 5,5-7,0 dengan komposisisi rasio pakan
normal (Dehority, 2004).
Bakteri merupakan biomasa terbesar di dalam rumen, terdapat sekitar 50%
dari total bakteri hidup bebas dalam cairan rumen serta sekitar 30%-40% menempel
pada partikel makanan. Bakteri rumen punya peran yang besar dalam membantu
mencerna pakan (Soetanto, 2004). Spesies-spesies bakteri dan protozoa yang berbeda
saling berinteraksi di dalam rumen melalui hubungan simbiosis dan menghasilkan
produk-produk yang khas seperti selulosa, hemiselulosa, dan pati melalui pencernaan
polimer tumbuhan. Bakteri-bakteri tertentu yang bertanggung jawab terhadap proses
fermentasi pregastric membentuk asetat, propionat, butirat, CO2, dan H2. Metanogen
mempergunakan CO2, H2, dan format untuk membentuk metana. Beberapa spesies
memproduksi amonia dan asam lemak terbang berantai cabang dari asam-asam
amino tertentu. Beberapa organisme mengeluarkan urease untuk memecah urea
sehingga menjadi amonia dan CO. Bakteri juga mensintesis vitamin-vitamin
golongan B kompleks (Arora, 1989).
Protozoa bersifat anaerob. Apabila kadar oksigen maupun nilai pH isi rumen
tinggi, maka protozoa tidak dapat membentuk cyste untuk mempertahankan diri dari
lingkungan yang jelek, sehingga dengan cepat akan mati (Arora, 1989). Protozoa
lebih besar sehingga total biomasanya hampir sama dengan bakteri (McDonald et al.,
2002). Jumlah protozoa dalam rumen sangat beragam menurut jenis makanan, umur,
dan jenis hewan yang menjadi inangnya. Biasanya jumlah protozoa ciliata adalah 105
per ml pada makanan berserat kasar tinggi, namun jumlah ini meningkat menjadi 106
per ml pada adaptasi terhadap gula-gula terlarut (Arora, 1989).
Banyak bukti yang menunjukkan bahwa interaksi antara bakteri dan protozoa
di dalam rumen lebih bersifat kompetitif. Protozoa memangsa bakteri yang terdapat
pada cairan rumen dan mencernanya sebagai sumber asam amino bagi
pertumbuhannya. Akibatnya populasi bakteri akan berkurang sehingga laju
kolonisasi partikel makanan di dalam rumen akan berkurang juga (Soetanto, 2004).
Setiap individu protozoa dapat memangsa bakteri dengan kecepatan antara 60-700
bakteri/protozoa/jam pada kondisi kepadatan bakteri 109 sel/ml (Arora, 1989).
Pencernaan bakteri dalam sel protozoa berkisar antara 345–1200
bakteri/protozoa/jam. Populasi jamur rumen (zoospores) telah dilaporkan meningkat
setelah defaunasi (menghilangkan protozoa dari rumen) yang dapat meningkatkan
daya cerna serat kasar secara nyata 6-10 unit/24 jam. Disamping itu jumlah bakteri
juga meningkat apabila protozoa dihilangkan dari rumen (Soetanto, 2004).
Amonia (NH3)
Seluruh protein yang terkandung dalam pakan akan dihidrolisa oleh mikroba
rumen menjadi asam amino. Hidrolisa protein menjadi asam amino tersebut diikuti
oleh proses deaminasi untuk membebaskan amonia. Sumber lain amonia adalah dari
hidrolisa urea atau garam-garam amonium lain yang dapat berasal dari saliva
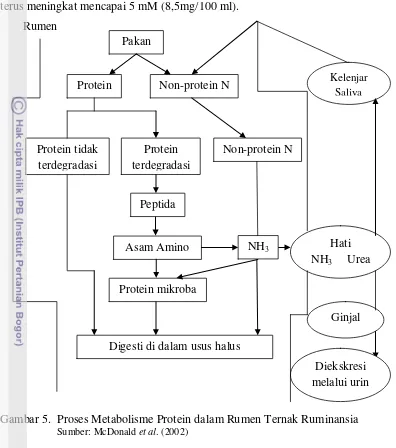
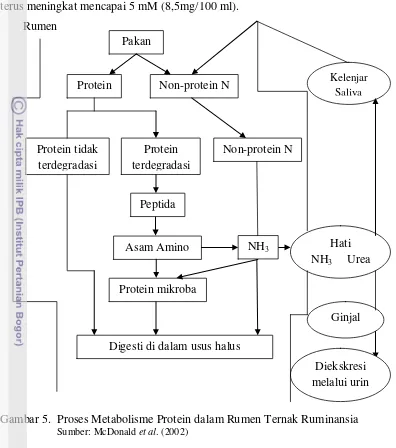
maupun pakan (Arora, 1989). Proses metabolisme protein pada rumen ruminansia
dapat dilihat pada Gambar 5.
Amonia merupakan sumber nitrogen utama yang penting untuk sintesis
protein mikroba. Bakteri yang mampu memanfaatkan amonia sebagai sumber energi
disebut bakteri penitrifikasi (Dehorty, 2004). Menurut Arora (1989), amonia yang
dibebaskan dari urea atau garam-garam amonium tersebut dapat menggantikan
protein makanan sampai 50%. Amonia dibebaskan di dalam rumen selama proses
fermentasi dalam bentuk ion NH4 maupun dalam bentuk tak terion sebagai NH3.
Sebanyak 82% mikroba rumen dapat tumbuh dengan NH4+ sebagai sumber N dan
8 amonia dalam cairan rumen adalah penting karena pemakaian amonia oleh mikroba
terus meningkat mencapai 5 mM (8,5mg/100 ml).
Gambar 5. Proses Metabolisme Protein dalam Rumen Ternak Ruminansia
Sumber: McDonald et al. (2002)
Amonia yang dihasilkan dari proses hidrolisa protein tidak semuanya
disintesis menjadi protein mikroba, namun sebagian akan diserap ke dalam darah.
Amonia yang tidak terpakai akan dibawa ke hati yang diubah menjadi urea, sebagian
dikeluarkan melalui urin serta yang lain dibawa ke kelenjar saliva. Konsentrasi
amonia yang optimum dalam menunjang proses sintesis mikroba sangat bervariasi
berkisar antara 6-21 mM. Faktor utama yang mempengaruhi penggunaan amonia
yaitu ketersediaan karbohidrat dalam ransum yang berfungsi sebagai energi untuk
pembentukan protein mikroba (McDonald et al., 2002).
Kadar amonia dalam rumen merupakan petunjuk antara proses degradasi dan
proteinnya tahan degradasi memiliki konsentrasi amonia yang rendah dalam rumen
serta pertumbuhan mikroba rumen akan lambat yang menyebabkan turunnya
kecernaan pakan (McDonald et al., 2002).
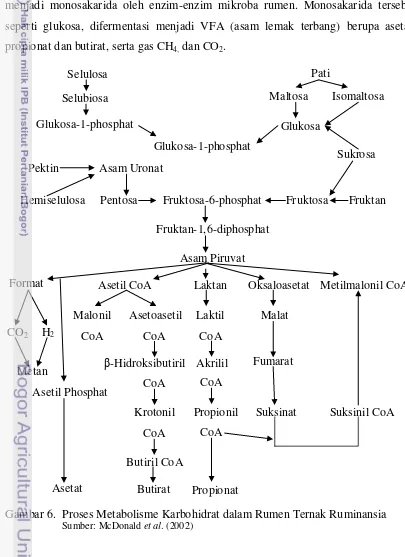
Volatile Fatty Acid (VFA)
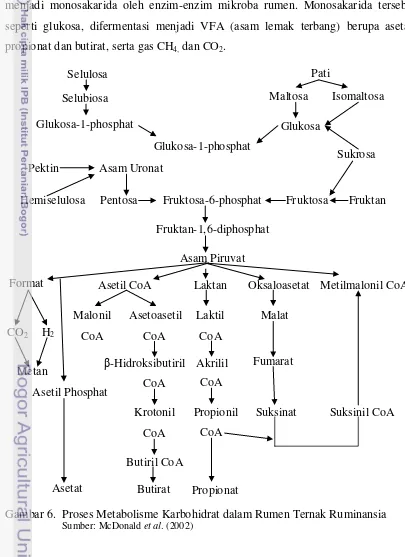
Karbohidrat yang terkandung dalam ransum pakan akan dipecah di dalam
rumen ruminansia. Karbohidrat yang berbentuk polisakarida akan dihidrolisa
menjadi monosakarida oleh enzim-enzim mikroba rumen. Monosakarida tersebut
seperti glukosa, difermentasi menjadi VFA (asam lemak terbang) berupa asetat,
propionat dan butirat, serta gas CH4, dan CO2.
Gambar 6. Proses Metabolisme Karbohidrat dalam Rumen Ternak Ruminansia
Sumber: McDonald et al. (2002)
Hemiselulosa Fruktosa-6-phosphat Fruktosa Fruktan
10 VFA akan diserap melalui dinding rumen, sementara gas CH4 dan CO2 akan
hilang melalui proses eruktasi. Sekitar 75% dari produksi total VFA yang akan
diserap langsung oleh retikulo-rumen yang masuk ke darah, sekitar 20% VFA
diserap di abomasum dan omasum serta sekitar 5% diserap oleh usus halus
(McDonald et al., 2002).
Arora (1989) menyatakan bahwa VFA merupakan sumber energi utama bagi
ruminansia. Glukosa pada ruminansia diabsorpsi dari saluran pencernaan dalam
jumlah kecil, dan kadarnya di dalam darah dipertahankan melalui sintesa endogenous
untuk keperluan fungsi-fungsi esensial jaringan tubuh. Produksi VFA cairan rumen
berkisar antara 70-150 mM. Konsentrasi VFA yang dihasilkan tergantung dari jenis
pakan yang dikonsumsi ternak (McDonald et al., 2002). Proses fermentasi
karbohidrat pada rumen ternak ruminansia dapat dilihat pada Gambar 6.
Kecernaan Bahan Kering dan Bahan Organik
Kecernaan pakan dapat didefinisikan sebagai bagian pakan yang tidak
diekskresikan dalam feses sehingga diasumsikan bagian tersebut diserap oleh tubuh
ternak. Kecernaan dinyatakan dengan dasar bahan kering (McDonald et al., 2002).
Tingkat pencernaan merupakan fungsi waktu pencernaan dan waktu yang tersedia
bagi pakan untuk dicerna. Absorpsi total neto pakan ditentukan oleh selisih antara
yang masuk (inflow) dan yang keluar (outflow) pada setiap seksi saluran pencernaan.
Kecernaan dapat dihitung dengan berbagai teknik. Salah satunya adalah teknik in
vitro yang harus mirip dengan in vivo agar sedapat mungkin menghasilkan pola yang
sama. Kadar substrat harus berkisar antara 0,5-0,15 gram per pakan hijauan sehingga
cukup untuk menjalankan kecepatan fermentasi yang normal di dalam sistem
pencernaan. Media harus mengandung sumber energi, namun di dalam evaluasi
makanan hijauan sumber energi tersebut dihindari dan tidak ditambahkan ke dalam
sistem. Substrat penting lainnya yang diperlukan dalam sistem in vitro ini adalah
sumber nitrogen (Arora, 1989).
Tilley dan Terry (1963) memperkenalkan metode two stage yang paling
banyak digunakan untuk mengukur kecernaan secara in vitro. Tahap pertama dari
metode ini adalah inkubasi dalam larutan buffer cairan rumen selama 48 jam dalam
MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan dari bulan Maret sampai Mei 2012. Analisis
fitokimia dilakukan di Laboratorium Balai Penelitian Ternak Ciawi, Bogor. Analisis
proksimat dilakukan di Laboratorium Pusat Penelitian Sumberdaya Hayati dan
Bioteknologi, Institut Pertanian Bogor. Analisis konsentrasi amonia, produksi
Volatile Fatty Acid (VFA) total, dan nilai kecernaan dilakukan di Laboratorium
Nutrisi Ternak Perah Fakultas Peternakan, Institut Pertanian Bogor. Analisis populasi
protozoa dilakukan di Laboratorium Biokimia, Fisiologi, dan Mikrobiologi Nutrisi
Fakultas Peternakan, Institut Pertanian Bogor.
Materi
Alat
Peralatan yang digunakan dalam penelitian ini antara lain oven 60oC, grinder,
timbangan digital, sudib, termos, kain penyaring, corong, tabung fermentor, tutup
karet, pipet volumetrik, labu Erlenmeyer, bulp, botol film, freezer, kulkas, spoit,
jarum suntik, shaker water bath, tabung gas CO2, selang, pH meter, timbangan
analitik, sentrifuge, alat destilasi VFA, magnetic stirer, buret, pipet mikro, cawan
Conway, ruang asam, oven 105oC, tanur, eksikator, gegep, cawan porselen, pompa
vakum, mikroskop, dan Fuchs Rosenthal Counting Chamber.
Bahan
Bahan yang digunakan dalam penelitian antara lain cairan rumen yang
diambil dari Rumah Pemotongan Hewan (RPH) Bubulak Bogor, aquades, larutan
McDougall, Trifanblue Formalsalin (TBFS), kertas saring, gas CO2, HgCl2 jenuh,
larutan Na2CO3 jenuh, asam borat, vaselin, larutan H2SO4 0,005 N, larutan H2SO4
15%, larutan NaOH 0,5 N, indikator phenolphthalein, larutan HCl 0,5 N, dan
pepsin-HCl 0,2%. Bahan yang digunakan dalam pembuatan larutan McDougall dan TBFS
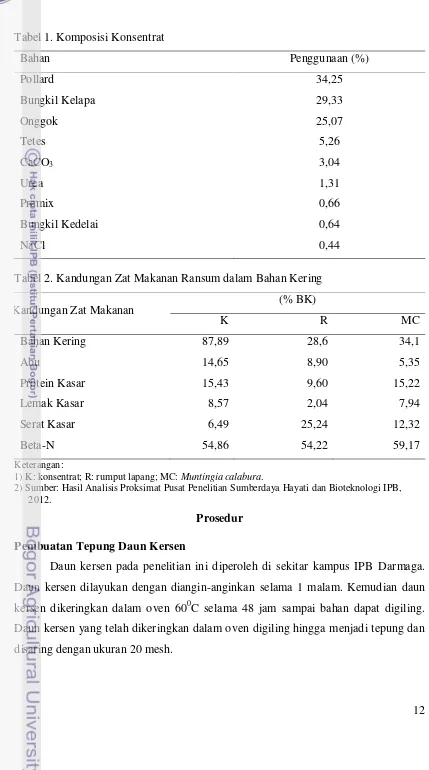
serta cara pembuatannya dicantumkan dalam prosedur penelitian. Bahan pakan yang
digunakan berupa ransum komplit berbentuk mash dengan perbandingan hijauan dan
konsentrat 70% : 30%. Hijauan yang digunakan dalam penelitian ini terdiri dari
rumput lapang dan daun kersen. Komposisi dan kandungan zat makanan ransum
12
Tabel 2. Kandungan Zat Makanan Ransum dalam Bahan Kering
Kandungan Zat Makanan (% BK)
1) K: konsentrat; R: rumput lapang; MC: Muntingia calabura.
2) Sumber: Hasil Analisis Proksimat Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB, 2012.
Prosedur
Pembuatan Tepung Daun Kersen
Daun kersen pada penelitian ini diperoleh di sekitar kampus IPB Darmaga.
Daun kersen dilayukan dengan diangin-anginkan selama 1 malam. Kemudian daun
kersen dikeringkan dalam oven 600C selama 48 jam sampai bahan dapat digiling.
Daun kersen yang telah dikeringkan dalam oven digiling hingga menjadi tepung dan
Analisis Proksimat dan Fitokimia
Analisis proksimat dilakukan di Pusat Penelitian Sumberdaya Hayati dan
Bioteknologi IPB. Analisis fitokimia dilakukan di Laboratorium Balai Penelitian
Ternak Ciawi, Bogor. Analisis saponin menggunakan metode uji spektrofotometri.
Analisis tanin berdasarkan metode Folin-Ciocalteu (Makkar, 2003).
Pembuatan Larutan McDougall
Pembuatan larutan McDougall berdasarkan Tilley dan Terry (1963). Bahan
yang digunakan untuk pembuatan larutan McDougall sebanyak 1 liter ditimbang dan
dimasukkan ke dalam labu Erlenmeyer. Bahan-bahan tersebut adalah NaHCO3 (9,8
gram), Na2HPO4.7H2O (7 gram), KCl (0,57 gram), NaCl (0,47 gram), dan
MgSO4.7H2O (0,12 gram). Kemudian ditambahkan aquades sampai kira-kira 900 ml
dan diaduk dengan magnetic stirer. Setelah larut ditambahkan CaCl2 (0,04 gram),
ditambahkan aquades sampai mencapai tanda tera 1 liter, dan dilarutkan kembali
sampai semua bahan larut.
Pengambilan Cairan Rumen
Cairan rumen diambil dari Rumah Pemotongan Hewan Bubulak Bogor.
Cairan rumen tersebut diambil dari dua ekor sapi yang dimasukkan dalam satu
termos. Menurut Mauricio (2001), cairan rumen diambil dari 2 ekor ternak. Suhu di
dalam termos harus disesuaikan suhu rumen dengan diisi oleh air panas sebelum diisi
cairan rumen. Kemudian air panas dalam termos dibuang terlebih dahulu sebelum
diisi cairan rumen. Isi rumen diperas dan disaring lalu dimasukkan ke dalam termos
dan segera dibawa ke laboratorium untuk dilakukan fermentasi in vitro. Pengambilan
cairan rumen dilakukan sebanyak 4 kali.
Fermentasi In Vitro
Metode in vitro yang digunakan adalah metode dua tahap (two-stage method)
(Tilley dan Terry, 1963). Sebanyak 0,5 gram sampel sesuai perlakuan dimasukkan
dalam tabung fermentor, ditambahkan 40 ml larutan McDougall dan 10 ml cairan
rumen. Kemudian dikocok dengan gas CO2 selama 30 detik untuk menciptakan
suasana anaerob dan ditutup dengan tutup karet berventilasi. Tabung dimasukan ke
dalam shaker water bath dengan suhu 39oC. Proses fermentasi dihentikan setelah
14 tetes HgCl2 jenuh untuk menghentikan aktivitas mikroba. Sampel disentrifuge
dengan kecepatan 3000 rpm selama 15 menit. Supernatan yang diperoleh pada
tabung inkubasi 4 jam diambil untuk analisis produksi VFA total dan konsentrasi
NH3. Supernatan yang diperoleh pada tabung inkubasi 48 jam dibuang dan diambil
endapannya. Endapan tersebut yang akan digunakan dalam analisis KCBK dan
KCBO.
Nilai pH
Nilai pH rumen diukur pada sampel yang telah diinkubasi selama 4 jam. Nilai
pH tersebut diukur dengan menggunakan pH meter sesudah tabung diangkat dari
shaker waterbath dan sebelum ditetesi dengan HgCl2.
Populasi Protozoa
Cairan rumen yang telah diinkubasi selama 4 jam, sebelum diangkat dari
shaker waterbath dan sebelum ditetesi HgCl2 diambil sebanyak 1 ml. Kemudian
dimasukkan ke dalam botol film yang berisi Trifanblue Formalsalin (TBFS)
sebanyak 1 ml. TBFS dibuat dari campuran 4% formalin dengan NaCl Fisiologis
0,9% dalam 100 ml larutan. Perhitungan populasi protozoa dilakukan menurut
metode Ogimoto dan Imai (1981) dengan menggunakan Fuchs Rosenthal Counting
Chamber. Populasi protozoa diamati dengan mikroskop lensa obyektif dengan
pembesaran 40x dan okuler 10x. Populasi protozoa dihitung dengan rumus :
Populasi protozoa = 1
0,2 x 0,0625 x 16 x 16 x 1000 x C x Fp
Keterangan : C = jumlah koloni yang dihitung
Fp = faktor pengencer ( 2 )
Konsentrasi NH3
Konsentrasi NH3 (amonia) diukur dengan metode mikrodifusi Conway
(Conway, 1962). Sebanyak 1 ml supernatan dipipet dan dibubuhkan disebelah kanan
sekat dan 1 ml larutan Na2CO3 jenuh disebelah kiri cawan Conway, sedangkan
cawan kecil ditengah diisi dengan 1 ml asam borat berindikator. Cawan Conway
tersebut ditutup rapat dengan tutup yang telah diolesi vaselin, kemudian digerakkan
perlahan sehingga supernatan dan larutan Na2CO3 bercampur. Cawan Conway
dibiarkan selama 24 jam dalam suhu kamar. Amonia yang dihasilkan dari reaksi
asam borat berubah menjadi ungu kebiruan. Kemudian dititrasi dengan larutan
H2SO4 0,005 N. Titrasi dihentikan setelah terjadi perubahan warna dari ungu
kebiruan menjadi merah kembali. Konsentrasi NH3 dihitung dengan rumus:
NH3 (mM) =Volume H2SO4 x N. H2SO4 x 1000 Berat sampel x BK sampel
Produksi VFA Total
Produksi VFA total diukur dengan menggunakan metode destilasi uap
(General Laboratory Procedures, 1966). Sebanyak 5 ml supernatan dipipet kedalam
tabung penyulingan khusus, kemudian ditambahkan 1 ml larutan H2SO4 15%. Hasil
penyulingan ditampung dengan labu Erlenmeyer yang berisi 5 ml larutan NaOH 0,5
N, sampai kira-kira tertampung sebanyak 250 ml. Kemudian ditambah 2-3 tetes
indikator phenolphthalein dan dititrasi dengan larutan HCl 0,5 N. Titrasi dihentikan
setelah terjadi perubahan warna dari merah jambu menjadi jernih. Produksi VFA
total yang dihasilkan, dihitung dengan rumus :
Produksi VFA (mM) =[(a−b) x N HCl x 1000/5] Berat sampel x BK sampel
a = ml titran blanko
b = ml titran sampel
KCBK dan KCBO
Supernatan yang diperoleh pada tabung inkubasi 48 jam dibuang dan diambil
endapannya. Endapan tersebut ditambahkan dengan larutan pepsin-HCl 0,2%
sebanyak 50 ml dan diinkubasi lagi selama 48 jam tanpa tutup karet. Kemudian
endapan disaring dengan kertas saring Whatman No.41 dengan bantuan pompa
vakum. Hasil saringan di oven 105oC selama 24 jam sehingga diperoleh bahan
kering. Selanjutnya dimasukkan ke dalam tanur 600oC selama 6 jam sehingga
diperoleh bahan organik (Tilley & Terry, 1963). Kecernaan bahan kering dan bahan
organik diperoleh dengan rumus:
% KCBK =BK asal − BK residu − BK blanko
BK asal x 100%
% KCBO =BO asal − (BO residu – BO blanko)
16
Rancangan
Perlakuan
Penelitian ini menggunakan 5 taraf perlakuan ransum dan 4 kelompok.
Perlakuan yang digunakan adalah :
R0 : 30% konsentrat : 70% rumput lapang : 0% daun kersen
R1 : 30% konsentrat : 65% rumput lapang : 5% daun kersen
R2 : 30% konsentrat : 60% rumput lapang : 10% daun kersen
R3 : 30% konsentrat : 55% rumput lapang : 15% daun kersen
R4 : 30% konsentrat : 50% rumput lapang : 20% daun kersen
Peubah
Peubah yang diamati pada penelitian ini adalah nilai pH, populasi protozoa,
konsentrasi NH3 (Amonia), produksi VFA total, KCBK (Kecernaan Bahan Kering),
dan KCBO (Kecernaan Bahan Organik).
Model
Rancangan percobaan yang digunakan adalah Rancangan Acak Kelompok
(RAK) dengan 5 taraf perlakuan ransum dan 4 kelompok sebagai ulangan.
Pengelompokan berdasarkan waktu pengambilan cairan rumen. Model matematika
yang digunakan adalah sebagai berikut :
Yij = µ + βi + τj + εij
Keterangan :
Yij : nilai pengamatan perlakuan ke-i, blok ke-j
µ : rataan umum
βi : efek perlakuan ke-i
τj : efek blok ke-j
εij : galat perlakuan ke-i dan blok ke-j
Analisis Data
Data yang diperoleh dianalisis dengan sidik ragam (ANOVA) dan jika
berbeda nyata pada level P<0,05 dilakukan Uji Jarak Duncan. Analisis data
HASIL DAN PEMBAHASAN
Daun Kersen sebagai Pakan
Peningkatan produksi daging lokal dengan mengandalkan peternakan rakyat
menghadapi permasalahan dalam hal pakan. Pakan yang digunakan oleh peternak
rakyat memiliki kualitas yang rendah karena menggunakan hijauan lebih banyak
(hampir 100%), sehingga dapat mengakibatkan defisiensi nutrien. Salah satu upaya
untuk mengatasi permasalahan tersebut adalah dengan mencari bahan pakan yang
mudah didapat dan memiliki kemampuan meningkatkan efisiensi fermentasi pakan.
Muntingia calabura (kersen) merupakan salah satu tumbuhan yang belum
digunakan sebagai pakan dan memiliki kemungkinan dapat dijadikan sebagai sumber
pakan. Hal tersebut karena daun kersen mengandung saponin, tanin, dan flavonoid
(Zakaria et al., 2010). Kandungan saponin dalam daun kersen diduga dapat
meningkatkan efisiensi fermentasi rumen pada ruminansia melalui defaunasi parsial
pada protozoa. Selain itu daun kersen memiliki kandungan protein yang lebih tinggi
(15,22%) daripada rumput lapang (9,60%). Kandungan fitokimia daun kersen yang
meliputi saponin dan tanin dapat dilihat pada Tabel 3, sementara analisis proksimat
daun kersen terdapat pada Tabel 2.
Tabel 3. Kandungan Fitokimia Daun Kersen
Sampel Tanin (%) Saponin (%)
Daun kersen 1,41 10,28
Keterangan: Analisis di Laboratorium Balai Penelitian Ternak, Ciawi Bogor (2012)
Daun kersen sangat aplikatif, karena dapat diberikan dalam bentuk segar
sehingga tidak memerlukan pengolahan dan memudahkan peternak rakyat. Daun
kersen juga mudah ditemukan pada berbagai kondisi lahan. Menurut Figueiredo et al.
(2008) pohon kersen merupakan tumbuhan yang mampu tumbuh cepat di lahan
marginal sehingga disebut sebagai tanaman perintis. Hal tersebut membuat daun
kersen mudah untuk dikembangbiakkan. Data hasil analisis populasi protozoa dan
18 Tabel 4. Pengaruh Perlakuan terhadap Populasi Protozoa dan Karakteristik
Fermentasi
Keterangan:
1) Superskrip berbeda pada baris yang sama menunjukkan berbeda nyata (P<0,05) 2) R0: 30% K + 70% R
R1: 30% K + 65% R + 5% MC R2: 30% K + 60% R + 10% MC R3: 30% K + 55% R + 15% MC R4: 30% K + 50% R + 20% MC
3) K: konsentrat; R: rumput lapang; MC: Muntingia calabura
Nilai pH Rumen
Nilai pH rumen yang dihasilkan menunjukkan kondisi rumen yang sesuai
atau tidak sesuai bagi pertumbuhan mikroba rumen. Hasil analisis ragam
menunjukkan bahwa penggunaan daun kersen tidak mempengaruhi nilai pH rumen
(Tabel 4). Nilai pH yang sama dengan kontrol menunjukkan bahwa penggunaan
daun kersen tidak mengganggu aktivitas fermentasi rumen. Rumen pada kondisi
normal memiliki pH 6,8 (Arora, 1989). Menurut Dehority (2004), pH normal rumen
sekitar 5,5-7,0 dengan pemberian rasio pakan normal.
Nilai pH sebenarnya menggambarkan jumlah asam yang diproduksi oleh
mikroflora yang ada di dalam rumen. Nilai pH minimum umumnya dicapai sekitar
2-6 jam setelah makan, sesuai dengan produksi asam yang maksimum. Perubahan pH
dipengaruhi oleh waktu setelah makan, sifat pakan, dan frekuensi makan ternak
(Dehority, 2004).
Populasi Protozoa
Populasi protozoa yang bersilia lebih dominan di dalam rumen, sementara
populasi protozoa yang berflagel hanya sedikit (Dehority, 2004). Protozoa yang
bersilia berkembang di dalam rumen ternak ruminansia secara alami, dan membantu
pencernaan zat-zat makanan dari rumput-rumputan yang kaya akan serat kasar
(Arora, 1989). Namun protozoa juga bersifat merugikan karena sifatnya yang
memangsa bakteri, akibatnya biomassa bakteri akan berkurang sehingga laju
degradasi pakan dan suplai protein mikroba akan berkurang pula (Soetanto, 2004).
Hasil analisis ragam menunjukkan bahwa penggunaan daun kersen hingga
taraf 20% tidak nyata mempengaruhi populasi protozoa. Hasil tersebut tidak sama
dengan penelitian sebelumnya yang menyatakan bahwa saponin asal tanaman dalam
bentuk ekstrak yaitu Yucca schidigera (Pen et al., 2006) dan lerak (Suharti et al.,
2011) dapat menekan populasi protozoa dalam rumen. Hal ini diduga karena
penelitian ini menggunakan sumber saponin yang masih dalam bentuk tepung,
sehingga banyak sanyawa lain yang mengikat saponin dan mengakibatkan belum
efektif menekan protozoa. Disamping itu perbedaan tersebut diduga pula disebabkan
oleh adanya perbedaan tipe dan asal saponin yang terdapat pada masing-masing
tanaman, seperti yang dilaporkan oleh Pen et al. (2006).
Pengambilan sampel pada inkubasi 4 jam diduga juga dapat mempengaruhi
keefektifan saponin dalam daun kersen untuk menekan populasi protozoa. Penelitian
Suharti et al. (2011) memperlihatkan adanya perbedaan populasi protozoa antara
waktu inkubasi 4 jam dan 24 jam. Waktu inkubasi 24 jam memperlihatkan
penurunan yang signifikan. Protozoa akan melalui fase cair yang mengalami
pergantian setiap 24 jam sekali, sehingga organisme yang ada di dalam rumen harus
memiliki kecepatan pertumbuhan 16,6 jam atau lebih kecil untuk mempertahankan
diri. Kecepatan pertumbuhan yang dibutuhkan protozoa antara 7-11 jam untuk
mempertahankan diri di dalam rumen (Dehority, 2004).
Konsentrasi protozoa dalam rumen sapi maupun domba pada kondisi normal
sekitar 1x106/ml (Dehority, 2004). Jumlah tersebut berbeda dengan populasi
protozoa yang dihasilkan dalam penelitian ini yaitu sekitar 103/ml. Hal tersebut
karena populasi protozoa pada penelitian in vitro lebih sedikit jika dibandingkan
dengan penelitian in vivo, karena pada penelitian in vitro terdapat pengenceran oleh
larutan McDougall. Jumlah tersebut masih dikatakan normal karena ransum hijauan
yang digunakan mencapai 70%. Hasil tersebut hampir sama dengan penelitian
Suharti et al. (2011) yang menggunakan ransum hijauan 70% dengan jumlah
protozoa 104/ml serta penelitian Hess et al. (2003) yang menggunakan ransum
20 waktu setelah makan (waktu inkubasi) dan rasio pakan hijauan dan konsentrat
(Dehority, 2004). Perbedaan rasio antara hijauan dan konsentrat menghasilkan
populasi protozoa yang berbeda dalam penelitian Suharti et al. (2011).
Kandungan tanin dalam daun kersen diduga juga dapat mempengaruhi
populasi protozoa dalam rumen. Tan et al. (2011) menyatakan bahwa penggunaan
ekstrak tanin terkondensasi dari tanaman Leucaena mampu menurunkan populasi
protozoa secara in vitro. Sementara pengaruh senyawa flavonoid dalam daun kersen
terhadap populasi protozoa rumen belum diketahui, seperti yang telah dilaporkan
oleh Patra dan Saxena (2010).
Konsentrasi Amonia (NH3)
Konsentrasi amonia dalam rumen menunjukkan banyaknya kandungan
protein kasar yang dirombak oleh mikroba. Perubahan konsentrasi amonia
menggambarkan efektivitas proses fermentasi. Syahrir et al. (2008) menyatakan
bahwa konsentrasi amonia yang rendah dalam cairan rumen dapat menggambarkan
proses fermentasi yang berjalan baik sehingga amonia dimanfaatkan dengan baik,
protein ransum yang sulit didegradasi atau kandungan protein ransum yang rendah.
Penggunaan daun kersen sampai dengan level 20% dalam ransum sangat
nyata (P<0,01) menurunkan konsentrasi amonia (Tabel 4). Pemberian daun kersen
pada level yang semakin tinggi akan semakin menurunkan konsentrasi amonia.
Kandungan protein daun kersen lebih tinggi jika dibandingkan dengan rumput
lapang, maka seharusnya semakin tinggi penggunaan daun kersen dan semakin
rendah penggunaan rumput lapang akan meningkatkan konsentrasi amonia. Hal
tersebut diduga karena pengaruh tanin yang terkandung dalam daun kersen. Telah
diketahui bahwa protein dan tanin dapat membentuk ikatan kompleks yang tidak
dapat dihidrolisa di dalam sistem pencernaan fermentatif. Menurut Arora (1989)
tanin pada hijauan biasanya dari jenis terkondensasi sehingga resisten terhadap
hidrolisa. Hasil tersebut sama dengan penelitian Santoso et al. (2007) yang
menggunakan Acacia mangium dengan kandungan tanin 4,51% mampu menurunkan
konsentrasi amonia rumen. Kandungan tanin dalam daun kersen yang hanya 1,41%
bisa jadi sama efektifnya dengan tanin dari Acacia mangium dalam membentuk
antara kandungan tanin hijauan (total fenol, total tanin, dan tanin terkondensasi)
belum tentu linier dengan aktivitas biologis tanin.
Rataan konsentrasi amonia yang dihasilkan (Tabel 4) menunjukkan bahwa
ransum kontrol dan ransum penggunaan daun kersen pada level 5% memiliki nilai
konsentrasi amonia yang optimal bagi pertumbuhan mikroba rumen. Hal ini sesuai
dengan McDonald et al. (2002) yang menyatakan bahwa konsentrasi amonia yang
optimal untuk menunjukkan sintesis protein mikroba berkisar 6-21 mM. Konsentrasi
amonia yang dihasilkan oleh penggunaan daun kersen pada level 10%, 15%, dan
20% masih dapat menunjang pertumbuhan mikroba rumen. Menurut Sutardi (1980)
konsentrasi amonia yang dibutuhkan untuk menunjang pertumbuhan mikroba rumen
berkisar antara 4-12 mM.
Produksi VFA Total
VFA merupakan produk akhir fermentasi karbohidrat oleh mikroba rumen
serta sebagai sumber energi utama bagi ternak ruminansia. Produksi VFA yang
utama yaitu asam asetat, propionat, dan butirat yang dianggap sebagai faktor utama
dalam mempengaruhi produksi ternak ruminansia (McDonald et al., 2002).
Peningkatan produksi VFA menunjukkan mudah atau tidaknya pakan difermentasi
oleh mikroba rumen.
Penggunaan daun kersen sampai level 20% sangat nyata (P<0,01)
meningkatkan produksi VFA (Tabel 4). Hal ini menunjukkan bahwa semakin tinggi
level daun kersen yang diberikan maka semakin tinggi pula produksi VFA total.
Produksi VFA total berkaitan dengan lama inkubasi yang dilakukan yaitu selama 4
jam. Telah diketahui bahwa pada awal fermentasi, mikroba rumen memfermentasi
bahan yang paling mudah tercerna. Peningkatan produksi VFA ini diduga karena
proporsi karbohidrat yang mudah tercerna pada daun kersen lebih tinggi daripada
rumput lapang (Tabel 2). Hal tersebut dapat dilihat dari kandungan Beta-N
(karbohidrat mudah tercerna) dalam daun kersen yang lebih tinggi bila dibandingkan
dengan rumput lapang. Selain itu peningkatan produksi VFA total yang diikuti
dengan rendahnya konsentrasi amonia merupakan gambaran efisiensi penggunaan
amonia oleh bakteri untuk mensintesis protein mikroba. Selanjutnya bakteri tersebut
22 sumber energi bagi induk semang dan sumber karbon bakteri itu sendiri (Syahrir et
al., 2009).
Rataan nilai produksi VFA yang dihasilkan meningkat dari 89,98 (ransum
kontrol) sampai 150,62 (level daun kersen 20%). Nilai konsentrasi tersebut berada
dalam kisaran normal dalam mendukung sintesis protein mikroba. McDonald et al.
(2002) menyatakan bahwa produksi VFA total yang dapat mendukung proses sintesis
protein mikroba adalah 70-150 mM.
Kecernaan Bahan Kering dan Bahan Organik
Kecernaan pakan dapat didefinisikan sebagai bagian pakan yang tidak
diekskresikan dalam feses sehingga diasumsikan bagian tersebut diserap oleh tubuh
ternak. Kecernaan dinyatakan dengan dasar bahan kering (McDonald et al., 2002).
Kecernaan zat makanan dari suatu pakan menunjukkan kualitas pakan.
Penggunaan daun kersen nyata (P<0,05) menurunkan kecernaan bahan kering
dan kecernaan bahan organik (Tabel 4). Nilai kecernaan yang dihasilkan merupakan
nilai kecernaan yang rendah. Sutardi (1980) menyatakan bahwa nilai kecernaan
bahan pakan >60% dikatakan memiliki nilai kecernaan yang tinggi. Rendahnya nilai
kecernaan yang dihasilkan dan penurunan nilai kecernaan diduga karena pengaruh
tanin dalam daun kersen yang mampu berikatan dengan protein pakan. Penambahan
tanin murni pada level 0,5 mg/ml dalam ransum secara nyata menurunkan kecernaan
bahan organik (Jayanegara et al., 2009). Ikatan yang terbentuk antara tanin dan
protein akan berpengaruh terhadap kecernaan pakan (Mueller, 2006). Menurut Arora
(1989) tanin dalam hijauan mampu memberikan perlindungan secara alami terhadap
protein pakan. Tanin dari hijauan biasanya dari jenis terkondensasi yang resisten
terhadap hidrolisa, sehingga dapat menurunkan kecernaan pakan dalam rumen.
Sementara kandungan saponin yang cukup tinggi (10,28%) dalam daun kersen belum
Kesimpulan
Penggunaan tepung daun kersen sampai level 20% dalam ransum
menghasilkan nilai pH yang stabil, mampu meningkatkan produksi VFA total,
menurunkan kecernaan bahan kering, kecernaan bahan organik, dan konsentrasi NH3
serta belum efektif dalam penekanan populasi protozoa dengan waktu inkubasi 4 jam
secara in vitro.
Saran
Perlu dilakukan penelitian in vitro dengan waktu inkubasi 24 jam untuk
mengetahui tingkat keefektifan daun kersen dalam penekanan populasi protozoa.
Perlu dilakukan pula penelitian secara in vivo agar efek penggunaan daun kersen
24
Ahamdulillahirobbil’alamin, puji syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya serta atas ridho-Nya sehingga
penyusunan skripsi ini dapat terselesaikan dengan baik. Shalawat serta salam
tercurah kepada Nabi Besar Muhammad SAW.
Kesempatan kali ini penulis mengucapkan terima kasih banyak kepada
Dr. Sri Suharti, S.Pt.M.Si selaku dosen pembimbing akademik sekaligus
pembimbing utama yang telah memberikan bantuan finansial, bimbingan, dan arahan
selama penelitian sampai selesainya skripsi ini dan kepada Dr. Anuraga Jayanegara,
S.Pt.M.Sc selaku dosen pembimbing anggota atas kesediaan waktunya dalam
mengarahkan, memotivasi, dan membimbing penulis selama penelitian sampai
selesainya skripsi ini. Terima kasih kepada Dr. Ir. Didid Diapari, M.Si selaku penguji
seminar, Ir. Anita S. Tjakradidjaja, M.Rur.Sc dan Ir. Komariah, M.Si selaku penguji
sidang serta Ir. Widya Hermana, M.Si selaku panitia sidang atas kritik dan saran
yang menjadikan skripsi ini lebih baik. Terima kasih penulis ucapkan kepada Bu
Dian dan Bu Adriani yang telah bersedia membantu penulis selama penelitian.
Terima kasih yang sebesar-besarnya penulis ucapkan kepada ibunda Eri
Lestari Muryani dan ayahanda Lis Indrianto serta adik Rizky Mahardhika atas kasih
sayang, dukungan, dan doanya. Terima kasih kepada sahabat penulis (Chandra) atas
motivasinya, partner selama penelitian (Dea) atas kerjasamanya, kepada Keluarga 8
(Habibah, Dea, Ponam, Apdila, Mutia, Pratita, Liza) atas bantuan, dukungan, dan
semangatnya, kepada keluarga besar GENETIC 45 yang tidak dapat disebutkan
satu-persatu atas kebersamaan dan kekompakannya serta kepada anak-anak wisma
Pondok Indah (Ponam, Riska, Dian, Enda, Anjani) atas keceriaan, semangat, dan
motivasinya.
Penulis mengucapkan terima kasih kepada semua pihak yang tidak dapat
penulis sebutkan satu-persatu yang telah menjadi bagian dari perjalanan penulis
dengan memberikan dukungan dan pengalaman yang berharga sampai
terselesaikannya skripsi ini. Penulis berharap semoga skripsi ini dapat bermanfaaat
terutama dalam dunia peternakan.
Bogor, Juli 2012
Arora, S. P. 1989. Pencernaan Mikroba pada Ruminansia. Edisi Indonesia. Gajah Mada University Press, Yogyakarta.
Badan Penelitian dan Pengembangan Pertanian. 2012. Inovasi Teknologi untuk Kesejahteraan Petani. Laporan Tahunan 2011. Kementrian Pertanian, Jakarta.
Badan Pusat Statistik. 2012. Populasi sapi potong Indonesia masa sensus Juni 2011. http://www.bps.go.id. [23 Februari 2012].
Conway, E. J. 1962. Microdiffusion Analysis and Volumetric Error. 5th ed. Crosby Lockwood, London.
Dehority, B. A. 2004. Rumen Microbiology. Nottingham University Press, Nottingham.
Figueiredo, R. A., A. A. Oliveira, M. A. Zacharias, S. M. Barbosa, F. F. Pereira, G. N. Cazela, J. P. Viana, & R. A. Camargo. 2008. Reproductive ecology of the exotic tree Muntingia calabura L. (Muntingiaceae) in Southeastern Brazil. J. R. Arvore. 32: 993-999.
General Laboratory Procedure. 1966. Report of Dairy Science. University of Wisconsin Madison, USA.
Hess, H. D., M. Kreuzer, T. E. Diaz, C. E. Lascano, J. E. Carulla, C. R. Soliva, & A. Machmuller. 2003. Saponin rich tropical fruits affect fermentation and methanogenesis in faunated and defaunated rumen fluid. J. Anim. Feed. Sci. 109: 79-94.
Hu, W. L., J. X. Liu, J. A. Ye, Y. M. Wu, & Y. Q. Guo. 2005. Effect of tea saponin on rumen fermentation in vitro. J. Anim. Feed. Sci. 120: 333-339.
Jayanegara, A. & A. Sofyan. 2008. Penentuan aktivitas biologis tanin beberapa hijauan secara in vitro menggunakan Hohenheim Gas Test dengan polietilen glikol sebagai determinan. Med. Pet. 31(1): 44-52.
Jayanegara, A., H. P. S. Makkar, & K. Becker. 2009. Emisi metana dan fermentasi rumen in vitro ransum hay yang mengandung tanin murni pada konsentrasi rendah. Med. Pet. 32(3): 185-195.
Makkar, H. P. S. 2003. Quantification of Tannins in Tree and Shrub Foliage. Kluwer Academic Publishers, Netherlands.
26 Nutrition. 6 Edition. Scientific and Tech John Willey & Sons. Inc, New York.
Mueller, H. I. 2006. Unrevelling the conundrum of tannins in animal nutrition and health. J. Sci. Food Agric. 86: 2010-2037.
Ogimoto, K. & S. Imai, 1981. Atlas of Rumen Microbiology. Japan Scientific Society Press, Tokyo.
Patra, A. K. & J. Saxena. 2010. A new perspective on the use of plant secondary metabolites to inhibit methanogenesis in the rumen. J. Phytochemistry. 71: 1198-1222.
Pen, B., C. Sar, B. Mwenya, K. Kuwaki, R. Morikawa, & J. Takahashi. 2006. Effects
of Yucca schidigera and Quillaja saponaria extracts on in vitro ruminal
fermentation and methane emission. J. Anim. Feed. Sci. 129:175-186.
Santoso, B. & B. Tj. Hariadi. 2007. Pengaruh suplementasi Accacia mangium Willd pada Pennisetum purpureum terhadap karakteristik fermentasi dan produksi gas metana in vitro. Med. Pet. 30(2): 106-113.
Sirait, M. 2007. Penuntun Fitokimia dalam Farmasi. Penerbit ITB (Institut Teknologi Bandung), Bandung.
Smithsonian Tropical Research Institute. 2003. Muntingia calabura immature-fruit plant. http://www.discoverlife.org/mp/20q?search=Muntingia+calabura. [23 Februari 2012].
Soetanto, H. 2004. Mikrobiologi Rumen. Fakultas Peternakan. Universitas Brawijaya, Malang. http://images.hendrawansoetanto.multiplycontent.com.
[24 Februari 2012].
Steenis, J. 2006. Flora: Untuk Sekolah di Indonesia. PT Pradnya Paramita, Jakarta.
Suharti, S., D. A. Astuti, E. Wina, & T. Toharmat. 2011. Rumen microbial population in the in vitro fermentation of different rations of forage and concentrate in the presence of whole lerak (Sapindus rarak) fruit extract. Asian-Aust. J. Anim. Sci. 24(8):1086-1091.
Suparjo. 2008. Saponin, peran dan pengaruhnya bagi ternak dan manusia. Laboratorium Makanan Ternak. Fakultas Peternakan. Universitas Jambi. http://jojo66.wordpress.com. [23 Februari 2012].
The effectivity of Mulberry leaves to substitute concentrate in the in vitro
ruminal system. Med. Pet. 32(2): 112-119.
Tan, H. Y., C. C. Sieo, N. Abdullah, J. B. Liang, X. D. Huang, & Y. W. Ho. 2011.
Effects of condensed tannins from Leucaena on methane production, rumen
fermentation and populations of methanogens and protozoa in vitro. J. Anim.
Feed. Sci. 169: 185-193.
Tilley, J. M. A & R. A. Terry. 1963. A two stage technique for the in vitro digestion of forage. J. British Grassland Society. 18: 104-111.
Mauricio, R. M., E. Owen, F. L. Mould, I. Givens, M. K. Theodorou, J. France, D. R. Davies, & M. S. Dhanoa. 2001. Comparison of bovine rumen liquor and bovine faeces as inoculum for an in vitro gas production technique for evaluating forages. J. Anim. Feed. Sci. 89: 33-48.
Zakaria, Z. A., A. S. Sufian, K. Ramasamy, N. Ahmat, M. R. Sulaiman, A. K. Arifah, A. Zuraini, & M. N. Somchit. 2010. In vitro antimicrobial activity of
28
Sumber
Lampiran 2. Hasil Analisa Pengaruh Perlakuan terhadap Populasi Protozoa (Log 10/ml)
Lampiran 3. Hasil Analisa Pengaruh Perlakuan terhadap Konsentrasi NH3
30
Lampiran 4. Hasil Analisa Pengaruh Perlakuan terhadap Produksi VFA Total
Sumber
Uji Lanjut Duncan Pengaruh Level Daun Kersen terhadap Produksi VFA (P<0,05)
Sumber
Uji Lanjut Duncan Pengaruh Level Daun Kersen terhadap Nilai KCBK (P<0,05)
Level
Lampiran 6. Hasil Analisa Pengaruh Perlakuan terhadap Nilai KCBO
32 Level
Kersen N
Subset
1 2
15 4 50,62
20 4 54,72
10 4 56,06
5 4 58,21 58,21
PENDAHULUAN
Latar Belakang
Kebutuhan impor daging belum dapat dihindarkan karena tingkat kebutuhan
daging di Indonesia lebih banyak daripada produksinya. Badan Pusat Statistik (2012)
mencatat terdapat 14.805.053 ekor sapi potong pada masa sensus Juni 2011, namun
hasil sensus tersebut belum dapat mengurangi kebutuhan impor karena hanya 1,425
juta ekor sapi yang siap potong. Laporan tahunan tahun 2011 oleh Badan Penelitian
dan Pengembangan Pertanian (2012) menyatakan bahwa Indonesia diperkirakan
mengimpor sapi hidup sebanyak 650 ribu ekor dari Australia dan 72 ribu ton daging
sapi beku (setara dengan 220 ribu ekor sapi). Penekanan jumlah impor daging dapat
dilakukan dengan meningkatkan produksi daging lokal.
Peternakan rakyat menjadi kunci keberhasilan program kecukupan daging
karena sistem peternakan sapi potong di Indonesia masih mengandalkan peternakan
rakyat (Mayulu et al., 2010). Sementara peternakan rakyat menggunakan ransum
hijauan dalam jumlah banyak (hampir 100%) yang sering menyebabkan defisiensi
nutrien sehingga mengakibatkan produktivitas ternak rendah. Peningkatan efisiensi
fermentasi rumen perlu dilakukan sebagai upaya untuk meningkatkan produktivitas
ternak yang sangat ditentukan oleh aktifitas mikroba rumen.
Ekosistem rumen ternak ruminansia termasuk sapi potong dihuni oleh bakteri,
protozoa, fungi, dan arkae yang berperan dalam pencernaan pakan. Populasi protozoa
yang tinggi dalam rumen ruminansia kurang menguntungkan karena sifatnya yang
memangsa (predator) bakteri untuk memenuhi kebutuhan proteinnya. Akibatnya
biomassa bakteri akan berkurang sehingga laju degradasi pakan di dalam rumen dan
suplai protein mikroba akan berkurang pula (Soetanto, 2004). Sementara itu pada
ternak yang mendapat pakan tinggi hijauan, perkembangan populasi mikroba rumen
terutama bakteri pencerna serat sangat menentukan fermentasi pakan di dalam
rumen.
Salah satu strategi untuk meningkatkan efisiensi fermentasi rumen pada
ternak yang mendapat ransum hijauan tinggi adalah menghambat pertumbuhan
protozoa secara parsial (defaunasi parsial). Defaunasi parsial pada protozoa tersebut
diharapkan dapat mengakibatkan peningkatan biomassa bakteri, sehingga terjadi
2 mengontrol populasi protozoa dengan berbagai agen defaunasi, salah satunya
menggunakan senyawa saponin asal tanaman, yaitu tanaman teh (Hu et al., 2005),
akasia (Santoso et al., 2007), dan lerak (Suharti et al., 2011).
Muntingia calabura atau yang biasa disebut dengan kersen (talok) merupakan
tumbuhan yang mengandung saponin, tanin, dan flavonoid (Zakaria et al., 2010).
Kandungan saponin dalam daun kersen tersebut diharapkan mampu menekan
populasi protozoa. Pohon kersen sangat mudah ditemukan di Indonesia termasuk di
kota-kota besar dan di tempat yang kering berkepanjangan. Menurut Figueiredo et al.
(2008) pohon kersen merupakan tumbuhan yang mampu tumbuh cepat di lahan
marginal sehingga mudah dikembangkan dan sangat berpotensi sebagai pakan
ternak.
Sejauh ini penelitian tentang pemanfaatan daun kersen sebagai sumber pakan
ruminansia belum ada. Oleh karena itu dilakukan analisis in vitro untuk mengetahui
pengaruh pemberian daun kersen terhadap ternak.
Tujuan
Penelitian ini bertujuan untuk menganalisis kandungan fitokimia daun kersen
yang meliputi senyawa tanin dan saponin serta mengevaluasi dosis penggunaan daun
kersen yang tepat dan sesuai untuk mengoptimalkan kecernaan bahan kering,
TINJAUAN PUSTAKA
Kersen (Muntingia calabura)
Kersen berasal dari Amerika tropis dan banyak ditanam di kebun sebagai
pohon peneduh. Kersen memiliki pohon yang kecil dengan tinggi 2-10 m.
Rantingnya diselimuti rapat oleh rambut biasa yang halus dan oleh rambut kelenjar.
Daunnya berseling, helaian daun tidak sama sisi, bulat telur bentuk lanset dengan
ujung runcing bergerigi, berambut rapat terutama di bawah daun, lebarnya 4,5-14
kali 1,5-4 cm, tangkai daun pendek dan berambut seperti wol. Bunga berjumlah 1-3
menjadi satu di ketiak daun, berbilangan 5 dan berkelamin 2. Mahkota bunganya
berbentuk bulat telur terbalik dan berwarna putih. Buahnya buni berwarna merah
(Steenis, 2006). Taksonomi tumbuhan Muntingia calabura adalah sebagai berikut: Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Superdivisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (Dikotil/berkeping dua)
Ordo : Malvales
Famili : Muntingiaceae
Genus : Muntingia L.
Spesies : M. calabura
Pohon kersen termasuk pohon yang tumbuh cepat dan dapat tumbuh subur di
lahan marginal. Tumbuhan ini mampu melakukan penyerbukan sendiri secara
spontan, mampu memproduksi buah dan biji dalam jumlah besar sepanjang tahun
serta memiliki laju perkecambahan biji yang tinggi (Figueiredo et al., 2008). Daun
kersen mengandung flavonoid, tanin, dan saponin (Zakaria et al., 2010).
Gambar 1. Daun Kersen (Muntingia calabura)
4
Saponin
Saponin termasuk ke dalam golongan glikosida yang terdapat pada tanaman
tinggi dan dapat menimbulkan buih bila dikocok. Glikosida adalah suatu senyawa
yang bila dihidrolisis akan terurai menjadi gula (glikon) dan senyawa lain (aglikon
atau genin). Saponin memiliki rasa pahit atau getir dan dapat membentuk senyawa
kompleks dengan kolesterol. Sebagian besar saponin bereaksi netral (larut dalam air),
beberapa ada yang bereaksi asam (sukar larut dalam air), sebagian kecil ada yang
bereaksi basa. Saponin berdasarkan struktur aglikonnya dapat dikelompokkan
menjadi dua yaitu saponin sterol (steroid) dan saponin triterpen (triterpenoid).
Saponin sterol bila dihidrolisis akan membentuk senyawa sterol, sedangkan saponin
triperten bila dihidrolisis akan membentuk senyawa triterpen (Sirait, 2007).
Saponin mempunyai pengaruh yang lebih menguntungkan pada ternak
ruminansia dibandingkan pada ternak non ruminansia. Pemberian bahan yang
mengandung saponin dapat meningkatkan pertumbuhan, efisiensi pakan, dan
kesehatan ternak dengan kemampuannya sebagai agen defaunasi. Kemampuan
saponin sebagai agen defaunasi dapat menyebabkan penurunan total populasi
protozoa rumen (Suparjo, 2008). Hal ini sesuai dengan penelitian sebelumnya yang
menyatakan bahwa senyawa saponin asal tanaman yaitu teh (Hu et al., 2005) dan
lerak (Suharti et al., 2010) dapat menekan pertumbuhan protozoa.
Gambar 2. Struktur Saponin Steroid Gambar 3. Struktur Saponin Triterpenoid
Sumber: Sirait (2007) Sumber: Sirait (2007)
Tanin
Tanin disebut juga zat samak yang memiliki sifat dapat menciutkan dan
mengendapkan protein dari larutan dengan membentuk senyawa yang tidak larut
(Sirait, 2007). Tanin merupakan polimer polifenolik yang dapat larut dalam air