RESPON PENAMBAHAN TEPUNG DAUN KEMBANG SEPATU
DAN AMPAS TEH TERHADAP POPULASI MIKROBA RUMEN
DAN PRODUKSI GAS METAN
IN VITRO
SKRIPSI
DINDA MULIA UTAMI
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
RINGKASAN
DINDA MULIA UTAMI. D24070152. 2012. Respon Penambahan Tepung Daun
Kembang Sepatu dan Ampas Teh Terhadap Populasi Mikroba Rumen dan Produksi Gas Metan in vitro. Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Sri Suharti, S.Pt. M.Si. Pembimbing Anggota : Dimar Sari Wahyuni, S. Pt.
Gas metan yang dihasilkan dari ternak ruminansia berasal dari aktivitas mikroba (bakteri, protozoa, dan fungi) rumen pada proses fermentasi pakan terutama oleh bakteri metanogen. Pembentukan gas metan pada sistem rumen dapat menyebabkan hewan ruminansia mengalami kehilangan sebagian energi yang tercerna. Sehingga banyak energi pakan yang seharusnya bisa dimanfaatkan ternak untuk pertumbuhan dan produksi, namun terkonversi menjadi gas metan. Produksi gas metan dapat berkurang melalui pemanfaatan agen defaunasi yang dapat menekan pertumbuhan protozoa dan bakteri metanogen. Selain itu, protozoa mempunyai sifat memangsa sebagian bakteri oleh karena itu perlu dilakukan defaunasi (penghambatan pertumbuhan) protozoa sehingga populasi bakteri dapat meningkat. Hibiscus rosa-sinensis (kembang sepatu) dan Camelia sinensis (teh) merupakan tanaman yang berfungsi sebagai agen defaunasi karena mengandung saponin dan tanin. Defaunasi dengan saponin dan tanin diharapkan dapat meningkatkan populasi bakteri di rumen, meningkatkan aliran sumber protein mikroba, dan menekan pertumbuhan bakteri metanogen. Penelitian ini bertujuan untuk mengevaluasi respon penambahan tepung daun kembang sepatu dan ampas teh serta kombinasinya terhadap populasi mikroba rumen (protozoa, bakteri amilolitik, selulolitik, proteolitik, dan total) dan produksi gas metan secara in vitro.
Penelitian ini dilaksanakan di bertempat di Laboratorium Pengembangan Teknologi Industri Agro dan Biomedika (LAPTIAB), BPPT, Tangerang; Laboratorium Biokimia, Fisiologi, dan Mikrobiologi; Laboratorium Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor; dan Pusat Penelitian Surfaktan dan Bioenergi, Bogor. Rancangan yang digunakan yaitu Rancangan Acak Kelompok (RAK) faktorial 4x3 dengan 4 ulangan. Faktor pertama adalah level tepung ampas teh (0; 1; 2; 3) mg/ml cairan rumen dan faktor kedua adalah level tepung daun kembang sepatu (0; 0,15; 0,3) mg/ml cairan rumen. Data dianalisis dengan menggunakan analysis of variance
(ANOVA) dan apabila terdapat perbedaan yang nyata antar perlakuan maka dilanjutkan dengan uji jarak Duncan. Peubah yang diamati dalam penelitian ini adalah populasi protozoa, bakteri amilolitik, bakteri selulolitik, bakteri proteolitik, bakteri total, dan produksi gas metan.
protozoa, bakteri total, bakteri proteolitik, dan produksi gas metan, namun dapat meningkatkan jumlah bakteri selulolitik dan amilolitik (P<0,1).
Kesimpulan yang dapat diambil dari penelitian ini adalah level terbaik yang cenderung mempengaruhi mikroba rumen adalah 2 mg tepung ampas teh/ml cairan rumen dan 0,3 mg tepung daun kembang sepatu/ml cairan rumen.
ABSTRACT
Response of Addition Wheat Leaf of Hibiscus rosa-sinensis and Tea by product
to Rumen Microbial Population and Methane Gas Production in vitro D. M. Utami, S. Suharti and D. S. Wahyuni
The objective of this experiment was to evaluate the response of the addition of
Hibiscus rosa-sinensis leaf meal and tea by product and its combinations on the populations of rumen microbes and methane gas production in vitro. The basal experimental diets was 60% elephant grass + 40% concentrate. A randomized block design 4x3 with four replicates was applied. The first factor was level of tea by product (0; 1; 2; 3) mg/ml and the second factor was level of Hibiscus rosa-sinensis
leaf meal (0; 0.15; 0.3) mg/ml. Data were analyzed by analysis of variance (ANOVA) and significant differences were further tested by Duncan’s test. The results show that there were no interaction between the different level of tea by product meal and Hibiscus rosa-sinensis leaf meal. The addition of tea by product meal decreased (P<0.1) protozoa population, increased (P<0.1) amilolytic and cellulolytic bacteria but that treatment had no effect for proteolytic and total bacteria. Addition of Hibiscus rosa-sinensis leaf meal had no effect for population of protozoa, total, and proteolytic bacteria, but increased (P<0.1) cellulolytic and amilolytic bacteria. It was concluded that supplementation using tea by product and
Hibiscus rosa-sinensis leaf meal is an optimum combination in ration based on 2 mg and 0.15 mg.
RESPON PENAMBAHAN TEPUNG DAUN KEMBANG SEPATU
DAN AMPAS TEH TERHADAP POPULASI MIKROBA RUMEN
DAN PRODUKSI GAS METAN
IN VITRO
LEMBAR PERNYATAAN
DINDA MULIA UTAMI D24070152
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
Judul : Respon Penambahan Tepung Daun Kembag Sepatu dan Ampas Teh terhadap Populasi Mikroba Rumen dan Produksi Gas Metan in vitro.
Nama : Dinda Mulia Utami
NIM : D24070152
LEMBAR PENGESAHAN
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
Dr. Sri Suharti, S.Pt. M.Si. Dimar Sari Wahyuni, S. Pt. NIP: 19741012 200501 2 002 NIP: 19860719 200901 2 001
Mengetahui: Ketua Departemen
Ilmu Nutrisi dan Teknologi Pakan
Dr. Ir. Idat Galih Permana, MSc.Agr. 19670506 199103 1 001
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 16 Juni 1989 di Bogor, Jawa Barat. Penulis
adalah anak ketiga dari tiga bersaudara dari pasangan Bapak H. Oyo R. Anwar dan
Ibu Hj. Mumun Marliah.
Penulis mengawali pendidikan dasar pada tahun 1995 di Sekolah Dasar
Negeri Pengadilan II Bogor dan diselesaikan pada tahun 2001. Pendidikan lanjutan
tingkat pertama dimulai pada tahun 2001 dan diselesaikan pada tahun 2004 di
Sekolah Lanjutan Tingkat Pertama Negeri 4 Bogor. Penulis melanjutkan pendidikan
di Sekolah Menengah Atas Negeri 5 Bogor pada tahun 2004 dan diselesaikan pada
tahun 2007.
Penulis diterima di Institut Pertanian Bogor pada tahun 2007 melalui jalur
USMI (Ujian Seleksi Masuk IPB) dan diterima di Departemen Ilmu Nutrisi dan
Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor pada tahun 2008. Penulis aktif dalam organisasi Lembaga Dakwah Fakultas FAMM Al-An’am
KATA PENGANTAR
Bismillahirrahmannirrahim
Alhamdulillahi rabbil’alamin, puji syukur kehadirat Allah SWT atas rahmat,
karunia, hidayah dan ridho-Nya sehingga penulis dapat menyelesaikan studi,
penelitian, seminar dan penyusunan skripsi ini. Skripsi yang berjudul ”Respon
Penambahan Tepung Daun Kembang Sepatu dan Ampas Teh terhadap Populasi
Mikroba rumen dan Produksi Gas Metan in vitro” merupakan salah satu syarat untuk
memperoleh gelar Sarjana Peternakan di Fakultas Peternakan, Institut Pertanian
Bogor. Skripsi ini disusun dengan harapan dapat memberikan informasi mengenai
manfaat tepung daun kembang sepatu dan ampas teh yang disuplementasi dalam pakan dalam mempengaruhi populasi protozoa, populasi bakteri rumen (amilolitik,
selulolitik, proteolitik, dan total), dan produksi gas metan. Saponin yang terkandung
dalam daun kembang sepatu dapat digunakan sebagai agen defaunasi protozoa
sehingga populasi bakteri meningkat. Jumlah bakteri yang meningkat menjadikan
asupan protein mikroba sebagai pasokan nutrien bagi induk semang turut meningkat.
Tanin dalam ampas teh memiliki potensi untuk menurunkan bakteri metanogen
sehingga produksi gas metan menurun. Penulis menyadari bahwa dalam penulisan
skripsi ini masih jauh dari sempurna. Penulis berharap semoga skripsi ini bermanfaat
dalam dunia peternakan. Amin.
Bogor, Januari 2012
DAFTAR ISI
Pembuatan Ransum Penelitian... 17
Pengujian Fermentasi in vitro ... 18
Perhitungan Populasi Protozoa ... 20
Rancangan dan Analisis Data ... 21
HASIL DAN PEMBAHASAN ... 23
Populasi Protozoa Total pada Level Tepung Daun Kembang sepatu
dan Ampas Teh yang Berbeda ... 24
Populasi Bakteri Total pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda ... 26
Populasi Bakteri Proteolitik pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda ... 27
Populasi Bakteri Selulolitik pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda ... 28
Populasi Bakteri Amilolitik pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda ... 29
Produksi Gas Metan pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda ... 30
KESIMPULAN DAN SARAN ... 32
Kesimpulan ... 32
Saran ... 32
UCAPAN TERIMA KASIH ... 33
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
Nomor Halaman
1. Kebutuhan Nutrisi (Energi dan Protein) untuk Sapi Perah ... 4
2. Kandungan Zat Makanan pada Ampas Teh Berdasarkan Bahan
Kering ... 5
3. Kandungan Nutrien Ransum Berdasarkan 100% Bahan Kering ... 23
4. Persentase Tanin dan Saponin pada Ampas Teh dan Daun
Kembang Sepatu ... 24
5. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu
terhadap Populasi Protozoa secara in vitro ... 25
6. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu
terhadap Populasi Bakteri Total secara in vitro ... 26
7. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu
terhadap Populasi Bakteri Proteolitik secara in vitro ... 27
8. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu
terhadap Populasi Bakteri Selulolitik secara in vitro ... 29
9. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu
terhadap Populasi Bakteri Amilolitik secara in vitro ... 30
10. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu
DAFTAR GAMBAR
Nomor Halaman
1. Ampas Teh dari PT. Sinar Sosro ... 4
2. Tanaman Kembang Sepatu ... 6
3. Mekanisme Perlindungan Tanin Terkondensasi terhadap Protein
pada Ternak Ruminansia ... 9
4. Struktur Kimia Sapogenin ... 9
DAFTAR LAMPIRAN
Nomor Halaman
1. Hasil Sidik Ragam (ANOVA) Populasi Protozoa ... 40
2. Hasil Sidik Ragam (ANOVA) Populasi Bakteri Amilolitik ... 41
3. Hasil Sidik Ragam (ANOVA) Populasi Bakteri Selulolitik ... 42
4. Hasil Sidik Ragam (ANOVA) Produksi Gas Metan ... 43
5. Hasil Sidik Ragam (ANOVA) Populasi Bakteri Total ... 44
6. Hasil Sidik Ragam (ANOVA) Populasi Bakteri Proteolitik ... 45
7. Tabung Fermentor ... 46
8. Persiapan Sampel Gas Metan ... 46
9. Konsentrat ... 46
10. Tepung Rumput Gajah ... 46
11. Media Pengencer ... 46
12. Sampel Protozoa ... 46
13. Proses Fermentasi ... 46
14. Persiapan Sampel Protozoa dan Bakteri ... 47
15. Spoid dan Needle untuk Pengambilan Sampel Protozoa dan Bakteri ... 47
16. Proses Pengambilan Sampel Protozoa dan Bakteri ... 47
17. Sampel Bakteri ... 47
18. Proses Pembuatan Larutan Media Pengencer ... 47
19. Tepung Ampas Teh ... 47
1
PENDAHULUAN
Latar Belakang
Pemanasan global merupakan ancaman bagi kelestarian lingkungan, karena
memiliki dampak yang sangat besar dalam berbagai segi kehidupan. Pemanasan
global terjadi akibat dari peningkatan efek rumah kaca yang disebabkan oleh naiknya
konsentrasi gas rumah kaca.
Salah satu hasil fermentasi mikroba di dalam rumen yaitu produksi gas metan
yang berkaitan erat dengan keberadaan protozoa. Salah satu bakteri dalam rumen
adalah bakteri metanogen yang bersimbiosis pada protozoa. Sebanyak 70% dari total
bakteri metanogen bersimbiosis pada protozoa. Penurunan jumlah protozoa
diperkirakan akan menyebabkan penurunan metan sebanyak.
Ekosistem rumen terdiri atas protozoa, bakteri, kapang, dan fungi yang
berperan dalam degradasi pakan. Namun, protozoa sering memangsa bakteri untuk
mencukupi kebutuhan proteinnya. Sumber nitrogen untuk pertumbuhan protozoa
berasal dari bakteri sementara itu bakteri rumen juga merupakan sumber protein
terbesar untuk ternak ruminansia, sehingga predatorisme protozoa terhadap bakteri
akan menurunkan suplai protein bagi ternak. Pengurangan jumlah protozoa didalam
rumen akan memberikan banyak keuntungan yaitu mengurangi emisi gas metan dan
meningkatkan suplai protein untuk ternak. Akhir-akhir ini telah banyak dilakukan
manipulasi fermentasi dalam rumen yang bertujuan untuk menurunkan populasi
protozoa, dengan memberikan agen defaunasi dalam pakan ruminansia seperti tanin
dan saponin.
Salah satu tanaman yang mengandung tanin dan saponin adalah kembang
sepatu dan ampas teh. Kembang sepatu (Hibiscus rosa sinensis) merupakan salah
satu jenis tanaman yang seluruh bagian tanamannya mulai dari akar, daun, dan bunga
mengandung flavonoida. Di samping itu bunga dan daunnnya juga mengandung
saponin dan polifenol, akarnya juga mengandung tanin, saponin, skopoletin,
cleomiscosin A, dan cleomiscosin C. Jadi, tanaman kembang sepatu dapat dijadikan
sebagai salah satu agen defaunasi untuk protozoa. Ampas teh mengandung tanin
yang dapat dijadikan agen defaunasi dan juga diduga dapat mematikan bakteri
2
Tujuan
Penelitian ini bertujuan untuk mengevaluasi respon penambahan tepung daun
kembang sepatu dan ampas teh serta kombinasinya terhadap populasi mikroba rumen
yaitu, protozoa dan bakteri (amilolitik, selulolitik, proteolitik, dan total) dan produksi
3
TINJAUAN PUSTAKA
Pakan Ruminansia
Pakan ternak ruminansia secara umum dikelompokkan menjadi dua jenis,
yakni hijauan dan pakan penguat atau konsentrat. Hijauan ditandai dengan jumlah
serat kasar yang relatif banyak (>18%) pada bahan keringnya, sedangkan pakan
penguat atau konsentrat mengandung serat kasar lebih sedikit daripada hijauan dan
mengandung karbohidrat, protein dan lemak yang relatif banyak tetapi jumlahnya
bervariasi dengan jumlah air yang relatif sedikit (Church, 1979).
Sutardi (1980) menyatakan bahwa energi merupakan hasil metabolisme zat
nutrisi organik yang terdiri dari karbohidrat, lemak dan protein. Karbohidrat pada
pakan ruminansia merupakan nutrien yang dominan dalam menyediakan sumber
energi untuk tubuh, disamping menyediakan bahan yang bersifat bulky yang berguna
untuk memelihara kelancaran proses pencernaan. Peranan protein dalam tubuh
adalah untuk memperbaiki jaringan tubuh, pertumbuhan jaringan baru, metabolisme
(deaminasi) untuk energi dan sebagai enzim-enzim yang esensial bagi tubuh
(Anggorodi, 1994). Kebutuhan nutrien (energi dan protein) untuk beberapa ternak
ruminansia besar dapat dilihat pada Tabel 1.
Church (1979) menyatakan hijauan adalah bahan makanan yang berasal dari
batang dan daun tanaman dan kadang-kadang mengandung bunga dan biji, masih
hijau atau dalam bentuk kering. Rumput mengandung zat-zat makanan yang
bermanfaat bagi ternak seperti air, lemak, bahan ekstrak tanpa-N, serat kasar
(terutama phosphor dan garam dapur) yang kadarnya akan berkurang dengan
meningkatnya umur tanaman (Tillman et al., 1989). Salah satu hijauan yang sering
digunakan di peternakan sapi perah adalah rumput gajah. Rumput gajah termasuk
tanaman berumur panjang, tumbuh cepat dan tegak mencapai tinggi 1,8-2,4 m,
perakarannya dalam dengan rhizome pendek serta membentuk rumpun (Nuraeni,
1993).
Konsentrat merupakan suatu bahan makanan yang digunakan bersama bahan
makanan lain untuk meningkatkan keserasian gizi dari keseluruhan makanan dan
dimaksudkan untuk disatukan dan dicampur sebagai suplemen (pelengkap) atau
4 dalam kuantitas yang kecil) ke dalam campuran makanan dasar untuk memenuhi
kebutuhan khusus disebut aditif (Tillman et al., 1997).
Tabel 1. Kebutuhan Nutrien (Energi dan Protein) untuk Sapi Perah
Jenis Ternak Kebutuhan
TDN (%)
Kebutuhan PK (%)
Sapi Perah*)
Pejantan
Dara (Umur 6-12 Bulan)
Masa Pengeringan
Laktasi (Produksi Susu 7-10 Kg/hari)
55
Ampas teh merupakan hasil ikutan atau limbah dari pembuatan minuman
ringan teh yang diproses dengan pelayuan, penggulungan, fermentasi, dan
pengeringan (Istirahayu, 1993). Produksi teh di Indonesia cukup tinggi, hal ini
didukung dengan banyaknya perkebunan teh yang tersebar di Indonesia dan terpusat
di pulau Jawa. Data terakhir menunjukkan bahwa Indonesia memiliki perkebunan teh
seluas 78.900 Ha dengan produksi daun teh 114,689 ton pada tahun 2008 (BPS,
2010).
Gambar 1. Ampas Teh dari PT. Sinar Sosro
Sumber: PT. Sinar Sosro (2011).
Teh sebagai minuman sangat popular di bagian timur Asia dan sebagian di
pertengahan timur dan utara Afrika. Konsumsi teh dalam kaleng, kemasan, dan botol
terjadi penambahan setiap tahunnya di bagian timur Asia dan negara bagian selatan
5 yang cukup besar (Kondo et al., 2007). Menurut (Khotijah et al., 2004) PT Sosro
yang dapat menghasilkan ampas teh sebanyak 470 ton/tahun ditambah dengan
beberapa perusahaan lain yang juga memproduksi minuman teh baik dalam kemasan
kotak maupun botol yaitu, Pepsi, Coca Cola, Teh Giju, dan Ultra Jaya, merupakan
potensi yang dapat menjamin ketersediaan ampas teh. Ampas teh berpotensi
dimanfaatkan sebagai pakan ternak. Ampas teh harus tampak segar, dengan warna
tembaga yang merata, tidak hitam kecoklatan atau coklat tua (Kuntadi, 1992).
Kandungan zat makanan dari ampas teh dapat dilihat pada Tabel 2.
Faktor yang membatasi penggunaan ampas teh adalah kandungan serat kasar
yang cukup tinggi yaitu 20,39%, lignin mencapai 29% dan tannin 1,4% (Istirahayu,
1993). Serat yang tertinggal dalam ampas teh lebih dominan berupa serat yang tidak
larut. Serat tidak larut dalam tanaman berupa polisakarida (selulosa dan
hemiselulosa) yang terikat dengan lignin membentuk kompleks stabil
lgnin-polisakarida (Galleher et al., 1993). Kandungan lignin yang tinggi dalam ransum
akan menghambat proses pencernaan, karena lignin dapat membentuk ikatan
hidrogen yang membatasi aktivitas enzim selulase sehingga menurunkan kecernaan
bahan kering ransum. Tanin merupakan senyawa polifenol yang mempunyai
kemampuan untuk mengikat protein sehingga menghalangi kerja enzim protease.
Jika dalam jumlah yang kecil pada ruminansia dapat bersifat menguntungkan karena
melindungi protein dari degradasi oleh mikroba secara berlebihan (Soebarinoto,
1986).
Tabel 2. Kandungan Zat Makanan pada Ampas Teh Berdasarkan Bahan Kering
Zat Makanan Persentase (%)
Bahan Kering 43,9
Abu 4,6
Protein Kasar 27,42
Serat Kasar 20,39
Lemak Kasar 3,26
Beta-N 44,20
TDN 66,71
6
DaunKembang Sepatu (Hibiscus rosa-sinensis)
Daun kembang sepatu merupakan tanaman yang banyak dibudidayakan oleh
masyarakat. Tanaman ini banyak ditanam orang di halaman sebagai tanaman hias
atau sebagai pagar hidup. Tanaman ini dikenal dengan nama kembang Wora Wari
(Jawa) dan bunga Wera (Sunda). Kembang Sepatu diklasifikasikan ke dalam
Kingdom: Plantae (Tumbuhan), Sub kingdom: Tracheobionta (Tumbuhan
berpembuluh), Super Divisi: Spermatophyta (Menghasilkan biji), Divisi:
Magnoliophyta (Tumbuhan berbunga), Kelas: Magnoliopsida (berkeping
dua/dikotil), SubKelas: Dilleniidae, Ordo: Malvales, Famili: Malvaceae (suku
kapas-kapasan), Genus: Hibiscus, Spesies: Hibiscus rosa-sinensis L. Kembang sepatu
(Hibiscus rosa-sinensis L.) biasanya banyak tumbuh di daerah tropis dan subtropis.
Pada umumnya, tinggi tanaman sekitar 1 sampai 4 meter. Tumbuh di daerah rendah
sampai pegunungan, daun tunggal benbentuk bulat telur dengan tepi bergerigi kasar
dan tulang daun menjari, ujung meruncing, panjang daun 3,5-9,5 cm dan lebar 2-6
cm dengan daun penumpu berbentuk garis. Daun mempunyai tangkai yang
panjangnya 1-3,7 cm. Bunga tunggal, keluar dari ketiak daun, sedikit menggantung,
dengan tangkai bunga beruas, warnanya ada yang merah, kuning, putih, orange, dadu
dan sebagainya (Wijayakusuma, 2000).
Gambar 2. Tanaman Kembang Sepatu
Sumber: Tanaman obat (2011).
Kembang sepatu dapat digunakan sebagi obat. Selain untuk pengobatan,
kembang sepatu juga dapat digunakan sebagai bahan makanan ternak. Kandungan
nutrisi dari kembang sepatu berdasarkan bahan kering yaitu BK 89,77%, abu
13,03%, lemak 7,91%, serat kasar 11,20%, BETN 46,65%, dan protein kasar 21,21%
7 samping itu daunnnya juga mengandung saponin dan polifenol, bunga mengandung
saponin dan polifenol, akarnya juga mengandung tanin, saponin, skopoletin,
cleomiscosin A, dan cleomiscosin C (Harborne,1996). Baik daun dan bunga dari
kembang sepatu memiliki senyawa bioaktif saponin. Oleh sebab itu, menurut Sutardi
(1980) kembang sepatu dapat dijadikan agensia defaunasi dari populasi protozoa
Tanin
Tanin terdiri atas dua kelompok, yaitu condensed tannin (tanin padat) dan
hydrolizable tannin (tanin yang dapat dihidrolisis). Kelompok condensed tannin
merupakan tipe tanin yang terkondensasi, tahan terhadap degradasi enzim, tahan
terhadap hidrolisis asam, dimetilasi dengan penambahan metionin, sering strukturnya
kompleks dan banyak dijumpai dalam biji-bijian sorgum. Condensed tannin
diperoleh dari kondensasi flavonoid seperti katekhin dan epikatekhin, tidak
mengandung gula dan mengikat protein sangat kuat sehingga menjadi rusak. Tannin
hydrolizable merupakan tannin yang mudah terhidrolisis oleh asam-asam alkali serta
enzim, menghasilkan glukosa dan asam aromatik yaitu asam galat dan asam ellagat,
yang terdiri atas residu gula-gula. Tanin yang dapat dihidrolisis sering juga disebut
dengan asam galat karena merupakan senyawa karbohidrat yang terdiri atas molekul
glukosa dan 10 asam galat. Tanin yang dapat dihidrolisis terdiri dari dua macam,
yaitu gallotannin dan ellagitannin. Gallotannin merupakan senyawa ester glukosa
dengan asam galat. Ellagitannin merupakan ester glukosa dengan asam ellagat (asam
heksahidroksifelat) (Widodo, 2007).
Tanin mempunyai kemampuan mengendapkan protein, karena tanin
mengandung sejumlah kelompok fungsional ikatan yang kuat dengan molekul
protein dan menghasilkan ikatan silang yang besar dan kompleks yaitu protein tanin.
Tiga mekanisme reaksi antara tanin dengan protein sehingga terjadi ikatan yang
cukup kuat antara ke duanya, yaitu :1) Ikatan hidrogen dengan gugus OH pada tanin
dan gugus reseptornya, 2) Ikatan ion antara gugus anion pada tanin dengan gugus
kation pada protein dan 3) Ikatan cabang kovalen antara quinon dan
bermacam-macam gugus reaktif pada protein. Ikatan-ikatan tersebut menyebabkan tanin akan
segera mengikat protein pakan dalam saluran pencernaan dan menyebabkan pakan
menjadi sulit dicerna oleh enzim-enzim pencernaan. Interaksi tanin dengan protein
8 (menyempit) pada mulut (widodo, 2007). Mekanisme perlindungan tanin
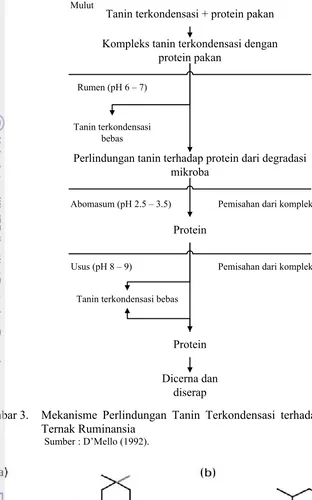
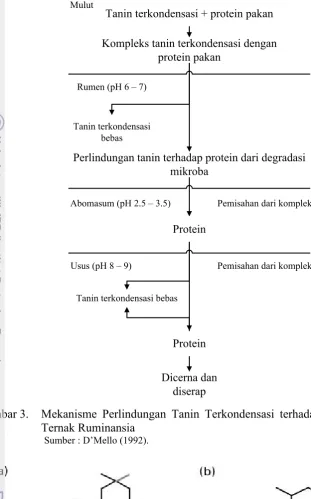
terkondensasi terhadap protein pada ternak ruminansia dapat dilihat pada Gambar 3.
Saponin
Saponin didefinisikan sebagai senyawa aktif permukaan yang kuat dan
menimbulkan busa bila dikocok dalam air dan dapat menyebabkan hemolisis sel
darah merah sehingga dapat dideteksi berdasarkan kemampuannya membentuk busa
dan menghemolisis darah. Saponin diambil dari kata latin sapo yang berarti sabun.
Fungsi dalam tumbuhan tidak diketahui, diduga sebagai bentuk penyimpanan
karbohidrat atau merupakan waste product dari metabolisme tumbuhan yang dapat
berguna untuk melindungi tumbuhan tersebut dari predator (Robinson, 1995).
Sifat-sifat saponin antara lain berasa pahit, berbusa dalam air, mempunyai Sifat-sifat detergen
yang baik, mempunyai aktivitas hemolisis (merusak sel darah merah) dan tidak
beracun bagi hewan berdarah panas (Robinson, 1995).
Saponin adalah senyawa fitokimia yang tersusun atas steroid atau
sapogenintriterpenoid yang membentuk satu atau lebih ikatan gula. Saponin
ditemukan pada tanaman yang secara umum dikelompokkan sebagai faktor
antinutrisi atau racun dan menyebabkan fotosensitasi (Pirez et al., 2002). Saponin
merupakan deterjen alami yang memiliki bahan surfaktan karena mengandung inti
lemak dan air yang mudah larut. Saponin terdiri atas gula yang biasanya
mengandung glukosa, galaktosa, asam glukoronat, xylosa, rhamnosa atau
methylpentosa yang berikatan membentuk glikosida dengan hydrophobic aglycone
(sapogenin) yang membentuk triterpenoid atau steroid (Gambar 4).
Saponin bersifat toksik pada ternak babi, tetapi ternak ruminansia dapat
mentoleransi saponin karena adanya mikroba rumen. Pada tenak ruminansia, saponin
berpotensi sebagai agen defaunasi dalam manipulasi proses fermentasi di dalam
rumen. Penggunaannya sebagai agen defaunasi karena protozoa dianggap predator
bakteri sehingga keberadaab protozoa dapat menurunkan populasi bakteri dan suplai
protein mikroba ke organ pasca rumen. Penggunaan saponin yang ditambahkan ke
dalam ransum dapat menurunkan populasi protozoa rumen secara parsial atau
keseluruhan (Wiseman dan Cole,1990). Saponin mampu membunuh atau melisiskan
protozoa dengan membentuk ikatan yang kompleks dengan sterol yang terdapat pada
9
Tanin terkondensasi + protein pakan
Kompleks tanin terkondensasi dengan protein pakan
Perlindungan tanin terhadap protein dari degradasi mikroba
Protein
Protein
Dicerna dan diserap Mulut
Rumen (pH 6 – 7)
Tanin terkondensasi bebas
Abomasum (pH 2.5 – 3.5) Pemisahan dari komplek
Tanin terkondensasi bebas
Pemisahan dari komplek Usus (pH 8 – 9)
Gambar 3. Mekanisme Perlindungan Tanin Terkondensasi terhadap protein pada Ternak Ruminansia
Sumber : D’Mello (1992).
Gambar 4. Struktur Kimia Sapogenin: (a) Triterpenoid, (b) Steroid
Sumber: Francis et al. (2002).
Hristov et al. (1999) menyatakan bahwa penambahan saponin dapat
10 yang menguntungkan dari pemberian saponin terhadap ternak dan pengaruhnya
terhadap lingkungan, yaitu mengurangi produksi metan (Wallace et al., 2002).
Suparjo (2008) menambahkan bahwa populasi bakteri rumen tidak mengalami
gangguan karena dinding membran bakteri berupa ikatan peptida dengan gliserol
(peptidoglikan). Bakteri tidak mempunyai sterol yang dapat berikatan dengan
saponin selain itu bakteri mempunyai kemampuan untuk memetabolisme faktor
antiprotozoa tersebut dengan menghilangkan rantai karbohidrat dari saponin.
Cairan Rumen
Rumen merupakan tabung besar dengan berbagai kantong yang menyimpan
dan mencampur pakan hasil fermentasi mikroba. Kondisi dalam rumen adalah
anaerobic dan hanya mikroorganisme yang paling sesuai dapat hidup di dalamnya.
Tekanan osmosis dalam rumen mirip dengan tekanan aliran darah dan suhunya
38-42o C. cairan rumen berfungsi sebagai buffer dan membantu mempertahankan pH
tetap pada nilai 6,8. Ternak dewasa, volume rumen mempunyai proporsi lebih besar
daripada bobot badan, volume untuk ternak ruminansia kecil adalah 10 liter atau
lebih. Ternak muda, rumen belum berkembang dan masih didominasi oleh
abomasum. Perkembangan bakteri rumen terjadi karena adanya kontaminasi dari
lingkungan dan kontak langsung induknya sehingga dengan demikian,
perkembangan populasi bakteri rumen akan terus meningkat seiring bertambahnya
umur ternak. Pemberian hijauan dan pakan berserat tinggi pada ternak ruminansia
akan menstimulasi perkembangan rumen (Hobson dan Stewart, 1997).
Rumen dipadati oleh mikroorganisme yang mengahsilkan selulase sehingga
dapat memecah selulosa, dan menghasilkan D-glukosa, yang kemudian akan
difermentasi menjadi asam lemak berantai pendek, karbondioksia, dan gas metan
(Lehninger, 1982).
Mikroba Rumen
Mikroorganisme yang mendominasi saluran pencernaan dapat dikelompokan
menjadi tiga kelompok utama, yaitu : bakteri, protozoa, dan kapang (Mackie et al.,
2000). Mikroba yang terdapat dalam rumen dibagi menjadi empat jenis
mikroorganisme anaerob, yaitu bakteri, protozoa, fungi dan mikroorganisme lainnya
seperti virus.cacahan sel per gram isi rumen dapat mencapai 1010-1011 (McDonald et
11 2000). Sedangkan populasi kedua yang tertinggi adalah protozoa yang dapat
mencapai 105-106 pada kondisi ternak yang sehat (McDonald et al., 2002), dan genus
yang ditemukan dalam cairan rumen untuk protozoa adalah 25 genus (Mackie et al.,
2000). Populasi fungi rumen (zoospora) di dalam rumen adalah 102-105 per ml dan
terdapat 5 genus, sedangkan populasi bakteriofage 107-109 partikel per ml (Mackie et
al., 2000). Widyastuti (2004) menyatakan bahwa mikroba rumen mempunyai
karkteristik : suhu lingkungan sesuai dengan suhu saluran pencernaan 39-40oC,
kondisi lingkungan anaerob dengan pH 5,5-7,0. Mikroba rumen menghasilkan
produk fermentasi berupa volatil fatty acid ( asam asetat, asam propionat, asam
butirat, dan asam valerat), CO2, CH4, dan NH3. Zat makanan yang didegradasi
adalah karbohidrat, lemak, dan protein. Interaksi yang terjadi antar mikroba rumen
adalah simbiosis mutualisme. Bakteri dan protozoa yang hidup dalam rumen
menjadikan ruminansia mampu mencerna serat kasar tinggi (McDonald et al., 2002).
Populasi mikroorganisme rumen pada satu ternak dengan ternak yang lainnya
berbeda. Hal ini karena populasi mikroba rumen dipengaruhi oleh manajemen
pemberian pakan (Hobson dan Stewart, 1997). Menurut Suminar (2005), rumen
segar mengandung bakteri total 3,7 x 109 sel per ml, di dalam rumen adalah 102-105
per ml dan terdapat sebanyak 5 genus, sedangkan mikroba amilolitiknya 3,0 x 106
sel per ml, total mikroba selulolitik berjumlah 1,7 x 103 sel per ml, total mikroba
lipolitik 5,0 x 103 sel per ml, dan total mikroba pembentuk asam adalah 1,1 x 104 sel
per ml.
Metanogen merupakan salah satu jenis mikroba yang hidup di dalam rumen.
Metanogen bukan termasuk jenis bakteri, berbentuk eukariot. Jika dilihat dari
komponen selnya, metanogen dapat diindentifikasi sebagai antibodi. Hasil sisa dari
pencernaan metanogen berupa endapan yang akan menempel pada hidrogen sehingga
menghasilkan metan (Hobson dan Stewart, 1997).
Bakteri Rumen
Bakteri merupakan biomassa terbesar di dalam rumen, terdapat sekitar 50%
dari total bakteri hidup bebas dalam cairan rumen dan sekitar 30-40% menempel
pada partikel makanan. Bakteri mampu memecah struktur selulosa, hemiselulosa,
pectin, fruktosa, pati, dan polisakarida lainnya menjadi monomer atau dimer dari
12
dari species Micrococcus, Staphylococcus, Streptococcus, Corynebacterium,
Lactobasillus, Fusobacterium dan Propionibacterium ditemukan menempel pada
epitel dinding rumen, disamping itu terdapat spesies bakteri methanogen yang hidup
menempel pada protozoa (Dehority, 2004).
Bakteri rumen terdiri dari jenis gram positif dan gram negatif. Perbedaan
utama antara bakteri gram positif dan gram negatif terletak pada struktur dinding sel.
Dinding sel bakteri gram negatif merupakan struktur berlapis, sedangkan bakteri
gram positif mempunyai satu lapis yang tebal. Bakteri gram positif memiliki
kandungan peptidoglikan yang tinggi di bandingkan bakteri gram negatif, disamping
itu kandungan lipid pada dinding sel bakteri gram positif lebih rendah dari dinding
sel bakteri gram negatif (Waluyo, 2005).
Hungate (1966) telah mengidentifikasikan beberapa spesies bakteri yang
terdapat dalam rumen antara lain :
1. Sarcina bakteri : merupakan bakteri gram negatif yang berbentuk sel
batang dan mempunyai diameter 3-4 µm.
2. Borrelia : merupakan bakteri rumen yang berbentuk spiral.
3. Lapropedia : merupakan bakteri rumen yang berbentuk coccus.
4. Oscilospira guilliermondii : merupakan bakteri rumen yang bergerak bebas dan
berbentuk koma.
5. Selenomonas : merupakan bakteri rumen yang berflagel pada salah
satu sisinya dengan ukuran yang besar.
6. Peptostreptococcus elsdenii : merupakan bakteri berbentuk coccus rantai
panjang.
Bakteri yang penting dalam proses fermentasi pakan adalah bakteri yang
mampu mendegradasi selulosa dan hemiselulosa, pati, gula, protein. Bakteri
penghasil enzim selulolitik yang dapat diidentifikasi di dalam rumen adalah
Bacteroides amylophilus, Butyrivibrio sp., Selenomonas ruminantium, Lachnospiro
multipharus dan Peptostreptococcus elsdenii. Sebagian besar bakteri tersebut
mempunyai aktivitas exopeptidase (Arora, 1995).
Pertumbuhan bakteri dipengaruhi oleh adanya keberadaan gas atsmosfer
seperti oksigen dan karbondioksida. Terdapat empat kelompok besar bakteri, yaitu :
13 mikroorganisme yang tidak membutuhkan oksigen dalam hidupnya; (3) anaerob
fakultatif organisme yang dapat tumbuh dalam lingkungan aerobic maupun
anaerobic; (4) mikroaerofilik adalah organisme yang tumbuh dengan baik jika hanya
ada sedikit oksigen dalam lingkungannya (Pelezar dan Chan, 1986).
Hobson dan Stewart (1997) menyatkan bahwa bakteri di dalam rumen dapat
dibedakan berdasarkan jenis bahan yang dicernanya. Bakteri pencerna pati biasa
disebut bakteri amilolitik. Jumlah bakteri amilolitik di dalam rumen cukup banyak
dibanding bakteri lainnya. Bebrapa jenis bakteri amilolitik antara lain : (1)
Bacteroides ruminicola ; (2) Prevotella sp. ; (3) Succinivibrio dextrinosolvens ; (4)
Ruminobacter amylophilus. Bakteri pencerna serat dari tanaman biasa dikenal bakteri
selulolitik. Bakteri selulolitik menghasilkan enzim yang dapat menghidrolisis ikatan
glukosida 1,4, sellulosa dan dimer selobiosa. Sepanjang yang diketahui tak satupun
hewan yang mampu memproduksi enzim selulase sehingga pencernaan selulosa
sangat tergantung pada bakteri yang terdapat di sepanjang saluran pencernaan pakan.
Beberapa jenis bakteri yang termasuk dalam bakteri selulolitik antara lain,
Syntrophococcus sucromutans dan Ruminococcus species. Bakteri pencerna asam
amino dikenal dengan bakteri proteolitik. Asam amino dicerna dengan mengunakan
enzim peptidoglikan yang dihasilkan bakteri-bakteri proteolitik. Jenis bakteri
proteolitik antara lain Selenomonas ruminatium dan Ruminobacter amylophilus.
Protozoa Rumen
Protozoa merupakan mikroorganisme yang ada dalam rumen dengan jumlah
protozoa dalam rumen lebih sedikit bila dibandingkan dengan jumlah bakteri.
Ukuran tubuhnya lebih besar dengan panjang tubuh sekitar 20-200 mikron, oleh
karena itu biomassa total dari protozoa hampir sama dengan biomassa total bakteri
dan kontribusinya 60% dari biomassa rumen (McDonald et al., 2002). Protozoa
bersifat anaerob, apabila kadar oksigen atau pH isi rumen tinggi, maka protozoa
tidak dapat membentuk cyste untuk mempertahankan diri dari lingkungan yang jelek,
sehingga dengan cepat akan mati (Arora, 1995).
Jumlah protozoa di dalam rumen pada kondisi normal sekitar 106 sel/ml
cairan rumen. Hal tersebut dipengaruhi oleh ransum dan meliputi sekitar 40% dari
total nitrogen mikroba rumen (Hungate, 1966). Protozoa tidak mampu secara
14 pertumbuhan protozoa selain berasal dari protein pakan juga berasal dari bakteri
rumen yang dimangsanya. Sebesar 50 % dari nitrogen yang dikonsumsi protozoa
tersebut akan dikeluarkan dalam bentuk amonia dan asam-asam amino. Biomassa
protozoa dalam rumen bervariasi, tergantung jenis ransum yang dimakan ternak
induk semang. Pada ruminansia, protozoa yang bersilia berkembang di dalam rumen
dan membantu pencernaan zat-zat mkanan dari rumput-rumputan yang kaya akan
serat kasar. Protozoa jenis Holotrica terutama memecah gula terlarut seperti glukosa,
maltosa, sukrosa dan pati terlarut dan melepaskan asam asetat, asam butirat, asam
laktat, CO2, H2, dan amilopektin. Protozoa memangsa bakteri untuk memenuhi
kebutuhannya karena kemampuan protozoa untuk mensintesa asam amino dan
vitamin B kompleks sangat rendah. Protozoa memperoleh dua golongan zat makanan
tersebut dari bakteri dan dapat menghidrogenasi asam-asam lemak tak jenuh menjadi
asam lemak jenuh. Sebagian besar protozoa memakan bakteri untuk memperoleh
sumber nitrogen dan mengubah protein bakteri menjadi protein protozoa, bersamaan
dengan itu memperoleh tambahan sumber protein dan pati dari ingesta rumen
(Jouany, 1991). Protozoa juga bersimbiosis dengan bakteri metanogenik dengan
memproduksi H2 yang akan dimanfaatkan bakteri tersebut, untuk kemudian diubah
menjadi gas CH4 (Arora, 1995).
Leng et al. (1984) menyatakan bahwa sebagian besar biomassa protozoa tidak
tersedia untuk pencernaan di usus halus dikarenakan protozoa cenderung retained
(tertahan) di dalam rumen. Sebagian kecil saja protozoa yang mengalir ke organ
pasca rumen. Komposisi asam amino dan kecernaan sel protozoa lebih baik
dibandingkan sel bakteri, namun kelebihan ini hanya sedikit kontribusinya untuk
ternak induk semang dikarenakan aliran protozoa dari rumen sangat kecil.
Sumbangan atau andil biomassa protozoa rumen bagi nutrisi ternak induk semang
pada kenyataannya tidak begitu besar.
Ditinjau dari faktor inilah defaunasi merupakan langkah yang essensial jika
dapat mengontrol ekosistem mikroba dalam rumen sehingga menguntungkan proses
pencernaan (Jouany, 1991).
Produksi Gas Metan dalam Rumen
Pada sektor peternakan, gas metan (CH4) yang dibentuk merupakan hasil
15 (bakteri penghasil metan) di dalam rumen ternak ruminansia, dan selanjutnya
dikeluarkan ke atmosfer melalui proses eruktasi. Pembentukan gas metan di dalam
rumen merupakan hasil akhir dari fermentasi pakan. Emisi metan dari proses enterik
fermentation merupakan hasil fermentasi anaerob karbohidrat struktural maupun non
struktural oleh metanogen (bakteri penghasil metan) di dalam rumen ternak
ruminansia, dan selanjutnya dikeluarkan ke atmosfer melalui proses eruktasi.
Pembentukan gas metan di dalam rumen merupakan hasil akhir dari fermentasi
pakan. Fermentasi anaerobik menghasilkan gas bio yang terdiri dari metan sebanyak
30-50%, karbondioksida 25-45%, sedikit hidrogen, nitrogen dan hidrogen sulfide
(Soejono et al., 1990).
Pada prinsipnya, pembentukan gas metan di dalam rumen terjadi melalui
reduksi CO2 oleh H2 yang dikatalisis oleh enzim yang dihasilkan oleh bakteri
metanogenik. Menurut jalur reaksi seperti berikut:
CO2 + 4H2 ===> CH4 + 2H2O ; ΔG 0 = – 32,75 kJ/mol H2 (reaksi-1)
Metanogenesis dapat menyebabkan kehilangan energi hingga 15 % dari total
energi kimia yang tercerna (Boccazzi dan Patterson, 1995). Pembentukan gas metan
melalui jalur metanogenesis rumen berpengaruh besar terhadap pembentukan
produk-produk akhir fementasi di rumen, yakni terutama berpengaruh terhadap
jumlah mol ATP yang terbentuk, yang selanjutnya berpengaruh terhadap efisiensi
produksi mikrobial rumen (Pinares-Patino et al., 2001).
Populasi protozoa di dalam rumen berbanding langsung dengan produksi gas
metan, artinya produksi gas metan berkurang apabila populasi protozoa rumen
menurun. Dengan demikian, emisi gas metan dapat dikurangi dengan memberikan
zat defaunator seperti saponin. Penurunan populasi protozoa dapat meningkatkan
aktivitas bakteri amilolitik di dalam rumen, sehingga menghasilkan lebih banyak
asam propionat dan lebih sedikit gas metan. Dengan demikian, defaunasi
memberikan harapan untuk menurunkan kontribusi gas metan dari ternak ruminansia
terhadap akumulasi gas rumah kaca antara lain berdasarkan sifat toksik terhadap
bakteri metanogen, sehingga mengurangi reduksi CO2 oleh hidrogen, seperti
16
Percobaan in vitro
Menurut Hungate (1966), metode in vitro adalah proses metabolisme yang
terjadi di luar tubuh ternak. Prinsip dan kondisinya sama dengan proses yang terjadi
di dalam tubuh ternak yang meliputi proses metabolisme dalam rumen dan
abomasum. pH retikulo-rumen biasanya berkisar antara 5,5-7,0 dan bervariasi
dengan rasio pemberian konsentrat.
Metode in vitro (metode tabung) harus menyerupai sistem in vivo agar dapat
menghasilkan pola yang sama sehingga nilai yang didapat juga mendekati sistem in
vivo (Arora, 1995). Metode in vitro menurut Tilley dan Terry (1963) adalah metode
yang menyamakan kondisi lingkungan sama dengan kondisi di dalam rumen.
Metode pengukuran gas (gas test) digunakan untuk mengevaluasi nilai nutrisi
pakan dan kecernaan bahan organik serta energi metabolis yang terkandung dalam
pakan. Metode ini menggunakan syringe yang mengutamakan produk fermentasi.
Metode gas in vitro ini lebih efisien dibandingkan dengan metode in sacco dalam
mengevaluasi efek zat anti nutrisi. Metode pengukuran gas tidak memerlukan
peralatan yang rumit atau ternak yang terlalu banyak, membantu dalam pemilihan
pakan yang berkualitas tidak hanya berdasarkan kecernaan bahan kering, tetapi
sintesis mikroba juga. Hasil dari metode ini didapatkan berdasarkan produksi CO2
dan CH4 yang berasal dari proses fermentasi pakan dalam cairan rumen (Menke et
17
MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini berlangsung dari bulan Februari sampai Mei 2011 bertempat di
Laboratorium Pengembangan Teknologi Industri Agro dan Biomedika (LAPTIAB,
BPPT), Tangerang; Laboratorium Biokimia, Fisiologi, dan Mikrobiologi;
Laboratorium Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan,
Fakultas Peternakan, Institut Pertanian Bogor; dan Pusat Penelitian Surfaktan dan
Bioenergi, Bogor.
Materi
Peralatan yang dipergunakan dalam penelitian ini meliputi, piston, syring,
waterbath, spoit, autoclave, shaker waterbath, oven 60°C, counting chamber,
mikroskop cahaya.
Bahan yang digunakan dalam penelitian ini adalah meliputi ransum (rumput
gajah, konsentrat dan tepung daun kembang sepatu dan tepung ampas teh), cairan
rumen, larutan mikro mineral, larutan McDougall, larutan resazurin 0,1%, gas CO2,
garam formalin (formalin salin), K2HPO4, NaCl, (NH4)2SO4, KH2PO4, MgSO4,
CaCl2, Na2CO3, cystein, Na2HPO4, KCl, tricloro acetic acid (TCA) dan sulfo
salicylic acid (SSA), media BHI powder, carboxy methyl cellulose, kasein, susu
skim, pati, agar, glukosa, larutan hemin 0,05% dan vitamin.
Cairan rumen yang dipergunakan diambil dari sapi berfistula pada bagian
rumen yang dipelihara di Laboratorium Lapang Departemen Ilmu Nutrisi dan
Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor. Selama
pemeliharaan pakan yang diberikan yaitu terdiri dari rumput dan konsentrat. Air
minum diberikan secara ad libitum.
Prosedur
Pembuatan Ransum Penelitian
Ransum komplit mengandung bahan baku pakan yang terdiri dari rumput
gajah, konsentrat, tepung daun kembang sepatu dan ampas teh. Rumput gajah yang
digunakan dalam penelitian ini berasal dari laboratorium Agrostologi, kandang B,
18 1000 gram segar, kemudian rumput tersebut dikeringkan dengan matahari selama ± 6
jam dan selanjutnya digiling. Berat rumput kering adalah 220,86 gram, atau
rendemen 22%. Konsentrat dibuat dengan kandungan protein kasar sebesar 15,43%.
Bahan yang digunakan dalam pembuatan konsentrat meliputi : Pollard (34,25%);
Bungkil kelapa (29,33%); Onggok (25,07%); Tetes (5,26%); CaCO3 (3,04%); Urea
(1,31%); Premix (0,66%); Bungkil kedelai (0,64%); NaCl (0,44%). Bahan dicampur
di dalam ember besar dengan bahan yang lebih sedikit dicampur terlebih dahulu.
Pembuatan Tepung Daun Kembang Sepatu. Bahan tepung daun kembang sepatu berasal dari tanaman kembang sepatu yang berada di kawasan Pusat Penelitian Ilmu
Pengetahuan dan Teknologi (PUSPIPTEK) Serpong dan Laboratorium
Pengembangan Teknologi Industri Agro dan Biomedika (LAPTIAB, BPPT). Daun
kembang sepatu dikering matahari selama 48 jam. Setelah itu dikeringkan
menggunakan oven (60oC) selama 24 jam, kemudian daun yang sudah kering
digiling menggunakan mesin penggiling (disc mill) untuk mendapatkan tepung daun
kembang sepatu.
Persiapan Ampas Teh. Ampas teh didapatkan dari PT. Sinar Sosro, Bekasi. Ampas teh dibersihkan, dikering anginkan selama 48 jam dibawah terik matahari. Setelah itu
dikeringkan dengan menggunakan oven (60oC) selama 24 jam. Ampas teh yang
sudah kering digiling dengan menggunakan mesin penggiling (disc mill) untuk
mendapatkan tepung ampas teh. Selanjutnya ampas teh dan tepung daun kembang
sepatu dianalisis untuk mengetahui kadar tanin dan saponin.
Pengujian Fermentasi in vitro (Tilley dan Terry, 1963)
Pengambilan Cairan Rumen. Termos yang akan dipakai untuk tempat cairan rumen diisi dengan air panas sehingga suhunya mencapai 39oC kemudian ditutup.
Cairan rumen diambil dari sapi berfistula, kemudian diperas dengan menggunakan
kain kasa dan dimasukkan kedalam termos hangat.
Pembuatan Larutan Mc Dougal (Saliva Buatan). Sebanyak 5 liter air destilasi dimasukkan ke dalam labu takar yang bervolume 6 liter kemudian dimasukkan
bahan-bahan sbagai berikut NaHCO3 (58,8 gram), Na2HPO4.7H2O (42 gram), KCL
(3,42 gram), NaCl (2,82 gram), MgSO4.7H2O (0,72 gram) dan CaCl2 (0,24 gram).
19
ditambahkan CaCl2. Kemudian leher labu di cuci dengan air destilasi hingga
permukaan air mencapai tanda tera. Campuran lalu dikocok dengan gas CO2 secara
perlahan-lahan.
Fermentasi Pakan. Tabung fermentor diisi dengan 0,5 gram sampel ransum perlakuan terdiri dari 0,02 gram tepung rumput gajah, 0,03 gram konsentrat, ampas
teh (0; 1; 2; 3) mg/ml cairan rumen, dan tepung daun kembang sepatu (0; 0,15; 0,3)
mg/ml cairan rumen lalu ditambahkan 10 ml cairan rumen dan 40 ml larutan
McDougal. Tabung fermentor dikocok dengan cara mengaliri gas CO2 selama 30
detik (pH 6,5-6,9) dan ditutup dengan karet berventilasi. Tabung dimasukkan
kedalam shaker water bath dengan suhu 39 oC, dilakuan fermentasi selama 4 jam
untuk sampel VFA/NH3.
Pembuatan Larutan Media (Close dan Menke, 1986). Proses pembuatan larutan media untuk gas test, 0,1 ml larutan mineral mikro dicampur dengan 200 ml larutan
buffer rumen, lalu 200 ml larutan mineral makro juga ditambahkan, 1,0 ml larutan
resazurin 0,1% ditambahkan ke dalam campuran tadi, ditambah 40 ml larutan
pereduksi. Larutan ini dicampur menjelang akan digunakan dan dijaga pada
temperatur 39oC.
Persiapan Sampel Gas Test. Larutan media yang sudah diaduk dan dialiri gas CO2
ditempatkan dalam waterbath 39oC. Selanjutnya, cairan rumen sebagai sumber
inokulum diambil dan disaring. Satu bagian cairan rumen dicampur dengan 2 bagian
media dan diaduk dengan magnetic stirer lalu disimpan dalam waterbath dan dialiri
gas CO2. Sebanyak 30 ml campuran cairan rumen dan media dimasukkan
kemasing-masing syring menggunakan spuit. Udara yang ada didalam syring dikeluarkan dan
klep syringe ditutup. Posisi piston pada waktu sebelum inkubasi dicatat (Gb0). Piston
diinkubasi dalam waterbath selama 48 jam dan pencatatan posisi piston dilakukan
pada jam ke 2, 4, 6, 8, 12, 24, dan 48. Produksi gas diukur dengan menggunakan
20
Keterangan: FH = produksi gas standar dibagi dengan produksi sebenarnya dari hijauan, asumsi = 1 FC = produksi gas standar dibagi dengan produksi sebenarnya dari konsentrat, asumsi =1
Pengambilan Sampel Gas Metan. Sampel gas metan (CH4) diambil menggunakan
spoit 1 ml pada fase gas masing-masing syringe. Fase gas tersebut kemudian
dinjeksikan dan ditampung dalam tabung vakum untuk selanjutnya dianalisis
konsentrasi gas metan menggunakan Gas Chromatography. Dengan membaca
kromatogram standar acuan CH4 yang konsentrasinya sudah diketahui maka
konsentrasi CH4 sampel dapat diukur.
Perhitungan Populasi Protozoa (Ogimoto dan Imai, 1981) dan Bakteri (Hungate, 1966)
Perhitungan Populasi Protozoa. Sampel cairan diteteskan pada counting chamber
dan ditutup dengan cover glass sampai rata. Counting chamber yang digunakan
mempunyai ketebalan 0,1 mm, dengan luas kotak terkecil 0,0625 mm yang terdapat
16 kotak dan kotak yang dibaca sebanyak 5 kotak. Populasi protozoa diamati dengan
mikroskop lensa obyektif dengan pembesaran 40x dan okuler 10x. Populasi protozoa
dihitung dengan rumus:
Keterangan: C = jumlah koloni yang dihitung Fp = faktor pengencer (2)
Perhitungan Populasi Bakteri Total, Selulolitik, Amilolitik, dan Proteolitik.
Media tumbuh yang digunakan untuk menghitung populasi bakteri total adalah
medium BHI yaitu dengan cara mencampur bahan-bahan seperti BHI bubuk dengan
bahan sumber nutrisi mikroba lainnya, kemudian dimasukkan ke dalam botol yang
telah diautoclave. Campuran tersebut dipanaskan perlahan-lahan sambil dialiri gas
CO2 sampai terjadi perubahan warna dari coklat menjadi merah dan berubah lagi
menjadi coklat muda, lalu didinginkan. Selanjutnya media dimasukkan ke dalam
tabung Hungate masing-masing sebanyak 5 ml yang sebelumnya telah diisi agar
Bacto sebanyak 0,15 g, kemudian media disterilkan dalam otoklaf pada suhu 121ºC
selama 15 menit dengan tekanan 1,2 Kgf/cm3. Setelah siap, medianya digunakan
untuk pembiakan bakteri, media agar dimasukkan ke dalam penangas air pada suhu
21 proteolitik sama seperti perhitungan populasi total bakteri. Perbedaan terdapat pada
penggunaan medium yang disesuaikan dengan jenis bakteri tersebut. Medium
tumbuh bakteri selulolitik ditambah dengan carboxyl methyl celluloce (CMC),
medium tumbuh bakteri amilolitik ditambah dengan pati dan medium tumbuh bakteri
proteolitik ditambah dengan susu skim. Pengenceran dilakukan sebagai berikut : 0,05
ml cairan rumen dimasukkan ke dalam 4,95 ml media pengencer. Selanjutnya
diambil kembali 0,05 ml lalu dimasukkan ke dalam 4,95 ml media pengencer
berikutnya, perlakuan tersebut dilakukan sampai 4 kali (4 seri tabung). Selanjutnya
dari masing-masing seri tabung pengenceran diambil sebanyak 0,1 ml lalu ditransfer
ke media agar dan diputar sambil dialiri air, sehingga media dapat memadat secara
merata pada dinding tabung dalam. Tabung selanjutnya diinkubasi selama 2-3 hari.
Populasi bakteri dapat dihitung dengan rumus:
Keterangan: n = jumlah koloni yang terdapat pada tabung seri pengenceran ke-x
Rancangan dan Analisis Data
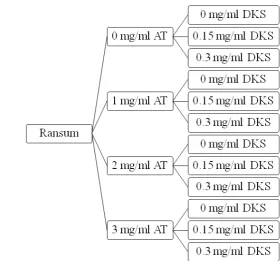
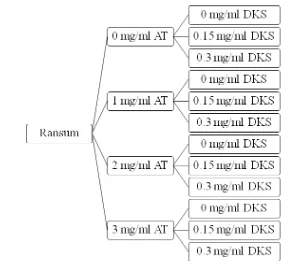
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan
Acak Kelompok (RAK) faktorial 4x3 dengan 4 kali ulangan secara duplo. Cairan
rumen ternak sapi berfistula digunakan sebagai ulangan yang dikelompokkan
22 Gambar 5. Diagram Rancangan Percobaan
Model matematik yang digunakan dalam analisa adalah :
Yijk = µ + αi + βj + αiβ + τk + εijk
Keterangan :
Yij : nilai faktor A ke-i, Faktor Bke-j, dan pengamatan kelompok ke-k
µ : rataan umum
αi : pengaruh faktor A (taraf pemberian tepung ampas teh) ke-i
βj : pengaruh faktor B (taraf pemberian tepung daun kembang sepatu) ke-j
αiβ : pengaruh interaksi faktor A ke-i dan faktor B ke-j
τk : pengaruh kelompok (cairan rumen) ke-k
23
HASIL DAN PEMBAHASAN
Ransum Komplit
Ransum yang digunakan dalam penelitian ini terdiri dari rumput gajah,
konsentrat, tepung daun kembang sepatu, dan ampas teh. Rumput gajah diperoleh
dari Laboratorium lapang Agrostologi IPB, sedangkan konsentrat dibuat sendiri
dengan mencampur beberapa bahan. Konsentrat yang dibuat mengandung protein
kasar sebesar 15,43%, nilai ini sudah memenuhi kebutuhan sapi perah berdasarkan
NRC 2001. Tillman et al. (1992) menyatakan bahwa rumput gajah mempunyai nilai
protein kasar yang cukup tinggi. Maka penggunaan rumput gajah dalam penelitian
ini sudah sesuai untuk sapi perah. Analisa proksimat bahan makanan yang digunakan
dalam penyusunan ransum komplit disajikan dalam Tabel 3.
Tabel 3. Kandungan Nutrien Ransum Berdasarkan 100% Bahan Kering
Nutrien
(%)
K H K:H=
40:60
AT DKS
Abu 14,65 6,43 9,72 14,28 10,48
PK 15,.43 14,58 14,92 22,28 14,91
24
SK 6,49 25,.37 17,82 16,78 13,.43
Beta-N 54,86 50,98 52,53 44,90 58,45
TDN 1) 76,67 61,91 67,81 69,04 68,29
Keterangan: 1) K=Konsentrat, H= Hijauan (Rumput Gajah), AT= Ampas Teh, DKS= Daun Kembang Sepatu 2) Analisa proksimat Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Dramaga Bogor (2011). 3) Perhitungan TDN dengan rumus (Hartadi,1980)
Rumus TDN = 92,464 - (3,338 x SK) - (6,945 x LK) - (0,762 x Beta-N) + (1,115 x PK) + (0,031 x SK2) - (0,133 x LK2) + (0,036 x SK x Beta-N) + (0,207 x LK x Beta-N) + (0,1 x LK x PK) - (0,022 x LK x PK)
Ampas teh diberikan dengan level 0; 1; 2; 3 mg/ml cairan rumen, sedangkan
tepung daun kembang sepatu diberikan pada level 0; 0,15; 0,3 mg/ml cairan rumen.
Ampas teh dan tepung daun kembang sepatu diberikan karena memiliki kandungan
saponin dan tanin yang merupakan agen defaunasi pada ruminansia. Tanin dan
saponin dalam dosis yang tepat tidak mengganggu kecernaan ternak. Kandungan
tanin dan saponin pada ampas teh dan daun kembang sepatu dapat dilihat pada tebel
4. Hasil uji fitokimia menunjukan bahwa kandungan tanin pada daun kembang
sepatu lebih besar daripada ampas teh. Hal ini terjadi diduga karena daun teh yang
digunakan pada penelitian ini mengalami fermentasi berulang sehingga kandungan
tanin pada ampas teh nya sudah sangat sedikit.
Tabel 4. Persentase Tanin dan Saponin pada Ampas Teh dan Daun Kembang Sepatu
Bahan (%)
Tanin Saponin
Ampas Teh 0,24 0,9
Daun Kembang Sepatu 0,48 7,68
Keterangan: Analisis di Laboratorium Balai Penelitian Ternak, Ciawi Bogor (2011)
Populasi Protozoa Total pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda
Hasil sidik ragam menunjukan bahwa tidak ada interaksi antara level
penambahan tepung ampas teh dan daun kembang sepatu terhadap populasi protozoa.
Penambahan tepung ampas teh pada level 3 mg/ml cairan rumen cenderung
menurunkan (P<0,1) populasi protozoa (Tabel 5). Tetapi penambahan tepung daun
kembang sepatu tidak mempengaruhi (P>0,1) jumlah protozoa. Penurunan jumlah
protozoa dengan penambahan ampas teh 3 mg/ml cairan rumen sebesar 1,73% yang
diduga karena tanin mengikat protein pakan di dalam rumen yang menyebabkan
25 bahwa tanin merupakan komponen polifenol yang mampu berikatan dengan protein
pakan, sehingga mampu menghambat transpor nutrien ke dalam mikroorganisme.
Sekitar 50% protein pakan akan didegradasi menjadi ammonia dan asam amino oleh
protozoa (Jouany, 1991).
Jumlah protozoa tidak dipengaruhi dengan penambahan tepung daun
kembang sepatu, diduga karena dalam penelitian ini menggunakan tepung daun
kembang sepatu dalam dosis yang masih rendah. Penggunaan ekstrak tumbuhan yang
mengandung saponin pada ternak ruminansia lebih efektif menekan protozoa.
Berdasarkan penelitian Fitri et al. (2010) kandungan saponin pada ekstrak daun
kembang sepatu adalah 23,33% sedangkan berdasarkan analisis Laboratorium Balai
Penelitian Ternak Ciawi Bogor (2011) kandungan saponin pada tepung daun
kembang sepatu hanya sebesar 7,68%. Pada penelitian ini, diduga protozoa akan
mampu beradaptasi terhadap keberadaan saponin yang rendah.
Wina et al. (2005) menyatakan bahwa bakteri rumen memiliki kemampuan
untuk mendegradasi sebagian saponin, sehingga saponin tidak memiliki kapasitas
untuk menekan populasi protozoa. Beberapa penelitian juga mengungkapkan bahwa
setelah 10 hari pemberian ransum yang mengandung saponin maka populasi
protozoa akan kembali normal akibat adanya proses adaptasi (Becker et al., 2005).
Tabel 5. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu Terhadap Populasi Protozoa Secara in vitro (dalam log)
Keterangan : Superskrip yang berbeda pada kolom yang sama berbeda pada (P<0,1).
Protozoa merupakan salah satu mikroba rumen yang ikut berperan dalam
fermentasi karbohidrat pakan dalam sistem rumen. Peranan protozoa saat ini masih Level Tepung
Ampas Teh (mg/ml)
26 dipertanyakan keberadaannya di dalam sistem pecerneaan. Sebagian ahli nutrisi
ruminansia menganggap bahwa protozoa dan bakteri bersaing dalam menggunakan
ransum. Protozoa bersifat memangsa bakteri sebagai sumber protein untuk
kehidupannya sehingga jumlah bakteri sebagai pencerna pakan dalam rumen akan
berkurang (Arora, 1995). Namun sebagian ahli berpendapat lain, yaitu protozoa
penting keberadaannya karena dapat menstabilkan pH saat fermentasi berlangsung
sehingga dapat berfungsi sebagai penyangga, karena mempunyai kemampuan
memecah pati lebih lama dibandingkan dengan bakteri (Jouany dan Ushida, 1989).
Jumlah protozoa di dalam rumen pada kondisi normal sekitar 104-106 sel/ml cairan
rumen (Kamra, 2005). Kisaran ini sama dengan populasi protozoa dalam penelitian
ini, yaitu 104.
Populasi Bakteri Total pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda
Hasil sidik ragam menunjukan bahwa tidak ada interaksi antara level
penambahan tepung ampas teh dan daun kembang sepatu terhadap populasi bakteri
total. Pemberian tepung ampas teh pada level 3 dan 2 mg/ml cairan rumen tidak
nyata meningkatkan (P>0,05) populasi bakteri total dibandingkan dengan kontrol.
Pemberian tepung daun kembang sepatu pada level 0,3 mg/ml cairan rumen juga
tidak nyata meningkatkan (P>0,05) pertumbuhan bakteri total (Tabel 6).
Tabel 6. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu Terhadap Populasi Bakteri Total Secara in vitro (dalam log)
Level Ampas Teh (mg/ml)
27
Keterangan : Superskrip yang berbeda pada kolom yang sama berbeda pada (P<0,05). Superskrip yang berbeda pada baris yang sama berbeda pada (P<0,05).
Tanin tidak mempengaruhi populasi bakteri total, diduga karena level
pemberian tannin masih cukup rendah sehingga bakteri mampu beradaptasi. Menurut
Gonzalez et al. (1990) ternak ruminansia dapat mentoleransi adanya senyawa
alkaloid dalam taraf yang rendah. Pada penelitian ini saponin tidak menghambat
pertumbuhan bakteri total, diduga karena bakteri mempunyai sel prokariotik
sehingga akan membentuk ikatan dengan kolesterol. Menurut Wina et al. (2005)
saponin mempunyai kemampuan untuk membentuk ikatan dengan kolesterol yang
ada pada membran sel eukariotik tetapi tidak pada sel prokariotik, sehingga adanya
saponin hanya akan mempengaruhi populasi protozoa tanpa menghambat
pertumbuhan bakteri. Kamra (2005) juga menyatakan bahwa zat anti nutrisi seperti
saponin dan tannin disintesis oleh tanaman untuk melindungi dari serangan mikroba,
oleh karena itu zat anti nutrisi memiliki aktivitas anti mikroba.
Rumen merupakan tempat hidup berbagai macam tipe bakteri dimana bakteri
tersebut berperan dalam proses mendegradasi berbagai komponen pakan. Interaksi
antara bakteri dengan mikroba rumen lainnya menghasilkan efek sinergis dalam
memproduksi hasil fermentasi seperti VFA dan protein mikroba di dalam rumen
(karma, 2005). Mikroorganisme yang ada di dalam rumen dapat hidup dan
melakukan aktivitasnya apabila kondisi lingkungannya mendukung.
Populasi Bakteri Proteolitik pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda
Hasil sidik ragam menunjukan bahwa tidak ada interaksi antara level
penambahan tepung ampas teh dan daun kembang sepatu terhadap populasi bakteri
proteolitik. Pemberian ampas teh sampai level 3 mg/ml tidak nyata mempengaruhi
(P>0,05) populasi bakteri proteolitik. Pemberian tepung daun kembang sepatu
sampai level 0,3 mg/ml cairan rumen juga tidak mempengaruhi (P>0,05) populasi
bakteri proteolitik (Tabel 7).
Tabel 7. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu Terhadap Populasi Bakteri Proteolitik Secara in vitro (dalam log)
28
Keterangan : Tidak berpengaruh nyata ( P>0,05).
Kandungan tanin dalam ampas teh pada penelitian ini diduga masih tergolong
rendah untuk dapat mengganggu aktivitas bakteri proteolitik. Ammar et al. (2008),
tannin yang terkandung dalam pakan akan didegradasi oleh bakteri pencerna tanin
dan oleh bakteri toleran terhadap tanin.
Level saponin yang diberikan pada penelitian ini juga tergolong rendah
(7,68%). Adaptasi bakteri terhadap saponin yaitu dengan cara mengembangkan
kemampuan bakteri untuk mendegradasi saponin dengan cepat (Wina et al., 2005).
Penelitian sebelumnya penggunaan ekstrak jarak pagar yang mengandung saponin
dan tanin sebesar 3%, tidak signifikan terhadap populasi bakteri proteolitik
(Wulandari, 2010). Hal ini menunjukan bahwa level pemberian tanin dan saponin
dalam penelitian masih tergolong sangat rendah yaitu 0,0037% dari saponin dan
tanin dalam ampas teh dan tepung daun kembang sepatu.
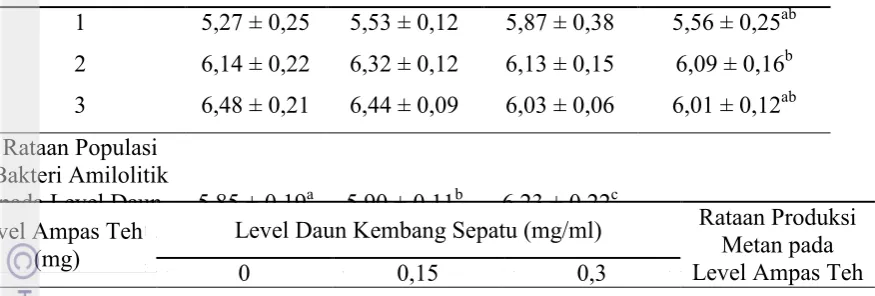
Populasi Bakteri Selulolitik pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda
Hasil sidik ragam menunjukan bahwa tidak ada interaksi antara level
penambahan tepung ampas teh dan daun kembang sepatu terhadap populasi bakteri
selulolitik. Pemberian tepung ampas teh pada level 2 dan 3 mg/ml cairan rumen
nyata meningkatkan (P<0,05) populasi bakteri selulolitik. Pemberian tepung daun
Level Ampas Teh (mg/ml)
Level Daun Kembang Sepatu (mg/ml)
29 kembang sepatu pada level 0,15 dan 0,3 mg/ml cairan rumen juga nyata
meningkatkan (P<0,05) populasi bakteri selulolitik (Tabel 8).
Ampas teh dalam penelitian ini meningkatkan populasi bakteri selulolitik, hal
ini disebabkan karena kandungan serat kasar ampas teh tinggi yaitu sebesar 16% BK.
Nurlaela (2006) menyatakan kandungan serat kasar yang tinggi akan mempengaruhi
populasi bakteri pecerna serat kasar di dalam rumen. Saponin dalam penelitian ini
meningkatkan populasi bakteri selulolitik, hal ini diduga saponin merupakan agen
defaunasi bagi protozoa di dalam rumen sehingga populasi protozoa menurun.
Wiseman dan Cole (1990) menyatakan penggunaannya sebagai agen defaunasi
karena protozoa dianggap predator bakteri sehingga keberadaan protozoa dapat
menurunkan populasi bakteri dan suplai protein mikroba ke organ pasca rumen.
Berbeda dengan penelitian sebelumnya penambahan.Ekstark antinurtisi jarak pagar
sebesar 3% yang mengandung saponin dan tanin 0,2% tidak mempengaruhi populasi
bakteri selulolitik (Wulandari, 2010). Hal ini diduga karena dalam penelitian ini
ampas teh menyumbangkan serat kasar juga sehingga populasi bakteri selulolitik
sebagai bakteri pencerna serat kasar bertambah.
Tabel 8. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu Terhadap Populasi Bakteri Selulolitik Secara in vitro (dalam log)
Level Ampas Teh (mg/ml)
Level Daun Kembang Sepatu (mg/ml) Rataan Populasi Bakteri Selulolitik pada Level Ampas Teh
30
Keterangan : Superskrip yang berbeda pada kolom yang sama berbeda pada (P<0,05). Superskrip yang berbeda pada baris yang sama berbeda pada (P<0,05).
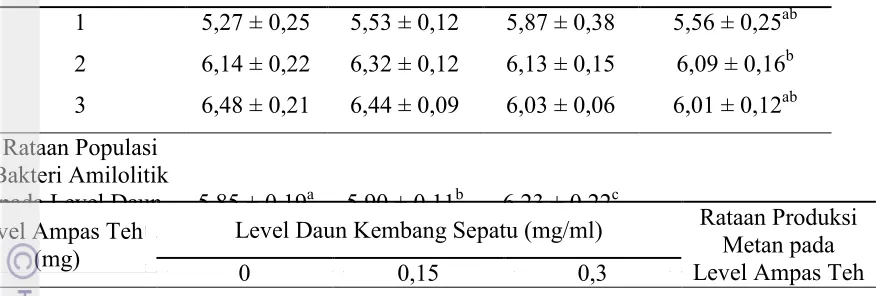
Populasi Bakteri Amilolitik pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda
Hasil sidik ragam menunjukan bahwa tidak ada interaksi antara level
penambahan tepung ampas teh dan daun kembang sepatu terhadap populasi bakteri
amilolitik. Pemberian tepung ampas teh pada level 3 dan 1 mg/ml cairan rumen
cenderung meningkatkan (P<0,1) populasi bakteri amilolitk rumen. Pemberian
tepung daun kembang sepatu dengan level 0,15 dan 0,3 mg/ml cairan rumen
cenderung meningkatkan (P<0,1) populasi bakteri amilolitik pada rumen (Tabel 9).
Populasi bakteri amilolitik cenderung meningkat dengan pemberian ampas
teh dan tepung daun kembang sepatu dalam penelitian ini diduga disebabkan karena
penurunan populasi protozoa dengan pemberian tepung ampas teh sehingga
menyebabkan populasi amilolitik meningkat. Penurunan populasi protozoa
mengakibatkan bertambahnya pati yang dapat difermentasi oleh bakteri amilolitik.
Brock dan Madigan (1991) menyatakan bahwa protozoa lebih menyukai substrat
yang mudah difermentasi seperti pati dan gula.
Tabel 9. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu Terhadap Populasi Bakteri Amilolitik Secara in vitro (dalam log)
yang Berbeda
31
Keterangan : Superskrip yang berbeda pada kolom yang sama berbeda pada (P<0,1). Superskrip yang berbeda pada baris yang sama berbeda pada (P<0,1).
Produksi Gas Metan pada Level Tepung Daun Kembang sepatu dan Ampas Teh yang Berbeda
Hasil sidik ragam menunjukan bahwa tidak ada interaksi antara level
penambahan tepung ampas teh dan daun kembang sepatu terhadap produksi metan.
Pemberian tepung ampas teh sampai dengan level 3 mg/ml cairan rumen tidak nyata
mempengaruhi (P>0,1) produksi metan. Pemberian tepung daun kembang sepatu
sampai level 0,3 juga tidak mempengaruhi (P>0,05) produksi metan (Tabel 10).
Kecenderungan penurunan produksi gas metan dengan penambahan tepung
ampas teh pada ransum disebabkan karena tanin juga merupakan salah satu agen
defaunasi bagi protozoa. Selain itu, tanin dari ampas teh akan mematikan metanogen,
karena merupakan zat racun bagi metanogen. Menurut Jouany (1991) defaunasi akan
menyebabkan penurunan produksi gas metan sebanyak 30 sampai 45%. Lebih lanjut
dijelaskan oleh Finlay et al. (1994) bahwa proses metanogenesis terjadi sebanyak
37% dari hubungan endosimbiosis antara protozoa dan bakteri metanogen. Hess et
al. (2003) menyatakan bahwa tanin dari legum merupakan racun bagi metanogen.
Metanogen juga bersimbiosis dengan protozoa, sehingga perubahan metanogen
mungkin disebabkan karena danya perubahan populasi protozoa. Dalam penelitian
ini jumlah protozoa menurun akibat penambahan tanin sehingga gas metan juga
menurun.
Tabel 10. Pengaruh Tepung Ampas Teh dan Daun Kembang Sepatu Terhadap Produksi Metan Secara in vitro
Level Daun Kembang Sepatu (mg/ml) Rataan Produksi
Metan pada Level Ampas Teh
32
Keterangan : Superskrip yang berbeda pada kolom yang sama berbeda pada (P<0,1).
Saponin sebagai agen defaunasi juga dalam penelitian ini tidak berpengaruh
dalam produksi metan, hal ini mungkin disebabkan karena rendahnya kadar saponin
yang terkadung dalam tepung daun kembang sepatu yang hanya 7,68%. Pada
penelitian ini, diduga protozoa akan mampu beradaptasi terhadap keberadaan
saponin. Wina et al. (2005) menyatakan bahwa bakteri rumen memiliki kemampuan
untuk mendegradasi sebagian saponin, sehingga saponin tidak memiliki kapasitas
untuk menekan populasi protozoa. Penelitian sebelumnya, penambahan 8 mg saponin
dari ampas teh dapat menurunkan gas metan sampai 26% (Wei et al.,2005). Hal ini
menunjukan bahwa pemberian saponin dengan level 0,3 mg masih terlalu rendah.
KESIMPULAN DAN SARAN
Kesimpulan
Tidak ada interaksi antara level pemberian tepung ampas teh dan tepung daun
kembang sepatu. Penambahan tepung ampas teh level 2 mg dapat menurunkan
populasi protozoa, meningkatkan jumlah bakteri amilolitik dan selulolitik, namun
tidak memberikan pengaruh terhadap populasi bakteri proteolitik dan jumlah total yang Berbeda
0 186,38 ± 17,24 294,05 ± 26,23 220,88 ± 9,03 233,77 ± 8,60a
1 170,93 ± 12,99 216,63 ± 32,84 239,42 ± 19,45 208,99 ± 10,13ab
2 212,71± 27,18 200,94 ± 1,52 180,99 ± 25,67 198,21 ± 14,40a
3 216,69 ± 75,22 234,37 ± 55,13 216,44 ± 3,08 222,50 ± 37,23b
Rataan produksi Metan pada Level
Daun Kembang Sepatu yang
Berbeda