IRMA AMALIA PRATIWI. Efek Pemberian Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.) terhadap Proliferasi dan Diferensiasi Sel Tulang Tikus Secara In Vitro. Dibimbing oleh ITA DJUWITA dan ADI WINARTO.
Penelitian ini dilakukan secara in vitro pada sel tulang tikus berumur empat minggu dalam medium DMEM (Dulbecco’s Modified Eagle’s Medium) yang diberi penambahan 10% NBCS (Newbor Calf Serum), 10% AANE (Asam Amino Non Esensial), NaHCO3, 1 µl/mL ITS (Insulin Transferrin Selenium), dan 50 µg/mL gentamicyn (mDMEM), dengan/tanpa penambahan ekstrak batang sipatah-patah (Cissus quadrangula Salisb.). Terdapat lima grup yang diberi perlakuan, terdiri atas kontrol positif (mDMEM+Dexametason 10-8M), kontrol negatif (mDMEM), dosis 1 (mDMEM+CQ 0.3 mg/mL), dosis 2 (mDMEM+CQ 0.6 mg/mL), dan dosis 3 (mDMEM+CQ 1.2 mg/mL). Kultur diinkubasi dalam inkubator dengan suhu 37 °C dan 5% CO2 selama tujuh hari. Parameter yang diamati adalah Population Doubling Time (PDT) yang dihitung menggunakan hemositometer. Osteoblas dan osteosit diwarnai dengan Hematoksilin Eosin kemudian dihitung jumlah dan diukur diameternya dengan menggunakan mikrometer. Data kuantitatif dianalisis menggunakan uji ANOVA dan DUNCAN. Hasil menunjukkan bahwa ekstrak batang sipatah-patah dengan dosis 0.3 mg/mL, 0.6 mg/mL, dan 1.2 mg/mL dapat meningkatkan proliferasi (P<0.05) dan pada dosis 0.6 mg/mL dapat menginduksi terjadinya diferensiasi osteoblas menjadi osteosit (P<0.05). Diferensiasi dapat dilihat dengan adanya penurunan diameter osteoblas dan peningkatan persentase osteosit dalam kultur. Dosis optimal pemberian ekstrak tanaman sipatah-patah (Cissus quadrangula Salisb.) untuk proliferasi dan diferensiasi sel tulang secara in vitro adalah 0.6 mg/mL.
Kata kunci : kultur sel, ekstrak batang sipatah-patah (Cissus quadrangula Salisb.), tulang.
(
Cissus quadrangula
Salisb.) TERHADAP PROLIFERASI DAN
DIFERENSIASI SEL TULANG TIKUS SECARA
IN VITRO
IRMA AMALIA PRATIWI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi dengan judul Efek Pemberian Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.) terhadap Proliferasi dan Diferensiasi Sel Tulang Tikus secara In Vitro adalah karya saya sendiri dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka bagian akhir skripsi.
Bogor, Oktober 2011
IRMA AMALIA PRATIWI. The Effect of Cissus quadrangula Salisb. Extract Against The Proliferation and Differentiation of Rat Bone Cells In Vitro. Under direction of ITA DJUWITA and ADI WINARTO.
Research has been conducted on in vitro culture of four weeks old rat (Sprague Dawley) bone cells in DMEM (Dulbecco’s Modified Eagle’s Medium) containing 10% NBCS (Newborne Calf Serum), 10% NEAA (Non Essential Amino Acid), NaHCO3, 1 µl/mL ITS (Insulin Transferrin Selenium), and 50 µg/mL gentamycin (mDMEM), with and without Cissus quadrangula Salisb. extracts (CQ). There are five groups of treatment, consisted of positive control (mDMEM+dexamethasone 10-8 M), negative control (mDMEM), dose 1 (mDMEM+CQ 0.3 mg/mL), dose 2 (mDMEM+CQ 0.6 mg/mL), and dose 3 (mDMEM+CQ 1.2 mg/mL). Culture was done in 5% CO2 incubator at 37 0 C for 7 days. The parameters observed were Population Doubling Time (PDT) done based on calculation using hemocytometer. Osteoblast and osteocyte were stained with Hematoxylin Eosin (HE), and the compotition and diameter of the cell were counted and measured using micrometer. Data were analyzed using statistical ANOVA and Duncan test. The results showed that Cissus quadrangula Salisb. extract at doses 0.3 mg/mL, 0.6 mg/mL, and 1.2 mg/mL increased the bone cells proliferation (P<0.05) and at dose 0.6 mg/mL induced differentiation osteoblast to osteocyte (P<0.05). Differentiation showed by the decreasing diameter of osteoblast thus by increased percentage of osteocyte.In conclusion, the optimal dose of Cissus quadrangula Salisb. extract for in vitro bone cells proliferation and differentiation is 0.6 mg/mL.
IRMA AMALIA PRATIWI. Efek Pemberian Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.) terhadap Proliferasi dan Diferensiasi Sel Tulang Tikus Secara In Vitro. Dibimbing oleh ITA DJUWITA dan ADI WINARTO.
Penelitian ini dilakukan secara in vitro pada sel tulang tikus berumur empat minggu dalam medium DMEM (Dulbecco’s Modified Eagle’s Medium) yang diberi penambahan 10% NBCS (Newbor Calf Serum), 10% AANE (Asam Amino Non Esensial), NaHCO3, 1 µl/mL ITS (Insulin Transferrin Selenium), dan 50 µg/mL gentamicyn (mDMEM), dengan/tanpa penambahan ekstrak batang sipatah-patah (Cissus quadrangula Salisb.). Terdapat lima grup yang diberi perlakuan, terdiri atas kontrol positif (mDMEM+Dexametason 10-8M), kontrol negatif (mDMEM), dosis 1 (mDMEM+CQ 0.3 mg/mL), dosis 2 (mDMEM+CQ 0.6 mg/mL), dan dosis 3 (mDMEM+CQ 1.2 mg/mL). Kultur diinkubasi dalam inkubator dengan suhu 37 °C dan 5% CO2 selama tujuh hari. Parameter yang diamati adalah Population Doubling Time (PDT) yang dihitung menggunakan hemositometer. Osteoblas dan osteosit diwarnai dengan Hematoksilin Eosin kemudian dihitung jumlah dan diukur diameternya dengan menggunakan mikrometer. Data kuantitatif dianalisis menggunakan uji ANOVA dan DUNCAN. Hasil menunjukkan bahwa ekstrak batang sipatah-patah dengan dosis 0.3 mg/mL, 0.6 mg/mL, dan 1.2 mg/mL dapat meningkatkan proliferasi (P<0.05) dan pada dosis 0.6 mg/mL dapat menginduksi terjadinya diferensiasi osteoblas menjadi osteosit (P<0.05). Diferensiasi dapat dilihat dengan adanya penurunan diameter osteoblas dan peningkatan persentase osteosit dalam kultur. Dosis optimal pemberian ekstrak tanaman sipatah-patah (Cissus quadrangula Salisb.) untuk proliferasi dan diferensiasi sel tulang secara in vitro adalah 0.6 mg/mL.
Kata kunci : kultur sel, ekstrak batang sipatah-patah (Cissus quadrangula Salisb.), tulang.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
(
Cissus quadrangula
Salisb.) TERHADAP PROLIFERASI DAN
DIFERENSIASI SEL TULANG TIKUS SECARA
IN VITRO
IRMA AMALIA PRATIWI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Nama Mahasiswa NIM
: :
Irma Amalia Pratiwi B04070088
Disetujui
Dr. Drh. Ita Djuwita, M.Phil Pembimbing I
Drh. Adi Winarto, Ph.D Pembimbing II
Diketahui
Drh. Agus Setiyono, MS, Ph.D
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
Puji syukur kehadirat Allah SWT atas berkat rahmat, nikmat, dan karunia-Nya sehingga skripsi ini dapat diselesaikan dengan baik oleh penulis. Skripsi ini merupakan hasil penelitian yang dilakukan pada bulan Januari sampai dengan Oktober 2011 yang bertempat di Laboratorium Embriologi dan Laboratorium Histologi FKH IPB. Skripsi ini berjudul “Efek Pemberian Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.) terhadap Proliferasi dan Diferensiasi Sel Tulang Tikus secara In Vitro”.
Terima kasih penulis ucapkan kepada Dr. drh. Ita Djuwita, M. Phil.dan drh. Adi Winarto, Ph. D sebagai dosen pembimbing yang telah memberikan bimbingan, pengarahan, dan pembelajaran kepada penulis sehingga penulis mampu menyelesaikan skripsi ini dengan baik. Penulis juga menyampaikan ucapan terima kasih kepada Dr. Drh. Mustafa Sbari, Drh. Huda Darusman dan Drh. Min Rahminiwati, MS, Ph.D atas bimbingannya, Seluruh dosen dan staf Laboratorium Embriologi dan Laboratorium Histologi FKH IPB; Kak Vid, Kak Rani, Kak Devi, Kak Yeni, Ibu Eka, Mas Wahyu, Mas Iwan, Pak Maman atas bantuannya selama penelitian berlangsung; teman-teman satu penelitian (Yunita, Ani, Disa, dan Yeni) atas kerjasama, bantuan serta pelajaran selama penelitian.
Ucapan terimakasih juga penulis sampaikan kepada ayahanda (Priyanto), ibunda (Marsitiningsih), Kakak dan adik (Arif, Endah, dan Okta) yang selalu memberikan doa, dukungan, dan semangat kepada penulis. Ucapan terima kasih kepada Yoga Herawan atas dukungan, semangat, doa, dan kebersamaannya. Terakhir keluarga besar GIANUZZI 44 FKH IPB yang telah bersama dalam suka dan duka selama menempuh pendidikan di FKH IPB.
Penulis berharap skripsi ini dapat memberikan sumbangan terhadap ilmu pengetahuan. Akhirnya, semoga skripsi ini memberikan manfaat baik bagi penulis maupun bagi pembaca.
Bogor, Oktober 2011
Penulis dilahirkan di Palembang pada tanggal 23 Desember 1989 dari pasangan Bapak Priyanto dan Ibu Marsitiningsih. Penulis merupakan anak kedua dari empat bersaudara.
Halaman
DAFTAR TABEL ... i
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... iii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 2
Manfaat ... 3
TINJAUAN PUSTAKA Tulang... ... 4
Perkembangan Tulang (Osteogenesis)... . 5
Struktur Tulang... ... 6
Osteoblas... .. 6
Osteosit... ... 7
Osteoklas... .. 8
Tanaman Sipatah-patah (Cissus quadrangula Salisb.) ... 9
Kultur In Vitro ... 12
Kultur Tulang ... 14
METODE PENELITIAN Waktu dan Tempat ... 16
Alat dan Bahan ... 16
Metode ... 16
Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.) ... 16
Persiapan Kultur Sel Tulang ... 16
Isolasi dan Kultur Sel Tulang ... 17
Evaluasi Hasil Kultur Sel Tulang ... 17
Tingkat Proliferasi (PDT) ... 17
Identifikasi Diferensiasi Osteoblas dan Osteosit... 18
Rancangan Percobaan ... 18
HASIL DAN PEMBAHASAN Tingkat Proliferasi Berdasarkan Population Doubling Time (PDT) ... 20
Diferensiasi Sel Tulang ... 21
Komposisi Jumlah Osteoblas dan Osteosit... 21
Diameter Osteoblas dan Osteosit... ... 23
SIMPULAN DAN SARAN Simpulan ... 26
Saran ... 26
DAFTAR PUSTAKA ... 27
DAFTAR TABEL
Halaman
1 Tingkat proliferasi sel tulang pada masing-masing perlakuan ... 20
2 Persentase osteoblas dan osteosit pada masing-masing perlakuan ... 22
DAFTAR GAMBAR
Halaman
1 Gambaran sel osteogenik, osteoblas, osteosit, dan osteoklas... ... 9
2 Morfologi tanaman sipatah-patah ... 10
3 Osteoblas ... 15
4 Osteosit ... 15
5 Morfologi sel tulang dalam kultur ... ... 21
DAFTAR LAMPIRAN
Halaman
1 Hasil analisis ANOVA dan Duncan (PDT) ... 32
2 Hasil analisis ANOVA dan Duncan (Persentase osteoblas dan osteosit) 34
3 Hasil analisis ANOVA dan Duncan (Diameter osteoblas dan osteosit) 36
I.
PENDAHULUAN
1.1. Latar Belakang
Tulang merupakan bagian tubuh yang memiliki banyak fungsi diantaranya
pembentuk rangka tubuh, alat gerak tubuh, tempat penyimpanan kalsium dan pada
tulang panjang terdapat sumsum tulang yang memiliki sifat pluripoten yang dapat
menghasilkan sel-sel lain bagi tubuh. Tulang terdiri atas interseluler material
terkalsifikasi, matriks tulang, dan tiga tipe sel yaitu osteosit yang dapat ditemukan
di ruang (lakuna) diantara matriks; osteoblas yang merupakan tempat sintesis
komponen organik dari matriks; dan osteoklas yang merupakan sel raksasa
multinuklear yang terlibat dalam proses resorpsi dan pembentukan jaringan tulang
(Junqueira dan Carneiro 2005).
Salah satu penyakit pada tulang adalah osteoporosis. Osteoporosis adalah
penyakit tulang sistemik yang ditandai dengan kepadatan tulang yang rendah dan
kerusakan jaringan tulang pada struktur mikro tulang yang menyebabkan
terjadinya kerapuhan pada tulang (WHO 2003). Osteoporosis sering dijumpai
pada manusia usia lanjut terutama wanita pascamenopause (Ott 2002). Salah satu
upaya untuk menanggulangi osteoporosis ini adalah dengan menggunakan
preparat estrogen sintesis namun memiliki banyak efek samping diantaranya dapat
menyebabkan timbulnya kanker. Estrogen merupakan salah satu faktor yang
sangat diperlukan dalam mengaktifkan osteoblas di jaringan endosteum di sekitar
jaringan myeloid sumsum merah pada individu dewasa. Faktor lain yang
mempengaruhi aktivitas osteoblas adalah nutrisi, hormon paratiroid, vitamin D,
sitokin, kortisol, dan aktivitas individu (Smith 1993). Kini telah banyak
dikembangkan pengobatan osteoporosis antara lain dengan menambahkan asupan
mineral dalam tubuh, konsumsi vitamin A, vitamin C, vitamin D, peningkatan
aktivitas fisik, dan penggunaan bahan alami dari tanaman yang mengandung
fitoestrogen.
Sejak dahulu masyarakat telah mengenal beberapa tanaman untuk
penyakit kelamin, dan osteoporosis (Shirwaikar et al. 2003). Di Indonesia, khususnya di Aceh, telah diketahui tanaman yang memiliki khasiat mempercepat
persembuhan tulang secara tradisional adalah tanaman sipatah-patah (Cissus quadrangula Salisb.). Tanaman sipatah-patah di Aceh sering digunakan untuk pengobatan beberapa penyakit di antaranya adalah rematik dan patah tulang.
Pengobatan rematik dilakukan dengan meminum rebusan daun tanaman tersebut,
yang ditambahkan dengan unsur-unsur yang lain. Sementara itu untuk mengobati
patah tulang, dilakukan dengan cara menggerus daun sipatah-patah lalu
ditempelkan pada tempat yang patah. Tanaman ini memiliki morfologi yang
hampir serupa dengan tanaman yang berasal dari India (Cissus quadrangularis
Linn.). Menurut Sabri (2011), kandungan kalsium, fosfor serta fitoestrogen yang
berasal dari ekstrak batang ini telah dibuktikan secara in vivo dapat mencegah osteoporosis pada tikus betina prapubertas dan mengobati osteoporosis pada tikus
ovariektomi.
Kepadatan tulang sangat ditentukan oleh keutuhan mikroarsitektur tulang
sebagai hasil keseimbangan antara proses remodeling tulang yaitu proses formasi dan reabsorbsi tulang. Kepadatan tulang yang didapat selama masa pertumbuhan
merupakan faktor yang menentukan terjadinya kasus osteoporosis di kemudian
hari. Individu dengan kepadatan tulang yang tinggi pada masa pertumbuhan
sampai masa premenopause akan terhindar dari osteoporosis pada masa
pascamenopause (Compston et al. 1993). Kepadatan tulang antara lain dipengaruhi oleh beberapa faktor yakni cara hidup (pola makan, aktivitas fisik,
asupan kalsium, dan merokok), obesitas, jumlah anak, laktasi, usia pertama kali
hamil, penyakit kelenjar tiroid, dan penggunaan obat-obat kontrasepsi hormonal
(Winarno 1998). Pada percobaan yang dilakukan oleh Sabri (2011) pada tikus
prapubertas, pemberian ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) secara in vivo dapat meningkatkan kepadatan tulang dilihat dari densitas tulang yang semakin radiopaque pada hasil gambaran radiologi tulang dibandingkan dengan kontrol. Kandungan kalsium, fosfor dan fitoestrogen yang tinggi dari
ekstrak ini dapat meningkatkan kepadatan tulang pada masa prapubertas dan dapat
Efek pemberian ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) pada sel tulang tikus muda (prapubertas) secara in vitro belum diketahui sehingga dilakukan penelitian untuk mengetahui efek ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) terhadap proliferasi dan diferensiasi sel tulang tikus secara
in vitro.
1.2. Tujuan
Tujuan penelitian ini adalah untuk mengetahui efek pemberian ekstrak
batang (Cissus quadrangula Salisb.) terhadap proliferasi dan diferensiasi sel tulang tikus yang ditumbuhkan secara in vitro pada beberapa tingkatan konsentrasi ekstrak batang sipatah-patah (Cissus quadrangula Salisb.).
1.3 Manfaat
Manfaat dari penelitian ini adalah untuk memberikan informasi kemampuan
II.
TINJAUAN PUSTAKA
2.1 TulangTulang merupakan jaringan penghubung yang terdiri dari material
interselular yang terkalsifikasi, matriks tulang, dan tiga tipe sel tulang yaitu
osteosit yang dapat ditemukan di ruang (lakuna) diantara matriks; osteoblas yang
merupakan tempat sintesis komponen organik dari matriks; dan osteoklas yang
merupakan sel raksasa multinuklear yang terlibat dalam proses resorpsi dan
pembentukan jaringan tulang (Junqueira dan Carneiro 2005). Secara makroskopis
tulang tersusun atas beberapa bagian, yakni diafise, epifise, metafise, tulang rawan
artikular, periosteum, ruang medullar, dan osteum. Secara mikroskopis tulang
terbentuk atas tiga jenis sel tulang, matriks ekstraselular tulang, dan
saluran-saluran yang tersusun secara sempuna dan kompak (Tortora dan Derrickson
2009). Tulang mempunyai beberapa fungsi utama, antara lain (1) sebagai
penyokong tubuh, dengan membentuk kerangka dan tempat perlekatan tendon
otot; (2) sebagai pelindung organ internal tubuh; (3) membantu pergerakan tubuh
bersama otot; (4) homeostasis mineral terutama kalsium dan fosfor; (5) produksi
sel darah merah oleh sumsum tulang merah; dan (6) penyimpanan trigliserida oleh
sumsum tulang kuning (Junqueira dan Carneiro 2005; Tortora dan Derrickson
2009).
Tulang secara dinamis dan terus menerus melakukan proses remodeling,
yakni proses penyusunan jaringan tulang baru dan perombakan jaringan tulang
lama. Proses remodeling sangat aktif terjadi pada individu muda 200 kali lebih cepat dibanding individu dewasa. Proses remodeling dan fungsi homeostasis mineral terutama kalsium dan fosfor pada tulang antara lain dipengaruhi oleh
hormon dalam tubuh seperti parathormon, kalsitonin, dan estrogen. Defisiensi
kalsium pada individu muda dapat menyebabkan terjadinya penyakit riketsia
sedangkan pada individu dewasa menyebabkan osteomalacia. Osteomalacia
berbeda dengan osteoporosis pada individu dewasa. Osteomalacia diakibatkan
oleh defisiensi kalsium per unit dari matriks tulang sehingga kalsifikasi tulang
terganggu. Sedangkan osteoporosis lebih sering terjadi pada individu dewasa
proses resorpsi tulang lebih tinggi dibanding dengan proses pembentukan tulang
(Junqueira dan Carneiro 2005).
2.1.1 Perkembangan Tulang (Osteogenesis)
Proses pembentukan tulang disebut osteogenesis atau osifikasi.
Perkembangan sel prekusor tulang dibagi ke dalam tahapan perkembangan yakni
1. mesenchymal stem cells 2. Sel-sel osteoprogenitor 3. Pre-osteoblas 4.
Osteoblas, dan 5. Osteosit matang. Setelah sel progenitor membentuk garis
osteoblastik, kemudian dilanjutkan dengan tiga tahap perkembangan diferensiasi
sel yaitu proliferasi, pematangan matrik, dan mineralisasi. Faktor pertumbuhan
tulang tergantung pada herediter, nutrisi, vitamin, mineral, hormon, dan latihan
atau stres pada tulang (Scalon dan Sanders 2007). Osifikasi adalah istilah lain
untuk pembentukan tulang. Osifikasi (osteogenesis) berdasarkan asal
embriologisnya terdapat dua jenis osifikasi, yaitu ossifikasi intramembran yang
terjadi pada sel mesenkim yang berdiferensiasi menjadi osteoblas di pusat
ossifikasi secara langsung tanpa pembentukan kartilago terlebih dahulu dan
osifikasi endokondral yaitu mineralisasi jaringan tulang yang dibentuk melalui
pembentukan kartilago terlebih dahulu (Leeson et al. 1996; Junqueira dan Carneiro 2005).
a. Osifikasi intramembran
Pada osifikasi intramembran, perkembangan tulang terjadi secara
langsung. Selama ossifikasi intramembran, sel mesenkim berproliferasi ke dalam
area yang memiliki vaskularisasi yang tinggi pada jaringan penghubung
embrionik dalam pembentukan kondensasi sel atau pusat osifikasi primer (Leeson
et al. 1996; Junqueira dan Carneiro 2005). Sel ini akan mensintesis matriks tulang pada bagian periperal dan sel mesenkimal berlanjut untuk berdiferensiasi menjadi
osteoblas. Setelah itu, tulang akan dibentuk kembali dan semakin digantikan oleh
tulang lamela matang/dewasa. Proses osifikasi ini merupakan sumber
pembentukan tulang pipih, salah satu diantaranya yaitu tulang pipih kepala. Pada
awal perkembangan tulang pipih atap kepala, tulang yang baru dibentuk
diendapkan pada pinggir dan permukaan tulang tersebut. Untuk tetap menjaga
dengan cara resorpsi tulang pada permukaan luar dan permukaan dalam oleh
osteoklas, bersamaan dengan terjadinya pengendapan tulang yang terus menerus
pada kedua permukaan tulang (Leeson et al. 1996; Junqueira dan Carneiro 2005). b. Osifikasi endokondral
Semua sel tulang lainnya di dalam tubuh dibentuk melalui proses osifikasi
endokondral. Proses ini terjadi secara tidak langsung yaitu melalui pembentukan
model tulang rawan terlebih dahulu dan kemudian mengalami penggantian
menjadi tulang dewasa. Ossifikasi endokondral dapat dilihat pada proses
pertumbuhan tulang panjang. Pada proses pertumbuhan tulang panjang akan
terbentuk pusat osifikasi primer dimana penulangan pertama kali terjadi yaitu
proses dimana kartilago memanjang dan meluas melalui proliferasi kondrosit dan
deposisi matriks kartilago. Setelah pembentukan tersebut, kondrosit di daerah
sentral kartilago mengalami proses pemasakan menuju hypertropic kondrosit
(Leeson et al. 1996; Junqueira dan Carneiro 2005). Setelah pusat osifikasi primer terbentuk maka rongga sumsum mulai meluas ke arah epifise. Perluasan rongga
sumsum menuju ke ujung-ujung epifisis tulang rawan dan kondrosit tersusun
dalam kolom-kolom memanjang pada tulang dan tahapan berikutnya pada
osifikasi endokondral berlangsung pada zona-zona pada tulang secara berurutan
(Leeson et al. 1996; Junqueira dan Carneiro 2005).
2.1.2 Struktur Sel Tulang Osteoblas
Osteoblas terbentuk dari sel osteoprogenitor yang telah berdiferensiasi.
Dalam penelitian Reid (1996) ditemukan bahwa di dalam osteoblas terdapat
reseptor dari estrogen dan juga kalsitriol. Osteoblas memiliki diameter antara
20-30 µm dan terlihat sangat jelas pada sekitar lapisan osteoid dimana tulang baru
terbentuk. Membran plasma osteoblas memiliki sifat khas yakni kaya akan enzim
alkali fostatase, yang konsentrasinya dalam serum digunakan sebagai indeks dari
adanya pembentukan tulang. Sel osteoblas yang telah matang memiliki banyak
aparatus golgi yang berkembang dengan baik yang berfungsi sebagai sel sekretori,
sitoplasma yang basofilik, dan banyak sekali retikulum endopasma. Osteoblas
aktif sedangkan dalam keadaan tidak aktif osteoblas akan berbentuk pipih
(Einhorn 1996; Kierszenbaum 2002). Osteoblas berasal dari sel pluripoten
mesenkim dan menyimpan osteoid, yakni matriks organik yang tidak
termineralisasi pada tulang. Osteoblas berfungsi untuk menginisiasi dan
mengontrol proses mineralisasi osteoid (Kierszenbaum 2002).
Osteoblas menghasilkan faktor pertumbuhan bersama dengan protein tulang
morfogenetik. Osteoblas berperan dalam sintesis protein, glikosilasi, dan sekresi
menghasilkan kolagen tipe I (90% dari total protein), osteocalcin, protein yang
bukan kolagen diantaranya osteonectin, osteopontin, sialoprotein tulang, faktor
pertumbuhan tulang, sitokin, dan tentunya reseptor dari hormon-hormon
(Kierszenbaum 2002). Osteocalcin merupakan protein sekretori spesifik yang
timbul hanya pada akhir diferensiasi osteoblas di bawah pengaruh Cbfa1 ( core-binding factor) (Kierszenbaum 2002). Osteocalcin banyak terdapat pada protein nonkolagen berfungsi meregulasi kristal apetit pertumbuhan dan mengikat
hidroksiapatit. Osteonectin merupakan polipeptida rantai tunggal yang terdapat
pada beberapa jaringan karena ada saat awal perkembangan tulang. Osteonectin
terbentuk karena adesi osteoblas yang mengikat hidroksiapatit. Sialoprotein
tulang merupakan polipeptida rantai tunggal pada tulang dan jaringan ikat
termineralisasi berfungsi mengikat sel melalui ikatan integrin dan hidroksiapatit
(Meyer dan Wiesmann 2006).
Osteosit
Osteositmerupakan sel tulang yang telah dewasa dan sel utama pada tulang
yang berperan dalam mengatur metabolisme seperti pertukaran nutrisi dan kotoran
dengan darah. Osteosit berasal dari osteoblas yang berdeferensiasi dan terdapat di
dalam lacuna yang terletak diantara lamela-lamela matriks pada saat
pembentukan lapisan permukaan tulang berlangsung. Jumlahnya 20.000 – 30.000
per mm3 dan sel-sel ini secara aktif terlibat untuk mempertahankan matriks tulang
dan kematiannya diikuti oleh resorpsi matriks tersebut sehingga osteosit lebih
penting saat perbaikan tulang daripada pembentukan tulang baru (Junqueira dan
Carneiro 2005; Tortora dan Derrickson 2009).
Setelah pembentukan tulang selesai, sebagian kecil (10-20%) dari osteoblas
osteosit (Junqueira dan Carneiro 2005; Lian dan Stein 1996). Kanalikuli
merupakan suatu kanal dimana terdapat pembuluh darah yang berfungsi sebagai
penyalur nutrisi dan pertukaran gas yang akan digunakan oleh osteosit (Lian dan
Stein 1996). Osteosit lebih kecil dari osteoblas dan osteosit telah kehilangan
banyak organel pada sitoplasmanya. Osteosit muda lebih menyerupai osteoblas
tetapi merupakan sel dewasa yang memiliki aparatus golgi dan retikulum
endoplasma kasar yang sedikit lebih jelas tetapi memiliki jumlah lisosom yang
lebih banyak. Osteosit (Gambar 1) dapat berhubungan satu sama lain melalui
penjuluran sitoplasma yang melewati kanalikuli yang berperan dalam membantu
koordinasi respon tulang terhadap stres atau deformasi (Stevenson dan Marsh
1992).
Osteoklas
Osteoklas (Gambar 1) adalah sel raksasa hasil peleburan monosit (jenis sel darah putih) yang terkonsentrasi di endosteum dan melepaskan enzim lisosom
untuk memecah protein dan mineral di matriks ekstraseluler. Osteoklas memiliki
progenitor yang berbeda dari sel tulang lainnya karena tidak berasal dari sel
mesenkim, melainkan dari jaringan mieloid yaitu monosit atau makrofag pada
sumsum tulang (Smith 1993; Ott 2002). Osteoklas bersifat mirip dengan sel
fagositik lainnya dan berperan aktif dalam proses resorbsi tulang. Osteoklas
merupakan sel fusi dari beberapa monosit sehingga bersifat multinukleus (10-20
nuklei) dengan ukuran besar dan berada di tulang kortikal atau tulang trabekular
(Marcus et al. 1996). Osteoklas berfungsi dalam mekanisme osteoklastogenesis, aktivasi resorpsi kalsium tulang, dan kartilago, dan merespon hormonal yang
dapat menurunkan struktur dan fungsi tulang (Boyle et al. 2003). Osteoklas dalam proses resorpsi tulang mensekresi enzim kolagenase dan proteinase lainnya, asam
laktat, serta asam sitrat yang dapat melarutkan matriks tulang. Enzim-enzim ini
memecah atau melarutkan matriks organik tulang sedangkan asam akan
melarutkan garam-garam tulang (Telford dan Bridgman 1995). Melalui proses
resorpsi tulang, osteoklas ikut mempengaruhi sejumlah proses dalam tubuh yaitu
dalam mempertahankan keseimbangan kalsium darah, pertumbuhan dan
memiliki reseptor untuk kalsitokinin, yakni suatu hormon tiroid. Akan tetapi
osteoblas memiliki reseptor untuk hormon paratiroid dan begitu teraktivasi oleh
hormon ini, osteoblas akan memperoduksi suatu sitokin yang disebut faktor
perangsang osteoklas. Osteoklas bersama hormon parathyroid berperan dalam
pengaturan kadar kalsium darah sehingga dijadikan target pengobatan
osteoporosis (Junqueira dan Carneiro 2005; Tortora dan Derrickson 2009).
Gambar 1 Gambaran sel osteogenik, osteoblas, osteosit, dan osteoklas (dimodifikasi dari Leeson et al. 1996).
2.2 Tanaman Sipatah-patah (Cissus quadrangula Salisb.)
Sipatah-patah (Cissus quadrangula Salisb.) ditemukan di Aceh. Tanaman ini umumnya ditemukan di kawasan hutan dan dapat tumbuh dengan cepat jika
dipindahkan ke tempat lain. Herbarium Bogoriensis menyatakan bahwa spesies
ini adalah Cissus quadrangula Salisb. Taksonomi tanaman tersebut adalah sebagai berikut.
Divisi : Spermatophyta
Class : Magnoliophyita
Ordo : Sapindales
Family : Vitaceae
Genus : Cissus
Spesies: Cissus quadrangula Salisb. (Sabri 2011)
Penampang melintang batangnya berbentuk segi empat sehingga tanaman
ini dinamakan quadrangula. Pada setiap sudutnya terdapat tonjolan yang tipis ke
samping, dan di antara masing-masing tonjolan terletak terpisah. Bentuk batang
berbuku-buku dan setiap satu meter batang terdapat 4-5 buku, batang berwarna
samping. Di antara buku-buku yang telah ada muncul 1-2 daun penumpu, dan di
bagian bawah daun penumpu ini muncul calon batang baru. Pada bagian ujung
batang muncul 1-2 daun penumpu, dan di antara daun penumpu ini muncul batang
baru ke atas (Gambar 2). Menurut Versteegh-Kloppenburgh (2006), batang
tanaman ini memiliki morfologi bertekuk-tekuk dan daunnya jarang. Daun
sipatah-patah berbentuk runcing, memiliki panjang daun sekitar 4-5 cm, dan
terdapat pada pertemuan diantara buku-buku serta cepat rontok.
Tanaman sipatah-patah di Aceh sering dipergunakan untuk pengobatan
beberapa penyakit di antaranya adalah rematik dan patah tulang. Pengobatan
rematik dilakukan dengan meminum rebusan daun tanaman tersebut, yang
ditambahkan dengan unsur-unsur yang lain. Sementara itu untuk mengobati patah
tulang, dilakukan dengan cara menggerus daun sipatah-patah lalu menempelkan
pada tempat yang patah. Selain itu tanaman ini juga sangat manjur untuk
mengobati wanita lanjut usia yang mengalami sakit sendi dan patah tulang (Sabri
2011). Tanaman ini memiliki kesamaan dengan tanaman dari India yaitu Cissus quadrangularis Linn. baik secara morfologi dan kandungannya.
Gambar 2 Morfologi tanaman sipatah-patah (Cissus quadrangula Salisb.) dari Aceh (Sabri 2011).
Batang Cissus quadrangularis Linn. secara luas digunakan untuk pengobatan fraktur tulang, tumor, wasir, sariawan, dan tukak lambung (Nadkarni
1954; Warrier et al. 1994). Ekstrak tanaman ini juga mempunyai sifat antiosteoporotik (Shirwaikar et al. 2003), analgesik, antioksidan, antimikroba, hipotensi, antibakterial, antifungal (Austin dan Jagdeesan 2004), obat anti kanker
anabolik dan androgenik (Mishra et al. 2010; Dalimartha 2003). Getah batang tanaman digunakan untuk pengobatan patah tulang, penyakit telinga dan mata,
sariawan, asma, menstruasi tidak teratur, wasir, tumor, dan luka (Kritikar dan
Basu 2000). Batang Cissus quadrangularis Linn. mengandung triterpenoid dan polifenol yang diketahui menekan pembentukan sitokin (Jainu dan Devi 2006).
Sedangkan Leiro et al. (2004) dan Thuong et al. (2005) menyatakan bahwa triterpenoid dan polifenol menurunkan pembentukan TNFα dan IL1-β. Pada
penelitian yang dilakukan Shirwaikar et al. (2003), penggunaan ekstrak Cissus quadrangularis Linn. melalui intraperitoneal pada mencit dapat mengakibatkan kematian (LD 50 ) pada dosis 5000 mg/kg.
Menurut Sabri (2011), batang sipatah-patah ini mengandung beberapa
komponen biologis yaitu kalsium, fosfor, alkaloid, flavonoid, tanin (polifenolat),
dan triterpenoid. Kadar kalsium yang ditemukan pada batang sipatah-patah
mencapai 4,33% dari bobot keringnya. Dengan demikian kandungan kalsium yang
tinggi pada batang sipatah-patah ini dapat digunakan sebagai sumber kalsium
dalam pembentukan tulang atau pemenuhan kebutuhan kalsium tubuh. Selain itu
dari ekstrak sipatah-patah didapatkan bahwa ekstrak tersebut mengandung
sebanyak 33 senyawa fitokimia dan 14 senyawa diantaranya termasuk golongan
steroid. Golongan steroid tersebut 7 diantaranya termasuk dalam golongan
fitoestrogen. Senyawa fitoestrogen itu antara lain A-noncholestan-3-one-5-ethenyl
(22.67%), Stigmast-5-en-3-ol (15.52%), Stigmast-4-en-3-one (8.53%),
Lup-20(29)-en-3-ol (3.beta) (7.49%), Ergost-22-en-3-ol (5.74%),
Stigmast-5,23-dren-3.beta-ol (2.55%) dan Methyl (25RS)-3β-hydrokxyl-5 cholesten (2.36%).
Menurut Jainu dan Devi (2006), senyawa fitoestrogen yang ada dalam
Cissus quadrangularis antara lain isoflavon, ligni, coumestan, triterpan, glicoside, dan asiklik. Selain itu terdapat juga kandungan flavonoid seperti kersetin, vitamin
C, resveratrol, piceantannol, palidol, ketosteroid, dan karoten (Swamy et al.
2006). Fitoestrogen memiliki kesamaan struktur kimia dan aktivitas yang sama
dengan hormon estrogen (Anderson dan Garner 1998; Dewell et al. 2002). Menurut Jefferson et al. (2002), fitoestrogen memiliki banyak kesamaan pada dua gugus –OH dan mempunyai gugus fenol serta jarak antara gugus hidroksil yang
estrogen di tulang. Tiga unsur utama dari fitoestrogen adalah isoflavon,
caumenstan, dan lignan. Isoflavone memiliki unsur utama yaitu genistien dan
daidzein. Isoflavone mampu mengikat reseptor estrogen beta dalam osteoblas dan
dapat menstimulasi proliferasi dari osteoblas (Yamaguchi 2002). Selain itu
isoflavon juga menginduksi terjadinya diferensiasi dari osteoblas yakni melalui
aktivasi transforming-growth factor β (TGF-β) (Kim 1998). Menurut Reid (1996), di dalam osteoblas terdapat reseptor dari estrogen dan juga kalsitriol.
Rachman et al. (1996), penggunaan fitoestrogen memiliki efek keamanan yang lebih baik dibandingkan dengan estrogen sintetis atau obat-obat hormonal
pengganti (hormonal replacement therapy/HRT). Pada saat kadar estrogen menurun, akan terdapat banyak kelebihan reseptor estrogen yang tidak terikat,
walaupun afinitasnya rendah, fitoestrogen dapat berikatan dengan reseptor
tersebut. Fitoestrogen menstimulasi aktivitas osteoblas melalui aktivitas
reseptor-reseptor estrogen dan mampu meningkatkan produksi hormon pertumbuhan
insulin-like growth factors-1 (IGF-1) yang memiliki hubungan positif terhadap pembentukan massa tulang. Fitoestrogen dapat mengurangi gejala menopause
(Rachman 1996), memperbaiki kadar lipid atau lemak dalam plasma, menghambat
perkembangan ateriosklerosis, serta menghambat pertumbuhan sel-sel tumor atau
kanker pada payudara dan endometrium (Dewell et al. 2002).
2.3 Kultur In Vitro
Kultur sel (cell culture) didefinisikan teknik menumbuhkan dan memelihara sel-sel dari organisme multiseluler di luar tubuh organisme terutama dalam wadah
khusus yang ditempatkan pada kondisi lingkungan menyerupai kondisi tubuh
organisme seperti temperatur, kelembaban, nutrisi, dan kondisi bebas
kontaminasi. Sel, jaringan, dan organ yang diisolasi serta dipelihara pada
laboratorium merupakan objek hidup yang dikultur. Perkembangan kultur sel
berkaitan erat dengan kultur jaringan dan organ.
Menurut Butler (2004) kultur sel asal hewan memiliki beberapa tujuan,
antara lain (1) mengetahui fisiologi normal atau proses biokimia yang terjadi
dalam sel, seperti memperlajari metabolisme sel; (2) menguji berbagai pengaruh
senyawa kimiawi ataupun obat pada tipe sel spesifik, seperti senyawa metabolit,
dievaluasi dalam kultur sel; (3) mempelajari kombinasi variasi tipe sel sehingga
menghasilkan jaringan buatan, seperti menghasilkan kulit buatan untuk perawatan
kulit terbakar; (4) mensintesis produk biologis bernilai pada kultur sel skala besar.
Produk biologis seluler memiliki cakupan luas termasuk protein spesifik ataupun
virus yang memerlukan sel hewan dalam perkembangannya, seperti protein yang
jumlahnya sangat sedikit dalam tubuh dapat disintesis dalam jumlah gram hingga
kilogram dengan menumbuhkan sel secara genetis secara in vitro. Jumlah produk biologis yang bernilai komersial telah meningkat dengan cepat selama beberapa
dekade terakhir. Pada kultur skala besar penting untuk menghindari kontaminasi
seperti virus dan protein tak diinginkan yang dapat menyebabkan kerugian besar.
Sel hewan memiliki bentuk dan karakteristik tertentu yang bersatu
membentuk jaringan berbeda-beda. Menurut Butler (2004) terdapat lima jenis sel
dalam jaringan yang sering digunakan pada kultur sel, antara lain (1) Jaringan
epitel, tersusun atas selapis sel yang menutup organ dan saluran seperti kulit dan
saluran pencernaan. Sel-sel epitel tumbuh dengan baik pada kultur sebagai sel
tunggal monolayer. (2) Jaringan ikat membentuk komponen utama struktur tubuh
hewan. Fibroblas merupakan jenis sel jaringan ikat yang paling banyak
digunakan untuk kultur sel karena mampu tumbuh dengan baik pada laju
pertumbuhan 18-24 jam. Osteoblas merupakan sel dalam jaringan tulang yang
dapat ditumbuhkan dalam kultur. (3) Jaringan otot mampu tumbuh dalam kultur
khususnya sel myoblas. Sel tersebut mampu berdiferensiasi membentuk
myotubes, yakni suatu proses yang hanya bisa diamati dalam kultur. (4) Jaringan
saraf dapat ditumbuhkan pada kultur dengan menambahkan growth factors pada kultur neuron sehingga membentuk neurit. Kultur sel saraf sering digunakan
untuk mengetahui pertumbuhan neuroblastoma. (5) Darah dan getah bening
(lymph) mengandung suspensi sel yang dapat tumbuh dalam kultur. Limfoblast merupakan salah satu jenis sel darah putih yang secara luas digunakan dalam
kultur karena mampu mensekresikan senyawa immunoregulasi.
Menurut Malole (1990), kondisi in vitro diciptakan menyerupai kondisi in vivo antara lain temperatur (37°C), pH (7.4), oksigen, CO2 (5%), tekanan osmosis,
permukaan untuk melekat sel, nutrien, proteksi terhadap zat toksik, hormon, dan
kultur antara lain gelatin, kolagen, laminin, atau fibronectin (Freshney 2005). Malole (1990), medium dasar berfungsi untuk mengatur pH, tekanan osmosis
dalam medium, dan sumber ion organik yang esensial. Menurut Frehsney (2005)
medium pertumbuhan yang sering digunakan dalam kultur in vitro adalah
Dulbecco’s Modified Eagle Medium (DMEM). DMEM mengandung konsentrasi asam amino dua kali lipat lebih banyak dari Eagle’s Minimal Essential Medium
(MEM), empat kali vitamin, dan mengatur konsentrasi HCO3 dan CO2. Sedangkan
menurut Buttler (2004), DMEM mengandung asam amino dan vitamin empat kali
lebih banyak dibanding Eagle’s Basal Medium (EBM). Nutrisi lainnya yaitu dengan penambahan serum yang berasal dari sapi (Fetal Calf Serum (FCS) dan
Newborne Calf Serum (NCBS)), serum asal manusia, dan serum asal kuda. Penambahan serum dalam medium berkisar antara 5-20%. Serum berfungsi
sebagai sumber faktor pertumbuhan, faktor hormonal, faktor pelekat sel, dan fakto
penyebar sel (Malole 1990). Untuk mengatasi adanya kontaminasi pada kultur
dapat ditambahkan antibiotik pada medium (Buttler 2004).
2.4 Kultur Tulang
Kultur primer adalah menempatkan sel secara langsung yang berasal dari
jaringan hewan ke dalam medium pertumbuhan (Butler 2004). Tulang merupakan
salah satu jaringan ikat yang dapat dikembangkan dan ditumbuhkan secara in vitro
(di luar tubuh hewan) untuk tujuan tertentu, seperti mengetahui tingkat proliferasi
osteoblas (Butler 2004). Pada individu muda sel osteoblas lebih cepat
berproliferasi dan berdiferesisasi dibanding individu dewasa (Pradel et al. 2008).
Kultur osteoblas (Gambar 3) dilakukan antara lain untuk mengetahui biokimia dan
fisiologi dari pembentukan tulang, mengetahui hingga tingkat molekuler dan
seluler dari penyakit tulang, mengetahui peran sel pada garis osteoblastik dalam
meregulasi penyerapan tulang, menguji agen terapeutik yang potensial, untuk
mengembangkan dan menguji biomaterial baru, dan untuk menggunakan terapi
sel pada teknik jaringan dan transplantasi tulang (Gallagher 2003).
Menurut Binderman et al. (1974), sel tulang tikus memiliki population doubling time sekitar 2-4 hari. Sel tulang pada penelitian tersebut didapat dengan cara mengisolasi secara langsung tulang tikus. Medium yang digunakan pada
selain mengetahui proliferasi juga dapat mengetahui diferensiasi sel tulang yang
dikultur. Secara in vitro, diferensiasi ini mudah didapatkan dengan menambahkan media penginduksi kedalam medium kultur. Media penginduksi diferensiasi
osteogenik pada kultur antara lain penambahan asam askorbat, β
-glycerophosphate, 1α, 25-dihydroxyvitamin D3, dan dexamethason (Gallagher
2003). Penambahan asam ascorbat dalam medium kultur sel tulang yaitu sebesar
50 µg/mL. Penambahan asam askorbat (vitamin C) pada medium kultur sel tulang
dapat mengotimalkan peningkatan diferensiasi sel tulang yang dikultur (Pradel et al. 2008).
Dexamethason merupakan senyawa glukokortikoid yang biasa digunakan
dalam medium osteogenik dalam kultur in vitro dengan dosis sebesar 10 nM (Freshney 2005). Berdasarkan penelitian Guzman-Morales et al. (2009), dexamethasone diketahui dapat menginduksi diferensiasi osteogenik dari sumsum
tulang belakang manusia secara in vitro, dapat mempengaruhi aktivitas pembelahan sel yang lambat (meningkatkan proliferasi) serta dapat meningkatkan
perlekatan sel pada substrat. Penelitian lainnya juga dilakukan oleh Beloti dan
Rosa (2005), dexamethason dapat memberikan efek dalam mendiferensiasi
sumsum tulang menjadi osteoblas matang.
Gambar 3 Osteoblas (Anonim 2011a).
III.
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari - Oktober 2011 di
Laboratorium Embriologi, Departemen Anatomi Fisiologi dan Farmakologi,
Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain gunting bedah, pinset,
mikrofilter, spoit 10 mL dan 1 mL, gelas objek, kaca penutup, cawan petri,
hemositometer, mikropipet, gelas ukur, erlenmeyer, gelas beaker, tabung
sentrifus, timbangan digital, inkubator, mikroskop dan biosafety cabinet.
Bahan yang digunakan antara lain tulang tikus (Rattus norvegicus) umur 4 minggu, medium kultur mDMEM [Dubelcco’s Modified Eagle Medium (DMEM) yang diberi tambahan asam amino non-essensial (AANE; Sigma) 10%, Newborn Calf Serum (NBCS) 10%, sodium bicarbonat (NaHCO3) 3,7 µg/mL, gentamycin
50 µg/mL, insulin transferrin selenium (ITS) 1µl/mL], mPBS [phosphate buffered saline (PBS) yang diberi tambahan NBCS 0.1% dan gentamycin 50 µg/mL], Dexamethason 10-8 M, ekstrak Cissus quadrangula Salisb. dan pewarna Hematoksilin Eosin (HE).
3.3 Metode
3.3.1. Ekstrak Batang Sipatah-patah (Cissus quadrangula Salisb.)
Ekstrak batang sipatah-patah (CQ) yang dipakai pada penelitian ini
merupakan ekstrak siap pakai yang berasal dari Laboratorium Farmasi FKH IPB
yang dibuat menggunakan metode maserasi etanol.
3.3.2. Persiapan Kultur Sel Tulang
Sebelum digunakan, cawan petri (Corning®) dilapisi dengan 1 mL gelatin
0.1% dan didiamkan pada suhu kamar selama 1 jam. Setelah satu jam, gelatin
dibuang dan dicuci dengan PBS kemudian didiamkan selama 5 menit. Cawan
0.3 mg/mL, 0.6 mg/mL, dan 1.2 mg/mL sebanyak 2 mL kemudian diinkubasi
selama minimal satu jam ke dalam inkubator CO2 5% pada suhu 37 oC.
3.3.3. Isolasi dan Kultur Sel Tulang
Sel tulang diisolasi dari tulang femur, tibia dan fibula tikus (Rattus norvegicus) umur empat minggu. Tulang dicacah hingga halus dan disuspensi di dalam mPBS menggunakan spuit 1 cc. Suspensi tulang disentrifugasi dengan
kecepatan 200 g selama 10 menit, pencucian ini dilakukan dengan mPBS
sebanyak empat kali dan mDMEM sebanyak satu kali. Sebelum dikultur, jumlah
sel dihitung menggunakan hemositometer. Sel dengan konsentrasi 3 x 104 sel/mL
dalam 100 µl dimasukkan ke dalam cawan petri yang berisi medium perlakuan
sebanyak 2 mL. Setiap kultur dilakukan rangkap dua, terdiri dari cawan petri
yang diberi dan tidak diberi kaca penutuppada dasar cawan petri tersebut. Cawan
petri yang tidak diberi kaca penutup digunakan untuk menghitung proliferasi sel
sedangkan cawan petri yang diberi kaca penutup digunakan untuk pewarnaan HE.
Kultur diinkubasi di dalam inkubator CO2 5% pada suhu 37 oC. Medium
mDMEM dan perlakuan diganti setiap 2 hari sekali sebanyak 2 mL setiap
penggantian. Kultur dilakukan sampai hari ketujuh.
3.4. Evaluasi Hasil Kultur Sel Tulang
3.4.1.Tingkat Proliferasi (population doubling time)
Tingkat proliferasi ditentukan dengan menghitung jumlah sel pada saat
sebelum dikultur dan setelah kultur hari ketujuh. Pada hari ketujuh medium
dibuang lalu sel hasil kultur dicuci dengan PBS kemudian dimasukkan larutan
tripsin 0.1% dalam mPBS sebanyak 1 mL. Sel diinkubasi selama 5 menit sampai
sel terlihat soliter dan diamati di bawah mikroskop. Pemipetan berulang dapat
dilakukan untuk mempermudah disosiasi sel. Sel yang telah terdisosiasi
disentrifugasi selama 10 menit dengan kecepatan 200 g di dalam mPBS.
Selanjutnya sel dihitung menggunakan hemositometer Improved Neubauer
dengan perhitungan :
Sedangkan Population Doubling Time (PDT) dihitung menggunakan rumus (Davis 2011):
3.4.2. Identifikasi Diferensiasi Osteoblas dan Osteosit
Identifikasi jumlah dan diameter sel-sel tulang yang dikultur yakni dengan
menggunakan teknik pewarmaan Hematoksilin Eosin. Kultur sel yang
ditumbuhkan di atas cover glass dicuci dengan PBS kemudian difiksasi dalam larutan buffer paraformaldehid 4%. Kultur yang telah difiksasi dan siap diwarnai
terlebih dahulu dimasukkan ke dalam alkohol 70% selama 5 menit, kemudian
alkohol 50% selama 5 menit, aquades 10 menit sebanyak 3 kali perendaman
sebagai rehidrasi. Setelah itu direndam dalam hematoksilin selama 10 menit dan
dibilas dengan aquades selama 5 menit. Selanjutnya dilakukan perendaman dalam
eosin selama 5 menit, dibilas dengan aquades selama 5 menit, dan dilakukan
dehidrasi bertingkat menggunakan alkohol. Setelah itu dilanjutkan dengan
perendaman pada xylol dua kali ulangan masing-masing selama 10 menit, kemudian cover glass ditempelkan dengan object glass menggunakan entelan dan diamati dibawah mikroskop dengan perbesaran 10 x 10 untuk dihitung jumlah
sel-sel tulang yang ada. Penghitungan dilakukan pada 16 lapang pandang kemudian
dipersentasekan dengan total sel yang dihitung. Perhitungan dilakukan sebanyak
tiga kali ulangan dan kemudian dirata-ratakan. Pada penghitungan diameter
dilakukan dengan menggunakan mikrometer Eyepiece dan diamati dengan mikroskop pada pembesaran 40 x 10. Penghitungan diameter dilakukan pada 20
osteoblas dan 20 osteosit yang ada pada masing-masing perlakuan. Perhitungan
dilakukan sebanyak tiga kali ulangan dan kemudian dirata-ratakan.
3.5. Rancangan Percobaan
Terdapat lima kelompok perlakuan yang terdiri dari kontrol negatif
(mDMEM), kontrol positif (mDMEM + dexamethason 10-8 M), pemberian
ekstrak batang Sipatah-patah (Cissus quadrangula Salisb. atau CQ) yakni CQ 0.3 1
PDT (hari) =
(log jumlah sel akhir-log jumlah sel awal) x 3,32
(mDMEM + CQ 0.3 mg/mL), CQ 0.6 (mDMEM + CQ 0.6 mg/mL), dan CQ 1.2
(mDMEM + CQ 1.2 mg/mL). Masing-masing kelompok perlakuan terdiri atas
satu cawan yang dilapisi cover glass untuk pewarnaan HE dan satu cawan tanpa
cover glass untuk menghitung Population Doubling Time (PDT). Masing-masing perlakuan dilakukan sebanyak tiga kali ulangan. Parameter yang diamati yaitu
PDT, jumlah osteoblas dan osteosit, serta diameter osteoblas dan osteosit. Data
PDT, jumlah osteoblas dan osteosit, serta diameter osteoblas dan osteosit
dianalisis menggunakan uji statistik ANOVA dan dilanjutkan dengan uji statistik
IV.
HASIL DAN PEMBAHASAN
4.1 Tingkat Proliferasi Berdasarkan Population Doubling Time (PDT)
Population Doubling Time (PDT) adalah waktu yang diperlukan oleh populasi sel untuk menjadikan jumlahnya dua kali dari jumlah semula. Semakin
kecil nilai PDT menandakan semakin cepat proliferasi sel yang terjadi. Hasil PDT
kultur sel tulang yang diberi perlakuan ekstrak batang sipatah-patah (Cissus quadrangula Salisb.). dapat dilihat pada Tabel 1.
Tabel 1 Proliferation Doubling Time (PDT) sel tulang pada kultur yang diberi ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) (hari)
Perlakuan PDT
Kontrol positif 2.34 ± 0.22a
Kontrol negatif 3.57 ± 0.40b
CQ 0.3 2.18 ± 0.12a
CQ 0.6 2.39 ± 0.25a
CQ 1.2 2.55 ± 0.35a
Ket: Huruf superskrip yang berbeda pada kolom yang sama menunjukkan adanya perbedaan
nyata (P<0,05). Kontrol negatif (mDMEM); kontrol positif (mDMEM+Dexamethason 10-8 M); ekstrak batang Sipatah-patah (Cissus quadrangula Salisb. atau CQ) CQ 0.3 (mDMEM+CQ 0.3 mg/mL); CQ 0.6 (mDMEM+0.6 mg/mL); CQ 0.3 (mDMEM+CQ 1.2 mg/mL).
Nilai PDT pada kontrol negatif dan kontrol positif adalah 3.57 ± 0.40 hari
dan 2.34 ± 0.22hari, sedangkan nilai PDT pada pemberian ekstrak CQ 0.3, CQ
0.6, dan CQ 1.2 masing-masing adalah 2.18 ± 0.12hari, 2.39 ± 0.25 hari, dan 2.55
± 0.35 hari. Menurut Binderman et al. (1974), sel tulang memiliki PDT sekitar 2-4 hari. Pemberian ekstrak batang tanaman sipatah-patah (Cissus quadrangula
Salisb.) pada kultur sel tulang dengan konsentrasi CQ 0.3, CQ 0.6, dan CQ 1.2
menurunkan nilai PDT jika dibandingkan dengan kontrol negatif (P<0.05). Hal
ini sejalan dengan kontrol positif yang juga menunjukkan terjadinya penurunan
nilai PDT. Nilai PDT yang semakin kecil menandakan pemberian ekstrak dapat
meningkatkan terjadinya proliferasi pada sel tulang yang dikultur. Hal ini sesuai
Cissus quadrangulais Linn. pada kultur sumsum tulang menyebabkan terjadinya proliferasi bone marrow mesenkhimal stem cell (MSCs).
Salah satu komponen yang terkandung dalam ekstrak batang sipatah-patah
adalah fitoestrogen (Sabri 2011). Senyawa fitoestrogen tersebut antara lain
isoflavon, lignin, coumestan, triterpen, asiklik, dan glicoides (Jainu dan Devi
2006). Isoflavon memiliki kemampuan dalam mengikat reseptor estrogen β dalam
osteoblas dan menstimulasi proliferasi osteoblas (Yamaguchi 2002). Selain itu,
menurut Rachman et al. (1996) fitoestrogen mampu meningkatkan produksi
insulin-like growt factor (IGF-1) yang memiliki hubungan positif terhadap pembentukan massa tulang. IGF-1 merupakan protein yang menyerupai hormon
insulin endogen dan berperan penting dalam pertumbuhan dan metabolisme sel.
IGF-1 juga berperan dalam proliferasi sel dan menghambat kematian sel (LeRoith
et al. 1992). Kandungan fitoestrogen yang terdapat dalam ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) dipercaya dapat meningkatkan proliferasi sel tulang yang dikultur.
4.2 Diferensiasi Sel Tulang
Diferensiasi merupakan proses transformasi sel menjadi bentuk matang dan
memiliki fungsi khusus. Dalam hal ini terjadi proses diferensiasi dari osteoblas
menjadi osteosit.
4.2.1 Diameter Osteoblas dan Osteosit
Sel tulang yang dikultur dengan penambahan ekstrak batang sipatah-patah
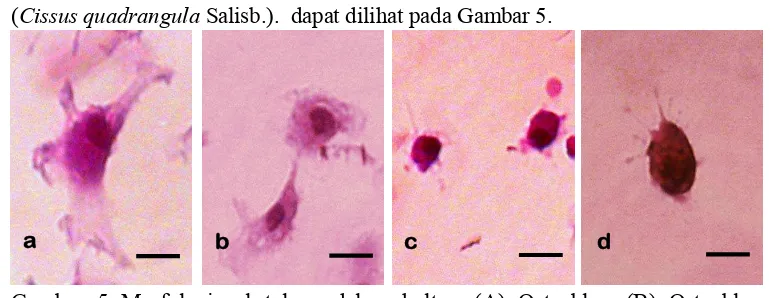
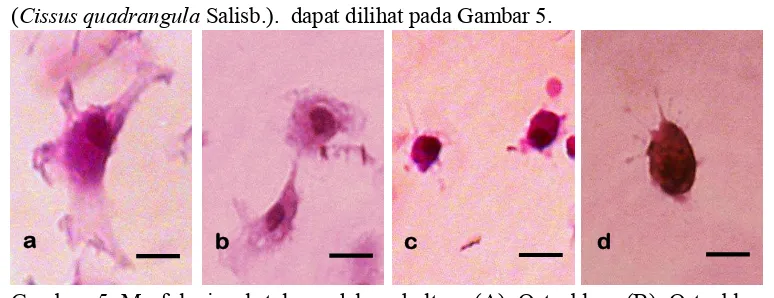
[image:35.612.127.514.513.662.2](Cissus quadrangula Salisb.). dapat dilihat pada Gambar 5.
Gambar 5 Morfologi sel tulang dalam kultur. (A) Osteoblas, (B) Osteoblas mengecil, (C) Osteosit, (D) Osteosit muda. Pewarnaan HE. Bar: 20µm.
Osteoblas merupakan sel yang berbentuk kubus atau kolumnar dalam
keadaan aktif sedangkan dalam keadaan tidak aktif osteoblas akan berbentuk pipih
(Einhorn 1996; Kierszenbaum 2002). Sedangkan osteosit merupakan sel dewasa
yang memiliki aparatus golgi dan retikulum endoplasma kasar yang lebih sedikit
tetapi memiliki jumlah lisosom yang lebih banyak serta osteosit memiliki
penjuluran pada sitoplasma (Stevenson dan Marsh 1992).
Diameter osteoblas dan osteosit pada masing-masing perlakuan dapat dilihat
[image:36.612.130.509.280.428.2]pada Tabel 2.
Tabel 2 Diameter osteoblas dan osteosit yang tumbuh dalam medium yang diberi ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) (µm)
Perlakuan Osteoblas Osteosit
Kontrol positif 19.51 ± 2.08a 12.33 ± 1.01b
Kontrol negatif 20.46 ± 3.20b 11.60 ± 1.84a
CQ 0.3 19.50 ± 1.72a 12.16 ± 1.02b
CQ 0.6 19.24 ± 1.70a 12.54 ± 1.25b
CQ 1.2 19.75 ± 2.38ab 12.56 ± 0.71b
Ket : Huruf superskrip yang berbeda pada kolom yang sama menunjukkan adanya perbedaan nyata (P<0.05).
Diameter osteoblas pada perlakuan CQ 0.3, CQ 0.6, dan CQ 1.2
berturut-turut adalah 19.50 ± 1.72 µm, 19.24 ± 1.70 µm, dan 19.75 ± 2.38 µm. Osteoblas
memiliki diameter antara 20-30 µm (Kierszenbaum 2002). Diameter osteoblas
pada kultur yang diberi ekstrak lebih kecil (Gambar 5B) dibandingkan dengan
diameter osteoblas pada kontrol negatif (Gambar 5A) yang memiliki diameter
sebesar 20.46 ± 3.20. Diameter osteosit pada perlakuan CQ 0.3, CQ 0.6, dan CQ
1.2 berturut-turut adalah 12.16 ± 1.02 µm, 12.54 ± 1.25 µm, dan 12.56 ± 0.71 µm.
Osteosit memiliki ukuran sekitar 9-20 µm (Kogianni dan Noble 2007). Berbeda
dengan osteoblas, diameter osteosit pada kultur dengan penambahan ekstrak
tanaman sipatah-patah (Gambar 5D) lebih besar (P<0.05) dibandingkan diameter
dan perbedaan diameter antar osteosit pada medium yang diberi penambahan
ekstrak dapat menunjukkan terjadinya proses diferensiasi sel.
Transformasi osteoblas menuju osteosit melibatkan perubahan morfologi
seperti penurunan ukuran sel, peningkatan proses intraseluler, dan perubahan
dalam organel-organel intraseluler (Palumbo 1986). Sel pada tahapan diferensiasi
antara osteoblas menuju osteosit salah satunya disebut dengan osteosit muda atau
preosteosit. Sel ini berukuran lebih besar dibandingkan osteosit matang dan
memiliki aparatus golgi yang berkembang dengan sangat baik (Dallas dan
Bonewald 2010). Beberapa studi menunjukkan bahwa tergantung pada tipe tulang
dan aktivitas serta ukuran dari osteoblas yang dapat menyebabkan ukuran osteosit
berbeda-beda. Osteosit yang baru tertanam dalam tulang dapat bervariasi dalam
bentuk dan ukuran. Hal ini tergantung pada umur masing-masing osteosit dan
tingkat kematangan osteosit (Dallas dan Bonewald 2010).
4.2.2 Komposisi Jumlah Osteoblas dan Osteosit
Banyak faktor yang dapat menimbulkan ekspresi dari sifat osteoblas dalam
kultur antara lain medium kultur yang digunakan, waktu kultur dan adanya
komponen yang dapat menyebabkan sel berproliferasi dan berdiferensiasi.
Komponen tersebut antara lain dapat berupa hormon maupun faktor pertumbuhan.
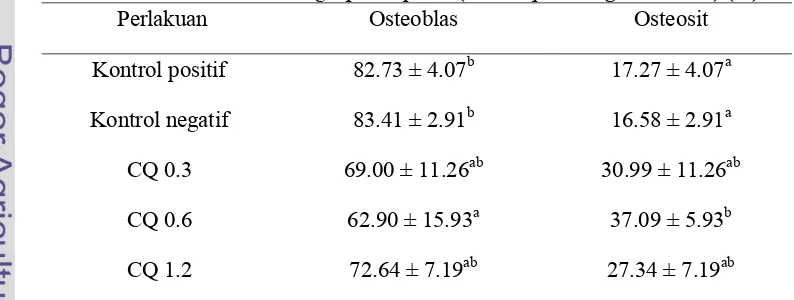
Komposisi jumlah osteoblas dan osteosit dalam kultur dapat dilihat pada Tabel 3
[image:37.612.111.508.525.675.2]berikut.
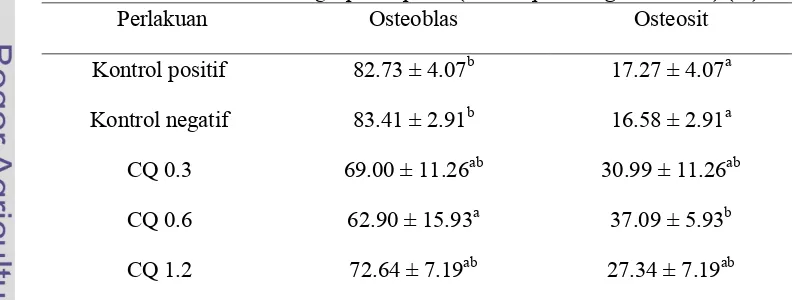
Tabel 3 Persentase osteoblas dan osteosit yang tumbuh dalam medium yang diberi ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) (%)
Perlakuan Osteoblas Osteosit
Kontrol positif 82.73 ± 4.07b 17.27 ± 4.07a
Kontrol negatif 83.41 ± 2.91b 16.58 ± 2.91a
CQ 0.3 69.00 ± 11.26ab 30.99 ± 11.26ab
CQ 0.6 62.90 ± 15.93a 37.09 ± 5.93b
CQ 1.2 72.64 ± 7.19ab 27.34 ± 7.19ab
Pemberian ekstrak pada dosis CQ 0.6 menunjukkan persentase jumlah
osteoblas terendah yakni sebesar 62.90 ± 15.93 dan persentase jumlah osteosit
tertinggi sebesar 37.09 ± 15.93. Dibandingkan dengan kontrol positif dan negatif,
persentase osteoblas pada dosis CQ 0.6 secara signifikan menurun dan persentase
osteosit semakin meningkat (P<0.05). Hal ini dapat menunjukkan bahwa
pemberian ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) menginduksi terjadinya proses diferensiasi osteoblas menjadi osteosit. Osteosit
merupakan sel akhir dari diferensiasi osteoblas dan bukan sel hasil proliferasi dari
osteoblas (Kogianni dan Noble 2007). Proporsi dari osteoblas dipengaruhi antara
lain oleh spesies hewan, umur, tipe tulang, hormon dan status penyakit (Dallas
dan Bonewald 2010).
Isoflavon yang terkandung dalam fitoestrogen akan berikatan dengan
reseptor estrogen β yang terdapat pada osteoblas dan menginduksi terjadinya
proses diferensiasi osteoblas melalui aktivasi transforming-growth factor β
(TGF-β) (Kim et al. 1998). TGF-β merupakan salah satu protein yang berfungsi sebagai faktor pertumbuhan yang berperan dalam proliferasi, determinan, diferensiasi,
motilitas dan kematian sel. TGF-β akan mempengaruhi kerja enzim tirosin kinase
yang merupakan enzim penting dalam pertumbuhan dan diferensiasi sel
(Massague 1998). Menurut Pradel et al. (2008), kandungan vitamin C dapat mengoptimalkan peningkatan diferensiasi sel tulang yang dikultur. Oleh karena
itu, kandungan isoflavon dan vitamin C yang terdapat dalam ekstrak tanaman
sipatah-patah dapat menginduksi terjadinya proses diferensiasi osteoblas menjadi
osteosit pada kultur. Hal ini sejalan dengan penelitian yang dilakukan Potu et al.
(2009), bahwa penambahan ekstrak Cissus quadrangularis Linn. ke dalam kultur
bone marrow mesenkhimal stem cell (MSCs) dapat menstimulasi proliferasi dan diferensiasi MSCs menjadi osteoblas. Diferensiasi MSCs menjadi osteoblas
melalui jalur Wnt-LRP-β-catenin. Wnt-signaling pathway merupakan protein yang berperan dalam perkembangan embrio dan diferensiasi sel bekerja sama dengan
low density lipoprotein receptor related protein 5 (LRP5) dan β-catenin (Akiyama 2000).
Berdasarkan data-data yang diperoleh, pemberian ekstrak batang
diferensiasi terhadap sel tulang tikus yang dikultur. Kandungan fitoestrogen yang
berasal dari ekstrak dapat meningkatkan proliferasi osteoblas dan meningkatkan
diferensiasi osteoblas menjadi osteosit sehingga pembentukan tulang dapat terjadi
dengan cepat dan kepadatan tulang juga akan semakin meningkat. Hal ini sejalan
dengan penelitian Sabri (2011) yang dilakukan secara in vivo yakni pemberian ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) dapat meningkatkan kepadatan tulang, pertambahan panjang tulang femur, dan peningkatan bobot
badan pada tikus prapubertas. Kandungan kalsium serta fosfor yang tinggi juga
dapat digunakan dalam pembentukan tulang sehingga kepadatan tulang akan
meningkat. Tingginya kadar kalsium dalam darah akan memicu kerja kelenjar
thiroid dalam penyimpanan kalsium ke dalam tulang. Selain itu, dapat menekan
kerja kelenjar parathiroid dalam mengaktivasi kerja osteoklas dalam perombakan
tulang. Kepadatan tulang yang didapat selama masa pertumbuhan merupakan
faktor yang menentukan terjadinya kasus osteoporosis di kemudian hari. Individu
dengan kepadatan tulang yang tinggi pada masa pertumbuhan sampai masa
premenopause akan terhindar dari osteoporosis pada masa pascamenopause
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Penambahan ekstrak batang sipatah-patah (Cissus quadrangula Salisb.) pada kultur sel tulang dapat meningkatkan proliferasi dan menginduksi terjadinya
diferensiasi osteoblas menjadi osteosit. Diferensiasi osteoblas menjadi osteosit
terlihat dari penurunan diameter osteoblas dan adanya peningkatan persentase
jumlah osteosit dalam kultur. Dosis optimal pemberian ekstrak batang
sipatah-patah (Cissus quadrangula Salisb.) untuk proliferasi dan diferensiasi sel tulang pada penelitian ini adalah 0.6 mg/mL.
5.2 Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui efek ekstrak
batang sipatah-patah (Cissus quadrangula Salisb.) secara in vitro pada sel lainnnya dalam tubuh serta efek ekstrak dalam menanggulangi berbagai penyakit.
Selain itu perlu dilakukan penelitian lebih lanjut mengenai dosis toksik ekstrak
DAFTAR PUSTAKA
Akiyama T. 2000. Wnt/beta-batenin signaling. Cytokine Growth Factor Rev. 11(4):273-83.
Anderson JJB, Garner SC. 1998. The effect of phytoestrogens of bone. J Nutr Res
17: 1617-1632.
[Anonim]. 2011a. Osteoblast. http://www.abdn.ac.uk [07 Juli 2011].
[Anonim]. 2011b. Osteocytehttp://www.tursiops-biology.com [07 Juli 2011].
Austin A, Jagdeesan M. 2004. Gastric and duodenal antiulcer and cytoprotective effects of Cissus quadrangularis Linn. variant II in rats. Nig J Nat Prod Med 6 :1-7.
Beloti MM, Rosa Al. 2005. Osteoblast differentiation of human bone marrow sells under continous and discontinous treatment with dexamethasone. Braz Dent J 16(2): 156-161.
Binderman I, Duksin D, Harell A, Katzir E, Sachs L. 1974. Formation of bone tissue in culture from isolated bone cells. J. Cell Biology 61: 427-439. Butler, M. 2004. Animal Cell Culture and Technology. Cornwall UK: Bios
Scientific Publishers.
Boyle WJ, Simonet WS, Lacey DL. 2003. Osteoclast differentiation and
activation. Nature 10:423 [terhubung berkala].
http://www.nature.com/nature/journal/v423/n6937/abs/nature01658.html [22 Apr 2011]
Compston JE, Garraham NJ, Croucher PI, Wright CDP, Yamaguchi K. 1993. Quantitative analysis of trabecular bone structure. Bone 14: 187-1992. Dalimartha S. 2003. Atlas Tumbuhan Obat Indonesia Jilid II. Jakarta: Trubus
Agriwidya.
Dallas SL, Bonewald LF. 2010. Dynamics of the transition from osteoblast to osteocyte. NIH Public Access 1192:437-443.
Davis JM. 2011. Basic techniques and media, the maintenance of cell lines, and safety. Di dalam Animal cell culture essesntial methods. John MD, Editors. UK: John Wiley and Sons Ltd.
Derek S, Kalangi SJR, Wangko S. 2007. Kerja osteoklas pada perombakan tulang. BIK Biomed.
Einhorn. 1996. Cellular control of bone homeostasis. Di dalam: Mishell’s textbook of infertility, Contraception and Reproductive Endocrinology. Ed. 4. Ney York: Blackwell Science.
Freshney RI. 2005. Culture of Animal Cells a Manual Basic Technique. Ed.5. Wiley-liss, a John Wiley & Sons, Inc, Pub.
Gallagher JA. 2003. Human osteoblast culture. Methods Mol Med 80:3– 18. Guzman-Morales J, El-Gabalawy H, Pham MH, Tran-Khanh N, McKee MD, Wu
W, Centola M, Hoemann CD. 2009. Effect of chotosan particles and dexamethasone on human bone marrow stromal cell osteogenesis and angiogenic factor secretion. J. Elsevier bone (45): 617-626.
Jainu JM, Devi CSS. 2006. Gastroprotective effect of Cissus quadrangularis
extract in rats with experimentally induced ulcer. Indian J Med Res
123:799-806.
Jefferson WN, Padilla-Banks E, Clark G, Newbold RR. 2002. Assessing estrogenic activity of phytochemicals using transcriptional activation and immature mouse uterotrophic responses. J Chrom. B Analytical Technologies in the Biomedical and Life Sci 777(1-2):179-189.
Junqueira LC, Carneiro J. 2005. Basic Histology: Text and Atlas. Ed.11. Poule; McGraw-Hill Medical.
Kierszenbaum AL. 2002. Histology and Cell Biology: An Introduction to Pathology. St. Louis: Mosby. Inc. An Affiliate of Elsevier.
Kim H, Peterson TG, Barnes S. 1998. Mechanisms of action of the soy isoflavone genistein: emerging role for its effects via transforming growth factor β signaling pathways. Am J Clin Nutr 68:1418S-25S.
Kogianni G, Noble BS. 2007. The biology of osteocytes. Current Medicine Group LLC 5: 81-86.
Kritikar KR, Basu BD. 2000. Indian Medicinal Plants. Ed. 3. Basu LM, Allahabad, Editors. India.
LeRoith D, McGuinness M, Schemer J, Stannard B, Lanau F, et al. 1992. Insulin-like growth factors. Biol Signals. 1(14): 173-81.
Leiro JD, Garcia JA, Arranz R, Delgado ML, Sanmartin F, Orallo. 2004. An
Anacardiaceae preparation reduces the expression of inflammation-related genes in murine macrophages. Int. Immunopharmacol 4:991– 1003.
Leeson RC, Leeson TS, Paparo AA. 1996. Buku ajar histologi. Ed. 7. Tambajong
Lian JB, Stein GS. 1996. Osteoblast biology. Di dalam : Osteoporosis. Maraus R, Fieldman D, Kelsey J, Editors. San Diego: Academic Pr. Inc.
Malole MBM. 1990. Kultur Sel dan Jaringan Hewan. Bogor: Departemen Pendidikan dan Kebudayaan. Direktorat Jenderal Pendidikan Tinggi Pusat antaruniversitas Bioteknologi, Institut Pertanian Bogor.
Marcus R, Feldman D, Klasey J. 1996. Osteoporosis. New York: Academic Pr. Massague J. 1998. TGF-β signal transduction. Annu. Rev. Biochem 67:753-91. Meyer U, Wiesmann HP. 2006. Bone and Cartilage Engineering. Heidelberg:
Springer.
Mishra G, Srivasta S, Nagori BP. 2010. Pharmacological and therapeutic activity of Cissus quadrangularis. J. Pharm Tech 2(2):1298-1310.
Nadkarni AK. 1954. Indian Meteria Medica, Ed.13. Bombay: Dhootapapeshwar Prakashan Ltd.
Ott SM. 2002. Osteoporosis and bone physiology. J Am Medic 228: 334-341. Palumbo C. 1986. A three-dimentional ultractructural study of osteoid-osteocyte
in tibia of chick embryos. Cell Tissue Res. 246: 125-131.
Potu BK, Bhat Kumar MR, Rao MS, Nampurath GK, Chamallamudi MR, Nayak SR, Muttigi MS. 2009. Petroleum ather extract of Cissus quadrangularis
(Linn.) enhances bone marrow mesenchymal stem cell proliferation and facilitates osteoblastogenesis. Clinical science 64(10): 993-8.
Pradel W. Mai R. Gedrange T. Lauer G. 2008. Cell passage and composition of culture medium effects proliferation and differentiation of human osteoblast-like cells from facial bone. J Phyiols Pharmacol 59(5): 47-58. Rachman IA, Baziad A, Jacoeb TZ, Isbagio H. 1996. Pengobatan estrogen dan
progesterone pada osteoporosis pascamenopause. Majalah Osbtetri dan Ginekologi Indonesia 20(2):121-127.
Reid IA. 1996. Vitamin D and its metabolites in the management of osteoporosis. Di dalam: Osteoporosis. Markus R, Fieldman D and Kelsey J, Editors. San Diego: Academic Press Inc.
Sabri M. 2011. Aktivitas ekstrak etanol batang sipatah-patah (Cissus quadrangula Salisb.) sebagai antiosteoporosis pada tikus (Rattus norvegicus).
[Disertasi]. Bogor : Pascasarjana IPB.
Scalon VC, Sanders T. 2007. Essentials of Anatomy and Physiology. Ed. 5. Philadelphia: F. A. Davis Comp.
Shirwaikar An, Khan S, Malini S. 2003. Antiosteoporotic effect of ethanol extract of Cissus quadrangularis Linn. on ovariectomized rat. J. ethnopharmacol
89: 245-250.
Stevenson JS, Marsh MS. 1992. An Atlas of Osteoporosis. New Jersey: Parthenon Publishing Group.
Swamy VAHM, Thippeswany AHM, Manjula DV, Cumar CBM. 2006. Some neuropharmacological effects of the methanolic root extract of Cissus quadrangularis in mice. Afr J Biomed Res 9: 69-75.
Taylor L. 2002. The healing power of rainforest herbs. Rain tree nutrition tropical plant database. [terhubung berkala] http//www.rain-tree.com/aveloz.htm [10 Juli 2011].
Telford IR, Bridgman CF. 1995. Introduction to Functional Histology. Ed. 2. Harper Collins Colloge Publisher. Hlm. 103-119.
Thuong PT, Jin W, Lee J, Seong R, Lee YM, Seong Y, Song K, Bae K. 2005. Inhibitory effect on TNF-alpha-induced IL-8 production in the HT29 cell of constituents from the leaf and stem of Weigela subsessilis, Arch. Pharm. Res. 28;1135–1141.
Tortora GJ, Derrickson B. 2009. Principles of Anatomy and Physiology.
Hoboken: John Wiley & Sons, Inc.
Versteegh-Kloppenburgh J. 2006. Tanaman Berkhasiat Indonesia volume 1.
Soegiri J dan Nawangsari, penerjemah. Bogor: IPB Pr.
Warrier PK, Nambiar VPK, Ramankutty C. 1994. Indian medicinal plants, Chennai, India. Orient Longman 2:112-113.
[WHO] World Health Organization. 2003. Prevention and Management of Osteoporosis. Geneva.
Winarno B. 1998. Densitas mineral tulang wanita menyusui. [Spesialis]. Jakarta: Program Pendidikan Doster Spesialis. Fakultas Kedokteran Universitas Indonesia.
Yamaguchi M. 2002. Isoflavone and bone metabolism: its cellular mechanism prevention role in bone loss. J. Health Sci. 48(3): 209-220.
LAMPIRAN
Lampiran 1 Hasil analisis ANOVA dan Duncan (PDT)
Oneway
[DataSet0]
Descriptives
PDT
N Mean
Std. Deviation
Std. Error
95% Confidence Interval for Mean
Minimu m
Maximu m Lower
Bound
Upper Bound
1 3 3.5777 .40166 .23190 2.5799 4.5754 3.11 3.82
2 3 2.3487 .22250 .12846 1.7959 2.9014 2.10 2.53
3 3 2.1857 .12440 .07182 1.8767 2.4947 2.05 2.29
4 3 2.3937 .24908 .14381 1.7749 3.0124 2.16 2.65
5 3 2.5557 .35547 .20523 1.6726 3.4387 2.19 2.90
Total 15 2.6123 .56901 .14692 2.2972 2.9274 2.05 3.82
Ket: Perlakuan 1(kontrol negatif); perlakuan 2 (kontrol positif); perlakuan 3 (mDMEM+CQ 0.3 mg/mL); perlakuan 4 (mDMEM+CQ 0.6 mg